Формула серной кислоты в химии
Химическая и структурная формула серной кислоты
Химическая формула: H2SO4
Молекулярная масса: 98,078г/моль.
Физические свойства серной кислоты
При обычных условиях – тяжёлая маслянистая жидкость без цвета и запаха (может иметь желтоватый оттенок), с кислым «медным» вкусом. Температура кристаллизации чистой серной кислоты +10°С.
Неограниченно смешивается с водой с выделением большого количества тепла, поэтому во избежание «вскипания» раствора всегда следует добавлять серную кислоту в воду, а не наоборот.
Раствор SO3 в серной кислоте называется олеум. Олеум содержит пиросерные кислоты, образующиеся по реакциям:
Серная кислота – сильная кислота, константа диссоциации Ка = 103. Образует средние и кислые соли – сульфаты и гидросульфаты.
Химические свойства серной кислоты
Разбавленная серная кислота проявляет типичные свойства кислот:
Качественная реакция на сульфат-ион – взаимодействие с растворимыми солями бария, с образованием нерастворимого в воде и кислотах белого осадка сульфата бария:
|
Концентрированная серная кислота – очень едкое вещество. При попадании на живые ткани дегидрирует углеводороды, выделяя избыточное тепло, что приводит к вторичному термическому ожогу, дополнительно к химическому ожогу. Поэтому повреждения, вызываемые серной кислотой, потенциально более опасны, чем повреждения, вызванные другими кислотами. |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Серная кислота, подготовка к ЕГЭ по химии
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3
SO2 + O2 ⇄ (кат. — V2O5) SO3
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
1. NO + O2 → NO2
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
2. NO + NO2 + 2H2SO4 = 2NO(HSO4) + H2O
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
3. NO(HSO4) + H2O = H2SO4
+ HNO2В упрощенном виде нитрозный способ можно записать так:
В водном растворе диссоциирует ступенчато.
H2SO4 ⇄ H+ + HSO4—
HSO4— ⇄ H+ + SO42-
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
MgO + H2SO4 → MgSO4 + H2O
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
BaBr2 + H2SO4 → BaSO4↓ + 2HBr
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O

Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
S + H2SO4 → SO2 + H2O
C + H2SO4 → CO2 + SO2 + H2O
Реакции разбавленная серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Fe + H
Zn + H2SO4(разб.) → ZnSO4 + H2↑
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
Na + H2SO4(конц.) → Na2SO4 + H2S + H2O
Zn + H2SO4(конц.) → ZnSO4 + S + H 2O
Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O

Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Ba, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Fe + H2SO4(конц.) → (t) Fe2(SO4)3 + SO2 + H2O
Cr + H2SO4(конц.) → (t) Cr2

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
СЕРНАЯ КИСЛОТА, h3SO4 — это… Что такое СЕРНАЯ КИСЛОТА, h3SO4?
- СЕРНАЯ КИСЛОТА, h3SO4
- СЕРНАЯ КИСЛОТА, h3SO4, тяжелая маслянистая жидкость, tкип 296,2шC. Применяется в производстве минеральных удобрений, для получения различных химических веществ, химических волокон, дымообразующих и взрывчатых веществ, красителей, в органическом синтезе, в металлургии, текстильной, кожевенной промышленности и др. Серная кислота образуется в атмосфере в результате промышленных выбросов оксидов серы, что приводит к кислотным дождям. Серная кислота — наиболее широко используемый химический продукт. Мировое производство 139 млн. т/год. При попадании на кожу и слизистые оболочки вызывает тяжелые ожоги. При смешении с водой сильно разогревается. При разбавлении серной кислоты водой ее следует добавлять в воду небольшими порциями, а не наоборот.
Современная энциклопедия. 2000.
- СЕРНА
- СЕРНЫЕ РУДЫ
Смотреть что такое «СЕРНАЯ КИСЛОТА, h3SO4» в других словарях:
Серная кислота — Серная кислота … Википедия
СЕРНАЯ КИСЛОТА — h3SO4, сильная двухосновная кислота. Безводная серная кислота бесцветная маслянистая жидкость, плотность 1,9203 г/см³, tпл 10,3 .С, tкип 296,2 .С. С водой смешивается во всех отношениях. Концентрированная серная кислота реагирует почти со… … Большой Энциклопедический словарь
Серная кислота — СЕРНАЯ КИСЛОТА, h3SO4, тяжелая маслянистая жидкость, tкип 296,2°C. Применяется в производстве минеральных удобрений, для получения различных химических веществ, химических волокон, дымообразующих и взрывчатых веществ, красителей, в органическом… … Иллюстрированный энциклопедический словарь
СЕРНАЯ КИСЛОТА — (h3SO4) сильная двухосновная кислота; бесцветная маслянистая жидкость; с водой смешивается во всех отношениях. Концентрированная С. к. реагирует почти со всеми металлами, образуя соли сульфаты. С. к. получают растворением в воде серного ангидрида … Российская энциклопедия по охране труда
Серная кислота — обладает очень сильными коррозионными свойствами. Она представляет собой плотную маслянистую жидкость, бесцветную (если не содержит примесей), желтую или коричневую (в других случаях). Бурно реагирует с водой, сжигает кожу и большинство… … Официальная терминология
серная кислота — h3SO4, сильная двухосновная кислота. Безводная серная кислота бесцветная маслянистая жидкость, плотность 1,8305 г/см3, tпл 10,3°C, tкип 279,6°C. С водой смешивается во всех отношениях. Концентрированная серная кислота реагирует почти со всеми… … Энциклопедический словарь
Серная кислота — h3SO4, сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях тяжёлая маслянистая жидкость без цвета и запаха. В технике С. к. называют её смеси как с водой, так и с серным ангидридом. Если… … Большая советская энциклопедия
СЕРНАЯ КИСЛОТА — h3SO4 сильная двухосновная к та. Безводная С. к. бесцветная маслянистая жидкость, застывающая в кристаллич. массу при темп ре 10.45 °С. При темп ре 296,2 °С безводная С. к. кипит с разложением. С водой и серным ангидридом SO2 С. к. смешивается в… … Большой энциклопедический политехнический словарь
СЕРНАЯ КИСЛОТА — h3SO4, сильная двухосновная кислота. Безводная С. к. бесцв. маслянистая жидкость, плотн. 1,8305 г/см3, tпл 10,3 °С, tкип 279,6 °С. С водой смешивается во всех отношениях. Концентрир. С. к. реагирует почти со всеми металлами, образуя соли сульфаты … Естествознание. Энциклопедический словарь
СЕРНАЯ КИСЛОТА — h3SO4, мол. м. 98,082; бесцв. маслянистая жидкость без запаха. Очень сильная двухосновная к та, при 18°С p … Химическая энциклопедия
dic.academic.ru
Серная кислота — это… Что такое Серная кислота?
H2SO4, сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха. В технике С. к. называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO3: Н2О меньше 1, то это водный раствор С. к., если больше 1, — раствор SO3 в С. к.
Физические и химические свойства. 100%-ная H2SO4 (моногидрат, SO3․H2O) кристаллизуется при 10,45 °С; tkип 296,2 °С; плотность 1,9203 г/см3; теплоёмкость 1,62 дж/г (К. H2SO4 смешивается с Н2О и SO3 в любых соотношениях, образуя соединения:
H2SO4․4H2O (tпл — 28,36°С),
H2SO4․3H2O (tпл — 36,31°С),
H2SO4․2H2O (tпл — 39,60°С),
H2SO4․H2O (tпл — 8,48 °С),
H2SO4․SO3 (H2S2O7 — двусерная или пиросерная кислота, tпл 35,15 °С), H2SO․2SO3 (H2S3O10 — трисерная кислота, tпл 1,20 °C). При нагревании и кипении водных растворов С. к., содержащих до 70% H2SO4, в паровую фазу выделяются только пары воды. Над более концентрированными растворами появляются и пары С. к. Раствор 98,3%-ной H2SO4 (Азеотропная смесь) при кипении (336,5 °С) перегоняется полностью. С. к., содержащая свыше 98,3% H2SO4, при нагревании выделяет пары SO3. Концентрированная С. к. — сильный окислитель. Она окисляет HI и НВг до свободных галогенов; при нагревании окисляет все металлы, кроме Au и платиновых металлов (за исключением Pd). На холоде концентрированная С. к. пассивирует многие металлы, в том числе РЬ, Cr, Ni, сталь, чугун. Разбавленная С. к. реагирует со всеми металлами (кроме РЬ), предшествующими водороду в ряду напряжении (См. Ряд напряжений), например: Zn + H2SO4= ZnSO4 + Н2.Как сильная кислота С. к. вытесняет более слабые кислоты из их солей, например борную кислоту из буры:
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H2BO3, а при нагревании вытесняет более летучие кислоты, например:
NaNO3 + H2SO4 = NaHSO4 + HNO3.
С. к. отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы — ОН. Дегидратация этилового спирта (См. Этиловый спирт) в присутствии концентрированной С. к. приводит к получению Этилена или диэтилового эфира. Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с С. к. объясняется также их обезвоживанием. Как двухосновная, С. к. образует два типа солей: Сульфаты и гидросульфаты.Получение. Первые описания получения «купоросного масла» (т. е. концентрированной С. к.) дали итальянский учёный В. Бирингуччо в 1540 и немецкий алхимик, чьи труды были опубликованы под именем Василия Валентина в конце 16 — начале17 вв. В 1690 французские химики Н. Лемери и Н. Лефевр положили начало первому промышленному способу получения С. к., реализованному в Англии в 1740. По этому методу смесь серы и селитры сжигалась в ковше, подвешенном в стеклянном баллоне, содержавшем некоторое количество воды. Выделявшийся SO3 реагировал с водой, образуя С. к. В 1746 Дж. Робек в Бирмингеме заменил стеклянные баллоны камерами из листового свинца и положил начало камерному производству С. к. Непрерывное совершенствование процесса получения С. к. в Великобритании и Франции привело к появлению (1908) первой башенной системы. В СССР первая башенная установка была пущена в 1926 на Полевском металлургическом заводе (Урал).
Сырьём для получения С. к. могут служить: сера, серный колчедан FeS2, отходящие газы печей окислительного обжига сульфидных руд Си, РЬ, Zn и других металлов, содержащие SO2. В СССР основное количество С. к. получают из серного колчедана. Сжигают FeS2 в печах, где он находится в состоянии кипящего слоя (См. Кипящий слой). Это достигается быстрым продуванием воздуха через слой тонко измельченного колчедана. Получаемая газовая смесь содержит SO2, O2, N2, примеси SO3, паров Н2О, As2O3, SiO2 и др. и несёт много огарковой пыли, от которой газы очищаются в электрофильтрах.С. к. получают из SO2 двумя способами: нитрозным (башенным) и контактным. Переработка SO2 в С. к. по нитрозному способу осуществляется в продукционных башнях — цилиндрических резервуарах (высотой 15 м и более), заполненных насадкой из керамических колец. Сверху, навстречу газовому потоку разбрызгивается «нитроза» — разбавленная С. к., содержащая нитрозилсерную кислоту NOOSO3H, получаемую по реакции:
N2O3 + 2H2SO4 = 2 NOOSO3H + H2O.
Окисление SO2 окислами азота происходит в растворе после его абсорбции нитрозой. Водою нитроза гидролизуется:
NOOSO3H + H2O = H2SO4 + HNO2.
Сернистый газ, поступивший в башни, с водой образует сернистую кислоту: SO2 + H2O = H2SO3.
Взаимодействие HNO2 и H2SO3 приводит к получению С. к.:
2 HNO2 + H2SO3= H2SO4 + 2 NO + H2O.
Выделяющаяся NO превращается в окислительной башне в N2O3 (точнее в смесь NO + NO2). Оттуда газы поступают в поглотительные башни, где навстречу им сверху подаётся С. к. Образуется нитроза, которую перекачивают в продукционные башни. Т. о. осуществляется непрерывность производства и круговорот окислов азота. Неизбежные потери их с выхлопными газами восполняются добавлением HNO3.
С. к., получаемая нитрозным способом, имеет недостаточно высокую концентрацию и содержит вредные примеси (например, As). Её производство сопровождается выбросом в атмосферу окислов азота («лисий хвост», названный так по цвету NO2).
Принцип контактного способа производства С. к. был открыт в 1831 П. Филипсом (Великобритания). Первым катализатором была платина. В конце 19 — начале 20 вв. было открыто ускорение окисления SO2 в SO3 ванадиевым ангидридом V2O5. Особенно большую роль в изучении действия ванадиевых катализаторов и их подборе сыграли исследования советских учёных А. Е. Ададурова, Г. К. Борескова, Ф. Н. Юшкевича и др. Современные сернокислотные заводы строят для работы по контактному методу. В качестве основы катализатора применяются окислы ванадия с добавками SiO2, Al2O3, K2O, CaO, BaO в различных соотношениях. Все ванадиевые контактные массы проявляют свою активность только при температуре не ниже Серная кислота420 °С. В контактном аппарате газ проходит обычно 4 или 5 слоев контактной массы. В производстве С. к. контактным способом обжиговый газ предварительно очищают от примесей, отравляющих катализатор. As, Se и остатки пыли удаляют в промывных башнях, орошаемых С. к. От тумана H2SO4 (образующейся из присутствующих в газовой смеси SO3 и H2O) освобождают в мокрых электрофильтрах. Пары H2O поглощаются концентрированной С. к. в сушильных башнях. Затем смесь SO2 с воздухом проходит через катализатор (контактную массу) и окисляется до SO3:SO2 + 1/2O2= SO3.
Серный ангидрид далее поглощается водой, содержащейся в разбавленной H2SO4:
SO3 + H2O = H2SO4.
В зависимости от количества воды, поступившей в процесс, получается раствор С. к. в воде или Олеум.В 1973 объём производства С. к. (в моногидрате) составлял (млн. т): СССР — 14,9, США — 28,7, Япония — 7,1, ФРГ — 5,5, Франция — 4,4, Великобритания — 3,9, Италия — 3,0, Польша — 2,9, Чехословакия — 1,2, ГДР — 1,1, Югославия — 0,9.
Применение. С. к. — один из важнейших продуктов основной химической промышленности. Для технических целей выпускаются следующие сорта С. к.: башенная (не менее 75% H2SO4), купоросное масло (не менее 92,5%) и олеум, или дымящая С. к. (раствор 18,5—20% SO3 в H2SO4), а также особо чистая аккумуляторная С. к. (92—94%; разбавленная водой до 26—31% служит электролитом в свинцовых Аккумуляторах). Кроме того, производится реактивная С. к. (92—94%), получаемая контактным способом в аппаратуре из кварца или Pt. Крепость С. к. определяют по её плотности, измеряемой ареометром. Большая часть вырабатываемой башенной С. к. расходуется на изготовление минеральных удобрений. На свойстве вытеснять кислоты из их солей основано применение С. к. в производстве фосфорной, соляной, борной, плавиковой и др. кислот. Концентрированная С. к. служит для очистки нефтепродуктов от сернистых и непредельных органических соединений. Разбавленная С. к. применяется для удаления окалины с проволоки и листов перед лужением и оцинкованием, для травления металлических поверхностей перед покрытием хромом, никелем, медью и др. Она используется в металлургии — с её помощью разлагают комплексные руды (в частности, урановые). В органическом синтезе концентрированная С. к. — необходимый компонент нитрующих смесей (См. Нитрующая смесь) и сульфирующее средство при получении многих красителей и лекарственных веществ. Благодаря высокой гигроскопичности С. к. применяется для осушки газов, для концентрирования азотной кислоты.Техника безопасности. В производстве С. к. опасность представляют ядовитые газы (SO2 и NO2), а также пары SO3 и H2SO4. Поэтому обязательны хорошая вентиляция, полная герметизация аппаратуры. С. к. вызывает на коже тяжёлые ожоги, вследствие чего обращение с ней требует крайней осторожности и защитных приспособлений (очки, резиновые перчатки, фартуки, сапоги). При разбавлении надо лить С. к. в воду тонкой струей при перемешивании. Приливание же воды к С. к. вызывает разбрызгивание (вследствие большого выделения тепла).
Лит.: Справочник сернокислотчика, под ред. Малина К. М., 2 изд., М., 1971; Малин К. М., Аркин Н. Л., Боресков Г. К., Слинько М. Г., Технология серной кислоты, М., 1950; Боресков Г. К., Катализ в производстве серной кислоты, М. — Л., 1954; Амелин А. Г., Яшке Е. В., Производство серной кислоты, М., 1974; Лукьянов П. М., Краткая история химической промышленности СССР, М., 1959.
И. К. Малина.
dic.academic.ru
Серная кислота – „едкая кровь” промышленности

Постоянный спрос на это химическое соединение свидетельствует о том, насколько оно необходимо для мировой экономики. H2SO4 – это „едкая кровь” промышленности, пульсирующая в бесчисленных производственных установках по всему миру. С серной кислотой работают профессионалы, оперирующие в различных отраслях промышленности. Для многих исследований и экспериментов используют ее ученые, а с ее помощью знания получают в химических лабораториях студенты и ученики. Сегодня сложно себе представить функционирование современной экономики без серной кислоты. Свойства серной кислоты делают ее незаменимым сырьем и реактантом, которое трудно вытеснить даже самыми инновационными химическими соединениями, выпускаемыми на рынок производителями химических веществ.
Характеристика и свойства H2SO4
Серная кислота – это одна из наиболее сильно действующих минеральных кислот. Она представляет собой маслянистую, тяжелую и бесцветную жидкость с необыкновенно сильными гигроскопическими свойствами. В своей концентрированной форме обладает также сильными окислительными свойствами. Серная кислота очень хорошо растворяется в воде во всех соотношениях, выделяя большое количество тепла. Именно поэтому необходимо помнить о том, чтобы наливать кислоту в воду, а не наоборот. Возможно изготовление серной кислоты даже с концентрацией 99%, однако, потери оксида серы при температуре близкой к температуре кипения приводят к образованию азеотропа с водой концентрацией 98,3%. Из-за этого серную кислоту обычно хранят в виде 98%-ного раствора. Конечно, H2SO4 может иметь разные концентрации. Наиболее широко применяемыми водными растворами серной кислоты являются:
— 10% — т.н. сильно разведенная серная кислота, используемая, обычно, в качестве обезвоживающего средства, регулятора pH, лабораторного реактива,
— 29-32% — применяют в популярных свинцово-кислотных аккумуляторах,
— 62-70% — используют в качестве удобрения,
— 77-80% — применяют в процессе получения H2SO4 „камерным” методом и используют для производства глауберовой соли, т.е. сульфата натрия (Na2SO4),
— 98% — уже упомянутая ранее серная кислота.
Получение серной кислоты
В промышленности серную кислоту получают контактным способом путем окисления диоксида серы, который образуется, в основном, в результате процессов сжигания серы или сульфидов металлов (напр. пирита). Процесс производства серной кислоты при использовании серы можно разделить на три этапа. Первый из них заключается в производстве диоксида серы. Затем диоксид серы окисляют для получения триоксида серы. Последний этап заключается в превращении оксида серы (VI) в серную кислоту.
Сжигание серы проводят при избытке воздуха с целью полного завершения реакции под давлением на уровне около 0,5 МПа. Весь этот процесс осуществляется при температуре около 150oC в баках, выложенных толстым слоем огне- и кислотостойкого кирпича. Расплавленную серу фильтруют с целью удаления примесей (в основном это железо и органические соединения). Часто в процессе применяют также известь, чтобы уменьшить кислотность расплавленной серы, тем самым ограничивая ее коррозийные свойства. Расплавленную серу подают в горелки, где она сгорает. Смесь диоксида серы и воздуха, выходящую из горелки, затем пропускают через фильтр, который удаляет любые загрязнения.
На следующем этапе диоксид серы превращают в триоксид серы в результате реакции с кислородом в присутствии катализатора. Широко используемым катализатором является пятиокись ванадия (V2O5), а в качестве его носителя используют сульфат калия. Функцию подложки для катализатора, как правило, исполняет диоксид кремния или глинокремнеземы, которые характеризуются очень высокой пористостью, обеспечивая тем самым большую площадь для протекания реакции. Скорость протекания процесса зависит также от температуры. На практике ее поддерживают на уровне около 500oC, чтобы обеспечить достаточную скорость реакции при максимально высокой конверсии.
Последний этап производства серной кислоты заключается в абсорбции SO3 в концентрированной H2SO4 или олеуме с целью предотвращения образования трудно поддающегося конденсации т.н. тумана серной кислоты. Серная кислота с концентрацией 98% циркулирует с такой скоростью, что вновь поглощаемый SO3 вызывает очень незначительное повышение ее концентрации. Весь процесс осуществляется при температуре около 70oC, тем самым максимизируя эффективность поглощения SO3. Кроме того, в бак с кислотой добавляют также воду, разбавляющую кислоту до соответствующей концентрации. Поток серной кислоты постоянно сливают и охлаждают с помощью пластинчатых теплообменников перед подачей в резервуары для хранения. Общее преобразование серы в серную кислоту составляет примерно 99%.
Применение серной кислоты
Серная кислота имеет огромное значение во многих отраслях промышленности. Наибольший расход H2SO4 наблюдается в производстве минеральных удобрений. Это, в основном, связано с производством суперфосфатов, а также фосфата и сульфата аммония. Серная кислота имеет также большое значение при производстве других кислот, например, соляной, азотной и фосфорной кислот. Ее используют также в производстве взрывчатых веществ в качестве одного из видов сырья для производства тротила (TNT). В свою очередь, в нефтехимической промышленности H2SO4 применяют, в основном, для осушения масел, керосина и парафина. Она выполняет также роль катализатора в реакции получения изооктана, являющегося одним из основных компонентов бензина. Серную кислоту используют также в горнодобывающей и металлургической промышленностях в процессах обогащения руд меди. H2SO4является также электролитом в популярных свинцово-кислотных аккумуляторах. Кроме того, серная кислота находит широкое применение в производстве моющих средств (напр. лаурилсульфата натрия), а также в косметической промышленности, где ее используют для производства сырья и полуфабрикатов (напр. нитрата серебра), а также перекиси водорода или же душистых веществ.
Такое широкое применение серной кислоты приводит к тому, что в случае ее отсутствия невозможным или просто невыгодным было бы проведение многих основных и весьма важных промышленных процессов.
Серная кислота в Группе РСС
PCC Rokita имеет устойчивую позицию поставщика водной серной кислоты с концентрацией 77%. H2SO4 мы производим в Комплексе Хлора контактным способом, что гарантирует очень высокую чистоту и однородность получаемого продукта. Предложение на поставку серной кислоты Группы РСС адресовано, прежде всего, производителям фосфорных удобрений, бумаги и глауберовой соли, т.е. сульфата натрия (Na2SO4). Последний продукт может быть также использован в производстве древесной массы, стекла, красителей и моющих средств. Сульфат натрия применяют также в медицине в качестве слабительного средства.
Серная кислота – это незаменимое сырье во многих технологических процессах, а ее чрезвычайно разнообразный рынок стоит на пороге многих вызовов. Опасения, связанные с негативным воздействием на окружающую среду, могут сбалансировать или даже ослабить спрос на это популярное сырье. Однако, тот факт, что H2SO4, несмотря на присутствие в химической промышленности уже столько лет, не теряет свою популярность и по-прежнему является одним из самых необходимых химических веществ, используемых в промышленности в массовом масштабе.
www.products.pcc.eu
Серная кислота и ее химические свойства :: SYL.ru
Кислоты — это химические соединения, состоящие из атомов водорода и кислотных остатков, к примеру, SO4, SO3, PO4 и т. д. Они бывают неорганическими и органическими. К первым относятся соляная, фосфорная, сульфидная, азотная, серная кислота. Ко вторым — уксусная, пальмитиновая, муравьиная, стеариновая и т. д.
Что такое серная кислота
Эта кислота состоит из двух атомов гидрогена и кислотного остатка SO4. Она имеет формулу h3SO4.
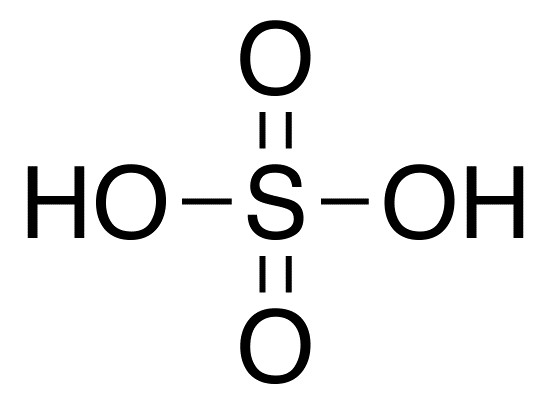 Серная кислота или, как она еще называется, сульфатная, относится к неорганическим кислородосодержащим двухосновным кислотам. Это вещество считается одним из самых агрессивных и химически активных. В большинстве химических реакций она выступает в качестве окислителя. Эта кислота может использоваться в концентрированном или разбавленном виде, в этих двух случаях она имеет немного различные химические свойства.
Серная кислота или, как она еще называется, сульфатная, относится к неорганическим кислородосодержащим двухосновным кислотам. Это вещество считается одним из самых агрессивных и химически активных. В большинстве химических реакций она выступает в качестве окислителя. Эта кислота может использоваться в концентрированном или разбавленном виде, в этих двух случаях она имеет немного различные химические свойства.Физические свойства
Серная кислота в нормальных условиях имеет жидкое состояние, температура ее кипения составляет примерно 279,6 градуса по Цельсию, температура замерзания, когда она превращается в твердые кристаллики, — около -10 градусов для стопроцентной и около -20 для 95-процентной.
 Чистая стопроцентная сульфатная кислота представляет собой маслянистое жидкое вещество без запаха и цвета, которое обладает почти вдвое большей плотностью, нежели вода — 1840 кг/м3.
Чистая стопроцентная сульфатная кислота представляет собой маслянистое жидкое вещество без запаха и цвета, которое обладает почти вдвое большей плотностью, нежели вода — 1840 кг/м3.Химические свойства сульфатной кислоты
Серная кислота реагирует с металлами, их оксидами, гидроксидами и солями. Разбавленная водой в различных пропорциях, она может вести себя по-разному, поэтому рассмотрим подробнее свойства концентрированного и слабого раствора серной кислоты по отдельности.
Концентрированный раствор серной кислоты
Концентрированным считается раствор, в котором содержится от 90 процентов сульфатной кислоты. Такой раствор серной кислоты способен реагировать даже с малоактивными металлами, а также с неметаллами, гидроксидами, оксидами, солями. Свойства такого раствора сульфатной кислоты схожи с таковыми у концентрированной нитратной кислоты.
Взаимодействие с металлами
При химической реакции концентрированного раствора сульфатной кислоты с металлами, находящимися правее водорода в электрохимическом ряду напряжений металлов (то есть с не самыми активными), образуются такие вещества: сульфат того металла, с которым происходит взаимодействие, вода и диоксид серы. К металлам, в результате взаимодействия с которыми образуются перечисленные вещества, относятся медь (купрум), ртуть, висмут, серебро (аргентум), платина и золото (аурум).

Взаимодействие с неактивными металлами
С металлами, которые стоят левее водорода в ряду напряжений, концентрированная серная кислота ведет себя немного по-другому. В результате такой химической реакции образуются следующие вещества: сульфат определенного металла, сероводород либо чистая сера и вода. К металлам, с которыми проходит подобная реакция, относятся также железо (ферум), магний, манган, бериллий, литий, барий, кальций и все остальные, находящиеся в ряду напряжений левее водорода, кроме алюминия, хрома, никеля и титана — с ними концентрированная сульфатная кислота во взаимодействие не вступает.
Взаимодействие с неметаллами
Данное вещество — сильный окислитель, поэтому оно способно участвовать в окислительно-восстановительных химических реакциях с неметаллами, такими как, к примеру, углерод (карбон) и сера. В результате таких реакций обязательно выделяется вода. При добавлении этого вещества к углероду также выделяется углекисый газ и диоксид сульфура. А если добавить кислоту к сере, получим только диоксид серы и воду. В такой химической реакции сульфатная кислота играет роль окислителя.
Взаимодействие с органическими веществами
Среди реакций серной кислоты с органическими веществами можно выделить обугливание. Такой процесс происходит при столкновении данного вещества с бумагой, сахаром, волокнами, деревом и т. д. При этом в любом случае выделяется углерод. Карбон, который образовался в процессе реакции, может частично взаимодействовать с серной кислотой при ее избытке. На фото показана реакция сахара с раствором сульфатной кислоты средней концентрации.

Реакции с солями
Также концентрированный раствор h3SO4 реагирует с сухими солями. В этом случае происходит стандартная реакция обмена, при которой образуется сульфат металла, который присутствовал в структуре соли, и кислота с остатком, который был в составе соли. Однако с растворами солей концентрированная серная кислота не вступает в реакцию.
Взаимодействие с другими веществами
Также данное вещество может вступать в реакции с оксидами металлов и их гидроксидами, в этих случаях происходят реакции обмена, в первом выделяется сульфат металла и вода, во втором — то же самое.
Химические свойства слабого раствора сульфатной кислоты
Разбавленная серная кислота реагирует с многими веществами и имеет такие же свойства, как и все кислоты. Она, в отличие от концентрированной, вступает во взаимодействие только с активными металлами, то есть теми, которые находятся левее водорода в ряду напряжений. В таком случае происходит такая же реакция замещения, как и в случае с любой кислотой. При этом выделяется водород. Также такой раствор кислоты взаимодействует с растворами солей, в результате чего происходит реакция обмена, уже рассмотренная выше, с оксидами — так же, как и концентрированная, с гидроксидами — тоже так же. Кроме обыкновенных сульфатов, существуют также гидросульфаты, которые являются продуктом взаимодействия гидроксида и серной кислоты.

Как узнать, что в растворе содержится серная кислота или сульфаты
Для определения, присутствуют ли эти вещества в растворе, применяется специальная качественная реакция на сульфат-ионы, которая позволяет это узнать. Она заключается в добавлении бария или его соединений в раствор. В результате этого может выпасть осадок белого цвета (сульфат бария), что показывает наличие сульфатов или серной кислоты.
Как добывают серную кислоту
Самым распространенным способом промышленного получения данного вещества является добыча его из пирита железа. Этот процесс происходит в три этапа, на каждом из которых происходит определенная химическая реакция. Рассмотрим их. Сначала к пириту добавляют кислород, вследствие чего образуется оксид ферума и диоксид серы, который используется для дальнейших реакций. Это взаимодействие происходит при высокой температуре. Далее следует этап, на котором посредством добавления кислорода в присутствии катализатора, в качестве которого выступает оксид ванадия, получают триоксид серы. Теперь, на последней стадии, к полученному веществу добавляют воду, при этом получают сульфатную кислот. Это самый распространенный процесс промышленного добывания сульфатной кислоты, он используется наиболее часто потому, что пирит — самое доступное сырье, подходящее для синтеза описанного в этой статье вещества. Серную кислоту, полученную с помощью такого процесса, используют в различных сферах промышленности — как в химической, так и во многих других, к примеру, при переработке нефти, обогащении руд и т. д. Также ее использование часто предусмотрено в технологии изготовления множества синтетических волокон.
www.syl.ru
Серная кислота. Получение серной кислоты. Сернистая кислота
Серная кислота
 Концентрированная серная кислота
Концентрированная серная кислотаСерная кислота H2SO4 — одна из сильных двухосновных кислот. В разбавленном состоянии она окисляет почти все металлы, кроме золота и платины. Интенсивно реагирует с неметаллами и органическими веществами, превращая некоторые из них в уголь. При приготовлении раствора серной кислоты всегда надо её приливать к воде, а не наоборот, во избежание разбрызгивания и вскипания воды. При 10 °С затвердевает, образуя прозрачную стекловидную массу. При нагревании 100-процентная серная кислота легко теряет серный ангидрид (триокись серы SO3) до тех пор, пока её концентрация не составит 98 %. Именно в таком состоянии её обычно и используют в лабораториях. В концентрированном (безводном) состоянии серная кислота — бесцветная, дымящаяся на воздухе (из-за паров), маслянистая жидкость с характерным запахом (Т кипения=338 °С). Она является очень сильным окислителем. Это вещество обладает всеми свойствами кислот:
Химические свойства серной кислоты
— химическая реакция с металлами:
H2SO4 + Fe → FeSO4 + H2;
2H2SO4 + Cu → CuSO4 + SO2 +2H2O — в этом случае кислота является концентрированной.
— химическая реакция с оксидами металлов:
H2SO4 + CuO → CuSO4 + H2O
Получающийся раствор синего цвета — CuSO4 — раствор медного купороса. Серную кислоту еще называют купоросным маслом, так как при реакциях с металлами и их оксидами образуются купоросы. Например, при химической реакции с железом (Fe) — образуется светло-зелёный раствор железного купороса.
— химическая реакция с основаниями и щелочами (или реакция нейтрализации)
H2SO4 + 2NaOH → Na2SO4 + 2H2O
— химическая реакция с серой (кислота — концентрированная, реакция — при нагревании):
2H2SO4 + S → 3SO2 + 2H2O
— химическая реакция с солями (например, со стиральной содой Na2CO3):
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Получение серной кислоты
 Сернистый ангидрид
Сернистый ангидридСерную кислоту получают окислением серы (S) сначала до оксида серы (сернистого газа SO2), а затем окислением сернистого газа до триоксида серы (сернистого ангидрида SO3) (на рисунке слева):
S + O2 → SO2
— сернистый газ — с удушливым запахом серы.
SO2 + O2 → SO3. Эта химическая реакция производится на катализаторе (оксиде ванадия V2O5). Вещество SO3 — сернистый ангидрид — очень гигроскопичное кристаллическое прозрачное вещество, жадно поглощающее воду с образованием серной кислоты:
SO3 + H2O → H2SO4
Сернистая кислота
Сернистая кислота — или Н2SO3 — так называют водный раствор оксида серы (SO2) в воде. На самом деле такого химического вещества не существует, его используют лишь для удобства составления химических уравнений реакций.
Раствор SO2 в воде, имеет кислую среду. Такому раствору присущи все свойства кислот, в том числе реакция нейтрализации.
Сернистая кислота (или правильнее сказать — раствор сернистого газа в воде) образует два вида солей: сульфиты и гидросульфиты. Эти соли являются восстановителями.
Н2SO4 + NaOH → NaНSO3 + Н2O — такая реакция протекает при избытке сернистой кислоты
Н2SO4 + 2NaOH → Na2SO3 + 2Н2O — а эта реакция протекает при избытке едкого натра
Сернистая кислота обладает отбеливающим действием. Всем известно, что подобным действием обладает и хлорная вода. Но отличие заключается в том, что в отличии от хлора сернистый газ не разрушает красители, а образует с ними неокрашенные химические соединения!
Кроме основных свойств кислот сернистая кислота способна обесцвечивать раствор марганцовки по следующему уравнению:
5Н2SO3+2KMnO4 → 2 Н2SO4 +2MnSO4+K2SO4+Н2O
В этой реакции образуется бледно-розовый раствор, состоящий из сульфатов калия, марганца. Окраска обусловлена именно сульфатом марганца.
Сернистая кислота способна обесцветить бром
Н2SO3 + Br2 + Н2O → Н2SO4 + 2HBr
В этой реакции образуется раствор, состоящий сразу из 2-х сильных кислот: серной и бромной.
Если хранить сернистую кислоту при доступе воздуха, то этот раствор окисляется и превращается в серную кислоту
2Н2SO3 + O2 → 2Н2SO2
www.kristallikov.net