Валентность. Как найти валентность. Элементы с постоянной валентностью
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
| Элементы | Постоянная валентность |
| щелочные металлы (Li, Na, K, Rb , Cs, Fr) | I |
| металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| алюминий (Al) | III |
| кислород (О) | II |
| фтор (F) |
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
Пример 1. Найти валентности всех элементов в соединении NH
Решение. Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2. Найти валентности всех элементов в молекуле Cl2O5.
Найти валентности всех элементов в молекуле Cl2O5.
Решение. У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3. Найти валентность хлора в молекуле SCl2, если известно, что валентность серы равна II.
Решение. Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4. Составьте формулу соединения кальция с водородом.
Решение. Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
«А почему именно CaH2? — спросите вы. — Ведь варианты Ca2H4 и Ca4H8 и даже Ca10H20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N2O4 или C6H6 невозможны? — спросите вы. — Следует заменить эти формулы на NO2 и CH?»
Нет, возможны. Более того, N2O4 и NO2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С6Н6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5. Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение. Пусть формула соединения — SxFy. Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF
6.Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность».
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Смотрите продолжение этой статьи →
Урок №14-15. Валентность химических элементов. Определение валентности элементов по формулам бинарных соединений. Составление химических формул бинарных соединений по валентности
Валентность – это способность
атомов присоединять к себе определенное число других атомов.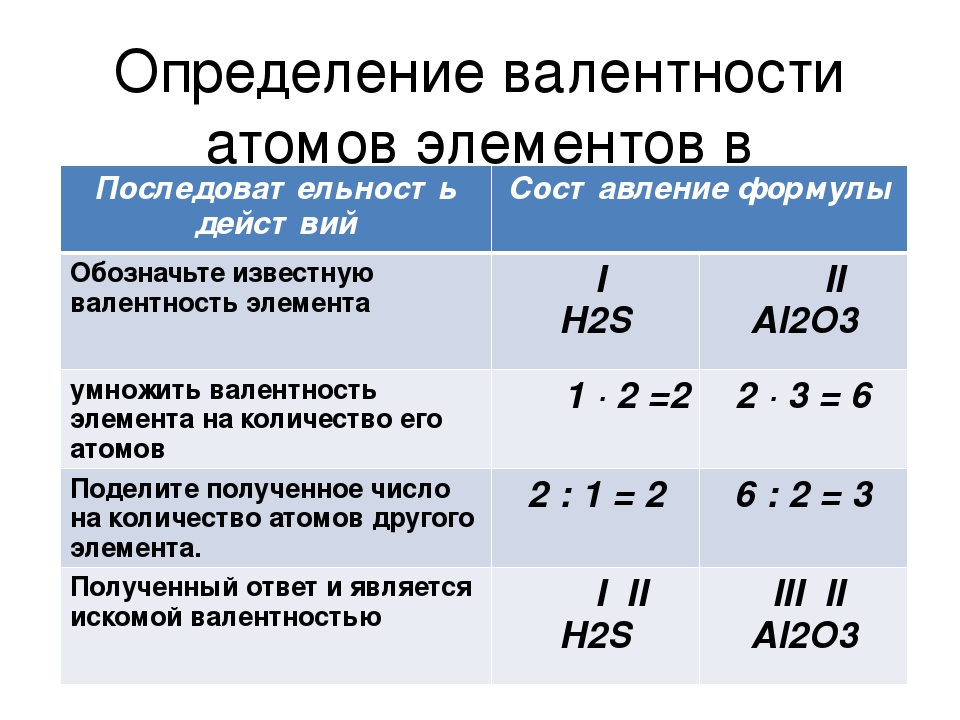
Валентность – определяется номером группы (число химических связей в структурной формуле вещества).
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений (валентность обозначается
Структурная формула вещества отображает порядок соединения атомов между собой, согласно их валентностям, т.е. химическое строение. | |
| | Na – одновалентен (одна связь) H – одновалентен (одна связь) O – двухвалентен (две связи у каждого атома) S – шестивалентна (образует шесть связей с соседними атомами) |
Правила определения валентности элементов в соединениях
1. Валентность водорода принимают
за I (единицу).
2. Кислород в своих соединениях проявляет валентность
II.3. Высшая валентность равна номеру группы Nгруппы (исключения, N, O, F — для этих элементов характерна только низшая валентность).
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — Nгруппы
Определение валентности металлов
(характерны валентности – постоянная и переменная)
Металлы главных (А) подгрупп I(А), II(А), III(А) | Характерна высшая постоянная валентность. В = Nгруппы | Металл в формуле всегда занимает первую позицию |
Металлы побочных (Б) подгрупп I(Б)-VIII(Б) | Характерна переменная валентность. В – указывается в названии вещества. Например, оксид марганца (VII), хлорид хрома (II). |
Определение валентности неметаллов
(характерны валентности – высшая, низшая, переменная)
Характерны высшая валентность В = N группы | Неметалл ставится в этом случае на первое место в формуле |
| Характерна
низшая валентность 8 — N группы | Неметалл ставится в этом случае на второе место в формуле |
Характерна переменная валентность. В – указывается в названии вещества. Например, оксид серы (IV),
сульфид фосфора (III). | Неметалл ставится в этом случае на первое место в формуле |
Запомните! Низшую валентность проявляет тот элемент — неметалл, который находится в таблице Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Если данное правило не работает. То следует воспользоваться информацией о
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов. | ||
ОКСИДЫ | СУЛЬФИДЫ | ХЛОРИДЫ |
Оксид – это сложное вещество,
в состав которого входят два вида атомов, одним из которых является кислород,
с валентностью (II). Na2О | Сульфид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является сера, с валентностью (II). K2S | Хлорид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является хлор, с валентностью (I). FeCl3 |
Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента |
* Другие
бинарные соединения: ЭxFy — фторид; ЭxBry —бромид; ЭxIy –йодид; ЭxNy –нитрид; ЭxPy –фосфид; ЭxHy –гидрид (у элемента на второй позиции низшая валентность).
Алгоритм составления формулы соединения оксида фосфора
Последовательность действий | Составление формулы оксида фосфора |
1. Написать символы элементов | Р О |
2. Определить валентности элементов | V II |
3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10 : 5 = 2 10 : 2 = 5 P : О = 2 : 5 |
5. | Р2 О5 |
6. Формула соединения (оксида) | Р2О5 |
Для составления формулы вещества можно воспользоваться следующим алгоритмом:
В=Nгруппы | В=8-Nгруппы |
Ах | Ву |
Запомните! Если элемент А – металл побочной
подгруппы или неметалл с переменной валентностью, валентность А определяем не
по таблице Менделеева, а согласно названию вещества.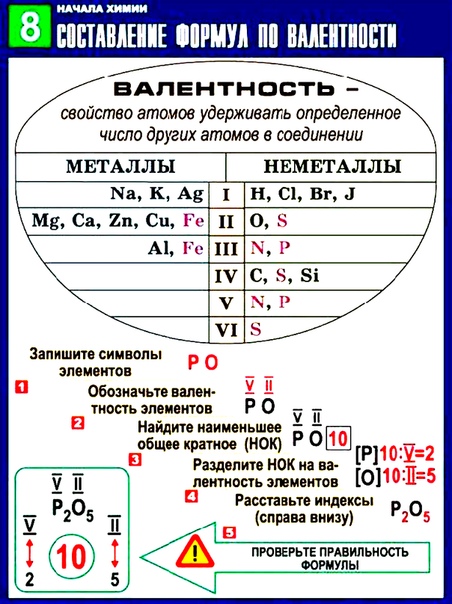 Например, оксид серы (IV), сульфид фосфора (III).
Например, оксид серы (IV), сульфид фосфора (III).
Валентность и степень окисления
☰
Валентность химического элемента определяет сколько одинарных химических связей способны образовывать атомы этого элемента с другими атомами. Атомы многих химических элементов могут проявлять разную валентность.
Химическую связь образует общая электронная пара двух атомов, которая образуется в ковалентной связи. Таким образом, валентность атомов определяется только в ковалентных соединениях. В ионной и металлической связи нет общих электронных пар, поэтому для веществ с такой связью понятие валентности не уместно.
Поскольку на внешнем энергетическом уровне атома не может быть больше 8 электронов, то валентность атомов разных химических элементов изменяется от I до VIII.
В структурных формулах молекул валентность изображают черточками между атомами. Сколько черточек отходит от одного атома, такова и его валентность.
Высшая валентность атома химического элемента в оксиде, равна номеру группы, в которой он находится. Так, углерод находится в IV группе и его высший оксид — CO2. Для натрия — Na2O, для хлора — Cl2O7.
Однако обычно атом проявляет валентность, равную количеству его неспаренных электронов. Так у галогенов — это один электрон, у кислорода — два, у водорода и щелочных металлов — по одному.
Степень окисления, по сравнению с валентностью, более универсальное понятие. Оно не зависит от вида химической связи и является характеристикой для соединений как с ковалентной, так и ионной и металлической связью. Степень окисления — это условный заряд на атоме в веществе. При определении степени окисления делают предположение, что все связи в соединении ионные. Степень окисления может быть положительной, отрицательной, нулевой.
В простых случаях степень окисления совпадает с зарядами ионов. Однако в отличие от заряда ионов степень окисления записывают после знака «+» или «-». Например:
Например:
Na+Cl—, Ca+2O-2, C+4O2-2
Поскольку металлы обычно образуют ионные связи неметаллами, то под их валентность понимают именно степень окисления.
В простых веществах степень окисления атомов считают равной нулю. Однако валентность не равна нулю, она равна числу общих электронных пар между атомами. Например, в молекуле h3 валентность атомов равна I, а степень окисления 0.
Отрицательную степень окисления имеют атомы с большей электроотрицательностью. Так в хлориде калия K+1Cl-1 электронная пара смещена к хлору.
При определении степеней окисления атомов в молекуле следует иметь в виду, что сумма степеней окисления должна быть равна нулю, так как молекула электронейтральна.
Химики нашли пропавшие при изменении валентности электроны
Два возможных состояния электронов у атома иттербия: локализованное состояние («пузырь» вокруг ядра), которое при понижении температуры переходит в подвижное состояние со скачками между атомами
Cornell University
Изменение валентности редкоземельных элементов в сплавах со смешанной валентностью при повышении температуры сопровождается электронным топологическим переходом, при котором электроны меняют локализованное состояние на подвижное. К такому выводу пришли американские ученые, изучив с помощью рентгеновской фотоэлектронной спектроскопии сплав иттербия и алюминия. Работа опубликована в Nature Communications.
К такому выводу пришли американские ученые, изучив с помощью рентгеновской фотоэлектронной спектроскопии сплав иттербия и алюминия. Работа опубликована в Nature Communications.
Понятие валентности — количества связей, которое может образовывать тот или иной элемент, — является одним из базовых в химии. И если в простых отдельных молекулах валентность определяется однозначно, то в химических комплексах и в кристаллических веществах определить валентность бывает несколько сложнее, потому что не всегда можно точно определить количество и направленность образованных связей.
Сейчас из-за неоднозначности определения валентности чаще используются термины «степень окисления» (описывает электронное состояние атома) и «координационное число» (описывает количество ближайших атомов-соседей). Наиболее актуальна проблема определения валентности и связи ее с электронным состоянием стоит для материалов, в которых один из элементов проявляет смешанную степень окисления, которая может при этом изменяться при понижении или повышении температуры. Однако до настоящего дня было не очень понятно, что при изменении степени окисления происходит в сплаве с теми электронами, которые освободились и не участвуют больше в образовании химических связей.
Однако до настоящего дня было не очень понятно, что при изменении степени окисления происходит в сплаве с теми электронами, которые освободились и не участвуют больше в образовании химических связей.
В своей работе химики из США изучали модельную систему — сплав алюминия и иттербия состава YbAl3, в котором атом иттербия находится в состоянии со смешанной валентностью. В таком сплаве из-за наличия упорядоченных систем магнитных примесей происходит снижение сопротивления, и иттербий проявляет две степени окисления: +2 и +3, — в которых на внешнем электронном уровне 4f находится 14 и 13 электронов, соответственно. Известно, что при снижении температуры от комнатной до 30 кельвинов (-243 градуса Цельсия) происходит уменьшение средней валентности примерно на 0,05. Но что при этом происходит с электронной структурой внутри кристалла, измерить не удавалось из-за сложностей при получении монокристалла с поверхностью достаточного качества. В новой работе для решения этой проблемы химики использовали тонкую пленку сплава, нанесенного на подложку с помощью молекулярно-лучевой эпитаксии, и исследовали ее с помощью рентгеновской фотоэлектронной спектроскопии с угловым разрешением.
Оказалось, что в таком материале часть электронов локализована и находится вблизи атомов иттербия, а часть электронов — подвижная и может находиться в нелокальном состоянии, перескакивая между атомами. Изменение силы взаимодействия между электронами разных типов при изменении температуры и давления может приводить к флуктуациям валентности иттербия. Электронная структура атома иттербия представляет из себя облако электронов вокруг ядра, размер которого увеличивается при понижении температуры. В обратном пространстве это выглядит как постепенное уменьшение заселенности соответствующего маленького электронного кармана.
Изменение электронной структуры иттербия в прямом (слева) и обратном (справа) пространствах при понижении температуры
S. Chatterjee et al./ Nature Communications, 2017
Это приводит к тому, что постепенно увеличивается подвижность электронов на низкоэнергетических уровнях 4f, при этом увеличивается время жизни этих электронов и площадь соответствующего пика в спектре. Это означает, что смена валентности при изменении температуры (или давления) сопровождается сильным перестроением электронной структуры иттербия и электронным топологическим переходом.
Это означает, что смена валентности при изменении температуры (или давления) сопровождается сильным перестроением электронной структуры иттербия и электронным топологическим переходом.По словам авторов работы, полученные результаты свидетельствуют о сильном влиянии изменения валентности на электронную структуру внутри металлических сплавов с подобными свойствами. Ученые ожидают, что в будущем эти данные смогут использоваться и для управления электронными свойствами металлических сплавов с повышенным сопротивлением.
В органических молекулах определить валентность атомов углерода значительно проще, но при этом она очень редко изменяется и практически для всех соединений равна четырем. Сейчас известно только несколько соединений, в которых углерод проявляет валентность пять, а совсем недавно ученым впервые удалось получить органическое соединение, в котором углерод связан сразу с шестью другими атомами.
Александр Дубов
Как узнать и определить валентность химического элемента по таблице менделеева
Время на чтение: 12 минут
Общая характеристика
Валентность представляет способность атомов создавать химические соединения, добавлять другие атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия
Определение в переводе характеризует силу, создание. Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которыми атом соединяется с другими элементами, называется валентностью. В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
Соединения водорода H с разными микрочастицами:
- Хлороводород (HCl).
- Вода (h3O).
- Аммиак (Nh4).
- Метан (Ch5).
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N)-с тремя, а углерода — с 4 атомными частицами. В молекуле углекислого газа СО2 частица Н связана с двумя атомами кислорода.
А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
- HCl (I I).
- h3O (I II).
- HN3 (III I).
- Ch5 (IV I).
Один атом водорода соединяется только с одной частью другого элемента, соответственно, валентность принимают за 1. Объясняя «химическим» языком, атомная частица водорода обладает единицей валентности (В), он одновалентен.
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум. В структурной составляющей метана В. углерода равна 4. Условно в химии обозначают единицы валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частицах 19 века не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.
Валентность как основной принцип химии изучается до сих пор.
Ученый Э. Франкленд ввел терминологию «связь» в научные труды для характеристики взаимодействия атомов между собой. Специалист выяснил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Позже ученый выдвинул теорию о существовании конкретных чисел химической связи и назвал ее «соединительной силой». Труды Франклина стали значимым вкладом в структурную химию.
Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является из четырех основным, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.
В Советском союзе информацию о строении веществ систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. является возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначений атомов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и переменной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность. Многие элементы имеют неустойчивую величину.
| Валентность | |||
| Постоянная | Переменная | ||
| Элемент | В | Элемент | В |
| H (Водород) | I | I (Йод) | I |
| Li (Литий) | S (Сера) | II, IV, VI | |
| Na (Натрий) | N (Азот) | I-V | |
| K (Калий) | F | II, III | |
| F (Фтор) | Cu | I, II | |
| Al (Алюминий), B, Р | III, V | C, Si | II, IV |
| O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) | II | Cl, Br, I | I, III, V, VII |
Водород образует связь не с каждым элементом, а кислородные соединения имеются почти у всех.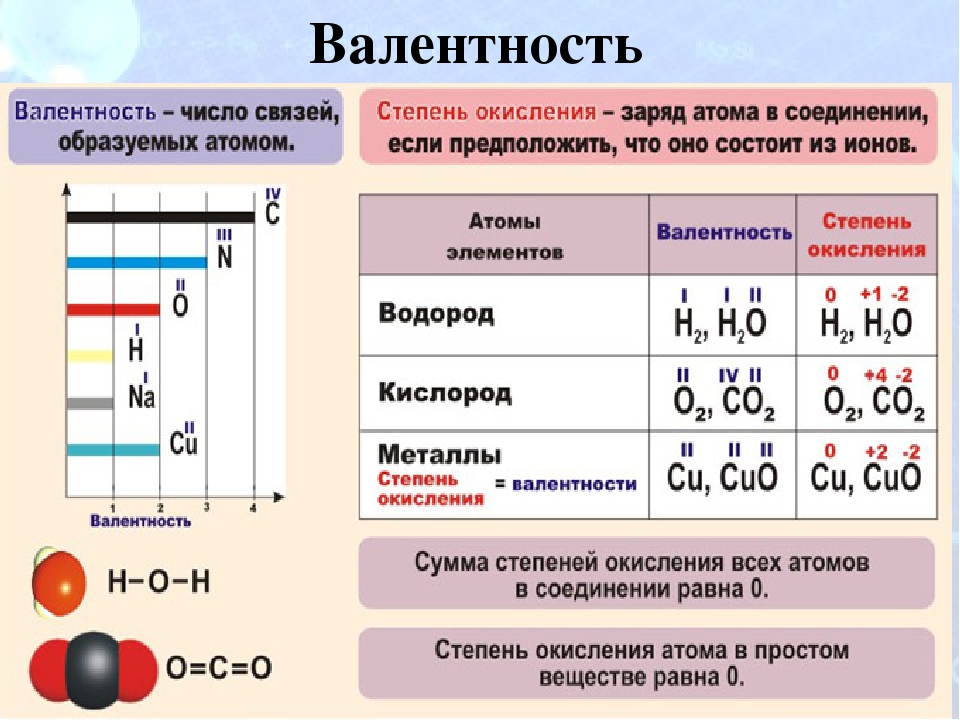 В таких сочетаниях атомы О2 проявляют двукратную валентность.
В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих электронных пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.
Валентность азота N в связи Nh4 составляет III, поскольку один атом Н связан с тремя частицами N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не применяется. Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана выглядит следующим образом: Ch5.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или прочих элементов модифицируется, когда они формируют различные соединения.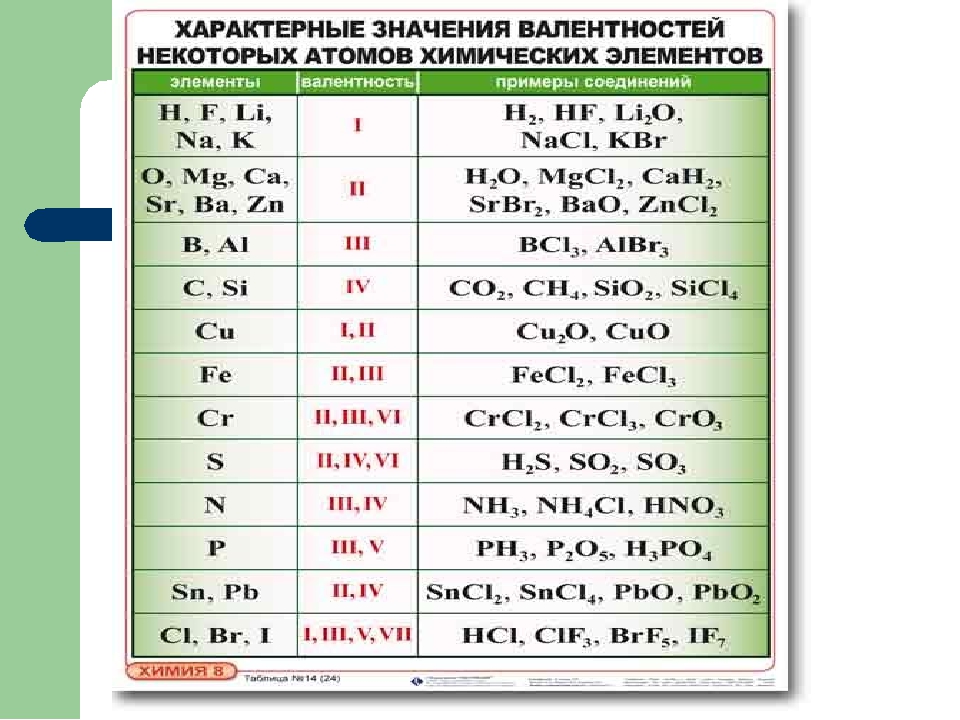
Йод представлен в таблице 53 по счету. Присутствие одного неспаренного электрона говорит о способности проявлять низшую В., равную единице в соединениях. Зная валентность, можно легко составить формулы соединений.
Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число атомов газа в сочетании 2*7, получается 14. Это число делится на количество мелких атомных частиц Mn:14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящих в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другого. В веществе, состоящем из молекул число В. обоих элементов равно. Используется минимальное общее кратное для определения неизвестной В.
Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Для правильной формулировки записи оксида фосфора учитывается В кислорода (II) и фосфора (V). Наименьшее общее кратное для Р и О получается десять. Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН)2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность. Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
- Записывают символы элементов и валентность. Это VII II ClO.
- Найти меньшее кратное валентностей двух элементов.
 VII*II, получается 14.
VII*II, получается 14. - Делят наименьшее кратное на В. каждого элемента, находят значение индексов. 14/2 = 7, 14/7 = 2.
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.
Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
взаимосвязаны.
Валентность:
- Высшая. Соответствует порядковому № группы.
- Низшая. От числа вида по табличным данным отнимают номер интересующего элемента.
- Основанием для образования соединений является прием электронов.
- Виды электронов:
- Спаренные. Расположены на одной орбитали.
- Неспаренные. Это 1 электрон на орбитали.
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
В молекулярной структуре водорода и серы h3S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.
Источник: https://nauka.club/khimiya/valentnost-khimicheskikh-elementov.html
Урок 6. Валентность – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода.
В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами.
Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле h3O у атома кислорода валентность равна двум.
По той же причине в молекуле Nh4 валентность атома азота равна трем, а в молекуле Ch5 валентность атома углерода равна четырем.
Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
- Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
- Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды h3O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
- Определяем индексы каждого элемента:
- Записываем формулу соединения: Si3N4.
- В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.

- Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-6-valentnost.html
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина.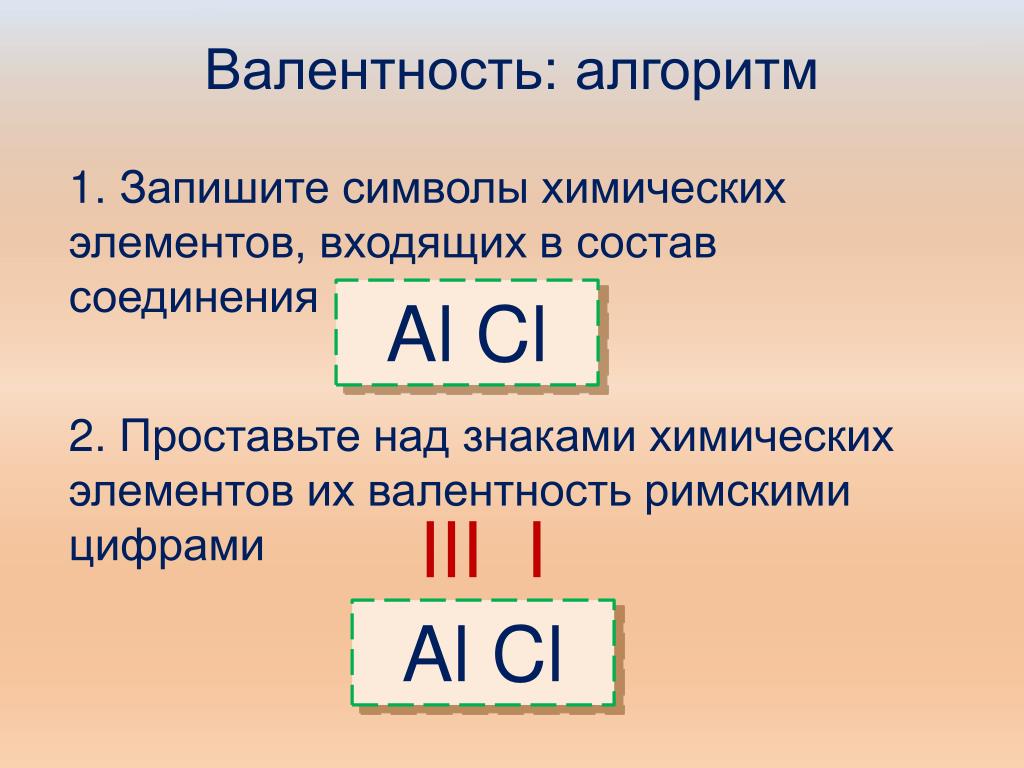 Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- — Высшая валентность всегда равна № группы.
- — Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- — У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- — У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
Атомный № Химический элемент Символ Валентность химических элементов Примеры соединений 1 Водород / Hydrogen H I HF 2 Гелий / Helium He отсутствует — 3 Литий / Lithium Li I Li2O 4 Бериллий / Beryllium Be II Beh3 5 Бор / Boron B III BCl3 6 Углерод / Carbon C IV, II CO2, Ch5 7 Азот / Nitrogen N III, IV Nh4 8 Кислород / Oxygen O II h3O, BaO 9 Фтор / Fluorine F I HF 10 Неон / Neon Ne отсутствует — 11 Натрий / Sodium Na I Na2O 12 Магний / Magnesium Mg II MgCl2 13 Алюминий / Aluminum Al III Al2O3 14 Кремний / Silicon Si IV SiO2, SiCl4 15 Фосфор / Phosphorus P III, V Ph4, P2O5 16 Сера / Sulfur S VI, IV, II h3S, SO3 17 Хлор / Chlorine Cl I, III, V, VII HCl, ClF3 18 Аргон / Argon Ar отсутствует — 19 Калий / Potassium K I KBr 20 Кальций / Calcium Ca II Cah3 21 Скандий / Scandium Sc III Sc2S3 22 Титан / Titanium Ti II, III, IV Ti2O3, Tih5 23 Ванадий / Vanadium V II, III, IV, V VF5, V2O3 24 Хром / Chromium Cr II, III, VI CrCl2, CrO3 25 Марганец / Manganese Mn II, III, IV, VI, VII Mn2O7, Mn2(SO4)3 26 Железо / Iron Fe II, III FeSO4, FeBr3 27 Кобальт / Cobalt Co II, III CoI2, Co2S3 28 Никель / Nickel Ni II, III, IV NiS, Ni(CO)4 29 Медь / Copper Сu I, II CuS, Cu2O 30 Цинк / Zinc Zn II ZnCl2 31 Галлий / Gallium Ga III Ga(OH)3 32 Германий / Germanium Ge II, IV GeBr4, Ge(OH)2 33 Мышьяк / Arsenic As III, V As2S5, h4AsO4 34 Селен / Selenium Se II, IV, VI, h3SeO3 35 Бром / Bromine Br I, III, V, VII HBrO3 36 Криптон / Krypton Kr VI, IV, II KrF2, BaKrO4 37 Рубидий / Rubidium Rb I RbH 38 Стронций / Strontium Sr II SrSO4 39 Иттрий / Yttrium Y III Y2O3 40 Цирконий / Zirconium Zr II, III, IV ZrI4, ZrCl2 41 Ниобий / Niobium Nb I, II, III, IV, V NbBr5 42 Молибден / Molybdenum Mo II, III, IV, V, VI Mo2O5, MoF6 43 Технеций / Technetium Tc I — VII Tc2S7 44 Рутений / Ruthenium Ru II — VIII RuO4, RuF5, RuBr3 45 Родий / Rhodium Rh I, II, III, IV, V RhS, RhF3 46 Палладий / Palladium Pd I, II, III, IV Pd2S, PdS2 47 Серебро / Silver Ag I, II, III AgO, AgF2, AgNO3 48 Кадмий / Cadmium Cd II CdCl2 49 Индий / Indium In III In2O3 50 Олово / Tin Sn II, IV SnBr4, SnF2 51 Сурьма / Antimony Sb III, IV, V SbF5, Sbh4 52 Теллур / Tellurium Te VI, IV, II Teh3, H6TeO6 53 Иод / Iodine I I, III, V, VII HIO3, HI 54 Ксенон / Xenon Xe II, IV, VI, VIII XeF6, XeO4, XeF2 55 Цезий / Cesium Cs I CsCl 56 Барий / Barium Ba II Ba(OH)2 57 Лантан / Lanthanum La III Lah4 58 Церий / Cerium Ce III, IV CeO2 , CeF3 59 Празеодим / Praseodymium Pr III, IV PrF4, PrO2 60 Неодим / Neodymium Nd III Nd2O3 61 Прометий / Promethium Pm III Pm2O3 62 Самарий / Samarium Sm II, III SmO 63 Европий / Europium Eu II, III EuSO4 64 Гадолиний / Gadolinium Gd III GdCl3 65 Тербий / Terbium Tb III, IV TbF4, TbCl3 66 Диспрозий / Dysprosium Dy III Dy2O3 67 Гольмий / Holmium Ho III Ho2O3 68 Эрбий / Erbium Er III Er2O3 69 Тулий / Thulium Tm II, III Tm2O3 70 Иттербий / Ytterbium Yb II, III YO 71 Лютеций / Lutetium Lu III LuF3 72 Гафний / Hafnium Hf II, III, IV HfBr3, HfCl4 73 Тантал / Tantalum Ta I — V TaCl5, TaBr2, TaCl4 74 Вольфрам / Tungsten W II — VI WBr6, Na2WO4 75 Рений / Rhenium Re I — VII Re2S7, Re2O5 76 Осмий / Osmium Os II — VI, VIII OsF8, OsI2, Os2O3 77 Иридий / Iridium Ir I — VI IrS3, IrF4 78 Платина / Platinum Pt I, II, III, IV, V Pt(SO4)3, PtBr4 79 Золото / Gold Au I, II, III AuH, Au2O3, Au2Cl6 80 Ртуть / Mercury Hg II HgF2, HgBr2 81 Талий / Thallium Tl I, III TlCl3, TlF 82 Свинец / Lead Pb II, IV PbS, Pbh5 83 Висмут / Bismuth Bi III, V BiF5, Bi2S3 84 Полоний / Polonium Po VI, IV, II PoCl4, PoO3 85 Астат / Astatine At нет данных — 86 Радон / Radon Rn отсутствует — 87 Франций / Francium Fr I — 88 Радий / Radium Ra II RaBr2 89 Актиний / Actinium Ac III AcCl3 90 Торий / Thorium Th II, III, IV ThO2, ThF4 91 Проактиний / Protactinium Pa IV, V PaCl5, PaF4 92 Уран / Uranium U III, IV UF4, UO3 93 Нептуний Np III — VI NpF6, NpCl4 94 Плутоний Pu II, III, IV PuO2, PuF3, PuF4 95 Америций Am III — VI AmF3, AmO2 96 Кюрий Cm III, IV CmO2, Cm2O3 97 Берклий Bk III, IV BkF3, BkO2 98 Калифорний Cf II, III, IV Cf2O3 99 Эйнштейний Es II, III EsF3 100 Фермий Fm II, III — 101 Менделевий Md II, III — 102 Нобелий No II, III — 103 Лоуренсий Lr III — Номер Элемент Символ Валентность химических элементов Пример
Источник: https://infotables. ru/khimiya/1071-valentnost-khimicheskikh-elementov
ru/khimiya/1071-valentnost-khimicheskikh-elementov
Ответы@Mail.Ru: Как определить валентность по таблице Менделеева?
есть высшая валентность это номер группы…. и низшая — это 8 — номер группы …но что касаетсятаких элементов как железо.. . они проявляют разную степень окисления и в таблице менделеева ты это не найдешь.. . это есть в справочниках по химии
Максимальная валентность по кислороду равна числу электронов на внешнем слое. В общем случае номеру группы. У Р с утра ещё была V группа, за это время что-то изменилось? Валентность по водороду равна числу электронов, которые элемент может принять на внешний слой. Равна 8- №группы.
У элементов с переменной валентностью всё сложнее. И Fe c утра был в VIII! Железо отдаёт 2 электрона с внешнего слоя, валентность 2, ст. окисления +2, ещё один «лишний» электрон с предвнешнего d слоя — валентность 3. Придётся запоминать! Только не говорите, что таблица Д.
Менделеева уже «перекроена», тогда мне придётся всё заново учить!
Валентность — свойство атомов одного химического элемента присоединять определенное число атомов другого химического элемента.
Есть элементы, которые имеют постоянную валентность:
одновалентны (I) — H,Li, Na, K, Rb, Cs, F, I
двухвалентны (II) — O, Be, Mg, Ca, Sr, Ba, Zn, Cd
трехвалентны (III) — B, Al Есть еще один способ: определять валентность можно по таблице Д. И. Менделеева.
Все элементы в таблице разделены на подгруппы а) и б) .
Активные металлы занимают только три первые группы. Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II. Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III).
Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую — вычисляют по формуле (8-Ь группы) , в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Есть в-ва, валентность которых определяется по группе, а есть те в-ва ( например металлы ) , у которых валентность с ней не совпадает. Нужно из 8 ( максимальной группы ) отнять номер группы в-ва, валентность у которого хотите найти
Нужно из 8 ( максимальной группы ) отнять номер группы в-ва, валентность у которого хотите найти
Все элементы в таблице разделены на подгруппы а) и б) . Активные металлы занимают только три первые группы.
Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II.
Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III). Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую — вычисляют по формуле (8-Ь группы) , в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Алгоритмы составления формул по валентности и определение валентности по формуле я посылаю как прикрепленный файл. Распечатай его и пользуйся пока не научишься.
Источник: https://touch. otvet.mail.ru/question/28569283
otvet.mail.ru/question/28569283
Как определить валентность?
Согласно школьному определению валентность — это способность химического элемента образовывать то или иное количество химических связей с другими атомами.
Как известно, валентность бывает постоянной (когда химический элемент образует всегда одно и то же количество связей с другими атомами) и переменной (когда в зависимости от того или иного вещества валентность одного и того же элемента изменяется).
Определить валентность нам поможет периодическая система химических элементов Д. И. Менделеева.
Действуют такие правила:
1) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у неё максимальная валентность равна 6.
2) Минимальная валентность для неметаллов равна 8 минус номер группы. Например, минимальная валентность того же хлора равна 8 – 7, то есть 1.
Например, минимальная валентность того же хлора равна 8 – 7, то есть 1.
- Увы, из обоих правил имеются исключения.
- Например, медь находится в 1-й группе, однако максимальная валентность меди равна не 1, а 2.
- Кислород находится в 6-й группе, но у него валентность почти всегда 2, а вовсе не 6.
- Полезно помнить ещё следующие правила:
3) Все щелочные металлы (металлы I группы, главной подгруппы) всегда имеют валентность 1. Например, валентность натрия всегда равна 1, потому что это щелочной металл.
4) Все щёлочно-земельные металлы (металлы II группы, главной подгруппы) всегда имеют валентность 2. Например, валентность магния всегда равна 2, потому что это щёлочно-земельный металл.
- 5) Алюминий всегда имеет валентность 3.
- 6) Водород всегда имеет валентность 1.
- 7) Кислород практически всегда имеет валентность 2.
- 8) Углерод практически всегда имеет валентность 4.

- Следует помнить, что в разных источниках определения валентности могут отличаться.
- Более или менее точно валентность можно определить как количество общих электронных пар, посредством которых данный атом связан с другими.
Согласно такому определению, валентность азота в HNO3 равна 4, а не 5. Пятивалентным азот быть не может, потому что в таком случае вокруг атома азота кружилось бы 10 электронов. А такого не может быть, потому что максимум электронов составляет 8.
Источник: http://www.bolshoyvopros.ru/questions/505034-kak-opredelit-valentnost.html
Как определить валентность по периодической таблице Менделеева: что это такое, изучение свойств химических элементов
Атомы химических элементов могут образовывать различное число связей. Эта способность имеет специальное название – валентность.
Давайте разберемся, как определить валентность по таблице Менделеева, узнаем, в чем заключается ее отличие от степени окисления, увидим закономерности, характерные для водорода, углерода, фосфора, цинка, научимся находить валентность химических элементов.
Основные сведения
Валентность – это возможность атомов различных химических элементов образовывать связи между собой. Другими словами можно сказать, что это способность атома присоединить к себе определенное количество других атомов.
Важно! Это не всегда постоянное число для одного и того же элемента. В разных соединениях элемент может обладать различными значениями.
Определение по таблице Д.И. Менделеева
Для определения этой способности атома по таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы.
Это вертикальные столбцы, которые делят все элементы по определенному признаку. В зависимости от признака, выделяют подразделения элементов.
Этими столбцами элементы делятся на тяжелые и легкие элементы, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, для определения способности элемента образовывать связи нужно руководствоваться двумя правилами:
- Высшая валентность элемента равна номеру его группы.

- Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Например, фосфор проявляет высшую валентность V – P2O5 и низшую (8-5)=3– PF3.
Стоит также отметить несколько основных характеристик и особенностей при определении этого показателя:
- Валентность водорода всегда I – h3O, HNO3, h4PO4.
- Валентность кислорода всегда равна II – CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы – Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две валентности – высшая и низшая.
Также существуют элементы, у которых может быть 3 или 4 разных значений этого показателя. К ним относятся хлор, бор, йод, хром, сера и другие. Например, хлор обладает валентностью I, III, V, VII – HCl, ClF3,ClF5,HClO4 соответственно.
Определение по формуле
Для определения по формуле можно воспользоваться несколькими правилами:
- Если известна валентность (V) одного из элементов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что валентность кислорода всегда равна II, тогда можем воспользоваться таким правилом: произведение числа атомов на его V одного элемента должно равняться произведению числа атомов другого элемента на его V.
 Таким образом, валентность углерода можно найти так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть валентность углерода равняется 4. Рассмотрим еще несколько примеров: P2O5 – тут валентность фосфора = (5*2)/2 = 5. HCl – валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
Таким образом, валентность углерода можно найти так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть валентность углерода равняется 4. Рассмотрим еще несколько примеров: P2O5 – тут валентность фосфора = (5*2)/2 = 5. HCl – валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1. - Если известна валентность нескольких элементов, которые составляют группу: в молекуле гидроксида натрия NaOH валентность кислорода равняется II, а валентность водорода – I, таким образом группа -OH обладает одной свободной валентностью, так как кислород присоединил только один атом водорода и еще одна связь свободна. К ней и присоединится натрий. Можно сделать вывод, что натрий – одновалентный элемент.
Разница между степенью окисления и валентностью
Очень важно понимать принципиальную разницу между этими понятиями. Степень окисления – это условный электрический заряд, которым обладает ядро атома, в то время как валентность – это количество связей, которые может установить ядро элемента.
Рассмотрим подробнее, что такое степень окисления. Согласно современной теории о строении атома, ядро элемента состоит из положительно заряженных протонов и нейтронов без заряда, а вокруг него находятся электроны с отрицательным зарядом, которые уравновешивают заряд ядра и делают элемент электрически нейтральным.
В случае, если атом устанавливает связь с другим элементом, он отдает или принимает электроны, то есть выходит из состоянии баланса и начинает обладать электрическим зарядом. При этом если атом отдает электрон, он становится положительно заряженным, а если принимает – отрицательным.
Внимание! В соединении хлора и водорода HCl водород отдает один электрон и приобретает заряд +1, а хлор принимает электрон и становится отрицательным -1. В сложных соединениях, HNO3 и h3SO4, степени окисления будут такими – H+1N+5O3 -2 и h3 +1S +6O4 -2.
Сравнивая два этих определения, можно сделать вывод, что валентность и степень окисления часто совпадают: валентность водорода +1 и валентность I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда!
В органическом соединении углерода под названием формальдегид и формулой HCOH у углерода степень окисления 0, но он обладает V, равной 4. В перекиси водорода h3O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке.
В перекиси водорода h3O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке.
Валентности распространенных элементов
Водород
Один из самых распространенных элементов во вселенной, встречается во многих соединениях и всегда обладает V=1. Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
На первом уровне может находиться не более двух электронов одновременно, таким образом, водород может либо отдать свой электрон и образовать связь (электронная оболочка останется пустой), либо принять 1 электрон, также образовав новую связь (электронная оболочка полностью заполнится).
Пример: h3O – 2 атома водорода с V=1 связаны с двухвалентным кислородом; HCl – одновалентные хлор и водород; HCN – синильная кислота, где водород также проявляет V, равную 1.
Углерод
Углерод может обладать либо валентностью II, либо IV. Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II.
Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II.
То есть 2 электрона установили 2 новые связи, например, соединение CO – угарный газ, где и кислород, и водород двухвалентные.
Однако бывают ситуации, когда один электрон с первого уровня переходит на второй, тогда у углерода образуется 4 свободных электрона, которые могут образовывать связи: СО2, НСООН, Н2СО3.
Фосфор
Данный элемент может обладать валентностью III и V.
Как и в предыдущих случаях, связанно это со строением внешнего электронного уровня, на котором у него 3 электрона, то есть возможность образовать 3 связи, но, как и углерод, у него возможен переход 1 электрона с s-орбитали на d-орбиталь, тогда неспаренных электронов станет 5, а значит, и валентность тоже будет равна V. Например: РН3, Р2О5, Н3РО4.
Цинк
Как элемент главной подгруппы и металл, цинк может обладать только валентностью, которая равна номеру его группы, то есть 2. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Определение валентности химических элементов
Изучение валентности по периодической таблице Менделеева
Вывод
Теперь вы знаете, что такое валентность, чем она отличается от степени окисления, и легко определите валентность элементов по формулам или таблице Менделеева.
Это интересно! Основной закон Гесса и следствия из него
Источник: https://uchim.guru/himiya/kak-opredelit-valentnost-po-tablitse-mendeleeva.html
Таблица валентностей химических элементов
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
Таблица валентностей химических элементов. Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют.
Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют. Таблица валентностей химических элементов.- Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра,
- он же: атомное число
Русское / Английское наименование Химический символ Валентность 1 Водород / Hydrogen H (-1), +1 2 Гелий / Helium He 3 Литий / Lithium Li +1 4 Бериллий / Beryllium Be +2 5 Бор / Boron B -3, +3 6 Углерод / Carbon C (+2), +4 7 Азот / Nitrogen N -3, -2, -1, (+1), +2, +3, +4, +5 8 Кислород / Oxygen O -2 9 Фтор / Fluorine F -1, (+1) 10 Неон / Neon Ne 11 Натрий / Sodium Na +1 12 Магний / Magnesium Mg +2 13 Алюминий / Aluminum Al +3 14 Кремний / Silicon Si -4, (+2), +4 15 Фосфор / Phosphorus P -3, +1, +3, +5 16 Сера / Sulfur S -2, +2, +4, +6 17 Хлор / Chlorine Cl -1, +1, (+2), +3, (+4), +5, +7 18 Аргон / Argon Ar 19 Калий / Potassium K +1 20 Кальций / Calcium Ca +2 21 Скандий / Scandium Sc +3 22 Титан / Titanium Ti +2, +3, +4 23 Ванадий / Vanadium V +2, +3, +4, +5 24 Хром / Chromium Cr +2, +3, +6 25 Марганец / Manganese Mn +2, (+3), +4, (+6), +7 26 Железо / Iron Fe +2, +3, (+4), (+6) 27 Кобальт / Cobalt Co +2, +3, (+4) 28 Никель / Nickel Ni (+1), +2, (+3), (+4) 29 Медь / Copper Сu +1, +2, (+3) 30 Цинк / Zinc Zn +2 31 Галлий / Gallium Ga (+2). +3
+3 32 Германий / Germanium Ge -4, +2, +4 33 Мышьяк / Arsenic As -3, (+2), +3, +5 34 Селен / Selenium Se -2, (+2), +4, +6 35 Бром / Bromine Br -1, +1, (+3), (+4), +5 36 Криптон / Krypton Kr 37 Рубидий / Rubidium Rb +1 38 Стронций / Strontium Sr +2 39 Иттрий / Yttrium Y +3 40 Цирконий / Zirconium Zr (+2), (+3), +4 41 Ниобий / Niobium Nb (+2), +3, (+4), +5 42 Молибден / Molybdenum Mo (+2), +3, (+4), (+5), +6 43 Технеций / Technetium Tc +6 44 Рутений / Ruthenium Ru (+2), +3, +4, (+6), (+7), +8 45 Родий / Rhodium Rh (+2), (+3), +4, (+6) 46 Палладий / Palladium Pd +2, +4, (+6) 47 Серебро / Silver Ag +1, (+2), (+3) 48 Кадмий / Cadmium Cd (+1), +2 49 Индий / Indium In (+1), (+2), +3 50 Олово / Tin Sn +2, +4 51 Сурьма / Antimony Sb -3, +3, (+4), +5 52 Теллур / Tellurium Te -2, (+2), +4, +6 53 Иод / Iodine I -1, +1, (+3), (+4), +5, +7 54 Ксенон / Xenon Xe 55 Цезий / Cesium Cs +1 56 Барий / Barium Ba +2 57 Лантан / Lanthanum La +3 58 Церий / Cerium Ce +3, +4 59 Празеодим / Praseodymium Pr +3 60 Неодим / Neodymium Nd +3, +4 61 Прометий / Promethium Pm +3 62 Самарий / Samarium Sm (+2), +3 63 Европий / Europium Eu (+2), +3 64 Гадолиний / Gadolinium Gd +3 65 Тербий / Terbium Tb +3, +4 66 Диспрозий / Dysprosium Dy +3 67 Гольмий / Holmium Ho +3 68 Эрбий / Erbium Er +3 69 Тулий / Thulium Tm (+2), +3 70 Иттербий / Ytterbium Yb (+2), +3 71 Лютеций / Lutetium Lu +3 72 Гафний / Hafnium Hf +4 73 Тантал / Tantalum Ta (+3), (+4), +5 74 Вольфрам / Tungsten W (+2), (+3), (+4), (+5), +6 75 Рений / Rhenium Re (-1), (+1), +2, (+3), +4, (+5), +6, +7 76 Осмий / Osmium Os (+2), +3, +4, +6, +8 77 Иридий / Iridium Ir (+1), (+2), +3, +4, +6 78 Платина / Platinum Pt (+1), +2, (+3), +4, +6 79 Золото / Gold Au +1, (+2), +3 80 Ртуть / Mercury Hg +1, +2 81 Талий / Thallium Tl +1, (+2), +3 82 Свинец / Lead Pb +2, +4 83 Висмут / Bismuth Bi (-3), (+2), +3, (+4), (+5) 84 Полоний / Polonium Po (-2), +2, +4, (+6) 85 Астат / Astatine At нет данных 86 Радон / Radon Rn 87 Франций / Francium Fr нет данных 88 Радий / Radium Ra +2 89 Актиний / Actinium Ac +3 90 Торий / Thorium Th +4 91 Проактиний / Protactinium Pa +5 92 Уран / Uranium U (+2), +3, +4, (+5), +6
Дополнительная информация:- А чем отличается Физика от Химии? Характерные диапазоны времени, расстояний и энергии для физики и химии.

- «Химический алфавит (словарь)» — названия, сокращения, приставки, обозначения веществ и соединений.
- Стандартная, она же научная форма записи числа. Порядок величины. Разница на порядок. Зачем это придумали.
- Нормальные условия (НУ). Что это такое?
- Таблица Менделеева. Названия. Электронные формулы. Структурные формулы.
- Вода (h3O) — свойства воды, пара и льда
- Водные растворы и смеси для обработки металлов.
- Характерные химические реакции на органические соединения. Как определить наличие органических соединений?
- Характерные химические реакции на катионы (положительно заряженные ионы). Как определить наличие катионов?
- Характерные химические реакции на анионы (отрицательно заряженные ионы). Как определить наличие анионов?
- Водородный показатель pH. Таблицы показателей pH.
- Свойства растворов. Константы диссоциации, кислотности, основности. Растворимость. Смеси.
- Свойства растворителей.
- Термические константы веществ.
 Энтальпии. Энтропии. Энергии Гиббса…
Энтальпии. Энтропии. Энергии Гиббса… - Тепловые величины, включая температуры кипения, плавления, пламени и т.д …
- Горение и взрывы. Окисление и восстановление.
- Классы, категории, обозначения опасности (токсичности) химических веществ
- Калькулятор физических свойств наиболее известных веществ по материалам методички В. Н. Бобылёва РХТУ им. Менделеева (Внешняя ссылка)
- Электрохимическая коррозия металла. Катодная защита. Анодная защита. Пассивная защита. Электродные потенциалы — таблица.
- Сырье и продукты промышленности органических и неорганических веществ. Подробнейший справочник технолога. Физические, химические, тепловые и прочие свойства веществ.
- Химия и физика человека.
Источник: https://tehtab.ru/guide/guidechemistry/valencytable/
как найти валентность, я не понял вообще как её находить?
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
Элементы Постоянная валентность
щелочные металлы (Li, Na, K, Rb , Cs, Fr) I
металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) II
алюминий (Al) III
кислород (О) II
фтор (F) I
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
valence — Перевод на русский — примеры английский
На основании Вашего запроса эти примеры могут содержать грубую лексику.
На основании Вашего запроса эти примеры могут содержать разговорную лексику.
Communicator reward valence plays a large part in how expectancy violations are handled in email communications.
Валентность вознаграждения коммуникатора играет большую роль в том, как нарушения ожиданий обрабатываются в сообщениях электронной почты. Power has a negative moral valence.
У власти присутствует негативная нравственная валентность. One valence electron on each center resides in a pz orbital, which is orthogonal to the other three sigma-bonds.
Один валентный электрон каждой ячейки находится на pz орбитали, которая ортогональна трём другим сигма-связям. Ordinary mesons are made up of a valence quark and a valence antiquark.
In these basis sets, the same number of Gaussian primitives comprise core and valence orbitals.
В этих базисах одинаковое число гауссовых функций описывает основные и валентные орбитали. In order to gain enough electrons to fill their valence shells (see also octet rule), many atoms will form covalent bonds with other atoms.
Для того, чтобы получить достаточное количество электронов, чтобы заполнить их валентные оболочки (см. также правило октета), множество атомов образуют ковалентные связи с другими атомами. The same behavior in different occasions and contexts is viewed differently in terms of the degree of valence.
Интересно, что такое поведение в разных случаях и контекстах оценивается по-разному с точки зрения валентности. In actuality, research shows expectancy violations vary in frequency, seriousness, and valence.
В действительности же, исследования показывают, что нарушения ожиданий различаются по частоте, важности и валентности. And the valence is actually quite negative, so you must have been a big fan.
Валентность весьма негативная, то есть ты, пожалуй, была фанатом. The most stable valence of americium is 3 in the aqueous solutions and 3 or 4 in solid compounds.
Наиболее устойчивой валентностью америция в водном растворе является +З, в твёрдых соединения +З и +4. During this time he also studied the gas density of metals which made it possible to determine the valence of various metals.
Также Нильсон изучал плотность газов металлов, что позволило определить валентность многих металлов. While the verbal prefixes indicate relations between the verb and its arguments, the suffixes cover a wider semantic range, including information about valence, modality, tense and evidentiality.
Если глагольные префиксы обозначают связь между глаголом и его аргументы, то суффиксы охватывают более широку. семантическую сферу, включая информацию о валентности, модальности, времени и очевидности. When the violation act is one that is likely to be ambiguous in its meaning or to carry multiple interpretations that are not uniformly positive or negative, then the reward valence of the communicator can be especially significant in moderating interpretations, evaluations, and subsequent outcomes.
Когда актом нарушения является акт, который может иметь ни одно значение или иметь множество интерпретаций, как положительных, так и отрицательных, тогда валентность вознаграждения коммуникатора может быть особенно важна в интерпретации, оценке и последующих результатах. When faced with behavior that does not meet an individual’s needs, expectations, or desires, he or she can respond either positively or negatively depending on the degree of violation and positive or negative valence of the relationship.
Когда он сталкивается с поведением, которое не отвечает потребностям, ожиданиям или желаниям, реакция может быть как положительной, так и отрицательной в зависимости от степени нарушения и положительной или отрицательной валентности отношений между коммуникаторами. Alternative convention include writing a number by the edge to indicate multiplicity (commonly used in Coxeter diagrams), darkening nodes to indicate root length, or using 120º angles on valence 2 nodes to make the nodes more distinct.
Альтернативные соглашения предполагают указание числа рёбер для кратности (обычно используется в диаграммах Коксетера), использование цвета для указания длины корня или использование углов 120º для узлов валентности 2, чтобы сделать узлы более различимыми. The Y and Z indicate that the valence orbitals are composed of two basis functions each, the first one composed of a linear combination of Y primitive Gaussian functions, the other composed of a linear combination of Z primitive Gaussian functions.
У и Z показывают, что валентные орбитали состоят из двух базисных функций каждая: первая из которых представляет собой линейную комбинацию Y простых гауссовых функций, а вторая — Z простых гауссовых функций. Proximity and valence electrons.
Some authors classify these elements as main-group elements because the valence electrons are in ns2 orbitals.
Некоторые авторы классифицируют эти элементы как основные элементы группы, поскольку валентные электроны у них расположены на ns²-орбиталях. For example, in traditional polymers such as polyethylenes, the valence electrons are bound in sp3 hybridized covalent bonds.
В традиционных полимерах, таких как полиэтилен, валентные электроны связаны ковалентной связью типа sp3-гибридизации.
In it, he also first introduced the term valence, under its longer variant quantivalence, to describe the combining capacity of an atom.
В ней он также впервые ввел термин валентность вместо его более длинного варианта поливалентность для описания объединительной способности атома. Валентность. Как найти валентность. Элементы с постоянной валентностью
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно число говоря, валентность — это «рук», атом цепляется за другие атомы. Естественно, никаких «рук» у элементов; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с постоянной валентностью (коих большинством).
Элементы с постоянной валентностью необходимо запомнить:
Элементы Постоянная валентность щелочные металлы (Li, Na, K, Rb, Cs, Fr) I металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) II алюминий (Al) III кислород (О) II фтор (F) I
Остальные элементы могут проявть разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), Но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений : максимальная (и единственная) валентность фтора равна I (а не VII), кислород — II (а не который VI), азот — IV (способность азота проявлять валентность V — популярный миф, встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью.Например, валентность азота в N 2 равна III, степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: в виде числа атомов первого элемента молекуле на его валентность должно быть аналогично произведению для второго элемента .
Запомните формальное правило: в виде числа атомов первого элемента молекуле на его валентность должно быть аналогично произведению для второго элемента .
В соединении A x B y : валентность (А) • x = валентность (В) • y
Пример 1 . Найти валентности всех элементов в соединении NH 3 .
Решение . Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно равно 3 .Очевидно, что Х = 3. Ответ: N (III), H (I).
Пример 2 . Найти валентности всех элементов в молекуле Cl 2 O 5 .
Решение . У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl (V), O (II).
Очевидно, что Х = 5. Ответ: Cl (V), O (II).
Пример 3 . Найти валентность хлора в молекуле SCl 2 , если известно, что валентность серы равна II.
Решение . Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схемам 1 и 2. Ответ: Cl (I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную ответственность.
Пример 4 .Составьте формулу соединения кальция с водородом.
Решение . Валентности кальция и водорода — II и соответственно I. Пусть формула искомого соединения — Ca x H y . Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH 2 .
Ответ: CaH 2 .
«А почему именно CaH 2 ? — спросите вы. — Ведь варианты Ca 2 H 4 и Ca 4 H 8 и даже Ca 10 H 20 не противоречат нашим правиламу!»
Ответ прост: берите минимально возможные значения х и у.В приведенном примере эти минимальные (натуральные!) Значения как раз и равны 1 и 2.
«Значения, соединения типа N 2 O 4 или C 6 H 6 невозможны? — спросите вы. — Следует заменить эти формулы на NO 2 и CH?»
Нет, возможны. Более того, N 2 O 4 и NO 2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (отличие от С 6 Н 6 ).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилами: берите наименьшие значения индексов.
Пример 5 . Составьте формулу соединения серы с фтором, если известно, что валентность серы шести шести.
Составьте формулу соединения серы с фтором, если известно, что валентность серы шести шести.
Решение . Пусть формула соединения — S x F y . Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения чисел — это 1 и 6.Ответ: SF 6 .
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти тест по теме «Валентность» .
Хотите узнать, почему «классическое определение валентности часто не» работает «? Почему валентность железа в FeO не равна двум? Почему для описания комплексных элементов используется понятие «координационное число»?
Смотрите продолжение этой статьи →
Урок №14-15.Валентность химических элементов. Определение валентности элементов по формулам бинарных соединений. Составление формул бинарных соединений по валентности
Валентность — это способность
присоединить к себе определенное число других атомов.
Валентность — определяется номером группы (число химических связей
в структурной формуле вещества).
Валентность элементов необходимо знать, чтобы составлять
химические формулы соединений (валентность обозначается римскими цифрами I, II, III — VIII).
Структурная формула вещества отображает
соединения элементов между собой, согласно их валентности, т.е. химическое
строение.
Na — одновалентен (одна связь)
H — одновалентен (одна связь)
O — двухвалентен (две связи у
каждого атома)
S — шестивалентна (образует шесть
связей с соседними атомами)
Правила
валентности элементов в соединениях
1. Валентность водорода принимать
за И (единицу).
Валентность водорода принимать
за И (единицу).
2. Кислород в своих соединениях проявляет
валентность II .
3. Высшая
валентность равна номеру группы N группы (исключение, N, O, F — для этих элементов характерна только низшая валентность).
4. Низкая валентность равна
разности между числом 8 (количество групп в таблице) и номером группы, в
которой находится данный элемент, т.е. 8- N группы
Определение
валентности металлов
(характерны
валентности — постоянная и переменная)
Металлы главных (А) подгрупп
I (А), II (А), III (А)
Характерна
высшая постоянная валентность.
В = N группы
Металл в формуле всегда занимает первую
позиция
Металлы побочных (Б) подгрупп
I (Б) -VIII (Б)
Характерна переменная валентность.
В —
указывается в названии вещества.
Например, оксид марганца ( VII ),
хлорид хрома ( II ).
Определение валентности неметаллов
(характерны валентности — высшая, низшая,
переменная)
Характерны
высшая валентность
В = N группы
Неметалл ставится в этом случае на первое
место в формуле
Характерна
низшая валентность
8- N группы
Неметалл ставится в этом случае на втором
место в формуле
Характерна переменная валентность.
В —
указывается в названии вещества.
Например, оксид серы ( IV ),
сульфид фосфора ( III ).
Неметалл ставится в этом случае на первое
место в формуле
Запомните! Низшую
валентность проявляет тот элемент — неметалл , который находится в
таблице Менделеева правее и выше, а высшую валентность — элемент, расположенный
левее и ниже.
Если данное правило не работает. То
следует использовать информацию о бинарных формулах веществ (оксидах, хлоридах, сульфидах и др.).
Бинарная химическая
формула — это формула химического соединения, в состав которого входят два
вида элементов.
ОКСИДЫ
СУЛЬФИДЫ
ХЛОРИДЫ
Оксид — это сложное вещество,
в состав которого входят два вида атомов, одним из которых является кислород,
с валентностью (II).
Na 2 О
CaО
P 2 О 5
Сульфид — это сложное
вещество, в состав которого входят два вида атомов, одним из которых является
сера, с валентностью (II).
K 2 S
MgS
Al 2 S 3
Хлорид — это сложное
вещество, в состав которого входят два вида атомов, одним из которых является
хлор, с валентностью (I).
FeCl 3
NaCl
CaCl 2
Общая формула
где Э — элемент;
Х — валентность элемента
Общая формула
где Э — элемент;
Х — валентность элемента
Общая формула
где Э — элемент;
Х — валентность элемента
* Другие
бинарные соединения: Э x F y — фторид; Э x Br y — бромид; Э x I y — йодид; Э x N y — нитрид; Э x P y — фосфид; Э x H y — гидрид (у элемента второй позиции низшая валентность).
Алгоритм составления формулы соединения оксида
фосфора
Последовательность
действий
Составление
формулы оксида фосфора
1. Написать символы элементов
Р О
2. Определить валентности элементов
V II
P O
3.Найти наименьшее общее кратное численных значений валентностей
5 • 2 = 10
4. Найти соотношения между атомами элементов путем деления
найденного наименьшего кратного на соответствующие валентности элементов
10: 5 = 2
10: 2 = 5
P
: О = 2: 5
5. Записать индексы при символах элементов
Записать индексы при символах элементов
Р 2 О 5
6.Формула соединения (оксида)
Р 2 О 5
Для
составления формулы можно воспользоваться следующим алгоритмом:
В = N группы
В = 8- N группы
А х
В у
Запомните! Если элемент А — металл побочной
подгруппы или неметалл с переменной валентностью, валентность А определяем не
по таблице Менделеева, а согласно названию вещества. Например, оксид серы ( IV ), сульфид фосфора ( III ).
Например, оксид серы ( IV ), сульфид фосфора ( III ).
как найти валентность, я не понял вообще как её находить?
Образно говоря, валентность — это число «рук», которое цепляется за другие атомы. Естественно, никаких «рук» у элементов; их роль играют т. н. валентные электроны. Можно сказать иначе: валентность — это способность атома данного элемента изменить определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их немного) и элементы с постоянной валентностью (коих большинству).
Элементы с постоянной валентностью необходимо запомнить:
Постоянная валентность
щелочные металлы (Li, Na, K, Rb, Cs, Fr) I
металлы II группы, главная подгруппы (Be, Mg, Ca, Sr, Ba, Ra ) II
алюминий (Al) III
кислород (О) II
фтор (F) I
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), Но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислород-II (а не VI), азот-IV (способность проявлять азот валентность V) — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, степень окисления = +2.
Например, валентность азота в N2 равна III, степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: изображение первого элемента в молекуле первого элемента должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
valence — Перевод на русский — примеры английский
На основании вашего запроса эти примеры могут содержать грубую лексику.
На основании вашего запроса эти примеры могут содержать разговорную лексику.
Коммуникатор вознаграждение Валентность играет большую роль в том, как обрабатываются нарушения ожидания при обмене сообщениями электронной почты.
Валентность вознаграждение коммуникатора играет большую роль в том, как нарушение ожидания обрабатываются в сообщениях электронной почты.
Власть имеет отрицательную мораль валентность .
У власти присутствует негативная нравственная валентность . Один электрон с валентностью на каждом центре находится на орбитали pz, которая ортогональна трем другим сигма-связям.
Один валентный электрон в каждой ячейке находится на pz орбитали, которая ортогональна трём другим сигма-связям. Обычные мезоны состоят из кварка с валентностью и антикварка с валентностью .
В этих базисных наборах такое же количество гауссовых примитивов включает ядро и валентных орбиталей.
В этих базисах одинаковое число гауссовых функций основных и валентных орбитали .
Чтобы получить достаточно электронов, чтобы заполнить свои оболочки с валентностью (см. Также правило октетов), многие атомы образуют ковалентные связи с другими атомами.
Для того, чтобы получить достаточное количество электронов, чтобы заполнить их валентные оболочки (см. Также правило октета), набор элементов образуют ковалентные связи с другими атомами. Одно и то же поведение в разных случаях и контекстах рассматривается по-разному с точки зрения степени валентности .
Интересно, что такое поведение в разных случаях и контекстах оценивается по-разному с точки зрения валентности . На самом деле, исследования показывают, что нарушения ожидания различаются по частоте, серьезности и валентности .
В же действительности, исследования показывают нарушения ожидания различаются по частотам, важности и валентности .
А валентность на самом деле довольно отрицательная, так что вы, должно быть, были большим поклонником.
Валентность весьма негативная, то есть ты, пожалуй, была фанатом. Самая стабильная валентность америция составляет 3 в водных растворах и 3 или 4 в твердых соединениях.
Наиболее устойчивой валентностью америция в водном растворе является + З, в твёрдых соединениях + З и +4. За это время он также изучил плотность газа металлов, что позволило определить валентность различных металлов.
Нильсон изучал плотность газов металлов, что определяет валентность многих металлов. В то время как глагольные префиксы указывают на отношения между глаголом и его аргументами, суффиксы охватывают более широкий семантический диапазон, включая информацию о валентности , модальности, времени и очевидности.
Если глагольные префиксы обозначают связь между глаголом и его аргументы, то суффиксы охватывают более широку.семантическую сферу, включая информацию о валентности , модальности, времени и очевидности. Когда акт нарушения может быть двусмысленным по своему значению или нести множественные интерпретации, которые не являются однозначно положительными или отрицательными, тогда валентность коммуникатора вознаграждения может быть особенно значимой для смягчения интерпретаций, оценок и последующих результатов. .
Когда актом нарушения является акт, который может иметь ни одно значение, как положительных, так и отрицательных, тогда валентность вознаграждения коммуникатора может быть важна особенно в интерпретации, оценке и оценке результатов. Столкнувшись с поведением, которое не соответствует потребностям, ожиданиям или желаниям человека, он или она может отреагировать либо положительно, либо отрицательно в зависимости от степени нарушения и положительной или отрицательной валентности отношений.
Когда он сталкивается с поведением, которое не отвечает потребностям, ожиданиям или желаниям, реакция может быть как положительной, так и отрицательной в зависимости от степени нарушения и положительной или отрицательной валентности отношений между коммуникаторами. Альтернативное соглашение включает запись числа на краю для обозначения множественности (обычно используется в диаграммах Кокстера), затемнение узлов для обозначения длины корня или использование углов 120º на узлах валентности 2, чтобы сделать узлы более различимыми.
Альтернативные соглашения предполагают указание числа рёбер для кратности (обычно используется в диаграммах Коксетера), использование цвета для длины корня или использование углов 120º для узлов валентности 2, чтобы сделать узлы более различимыми. Y и Z указывают, что орбитали валентности состоят из двух базисных функций каждая, первая из которых состоит из линейной комбинации Y примитивных функций Гаусса, а другая состоит из линейной комбинации Z примитивных функций Гаусса.
У и Z показывают, что валентные орбитали состоят из двух базисных функций каждую: первая из которых представляет собой линейную комбинацию Y простых гауссовых функций, а вторая — Z простых гауссовых функций. Близость и валентность электронов.
Некоторые авторы классифицируют эти элементы как элементы основной группы, поскольку валентность и электронов находятся на орбиталях ns2.
Некоторые авторы классифицируют эти элементы как основные элементы группы, поскольку валентные электроны у них расположены на ns²-орбиталях. Например, в традиционных полимерах, таких как полиэтилены, валентных электронов связаны ковалентными связями sp3-гибридизации.
В полимерах, таких как полиэтилен, валентные электроны связаны ковалентной связью типа sp3-гибридизации.
В нем он также впервые ввел термин валентность под его более длинным вариантом количественной, чтобы описать объединяющую способность атома.
В ней он также впервые ввел термин валентность вместо его более длинного варианта поливалентность для описания объединительной способности атома. ВАЛЕНТНОСТЬ • Большая российская энциклопедия
В книжной версии
Том 4.Москва, 2006, стр. 531
Скопировать библиографическую ссылку:
Авторы: В. И. Минкин
И. Минкин
ВАЛЕ́НТНОСТЬ (от лат. Valentia — сила), способность атома к образованию химич.связей. Количественной мерой В. атома элемента $ \ ce {Э} $ атомов числа атомов водорода или кислорода (атомы этих элементов считаются соответственно одно- или двухвалентными), $ \ ce {Э} $ присоединяет, образуярид $ \ ce {ЭН} _x $ или оксид $ \ ce {Э} _n {O} _m $. В. может быть определена и по др. атомам с известной валентностью. В разных соединениях атомы одного и того же элемента могут проявлять разл. В. Так, сера двухвалентна в $ \ ce {h3S} $ и $ \ ce {CuS} $, четырёхвалентна в $ \ ce {SO2} $ и $ \ ce {SF4} $, шестивалентна в $ \ ce {SO3} $ и $ \ ce {SF6} $.
В рамках электронной теории химической связи В. атома определяет его неспаренных электронов (в основном или возбужденных состояний), участвующих в общих образовании электронных пар с электронами др. элементы. Обычно макс. В. химич. элементов одной и той же группы периодич. системы одинаковы; для короткой формы системы макс. В. элемента соответствует порядковому номеру группы, в которой он находится.Напр., Макс. В. атома углерода должна быть равной 4, хлора 7. Электростатич. теория химич. связи привела к формулировке близкого к В. и дополнительного понятия степени окисления (окислительного числа). Степень окисления соответствует формальному заряду, который приобрёл бы атом, если бы все электронные пары его химич. связи сместились в сторону более электроотрицательных элементов. По знаку степени окисления, как правило, совпадает с экспериментально эффективным зарядом атома.Напр., Степень окисления серы в $ \ ce {SO3} $ равна + 6, её эффективный заряд ок. + 2.
В. элемента соответствует порядковому номеру группы, в которой он находится.Напр., Макс. В. атома углерода должна быть равной 4, хлора 7. Электростатич. теория химич. связи привела к формулировке близкого к В. и дополнительного понятия степени окисления (окислительного числа). Степень окисления соответствует формальному заряду, который приобрёл бы атом, если бы все электронные пары его химич. связи сместились в сторону более электроотрицательных элементов. По знаку степени окисления, как правило, совпадает с экспериментально эффективным зарядом атома.Напр., Степень окисления серы в $ \ ce {SO3} $ равна + 6, её эффективный заряд ок. + 2.
Развитие представлений о донорно-акцепторном механизме образования связи, водородной связи, нестехиометрич. соединениях, обнаружение новых классов химич. соединения (мостиковых, электронодефицитных, металлоорганических, в т. ч. металлоценов, металлич. кластеров, $ \ pi $ -комплексов), а также исследования кристаллич. структурно показана ограниченность правил определения формальной В. {2 -}} $ — с 8 атомами $ \ ce {Co} $. Химич. связь в подобных соединениях не может быть описана с помощью представлений о двухэлектронных двухцентровых связях и обусловлена образованием многоцентровой связи.
{2 -}} $ — с 8 атомами $ \ ce {Co} $. Химич. связь в подобных соединениях не может быть описана с помощью представлений о двухэлектронных двухцентровых связях и обусловлена образованием многоцентровой связи.
Основы теории В. заложены в 1850–1860-х гг. Э. Франклендом, Ф. А. Кекуле, А. Кольбе. Термин «В.» предложен в 1868 нем. химиком К. Вихельхаусом. На представлениях о В. была основанная теория химич. строения. В совр. теории химич.строения представления о В. часто отождествляют с общим учением о химич. связи.
Валентность элементов — Справочник химика 21
Химическим эквивалентом элемента называется его количество, которое соединяется с 1 молью водорода или заменяет то же количество водорода в химических реакциях. Химический эквивалент не является постоянной величиной, он зависит от валентности элемента. [c.5] От чего зависит эквивалент химического элемента а) от валентности элемента б) всегда является постоянной величиной [c. 10]
10]
Проведенный выше обзор валентности элементов второго периода периодической системы позволяет причину отличия этих элементеитов от других. Особенно сильно это выражено у трех элементов — азота, кислорода и фтора. Кроме особенностей ,. Они обусловливают внешние электроны, находящиеся во втором слое, в котором имеются только квантовые ячейки.Поэтому данные элементы не могут проявлять высокие валентности, известны для их аналогов. [c.83] Природа сил, вызывающих адсорбцию, может быть различной. Этот часто сопровождается конденсацией паров поглощаемого вещества в капиллярных порах адсорбента, присоединением молекул поглощаемого вещества на месте ненасыщенных валентностей элементов, составляют, их кристаллическую решетку адсорбента, и другими процессами.Независимо от природы адсорбционных сил на адсо]) бции следующие факторы природа поглощаемого вещества, температура, давление и примеси в фазе, из которой поглощается вещество. [c. 384]
384]
Если оба элемента могут образовывать друг с другом несколько соединений, то соотношение, в котором они находятся, или валентность элемента с меньшей электроотрицательностью, если последняя имеет переменную валентность, также отражается в названии. [c.138]
Точно установленный состав этого соединения никак и не мог быть объяснен с точки зрения обычных представлений о валентности азота, хлора и водорода.Существуют и другие сложные сложные соединения, для которых существует природа явления о валентности явно недостаточным. Альфред Вернер (1866—1919) в 1891 г. для случаев, когда к молекулам соедиений, в которых валентность элементов была полностью насыщена, присоединены другие молекулы, использование явления побочной валентности. Вслед за этим (1893 г.) Вернер разработал координационную теорию для объяснения этих соединений, которые в дальнейшем были названы комплексными соединениями.В настоящее время механизма образования химических связей в комплексныхх вскрыт на основе электронных представлений. Рассмотрим этот механизм на примере образования соединения аммиака с хлороводородом. [c.65]
Рассмотрим этот механизм на примере образования соединения аммиака с хлороводородом. [c.65]
Эквивалентная масса (Э) — это масса одного эквивалента элемента (г / моль). Эквивалентная масса равна частному от деления молярной массы его элементов (А) на валентность элемента (В) в данном соединении Э = А / В.Например, эквивалентная масса серы в SO2 и SO3 соответственно равна 32/4 = 8 г / моль и 32/6 = 5,33 г / моль. [c.5] Когда Менделеев составлял периодическую таблицу, он исходил из валентности элементов, поскольку известно о распределении в них электронов в то время ему еще ничего не было известно. Теперь вполне разумно было предположить, что валентность элемента представляет его электронную структурой. [c.158]
Химические свойства элементов и их соединений являются периодической функцией заряда ядра атома.С ростом заряда ядра, т.е. порядкового номера элемента, периодически меняются строение двух внешних электронных оболочек, радиусы, радиусы и заряды перво. Эти факторы определяют валентность элемента, его окислительно-восстановительную способность и кислотно-основную характеристику. Количество электронов на двух оболочках (предпоследний и наружный слой) приведено в табл. 4, радиусы элементов — в табл. 5. [c.12]
Эти факторы определяют валентность элемента, его окислительно-восстановительную способность и кислотно-основную характеристику. Количество электронов на двух оболочках (предпоследний и наружный слой) приведено в табл. 4, радиусы элементов — в табл. 5. [c.12]
Число атамов элемента валентность элемента [c.8]
Простейшим представлением в химической связи, по-видимому, является понятие валентности, называемой также емкостью насыщения. Валентность элемента в данном соединении определяет как отношение его истинного ато.много веса (массы) к соединительному весу в данном соединении [c.294]
Исходя из изложенных представлений, определим валентность элементов второго периодической системы. [c.82]
Позже, с развитием представлений о строении элементов, валентность элементов стали связывать с числом неспаренных электронов, благодаря которой осуществляется связь между атомами. [c.42]
Понятие валентности появилось в начале XIX в. после открытия закона кратных отношений. В это время валентность элементов установлена экспериментально по стехиометрическому составу соединений. В качестве стандарта были выбраны одновалентный водород (валентность по водороду) и двухвалентный кислород (валентность по кислороду). С открытием периодического закона была связь валентности с положением элемента в периодической системе. Высшая валентность элемента определяется номером группы периодической системы, в которой он находится.С помощью подобных представлений удалось систематизировать фактический материал в химии, предсказать состав и синтезировать неизвестные соединения. [c.78]
после открытия закона кратных отношений. В это время валентность элементов установлена экспериментально по стехиометрическому составу соединений. В качестве стандарта были выбраны одновалентный водород (валентность по водороду) и двухвалентный кислород (валентность по кислороду). С открытием периодического закона была связь валентности с положением элемента в периодической системе. Высшая валентность элемента определяется номером группы периодической системы, в которой он находится.С помощью подобных представлений удалось систематизировать фактический материал в химии, предсказать состав и синтезировать неизвестные соединения. [c.78]
Разместив естественным образом водород в системе, не трудно будет понять и объяснить его свойства. Спиральная модель учитывает и показывает зю его качество. Оно вытекает из особенностей электронной почты водорода. Единственный электрон, не ограниченный ни снизу, ни сверху другими слоями, может принимать разные состояния возбуждения, менять орбитали, а также знак валентности +1 или —1 и выступать от любого из семи валентных групп. Это хорошо иллюстрируется набором границ между валентными группами в первом периоде (центральный круг на модели). Так что водород может «дрейфовать по всей акватории для всех акваторий. И это не только его привилегией. Ведь и другие химические элементы не всегда следуют валентности, предписанной им системе. Например, Fe (УП1 группа) часто выступает в химической системе». Практически все химические элементы дрейфуют по всему валентному спектру, но знают свой постоянный причал-клетку, соединения как 1, 2 и 3-х валентный элемент. [c.172]
Это хорошо иллюстрируется набором границ между валентными группами в первом периоде (центральный круг на модели). Так что водород может «дрейфовать по всей акватории для всех акваторий. И это не только его привилегией. Ведь и другие химические элементы не всегда следуют валентности, предписанной им системе. Например, Fe (УП1 группа) часто выступает в химической системе». Практически все химические элементы дрейфуют по всему валентному спектру, но знают свой постоянный причал-клетку, соединения как 1, 2 и 3-х валентный элемент. [c.172]
Чтобы написать формулу, нужно знать валентность элементов, образующих соединение. Валентность может быть определена из соотношения [c.161]
Таким образом, валентность элемента в общем случае определяется как орбиталей, используемых при образовании химической связи. [c.62]
Валентность кислорода, как правила, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду так, в соединениях N2O, СО, ЗЮг, SO [c.35]
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду так, в соединениях N2O, СО, ЗЮг, SO [c.35]
Валентность, определяемая последнимением, называется стехиометрнческой валентностью элемента. Пользуясь этим использованием, нетрудно установить точное значение атомной массы элемента, если известны ее приближенное значение и точное значение эквивалентной массы. Для этого сначала находят стехиометрическую валентность элемента делением приближающегося значения мольиой массы элементов элемента на эквивалентную массу.Время стехнометрнческая валентность всегда выражается целым числом, то полученное частное округление до ближайшего целого числа. Умножая эквивалентную массу на валентность, получить точную мельную массу элемента, совпадающую с атомной массой элемента. [c.37]
Элементы, входящие в первую группу, образуют оксиды с общей формулой R20, во второй — КО, в третью — КгОз и т. д. Таким образом, наибольшая валентность элементов каждой группы по ккатороду соответствует, за немногими исключеииями, номеру группы. [c.51]
д. Таким образом, наибольшая валентность элементов каждой группы по ккатороду соответствует, за немногими исключеииями, номеру группы. [c.51]
Валентность элемента в химическом соединении может быть найдена на основе ху1Мической формулы, если известна валентность других элементов. [c.59]
Эта теория обтояснпла широко использует вещества. А. М. Бутлеров показал, что внутренняя структура познаваема, доступно для сознательного воспроизведения. Изучая химические превраптения, на основе теории А. М. Бутлерова можно узнать строение молекул — эта теория указала химические методы исследования строения вещества.Например, для молекулы этило-гюго спирта СдНбО с учетом валентности элементов можно предположить две структуры [c.53]
Валентность элементов на основании представлений Гейтлера и Лондона. Гейтлером и Лондоном было рассмотрено также взаимодействие двух атомов Не. В этой системе невозможно об-разваи химической связи, так как здесь имеются две пары электронов с одинаковыми спинами. [c.81]
[c.81]
Тогда становится возможным перекрывание электронных облаков неспареиных электронов, в результате которого создается зона повышенной электроиной плотности, вызывающая химическую связь.Очевидно, если в атоме имеются неспареиные электроны, то этот атом может образовать химические связи с другими атомами, имеющими по одному иеспареииомуому электрону. Поэтому, согласно представлениям Гейтлера и Лондона, валентность элемента представляет собой неспаренных электронов, которые имеются в его атоме. Таким образом, квантовомеханические расчеты Гейтона и Лондона дали теоретическое обоснование предположению о том, что химическая связь обусловлена парой электронов. [c.81]
Число электронов, которые могут быть использованы для образования связей с другими атомами, а следовятельио, и валентность элемента определения тем, что наружная электронная оболочка наиболее устойчивой, когда обладает структурой из восьми электронов (электронный октет), кроме первой оболочки (у водорода), для устойчивой структуры из двух электронов. Прн этом электронные, пары, связывающие данные два атома, следует считать принадлежащими обоим (как, так и другому) атомам, что схематически показано для молекулы фтора [c.63]
Прн этом электронные, пары, связывающие данные два атома, следует считать принадлежащими обоим (как, так и другому) атомам, что схематически показано для молекулы фтора [c.63]
Первый период включает всего два элемента, второй и третий периоды — по восемь, четвертый и пятый — по восемнадцать, шестой, седьмой — по тридцать два элемента. Первые три периода называются малыми, а четвертый и с.аедующие — большими. Большие периоды подразделяются на ряды, малые же периоды совпадают с соглашением.В каждой группе элементы больших периодов подразделяются на две подгруппы — главную и побочную. Элементы малых периодов — второго третьего — класса к главной подгруппе. Основанием для помендеиия элементов в ту или иную группу является максимально возможная валентность элемента — ее значению соответствует 1юмер группы псключенпе составляют кислород, фтор, неон и элементы побочной подгруппы VIH группы, валентность которых не соответствует шести, семи и восьми, а таклэлементы побочной подгруппы I группы, валентность достижения трех. Номер каждого периода совпадает с электронными уровнями в оболочках элементов, номер группы — с электронов па наружном уровне электронной оболочки, хотя это выполняется только для элементов главных подгрупп. [c.36]
Номер каждого периода совпадает с электронными уровнями в оболочках элементов, номер группы — с электронов па наружном уровне электронной оболочки, хотя это выполняется только для элементов главных подгрупп. [c.36]
Валентность химических элементов. Под валентностью, как известно, понимают способность атома данного элемента соединяться с другим элементом в определенных соотношениях.Валентность элемента определяли как способность его атома присоединять (или заменить) то или определение количества атомов. В связи с возникновением и развитием теории строения гность стали связывать с структурно-теоретическими представлениями, а именно с численностью электронов, пере-ходян их от одного атома к другому, или с численными химическими связями, Bi.l.зпикaк ) Lми.x мсж.ау атомами в процессе образования химического соединения. [c.44]
Атомы элементов главной подгруппы VUI группы периодической системы и нормальном состоянии не содержат непарных элек-тронов. Этим и объяснялась инертность этих элементов, т. е. неспособность их элементов к образованию химических соединений. Очевидно, что возбуждение элементов гелия и неона не может привести к появлению непарных электронов, соответственно, в первом и втором уровне их электронных оболочек. У других элементов группы — аргона, криптона, ксенона и радона — благодаря этой наличию на нарулэлектронных оболочек свободных -орбиталей возбуждение может привести к появлению непарных электронов, причем число их может достичь восьми.С [1м, естественно, соединяется система образования элементов химических соединений, в которой валентность может достигать восьми. В последние годы [c.46]
Этим и объяснялась инертность этих элементов, т. е. неспособность их элементов к образованию химических соединений. Очевидно, что возбуждение элементов гелия и неона не может привести к появлению непарных электронов, соответственно, в первом и втором уровне их электронных оболочек. У других элементов группы — аргона, криптона, ксенона и радона — благодаря этой наличию на нарулэлектронных оболочек свободных -орбиталей возбуждение может привести к появлению непарных электронов, причем число их может достичь восьми.С [1м, естественно, соединяется система образования элементов химических соединений, в которой валентность может достигать восьми. В последние годы [c.46]
Важной количественной характеристикой, показывающей число взаимодействующих между собой в образовавшейся молекуле, является валентность. Понятие о валентности элементов возникло в химии выше ста лет назад. Валентность — элементы одного элемента присоединение определенное число других элементов.Количественно валентность определяется жидким водородом, данный элемент может присоединять или заменить. Так, например, в плавиковой кислоте НГ фтор одновалентен, в аммиаке ЫНз азот трехвалентен, в кремневодороде 31Н4 кремний четырехвалентен и т. д. [c.42]
Так, например, в плавиковой кислоте НГ фтор одновалентен, в аммиаке ЫНз азот трехвалентен, в кремневодороде 31Н4 кремний четырехвалентен и т. д. [c.42]
Каковы основные [юложения тории валентных связей] Каким механизмам возможно образование ковалентных связей Как оценить валентность элементов в молекуле части налентные возможности элемента От че1о пространственная конфигурация молекулы В чем сущность модели гибридизации орбиталей центрального атома молекулы и модели локализованных электронных пар [c.63]
Стремление во всех случаях объяснить значение стехиометрической валентности элементов через число их валентных электронов приводит к структурам, которые неверно передают свойства образуемых ими соединений. В этом смысле очень неудачны графические формулы, состоящие из элементов валентных электронов. Так, исходя из грехвалентности алюминия и двухвалентности кислорода [c.80]
Какова валентность элементов в соединениях N0, СО, ВР, О2, Вг, Сз обоснование ответа приведите электронную конфигурацию (распределение электронов по орбиталям) этих молекул. Можно ли считать в этих соединениях кислородом двухвалентным, фтор одновалентным, бор и углерод-нульва-лентными [c.81]
Можно ли считать в этих соединениях кислородом двухвалентным, фтор одновалентным, бор и углерод-нульва-лентными [c.81]
Однако в большинстве случаев между величинами степени окисления и валентности элемента (число двухцентровых электронных связей) прямые связи нет. Например, на основании стехиометри-ческого состава считается, что в ВеС12 атом бериллия проявляет степень окисления — -2, а хлор -1. Но молекула ВеСЬ в обычных условиях полимерна и атом Ве имеет четыре, а атом С1 —две связи [c.84]
И9. Некоторый элемент, проявляющий двоякую г.а-лентность, образует два хлорида и два окисла. Процентное содержание хлорида в хлоридах имеет отношение 1 1,271, кислород — 1 1,501 при условии, что валентность элемента в хлоридах и окислах соответственно одинакова. Определите атомный вес и название элемента [c.17]
Заметим, что поглощением данным твердым соединением элементов тех или элементов, в числе входящих в его состав, связанного с образованием связей между поглощенными атомами и исходными атомами твердого вещества , с химической точки зрения следует рассматривать процесс образования новых твердых соединений, например, ряд твердых оксидов титана или металлокомплексов [ЫаС1], г, как этот процесс приводит, конечно, к образованию кристаллической структуры иного строения, чем исходная. В их структуре есть и атомы в междоузлиях и вакансии, но нет недостатка элементов. Это становится ясно, если у истинные валентности элементов. [c.168]
В их структуре есть и атомы в междоузлиях и вакансии, но нет недостатка элементов. Это становится ясно, если у истинные валентности элементов. [c.168]
Для элементов, проявляющих переменную валентность, влияние величины выражается в следующей закономерности в низшей валентности элемент проявляющего свойства, а в высшей — кислотными. Например, r дает типичное основание Сг ОН) г Сг (ОН) з обладает амфотерными свойствами, а Сг + образует кислоту Н2СГО4. [c.21]
Как узнать валентность химического элемента в таблице менделеева
Время на чтение: 12 минут
Общая характеристика
Валентность представляет способность создавать химические соединения, химические атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия
Определение в переводе выполняет силу, создание.Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которое соединяется с другими элементами, называется валентностью. В не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом использовании атомных частиц.
Соединения H с разными микрочастицами:
- Хлороводород (HCl).
- Вода (h3O).
- Аммиак (Nh4).
- Метан (Ch5).
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N) -с тремя, а углерода — с 4 атомными частями. В молекуле углекислого газа СО2 частица связана с двумя атомами кислорода.
А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
- HCl (I I).
- h3O (I II).

- HN3 (III I).
- Ч5 (IV I).
Один атом водорода соединяется только с одной частью другого элемента, соответственно, валентность принимает химический язык 1. Объясняя «химическим» языком, атомная часть молекулы обладает способностью валентности (В), он одновалентен.
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум.В структурной составляющей метана В. углерода равна 4. Условие в химии обозначает единицу валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частиц 19 века не позволяют объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.
Ученый Э. Франкленд ввел терминологию «связь» в научные труды для характеристик атомов между собой. Специалист гельнил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Специалист гельнил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Позже ученый выдвинул теорию о существовании химической связи и назвал ее «соединительной силой». Труды Франклина стали значимым вкладом в структурную химию.
Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является одним из четырех основных, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.
В Советском союзе информацию о строении систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначениями элементов черточкой выделяется связь, а число линий соответствует В.
Между обозначениями элементов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и постоянной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность. Многие элементы имеют устойчивую устойчивость.
Валентность Постоянная Переменная Элемент В Элемент В H (Водород) I I (Йод) I Li (Литий) S (Сера) II, IV, VI Na (Натрий) N (Азот) I-V К (Калий) F II, III Ф (Фтор) Cu I, II Алюминий, Б, Р III, В C, Si II, IV O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) II Cl, Br, I I, III, V, VII
Водород образует связь не с каждым устройством, снабженным системой связи у всех. В таких сочетаниях атомы О2 проявляют двукратную валентность.
В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.
Валентность азота N в связи Nh4 составляет III, поскольку один атом Н связан с тремя частями N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не имеющейся.Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана следующим образом: Ch5.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или других элементов модифицируется, когда они формируют различные соединения.
Йод представлен в таблице 53 по счету. Присутствие неспаренного электрона обладает способностью проявлять низшую В., равную единицу в соединениях. Зная валентность, можно легко составить формулы соединений.
Присутствие неспаренного электрона обладает способностью проявлять низшую В., равную единицу в соединениях. Зная валентность, можно легко составить формулы соединений.
Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для создания выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число элементов газа в сочетании 2 * 7, получается 14.Это число делится на количество мелких атомных частиц Mn: 14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящего в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другое. В веществе, состоящем из числа молекул В. обоих элементов равно. Используется минимальное общее краткое для определения неизвестной В.
Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Минимальным общим кратным будет 6.
Логическая формулировка записи оксида фосфораывается В кислород (II) и учит фосфора (V). Наименьшее общее кратное для Р и О получается десять. Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН) 2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность.Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
- Записывают символы элементов и валентность. Это VII II ClO.
- Найти меньшее кратное валентностей двух элементов. VII * II, получается 14.
- Делят наименьшее кратное на В. каждого элемента, находят значение индексов. 14/2 = 7, 14/7 = 2.
 9 1075
9 1075
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
Атомы устанавливают положительную основу (ядро), вокруг которой установлены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а стабильная структура включает восемь электронов.
Создание связи за счет общего пар электронов приводит к благоприятному состоянию элементов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
- Высшая. Соответствует порядковому № группы.

- Низшая. От числа вида по табличным данным отнимают номер интересного элемента.
- Основание для образования соединений является приемником электронов.
- Виды электронов:
- Спаренные. Расположены на одной орбитали.
- Неспаренные. Это 1 электрон на орбитали.
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
Последнее вещество в молекулярной структуре водорода и серы h3S приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар.Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице. Закономерность проявляется у всех, кроме нескольких, потому что они не включают перед собой элементы, аналогичные по атомному объему.
Закономерность проявляется у всех, кроме нескольких, потому что они не включают перед собой элементы, аналогичные по атомному объему.
Валентность металлов:
Элемент В Серебро I-III Ртуть I-II Золото I-III Никель I- IV Мышьяк -III, II, III, V Свинец II-IV Кобальт II-IV Олово II, IV
В периодической таблице элементов классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств.Ряды называются периодами, а столбцы — группой. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику найти на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным.Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которым он формирует химическое соединение, В. и стадия совпадения (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученых-химики не использовать по Менделеевской таблице.
Источник: https://nauka.club/khimiya/valentnost-khimicheskikh-elementov.html
Урок 6. Валентность — HIMI4KA
Архив уроков ›Химия 8 класс
В уроке 6 « Валентность » из курса « Химия для чайников » дадим определение валентности, научимся ее определять; рассмотрим элементы постоянной и стандартной валентности, кроме того, составляем химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также определение химических формул веществ молекулярного и немолекулярного строения.
Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также определение химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атомом кислорода — с двумя атомами азота — с тремя, а атомами углерода — с четырьмя атомами водорода.
В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами.
Такая способность элементов выражается с помощью численной характеристики, называемой валентностью .
Валентность — численная характеристика качества элементов элемента соединяться с другими атомами.
1 атома водорода может соединиться только с одним атомом другого элемента.Иначе говорят, что атом водорода одной единицы валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента представляет собой соединившихся с ним водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле h3O у атома кислорода валентность равна двум.
По той же причине в молекуле Nh4 валентность атома азота равна трем, а в молекуле Ch5 валентность атома углерода равна четырем.
Если условно обозначить единицу валентности черточкой | , вышесказанное можно изобразить схематически:
- Следовательно, валентность атома элемента любого есть число, которое показывает, со сколькими атомами одновалентного элемента этот атом в химическом соединении.
- Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Водород образует соединительные элементы, соединяющие не со всеми элементами. И во всех таких соединенийх атомы кислорода проявляют валентность, равную две. Зная это, можно определить валентные элементы других элементов в их бинарных соединениях с кислородом. (Бинарными называемыми соединения, состоящие из элементов двух химических элементов.)
И во всех таких соединенийх атомы кислорода проявляют валентность, равную две. Зная это, можно определить валентные элементы других элементов в их бинарных соединениях с кислородом. (Бинарными называемыми соединения, состоящие из элементов двух химических элементов.)
, необходимо соблюдать простое правило: в химической формуле вещества числа валентности каждого элемента должны быть одинаковыми .
Так, в молекуле воды h3O общее число валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число валентности атома кислорода:
По величине валентности элементов одного элемента можно определить валентность элементов другого элемента.Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х · 1 = II · 2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х · 1 = II · 1, откуда х = II:
Постоянная и переменная валентность
Как видим, происходит соединение с разным числом атомов кислорода, т. е. имеет переменную валентность. У всех элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. Таблицу).
е. имеет переменную валентность. У всех элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. Таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составить формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример.Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV · III).
- Определение индексов каждого элемента:
- Записываем формулу соединения: Si3N4.
- В дальнейшем при составлении формул веществ указывать цифрами значения валентностей, а несложные можно выполнять в уме.
- Краткие выводы урока:
- Численной характеристикой способности данного элемента соединяться с другими атомами валентность.

- Валентность постоянного постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 « Валентность » был понятным и познавательным.Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-6-valentnost.html
Валентность химических элементов (Таблица)
Валентность химических элементов — это способность у элементов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равно 0. Определяется число электронов атома затраченых на образование хим. связей с другими атомом. Валентность это реальная величина.Обозначается римскими цифрами (I, II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
Отсюда в соединении h3O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- — Высшая валентность всегда равна № группы.
- — Низшая валентность равна разности между числом 8 (групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- — У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- — У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и стандартной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
Атомный № Химический элемент Символ Валентность химических элементов Примеры соединений 1 Водород / Водород ЧАС я HF 2 Гелий / Гелий Он отсутствует — 3 Литий / Литий Ли я Li2O 4 Бериллий / Бериллий Быть II Beh3 5 Бор / Бор B III BCl3 6 Углерод / Карбон C IV, II CO2, Ch5 7 Азот / Азот N III, IV Кh4 8 Кислород / Кислород О II h3O, BaO 9 Фтор / Фтор F я HF 10 Неон / Neon Ne отсутствует — 11 Натрий / Натрий Na я Na2O 12 Магний / Магний Mg II MgCl2 13 Алюминий / Алюминий Al III Al2O3 14 Кремний / Кремний Si IV SiO2, SiCl4 15 Фосфор / Phosphorus п III, V Ph4, P2O5 16 Сера / Сера S VI, IV, II h3S, SO3 17 Хлор / Хлор Cl I, III, V, VII HCl, ClF3 18 Аргон / Аргон Ar отсутствует — 19 Калий / Калий K я KBr 20 Кальций / Кальций Ca II Cah3 21 год Скандий / Скандий Sc III Sc2S3 22 Титан / Титан Ti II, III, IV Ti2O3, Tih5 23 Ванадий / Ванадий V II, III, IV, V VF5, V2O3 24 Хром / Chromium Cr II, III, VI CrCl2, CrO3 25 Марганец / Марганец Mn II, III, IV, VI, VII Mn2O7, Mn2 (SO4) 3 26 Железо / Железо Fe II, III FeSO4, FeBr3 27 Кобальт / Кобальт Co II, III CoI2, Co2S3 28 Никель / Никель Ni II, III, IV NiS, Ni (CO) 4 29 Медь / Медь Сu I, II CuS, Cu2O 30 Цинк / Цинк Zn II ZnCl2 31 год Галлий / Галлий Ga III Ga (OH) 3 32 Германий / Германий Ge II, IV GeBr4, Ge (OH) 2 33 Мышьяк / Мышьяк Так как III, V As2S5, h4AsO4 34 Селен / Селен Se II, IV, VI, h3SeO3 35 год Бром / Бром Br I, III, V, VII HBrO3 36 Криптон / Krypton Kr VI, IV, II KrF2, BaKrO4 37 Рубидий / Рубидий Руб.
я RbH 38 Стронций Стронций Sr II SrSO4 39 Иттрий / Иттрий Y III Y2O3 40 Цирконий / Цирконий Zr II, III, IV ZrI4, ZrCl2 41 год Ниобий / Ниобий Nb I, II, III, IV, V NbBr5 42 Молибден / молибден Пн II, III, IV, V, VI Mo2O5, MoF6 43 год Технеций / Технеций Tc I — VII Tc2S7 44 Рутений / Рутений RU II — VIII RuO4, RuF5, RuBr3 45 Родий / Родий Rh I, II, III, IV, V RhS, RhF3 46 Палладий / Палладий Pd I, II, III, IV Pd2S, PdS2 47 Серебро / Серебро Ag I, II, III AgO, AgF2, AgNO3 48 Кадмий / Кадмий Компакт диск II CdCl2 49 Индий / Индий В III In2O3 50 Олово / Олово Sn II, IV SnBr4, SnF2 51 Сурьма / Сурьма Sb III, IV, V СбФ5, Сбх4 52 Теллур / Теллур Te VI, IV, II Тех3, H6TeO6 53 Иод / Йод я I, III, V, VII HIO3, HI 54 Ксенон / Ксенон Xe II, IV, VI, VIII XeF6, XeO4, XeF2 55 Цезий / Цезий CS я CsCl 56 Барий / Барий Ба II Ва (ОН) 2 57 Лантан / Лантан Ла III Lah4 58 Церий / Церий Ce III, IV CeO2, CeF3 59 Празеодим / Празеодим Pr III, IV PrF4, PrO2 60 Неодим / Неодим Nd III Nd2O3 61 Прометий / Прометий Вечера III Pm2O3 62 Самарий / Самарий См II, III SmO 63 Европий / Европий ЕС II, III EuSO4 64 Гадолиний / Гадолиний Б-г III GdCl3 65 Тербий / Тербий Tb III, IV TbF4, TbCl3 66 Диспрозий / Диспрозий Dy III Dy2O3 67 Гольмий / Гольмий Хо III Ho2O3 68 Эрбий / Эрбий Э III Er2O3 69 Тулий / Тулий Тм II, III Tm2O3 70 Иттербий / Ytterbium Yb II, III ЭЙ 71 Лютеций / Лютеций Лу III LuF3 72 Гафний / Гафний Hf II, III, IV HfBr3, HfCl4 73 Тантал / Тантал Та I — V TaCl5, TaBr2, TaCl4 74 Вольфрам / Вольфрам W II — VI WBr6, Na2WO4 75 Рений / Рений Re I — VII Re2S7, Re2O5 76 Осмий / Осмий Операционные системы II — VI, VIII OsF8, OsI2, Os2O3 77 Иридий / Иридий Ir I — VI IrS3, IrF4 78 Платина / Платина Pt I, II, III, IV, V Pt (SO4) 3, PtBr4 79 Золото / Золото Au I, II, III AuH, Au2O3, Au2Cl6 80 Ртуть / Меркурий Hg II HgF2, HgBr2 81 год Талий / Таллий Tl I, III TlCl3, TlF 82 Свинец / Свинец Pb II, IV ПбС, Пбх5 83 Висмут / Висмут Би III, V BiF5, Bi2S3 84 Полоний / Полоний По VI, IV, II PoCl4, PoO3 85 Астат / Астатин В нет данных – 86 Радон / Радон Rn отсутствует – 87 Франций / Франций Пт я – 88 Радий / Radium Ра II RaBr2 89 Актиний / Актиний Ac III AcCl3 90 Торий / Торий Чт II, III, IV ThO2, ThF4 91 Проактиний / Протактиний Па IV, V PaCl5, PaF4 92 Уран / Уран U III, IV UF4, UO3 93 Нептуний Np III — VI NpF6, NpCl4 94 Плутоний Пу II, III, IV PuO2, PuF3, PuF4 95 Америций Am III — VI AmF3, AmO2 96 Кюрий См III, IV CmO2, Cm2O3 97 Берклий Bk III, IV BkF3, BkO2 98 Калифорний Cf II, III, IV Cf2O3 99 Эйнштейний Es II, III EsF3 100 Фермий FM II, III — 101 Менделевий Мкр II, III — 102 Нобелий Нет II, III — 103 Лоуренсий Lr III — Номер Элемент Символ Валентность химических элементов Пример
Источник: https: // infotables. ru / химия / 1071-валентность-химических-элементов
ru / химия / 1071-валентность-химических-элементов
Ответы@Mail.Ru: Как определить валентность по таблице Менделеева?
есть высшая валентность это номер группы…. и низшая — это 8 — номер группы… но что касаетсятаких элементов как железо … они проявляют разную степень окисления и в таблице менделеева ты это не найдешь … это есть в справочниках по химии
Максимальная валентность по кислороду представляет собой электронов на внешнем слое. В общем случае номеру группы.У Р с утра ещё была V группа, за это время что-то изменилось? Валентность по водороду представляет собой электронов, который может принять на внешний слой. Равна 8- №группы.
У элементов с переменной валентностью всё сложнее. И Fe c утра был в VIII! Железо отдаёт 2 электрона с внешнего слоя, валентность 2, ст. окисления +2, ещё один «лишний» электрон с предвнешнего d слоя — валентность 3. Придётся запоминать! Только не говорите, что таблица Д.
Менделеева уже «перекроена», тогда мне придётся всё заново учить!
Валентность — число элементов одного химического элемента присоединять определенное число другого химического элемента.
Есть элементы, которые имеют постоянную валентность:
одновалентны (I) — H, Li, Na, K, Rb, Cs, F, I
двухвалентны (II) — O, Be, Mg, Ca, Sr, Ba, Zn, Cd
трехвалентны (III) — B, Al Есть еще один способ: определить валентность можно по таблице Д. И. Менделеева.
Все элементы в таблице разделены на подгруппы а) и б).
Активные металлы занимают только три первые группы. Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе валентность II.Есть металлы с модельной валентностью, тогда ее указать в скобках, например, оксид железа (III).
Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках): низшую — вычисляют по формуле (8-Ь группы), в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Есть в-ва, валентность которых определяется по группе, а есть те в-ва (например, металлы), у которых валентность с ней не совпадает. Нужно из 8 (максимальной группы) отнять номер группы в-ва, валентность у которого хотите найти
Нужно из 8 (максимальной группы) отнять номер группы в-ва, валентность у которого хотите найти
Все элементы в таблице разделены на подгруппы а) и б). Активные металлы занимают только три первые группы.
Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II.
Есть металлы с модельной валентностью, тогда ее указать в скобках, например, оксид железа (III). Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках): низшую — вычисляют по формуле (8-Ь группы), в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Алгоритмы составления формул по валентности и определение валентности по формуле я послания как прикрепленный файл. Распечатай его и пользуйся пока не научишься.
Источник: https: //touch. otvet.mail.ru/question/28569283
otvet.mail.ru/question/28569283
Как определить валентность?
Согласно школьному определению валентность — это способность химического элемента образовывать или количество химических связей с другими атомами.
Как известно, валентность бывает постоянной (когда химический элемент образует всегда одно и то же связи с другими атомами) и количество (когда в зависимости от того или иного вещества изменяется валентность одного и того же элемента).
Определить валентность нам поможет периодическая система химических элементов Д. И. Менделеева.
Действуют такие правила:
1) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у нее максимальная валентность равна 6.
2) Минимальная валентность для неметаллов равна 8 минус номер группы. Например, минимальная валентность того же хлора равна 8 — 7, то есть 1.
Например, минимальная валентность того же хлора равна 8 — 7, то есть 1.
- Увы, из обоих правил имеются сведения.
- Например, медь находится в 1-й группе, однако максимальная валентность соответствует не 1, а 2.
- Кислород находится в 6-й группе, но у него валентность почти всегда 2, а вовсе не 6.
- Полезно ещё помнить следующие правила:
3) Все щелочные металлы (металлы I группы, главной подгруппы) всегда имеют валентность 1 .Например, валентность натрия всегда равна 1, потому что это щелочной металл.
4) Все щёлочно-земельные металлы (металлы II группы, главная подгруппы) всегда имеют валентность 2 . Например, валентность магния всегда равна 2, потому что это щёлочно-земельный металл.
- 5) Алюминий всегда имеет валентность 3.
- 6) Водород всегда имеет валентность 1.
- 7) Кислород практически всегда имеет валентность 2.

- 8) Углерод практически всегда имеет валентность 4.
- Следует помнить, что в разных источниках определения валентности могут отличаться.
- Более или менее точно валентность можно определить как количество общих электронных пар, посредством данного атома связан с другими .
Согласно такому определению валентность азота в HNO3 равна 4, а не 5. Пятивалентным азотом быть не может, потому что в таком случае вокруг атома азота кружилось бы 10 электронов. А такого не может быть, потому что максимум электронов составляет 8.
Источник: http://www.bolshoyvopros.ru/questions/505034-kak-opredelit-valentnost.html
Как определить валентность по периодической таблице Менделеева: что это такое, изучение свойств химических элементов
Атомы химические элементы могут образовывать различное число связей. Эта способность имеет специальное название — валентность.
Давайте разберемся, как определить валентность по таблице Менделеева, узнаем, чем заключается ее отличие от степени окисления, увидим закономерности, характерные для водорода, углерода, фосфора, цинка, научимся находить валентность химических элементов.
Основные сведения
Валентность — это возможность связи между собой химических элементов образовывать. Другими словами можно сказать, что это способность атома присоединить к себе определенное количество других элементов.
Важно! Это не всегда постоянное число для одного и того же элемента. В разных соединениях элемент может обладать различными значениями.
Определение по таблице Д.И. Менделеева
Для определения этой способности атома в таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы .
Это вертикальные столбцы, которые делят все элементы по определенному признаку. В зависимости от признака выделяют подразделения элементов.
Этими столбцами элементы делятся на тяжелые и легкие элементы, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, для определения способности образовывать связи, руководствуясь двумя правилами:
- Высшая валентность элемента равна номеру его группы.

- Низкая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Например, фосфор проявет высшую валентность V — P2O5 и низшую (8-5) = 3– PF3.
Стоит также отметить несколько основных характеристик и особенности при определении этого показателя:
- Валентность водорода всегда I — h3O, HNO3, h4PO4.
- Валентность кислорода всегда равна II — CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы — Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две валентности — высшая и низшая.
Также существуют элементы, у которых может быть 3 или 4 разных значения этого показателя. К ним защитный хлор, бор, йод, хром, сера и другие. Например, хлор обладает валентностью I, III, V, VII — HCl, ClF3, ClF5, HClO4 соответственно.
Определение по формуле
Для определения по формуле можно использовать границы:
- Если известна валентность (V) одного из элементов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что валентность кислорода всегда равна II, тогда можно использовать такие правила: произведение числа элементов на его V одного элемента должно равняться произведению числа элементов другого элемента на его V.
 Таким образом, валентность углерода можно найти так — 2 × 2 (в молекуле 2 атома кислорода с V = 2), то есть валентность углерода равняется 4 . Рассмотрим еще несколько примеров: P2O5 — тут валентность фосфора = (5 * 2) / 2 = 5. HCl — валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V = 1.
Таким образом, валентность углерода можно найти так — 2 × 2 (в молекуле 2 атома кислорода с V = 2), то есть валентность углерода равняется 4 . Рассмотрим еще несколько примеров: P2O5 — тут валентность фосфора = (5 * 2) / 2 = 5. HCl — валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V = 1. - . .К ней и присоединится натрий. Можно сделать вывод, что натрий — одновалентный элемент.
Разница между степенью окисления и валентностью
Очень важно понимать разницу между этими понятиями. Степень окисления — это условный электрический заряд , которым обладает ядро атома, в то время как валентность — это количество связей, которые могут установить ядро элемента.
Рассмотрим подробнее, что такое степень окисления. Согласно современной теории о строении атома, ядро элемента состоит из положительно заряженных протонов и нейтронов без заряда, а вокруг него находятся электроны с отрицательным зарядом, которые уравновешивают заряд ядра и делают элемент электрически нейтральным.
В случае, если атом устанавливает связь с другим, он отдает или принимает электроны , то есть выходит из состояния баланса и начинает обладать электрическим зарядом. При этом если атом отдает электрон, он становится положительно заряженным, а если принимает — отрицательно заряженным электроном.
Внимание! В соединении хлора и один электрон HCl водород отдает электрон и приобретает заряд +1, а хлор принимает и становится отрицательным -1. В сложных соединениях, HNO3 и h3SO4, степени окисления будут такими — H + 1N + 5O3 -2 и h3 + 1S + 6O4 -2.
Сравнивая два определения, можно сделать вывод, что валентность и степень окисления часто совпадают: валентность водорода +1 и валентность I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда !
В органическом соединении углерода степень окисления +1, но он обладает V, равной 4. В перекиси водорода h3O2 у углерода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в нескольких случаях это может привести к ошибке.
Поэтому не следует отождествлять два этих понятия, так как в нескольких случаях это может привести к ошибке.
Валентности распространенных элементов
Водород
Один из самых распространенных элементов во вселенной, встречается во многих соединениях и всегда обладает V = 1 . Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
На первом уровне может находиться не более двух электронов одновременно, таким образом, водород может либо отдать свой электрон и образовать связь (электронная оболочка останется пустой), либо 1 электронная оболочка останется пустой), либо 1, также образовав новую связь (электронная оболочка полностью заполнится).
Пример: h3O — 2 атома водорода с V = 1 связаны с двухвалентным кислородом; HCl — одновалентные хлор и водород; HCN — синильная кислота, где водород также проявляет V, равную 1.
Углерод
Углерод может обладать либо валентностью II, либо IV. Связано это со строением внешнего электронного электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V II.
Связано это со строением внешнего электронного электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V II.
То есть 2 электрона установили 2 новые связи, например, соединение CO — угарный газ, где и кислород, и водород двухвалентные.
Однако бывают ситуации, когда один электрон с первого уровня переходит на второй, тогда у углерода образует 4 свободных электрона , которые могут образовывать связи: СО2, НСООН, Н2СО3.
Фосфор
Данный элемент может обладать валентностью III и V.
Как и в предыдущих случаях, он может образовать переход 1 электрона с s-орбитали на d-орбиталь, на котором у него есть 3 электрона. тогда неспаренных электронов станет 5, а значит, и валентность тоже будет равна V.Например: РН3, Р2О5, Н3РО4.
Цинк
Как элемент главной подгруппы и металл, цинк может обладать только валентностью, которая соответствует номеру его группы , то есть 2. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Определение валентности химических элементов
Изучение валентности по периодической таблице Менделеева
Вывод
Теперь вы знаете, что такое валентность, чем она легко отличается от степени окисления, и определите валентность элементов по формулам или таблице Менделеева.
Это интересно! Основной закон Гесса и следствия из него
Источник: https://uchim.guru/himiya/kak-opredelit-valentnost-po-tablitse-mendeleeva.html
Таблица валентных химических элементов
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
Таблица валентностей химических элементов. Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы. Действительно, теоретически, это самая распространенная валентность для химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому предлагаем Вашему вниманию таблицу валентностей химических элементов.Числовое значение положительной валентности элемента, состоящее из отданных атомом электронов, отрицательной валентности, которое должно быть добавлено для внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют.
Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому предлагаем Вашему вниманию таблицу валентностей химических элементов.Числовое значение положительной валентности элемента, состоящее из отданных атомом электронов, отрицательной валентности, которое должно быть добавлено для внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют. Таблица валентных химических элементов.- Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра,
- он же: атомное число
Русское / Английское наименование Химический символ Валентность 1 Водород / Водород H (-1), +1 2 Гелий / Гелий He 3 Литий / Литий Ли +1 4 Бериллий / Бериллий Be +2 5 Бор / Бор Б -3, +3 6 Углерод / Карбон К (+2), +4 7 Азот / Азот N -3, -2, -1, (+1), +2, +3, +4, +5 8 Кислород / Кислород О -2 9 Фтор / Фтор Ф -1, (+1) 10 Неон / Neon Ne 11 Натрий / Натрий Na +1 12 Магний / Магний мг +2 13 Алюминий / Алюминий Al +3 14 Кремний / Кремний Si -4, (+2), +4 15 Фосфор / Phosphorus пол.
-3, +1, +3, +5 16 Сера / Сера ю -2, +2, +4, +6 17 Хлор / Хлор Класс -1, +1, (+2), +3, (+4), +5, +7 18 Аргон / Аргон Ар 19 Калий / Калий К +1 20 Кальций / Кальций Ca +2 21 Скандий / Скандий СК +3 22 Титан / Титан Ti +2, +3, +4 23 Ванадий / Ванадий В +2, +3, +4, +5 24 Хром / Хром Кр +2, +3, +6 25 Марганец / Марганец млн +2, (+3), +4, (+6), +7 26 Железо / Утюг Fe +2, +3, (+4), (+6) 27 Кобальт / Cobalt Co +2, +3, (+4) 28 Никель / Никель Ni (+1), +2, (+3), (+4) 29 Медь / Медь Сu +1, +2, (+3) 30 Цинк / Цинк Zn +2 31 Галлий / Галлий Ga (+2). +3
+3 32 Германий / Германий Ge -4, +2, +4 33 Мышьяк / Мышьяк Как -3, (+2), +3, +5 34 Селен / Selenium SE -2, (+2), +4, +6 35 Бром / Бром Руб -1, +1, (+3), (+4), +5 36 Криптон / Krypton Кр 37 Рубидий / Рубидий руб. +1 38 Стронций / Стронций Sr +2 39 Иттрий / Yttrium Я +3 40 Цирконий / Цирконий злотый (+2), (+3), +4 41 Ниобий / Ниобий Nb (+2), +3, (+4), +5 42 Молибден / молибден Пн (+2), +3, (+4), (+5), +6 43 Технеций / Технеций Тс +6 44 Рутений / Рутений Ру (+2), +3, +4, (+6), (+7), +8 45 Родий / Rhodium Rh (+2), (+3), +4, (+6) 46 Палладий / Палладий Pd +2, +4, (+6) 47 Серебро / Серебро Ag +1, (+2), (+3) 48 Кадмий / Кадмий Кд (+1), +2 49 Индий / Индий В (+1), (+2), +3 50 Олово / Олово Sn +2, +4 51 Сурьма / Сурьма Сб -3, +3, (+4), +5 52 Теллур / Теллур Te -2, (+2), +4, +6 53 Иод / Йод I -1, +1, (+3), (+4), +5, +7 54 Ксенон / Xenon Xe 55 Цезий / Цезий CS +1 56 Барий / Барий Ba +2 57 Лантан / Lanthanum La +3 58 Церий / Церий CE +3, +4 59 Празеодим / Празеодим Пр +3 60 Неодим / Неодим Nd +3, +4 61 Прометий / Прометий мкм +3 62 Самарий / Samarium см (+2), +3 63 Европий / Европий ЕС (+2), +3 64 Гадолиний / Гадолиний Gd +3 65 Тербий / Тербий Тб +3, +4 66 Диспрозий / Диспрозий Dy +3 67 Гольмий / Гольмий Ho +3 68 Эрбий / Эрбий Er +3 69 Тулий / Тулий тм (+2), +3 70 Иттербий / Ytterbium Yb (+2), +3 71 Лютеций / Lutetium Лю +3 72 Гафний / Гафний Hf +4 73 Тантал / Тантал Ta (+3), (+4), +5 74 Вольфрам / Вольфрам Вт (+2), (+3), (+4), (+5), +6 75 Рений / Рений Re (-1), (+1), +2, (+3), +4, (+5), +6, +7 76 Осмий / Осмий Ос (+2), +3, +4, +6, +8 77 Иридий / Иридий Ir (+1), (+2), +3, +4, +6 78 Платина / Платина Пт (+1), +2, (+3), +4, +6 79 Золото / Золото Au +1, (+2), +3 80 Ртуть / Mercury Hg +1, +2 81 Талий / Таллий Тл +1, (+2), +3 82 Свинец / Свинец Пб +2, +4 83 Висмут / Висмут Би (-3), (+2), +3, (+4), (+5) 84 Полоний / Полоний Po (-2), +2, +4, (+6) 85 Астат / Astatine по адресу нет данных 86 Радон / Радон Rn 87 Франций / Франций Fr нет данных 88 Радий / Radium Ra +2 89 Актиний / Актиний Ac +3 90 Торий / Thorium Чт +4 91 Проактиний / Протактиний Па +5 92 Уран / Уран U (+2), +3, +4, (+5), +6
Дополнительная информация:- А чем отличается Физика от Химии? Характерные диапазоны времени, расстояний и энергии для физики и химии.

- «Химический алфавит (словарь)» — названия, сокращения, приставки, обозначения соединений и соединений.
- Стандартная, она же научная форма записи числа. Порядок величины. Разница на порядок. Зачем это придумали.
- Нормальные условия (НУ). Что это такое?
- Таблица Менделеева. Названия. Электронные формулы. Структурные формулы.
- Вода (h3O) — свойства воды, пара и льда
- Водные растворы и смеси для обработки металлов.
- Характерные химические реакции на органические соединения.Как определить наличие соединений?
- Характерные химические реакции на катионы (положительно заряженные ионы). Как определить наличие катионов?
- Характерные химические реакции на анионы (отрицательно заряженные ионы). Как определить наличие анионов?
- Водородный показатель pH. Таблицы показателей pH.
- Свойства растворов. Константы диссоциации, кислотности, основности. Растворимость. Смеси.
- Свойства растворителей.

 ru/khimiya/1071-valentnost-khimicheskikh-elementov
ru/khimiya/1071-valentnost-khimicheskikh-elementov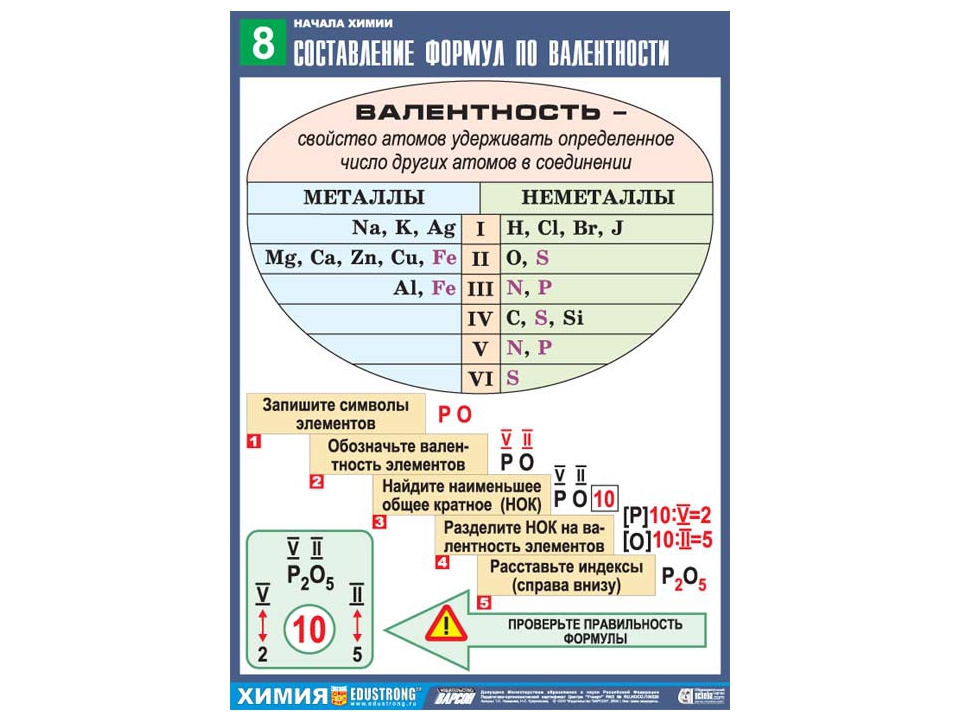
одновалентны (I) — H,Li, Na, K, Rb, Cs, F, I
двухвалентны (II) — O, Be, Mg, Ca, Sr, Ba, Zn, Cd
трехвалентны (III) — B, Al Есть еще один способ: определять валентность можно по таблице Д. И. Менделеева.
Все элементы в таблице разделены на подгруппы а) и б) .
Металлы, которые стоят во второй а) группе имеют валентность II. Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III).
Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую — вычисляют по формуле (8-Ь группы) , в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Есть в-ва, валентность которых определяется по группе, а есть те в-ва ( например металлы ) , у которых валентность с ней не совпадает. Нужно из 8 ( максимальной группы ) отнять номер группы в-ва, валентность у которого хотите найти
Нужно из 8 ( максимальной группы ) отнять номер группы в-ва, валентность у которого хотите найти
Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II.
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
 otvet.mail.ru/question/28569283
otvet.mail.ru/question/285692831) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у неё максимальная валентность равна 6.
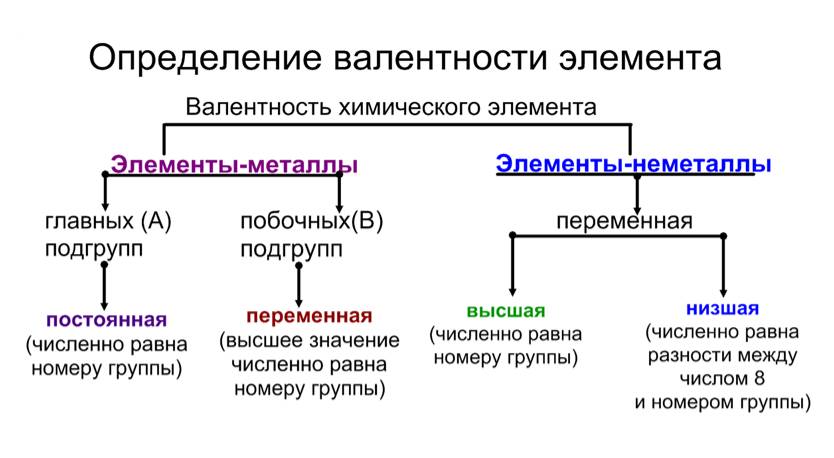 Например, минимальная валентность того же хлора равна 8 – 7, то есть 1.
Например, минимальная валентность того же хлора равна 8 – 7, то есть 1.


 Таким образом, валентность углерода можно найти так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть валентность углерода равняется 4. Рассмотрим еще несколько примеров: P2O5 – тут валентность фосфора = (5*2)/2 = 5. HCl – валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
Таким образом, валентность углерода можно найти так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть валентность углерода равняется 4. Рассмотрим еще несколько примеров: P2O5 – тут валентность фосфора = (5*2)/2 = 5. HCl – валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
Сравнивая два этих определения, можно сделать вывод, что валентность и степень окисления часто совпадают: валентность водорода +1 и валентность I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда!
 В перекиси водорода h3O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке.
В перекиси водорода h3O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке.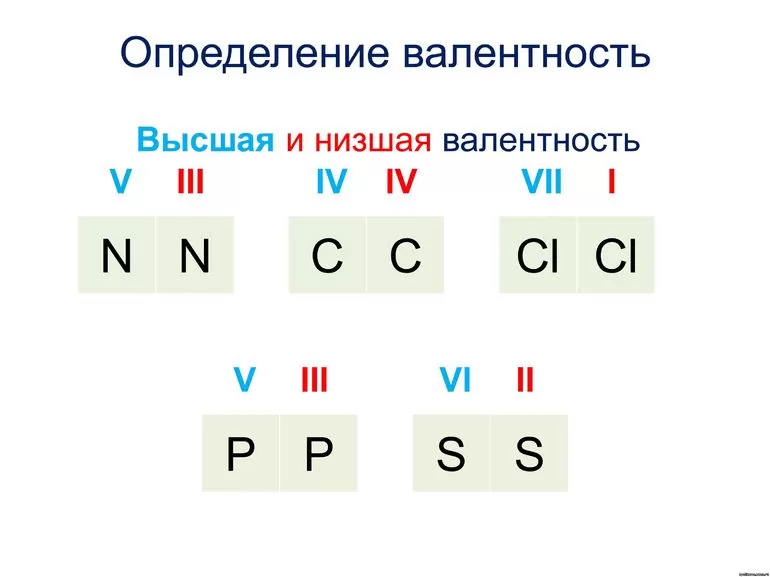 Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II.
Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4. Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют.
Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют. Таблица валентностей химических элементов.
| Дополнительная информация:
|
щелочные металлы (Li, Na, K, Rb , Cs, Fr) I
металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) II
алюминий (Al) III
кислород (О) II
фтор (F) I










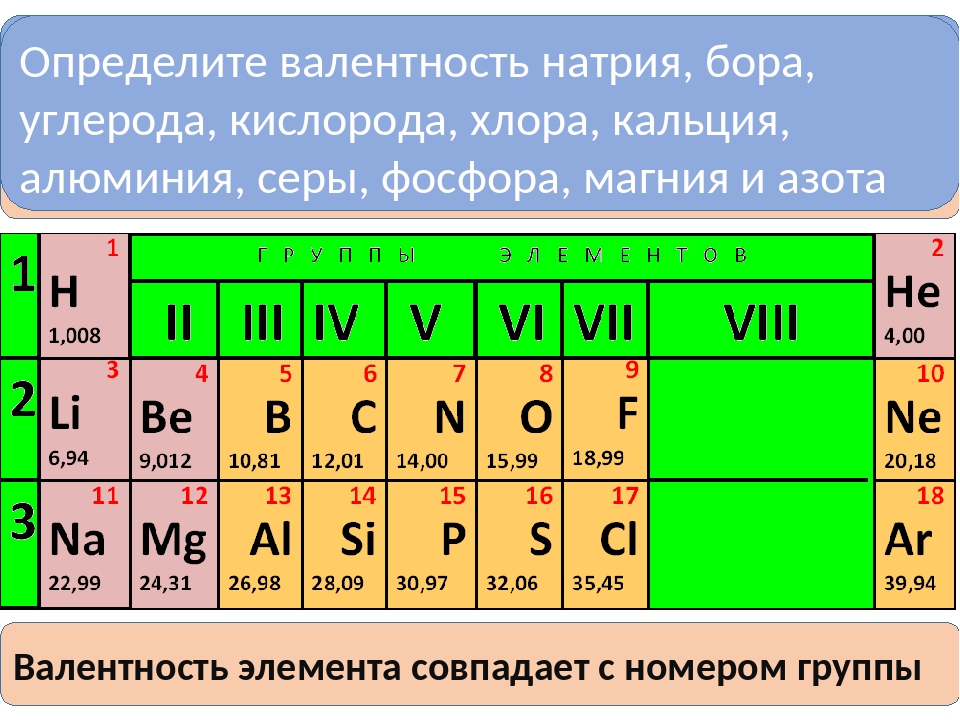 Запомните формальное правило: в виде числа атомов первого элемента молекуле на его валентность должно быть аналогично произведению для второго элемента .
Запомните формальное правило: в виде числа атомов первого элемента молекуле на его валентность должно быть аналогично произведению для второго элемента . Очевидно, что Х = 5. Ответ: Cl (V), O (II).
Очевидно, что Х = 5. Ответ: Cl (V), O (II). Ответ: CaH 2 .
Ответ: CaH 2 . Составьте формулу соединения серы с фтором, если известно, что валентность серы шести шести.
Составьте формулу соединения серы с фтором, если известно, что валентность серы шести шести.
Структурная формула вещества отображает соединения элементов между собой, согласно их валентности, т.е. химическое строение.
Na — одновалентен (одна связь)
H — одновалентен (одна связь)
O — двухвалентен (две связи у каждого атома)
S — шестивалентна (образует шесть связей с соседними атомами)
 Валентность водорода принимать
за И (единицу).
Валентность водорода принимать
за И (единицу).Металлы главных (А) подгрупп
I (А), II (А), III (А)
Характерна
высшая постоянная валентность.
В = N группы
Металл в формуле всегда занимает первую позиция
Металлы побочных (Б) подгрупп
I (Б) -VIII (Б)
Характерна переменная валентность.
В — указывается в названии вещества.
Например, оксид марганца ( VII ), хлорид хрома ( II ).
Характерны высшая валентность
В = N группы
Неметалл ставится в этом случае на первое место в формуле
Характерна низшая валентность
8- N группы
Неметалл ставится в этом случае на втором место в формуле
Характерна переменная валентность.
В — указывается в названии вещества.
Например, оксид серы ( IV ), сульфид фосфора ( III ).
Неметалл ставится в этом случае на первое место в формуле
Бинарная химическая формула — это формула химического соединения, в состав которого входят два вида элементов.
ОКСИДЫ
СУЛЬФИДЫ
ХЛОРИДЫ
Оксид — это сложное вещество,
в состав которого входят два вида атомов, одним из которых является кислород,
с валентностью (II).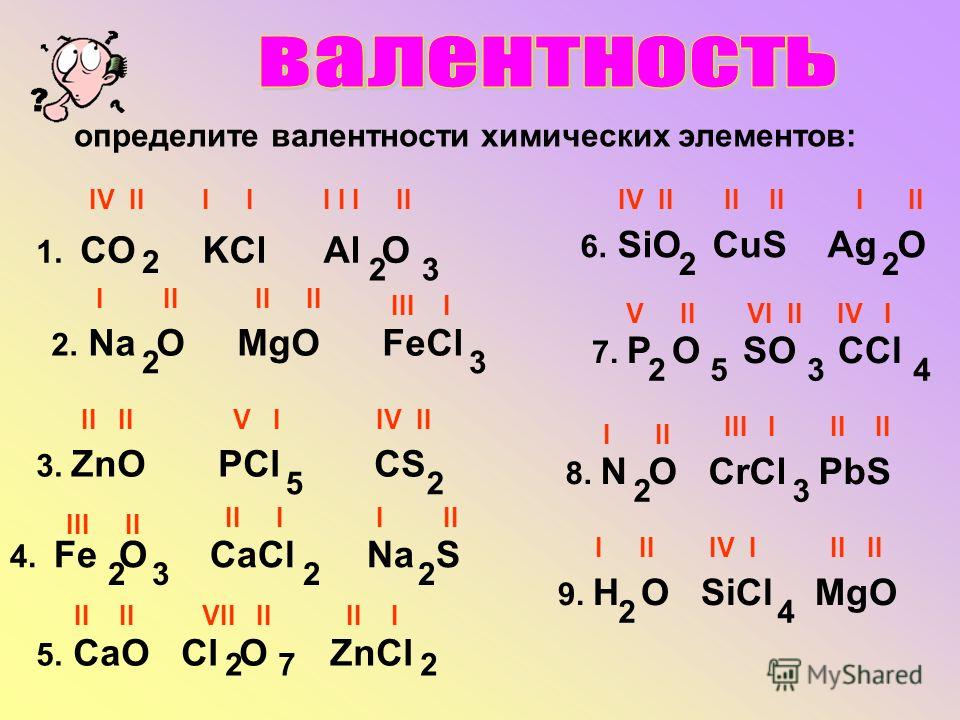
Na 2 О
CaО
P 2 О 5
Сульфид — это сложное вещество, в состав которого входят два вида атомов, одним из которых является сера, с валентностью (II).
K 2 S
MgS
Al 2 S 3
Хлорид — это сложное вещество, в состав которого входят два вида атомов, одним из которых является хлор, с валентностью (I).
FeCl 3
NaCl
CaCl 2
Общая формула
где Э — элемент;
Х — валентность элемента
Общая формула
где Э — элемент;
Х — валентность элемента
Общая формула
где Э — элемент;
Х — валентность элемента

Последовательность действий
Составление формулы оксида фосфора
1. Написать символы элементов
Р О
2. Определить валентности элементов
V II
P O
3.Найти наименьшее общее кратное численных значений валентностей
5 • 2 = 10
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов
10: 5 = 2
10: 2 = 5
P : О = 2: 5
5. Записать индексы при символах элементов
Записать индексы при символах элементов
Р 2 О 5
6.Формула соединения (оксида)
Р 2 О 5
В = N группы
В = 8- N группы
А х
В у
 Например, оксид серы ( IV ), сульфид фосфора ( III ).
Например, оксид серы ( IV ), сульфид фосфора ( III ). щелочные металлы (Li, Na, K, Rb, Cs, Fr) I
металлы II группы, главная подгруппы (Be, Mg, Ca, Sr, Ba, Ra ) II
алюминий (Al) III
кислород (О) II
фтор (F) I
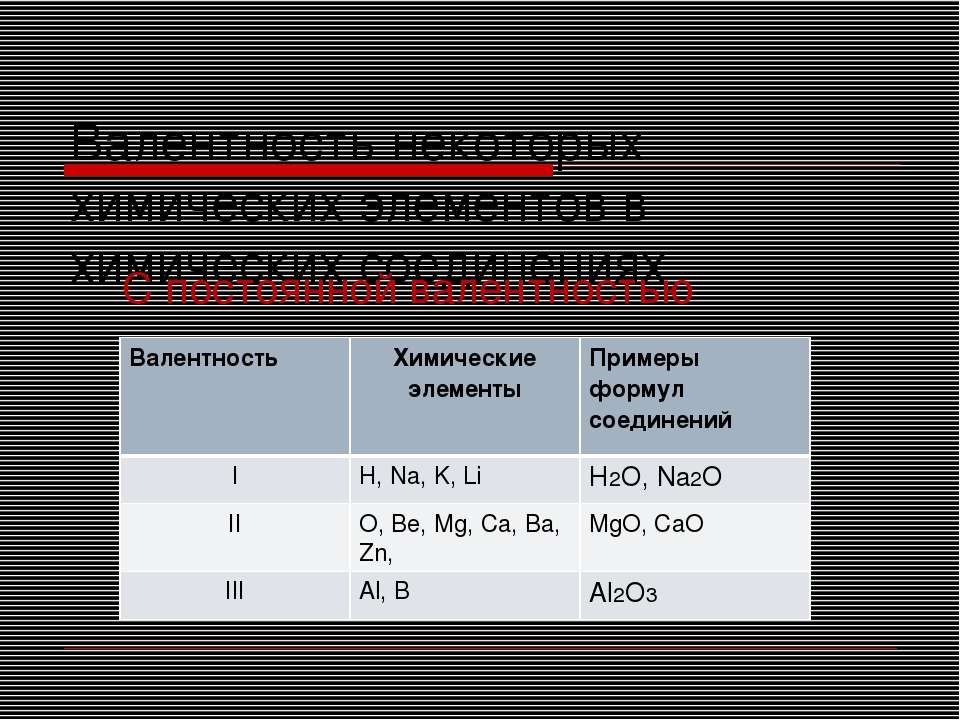
 Например, валентность азота в N2 равна III, степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, степень окисления = +2.
Например, валентность азота в N2 равна III, степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, степень окисления = +2.


В книжной версии
Том 4.Москва, 2006, стр. 531
Скопировать библиографическую ссылку:
 И. Минкин
И. Минкин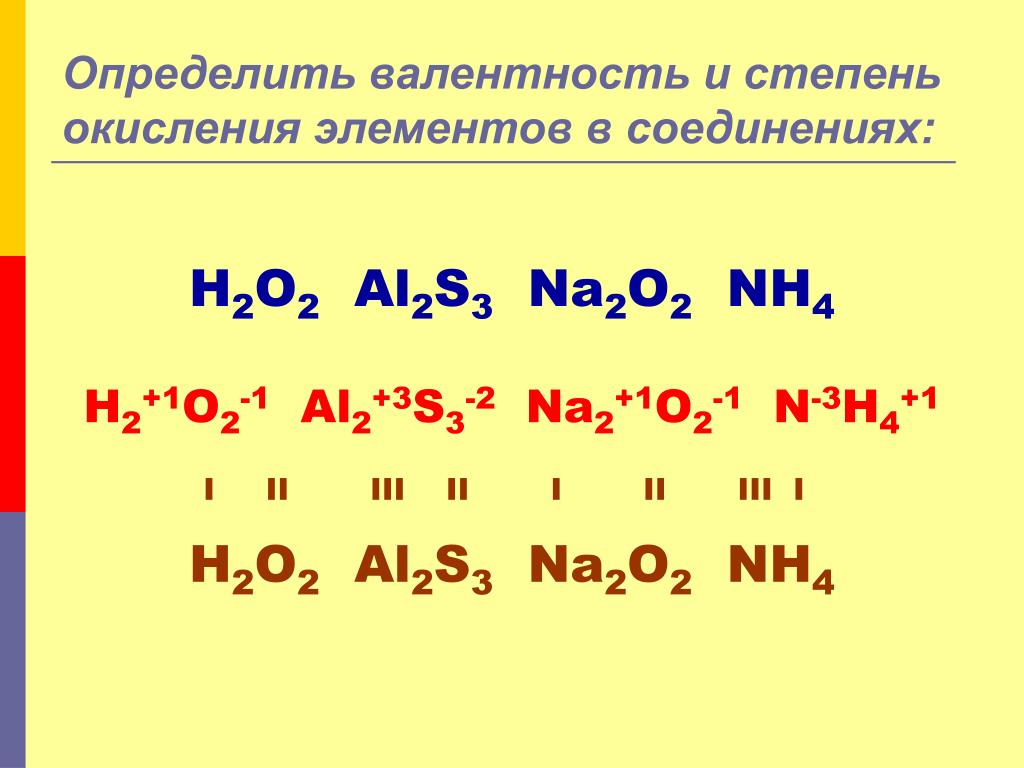 В. элемента соответствует порядковому номеру группы, в которой он находится.Напр., Макс. В. атома углерода должна быть равной 4, хлора 7. Электростатич. теория химич. связи привела к формулировке близкого к В. и дополнительного понятия степени окисления (окислительного числа). Степень окисления соответствует формальному заряду, который приобрёл бы атом, если бы все электронные пары его химич. связи сместились в сторону более электроотрицательных элементов. По знаку степени окисления, как правило, совпадает с экспериментально эффективным зарядом атома.Напр., Степень окисления серы в $ \ ce {SO3} $ равна + 6, её эффективный заряд ок. + 2.
В. элемента соответствует порядковому номеру группы, в которой он находится.Напр., Макс. В. атома углерода должна быть равной 4, хлора 7. Электростатич. теория химич. связи привела к формулировке близкого к В. и дополнительного понятия степени окисления (окислительного числа). Степень окисления соответствует формальному заряду, который приобрёл бы атом, если бы все электронные пары его химич. связи сместились в сторону более электроотрицательных элементов. По знаку степени окисления, как правило, совпадает с экспериментально эффективным зарядом атома.Напр., Степень окисления серы в $ \ ce {SO3} $ равна + 6, её эффективный заряд ок. + 2. {2 -}} $ — с 8 атомами $ \ ce {Co} $. Химич. связь в подобных соединениях не может быть описана с помощью представлений о двухэлектронных двухцентровых связях и обусловлена образованием многоцентровой связи.
{2 -}} $ — с 8 атомами $ \ ce {Co} $. Химич. связь в подобных соединениях не может быть описана с помощью представлений о двухэлектронных двухцентровых связях и обусловлена образованием многоцентровой связи. 10]
10]  384]
384]  Рассмотрим этот механизм на примере образования соединения аммиака с хлороводородом. [c.65]
Рассмотрим этот механизм на примере образования соединения аммиака с хлороводородом. [c.65]  Эти факторы определяют валентность элемента, его окислительно-восстановительную способность и кислотно-основную характеристику. Количество электронов на двух оболочках (предпоследний и наружный слой) приведено в табл. 4, радиусы элементов — в табл. 5. [c.12]
Эти факторы определяют валентность элемента, его окислительно-восстановительную способность и кислотно-основную характеристику. Количество электронов на двух оболочках (предпоследний и наружный слой) приведено в табл. 4, радиусы элементов — в табл. 5. [c.12]  после открытия закона кратных отношений. В это время валентность элементов установлена экспериментально по стехиометрическому составу соединений. В качестве стандарта были выбраны одновалентный водород (валентность по водороду) и двухвалентный кислород (валентность по кислороду). С открытием периодического закона была связь валентности с положением элемента в периодической системе. Высшая валентность элемента определяется номером группы периодической системы, в которой он находится.С помощью подобных представлений удалось систематизировать фактический материал в химии, предсказать состав и синтезировать неизвестные соединения. [c.78]
после открытия закона кратных отношений. В это время валентность элементов установлена экспериментально по стехиометрическому составу соединений. В качестве стандарта были выбраны одновалентный водород (валентность по водороду) и двухвалентный кислород (валентность по кислороду). С открытием периодического закона была связь валентности с положением элемента в периодической системе. Высшая валентность элемента определяется номером группы периодической системы, в которой он находится.С помощью подобных представлений удалось систематизировать фактический материал в химии, предсказать состав и синтезировать неизвестные соединения. [c.78]  Это хорошо иллюстрируется набором границ между валентными группами в первом периоде (центральный круг на модели). Так что водород может «дрейфовать по всей акватории для всех акваторий. И это не только его привилегией. Ведь и другие химические элементы не всегда следуют валентности, предписанной им системе. Например, Fe (УП1 группа) часто выступает в химической системе». Практически все химические элементы дрейфуют по всему валентному спектру, но знают свой постоянный причал-клетку, соединения как 1, 2 и 3-х валентный элемент. [c.172]
Это хорошо иллюстрируется набором границ между валентными группами в первом периоде (центральный круг на модели). Так что водород может «дрейфовать по всей акватории для всех акваторий. И это не только его привилегией. Ведь и другие химические элементы не всегда следуют валентности, предписанной им системе. Например, Fe (УП1 группа) часто выступает в химической системе». Практически все химические элементы дрейфуют по всему валентному спектру, но знают свой постоянный причал-клетку, соединения как 1, 2 и 3-х валентный элемент. [c.172]  Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду так, в соединениях N2O, СО, ЗЮг, SO [c.35]
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду так, в соединениях N2O, СО, ЗЮг, SO [c.35] 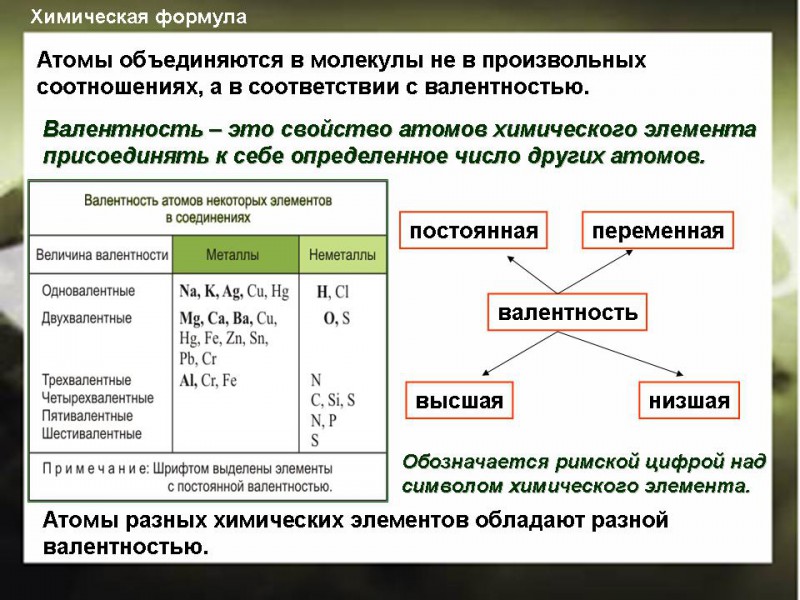 д. Таким образом, наибольшая валентность элементов каждой группы по ккатороду соответствует, за немногими исключеииями, номеру группы. [c.51]
д. Таким образом, наибольшая валентность элементов каждой группы по ккатороду соответствует, за немногими исключеииями, номеру группы. [c.51]  [c.81]
[c.81]  Прн этом электронные, пары, связывающие данные два атома, следует считать принадлежащими обоим (как, так и другому) атомам, что схематически показано для молекулы фтора [c.63]
Прн этом электронные, пары, связывающие данные два атома, следует считать принадлежащими обоим (как, так и другому) атомам, что схематически показано для молекулы фтора [c.63]  Номер каждого периода совпадает с электронными уровнями в оболочках элементов, номер группы — с электронов па наружном уровне электронной оболочки, хотя это выполняется только для элементов главных подгрупп. [c.36]
Номер каждого периода совпадает с электронными уровнями в оболочках элементов, номер группы — с электронов па наружном уровне электронной оболочки, хотя это выполняется только для элементов главных подгрупп. [c.36]  Этим и объяснялась инертность этих элементов, т. е. неспособность их элементов к образованию химических соединений. Очевидно, что возбуждение элементов гелия и неона не может привести к появлению непарных электронов, соответственно, в первом и втором уровне их электронных оболочек. У других элементов группы — аргона, криптона, ксенона и радона — благодаря этой наличию на нарулэлектронных оболочек свободных -орбиталей возбуждение может привести к появлению непарных электронов, причем число их может достичь восьми.С [1м, естественно, соединяется система образования элементов химических соединений, в которой валентность может достигать восьми. В последние годы [c.46]
Этим и объяснялась инертность этих элементов, т. е. неспособность их элементов к образованию химических соединений. Очевидно, что возбуждение элементов гелия и неона не может привести к появлению непарных электронов, соответственно, в первом и втором уровне их электронных оболочек. У других элементов группы — аргона, криптона, ксенона и радона — благодаря этой наличию на нарулэлектронных оболочек свободных -орбиталей возбуждение может привести к появлению непарных электронов, причем число их может достичь восьми.С [1м, естественно, соединяется система образования элементов химических соединений, в которой валентность может достигать восьми. В последние годы [c.46]  Так, например, в плавиковой кислоте НГ фтор одновалентен, в аммиаке ЫНз азот трехвалентен, в кремневодороде 31Н4 кремний четырехвалентен и т. д. [c.42]
Так, например, в плавиковой кислоте НГ фтор одновалентен, в аммиаке ЫНз азот трехвалентен, в кремневодороде 31Н4 кремний четырехвалентен и т. д. [c.42]  Можно ли считать в этих соединениях кислородом двухвалентным, фтор одновалентным, бор и углерод-нульва-лентными [c.81]
Можно ли считать в этих соединениях кислородом двухвалентным, фтор одновалентным, бор и углерод-нульва-лентными [c.81]  В их структуре есть и атомы в междоузлиях и вакансии, но нет недостатка элементов. Это становится ясно, если у истинные валентности элементов. [c.168]
В их структуре есть и атомы в междоузлиях и вакансии, но нет недостатка элементов. Это становится ясно, если у истинные валентности элементов. [c.168] 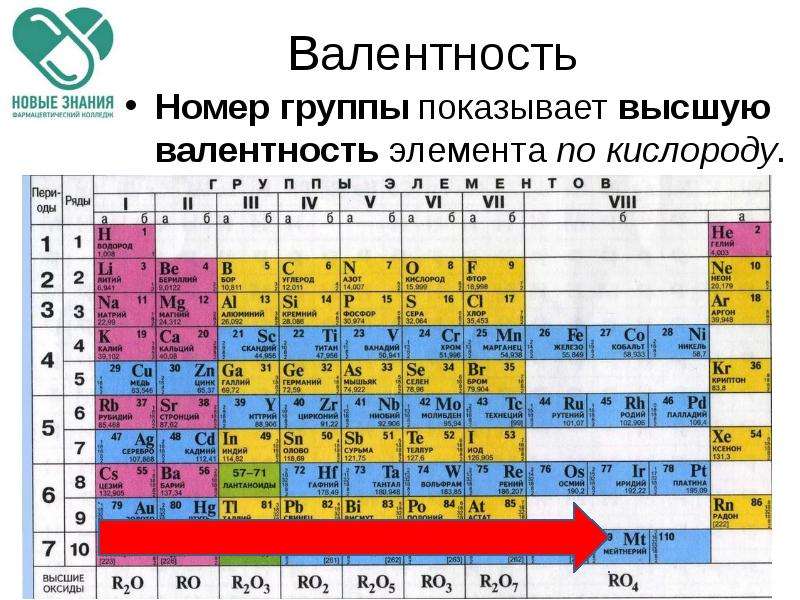 Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
 Специалист гельнил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Специалист гельнил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака. Между обозначениями элементов черточкой выделяется связь, а число линий соответствует В.
Между обозначениями элементов черточкой выделяется связь, а число линий соответствует В.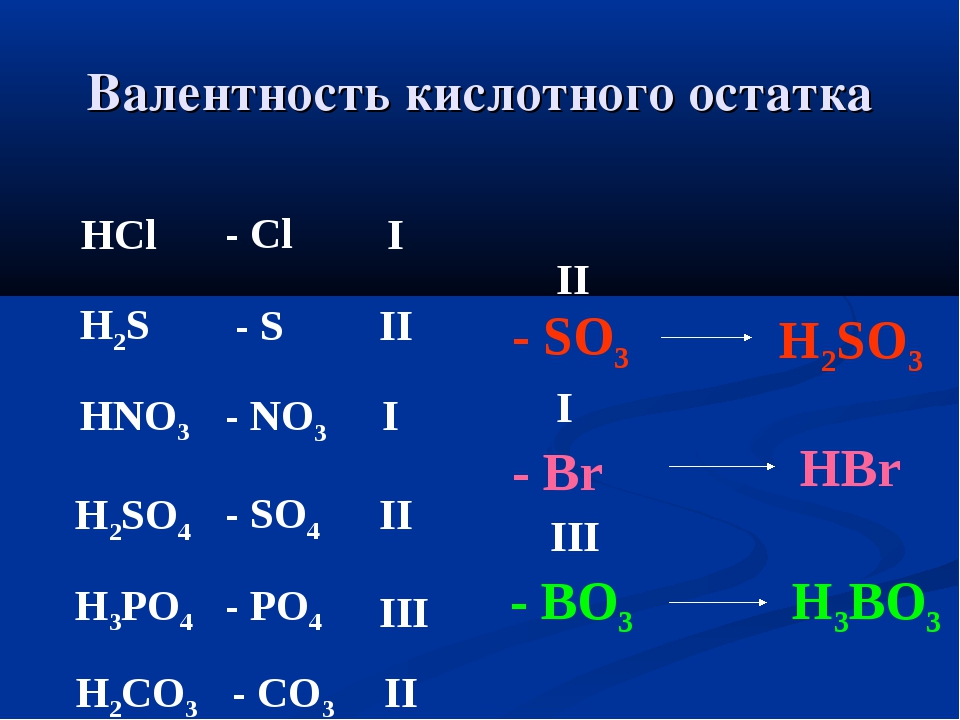 В таких сочетаниях атомы О2 проявляют двукратную валентность.
В таких сочетаниях атомы О2 проявляют двукратную валентность. Присутствие неспаренного электрона обладает способностью проявлять низшую В., равную единицу в соединениях. Зная валентность, можно легко составить формулы соединений.
Присутствие неспаренного электрона обладает способностью проявлять низшую В., равную единицу в соединениях. Зная валентность, можно легко составить формулы соединений. Минимальным общим кратным будет 6.
Минимальным общим кратным будет 6. 9 1075
9 1075
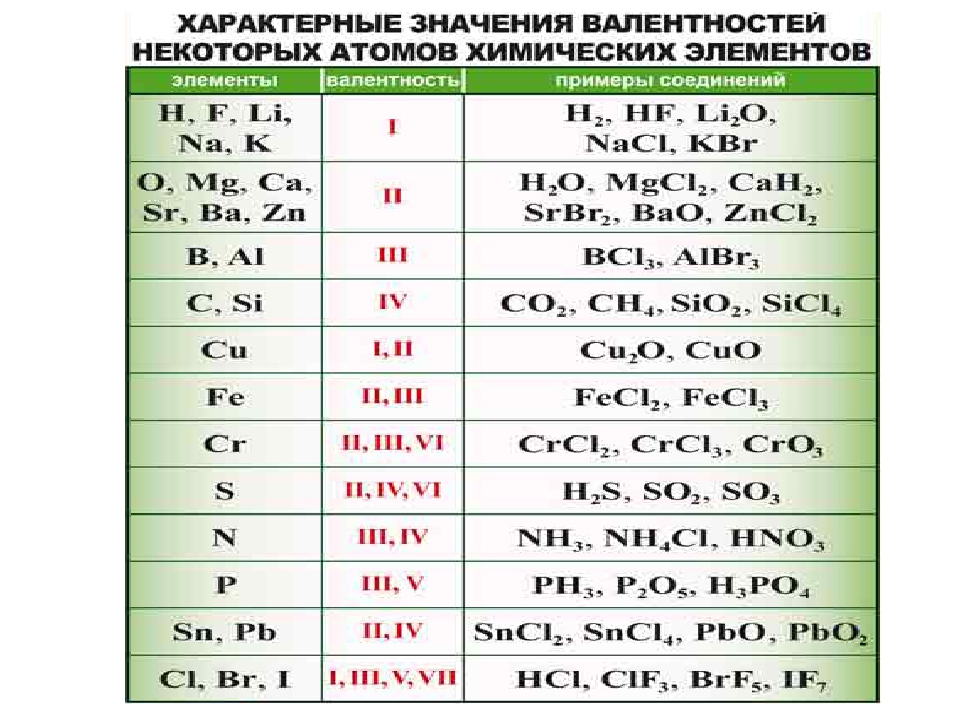 Закономерность проявляется у всех, кроме нескольких, потому что они не включают перед собой элементы, аналогичные по атомному объему.
Закономерность проявляется у всех, кроме нескольких, потому что они не включают перед собой элементы, аналогичные по атомному объему.
 Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также определение химических формул веществ молекулярного и немолекулярного строения.
Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также определение химических формул веществ молекулярного и немолекулярного строения.
По той же причине в молекуле Nh4 валентность атома азота равна трем, а в молекуле Ch5 валентность атома углерода равна четырем.
 И во всех таких соединенийх атомы кислорода проявляют валентность, равную две. Зная это, можно определить валентные элементы других элементов в их бинарных соединениях с кислородом. (Бинарными называемыми соединения, состоящие из элементов двух химических элементов.)
И во всех таких соединенийх атомы кислорода проявляют валентность, равную две. Зная это, можно определить валентные элементы других элементов в их бинарных соединениях с кислородом. (Бинарными называемыми соединения, состоящие из элементов двух химических элементов.) е. имеет переменную валентность. У всех элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. Таблицу).
е. имеет переменную валентность. У всех элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. Таблицу).
 Отсюда в соединении h3O валентность O равна 2.
Отсюда в соединении h3O валентность O равна 2.Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Водород | ЧАС | я | HF |
| 2 | Гелий / Гелий | Он | отсутствует | — |
| 3 | Литий / Литий | Ли | я | Li2O |
| 4 | Бериллий / Бериллий | Быть | II | Beh3 |
| 5 | Бор / Бор | B | III | BCl3 |
| 6 | Углерод / Карбон | C | IV, II | CO2, Ch5 |
| 7 | Азот / Азот | N | III, IV | Кh4 |
| 8 | Кислород / Кислород | О | II | h3O, BaO |
| 9 | Фтор / Фтор | F | я | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Натрий | Na | я | Na2O |
| 12 | Магний / Магний | Mg | II | MgCl2 |
| 13 | Алюминий / Алюминий | Al | III | Al2O3 |
| 14 | Кремний / Кремний | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | п | III, V | Ph4, P2O5 |
| 16 | Сера / Сера | S | VI, IV, II | h3S, SO3 |
| 17 | Хлор / Хлор | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Аргон | Ar | отсутствует | — |
| 19 | Калий / Калий | K | я | KBr |
| 20 | Кальций / Кальций | Ca | II | Cah3 |
| 21 год | Скандий / Скандий | Sc | III | Sc2S3 |
| 22 | Титан / Титан | Ti | II, III, IV | Ti2O3, Tih5 |
| 23 | Ванадий / Ванадий | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Марганец | Mn | II, III, IV, VI, VII | Mn2O7, Mn2 (SO4) 3 |
| 26 | Железо / Железо | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Кобальт | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Никель | Ni | II, III, IV | NiS, Ni (CO) 4 |
| 29 | Медь / Медь | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Цинк | Zn | II | ZnCl2 |
| 31 год | Галлий / Галлий | Ga | III | Ga (OH) 3 |
| 32 | Германий / Германий | Ge | II, IV | GeBr4, Ge (OH) 2 |
| 33 | Мышьяк / Мышьяк | Так как | III, V | As2S5, h4AsO4 |
| 34 | Селен / Селен | Se | II, IV, VI, | h3SeO3 |
| 35 год | Бром / Бром | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Рубидий | Руб. | я | RbH |
| 38 | Стронций Стронций | Sr | II | SrSO4 |
| 39 | Иттрий / Иттрий | Y | III | Y2O3 |
| 40 | Цирконий / Цирконий | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 год | Ниобий / Ниобий | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / молибден | Пн | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 год | Технеций / Технеций | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Рутений | RU | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Родий | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Палладий | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Серебро | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Кадмий | Компакт диск | II | CdCl2 |
| 49 | Индий / Индий | В | III | In2O3 |
| 50 | Олово / Олово | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Сурьма | Sb | III, IV, V | СбФ5, Сбх4 |
| 52 | Теллур / Теллур | Te | VI, IV, II | Тех3, H6TeO6 |
| 53 | Иод / Йод | я | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Ксенон | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Цезий | CS | я | CsCl |
| 56 | Барий / Барий | Ба | II | Ва (ОН) 2 |
| 57 | Лантан / Лантан | Ла | III | Lah4 |
| 58 | Церий / Церий | Ce | III, IV | CeO2, CeF3 |
| 59 | Празеодим / Празеодим | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Неодим | Nd | III | Nd2O3 |
| 61 | Прометий / Прометий | Вечера | III | Pm2O3 |
| 62 | Самарий / Самарий | См | II, III | SmO |
| 63 | Европий / Европий | ЕС | II, III | EuSO4 |
| 64 | Гадолиний / Гадолиний | Б-г | III | GdCl3 |
| 65 | Тербий / Тербий | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Диспрозий | Dy | III | Dy2O3 |
| 67 | Гольмий / Гольмий | Хо | III | Ho2O3 |
| 68 | Эрбий / Эрбий | Э | III | Er2O3 |
| 69 | Тулий / Тулий | Тм | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | ЭЙ |
| 71 | Лютеций / Лютеций | Лу | III | LuF3 |
| 72 | Гафний / Гафний | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Тантал | Та | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Вольфрам | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Рений | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Осмий | Операционные системы | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Иридий | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Платина | Pt | I, II, III, IV, V | Pt (SO4) 3, PtBr4 |
| 79 | Золото / Золото | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Меркурий | Hg | II | HgF2, HgBr2 |
| 81 год | Талий / Таллий | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Свинец | Pb | II, IV | ПбС, Пбх5 |
| 83 | Висмут / Висмут | Би | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Полоний | По | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Астатин | В | нет данных | – |
| 86 | Радон / Радон | Rn | отсутствует | – |
| 87 | Франций / Франций | Пт | я | – |
| 88 | Радий / Radium | Ра | II | RaBr2 |
| 89 | Актиний / Актиний | Ac | III | AcCl3 |
| 90 | Торий / Торий | Чт | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Протактиний | Па | IV, V | PaCl5, PaF4 |
| 92 | Уран / Уран | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Пу | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | См | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | FM | II, III | — |
| 101 | Менделевий | Мкр | II, III | — |
| 102 | Нобелий | Нет | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Источник: https: // infotables. ru / химия / 1071-валентность-химических-элементов
ru / химия / 1071-валентность-химических-элементов
Ответы@Mail.Ru: Как определить валентность по таблице Менделеева?
есть высшая валентность это номер группы…. и низшая — это 8 — номер группы… но что касаетсятаких элементов как железо … они проявляют разную степень окисления и в таблице менделеева ты это не найдешь … это есть в справочниках по химии
Максимальная валентность по кислороду представляет собой электронов на внешнем слое. В общем случае номеру группы.У Р с утра ещё была V группа, за это время что-то изменилось? Валентность по водороду представляет собой электронов, который может принять на внешний слой. Равна 8- №группы.
У элементов с переменной валентностью всё сложнее. И Fe c утра был в VIII! Железо отдаёт 2 электрона с внешнего слоя, валентность 2, ст. окисления +2, ещё один «лишний» электрон с предвнешнего d слоя — валентность 3. Придётся запоминать! Только не говорите, что таблица Д.
Менделеева уже «перекроена», тогда мне придётся всё заново учить!
Валентность — число элементов одного химического элемента присоединять определенное число другого химического элемента.
Есть элементы, которые имеют постоянную валентность:
одновалентны (I) — H, Li, Na, K, Rb, Cs, F, I
двухвалентны (II) — O, Be, Mg, Ca, Sr, Ba, Zn, Cd
трехвалентны (III) — B, Al Есть еще один способ: определить валентность можно по таблице Д. И. Менделеева.
Все элементы в таблице разделены на подгруппы а) и б).
Активные металлы занимают только три первые группы. Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе валентность II.Есть металлы с модельной валентностью, тогда ее указать в скобках, например, оксид железа (III).
Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках): низшую — вычисляют по формуле (8-Ь группы), в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Есть в-ва, валентность которых определяется по группе, а есть те в-ва (например, металлы), у которых валентность с ней не совпадает.
Нужно из 8 (максимальной группы) отнять номер группы в-ва, валентность у которого хотите найти
Все элементы в таблице разделены на подгруппы а) и б). Активные металлы занимают только три первые группы.
Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II.
Есть металлы с модельной валентностью, тогда ее указать в скобках, например, оксид железа (III). Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках): низшую — вычисляют по формуле (8-Ь группы), в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Алгоритмы составления формул по валентности и определение валентности по формуле я послания как прикрепленный файл. Распечатай его и пользуйся пока не научишься.
Источник: https: //touch. otvet.mail.ru/question/28569283
otvet.mail.ru/question/28569283
Как определить валентность?
Согласно школьному определению валентность — это способность химического элемента образовывать или количество химических связей с другими атомами.
Как известно, валентность бывает постоянной (когда химический элемент образует всегда одно и то же связи с другими атомами) и количество (когда в зависимости от того или иного вещества изменяется валентность одного и того же элемента).
Определить валентность нам поможет периодическая система химических элементов Д. И. Менделеева.
Действуют такие правила:
1) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у нее максимальная валентность равна 6.
2) Минимальная валентность для неметаллов равна 8 минус номер группы. Например, минимальная валентность того же хлора равна 8 — 7, то есть 1.
Например, минимальная валентность того же хлора равна 8 — 7, то есть 1.
- Увы, из обоих правил имеются сведения.
- Например, медь находится в 1-й группе, однако максимальная валентность соответствует не 1, а 2.
- Кислород находится в 6-й группе, но у него валентность почти всегда 2, а вовсе не 6.
- Полезно ещё помнить следующие правила:
3) Все щелочные металлы (металлы I группы, главной подгруппы) всегда имеют валентность 1 .Например, валентность натрия всегда равна 1, потому что это щелочной металл.
4) Все щёлочно-земельные металлы (металлы II группы, главная подгруппы) всегда имеют валентность 2 . Например, валентность магния всегда равна 2, потому что это щёлочно-земельный металл.
- 5) Алюминий всегда имеет валентность 3.
- 6) Водород всегда имеет валентность 1.
- 7) Кислород практически всегда имеет валентность 2.

- 8) Углерод практически всегда имеет валентность 4.
- Следует помнить, что в разных источниках определения валентности могут отличаться.
- Более или менее точно валентность можно определить как количество общих электронных пар, посредством данного атома связан с другими .
Согласно такому определению валентность азота в HNO3 равна 4, а не 5. Пятивалентным азотом быть не может, потому что в таком случае вокруг атома азота кружилось бы 10 электронов. А такого не может быть, потому что максимум электронов составляет 8.
Источник: http://www.bolshoyvopros.ru/questions/505034-kak-opredelit-valentnost.html
Как определить валентность по периодической таблице Менделеева: что это такое, изучение свойств химических элементов
Атомы химические элементы могут образовывать различное число связей. Эта способность имеет специальное название — валентность.
Давайте разберемся, как определить валентность по таблице Менделеева, узнаем, чем заключается ее отличие от степени окисления, увидим закономерности, характерные для водорода, углерода, фосфора, цинка, научимся находить валентность химических элементов.
Основные сведения
Валентность — это возможность связи между собой химических элементов образовывать. Другими словами можно сказать, что это способность атома присоединить к себе определенное количество других элементов.
Важно! Это не всегда постоянное число для одного и того же элемента. В разных соединениях элемент может обладать различными значениями.
Определение по таблице Д.И. Менделеева
Для определения этой способности атома в таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы .
Это вертикальные столбцы, которые делят все элементы по определенному признаку. В зависимости от признака выделяют подразделения элементов.
Этими столбцами элементы делятся на тяжелые и легкие элементы, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, для определения способности образовывать связи, руководствуясь двумя правилами:
- Высшая валентность элемента равна номеру его группы.

- Низкая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Например, фосфор проявет высшую валентность V — P2O5 и низшую (8-5) = 3– PF3.
Стоит также отметить несколько основных характеристик и особенности при определении этого показателя:
- Валентность водорода всегда I — h3O, HNO3, h4PO4.
- Валентность кислорода всегда равна II — CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы — Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две валентности — высшая и низшая.
Также существуют элементы, у которых может быть 3 или 4 разных значения этого показателя. К ним защитный хлор, бор, йод, хром, сера и другие. Например, хлор обладает валентностью I, III, V, VII — HCl, ClF3, ClF5, HClO4 соответственно.
Определение по формуле
Для определения по формуле можно использовать границы:
- Если известна валентность (V) одного из элементов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что валентность кислорода всегда равна II, тогда можно использовать такие правила: произведение числа элементов на его V одного элемента должно равняться произведению числа элементов другого элемента на его V.
 Таким образом, валентность углерода можно найти так — 2 × 2 (в молекуле 2 атома кислорода с V = 2), то есть валентность углерода равняется 4 . Рассмотрим еще несколько примеров: P2O5 — тут валентность фосфора = (5 * 2) / 2 = 5. HCl — валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V = 1.
Таким образом, валентность углерода можно найти так — 2 × 2 (в молекуле 2 атома кислорода с V = 2), то есть валентность углерода равняется 4 . Рассмотрим еще несколько примеров: P2O5 — тут валентность фосфора = (5 * 2) / 2 = 5. HCl — валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V = 1. - . .К ней и присоединится натрий. Можно сделать вывод, что натрий — одновалентный элемент.
Разница между степенью окисления и валентностью
Очень важно понимать разницу между этими понятиями. Степень окисления — это условный электрический заряд , которым обладает ядро атома, в то время как валентность — это количество связей, которые могут установить ядро элемента.
Рассмотрим подробнее, что такое степень окисления. Согласно современной теории о строении атома, ядро элемента состоит из положительно заряженных протонов и нейтронов без заряда, а вокруг него находятся электроны с отрицательным зарядом, которые уравновешивают заряд ядра и делают элемент электрически нейтральным.
В случае, если атом устанавливает связь с другим, он отдает или принимает электроны , то есть выходит из состояния баланса и начинает обладать электрическим зарядом. При этом если атом отдает электрон, он становится положительно заряженным, а если принимает — отрицательно заряженным электроном.
Внимание! В соединении хлора и один электрон HCl водород отдает электрон и приобретает заряд +1, а хлор принимает и становится отрицательным -1. В сложных соединениях, HNO3 и h3SO4, степени окисления будут такими — H + 1N + 5O3 -2 и h3 + 1S + 6O4 -2.
Сравнивая два определения, можно сделать вывод, что валентность и степень окисления часто совпадают: валентность водорода +1 и валентность I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда !
В органическом соединении углерода степень окисления +1, но он обладает V, равной 4. В перекиси водорода h3O2 у углерода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в нескольких случаях это может привести к ошибке.
Поэтому не следует отождествлять два этих понятия, так как в нескольких случаях это может привести к ошибке.
Валентности распространенных элементов
Водород
Один из самых распространенных элементов во вселенной, встречается во многих соединениях и всегда обладает V = 1 . Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
На первом уровне может находиться не более двух электронов одновременно, таким образом, водород может либо отдать свой электрон и образовать связь (электронная оболочка останется пустой), либо 1 электронная оболочка останется пустой), либо 1, также образовав новую связь (электронная оболочка полностью заполнится).
Пример: h3O — 2 атома водорода с V = 1 связаны с двухвалентным кислородом; HCl — одновалентные хлор и водород; HCN — синильная кислота, где водород также проявляет V, равную 1.
Углерод
Углерод может обладать либо валентностью II, либо IV. Связано это со строением внешнего электронного электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V II.
Связано это со строением внешнего электронного электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V II.
То есть 2 электрона установили 2 новые связи, например, соединение CO — угарный газ, где и кислород, и водород двухвалентные.
Однако бывают ситуации, когда один электрон с первого уровня переходит на второй, тогда у углерода образует 4 свободных электрона , которые могут образовывать связи: СО2, НСООН, Н2СО3.
Фосфор
Данный элемент может обладать валентностью III и V.
Как и в предыдущих случаях, он может образовать переход 1 электрона с s-орбитали на d-орбиталь, на котором у него есть 3 электрона. тогда неспаренных электронов станет 5, а значит, и валентность тоже будет равна V.Например: РН3, Р2О5, Н3РО4.
Цинк
Как элемент главной подгруппы и металл, цинк может обладать только валентностью, которая соответствует номеру его группы , то есть 2. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Определение валентности химических элементов
Изучение валентности по периодической таблице Менделеева
Вывод
Теперь вы знаете, что такое валентность, чем она легко отличается от степени окисления, и определите валентность элементов по формулам или таблице Менделеева.
Это интересно! Основной закон Гесса и следствия из него
Источник: https://uchim.guru/himiya/kak-opredelit-valentnost-po-tablitse-mendeleeva.html
Таблица валентных химических элементов
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
Таблица валентностей химических элементов. Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы. Действительно, теоретически, это самая распространенная валентность для химических элементов значительно сложнее.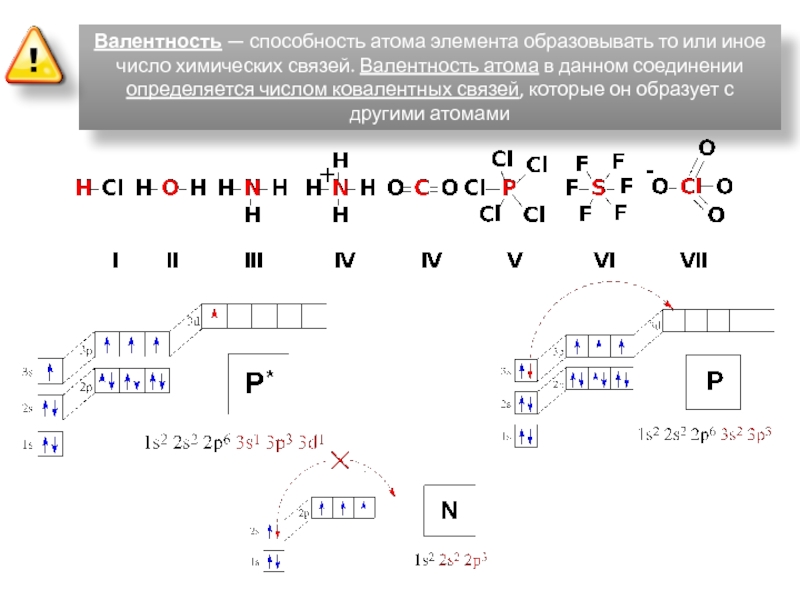 Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому предлагаем Вашему вниманию таблицу валентностей химических элементов.Числовое значение положительной валентности элемента, состоящее из отданных атомом электронов, отрицательной валентности, которое должно быть добавлено для внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому предлагаем Вашему вниманию таблицу валентностей химических элементов.Числовое значение положительной валентности элемента, состоящее из отданных атомом электронов, отрицательной валентности, которое должно быть добавлено для внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют.
|



 Записать индексы при символах элементов
Записать индексы при символах элементов VII*II, получается 14.
VII*II, получается 14.
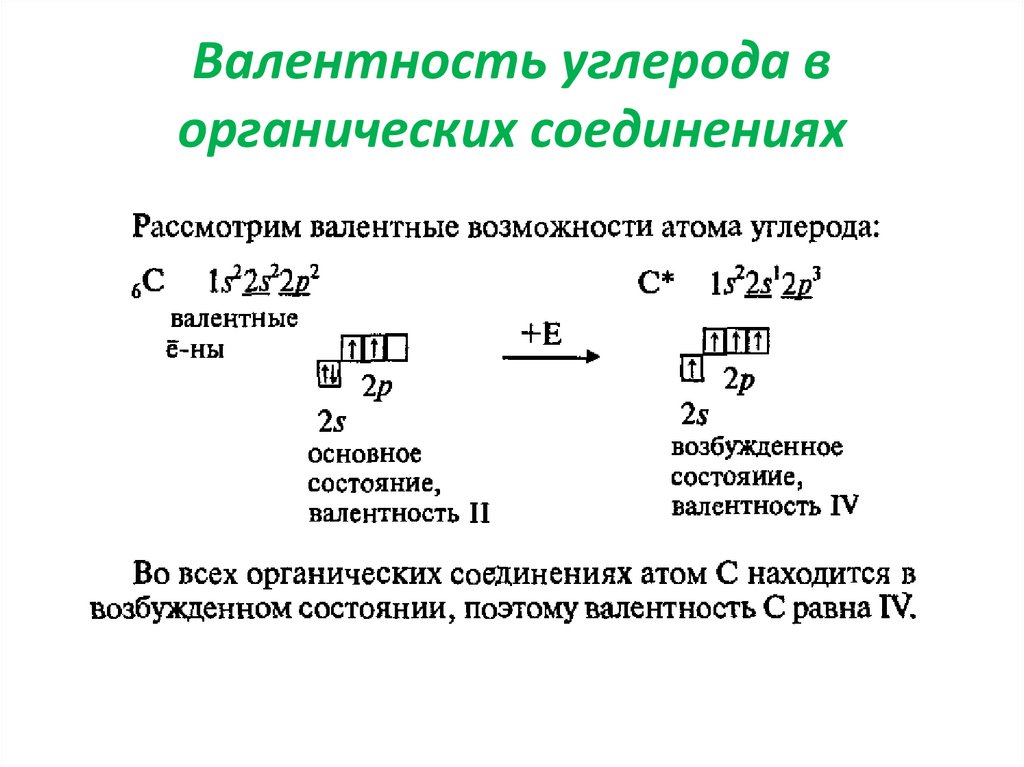 +3
+3
 Энтальпии. Энтропии. Энергии Гиббса…
Энтальпии. Энтропии. Энергии Гиббса… Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
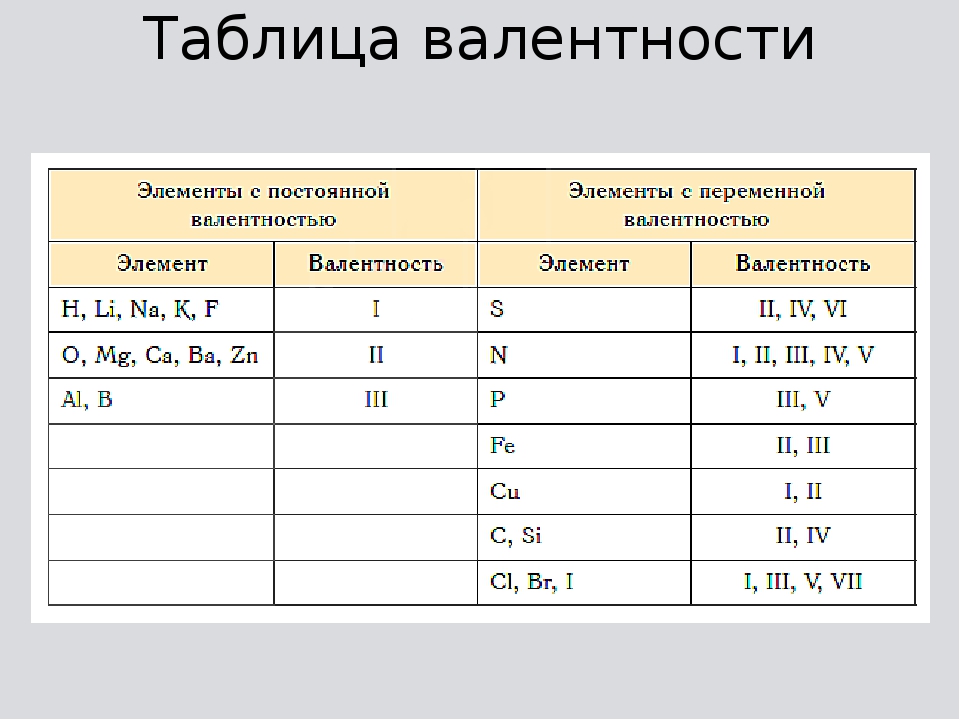



 Нужно из 8 (максимальной группы) отнять номер группы в-ва, валентность у которого хотите найти
Нужно из 8 (максимальной группы) отнять номер группы в-ва, валентность у которого хотите найти
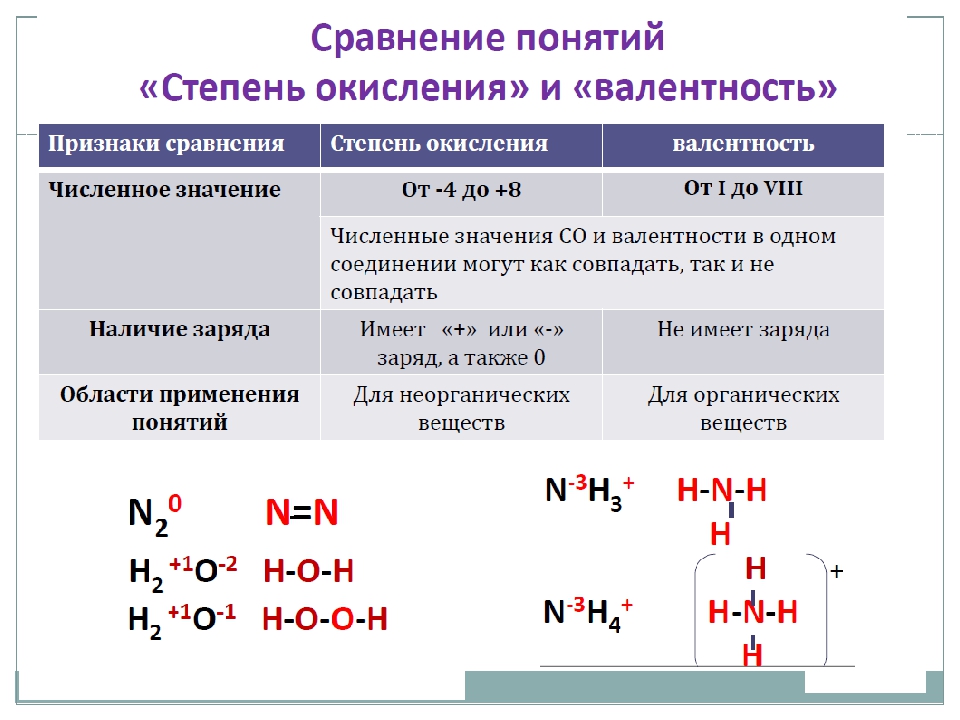
 Таким образом, валентность углерода можно найти так — 2 × 2 (в молекуле 2 атома кислорода с V = 2), то есть валентность углерода равняется 4 . Рассмотрим еще несколько примеров: P2O5 — тут валентность фосфора = (5 * 2) / 2 = 5. HCl — валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V = 1.
Таким образом, валентность углерода можно найти так — 2 × 2 (в молекуле 2 атома кислорода с V = 2), то есть валентность углерода равняется 4 . Рассмотрим еще несколько примеров: P2O5 — тут валентность фосфора = (5 * 2) / 2 = 5. HCl — валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V = 1.
 +3
+3
