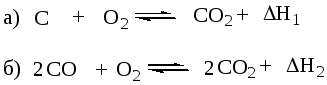Зависимость теплового эффекта от температуры.
⇐ ПредыдущаяСтр 30 из 115Следующая ⇒
Уравнения Кирхгоффа
Тепловой эффект реакции зависит от различных факторов и, в частности, от температуры.
По закону Гесса можно вычислить тепловой эффект реакции при стандартной температуре Т = 298,15 К, при которой известны теплоты образования или теплоты сгорания всех реагентов. Но зачастую необходимо знать тепловой эффект при других температурах.
Рассмотрим зависимость DH = f(T).
Пусть происходит химическая реакция
n1A1 + n2A2 = n3A3 + n4A4 (6.54)
В результате одного пробега реакции расходуется (n1 + n2) моль исходных веществ и появляется (n3 + n4) моль продуктов реакции. Если температура исходных веществ и продуктов равны (Тнач = Ткон), то теплота реакции или изменение энтальпии в процессе будет равно
DH = (n3H3 + n4H4) — (n1H1 + n2H2) (6.55)
Продифференцируем выражение (22) по температуре при условии p = const и получим

Т.к.  ,
,
то  (6.56)
(6.56)
Поскольку тепловой эффект реакции практически не зависит от давления, можно заменить частную производную на отношение дифферен-циалов, т.е.
 (6.57)
(6.57)
и аналогично
 (6.58)
(6.58)
Полученные зависимости (6.57), (6.58) были впервые выведены Кирхгоффом в 1858 г и называются уравнениями Кирхгоффав дифференциальном виде.
Проинтегрируем (6.57), предварительно разделив переменные, т.е.
d(DH) = DCpdT
 (6.59)
(6.59)
Аналогично
 (6.60)
(6.60)
Выражения (6.59) и (6.60) называются уравнениями Кирхгоффа в интегральном виде.
Если пренебречь изменениями DCp с температурой, то выраже-ния (6.59) и (6.61) позволяют рассчитать тепловой эффект реакции при температурах не равных 298 К. Причем удобно интегрировать в температурном интервале 298 ¸ Т, т.к. DH  легко определить по двум следствиям из закона Гесса. Если зависимость C
легко определить по двум следствиям из закона Гесса. Если зависимость C
Cp,1 = a1 + в1T + c1/T-2
Cp,3 = a3 + в3T + c3/T-2,
а для веществ А2 и А4
Cp,2 = a2 + в2T + c2T2
Cp,4 = a4 + в4T + c4T2,
то DСр
DCp= Da + DвT + Dc/T–2 +DcT2, (6.62)
где Da = n3a3 + n4a4 – n1a1 – n2a2
Dв = n3в3 + n4в4 – n1в1 – n2в2
Dс/ = n3c 3/ – n1c1/
Dc = n4c4 — n2c2
DH°(T) = DH°(298) +  (6.63)
(6.63)
После интегрирования
DH°(T) = DH°(298) +  (6.64)31
(6.64)31
или 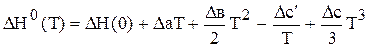 ,
,
где 
 является постоянной интегрирования, определяемой по значению теплового эффекта при стандартных условиях.
является постоянной интегрирования, определяемой по значению теплового эффекта при стандартных условиях.
Для упрощения расчетов можно воспользоваться средней теплоемкостью 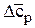
и тогда 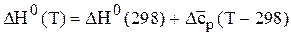 (6.65)
(6.65)
Анализ уравнений Кирхгоффа
Характер зависимости DН(Т) определяется характером зависимости суммарных теплоемкостей реагентов и продуктов реакции от Т, т.е. DСр(Т)
1) DСр = 0
 |
Рис. 6.8. Зависимость теплоемкости и теплового эффекта от температуры
Следовательно,  – постоянная величина, от температуры не зависит.
– постоянная величина, от температуры не зависит.
Проводя подобным образом анализ поведения суммарных теплоемкостей продуктов реакции и исходных веществ в зависимости от Т, можно определить характер изменения теплоты реакции с изменением Т.
Теплоемкости веществ используются при различных термохимичес-ких и термодинамических расчетах (тепловых балансов, энтропии, химического равновесия и др.).
2) DСр > 0
 |
Рис. 6.9. Зависимость теплоемкости и теплового эффекта от температуры
 3) DСр < 0
3) DСр < 0
Рис. 6.10. Зависимость DСр и DH реакции от Т
4) Если DСр = f(T)
Т.к. теплоемкости разных веществ изменяются с температурой различно, то для одной и той же реакции в разных интервалах температур могут быть все 3 случая

Рис. 6.11. Зависимость DСр и DH реакции от Т
6.4. Энтропия и ее свойства
Первый закон термодинамики устанавливает эквивалентность раз-личных форм энергии, в частности внутренней энергии, теплоты и работы.
Если система изолирована от окружающего мира, то ее внутренняя энергия остается неизменной.
С точки зрения I закона термодинамики возможны процессы, в которых вместо исчезнувшего одного вида энергии появится эквивалентное количество другого вида
Первый (I) закон термодинамики позволяет рассчитывать теплоту процесса. С точки зрения I закона термодинамики возможны процессы, в которых вместо исчезнувшего одного вида энергии появится эквивалентное количество другого вида. Переход теплоты от менее нагретого тела к более нагретому означал бы лишь распределение энергии внутри системы и также не противоречил первому закону.
Однако, знания этих величин: теплоты, работы и изменения внутренней энергии недостаточно для точного описания процесса:
а) в каком направлении будет протекать процесс?
б) при каком соотношении концентраций реагентов установится состояние равновесия химической реакции?
в) как температура, давление влияют на равновесие?
На эти вопросы первый закон термодинамики ответа не дает. Недостаточность I закона термодинамики проявляется в том, что он не дает представления о возможности протекания процессов.
Если внимательно рассмотреть процессы, протекающие в окружающем нас мире, то их можно разбить на две существенно различающиеся группы: самопроизвольные и несамопроизвольные.
Принципом, устанавливающим возможность протекания процесса, является второе начало (II закон) термодинамики.
II закон термодинамики как закон роста энтропии в изолированной системе является самостоятельным положением и не может быть выведен из I закона термодинамики. II закон термодинамики делает вывод о некоторой направленности процессов в изолированной системе.
Рекомендуемые страницы:
Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа.
Рассмотренные ранее расчеты тепловых эффектов на основе законов Гесса по теплотам образования и сгорания ограничены стандартными условиями. Для практических целей необходимо рассчитать тепловые эффекты для конкретных усл, овийтличных от стандартных..
Тепловые эффекты хим. реакций зависят не только от природы реагирующих веществ, но и от внешних условий, прежде всего от температуры. Зависимость тепловых эффектов от температуры можно установить термодинамически.
Ранее на основании закона Гесса, мы установили что
1. изменение теплоты при p=const выражается через изменение энтальпии . QP =Н2-
Н1=D Н | (45) |
2. тепловой эффект реакций, протекающих при V=const выражается как изменение | |
внутренней энергии QV =U2-U1=D U (46)
Продифференцировав по температуре эти два уравнения, получим: | |||||||||||||||||
| ¶ | (TН) | = | ¶ | Н | − | ¶ | Н | = |
| (47) | ||||||
D |
|
|
|
|
|
|
|
|
|
| — |
| |||||
|
|
| ¶ | ) |
| = | ¶T |
| − | ¶T | = | — (48) | |||||
|
| ¶¶(T |
| ¶¶T |
| ¶¶T | |||||||||||
|
|
| D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где производная энтальпии | по | температуре- это теплоемкость при постоянном | |||||||||||||||
давлении, а производная внутренней | энергии | по температуре- теплоемкость при | |||||||||||||||
постоянном давлении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
Уравнения (47) и (48) можно представить в несколько измененном виде: | |||||||||||||||||
| ¶¶(TН) |
| = D | (49), |
| ¶¶(T |
| ) |
| = D |
| (50) | |||||
|
| D |
|
|
|
|
|
|
| D |
|
|
|
|
|
| |
Эта закономерность была установлена Кирхгофом. Закон Кирхгофа читается так:
температурный коэффициент теплового эффекта равен приращению теплоемкости в результате протекания процесса.
Закон Кирхгофа в дифференциальной форме позволяет определить лишь изменение теплового эффекта с изменением температуры, а не величину самого теплового эффекта.
При исследовании температурной зависимости тепловых эффектов реакций чаще используется уравнение(7.76), так как большинство
химических процессов протекает при постоянном давлении.

Согласно уравнению (49) влияние температуры на тепловой эффект
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| D |
|
обусловливается знаком величины Ср: 1) при Ср > 0 величина | ¶¶(TН) |
| |||||||||||||||||
> 0, т.е. | с увеличением | температуры | тепловой | эффект | реакции | ||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| D |
|
|
|
будет | возрастать, | 2) | при | Ср | < |
| 0 величина | ¶¶(TН) | < 0, | т.е. с |
| ||||||||
увеличением |
| температуры | тепловой |
| эффект | реакции | бу | ||||||||||||
|
|
|
|
|
|
|
|
|
| D |
|
|
|
|
|
|
|
|
|
уменьшаться; | 3) при Ср = 0, | — | ¶¶(TН) | = | 0, | т.е. тепловой эффект |
| ||||||||||||
реакции не зависит от температуры. | + |
| Ср |
|
|
|
|
|
|
| |||||||||
где | ( | ) | D | ( ) | Н° Т = | Н° 0 | ∫ |
| Т |
|
|
|
|
| |||||
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
Интегрируя уравнение (49), получаем |
| т D |
|
|
|
|
|
|
|
| |||||||||
| Н° Т и |
| Н° 0 | D | ( ) | D | ( ) |
|
| d |
| (51) |
|
|
| ||||
|
|
|
|
| — соответственно0 | тепловые | эффекты | реакции | |||||||||||
заданной температуре Т и абсолютном нуле.
где СP – разность изобарных теплоемкостей продуктов реакции и исходных веществ с
учетом количества молей реагентов (стехиометрических коэффициентов):
|
|
|
|
|
| i |
|
| i |
|
|
|
|
|
|
|
|
|
|
|
| DCP | = å(niCP,i )кон — å(ni CP,i )исх | (52) |
|
|
| ||||||||
|
|
|
|
|
| 1 |
|
| 1 |
|
|
|
|
|
|
|
|
Из уравнения (49) следует, что характер зависимости | |||||||||||||||||
HT = f(T) определяется | знаком | СP. Для | эндотермических | ||||||||||||||
реакций, | если | СP | > | 0, | то | с | увеличением | температуры | |||||||||
тепловой эффект возрастает. Для экзотермических | реакций | ||||||||||||||||
в | этом |
| случае |
| с | увеличением |
| температуры | |||||||||
наблюдаться |
| уменьшение | тепловыделения. | При | изменении | ||||||||||||
знака | СP | с | увеличением температуры на | зависимости HT = | |||||||||||||
f(T) появляется экстремум. |
|
|
|
|
|
|
|
|
|
| |||||||
Первое приближение |
| (Т – Т1) невелика, | можно принять | СP | |||||||||||||
Если разность | |||||||||||||||||
= const. Тогда | DH o | = DH o | + DC |
| × (T — T ) |
|
|
|
| ||||||||
|
|
|
|
| P | . |
|
| (53) | ||||||||
|
|
|
|
|
| T | T |
|
|
|
| 1 |
|
| |||
|
|
|
|
|
|
| 1 |
|
|
|
|
|
|
|
|
|
|
При |
|
| точных |
| расчетах |
|
| необходимо | учи | ||||||||
температурную | зависимость |
| СP = f(T). Так | как | для | ||||||||||||
каждого вещества, участвующего в химической реакции, | |||||||||||||||||
установлено |
| уравнение, | описывающее |
| зависимость | его | |||||||||||
теплоемкости от температуры, в степенной форме вида | |||||||||||||||||
(1.12) | и | (1.13), | то | в |
|
| этом |
| случае | разно | |||||||
Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа.
Рассмотренные ранее расчеты тепловых эффектов на основе законов Гесса по теплотам образования и сгорания ограничены стандартными условиями. Для практических целей необходимо рассчитать тепловые эффекты для конкретных усл, овийтличных от стандартных..
Тепловые эффекты хим. реакций зависят не только от природы реагирующих веществ, но и от внешних условий, прежде всего от температуры. Зависимость тепловых эффектов от температуры можно установить термодинамически.
Ранее на основании закона Гесса, мы установили что
1. изменение теплоты при p=const выражается через изменение энтальпии . QP =Н2-
Н1=D Н | (45) |
2. тепловой эффект реакций, протекающих при V=const выражается как изменение | |
внутренней энергии QV =U2-U1=D U (46)
Продифференцировав по температуре эти два уравнения, получим: | |||||||||||||||||
| ¶ | (TН) | = | ¶ | Н | − | ¶ | Н | = |
| (47) | ||||||
D |
|
|
|
|
|
|
|
|
|
| — |
| |||||
|
|
| ¶ | ) |
| = | ¶T |
| − | ¶T | = | — (48) | |||||
|
| ¶¶(T |
| ¶¶T |
| ¶¶T | |||||||||||
|
|
| D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где производная энтальпии | по | температуре- это теплоемкость при постоянном | |||||||||||||||
давлении, а производная внутренней | энергии | по температуре- теплоемкость при | |||||||||||||||
постоянном давлении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
Уравнения (47) и (48) можно представить в несколько измененном виде: | |||||||||||||||||
| ¶¶(TН) |
| = D | (49), |
| ¶¶(T |
| ) |
| = D |
| (50) | |||||
|
| D |
|
|
|
|
|
|
| D |
|
|
|
|
|
| |
Эта закономерность была установлена Кирхгофом. Закон Кирхгофа читается так:
температурный коэффициент теплового эффекта равен приращению теплоемкости в результате протекания процесса.
Закон Кирхгофа в дифференциальной форме позволяет определить лишь изменение теплового эффекта с изменением температуры, а не величину самого теплового эффекта.
При исследовании температурной зависимости тепловых эффектов реакций чаще используется уравнение(7.76), так как большинство
химических процессов протекает при постоянном давлении.

Согласно уравнению (49) влияние температуры на тепловой эффект
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| D |
|
обусловливается знаком величины Ср: 1) при Ср > 0 величина | ¶¶(TН) |
| |||||||||||||||||
> 0, т.е. | с увеличением | температуры | тепловой | эффект | реакции | ||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| D |
|
|
|
будет | возрастать, | 2) | при | Ср | < |
| 0 величина | ¶¶(TН) | < 0, | т.е. с |
| ||||||||
увеличением |
| температуры | тепловой |
| эффект | реакции | бу | ||||||||||||
|
|
|
|
|
|
|
|
|
| D |
|
|
|
|
|
|
|
|
|
уменьшаться; | 3) при Ср = 0, | — | ¶¶(TН) | = | 0, | т.е. тепловой эффект |
| ||||||||||||
реакции не зависит от температуры. | + |
| Ср |
|
|
|
|
|
|
| |||||||||
где | ( | ) | D | ( ) | Н° Т = | Н° 0 | ∫ |
| Т |
|
|
|
|
| |||||
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
Интегрируя уравнение (49), получаем |
| т D |
|
|
|
|
|
|
|
| |||||||||
| Н° Т и |
| Н° 0 | D | ( ) | D | ( ) |
|
| d |
| (51) |
|
|
| ||||
|
|
|
|
| — соответственно0 | тепловые | эффекты | реакции | |||||||||||
заданной температуре Т и абсолютном нуле.
где СP – разность изобарных теплоемкостей продуктов реакции и исходных веществ с
учетом количества молей реагентов (стехиометрических коэффициентов):
|
|
|
|
|
| i |
|
| i |
|
|
|
|
|
|
|
|
|
|
|
| DCP | = å(niCP,i )кон — å(ni CP,i )исх | (52) |
|
|
| ||||||||
|
|
|
|
|
| 1 |
|
| 1 |
|
|
|
|
|
|
|
|
Из уравнения (49) следует, что характер зависимости | |||||||||||||||||
HT = f(T) определяется | знаком | СP. Для | эндотермических | ||||||||||||||
реакций, | если | СP | > | 0, | то | с | увеличением | температуры | |||||||||
тепловой эффект возрастает. Для экзотермических | реакций | ||||||||||||||||
в | этом |
| случае |
| с | увеличением |
| температуры | |||||||||
наблюдаться |
| уменьшение | тепловыделения. | При | изменении | ||||||||||||
знака | СP | с | увеличением температуры на | зависимости HT = | |||||||||||||
f(T) появляется экстремум. |
|
|
|
|
|
|
|
|
|
| |||||||
Первое приближение |
| (Т – Т1) невелика, | можно принять | СP | |||||||||||||
Если разность | |||||||||||||||||
= const. Тогда | DH o | = DH o | + DC |
| × (T — T ) |
|
|
|
| ||||||||
|
|
|
|
| P | . |
|
| (53) | ||||||||
|
|
|
|
|
| T | T |
|
|
|
| 1 |
|
| |||
|
|
|
|
|
|
| 1 |
|
|
|
|
|
|
|
|
|
|
При |
|
| точных |
| расчетах |
|
| необходимо | учи | ||||||||
температурную | зависимость |
| СP = f(T). Так | как | для | ||||||||||||
каждого вещества, участвующего в химической реакции, | |||||||||||||||||
установлено |
| уравнение, | описывающее |
| зависимость | его | |||||||||||
теплоемкости от температуры, в степенной форме вида | |||||||||||||||||
(1.12) | и | (1.13), | то | в |
|
| этом |
| случае | разно | |||||||
2. 6. Зависимость теплового эффекта от температуры
Для какой-либо произвольной реакции
1A + 2B + … = 3C + 4D + …,
протекающей при постоянном давлении, тепловой эффект
Нp=3HС+4HD+ … –1HA–2HB– …,
где Hi– энтальпии реагирующих веществ. Так как (dH/dT)p=cp, т.е. изобарной теплоемкости вещества, то температурные изменения теплового эффекта
(dНp/dT)р=3(dHС/dT)р+4(dHD/dT)р+ … –1(dHA/dT)р–2(dHB/dT)р–…,
или в общем виде
(dНp /dT)р=(kcp,k)прод–(іcp,і)исхcp, (2.48)
где cp– изменение общей теплоемкости системы в результате полного протекания реакции. Интегрируя уравнение (2.21) в пределах температуры отT1доT2, получим:
. (2.49)
Рис.2.2. Зависимость теплоемкостей и тепловых эффектов от температуры
Уравнения (2.48) и (2.49) представляют дифференциальную и интегральную формууравнений Кирхгофа. В общем случае теплоемкость веществ зависит от температуры и для интегрирования нужно знать эту зависимость. Если температурный интервал небольшой или температурные измененияcpневелики, можно считать эту величину постоянной и тогда. (2.50)
Таким образом, температурные изменения теплового эффекта зависят от теплоемкости реагирующих веществ. Поскольку общая теплоемкость может увеличиваться (cp> 0) или уменьшаться (cp< 0), то и тепловой эффект может увеличиваться или уменьшаться по абсолютной величине при изменении температуры.
Для некоторых реакций возможно изменение знака ср при изменении температуры. Это объясняется тем, что теплоемкость исходных веществ и продуктов изменяются по-разному в зависимости от темпратуры – в одном температурном интервале(kcp,k)прод>(іcp,і)вих, а в другом –(kcp,k)прод<(іcp,і)вих. В таких случаях на зависимости тепловых эффектов от температуры наблюдается экстремум при температуре, когда(kcp,k)прод=(іcp,і)вих(рис. 2.2). Иногда встречаются реакции, для которыхср 0 в некотором температурном интервале и тепловой эффект практически не зависит от температуры.
Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
Согласно закону Гесса можно вычислить тепловой эффект реакции при той температуре (обычно 298 К), при которой известны теплоты образования или сгорания всех реагентов. Часто бывает необходимо знать тепловой эффект реакции при различных температурах.
Запишем термодинамическое уравнение в виде:
v1А1 + v2А2= v3А3+v4А4; ΔrН0(т)
Обозначив энтальпию образования i –того компонента, отнесенную к 1 молю через Нi, энтальпию реакции представим в виде
ΔrН0(т)= (v3Н3+v4Н4) — (v1Н1+v2Н2)
Продифференцируем данное уравнение по температуре при постоянном давлении:
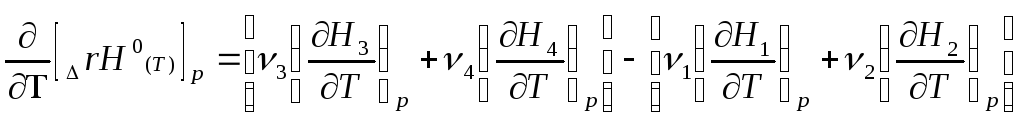 (1.37)
(1.37)
Как следует из уравнения (1.30), производная 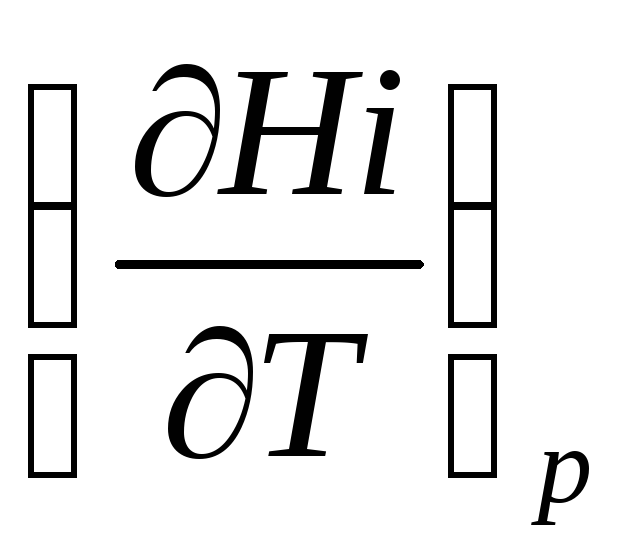 является
истинной теплоемкостьюi– того реагента. Из уравнения (1.37) получим
является
истинной теплоемкостьюi– того реагента. Из уравнения (1.37) получим
 [ΔrН0(т)]
[ΔrН0(т)] (1.38)
(1.38)
или
 [ΔrН0(т)]
[ΔrН0(т)] =ΔСр0(1.38а)
=ΔСр0(1.38а)
Частную производную от теплового эффекта по температуре можно заменить на полную:
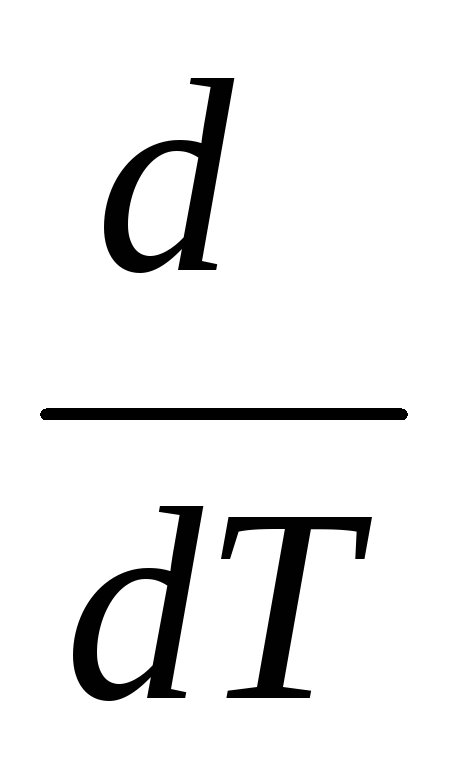 (ΔrН0(т))р=ΔСр0(1.39)
(ΔrН0(т))р=ΔСр0(1.39)
Или
d(ΔrН0(т)) =ΔСр0· dТ (1.40)
Выражения (1.39) и (1.40) называют уравнениями Кирхгофа в дифференциальном виде. Для практического применения интегрируют (1.40), используют неопределенный интеграл
ΔrН0(т)=ΔНI +  (1.41)
(1.41)
Где ΔНI—постоянная интегрирования или интегрируют в пределах от Т1до Т2.
В качестве нижнего предела интегрирования обычно выбирают Т1= 298 К, так какΔrН0298легко вычислить по следствиям из закона Гесса
ΔrН0(т )=ΔrН0298+
)=ΔrН0298+ (1.42)
(1.42)
В практике используют обе интегральные формулы. Формулы Кирхгоффа применяют в трех приближениях. В первом наиболее грубом полагают ΔСр = 0, т.е. считают равными суммарные теплоемкости продуктов и исходных веществ.
Тогда ΔrН0(т )=ΔrН0(т
)=ΔrН0(т )= const, т.е. тепловой эффект считают
независящим от температуры. Во втором,
более точном приближении считают
разность теплоемкостей постоянной
величинойΔСр0 = const;
тогдаΔСр0 можно
вывести за знак интеграла и для уравнения
(1.42) получим следующую формулу второго
приближения.
)= const, т.е. тепловой эффект считают
независящим от температуры. Во втором,
более точном приближении считают
разность теплоемкостей постоянной
величинойΔСр0 = const;
тогдаΔСр0 можно
вывести за знак интеграла и для уравнения
(1.42) получим следующую формулу второго
приближения.
ΔrН0(т )=ΔrН0298+ΔСр(Т2— 298)
)=ΔrН0298+ΔСр(Т2— 298)
В третьем, наиболее точном, приближении использования формулы Кирхгоффа учитывают зависимость ΔСрот температуры в виде степенного ряда Ср0= а + вТ. ЗависимостьΔСр0 =f(T) в общем виде записывается следующим образом:ΔСр0 =Δа +ΔвТ, гдеΔа = Σviai(продуктов реакции) — Σvjaj(исходных веществ)
Аналогично для Δв. При использовании формулы (1.42) при расчете в третьем приближении получим:
ΔrН0(т )=ΔrН0298+
)=ΔrН0298+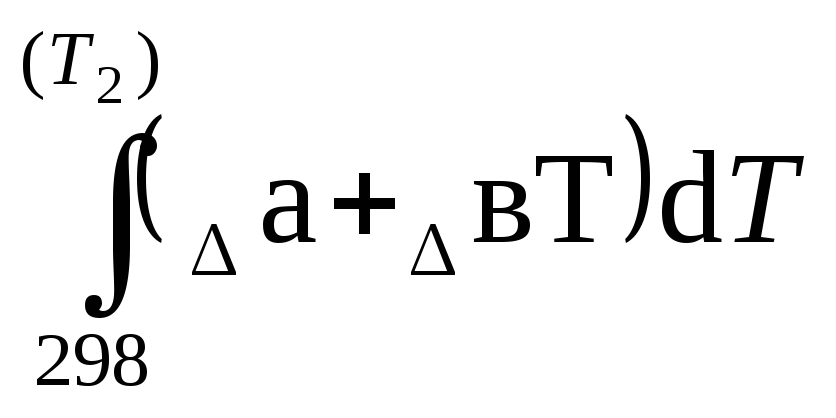
После интегрирования будем иметь:
ΔrН0(т )=ΔrН0298+Δа (Т2— 298) +
)=ΔrН0298+Δа (Т2— 298) +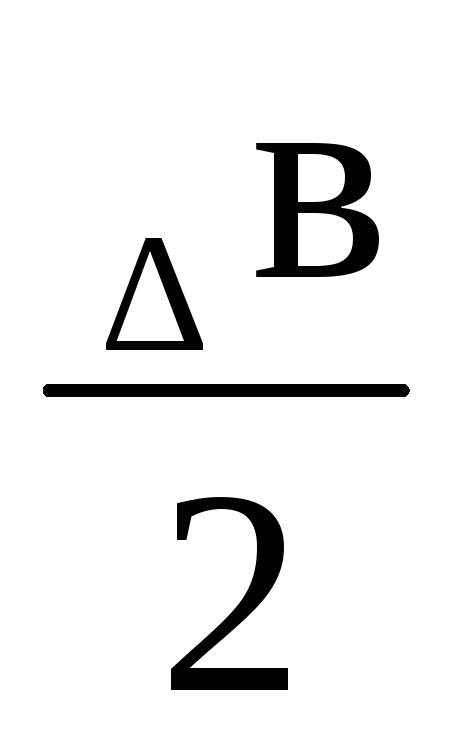 (Т22– 2982)
(Т22– 2982)
Рассмотрим примеры решения задач, основанных на первом и втором следствиях из закона Гесса.
Пример № 1.
Рассчитайте стандартную энтальпию (стандартный )тепловой эффект при постоянном давлении реакции
СН4(г) + 2О2(г) → СО2(г) + 2Н2О(ж)
Используя стандартные энтальпии образования исходных веществ и продуктов реакции.
Решение: По первому следствию из закона Гесса.
ΔгН0298= —
—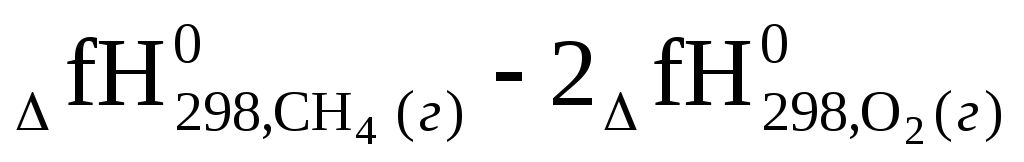 =
=
= -393,5 + 2(- 285,8) — (-74,9) — 0 = -890,2 кДж < 0
Пример № 2.
По термохимическому уравнению рассчитайте стандартную энтальпию образования исходного вещества
2КС1О3(кр)→ КС1(кр)+ 3О2(г); ΔгН0298 = -75,4 кДж.
Решение: По первому следствию из закона Гесса.
ΔгН0298= 2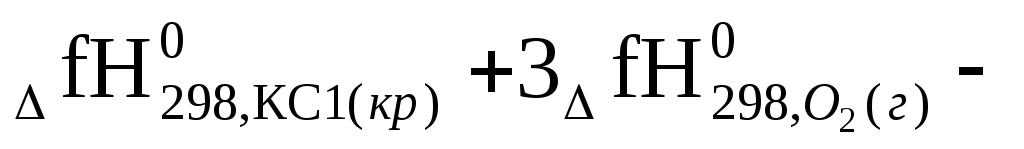
 ,
,
Следовательно,
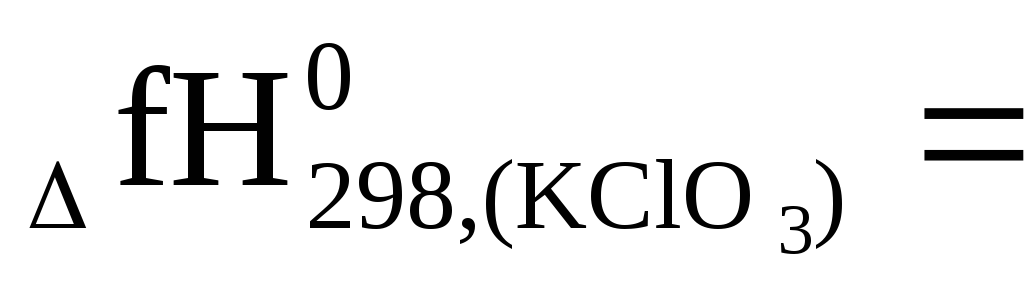 0,5 (2
0,5 (2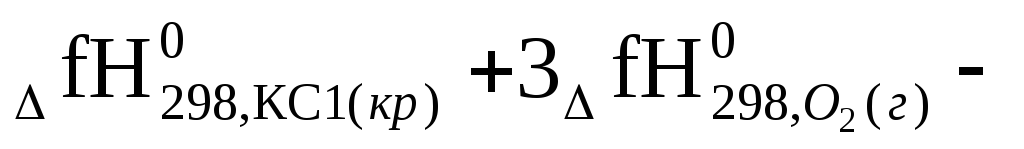
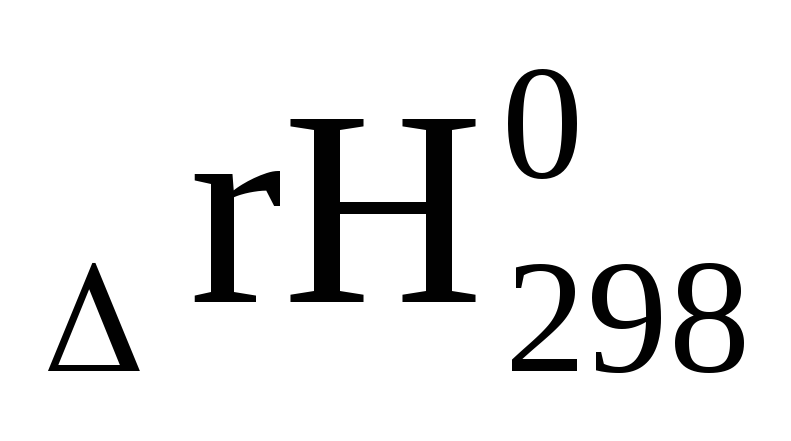 ,)
= 0,5 [(2(-436,7) + 0 – (-75,4)] =
,)
= 0,5 [(2(-436,7) + 0 – (-75,4)] =
= 0,5 (-873,4 + 75,4) = -399 кДж/моль
Пример № 3.
Для реакции 2NO(г)+ О2(г)→ 2NO2(г)рассчитайте стандартные тепловые эффекты при постоянном давлении (Qр=ΔгН0298) и объеме (Qv=ΔгU0298)
Решение:
Стандартный тепловой эффект при постоянном давлении найдем по первому следствию из закона Гесса
Qр=ΔгН0298=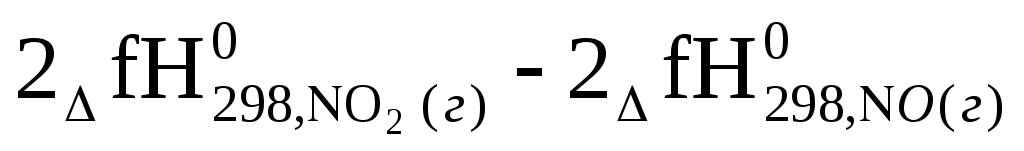 –
– 2 * 34,2 – 2 * 91,3 — 0 = -114,2 кДж =
2 * 34,2 – 2 * 91,3 — 0 = -114,2 кДж =
= — 114200Дм
По уравнению ΔгН0298=ΔгU0298+ΔVгRT
Qv=ΔгU0298=ΔгН0298—ΔVгRT
Для данной реакции ΔVг = 2 – (2+1) = — 1 моль
Стандартный тепловой эффект при постоянном объеме
Qv=ΔгU0298= — 114200 – (-1) * 8,31 * 298 = — 111724 Дж = — 111,7 кДж
Пример № 4.
Стандартные энтальпии сгорания ацетилена С2Н2(г) и бензола С6Н6(г)соответственно равны – 1300 и – 3302 кДж /моль. Рассчитайте стандартную энтальпию реакции циклизации ацетилена.
3С2Н2(г)→ С6Н6(г)
Решение: По второму следствию из закона Гесса
ΔгН0298=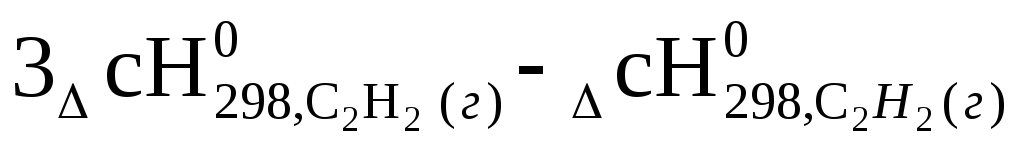 =
3 (- 1300) – (- 3302) = — 598 кДж
=
3 (- 1300) – (- 3302) = — 598 кДж
1.1.6 Способы определения тепловых эффектов при постоянной температуре
Все способы определения тепловых эффектов реакции основаны на законе Гесса. Применение закона Гесса основано на том, что с термохимическими уравнениями можно оперировать так же, как с алгебраическими.
Термохимические уравнения – уравнения реакций, для которых указываются числовые значения тепловых эффектов.
Они могут быть записаны двумя способами:
N2 + 3H2 = 2 NH3 – 91,88 кДж или
N2 + 3H2 = 2 NH3, ΔН = — 91,88 кДж
Наиболее распространенными способами определения тепловых эффектов являются следующие:
1. Непосредственно из закона Гесса
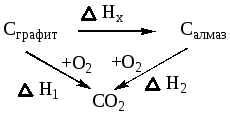
Можно выделить два пути перехода из графита в С02:
— сгоранием Cграфита,:
— через образование Cалмаза и далее сгорания Салмаза. Теплоты для разных путей равны
Н1 = Нх + Н2
Нх = Н1 — Н2
2. Из теплот образования
Нреак. =
niН0f (кон) —
niН0f(нач)
3. Из теплот сгорания
Нреак. =
niН0сг(нач) —
niН0сг(кон)
4. Комбинированием.
Рассмотрим применение этого метода на примере.
Н айти
теплоту реакции
айти
теплоту реакции
если известны тепловые эффекты реакций:
|
|
Реакции (а) и (б) следует переписать так, чтобы вещества в них находились в той части уравнения, в которой они присутствуют в искомом уравнении. То есть, если в искомом уравнении в левой части находятся С и О2, а в правой СО, то и в уравнениях (а) и (б) они должны находиться там же. Уравнение (а) этому соответствует, его не изменяем, а уравнение (б) переписываем, меняя местами компоненты:

Сложением этих уравнений мы пытаемся получить искомое уравнение. Но в уравнении (б) в правой части 2СО, а в искомом СО, значит все (б) уравнение надо умножить на 1/2, получим уравнение б’:
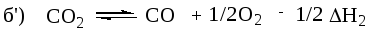
Складываем теперь уравнения (а) и (б’), взаимно уничтожая С02, получаем
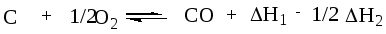
Сравнивая полученное уравнение с искомым, видим, что
НХ = Н1 — 1/2Н2
1.1.7 Зависимость теплового эффекта реакции от температуры
Приведенные ранее способы расчета тепловых эффектов применимы для определения Н при постоянной температуре (чаще всего стандартной, 298 К).
При температурах, отличных от стандартной, используют уравнение Кирхгофа.
В дифференциальном виде оно имеет вид,
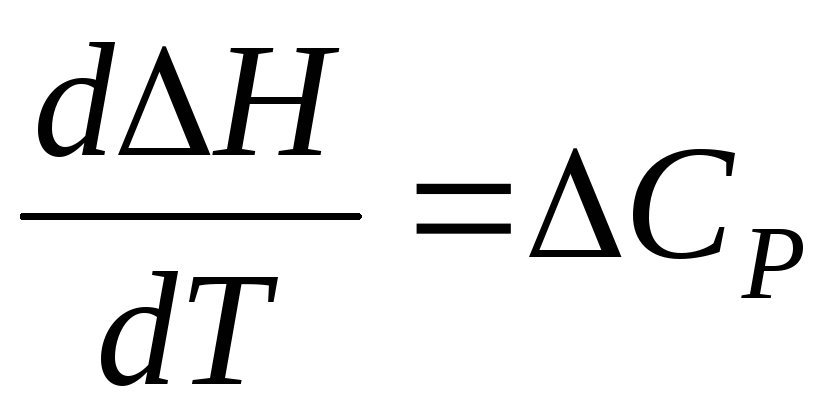 (1.5)
(1.5)
где  есть
разность между суммарными теплоемкостями
продуктов реакции
(конечных веществ) и исходных веществ
(начальных).
есть
разность между суммарными теплоемкостями
продуктов реакции
(конечных веществ) и исходных веществ
(начальных).
Анализ уравнения (1.5)
1. Если СР >0, то первая производная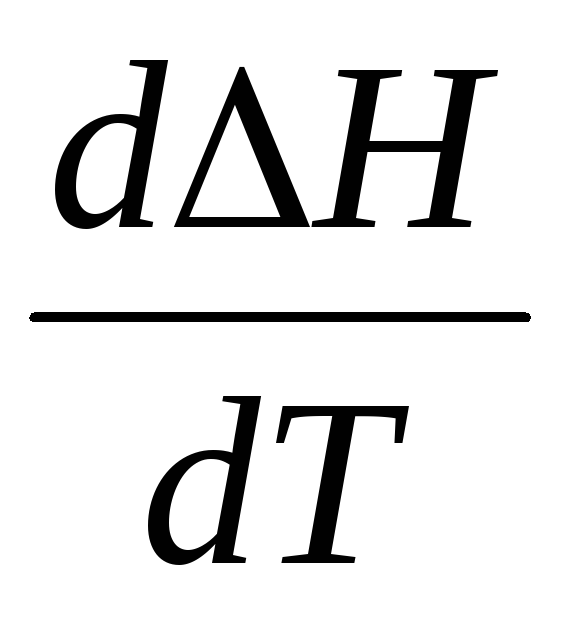 >
0, следовательнофункция
Н
растет с ростом температуры, то есть
тепловой эффект
возрастает, независимо от знака самого
теплового эффекта (рисунок 1.2 а).
>
0, следовательнофункция
Н
растет с ростом температуры, то есть
тепловой эффект
возрастает, независимо от знака самого
теплового эффекта (рисунок 1.2 а).
2. Если СР < 0, то первая производная 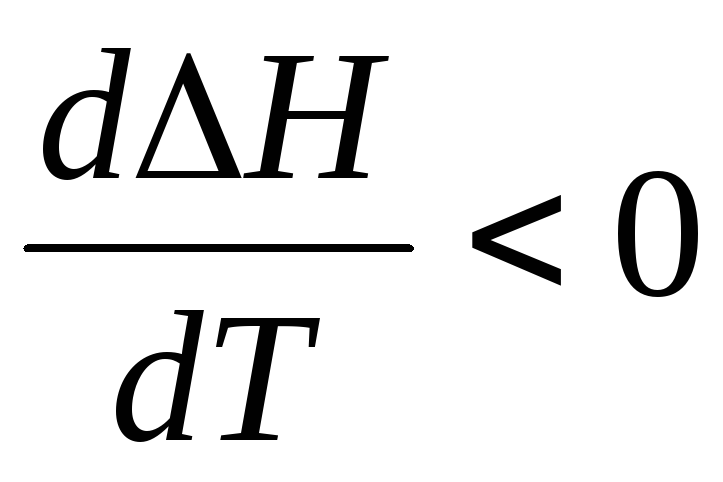 ,
следовательно,функция
Н
убывает с ростом температуры.
,
следовательно,функция
Н
убывает с ростом температуры.
3. Если СР=
0, то первая производная 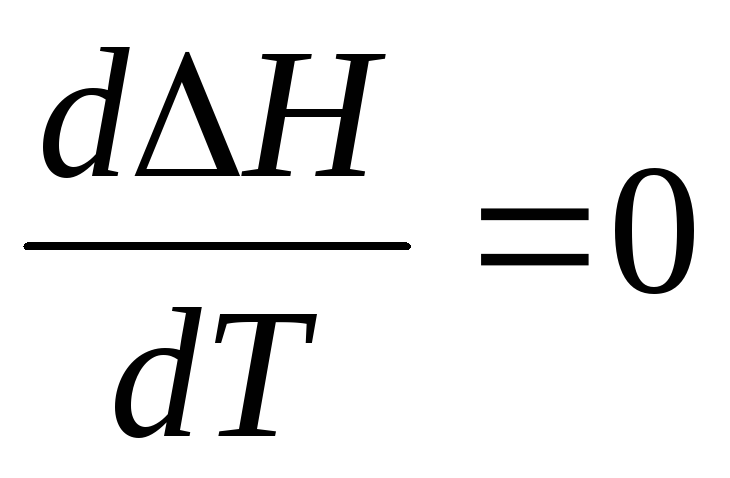 .
В этом случае Н
= const,
то есть не зависит от температуры. Если
.
В этом случае Н
= const,
то есть не зависит от температуры. Если  при одной температуре, то при этой
температуре будет экстремум (рисунок
1.2 б).
при одной температуре, то при этой
температуре будет экстремум (рисунок
1.2 б).

Рисунок 1.2 – Зависимость теплового эффекта от температуры
Интегрирование уравнения Кирхгофа приводит к уравнению, позволяющему рассчитать тепловой эффект реакции при любой температуре:
 (1.6)
(1.6)
где Н2 — тепловой эффект реакции при любой температуре; H1 — тепловой эффект реакции при Т1, рассчитанный одним из ранее приведенных способов; Ср — разность между суммарными теплоемкостями продуктов реакции и исходных веществ.
Расчет интеграла в уравнении 1.6 возможен с разной степенью точности:
1. 
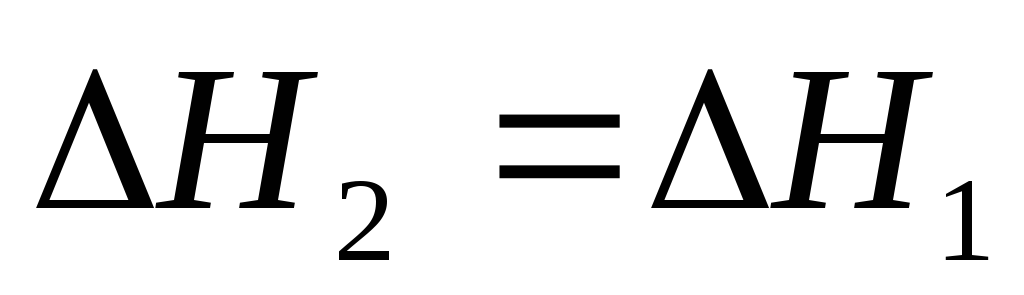
Это возможно в случае небольшого температурного интервала, а также в случае больших значений теплового эффекта, когда температурной зависимостью можно пренебречь.
2. 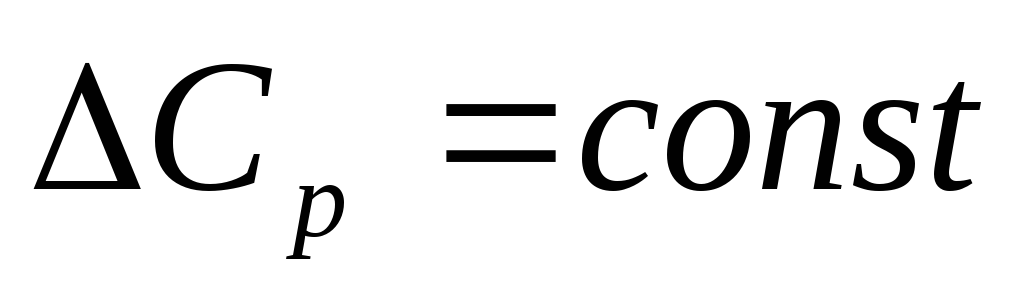
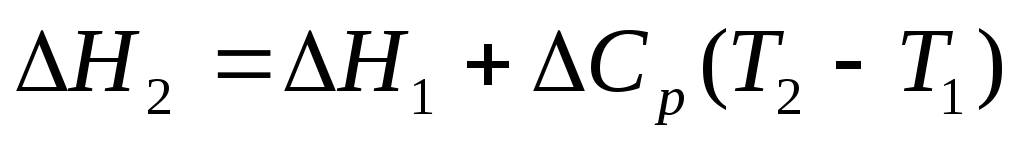
Если
значение 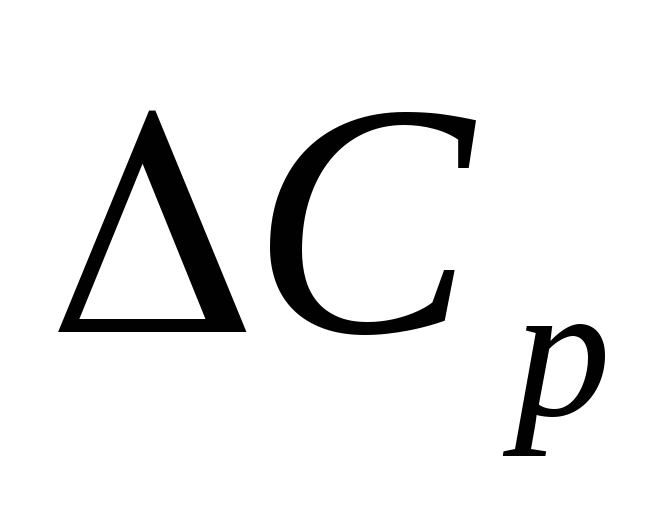 в данном температурном интервале
неизвестно, можно принять
в данном температурном интервале
неизвестно, можно принять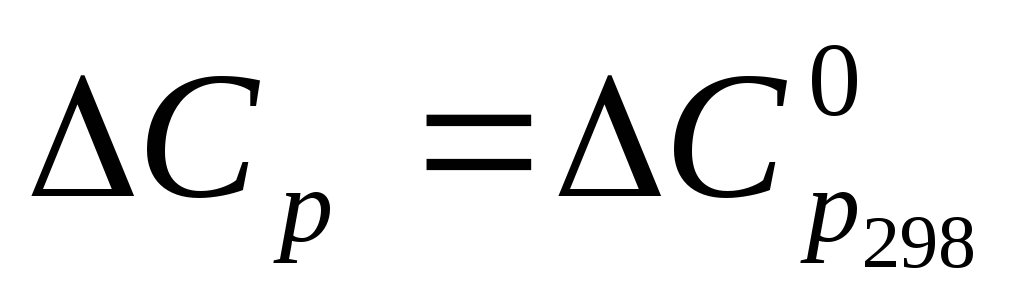 .
.
3. 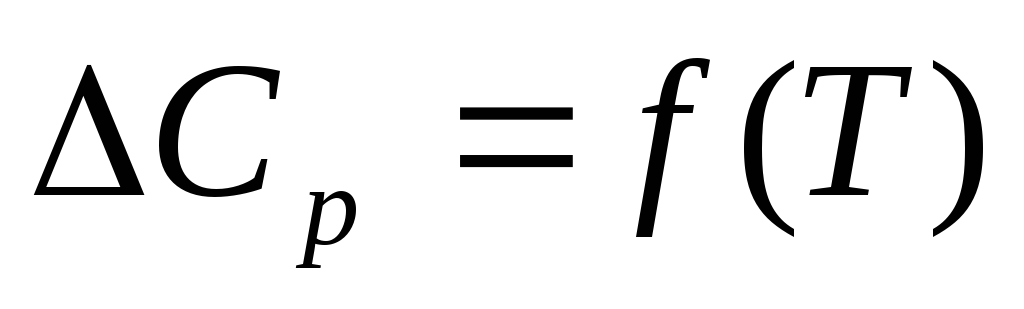 .
Обычно эта зависимость может быть
получена из интерполяционных уравнений
для Ср (1.4):
.
Обычно эта зависимость может быть
получена из интерполяционных уравнений
для Ср (1.4):
∆Ср = ∆а + ∆вТ +∆сТ2 + ∆сlТ -2 (1.7)
где ; Δв, Δс, Δсl находятся аналогично.
Подстановка уравнения 1.7 в уравнение 1.6 и интегрирование дает развернутое уравнение Кирхгофа:
 (1.8)
(1.8)
Анализ температурной зависимости ΔН = f(T)
1. Исследование на экстремум.
Признаком
существования экстремума является
обращение в нуль первой производной
исследуемой функции ΔН = f
(T),
т.е. 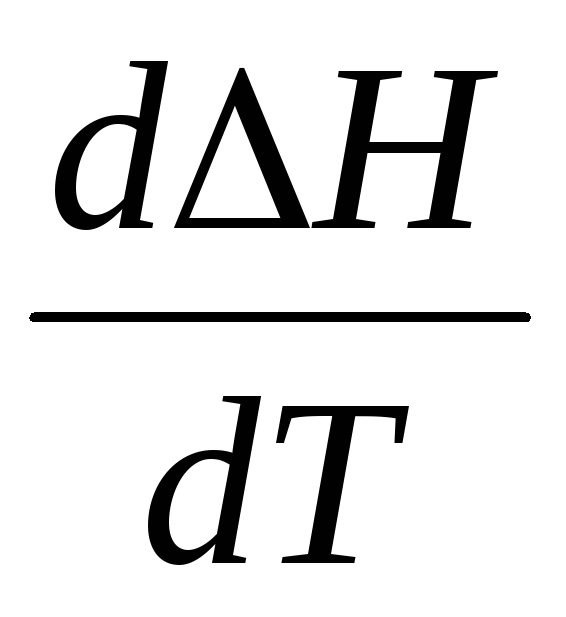 по уравнению (1.8).
по уравнению (1.8).
Из уравнения Кирхгофа:
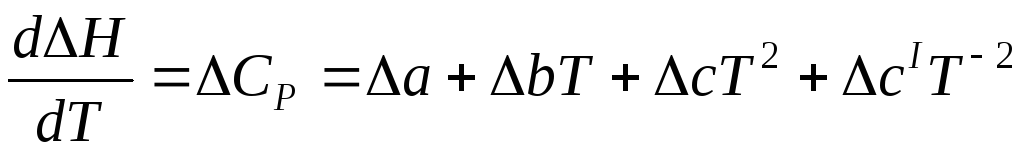 (1.9)
(1.9)
Приравнивая к нулю
полученное выражение, рассчитывается
температура, при которой производная
обращается в нуль. Приближенно можно
ограничиться двумя слагаемыми в уравнении
(1.9), т.е. 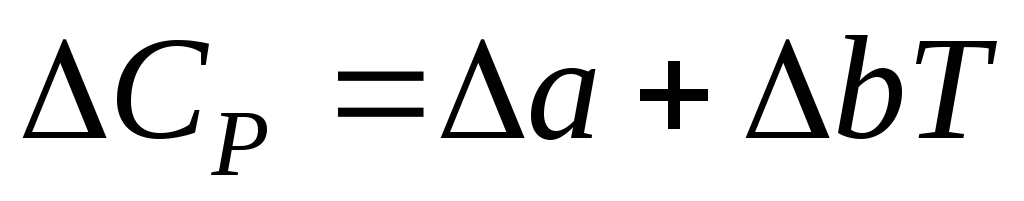 .
.
Если Т > 0 и ее значение лежит в интервале температур, в пределах которых действуют интерполяционные уравнения (интервалы указаны в справочнике), значит экстремум на кривой ΔН = f (T) существует. Для уточнения, какой именно экстремум (максимум или минимум) следует взять вторую производную и определить ее знак:
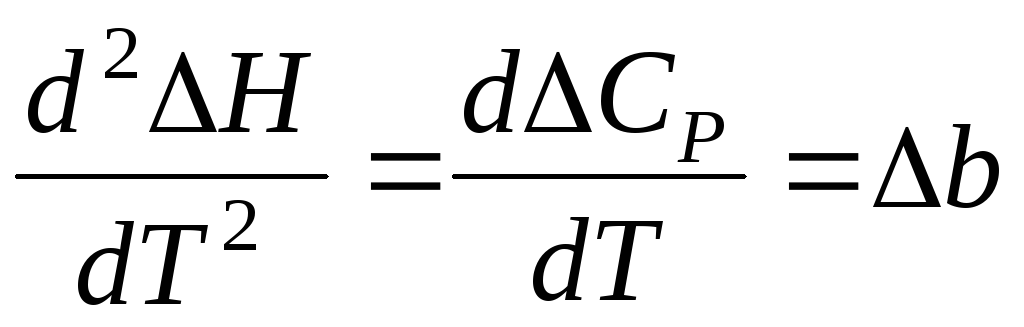
Если  > 0, то имеет место минимум, если
> 0, то имеет место минимум, если < 0, то максимум.
< 0, то максимум.
Если же Т < 0 или лежит вне интервала температур, значит экстремум отсутствует и в исследовании функции переходим к пункту 2.
2. Для определения возрастающей или убывающей функции следует определить знак первой производной:
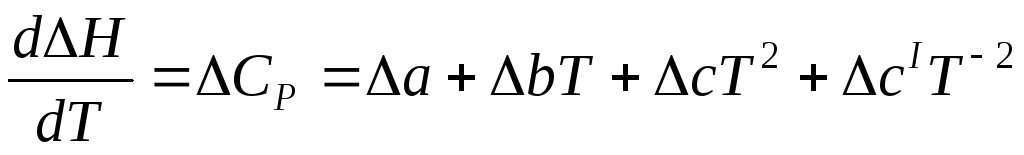
В это уравнение
подставляется любая температура, взятая
внутри интервала, и рассчитывается 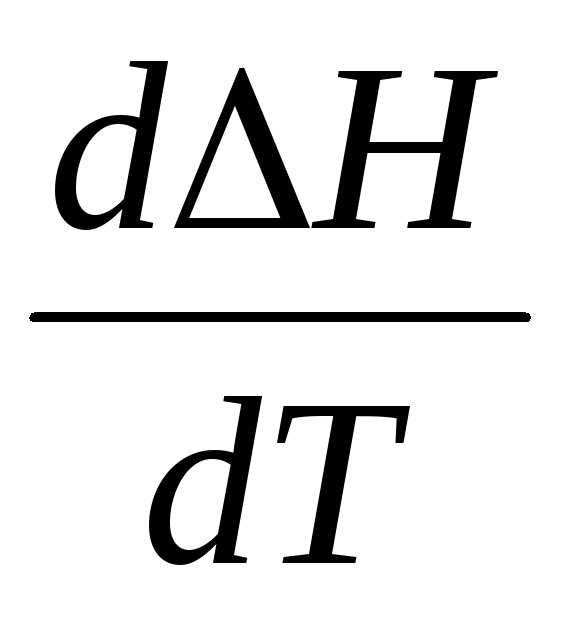 :
если
:
если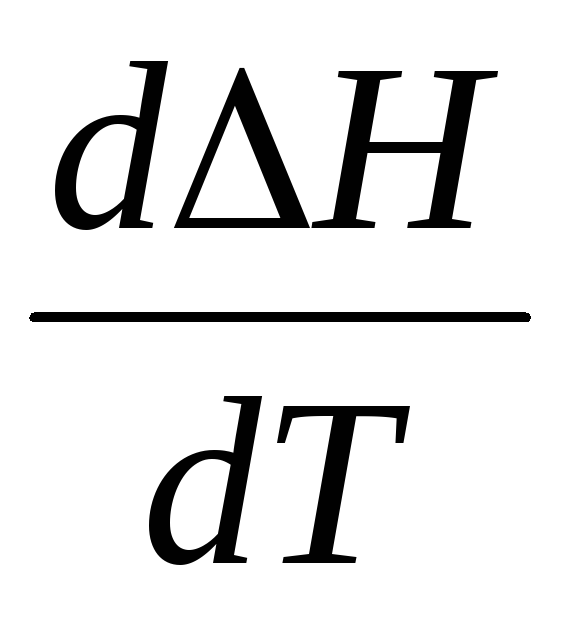 > 0, то ΔН — возрастающая функция; если
> 0, то ΔН — возрастающая функция; если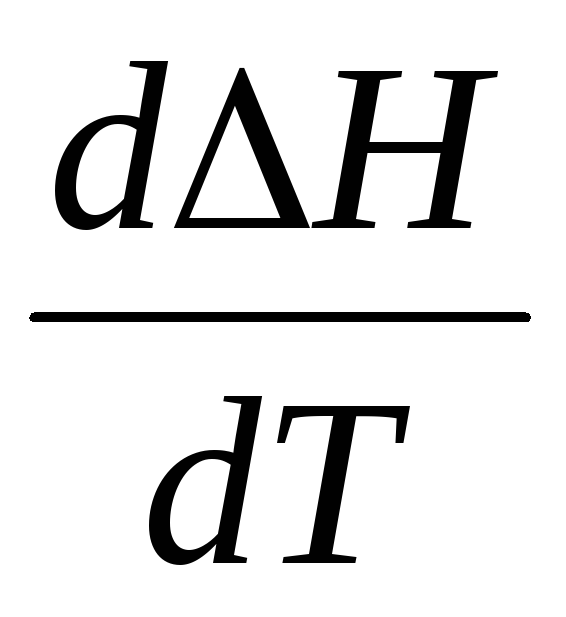 < 0, то убывающая функция.
< 0, то убывающая функция.
Для уточнения хода кривой определяют вторую производную и ее знак:
 > 0, то кривая
вогнутая, при
> 0, то кривая
вогнутая, при 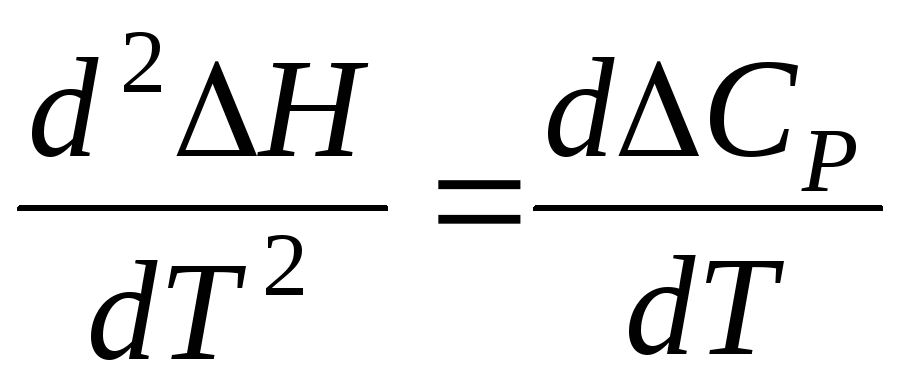 <0 — выпуклая.
<0 — выпуклая.
Как зависит от температуры тепловой эффект этой реакции?
Подборка по базе: Существенное наказание предусматривается только в тех случаях.do, ЕГЭ-2010. Физика. Тренировочная работа 4 (вар.1-2) (ответы тольк, статья Работаем только творчески.doc.
Как зависит от температуры тепловой эффект этой реакции?
Выберите один ответ:
a. Тепловой эффект реакции повышается с ростом Т
b. По данному графику невозможно сделать вывод о влиянии температуры на тепловой эффект
c. Тепловой эффект реакции уменьшается с ростом Т
d. Тепловой эффект реакции с ростом Т сначала повышается, затем понижается
e. Тепловой эффект реакции не зависит от температуры
f. Тепловой эффект реакции с ростом Т сначала понижается, затем возрастает
Правильный ответ: По данному графику невозможно сделать вывод о влиянии температуры на тепловой эффект
45. Формула для вычисления работы расширения идеального газа.Поставьте в соответствие
Изотермический процесс Ответ 1
Изобарный процесс Ответ 2
Изохорный процесс Ответ 3
Правильный ответ: Изотермический процесс – W=RT*ln(V2/V1), Изобарный процесс – W=P(V2-V1), Изохорный процесс – W=0
46. При плавлении теплоемкость вещества
Выберите один ответ:
a. повышается только у простых веществ, у сложных — понижается
b. понижается
c. повышается
d. не изменяется
e. может, как повышаться, так и понижаться
Правильный ответ: повышается
47. Вычислите работу расширения 2 моля идеального газа при нагревании его на 20 градусов в изобарных условиях.
Универсальную газовую постоянную считать равной 8,3Дж/(моль*К).
Ответ введите цифрами.
Размерность (Дж) не указывайте.
Правильный ответ: 332
48. Сколько независимых компонентов содержится в системе, представляющей из себя водный раствор соли NaCl?
Выберите один ответ:
a. Один, поскольку, по закону Гесса, при стандартных условиях в системе не может содержаться более одного компонента
b. два: соль и вода.
c. Недостаточно данных, чтобы ответить на вопрос
d. три: катион Na+, анион Cl- и вода.
e. один, поскольку это истинный раствор
Правильный ответ: два: соль и вода.
49. Химический реактор, накрытый крышкой и обогреваемый снаружи, можно с достаточной точностью назвать
Выберите один ответ:
a. Закрытой термодинамической системой
b. Аномальной термодинамической системой
c. Изолированной термодинамической системой
d. Адиабатической термодинамической системой
e. Открытой термодинамической системой
Правильный ответ: Закрытой термодинамической системой
50. Определите, какое количество теплоты необходимо для нагревания 6 моль вещества от минус 15 до плюс 15 оС, если известно, что при начальной температуре вещество находится в твердом состоянии, а при минус 10 оС вещество плавится. Известна теплота плавления 7,4 кДж/моль. Известны теплоемкости вещества в твердом и жидком состояниях – соответственно, 3 и 5 Дж/(мольК)
Ответ укажите в Дж.
Ответ введите цифрами.
Введите только число, размерность (Дж) не указывайте.
Правильный ответ: 45240
51. Для некоторого вещества известны теплоты кристаллизации (20 КДж/моль) и конденсации (45 КДж/моль). Определите теплоту сублимации данного вещества.
Ответ введите цифрами.
Размерность (КДж/моль) не указывайте.
В случае, если ответ является отрицательным числом, перед ним поставьте знак «минус» без пробелов.
Правильный ответ: -65
52. На рисунке приведены зависимости суммарных теплоемкостей исходных веществ и продуктов для некоторой реакции от температуры.

Как зависит от температуры тепловой эффект этой реакции?
Выберите один ответ:
a. По данному графику невозможно сделать вывод о влиянии температуры на тепловой эффект
b. Тепловой эффект реакции с ростом Т сначала понижается, затем возрастает
c. Тепловой эффект реакции уменьшается с ростом Т
d. Тепловой эффект реакции повышается с ростом Т
e. Тепловой эффект реакции с ростом Т сначала повышается, затем понижается
f. Тепловой эффект реакции не зависит от температуры
Правильный ответ: Тепловой эффект реакции с ростом Т сначала понижается, затем возрастает
53. Некоторое твердое вещество может находиться в двух кристаллических модификациях – альфа и бета. Известны теплоты плавления альфа-кристаллов (минус 50 КДж/моль) и бета-кристаллов (минус 43 КДж/моль). Определите тепловой эффект перехода из альфа в бета-модификацию.
Ответ введите цифрами.
Размерность (КДж/моль) не указывайте.
В случае, если ответ является отрицательным числом, перед ним поставьте знак «минус» без пробелов.
Правильный ответ: -7
54. Выберите все верные высказывания
Выберите один или несколько ответов:
a. -Термодинамической системой называют реально или мысленно отделенную от всего окружающего (от внешней среды) группу тел или отдельное тело.
b. -Термодинамическая система может иметь различные размеры – от нескольких молекул до вселенной в целом.
c. -Термодинамика рассматривает макроскопические свойства тел без учета их внутренней структуры.
Правильный ответ: -Термодинамической системой называют реально или мысленно отделенную от всего окружающего (от внешней среды) группу тел или отдельное тело., -Термодинамика рассматривает макроскопические свойства тел без учета их внутренней структуры.
55. При любом фазовом переходе в чистом веществе теплоемкость этого вещества
Выберите один ответ:
a. не изменяется
b. равна нулю
c. изменяется скачкообразно
d. равна единице
e. равна стандартной теплоемкости
Правильный ответ: изменяется скачкообразно
56. Вставьте пропущенный текст:
Тепловой эффект прямой реакции _______________________ тепловому эффекту обратной реакции.
Выберите один ответ:
a. равен по величине и по знаку
b. противоположен по величине и равен по знаку
c. обратно пропорционален
d. равен по величине и противоположен по знаку
e. противоположен по величине и по знаку
Правильный ответ: равен по величине и противоположен по знаку
57. Выберите правильную запись
Выберите один ответ:
a. СV = dG/dT
b. СV = dH*dT
c. СV = dU*dT
d. СV = dU/dT
e. СV = dH/dT
Правильный ответ: СV = dU/dT
58. Что общего между теплотой и работой?
Выберите один ответ:
a. Обе измеряются в кДж/К
b. Обе являются характеристическими функциями
c. Обе являются формами передачи энергии
d. Ничего общего.
e. Обе являются функциями состояния
Правильный ответ: Обе являются формами передачи энергии
59. ΔСр в законе Кирхгофа – это
Выберите один ответ:
a. ни один из ответов не верен
b. сумма концентраций продуктов и исходных веществ
c. разность концентраций продуктов и исходных веществ
d. теплоемкость исходных веществ
e. сумма теплопроводностей продуктов и исходных веществ
Правильный ответ: ни один из ответов не верен
60. Определите тепловой эффект реакции C6H6(ж)=3С2Н2(г) при стандартных условиях, если известны стандартные теплоты сгорания исходных и конечных веществ:
ΔсН298 o(С2Н2(г)) = -1300кДж,
ΔсН298 o (C6H6(ж)) = -3268кДж.
Ответ приведите в кДж. Введите только число, размерность указывать не нужно.
Правильный ответ: 632
61. Некоторое количество идеального газа нагревают в изобарных условиях с 370 до 390 К. При этом газ совершает работу расширения, равную 332 Дж.
Сколько моль газа участвует в процессе?
Универсальную газовую постоянную считать равной 8,3Дж/(моль*К).
Правильный ответ: 2
62. Определите, какое количество теплоты необходимо для нагревания 2 моль вещества от 280 до 410 К, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
СР = 28 + 0,01Т
Ответ укажите в Дж.
Ответ введите цифрами.
Введите только число, размерность (Дж) не указывайте.
Правильный ответ: 1877
64. В изобарном процессе к системе подведено некоторое количество теплоты. Какая запись походит для описания этого процесса:
Выберите один ответ:
a. ΔU = 30 кДж
b. ΔU = –30 кДж
c. ΔG = 30 кДж
d. ΔG = –30 кДж
e. ΔН = 30 кДж
f. ΔН = – 30 кДж
Правильный ответ: ΔН = 30 кДж
65. В каком случае, в соответствии с законом Кирхгофа, тепловой эффект реакции не зависит от температуры?
Выберите один ответ:
a. если процесс протекает в адиабатических условиях
b. если реакция идет до конца
c. если реакция идет при постоянном объеме
d. если теплоемкости продуктов реакции и исходных веществ одинаковы
e. если теплоемкости продуктов реакции и исходных веществ равны нулю
Правильный ответ: если теплоемкости продуктов реакции и исходных веществ одинаковы
66. Система представляет из себя насыщенный водный раствор соли КCl, на дне которого лежат кристаллы нерастворившейся соли. Сколько независимых компонентов содержится в системе, и какие это компоненты?
Выберите один ответ:
a. три: катион К+, анион Cl- и вода
b. два: кристаллы соли и водный раствор соли
c. Недостаточно данных, чтобы ответить на вопрос
d. два: соль и вода.
e. три: соль в растворе, кристаллическая соль и вода
Правильный ответ: два: соль и вода
67. Найдите все верные высказывания:
В уравнении Ван-дер-Ваальса (P+a2/V2)(V-b)=RT
Выберите один или несколько ответов:
a. коэффициент b учитывает объем занимаемый самими молекулами
b. коэффициент b учитывает среднюю скорость движения молекул
c. коэффициент а учитывает силы взаимодействия между молекулами
d. коэффициент а учитывает углы и длины в молекулах
Правильный ответ: коэффициент b учитывает объем занимаемый самими молекулами , коэффициент а учитывает силы взаимодействия между молекулами
68. Продолжите высказывание: Идеальный газ — это такой газ, в котором предполагается, что:
Выберите один ответ:
a. — столкновения молекул друг с другом невозможны
b. — все молекулы движутся с одинаковой скоростью
c. — молекулы не имеют формы, размеров
d. — молекулы не имеют массы;
Правильный ответ: — молекулы не имеют формы, размеров
69. Вставьте пропущенное слово
Теплоемкостьюсистемы называется отношение количества теплоты, подведенной к системе, к повышению —————, которое при этом происходит.
Выберите один ответ:
a. Плотности
b. Температуры
c. Объема
d. Теплоты
e. Энергии
Правильный ответ: Температуры
70. Выберите все верные высказывания
Выберите один или несколько ответов:
a. -Термодинамика рассматривает макроскопические свойства тел без учета их внутренней структуры.
b. -Термодинамической системой называют реально или мысленно отделенную от всего окружающего (от внешней среды) группу тел или отдельное тело.
c.-Термодинамическая система может иметь различные размеры – от нескольких молекул до вселенной в целом
Правильный ответ:
-Термодинамической системой называют реально или мысленно отделенную от всего окружающего (от внешней среды) группу тел или отдельное тело.,
-Термодинамика рассматривает макроскопические свойства тел без учета их внутренней структуры.
71. Какое из веществ является простым
Выберите один ответ:
a. Хлор Сl2 (газ)
b. Газообразная соляная кислота HCl
c. Сжиженный хлор Сl2
d. Атомарный хлор Cl
e. Ион хлора Сl-
Правильный ответ: Хлор Сl2 (газ)
72. Закончите высказывание: При приближении температуры к абсолютному нулю теплоемкость правильного кристалла чистого вещества ____________
Выберите один ответ:
a. принимает постоянное значение, характерное для данного вещества
b. равна универсальной газовой постоянной
c. становится равной единице
d. также стремится к нулевому значению
e. стремится к максимуму
Правильный ответ: также стремится к нулевому значению
73. Определите, какое количество теплоты необходимо для нагревания 2 моль вещества от 97 до 137 оС, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
СР = 44 + 0,08Т
Ответ укажите в Дж.
Ответ введите цифрами.
Введите только число, размерность (Дж) не указывайте.
Правильный ответ: 6016
74. Система представляет из себя два жидких слоя: сверху водный раствор йода, нижний слой – четыреххлористый углерод (ССl4), также содержащий растворенный йод. Химических реакций в системе не протекает. Сколько независимых компонентов содержится в системе, и какие это компоненты?
Выберите один ответ:
a. два: водный раствор йода и раствор йода в ССl4
b. четыре: вода, йод в воде, ССl4, йод в ССl4
c. три: четыреххлористый углерод, йод и вода.
d. Один, поскольку, по закону Гесса, при стандартных условиях в системе не может содержаться более одного компонента
e. более четырех, так как надо учесть, что вода и ССl4 частично растворяются друг в друге
Правильный ответ: три: четыреххлористый углерод, йод и вода.
75. Какое из веществ является простым:
Выберите один ответ:
a. Вода Н2О (газ)
b. Жидкий кислород
c. Атомарный кислород О
d. Кислород O2 (газ)
e. Озон O3 (газ)
Правильный ответ: Кислород O2 (газ)
76. Некоторое количество идеального газа нагревают в изобарных условиях с 250 до 260 К. При этом газ совершает работу расширения, равную 83 Дж.
Сколько моль газа участвует в процессе?
Универсальную газовую постоянную считать равной 8,3Дж/(моль*К).
Ответ введите цифрами.
Размерность (моль) не указывайте.
Правильный ответ: 1
77. Какие из перечисленных величин в общем случае не являются функциями состояния т.е. зависят от пути процесса? Выберите все верные варианты
Выберите один или несколько ответов:
a. внутренняя энергия
b. давление в системе
c. Теплота
d. работа
e. температура
f. энтальпия
g. объем системы
h. внутренняя энергия
Правильный ответ: Теплота, работа
78. Продолжите высказывание: Идеальный газ — это такой газ, в котором предполагается, что:
Выберите один ответ:
a. — все молекулы движутся с одинаковой скоростью
b. — столкновения молекул друг с другом невозможны
c. — молекулы не имеют формы, размеров
d. — молекулы не имеют массы;
Правильный ответ: — молекулы не имеют формы, размеров
79. Для некоторого вещества известны теплоты кипения (минус 40 КДж/моль) и сублимации (минус 60 КДж/моль). Определите теплоту плавления данного вещества.
Ответ введите цифрами.
Размерность (КДж/моль) не указывайте.
В случае, если ответ является отрицательным числом, перед ним поставьте знак «минус» без пробелов.
Правильный ответ: -20
80. От системы отводится некоторое количество теплоты. Какое численное значение может иметь эта теплота?
Выберите один ответ:
a. Минус 10 кДж/К
b. 10 кГц
c. 10 кДж
d. 10 кДж/К
e. Минус 10 кДж
Правильный ответ: Минус 10 кДж
81. ΔСр в законе Кирхгофа рассчитывается как
Выберите один ответ:
a. ни один из ответов не верен
b. произведение теплоемкостей исходных веществ и продуктов
c. сумма теплоемкостей исходных веществ и продуктов
d. отношение теплоемкостей исходных веществ и продуктов
e. разность теплоемкостей исходных веществ и продуктов
f. разность теплоемкостей продуктов и исходных веществ
Правильный ответ: разность теплоемкостей продуктов и исходных веществ
82. Определите тепловой эффект реакции ZnSO4(тв)=ZnO(тв)+SO3(г) при стандартных условиях, если известны стандартные теплоты образования исходных и конечных веществ:
Δfh398 o(ZnSO4(тв)) = -981кДж,
Δfh398 o(ZnO(тв)) = -348кДж,
Δfh398 o(SO3(г)) = -396кДж.
Ответ приведите в кДж. Введите только число, размерность указывать не нужно.
Правильный ответ: 237
83. Максимальное количество работы можно получить при
Выберите один ответ:
a. адиабатическом нагревании реального газа и изобарно-изохорном расширении
b. обратимом изохорном процессе
c. обратимом изотермическом расширении идеального газа
d. необратимом изотермическом расширении идеального газа против вакуума
e. необратимом изотермическом расширении идеального газа против постоянного давления
Правильный ответ: обратимом изотермическом расширении идеального газа
84. Какая из записей уравнения закона Кирхгофа верна
Выберите один ответ:
a. ΔHТ = Δh398 – ΔСр(Т–298)
b. Ни один из вариантов не верен
c. ΔHТ = ТΔh398 + ΔСр
d. ΔHТ = Δh398 – ΔСр(Т+298)
e. ΔHТ = – Δh398 – ΔСр(Т+298)
Правильный ответ: Ни один из вариантов не верен
85. На рисунке приведены зависимости суммарных теплоемкостей исходных веществ и продуктов для некоторой реакции от температуры. Как зависит от температуры тепловой эффект этой реакции?

Выберите один ответ:
a. Тепловой эффект реакции с ростом Т сначала понижается, затем возрастает
b. Тепловой эффект реакции с ростом Т сначала повышается, затем понижается
c. Тепловой эффект реакции уменьшается с ростом Т
d. Тепловой эффект реакции не зависит от температуры
e. По данному графику невозможно сделать вывод о влиянии температуры на тепловой эффект
f. Тепловой эффект реакции повышается с ростом Т
Правильный ответ: Тепловой эффект реакции с ростом Т сначала повышается, затем понижается
86. Вставьте пропущенный текст:
Теплотой сгорания называется изменение энтальпии в реакции окисления одного моля данного вещества __________________________c образованием высших окислов соответствующих элементов
Выберите один ответ:
a. при условии, что все продукты сгорания выводятся из системы
b. в адиабатических условиях
c. кислородом
d. при постоянстве объема системы
e. сильным окислителем
Правильный ответ: кислородом
87. Функцией состояния называют такую термодинамическую функцию ——————-
Выберите один ответ:
a. Изменение которой в каком-либо процессе равно нулю
b. Изменение которой в каком-либо процессе не зависит от состояния продуктов реакции
c. Изменение которой в каком-либо процессе не зависит от состояния исходных веществ
d. Изменение которой в каком-либо процессе зависит от пути процесса
e. Изменение которой в каком-либо процессе не зависит от пути процесса, а только от начального и конечного состояния системы
Правильный ответ: Изменение которой в каком-либо процессе не зависит от пути процесса, а только от начального и конечного состояния систем
88. Для некоторого вещества известны теплоты плавления (минус 50 КДж/моль) и конденсации (25 КДж/моль). Определите теплоту сублимации данного вещества.
Ответ введите цифрами.
Размерность (КДж/моль) не указывайте.
В случае, если ответ является отрицательным числом, перед ним поставьте знак «минус» без пробелов.
Правильный ответ: -75
89.
Выберите один ответ:
a. ΔU = 5кДж
b. ΔU = –5 кДж
c. ΔG = –5 кДж
d. Ни один из ответов не подходит
e. ΔG = 5 кДж
Правильный ответ: ΔU = –5 кДж
90. Какое из веществ является простым:
Выберите один ответ:
a. Фуллерен
b. Алмаз
c. Аморфный углерод
d. Графит
e. Графен
Правильный ответ: Графит
91. Вычислите работу расширения 3 моля идеального газа при нагревании его на 30 градусов в изобарных условиях.
Универсальную газовую постоянную считать равной 8,3Дж/(моль*К).
Ответ введите цифрами.
Размерность (Дж) не указывайте.
Правильный ответ: 747
92. Определите тепловой эффект реакции N2O4(г)=2NO2(г) при стандартных условиях, если известны стандартные теплоты образования исходных и конечных веществ:
Δ f h3980 (N2O4(г)) = 11кДж,
Δ f h398 0(NO2(г)) = 34кДж.
Ответ приведите в кДж. Введите только число, размерность указывать не нужно.
Правильный ответ: 57
93. Теплоемкость чистого вещества стремится к нулю при
Выберите один ответ:
a. — плавлении
b. -сублимации
c. -кипении
d. -кристаллизации
e. -любом фазовом переходе
f. -ни в одном из перечисленных случаев
Правильный ответ: -ни в одном из перечисленных случаев
94. ΔСр в законе Кирхгофа – это
Выберите один ответ:
a. разность концентраций продуктов и исходных веществ
b. сумма теплопроводностей продуктов и исходных веществ
c. ни один из ответов не верен
d. теплоемкость исходных веществ
e. сумма концентраций продуктов и исходных веществ
Правильный ответ: ни один из ответов не верен