Плотность серы (S), значение и примеры
Плотность серы и другие её физические свойства
Обычная модификация твердой серы в узлах кристаллической структуры содержит молекулы S8. Она образует две кристаллические модификации, существующие при температуре, близкой к комнатной. Это так называемые ромбическая и моноклинная (или, что то же, моноклиническая, призматическая) сера. Иначе их называют a- и b- формой соответственно. Точка перехода ромбической серы в моноклинную лежит при 95oС. Хотя a- и b-формы серы имеют один и тот же молекулярный состав, они, кристаллизуясь, образуют различные кристаллические структуры.
Рис. 1. Аллотропные модификации серы.
Важнейшие константы серы представлены в таблице ниже:
Таблица 1. Физические свойства и плотность серы.
|
Характеристика |
Ромбическая сера |
Моноклинная сера |
|
Цвет |
светло-желтый порошок |
Желтые иглы |
|
Плотность, г/см3 |
2,07 |
1,98 |
|
Температура плавления, oС |
112,8 |
119,3 |
|
Температура кипения, oС |
444,6 |
|
Распространенность серы в природе
Сера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) и служат источником получения цветных металлов.
Из соединений серы в природе также распространены сульфаты, главным образом, кальция и магния; соединения серы содержатся в организмах растений и животных.
Общее содержание серы земной коре составляет приблизительно 0,1%.
Краткая характеристика химических свойств и плотность серы
Сера охотно (в сравнительно мягких условиях) взаимодействует со многими металлами и неметаллами. Примером может служит её реакция с металлической медью:
Cu + S = CuS + Q.
С другими металлами, например с железом и цинком, сера реагирует менее энергично. С неметаллами сера также активно взаимодействует. Например, пропускание паров серы над углеродом приводит к образованию сероуглерода CS2 (жидкость при обычных условиях). Взаимодействуя при комнатной температуре с фтором, сера загорается, образуя шестифтористую серу SF6, которая имеет практическое значение как газообразный диэлектрик и источник атомарного фтора.
S + H2 = H2S;
S + O2 = SO2;
S + 3F
S + Cl2 = SCl2;
2S + C = CS2.
Сера не реагирует с жидкой водой, иодом. Окисляется концентрированными серной и азотной кислотами, подвергается дисмутации в растворах щелочей и гидрата аммиака.
S + 2H2SO4(conc) = 3SO2 + 2H2O;
S + 6HNO3(conc) = H2SO4 + 6NO2 + 2H2O;
4S + 6NaOH(conc) = Na2SO3S + 2Na2S + 3H2O.
Примеры решения задач
ru.solverbook.com
Плотность серы жидкой — Справочник химика 21
Двуокись серы кипит при —10°, но она может быть сжижена при комнатной температуре под давлением. Плотность жидкой двуокиси серы при 20° равна 1,45. Вследствие весьма низкой температуры кипения двуокись серы очень легко отгоняется из смеси с нефтяными продуктами ее низкая вязкость и высокая плотность способствуют легкому разделению двух фаз при отстаивании. [c.313]Плотность жидкой серы, г/мл [c.254]
Из-за этого явление получило образное название оловянная чума . Плотность серого олова меньше чем белого, в результате чего при сильных морозах оловянные предметы становятся хрупкими и превращаются в порошок. Вследствие разрушения паяных оловом сосудов с жидким топливом в 1912 г. погибла экспедиция Скотта к Южному полюсу,— Прим. ред. [c.488]
Получаемая в жидком виде сера отделяется от раствора вследствие разности плотностей и имеет чистоту 99,9-99,97 . [c.88]
В начальный момент, при загрузке реактора горячим сырьем, стенки камеры разогреваются. Происходит усиленное выделение паров и на дне реактора накапливается жидкая масса — тяжелая часть загрузки. При незначительном уровне жидкости в реакторе дистиллят, проходящий через верх реактора, представляет собой в основном малоизмененные фракции исходного сырья. В этом случае процесс испарения преобладает над процессом разложения, что и приводит к высоким значениям плотности и вязкости дистиллята, его коксуемости и содержания в нем серы. Выход продуктов разложения в этот период относительно мал.
Поместите в пробирку несколько кусочков серы и, осторожно нагревая ее, чтобы сера не воспламенилась, заметьте происходящие в пробирке изменения. При П3° С сера плавится, выше 155° С буреет, при 190° С становится весьма вязкой, не выливается из пробирки (проверьте), но затем вязкость снова уменьшается, и при 300° С жидкость становится легкоподвижной. Наконец, при 445° С сера закипает. Наблюдаемые изменения связаны со способностью серы образовать различные модификации, отличающиеся плотностью и температурами плавления. Модификации серы составлены из молекул Sg, расположенных в пространстве и соединенных между собой разными способами. В жидкой сере часть молекул диссоциирует и [c.227]
При обыкновенной температуре и атмосферном давлении диоксид серы — бесцветный газ с характерным резким запахом. Он легко конденсируется. Уже при охлаждении смесью льда ссольюдо—10°Спринормальном давлении он сжижается в бесцветную жидкость, затвердевающую при —72,7° С в белое кристаллическое вещество. Плотность жидкого диоксида серы (при —10° С) 1,46 критическая температура 157,2° С, критическое давление 77,7 атм. [c.570]
Химические свойства вещества не зависят от агрегатного состояния, а физические свойства зависят. Так, сера в любом агрегатном состоянии при сгорании образует сернистый газ, т.е. проявляет одно и то же химическое свойство, но физические свойства серы в разных агрегатных состояниях весьма различны например, плотность твердой серы равна 2,1 г/см , жидкой серы 1,8 г/см и газообразной серы 0,004 г/см .
Плотность, см т. пл., С 1.14 (жидкий, —183°С) —219 2,06 (ромбическая) 112,8 (ромбическая) 445 2,80 (серый) 217,4 6.24 450 9,5 250 [c.307]
Мышьяк. Пары мышьяка так же, как и фосфора, до 800° С состоят из молекул As 4. Выше 800° С они диссоциируют в заметных количествах на молекулы Asa. При 1700° С диссоциация на молекулы Asj заканчивается. Если пары мышьяка конденсируются на поверхности, охлаждаемой жидким воздухом, то образуется желтый мышьяк. Его свойства похожи на свойства белого фосфора, плотность равна 1,97 г/мл, решетка кубическая, как у кристаллов а-формы белого фосфора. Желтый мышьяк неустойчив. Он легко переходит в металлический или серый мышьяк. Это наиболее устойчивая и наиболее плотная модификация мышьяка. Его плотность при 20° С равна 5,20 г/мл. [c.206]
Свойства. Г,-светло-серый металл с синеватым оттенком, Расплав Г, может находиться в жидком состоянии прн т-рах ниже т-ры плавления в течение неск, месяцев. Кристаллич, решетка устойчивой модификации I (нли а см, табл, и рис,) образована двухатомными молекулами с длиной связи 0,244 нм, к-рые сохраняются и в жидком металле в парах Г, одноатомен. Из переохлажденного дисперги-ров, металла кристаллизуются неустойчивые модификации-р, V, 8 и е прн давлениях выше 1,14 и 3,0 ГПа обнаружены модификации соотв, II и III существуют также еше две метастабильные фазы Г, Конденсацией паров при 4,2 К получен аморфный галлий. Т. кип. 2205 °С плотность жидкого 6,0948 г/см Ср 26,07 ДжДмоль К) АН п 271 кДж/моль (О К) 55,, 40,81 ДжДмоль-К), Ур-иия температурных зависимостей давления пара над жидким в-вом, плотности и поверхностного натяжения [c.479]
Сырье и продукция. Сырьем являются гидроочищенные дизельные фракции, пределы выкипания которых зависят от требований, предъявляемых к извлекаемым парафинам. При получении жидких парафинов, используемых в производстве синтетического белка, на адсорбционное извлечение направляется гидроочищенная дизельная фракция 200—320 °С со следующими показателями качества плотность Р4° = 0,8250,845 йодное число содержание серы ароматических углеводородов [c.142]
В качестве сырья используют смеси жидких продуктов нефтяного (60—70 % об.) и каменноугольного (30—40 % об.) происхождения. Из продуктов нефтепереработки наиболее широко применяют термогазойль, зеленое масло, экстракты газойлей каталитического крекинга, а из продуктов коксохимии — антраценовое масло, хризеновую фракцию и пековый дистиллят. Сырье представляет собой углеводородные фракции, выкипающие при температуре выше 200 °С и содержащие значительное количество ароматических углеводородов (60— 90 % масс.). Применяемое сырье в соответствии с требованиями стандартов контролируется по следующим показателям плотность, индекс корреляции, показатель преломления, вязкость, содержание серы, влаги и механических примесей, коксуемость. [c.108]
Сера, получаемая в жидком виде, отделяется от раствора вследствие разницы плотностей, степень чистоты серы 99,92—99,97%. Пары, конденсируемые после разложения раствора, представляют собой чистый сернистый аммоний. [c.296]
Для решения данных задач было предложено несколько схем стабилизации, в результате применения которых получены жидкие продукты следующего качеств
www.chem21.info
Серые плотности — Справочник химика 21
Получение нефтяного кокса, отвечающего всем требованиям потребителей, возможно при постоянстве качества исходного сырья. В зависимости от качества сырья получаемые в процессах коксования и прокаливания нефтяные коксы различаются по своей структуре и свойствам. Наряду с широко известными физико-химическими свойствами кокса (содержание летучих веществ и серы, плотность, зольность, реакционная способность, электрическая проводимость, теплопроводность и др.) важное значение приобретают также физико-механические свойства — прочность, сыпучесть, коэффициенты внутреннего и внешнего трения, углы естественного откоса, гранулометрический состав, степень уплотнения, сегрегация и т. д. Знание этих свойствСодержание серы, % Плотность . [c.236]
Массовая доля общей серы, % Плотность при 20 °С, г/см [c.209]
Содержание серы, % Плотность. . . . Октановое число в чистом виде…… [c.12]Если раньше предусматривалось только достижение высокой степени подготовки нефти (по содержанию воды, солей, механических примесей, ДНП), то теперь дополнительно стали учитывать физико-химические свойства нефтей содержание серы, плотность и другие потребительские характеристики. [c.83]
В результате анализа проб необходимо определить плотность и количество темной части (соляра) содержание в ней серы плотность и количество светлой части, содержание в ней органики состав и плотность сухой части газов Одновременно с пробоотбором измеряют скорость, температуру газов окисления температуру и давление сухой части газа перед ротаметром, расход сухой части газа температуру и давление (полное, статическое, динамическое) в газоходе. [c.456]
Контролируемыми показателями, в соответствии с ГОСТ Р 51858 являются массовая доля серы %), плотность (кг/м ), выход фракций (%), массовая доля парафина (%), массовая доля воды (%), концентрация хлористых солей (мг/дм ), массовая доля механических примесей (%), давление насыщенных паров (мм рт. ст.), содержание хлорорганических соединений (млн ), массовая доля сероводорода (млн ), массовая доля метил- и этилмеркаптанов (млн ). [c.494]
При разгонке получают узкие (обычно десятиградусные) фракции, из которых смешением получают бензин, керосин, дизельное топливо, соответствующие по фракционному составу и другим параметрам (вязкость, содержание серы, плотность и т.д.) требованиям стандарта. [c.36]
Пределы кипения, °С Выход на фракцию, % вес. Содержание серы, % Плотность еГ Молекулярный вес 20 По Удельная дисперсия Vao, сст Содержание, % [c.73]
Ромбическая модификация серы —желтые кристаллы (плотность 2,07), хорошо растворимые во многих органических растворителях и обесцвечивающиеся при охлаждении ниже —50°. Если эти кристаллы нагревать медленно, то при 95,5° они перейдут в моноклинную серу (плотность 1,96), которая затем плавится при 119,3°. Плавление кристаллов сопровождается значительным уменьшением объема (около 15%), и при этом образуется подвижная светло-желтая жидкость (Я-модификация серы), вязкость которой падает при дальнейшем нагреве от 119 до 155°. [c.117]
Сергеевская нефть девонского горизонта по своим физико-хими-ческим свойства] отличается как от высокосернистых нефтей северо-западных месторождений, так и от туймазинской нефти по содержанию серы, плотности, количеству и характеру асфальтово-смолистых веществ (табл. 1). [c.4]
Сера, 5 — продукт желтого цвета разных оттенков. В воде нерастворима, но хорошо растворяется в ряде органических жидкостей (сероуглероде, гидрированном нафталине, хлорированном бензоле), а также в хлористой сере. Плотность 2,07 г/см , темп. пл. 113°С. [c.61]
Сер — плотность воздуха при давлении р [c.127]
Установлено , что вулканизация, как и окисление каучуков, протекает с участием свободных радикалов, причем одновременно образуются серные связи различной степени сульфидности (от 1 до 20 атомов серы). Плотность образующейся при вулканизации сетки, распределение и степень сульфидности серных связей в основном обусловливают работоспособность вулканизатов. [c.226]
Контролируемыми показателями, в соответствии с ГОСТ Р 51858 являются массовая доля серы (%), плотность (кг/м ), выход фракций (%), массовая доля парафина (%), массовая доля воды (%), концентрация хлористых солей (мг/дм ), мас- [c.482]
Сера Плотность плавления [c.242]
www.chem21.info
Концентрация и плотность серной кислоты. Зависимость плотности серной кислоты от концентрации в аккумуляторе автомобиля
Разбавленная и концентрированная серная кислота — это настолько важные химические продукты, что в мире их вырабатывается больше, чем любых других веществ. Экономическое богатство страны может быть оценено по объему производимой в ней серной кислоты.
Процесс диссоциации
Серная кислота находит применение в виде водных растворов различной концентрации. Она подвергается реакции диссоциации в два этапа, производя H+-ионы в растворе.
H2SO4 = H+ + HSO4— ;
HSO4— = H + + SO4-2 .
Серная кислота является сильной, и первый этап ее диссоциации происходит настолько интенсивно, что практически все исходные молекулы распадаются на H+-ионы и HSO4 -1 -ионы (гидросульфата) в растворе. Последние частично распадаются дальше, выделяя другой H+-ион и оставляя сульфат-ион (SO4-2 ) в растворе. Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H+ и SO4-2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Свойства серной кислоты
Она является особенной в том смысле, что может действовать как обычная кислота или как сильный окислитель — в зависимости от ее температуры и концентрации. Холодный разбавленный раствор серной кислоты реагирует с активными металлами с получением соли (сульфата) и выделением газа водорода. Например, реакция между холодной разбавленной Н2SO4 (в предположении ее полной двухэтапной диссоциации) и металлическим цинком выглядит так:
Zn + Н2SO4 =ZnSO4 + H2.
Горячая серная кислота концентрированная, плотность которой около 1,8 г/см3, может действовать в качестве окислителя, реагируя с материалами, которые обычно инертны к кислотам, такими, например, как металлическая медь. В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.
Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2 O.

Как вообще выражается концентрация растворов
Собственно, концентрация любого раствора может быть выражена различными способами, но наиболее широко используется весовая концентрация. Она показывает количество граммов растворенного вещества в определенной массе или объеме раствора или растворителя (обычно 1000 г, 1000 см3, 100 см3 и 1 дм3). Вместо массы вещества в граммах можно брать его количество, выраженное в молях, – тогда получается молярная концентрация на 1000 г или 1 дм3 раствора.
Если молярная концентрация определена по отношению не к количеству раствора, а только к растворителю, то она носит название моляльности раствора. Для нее характерна независимость от температуры.
Зачастую весовую концентрацию указывают в граммах на 100 г растворителя. Умножая этот показатель на 100 %, получают ее в весовых процентах (процентная концентрация). Именно этот способ является наиболее часто употребляемым в применении к растворам серной кислоты.
Каждой величине концентрации раствора, определенной при данной температуре, соответствует вполне конкретная его плотность (например, плотность раствора серной кислоты). Поэтому иногда раствор характеризуют именно ею. Например, раствор Н2SO4, характеризующийся процентной концентрацией 95,72 %, имеет плотность 1,835 г/см3 при t = 20 °С. Как же определить концентрацию такого раствора, если дана только плотность серной кислоты? Таблица, дающая такое соответствие, является неотъемлемой принадлежностью любого учебника по общей или аналитической химии.
Пример пересчета концентрации
Попробуем перейти от одного способа выражения концентрации раствора к другому. Предположим, что мы имеем раствор Н2SO4в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
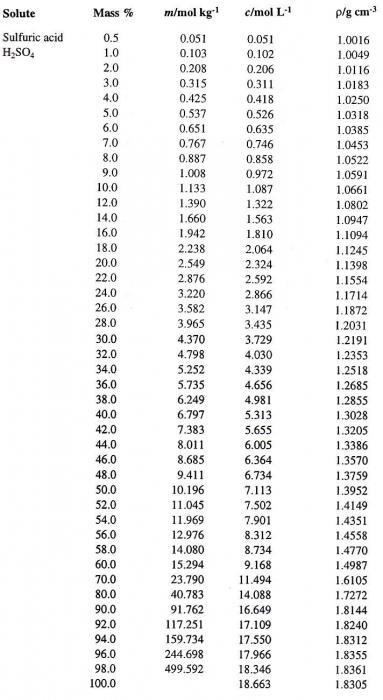
По ней определяем искомую величину, которая равна 1,4987 г/см3. Вычислим теперь молярность данного раствора. Для этого необходимо определить массу Н2SO4в 1 л раствора и соответствующее ей число молей кислоты.
Объем, который занимают 100 г исходного раствора:
100 / 1,4987 = 66,7 мл.
Так как в 66,7 миллилитрах 60%-ного раствора содержится 60 г кислоты, то в 1 л ее будет содержаться:
(60 / 66,7) х 1000 = 899, 55 г.
Молярный вес серной кислоты равен 98. Отсюда число молей, содержащихся в 899,55 г ее граммах, будет равно:
899,55 / 98 = 9,18 моль.
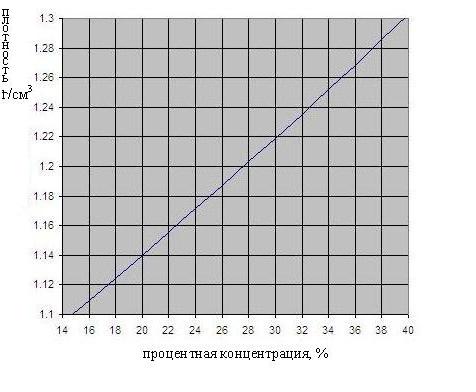
Зависимость плотности серной кислоты от концентрации приведена на рис. ниже.
Использование серной кислоты
Она применяется в различных отраслях промышленности. В производстве чугуна и стали она используется для очистки поверхности металла, прежде чем он покрывается другим веществом, участвует в создании синтетических красителей, а также других типов кислот, таких как соляная и азотная. Она также применяется в производстве фармпрепаратов, удобрений и взрывчатых веществ, а еще является важным реагентом при удалении примесей из нефти в нефтеперерабатывающей промышленности.
Это химическое вещество является невероятно полезным и в быту, и легко доступно как раствор серной кислоты, используемый в свинцово-кислотных аккумуляторных батареях (например, тех, что стоят в автомобилях). Такая кислота, как правило, имеет концентрацию примерно от 30% до 35% H2SO 4 по весу, остальное — вода.
Для многих бытовых приложений 30% Н2SO4 будет более чем достаточно, чтобы удовлетворить свои потребности. Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем — на втором этапе — поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Плотность серной кислоты и ее сорта
Хотя почти 99%-ную серную кислоту можно получить кратковременно при кипении, но последующая потеря SO3 в точке кипения приводит к снижению концентрации до 98,3%. Вообще, разновидность с показателем 98% более устойчива в хранении.
Товарные сорта кислоты различаются по ее процентной концентрации, причем для них выбраны те ее значения, при которых минимальны температуры кристаллизации. Это сделано для уменьшения выпадения кристаллов серной кислоты в осадок при транспортировке и хранении. Основные сорта таковы:
- Башенная (нитрозная) — 75 %. Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
- Контактная — 92,5-98,0 %. Плотность серной кислоты 98%-ной этого сорта равна 1836,5 кг/м3. Получают ее также из обжигового газа, содержащего SO2, причем процесс включает окисление двуокиси до ангидрида SO3 при ее контакте (отсюда и название сорта) с несколькими слоями твердого ванадиевого катализатора.
- Олеум — 104,5 %. Плотность его равна 1896,8 кг/м3. Это раствор SO3 в H2SO4, в котором первого компонента содержится 20 %, а кислоты — именно 104,5 %.
- Высокопроцентный олеум — 114,6 %. Его плотность – 2002 кг/м3.
- Аккумуляторная — 92-94 %.
Как устроен автомобильный аккумулятор
Работа этого одного из самых массовых электротехнических устройств полностью основана на электрохимических процессах, происходящих в присутствии водного раствора серной кислоты.
Автомобильный аккумулятор содержит разбавленный серно-кислотный электролит, а также положительный и отрицательный электроды в виде нескольких пластин. Положительные пластины выполнены из красновато-коричневого материала — диоксида свинца (PbO2), а отрицательные — из сероватого «губчатого» свинца (Pb).
Поскольку электроды изготовлены из свинца или свинцовосодержащего материала, то этот тип батареи часто называют свинцово-кислотным аккумулятором. Работоспособность его, т. е. величина выходного напряжения, напрямую определяется тем, какова в данный момент времени плотность серной кислоты (кг/м3 или г/см3), залитой в аккумулятор в качестве электролита.
Что происходит с электролитом при разряде аккумулятора
Электролит свинцово-кислотного аккумулятора представляет собой раствор аккумуляторной серной кислоты в химически чистой дистиллированной воде с процентной концентрацией по 30 % при полной зарядке. Чистая кислота имеет плотность 1,835 г/см3, электролит – около 1,300 г/см3. Когда аккумулятор разряжается, в нем происходят электрохимические реакции, в результате которых из электролита отбирается серная кислота. Плотность от концентрации раствора зависит практически пропорционально, поэтому она должна уменьшаться вследствие снижения концентрации электролита.
До тех пор, пока ток разряда протекает через аккумулятор, кислота вблизи его электродов активно используется, и электролит становится все более разбавленным. Диффузия кислоты из объема всего электролита и к электродным пластинам поддерживает примерно постоянную интенсивность химических реакций и, как следствие, выходное напряжение.
В начале процесса разряда диффузия кислоты из электролита в пластины происходит быстро потому, что образующийся при этом сульфат еще не забил поры в активном материале электродов. Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Теоретически можно продолжить разряд до тех пор, пока все кислота не будет использована, и электролит будет состоять из чистой воды. Однако опыт показывает, что разряды не должны продолжаться после того, как плотность электролита упала до 1,150 г/см3.
Когда плотность падает от 1,300 до 1,150, это означает, что столько сульфата было сформировано в процессе реакций, и он заполняет все поры в активных материалах на пластинах, т. е. из раствора уже отобрана почти вся серная кислота. Плотность от концентрации зависит пропорционально, и точно так же от плотности зависит заряд аккумулятора. На рис. ниже показана зависимость заряда аккумулятора от плотности электролита.
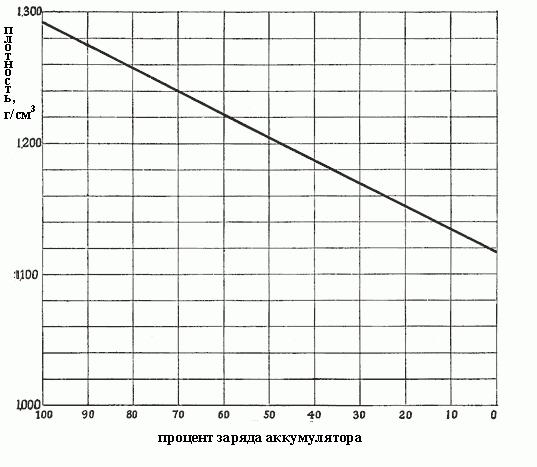
Изменение плотности электролита является лучшим средством определения состояния разряда аккумулятора, при условии, что он используется надлежащим образом.
Степени разряда автомобильного аккумулятора в зависимости от плотности электролита
Плотность его должна измеряться каждые две недели и постоянно должна вестись запись показаний для использования в будущем.
Чем плотнее электролит, тем больше кислоты он содержит, и тем более заряжен аккумулятор. Плотность в 1,300-1,280 г/см3 указывает на полный заряд. Как правило, различаются следующие степени разряда аккумулятора в зависимости от плотности электролита:
- 1,300-1,280 – полностью заряжен:
- 1,280-1,200 – более чем наполовину разряжен;
- 1,200-1,150 – заряжен менее чем наполовину;
- 1,150 – практически разряжен.
У полностью заряженного аккумулятора перед подключением его автомобильной сети напряжение каждой ячейки составляет от 2,5 до 2,7 В. Как только подключается нагрузка, напряжение быстро падает примерно до 2,1 В в течение трех или четырех минут. Это происходит из-за формирования тонкого слоя сульфата свинца на поверхности отрицательных электродных пластин и между слоем перекиси свинца и металлом положительных пластин. Окончательное значение напряжения ячейки после подключения к автомобильной сети составляет около 2,15-2,18 вольт.
Когда ток начинает протекать через аккумулятор в течение первого часа работы, происходит падение напряжения до 2 В, объясняемое ростом внутреннего сопротивления ячеек из-за формирования большего количества сульфата, который заполняет поры пластин, и отбора кислоты из электролита. Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см3. Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
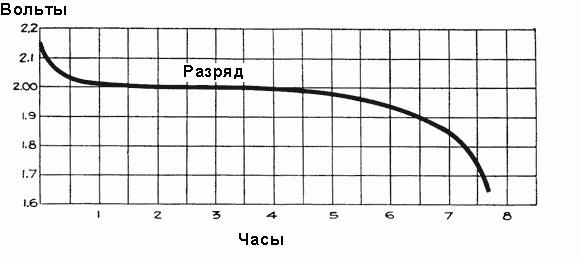
Контроль состояния электролита в аккумуляторе
Для определения плотности используется ареометр. Он состоит из небольшой запаянной стеклянной трубки с расширением на нижнем конце, заполненным дробью или ртутью, и градуированной шкалой на верхнем конце. Эта шкала помечена от 1,100 до 1,300 с различными промежуточными значениями, как показано на рис. ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
 Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.
Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.fb.ru
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Физический справочник / / Плотность. Удельный вес. Насыпная плотность. Объемный вес. Вес / / Таблица плотности. Плотность — таблица (в т.ч. насыпная) материалов, веществ, продуктов, жидкостей и газов при атмосферном давлении. Состояние вещества. Английские наименования. Поделиться:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
dpva.ru
|
Агат плотность агата |
2600 | 2,6 |
|
Азот плотность азота |
1250 | 1,25 |
|
Азот сжиженный (-195°C) плотность сжиженного азота |
850 | 0,850 |
|
Азота закись N2O плотность закиси азота |
1,98 | 0,00198 |
|
Азота окись NO плотность окиси азота |
1,3402 | 0,00134 |
|
Азота фторокись NO2F плотность фторокиси азота |
2,9 | 0,0029 |
|
Азота хлорокись NO2Cl плотность хлорокись азота |
2,57 | 0,00257 |
|
Азотная кислота, HNO3 водный раствор 91% плотность азотной кислоты |
1505 | 1,505 |
|
Актиний плотность актиния |
10070 | 10,07 |
|
Алебастр плотность алебастра |
1800-2500 | 1,8-2,5 |
|
Алмаз плотность алмаза |
3510 | 3,51 |
|
Алюминиевая бронза (3-10% Al) плотность алюминиевой бронзы |
7700-8700 | 7,7-8,7 |
|
Алюминиевая фольга плотность алюминиевой фольги |
2700 -2750 | 7,7-2,75 |
|
Алюминий плотность алюминия |
2710 | 2,71 |
|
Алюминий крупнокусковой плотность крупнокускового алюминия |
880 | 0,88 |
|
Алюминий порошкообразный плотность порошкообразного алюминия |
750 | 0,75 |
|
Алюминий фтористый (криолит) плотность фтористого алюминия |
1600 | 1,6 |
|
Алюминия оксид Al2O3 (чистый сухой) плотность оксида алюминия |
1520 | 1,52 |
|
Америций чистый плотность амерция |
13670 | 13,67 |
|
Аммиак плотность аммиака |
770 | 0,77 |
|
Аммиачная селитра (нитрат аммония) плотность аммиачной селитры |
730 | 0,73 |
|
Аммония сульфат; сернокислый аммоний (мокрый) плотность сульфата аммония |
1290 | 1,29 |
|
Аммония сульфат; сернокислый аммоний (сухой) плотность сульфата аммония |
1130 | 1,13 |
|
Андезит цельный плотность андезита |
2770 | 2,77 |
|
Анилин плотность анилина |
1020 | 1,02 |
|
Апатит плотность апатита |
3190 | 3,19 |
|
Арахис нечищенный (земляной орех) плотность арахиса |
270 | 0,27 |
|
Арахис чищенный (земляной орех) плотность арахиса |
650 | 0,65 |
|
Аргон плотность аргона |
1784 | 1,784 |
|
Асбест кусками плотность асбеста |
1600 | 1,6 |
|
Асбест цельный плотность асбеста |
2350-2600 | 2,35-2,6 |
|
Асфальтобетон плотность асфальтобетона |
2250 | 2,25 |
|
Асфальтовая крошка плотность асфальтовой крошки |
720 | 0,72 |
|
Ацетилен C2H2 плотность ацетилена |
1,17 | 0,00117 |
|
Ацетон плотность ацетона |
800 | 0,8 |
|
Ацетонитрил плотность ацетонитрила |
780 | 0,78 |
|
Баббит плотность баббита |
7270 | 7,27 |
|
Базальт дробленый плотность базальта дробленного |
1950 | 1,95 |
|
Базальт цельный плотность базальта цельного |
3000 | 3 |
|
Бакелит цельный плотность бакелита цельного |
1360 | 1,36 |
|
Барий чистый плотность бария чистого |
3590 | 3,59 |
|
Бариллиево-медный сплав, бериллиевая бронза плотность сплава |
8100 — 8250 | 8,1 — 8,25 |
|
Бария сульфат (барит), дробленый плотность сульфата бария |
2880 | 2,88 |
|
Бензин плотность бензина |
750 | 0,75 |
|
Бензол плотность бензола |
880 | 0,88 |
|
Бериллий плотность бериллия |
1848 | 1,848 |
|
Берклий чистый плотность берклий чистый |
14780 | 14,78 |
|
Бетон плотность бетона |
2300 | 2,3 |
|
Бетонит сухой плотность бетонита сухого |
600 | 0,6 |
|
Бобы какао плотность какое бобов |
600 | 0,6 |
|
Бобы касторовые плотность бобов касторовых |
580 | 0,58 |
|
Бобы соевые плотность соевых бобов |
720 | 0,72 |
|
Бокситы дробленые плотность дробленых боксидов |
1282 | 1,282 |
|
Бор плотность бора |
2460 | 2,46 |
|
Бор фтористый плотность фтористого бора |
2,99 | |
|
Бром чистый плотность блома |
3120 | 3,12 |
|
Бронза плотность бронзы |
8700-8900 | 8,7-8,9 |
|
Бронза свинцовистая плотность свинцовой бронзы |
7700 — 8700 | 7,7-8,7 |
|
Бронза фосфористая плотность бронзы фосфористной |
8780 — 8920 | 8,78-8,92 |
|
Бумага обычная плотность бумаги |
1201 | 1,201 |
|
Бура (пироборнокислый натрий) плотность буры |
850 | 0,85 |
|
Буровой раствор глинистый жидкий плотность раствора |
1730 | 1,73 |
|
Бутан (i-Бутан) C4h20 плотность бутана |
2,67 | |
|
Бутан (n-Бутан) C4h20 плотность бутана |
2,7 | |
|
Бытовые отходы, бытовой мусор плотность мусора |
480 | 0,48 |
|
Ванадий чистый плотность ванадия |
6020 | 6,02 |
|
Винипласт плотность винипласта |
1380 | 1,38 |
|
Висмут чистый плотность висмута |
9750 | 9,75 |
|
Вода дистиллированная плотность воды дистиллированной |
998 | 0,998 |
|
Вода морская плотность морской воды |
1020 | 1,02 |
|
Водород плотность водорода |
90 | 0,09 |
|
Водород сжиженный плотность сжиженного водорода |
72 | 0,072 |
|
Водород бромистый HBr плотность бромистого водорода |
3,66 | |
|
Водород иодистый Hl плотность иодистого водорода |
5,79 | |
|
Водород мышьяковистый h4As плотность мышьяковистого водорода |
3,48 | |
|
Водород селенистый h3Se плотность селенистого водорода |
3,66 | |
|
Водород сернистый h3S плотность сернистого водорода |
1,54 | |
|
Водород теллуристый h3Te плотность теллуристного водорода |
5,81 | |
|
Водород фосфористый h4P плотность фосфористого водорода |
1,53 | |
|
Водород хлористый HCl плотность хлористого водорода |
1,64 | |
|
Водяной пар (100°C) плотность водяного пара |
880 | 0,88 |
|
Воздух плотность воздуха |
1290 | 1,29 |
|
Воздух сжиженный плотность воздуха |
861 | 0,861 |
|
Вольфрам плотность вольфрама |
19100 | 19,1 |
|
Гадолиний чистый Gadolinium Gd плотность гадолиния |
7895 | 7,895 |
|
Галлий чистый плотность галлия |
5900 | 5,9 |
|
Гафний чистый Hafnium Hf плотность гафния |
13310 | 13,31 |
|
Гелий плотность гелия |
0,18 | |
|
Гелий сжиженный плотность гелия |
147 | |
|
Гематит (красный железняк) дробленый плотность гематита |
2100-2900 | 2,1-2,9 |
|
Гематит (красный железняк) цельный плотность гематита |
5095 — 5205 | 5,095 — 5,205 |
|
Германий чистый плотность германия |
5300 | 5,3 |
|
Глицерин плотность глицерина |
1260 | 1,26 |
|
Гранит плотность гранита |
2800 | 2,8 |
|
Двуокись углерода плотность углекислого газа |
1980 | 1,98 |
|
Дедерон плотность дедерона |
1100 | 1,1 |
|
Дизельное топливо (солярка) плотность дизельного топлива |
850 | 0,85 |
|
Дуб плотность дуба |
800 | 0,8 |
|
Дюралюминий плотность дюралюминия |
2790 | 2,79 |
|
Дюралюминий плотность дюралюминия |
2790 | 2,79 |
|
Железо плотность железа |
7800 | 7,8 |
|
Золото плотность золота |
19300 | 19,3 |
|
Инвар плотность инвара |
8700 | 8,7 |
|
Иридий плотность иридия |
22400 | 22,4 |
|
Каменный уголь плотность каменного угля |
1400 | 1,4 |
|
Керосин плотность керосина |
800 | 0,8 |
|
Кислород плотность кислорода |
1470 | 1,47 |
|
Кокс плотность кокса |
600 | 0,6 |
|
Криптон плотность криптона |
3743 | 3,743 |
|
Ксенон плотность ксенона |
5851 | 5,851 |
|
Латунь плотность латуни |
8600 | 8,6 |
|
Лед (вода ниже 0°С) плотность льда |
900 | 0,9 |
|
Литий плотность лития |
535 | 0,535 |
|
Магний плотность магния |
1738 | 1,738 |
|
Медь плотность меди |
8900 | 8,9 |
|
Метан плотность метана |
717 | 0,717 |
|
Молоко плотность молока |
1030 | 1,03 |
|
Натрий плотность натрия |
968 | 0,986 |
|
Неон плотность неона |
900 | 0,9 |
|
Окись углерода плотность угарного газа |
1250 | 1,25 |
|
Пертинакс плотность пертинакса |
1350 | 1,35 |
|
Песчаник плотность песчаника |
2400 | 2,4 |
|
Платина плотность платины |
21500 | 21,5 |
|
Пропан плотность пропана |
2200 | 2,2 |
|
Органическое стекло плотность органического стекла |
1180 | 1,18 |
|
Пробковая кора плотность пробковой коры |
150 | 0,15 |
|
Ртуть плотность ртути |
13500 | 13,5 |
|
Свинец плотность свинца |
11340 | 11,34 |
|
Серебро плотность серебра |
10500 | 10,5 |
|
Серная кислота (концентрированная) плотность серной кислоты |
1830 | 1,83 |
|
Сосна плотность сосны |
500 | 0,5 |
|
Спирт (ректификат) плотность спирта |
830 | 0,83 |
|
Стекло оконное плотность оконного стекла |
2500 | 2,5 |
|
Титан плотность титана |
4500 | 4,5 |
|
Углерод плотность углерода |
2260 | 2,26 |
|
Фтор плотность фтора |
1696 | 1,696 |
|
Хлор плотность хлора |
3220 | 3,22 |
|
Цинк плотность цинка |
7100 | 7,1 |
|
Электрон плотность электрона |
1800 | 1,8 |
|
Этилен плотность этилена |
1260 | 1,26 |
|
Этиловый спирт плотность этилового спирта |
790 | 0,79 |
|
Эфир плотность эфира |
720 | 0,72 |
www.mozgan.ru
Плотность сероводорода (h3S), значение и примеры
Плотность сероводорода и другие его физические свойства
Насыщенный раствор (0,1М) называют «сероводородной водой», который мутнеет при стоянии на воздухе. Плотность сероводорода равна 1,36 кг/м3.
Сероводород образуется при разложении растительных и животных остатков, например яичного белка. Неприятный запах тухлых яиц обусловлен выделением сероводорода. Сероводород содержится во многих минеральных источниках. Особенно им богаты некоторые источники Кавказа (Мацеста, Пятигорск).
Химический состав и строение молекулы сероводорода
Химический состав молекулы сероводорода отражается эмпирической формулой H2S. Структурная (графическая) формула сероводорода является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
Рис. 1. Строение молекулы сероводорода с указанием валентного угла между связями и длины химических связей.
Строение молекулы сероводорода сходно со строением молекулы воды. Она образована перекрыванием s-электронных облаков атомов водорода с p-электронными облаками атома серы. Так как p-электронные орбитали расположены взаимно перпендикулярно, то перекрывание s- и p-электронных облаков происходит под углом примерно 90oC.
Из-за большой элекроотрицательности серы электронная плотность сдвинута в её сторону: молекула сероводорода имеет не линейное, а угловое строение.
Краткое описание химических свойств и плотность сероводорода
Сероводород энергично реагирует с кислородом:
2H2S + 3O2 = 2H2O + 2SO2;
S-2 →S+4;
O0→O-2.
При охлаждении пламени происходит неполное сгорание:
2H2S + O2 = 2H2O + 2S;
S-2 →S0;
O0→O-2.
Аналогично протекает реакция с хлором:
H2S + Cl2 = 2HCl + S;
S-2 →S0;
Cl0→Cl—.
В этих условиях атомы окислителя (кислорода и хлора) присоединяют электроны и восстанавливаются. Сероводород (точнее, сера со степенью окисления -2) является сильным восстановителем.
Сероводород – очень ядовитый газ. Он разрушает гемоглобин крови, ибо осаждает из него железо в виде соли FeS.
Примеры решения задач
ru.solverbook.com