Сверхкислота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 марта 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 марта 2019; проверки требуют 2 правки.Сверхкислота́[1] (или су̀перкислота́[2]) — вещество или смесь веществ, параметр кислотности которых превышает кислотность 100%-ой серной кислоты. В данном случае параметр кислотности принимается как способность кислоты протонировать произвольное основание и фактически совпадает с функцией кислотности. Для 100 % серной кислоты параметр кислотности составляет H0 = −11,93. Наличие воды снижает кислотность сверхкислот, так как в присутствии воды сила кислоты ограничивается кислотностью иона гидроксония H3O+.
Термин суперкислота
Магическая кислота получила своё название за исключительную способность растворять воск. Она является смесью пентафторида сурьмы, который является кислотой Льюиса, и фторсульфоновой кислоты — кислоты Брёнстеда. Одной из сильнейших суперкислотных систем является гексафторсурьмяная кислота — смесь плавиковой кислоты и пентафторида сурьмы. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы. Фторсурьмяная кислота в 2⋅10 19 раз сильнее 100%-ой серной кислоты.
Для характеристики кислотности веществ в неводных средах используют функцию кислотности Гаммета Н0. Известны жидкости, для которых Н0 более отрицательна, чем для концентрированных водных растворов очень сильных кислот, таких, как HNO3, Н2SO4. Эти жидкости называются сверхкислотами. Примеры: 100%-ная H2SO4 (Н0 = −12), безводная фторсульфоновая кислота HSO3F (Н0 = −15), смесь HF и SbF5 (Н0 = −28), 7%-ный раствор SbF5 в HSO3F (Н0 = −19,4). Эквимолярную смесь HSO3F и SbF5 называют «магической кислотой». Сверхкислотность обусловлена исключительной слабостью взаимодействия с протоном соответствующих анионов (HSO4−, SbF6
Протонные суперкислоты[править | править код]
К простым суперкислотам относят трифторметансульфоновую (CF3SO3H), хлорную , хлорсульфоновую, пентафторэтансульфоновую, фторсульфоновую (FSO3H) кислоты. Во многих случаях суперкислота является не одиночным соединением, а смесью соединений, совмещаемых для достижения высокой кислотности.
Карборановая кислота — одна из самых сильных кислот, из тех, которые можно хранить в бутылках. Она в миллион раз сильнее концентрированной серной кислоты. Создана в университете Калифорнии (США) при участии сотрудников Института катализа СО РАН (Новосибирск). Самой сильной сверхкислотой из всех, на данный момент, является фторированная карборановая кислота.
Сильнейшей известной кислотой среди всех систем является ион гидрида гелия, но данную систему невозможно хранить в сколько-нибудь заметном количестве.
Сверхкислоты Льюиса[править | править код]
К сверхкислотам Льюиса относятся большинство пентафторидов металлов и трифторид бора.
Оксикислоты — Википедия
Материал из Википедии — свободной энциклопедии

Оксикисло́ты (оксикарбоновые кислоты или гидроксикислоты) — карбоновые кислоты, в которых одновременно содержатся карбоксильная и гидроксильная группы, например молочная кислота: СН3-СН(ОН)-СООН. Оксикислоты проявляют все свойства, характерные для кислот (диссоциация, образование солей, сложных эфиров и т. д.), и свойства, характерные для спиртов (окисление, образование простых эфиров и т. д.).
Оксикислоты весьма широко распространены в природе. Так, к оксикислотам относятся винная, лимонная, яблочная, молочная и некоторые другие природные кислоты, а их название отражает первичный природный источник, в котором было найдено данное вещество.
- Получение α-оксикислот гидролизом оксинитрилов (циангидринов)
- Получение α-оксикислот гидролизом галогенкарбоновых кислот
- Получение β-оксикислот гидратацией непредельных кислот
- Получение β-оксикислот по реакции Реформатского
- Получение β-оксикислот ферментативным окислением предельных кислот в β-положение
- δ- и γ-оксикислоты получают окислением циклических кетонов надкислотами (реакция Байера — Виллигера) с последующим гидролизом лактонов.
Реакция Реформатского[править | править код]
Реакция Реформатского является методом синтеза эфиров β-гидроксикарбоновых кислот.
Гидроксикислоты — химически активные вещества. Наличие в составе их молекул двух видов функциональных групп (-СООН и -ОН) позволяет им легко вступать в различные химические реакции, характерные для карбоновых кислот, спиртов, и типичные для самих гидроксикислот.
Реакции окисления спиртовых групп[править | править код]
Гидроксикислоты легко вступают в реакции окисления спиртовых групп, что обуславливает образование оксокислот — альдегидо- и кетокислот. Например, молочная кислота, окисляясь, превращается в пировиноградную:
- Ch4CH(OH)COOH+[O]→KMnO4+h3OCh4COCOOH+h3O.{\displaystyle {\mathsf {CH_{3}CH(OH)COOH+[O]{\xrightarrow {KMnO_{4}+H_{2}O}}CH_{3}COCOOH+H_{2}O}}.}
Окисление оксикислот при нагревании с концентрированными минеральными кислотами[править | править код]
При нагревании с концентрированной серной кислотой лимонная кислота сначала разлагается на муравьиную и ацетондикарбоновую кислоты:
- HOOCCh3C(OH)COOHCh3COOH→t,h3SO4HCOOH+HOOCCh3COCh3COOH.{\displaystyle {\mathsf {HOOCCH_{2}C(OH)COOHCH_{2}COOH{\xrightarrow {t,H_{2}SO_{4}}}HCOOH+HOOCCH_{2}COCH_{2}COOH}}.}
В подобную реакцию вступает и молочная кислота:
- Ch4CH(OH)COOH→t,h3SO4HCOOH+Ch4CHO.{\displaystyle {\mathsf {CH_{3}CH(OH)COOH{\xrightarrow {t,H_{2}SO_{4}}}HCOOH+CH_{3}CHO}}.}
В результате окисления образуется муравьиная кислота и ацетальдегид.
Образование солей[править | править код]
Оксикислоты реагируют с гидроксидами или солями металлов, образуя кислые или средние соли.
Например, образование кислой и средней солей тартратной кислоты происходит следующим образом.
На первой стадии образуется кислая соль тартратной кислоты, которая практически не растворяется в воде:
- HOOCCH(OH)CH(OH)COOH+KOH→HOOCCH(OH)CH(OH)COOK+h3O.{\displaystyle {\mathsf {HOOCCH(OH)CH(OH)COOH+KOH\rightarrow HOOCCH(OH)CH(OH)COOK+H_{2}O}}.}
На второй стадии образуется средняя соль, которая хорошо растворяется в воде:
- HOOCCH(OH)CH(OH)COOK+KOH→KOOCCH(OH)CH(OH)COOK+h3O.{\displaystyle {\mathsf {HOOCCH(OH)CH(OH)COOK+KOH\rightarrow KOOCCH(OH)CH(OH)COOK+H_{2}O}}.}
При взаимодействии молочной кислоты и гидроксида цинка образуется лактат цинка:
- 2Ch4CH(OH)COOH+Zn(OH)2→(Ch4CH(OH)COO)2Zn+2h3O.{\displaystyle {\mathsf {2CH_{3}CH(OH)COOH+Zn(OH)_{2}\rightarrow (CH_{3}CH(OH)COO)_{2}Zn+2H_{2}O}}.}
- 2HOOCCh3C(OH)COOHCh3COOH+3CaCl2→[OOCCh3C(OH)COOCh3COO]2Ca3+6HCl.{\displaystyle {\mathsf {2HOOCCH_{2}C(OH)COOHCH_{2}COOH+3CaCl_{2}\rightarrow [OOCCH_{2}C(OH)COOCH_{2}COO]_{2}Ca_{3}+6HCl}}.}
Многие оксикислоты получили применение в косметике в качестве кератолитиков[1]. Название, правда, маркетологи немного изменили — для большей привлекательности в косметологии их часто называют «фруктовые кислоты».
- Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз.
- Тюкавкина Н. А. Биоорганическая химия. 2004.
Аминокислоты — Википедия
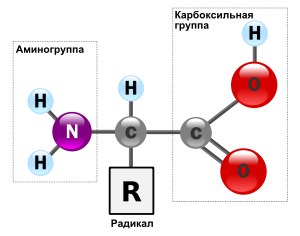
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде).
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков[править | править код]
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (Хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH
 N+H3 —CH2COO—
N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белка, синтезируемых на рибосомах.
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счёт образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Решение этого вопроса смотрим в работе[13]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация[править | править код]
| Аминокислота | 3-буквы[14] | 1-буква[14] | аминокислот | мнемоническое правило[15] | Полярность[16] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[17] | частота в белках (%)[18] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Полярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу[править | править код]
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[16]
По функциональным группам[править | править код]
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз[править | править код]
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза[править | править код]
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников[править | править код]
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных[править | править код]
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты[править | править код]
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[19]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[20]
- ↑ 1 2 Wagner I., Musso H. New Naturally Occurring Amino Acids (нем.) // Angewandte Chemie International Edition in English : magazin. — 1983. — November (Bd. 22, Nr. 11). — S. 816—828. — DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена (рус.) // Природа. — Наука, 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada. Aspartic acid racemization in tooth enamel from living humans (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1975. — Vol. 72, no. 8. — P. 2891 —2894.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (неопр.) (1 февраля 2000). Дата обращения 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R—36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514—3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317—327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1—13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706—712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29—35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ Burtyka M.V. Биометрия: метрика молекулярного углеродистого многообразия.CTAG biometry=http://biometry-burtyka.blogspot.com.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105—132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112—D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
| Тривиальное название | Название по ИЮПАК | Структурная или рациональная формула | Название солей и сложных эфиров | Регистрационный номер по СAS |
|---|---|---|---|---|
| Абиетиновая кислота | (4aR)-1,2,3,4,4ar,4bt,5,6,10,10at-декагидро-7-изопропил-1c,4-диметил-фенантренкарбоновая кислота | 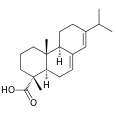 | ||
| Абрин | (2S)-3-(1H-индол-3-ил)-2-(метиламино)пропановая кислота | |||
| Абсцизовая кислота | (2Z,4E)-5-[(1S)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил]-3-метилпента-2,4-диеновая кислота | 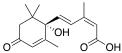 | ||
| Агарициновая кислота | 2-гидрокси-1,2,3-нонадекантрикарбоновая кислота | CH3(CH2)15CH(COOH)C(OH)(COOH)CH2COOH | ||
| Адипиновая кислота | гександиовая кислота | HOOC(СH2)4COOH | адипинаты | |
| Азароновая кислота | 2,4,5-триметоксибензойная кислота | |||
| Азелаиновая кислота | нонандиовая кислота | HOOC(СH2)7COOH | азелаинаты | |
| Аконитовая кислота | пропен-1,2,3-трикарбоновая кислота | HOOCCH2C(COOH)=CHCOOH | ||
| Аконовая кислота | 2,5-дигидро-5-оксо-3-фуранкарбоновая кислота | ChemSpider: 14482627 | ||
| Акриловая кислота | пропеновая кислота | H2C=CHCOOH | акрилаты | |
| α-Аланин | 2-аминопропановая кислота | CH3CH(NH2)COOH | ||
| Алейритовая кислота | 9,10,16-тригидроксигексадекановая кислота | HO(CH2)6CH(OH)CH(OH)(CH2)7COOH | ||
| Аллантоиновая кислота | диуреидоуксусная кислота | 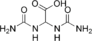 | ||
| Аллиинruen | 2-амино-3-проп-2-енилсульфонилпропановая кислота | 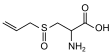 | ||
| Аллокоричная кислота | цис-3-фенилпропеновая кислота | С6Н5СН=СНСООН | ||
| Аллоксановая кислота | 4-гидрокси-2,5-диоксо-4-имидазолидинкарбоновая кислота | |||
| Аллосантеновая кислота | 1-цис-2-диметилциклопентан-1-цис-3-дикарбоновая кислота | C9H14O4 | ||
| D-Аллослизевая кислота | (2R,3R,4S,5S)-2,3,4,5-тетрагидроксибутандиовая кислота | HOOCCH(OH)CH(OH)CH(OH)CH(OH)COOH | ||
| Аллофановая кислота | карбоксиломочевина | NH2СОNHCOOH[1] | аллофанаты | |
| Ангеликовая кислотаruen | транс-2-метил-2-бутеновая кислота | СН3СН=С(СН3)СООН | ||
| Ангидроэкгонин | (см. экгонидин) | |||
| п-Анисовая кислота | 4-метоксибензойная кислота | |||
| Антраниловая кислота | 2-аминобензойная кислота | |||
| 1-Антройная кислота | 1-антраценкарбоновая кислота | 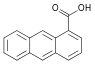 | ||
| 2-Антройная кислота | 2-антраценкарбоновая кислота | 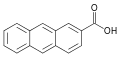 | ||
| 9-Антройная кислота | 9-антраценкарбоновая кислота | 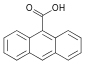 | ||
| Апокамфорная кислота | 2,2-диметил-1,3-циклопентандикарбоновая кислота | |||
| Апофенхокамфорная кислота | цис-4,4-диметилциклопентан-1,3-дикарбоновая кислота | |||
| Арахидоновая кислота | цис-5,8,11,14-эйкозатетраеновая кислота | CH3(CH2)3(CH2CH=CH)4(CH2)3COOH | ||
| Арахиновая кислота | эйкозановая кислота | C19H39COOH | арахаты | |
| Аргинин | 2-амино-5-гуанидинопентановая кислота | 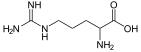 | ||
| Арекаидин | 1,2,5,6-тетрагидро-1-метилпиридин-3-карбоновая кислота | 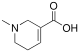 | ||
| Аристолоховая кислотаruen | 3,4-метилендиокси-8-метокси-10-нитрофенантрен-1-карбоновая кислота | 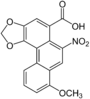 | ||
| Аспарагин | 4-амид-2-аминобутандиовая кислота | HOOCCH(NH2)CH2CONH2 | ||
| Аспарагиновая кислота | 2-аминобутандиовая кислота | HOOCCH2CH(NH2)COOH | аспарагинаты | |
| Атролактиновая кислота | 2-гидрокси-2-фенилпропановая кислота | CH3C(C6H5)(OH)COOH | ||
| Атроповая кислота | 2-фенилпропеновая кислота | CH2=C(C6H5)COOH | ||
| Ацетилендикарбоновая кислота | бутиндиовая кислота | HOOCC≡CCOOH | ||
| Ацетоуксусная кислота | 3-оксобутановая кислота | CH3COCH2COOH | ||
| Ацетуровая кислота | N-ацетиламиноуксусная кислота | CH3CONHCH2COOH | ||
| Баикиаин | 1,2,3,6-тетрагидропиридин-2-карбоновая кислота | |||
| Бегеновая кислота | докозановая кислота | C21H43COOH | бегенаты | |
| Бегенолевая кислота | 13-доказиновая кислота | CH3(CH2)7C≡C(CH2)11COOH | ||
| Бензиловая кислотаruen | гидроксидифенилуксусная кислота | (C6H5)2C(OH)COOH | ||
| Бензойная кислота | бензойная кислота | 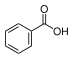 | бензоаты | |
| Бербероновая кислота | пиридин-2,4,5-трикарбоновая кислота | ChemSpider: 9075159 | ||
| Бетулиновая кислота | 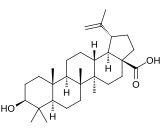 | |||
| Билиановая кислота | 7,12-диоксо-3,4-секо-5β-холан-3,4,24-триовая кислота | |||
| Биотин | 5-(7-оксо-3-тиа-6,8-диазабицикло[3.3.0]октил-2)пентановая кислота | 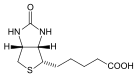 | ||
| Брассидиновая кислота | транс-13-докозеновая кислота | CH3(СH2)7CH=CH(СH2)11COOH | ||
| Брассиловая кислота | тридекандиовая кислота | HOOC(СH2)11COOH | ||
| Валериановая кислота | пентановая кислота | C4H9COOH | валераты | |
| Валин | 2-амино-3-метилбутановая кислота | (CH3)2CHCH(NH2)COOH | ||
| Вальпроевая кислота | 2-пропилпентановая кислота | CH3CH2CH2CH(COOH)CH2CH2CH3 | вальпроаты | |
| Ванилилминдальная кислота | 2-гидрокси-2-(4-гидрокси-3-метоксифенил)уксусная кислота | 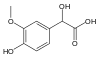 | ||
| Ванилиновая кислота | 4-гидрокси-3-метоксибензойная кислота | |||
| Вацценовая кислотаruen | 11-октадеценовая кислота | CH3(CH2)5CH=CH(CH2)9COOH | ||
| Вератровая кислота | 3,4-диметоксибензойная кислота | |||
| Верноловая кислотаruen | цис-12,13-эпокси-9-октадеценовая кислота | |||
| Винная кислота | 2,3-дигидроксибутандиовая кислота | НООССН(ОН)СН(ОН)СООН | тартраты | |
| Виноградная кислота[2] | DL-винная кислота | |||
| Гадолеиновая кислота | цис-9-эйкозеновая кислота | CH3(CH2)9CH=CH(CH2)7COOH | ||
| Галактаровая кислота | (см. слизевая кислота) | |||
| D-Галактуроновая кислота | (2S,3R,4S,5R)-2,3,4,5-тетрагидро-6-оксогексановая кислота |  | ||
| Галловая кислота | 3,4,5-тригидроксибензойная кислота | 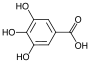 | галлаты | |
| Геддовая кислота | тетратриаконтановая кислота | CH3(CH2)32COOH | ||
| Гематиновая кислота | 2,5-дигидро-2,5-диоксо-4-метил-1H-пиррол-3-пропановая кислота | |||
| Гемеллитиловая кислота | 2,3-диметилбензойная кислота | |||
| Гемимеллитовая кислота | 1,2,3-бензолтрикарбоновая кислота | |||
| Гемипиновая кислота | 3,4-диметокси-1,2-бензолдикарбоновая кислота | |||
| Гентизиновая кислота | 2,5-дигидроксибензойная кислота | 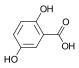 | ||
| Героновая кислота | 2,2-диметил-6-оксогептановая кислота | CH3C(=O)CH2CH2CH2CH(CH3)2COOH | ||
| Гесперетиновая кислота | (2E)-3-(3-гидрокси-4-метоксифенил)-2-пропеновая кислота | |||
| Гетероауксин | 1H-индол-3-уксусная кислота | 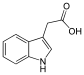 | ||
| Гидантоиновая кислота | уреидоуксусная кислота | H2NCONHCH2COOH | ||
| Гиднокарповая кислота | 11-(2-циклопентенил)ундекановая кислота | |||
| Гидракриловая кислотаruen | 3-гидроксипропановая кислота | HOCH2CH2COOH | ||
| Гидратроповая кислота | 2-фенилпропановая кислота | C6H5CH(CH3)COOH | ||
| Гидрокоричная кислотаruen | 3-фенилпропановая кислота | C6H5(CH2)2COOH | ||
| Гиппуровая кислота | N-бензоиламиноуксусная кислота | C6H5CONHCH2COOH | ||
| Гистидин | 2-амино-3-(4-имидазолил)пропановая кислота | 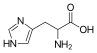 | ||
| Гликолевая кислота | гидроксиуксусная кислота | HOCH2COOH | ||
| Гликохолевая кислота | гликохолаты | |||
| Глиоксиловая кислота | оксоуксусная кислота | HCOCOOH | ||
| Глицериновая кислота | 2,3-дигидроксипропановая кислота | HOCH2CH(OH)COOH | ||
| Глицин | аминоуксусная кислота | H2NCH2COOH | ||
| Глицирризиновая кислота | 20β-карбокси-11-оксо-30-норолеан-12-ен-3β-ил-2-О-β-D-глюкопирануронозил-альфа-D-глюкопиранозидуроновая кислота | 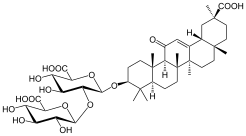 | ||
| Глутаконовая кислотаruen | 2-пентендиовая кислота | HOOCCH=CHCH2COOH | ||
| Глутамин | 5-амид-2-аминопентадиовая кислота | HOOCCH(NH2)CH2CH2CONH2 | ||
| Глутаминовая кислота | 2-аминопентандиовая кислота | HOOC(CH2)2CH(NH2)COOH | глутаматы | |
| Глутаровая кислота | пентандиовая кислота | HOOC(СH2)3COOH | глутараты | |
| Глюконовая кислота | 2,3,4,5,5-пентагидрогексановая кислота | глюконаты | ||
| Глюкуроновая кислота | тетрагидро-3,4,5,6-тетрагидроксипиран-2-карбоновая кислота | 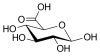 | глюкуронаты | |
| Гомованилиновая кислота | 4-гидрокси-3-метоксифенилуксусная кислота | 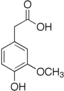 | ||
| Гомовератровая кислота | 3,4-диметоксифенилуксусная кислота | |||
| Гомогентизиновая кислота | 2,5-дигидроксифенилуксусная кислота | 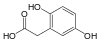 | ||
| Гомокамфорная кислота | 3-(карбоксиметил)-1,2,2-триметилциклопентанкарбоновая кислота |
Карборановая кислота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 марта 2019; проверки требуют 6 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 марта 2019; проверки требуют 6 правок.| Карборановая кислота | |
|---|---|
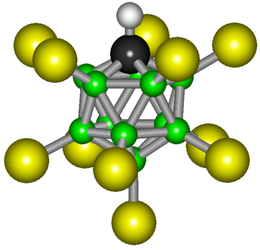 ( {{{картинка}}}) | |
| Систематическое наименование | 2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12) |
| Хим. формула | H(CHB11Cl11) |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |

 3D-анимация иона карборановой кислоты
3D-анимация иона карборановой кислоты2,3,4,5,6,7,8,9,10,11,12-Ундекахлор-1-карба-клозо-додекаборан(12) (журналистское название Карборановая кислота) — одна из самых сильных кислот[1] (суперкислота), полученных в начале XXI века.
Химическая формула — H(CHB11Cl11). Карборановая часть молекулы имеет икосаэдрическую структуру.
Получена реакцией 1-триэтилсилил-2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборана(12) с газообразным хлороводородом.
Бесцветное сильно гигроскопичное кристаллическое вещество. Может быть перегнано в высоком вакууме. С водой и влагой воздуха образует соль гидроксония. Не действует на стекло. Как сильная кислота может действовать на кожу, но ее натриевая соль малотоксична. Как сильная кислота может реагировать с металлами до водорода с образованием солей и выделением водорода.
Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется.
Протонирует бензол, давая стабильную соль бензолия. Протонирует фуллерен-60, диоксид серы.
На данный момент, сильнейшей известной кислотой, которую можно хранить в лаборатории является фторированная карборановая кислота.
Кислота создана в университете Калифорнии (США) при участии сотрудников Института катализа СО РАН (Новосибирск)[2]. Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых», — сказал Кристофер Рид, один из её создателей, в интервью службе новостей Nature.
 N+H3 —CH2COO—
N+H3 —CH2COO—