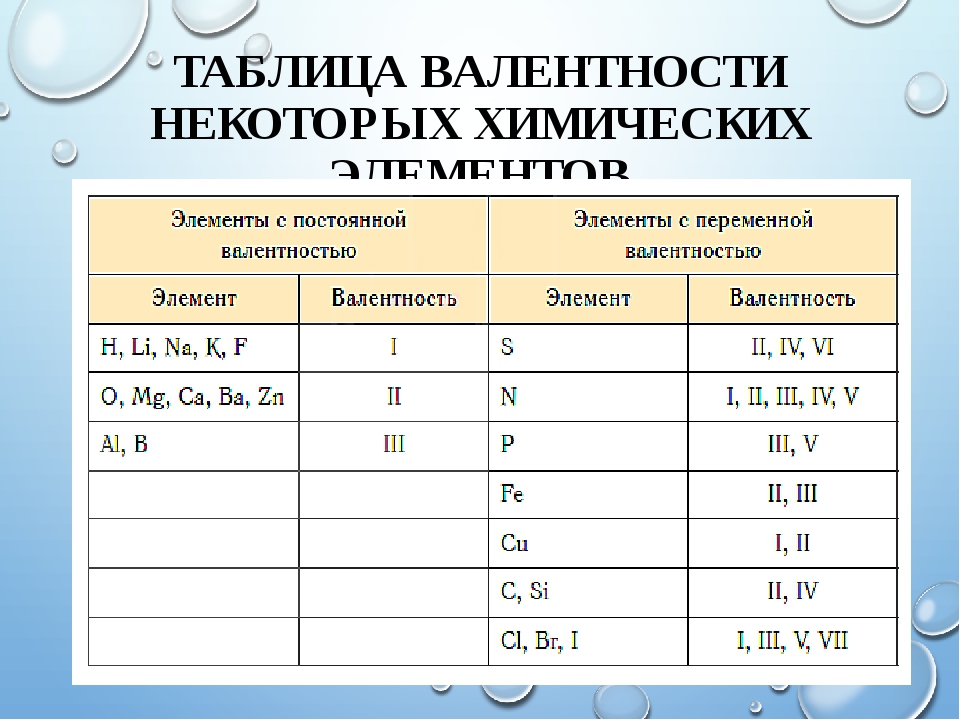
Валентность и степень окисления
☰
Валентность химического элемента определяет сколько одинарных химических связей способны образовывать атомы этого элемента с другими атомами. Атомы многих химических элементов могут проявлять разную валентность.
Химическую связь образует общая электронная пара двух атомов, которая образуется в ковалентной связи. Таким образом, валентность атомов определяется только в ковалентных соединениях. В ионной и металлической связи нет общих электронных пар, поэтому для веществ с такой связью понятие валентности не уместно.
Поскольку на внешнем энергетическом уровне атома не может быть больше 8 электронов, то валентность атомов разных химических элементов изменяется от I до VIII.
В структурных формулах молекул валентность изображают черточками между атомами. Сколько черточек отходит от одного атома, такова и его валентность.
Высшая валентность атома химического элемента в оксиде, равна номеру группы, в которой он находится.
Однако обычно атом проявляет валентность, равную количеству его неспаренных электронов. Так у галогенов — это один электрон, у кислорода — два, у водорода и щелочных металлов — по одному.
Степень окисления, по сравнению с валентностью, более универсальное понятие. Оно не зависит от вида химической связи и является характеристикой для соединений как с ковалентной, так и ионной и металлической связью. Степень окисления — это условный заряд на атоме в веществе. При определении степени окисления делают предположение, что все связи в соединении ионные. Степень окисления может быть положительной, отрицательной, нулевой.
В простых случаях степень окисления совпадает с зарядами ионов. Однако в отличие от заряда ионов степень окисления записывают после знака «+» или «-». Например:
Na+Cl—, Ca+2O-2, C+4O2-2
Поскольку металлы обычно образуют ионные связи неметаллами, то под их валентность понимают именно степень окисления.
В простых веществах степень окисления атомов считают равной нулю. Однако валентность не равна нулю, она равна числу общих электронных пар между атомами. Например, в молекуле h3 валентность атомов равна I, а степень окисления 0.
Отрицательную степень окисления имеют атомы с большей электроотрицательностью. Так в хлориде калия K+1Cl-1 электронная пара смещена к хлору.
При определении степеней окисления атомов в молекуле следует иметь в виду, что сумма степеней окисления должна быть равна нулю, так как молекула электронейтральна.
Урок №14-15. Валентность химических элементов. Определение валентности элементов по формулам бинарных соединений. Составление химических формул бинарных соединений по валентности
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность – определяется номером группы (число химических связей
в структурной формуле вещества).
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений (валентность обозначается римскими цифрами I, II, III – VIII).
Структурная формула вещества отображает порядок соединения атомов между собой, согласно их валентностям, т.е. химическое строение. | |
| | Na – одновалентен (одна связь) H – одновалентен (одна связь) O – двухвалентен (две связи у каждого атома) S – шестивалентна (образует шесть связей с соседними атомами) |
Правила определения валентности элементов в соединениях
1. Валентность водорода принимают за I (единицу).
2. Кислород в своих соединениях проявляет валентность II.
3. Высшая
валентность равна номеру группы Nгруппы (исключения, N, O, F — для этих элементов характерна только низшая валентность).
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — Nгруппы
Определение валентности металлов
(характерны валентности – постоянная и переменная)
Металлы главных (А) подгрупп I(А), II(А), III(А) | Характерна высшая постоянная валентность. В = Nгруппы | Металл в формуле всегда занимает первую позицию |
Металлы побочных (Б) подгрупп I(Б)-VIII(Б) | Характерна переменная валентность. В – указывается в названии вещества. Например, оксид марганца (VII), хлорид хрома (II). |
Определение валентности неметаллов
(характерны валентности – высшая, низшая, переменная)
Характерны высшая валентность В = N группы | Неметалл ставится в этом случае на первое место в формуле |
Характерна низшая валентность 8 — N группы | Неметалл ставится в этом случае на второе место в формуле |
Характерна переменная валентность. В – указывается в названии вещества. Например, оксид серы (IV),
сульфид фосфора (III). | Неметалл ставится в этом случае на первое место в формуле |
Запомните! Низшую валентность проявляет тот элемент — неметалл, который находится в таблице Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Если данное правило не работает. То следует воспользоваться информацией о бинарных формулах веществ (оксидах, хлоридах, сульфидах и др.).
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов. | ||
ОКСИДЫ | СУЛЬФИДЫ | ХЛОРИДЫ |
Оксид – это сложное вещество,
в состав которого входят два вида атомов, одним из которых является кислород,
с валентностью (II). Na2О | Сульфид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является сера, с валентностью (II). K2S | Хлорид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является хлор, с валентностью (I). FeCl3 |
Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента | Общая формула где Э – элемент; Х – валентность элемента |
* Другие
бинарные соединения: ЭxFy — фторид; ЭxBry —бромид; ЭxIy –йодид; ЭxNy –нитрид; ЭxPy –фосфид; ЭxHy –гидрид (у элемента на второй позиции низшая валентность).
Алгоритм составления формулы соединения оксида фосфора
Последовательность действий | Составление формулы оксида фосфора |
1. Написать символы элементов | Р О |
2. Определить валентности элементов | V II |
3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10 : 5 = 2 10 : 2 = 5 P : О = 2 : 5 |
5. | Р2 О5 |
6. Формула соединения (оксида) | Р2О5 |
Для составления формулы вещества можно воспользоваться следующим алгоритмом:
В=Nгруппы | В=8-Nгруппы |
Ах | Ву |
Запомните! Если элемент А – металл побочной
подгруппы или неметалл с переменной валентностью, валентность А определяем не
по таблице Менделеева, а согласно названию вещества. Например, оксид серы (IV), сульфид фосфора (III).
Например, оксид серы (IV), сульфид фосфора (III).
Электроотрицательность, степень окисления и валентность химических элементов. Часть 1
Чтобы поделиться, нажимайте
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Дан ряд элементов: 1) C; 2) H; 3) O; 4) Mg; 5) N.
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +4.
Запишите в поле ответа номера выбранных элементов.

Дан ряд элементов: 1) Sn; 2) Fe; 3) C; 4) Pb; 5) Cr.
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +6.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) O; 2) H; 3) Be; 4) Cu; 5) N.
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют только положительную степень окисления.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) H; 2) S; 3) F; 4) Na; 5) Mg.
Из указанных в ряду элементов выберите два элемента, которые в соединениях
не проявляют отрицательную степень окисления. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Mg; 2) Al; 3) Na; 4) S; 5) Si.

Из числа указанных в ряду элементов выберите два элемента, которые проявляют в соединениях с кислородом степень окисления +4.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) B; 2) Al; 3) F; 4) Fe; 5) N.
Из числа указанных в ряду элементов выберите два элемента, которые проявляют в оксидах степень окисления как +2, так и +3.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) H; 2) He; 3) Al; 4) Si; 5) P.
Из числа указанных в ряду элементов выберите два элемента, которые проявляют положительную степень окисления в соединениях с водородом. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Li; 2) Be; 3) C; 4) Si; 5) P.
Из числа указанных в ряду элементов выберите два элемента, которые проявляют одинаковую высшую степень окисления.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Cl; 2) F; 3) N; 4) Li; 5) S.
Из числа указанных в ряду элементов выберите два элемента, образующие летучее
водородное соединение состава RH. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Be; 2) N; 3) Na; 4) C; 5) Cu.
Из числа указанных в ряду элементов выберите два элемента, образующие высший
оксид состава RO. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Na; 2) Cl; 3) Si; 4) Mn; 5) Cr.
Из числа указанных в ряду элементов выберите два элемента, которые проявляют отрицательную степень окисления.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) C; 2) N; 3) F; 4) Be; 5) Ne.

Из числа указанных в ряду элементов выберите два элемента, высшая степень окисления которых не совпадает с номером группы.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Al; 2) C; 3) Cl; 4) P; 5) Ca.
Из числа указанных в ряду элементов выберите два элемента, образующие водородное соединение состава RH
3. Запишите в поле ответа номера выбранных элементов.Дан ряд элементов: 1) Na; 2) Al; 3) Zn; 4) P; 5) Kr.
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +3.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) O; 2) Fe; 3) Mn; 4) Si; 5) C.
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +6.

Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Cl; 2) He; 3) Mg; 4) Al; 5) Cu.
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +3.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Li, 2) Ca, 3) Cs, 4) N, 5) K.
Выберите два элемента, которые в соединениях могут проявлять степень окисления +2.
Дан ряд элементов: 1) Na, 2) Be, 3) Cl, 4) Ba, 5) Mg.
Выберите два элемента, которые в соединениях могут проявлять степень окисления +1.
Выберите два элемента, низшая степень окисления которых равна –1.
1) H;
2) Li;
3) F;
4) Al;
5) N.
Запишите в поле ответа номера выбранных элементов.
Выберите два элемента, которые в соединениях могут проявлять степень окисления +4.

1) N;
2) B;
3) Si;
4) O;
5) Al.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Дан ряд элементов: 1) C; 2) Be; 3) F; 4) Cr; 5) Cu.
Из числа указанных в ряду элементов выберите два элемента, которые проявляют постоянную степень окисления в соединениях.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Li; 2) Na; 3) K; 4) F; 5) O.
Из числа указанных в ряду элементов выберите два элемента, которые
не проявляют высшей степени окисления, равной номеру группы.Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Li; 2) Na; 3) Al; 4) C; 5) N.
Из числа указанных в ряду элементов выберите два элемента, атомы которых имеют наибольшую электроотрицательность.

Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Li; 2) С; 3) N; 4) Br; 5) Cl.
Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковою низшую степень окисления.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Mg; 2) P; 3) N; 4) O; 5) Ti.
Из числа указанных в ряду элементов выберите два элемента, которые
не проявляют валентности, равной номеру группы.Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Ca; 2) Si; 3) P; 4) Be; 5) S.
Из числа указанных в ряду элементов выберите два элемента, которые проявляют постоянную степень окисления в соединениях.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) S; 2) Al; 3) Mn; 4) C; 5) Na.

Из числа указанных в ряду элементов выберите два элемента, которые в сложных веществах проявляют постоянную степень окисления.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) C; 2) P; 3) Ca; 4) F; 5) Mg.
Из числа указанных в ряду элементов выберите два элемента, которые в сложных веществах проявляют постоянную степень окисления +2.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Fe; 2) S; 3) Ca; 4) As; 5) P.
Из числа указанных в ряду элементов выберите два элемента, которые с водородом образуют летучие соединения состава ЭН
3.Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Fe; 2) S; 3) Ca; 4) As; 5) P.
Из числа указанных в ряду элементов выберите два элемента, которые с водородом образуют соединения состава ЭН
2.
Запишите в поле ответа номера выбранных элементов.
Ответы:
- 15
- 25
- 34
- 45
- 45
- 45
- 34
- 34
- 12
- 15
- 23
- 35
- 14
- 24
- 23
- 14
- 24
- 13
- 13
- 13
- 23
- 45
- 45
- 45
- 34
- 14
- 25
- 35
- 45
- 23
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
Валентность элемента и номер главной подгрупп
Высшая валентность элементов определяется в основном номером группы периодической системы, т. е. должна изменяться в пределах от 1 до 8. Однако ход изменения валентности элементов в периодах и группах представляет собой сложную функцию (наблюдается ряд отступлений). Например, в главной пэлементы одновалентны, а в побочной подгруппе этой группы валентность элементов Си, Ag и Аи может быть равна 1, 2 и 3. Элементы VHI побочной подгруппы, судя по номеру группы, должны проявлять максимальную валентность 8. Но только для рутения и осмия известны соединения, в которых они восьмивалентны для остальных элементов подгруппы известны максимальные валентности от 4 до 6. [c.77]
е. должна изменяться в пределах от 1 до 8. Однако ход изменения валентности элементов в периодах и группах представляет собой сложную функцию (наблюдается ряд отступлений). Например, в главной пэлементы одновалентны, а в побочной подгруппе этой группы валентность элементов Си, Ag и Аи может быть равна 1, 2 и 3. Элементы VHI побочной подгруппы, судя по номеру группы, должны проявлять максимальную валентность 8. Но только для рутения и осмия известны соединения, в которых они восьмивалентны для остальных элементов подгруппы известны максимальные валентности от 4 до 6. [c.77] Рассмотреть особенности строения атомов элементов главной подгруппы третьей группы. Какие валентные состояния характерны для этих элементов Как изменяются их свойства с увеличением порядкового номера элемента [c.244]
I См. также Номер главной подгруппы и валентность (стр. 44). Валентность указывается римской цифрой вверху справа от сим-вола элемента. [c.58]
[c.58]
Какая существует зависимость между числом валентных электронов атома и номером группы, в которой находится элемент а) главной подгруппы, б) побочной подгруппы [c.65]
Хлор находится в УП (нечетной) группе и валентности его будут нечетными 1, 3, 5 и 7. Таким образом, для элементов главных подгрупп четных групп будет характерна переменная четная валентность, для нечетных подгрупп — нечетная. В том и другом случае максимальная валентность не превышает номера группы, т. е. числа электронов на внешней оболочке. [c.76]
Элементы побочных подгрупп в какой-то мере сходны с элементами соответствующих главных подгрупп. Сходство в наибольшей степени проявляется у элементов третьей группы, где только начинается ответвление побочных подгрупп. С возрастанием порядкового номера -элемента в группе и номера самой группы (начиная с третьей группы) сходство уменьшается и в восьмой группе почти совсем исчезает. В первой группе вновь появляется отдаленное сходство элементов обеих подгрупп, а во второй сходство весьма сильное электроны (п—1) элементов подгруппы цинка уже не участвуют в валентных связях. [c.318]
[c.318]
Гомология Н и Не со щелочными и щелочноземельными металлами в свете изложенного становится ясной, последует еще указать на причину укрепившегося в науке сопоставления гелия с элементами последовательности N6— Кп. Давно уже полагают, что в Системе имеется нулевая группа элементов, включающая в себя не только неон и его гомологи, но и гелий. Так как номера главных подгрупп теперь обычно сопоставляют с числом внешних валентных дор-электронов, то в последнее время предложено называть неон и его гомологи элементами восьмой группы при этом делается очевидным, что гелий к подгруппе неона принадлежать не может, г Причина сходства Не и Ые, т. е. их функциональной химической инертности, не одинакова для Не она заложена в законченности подоболочки [c.165]
Металлическими элементами, как известно, начинается каждый период, и число их возрастает с увеличением номера периода. Так, если в первом периоде металлических элементов нет совсем, то во втором их два, в третьем три, в четвертом тринадцать, в пятом четырнадцать, в шестом двадцать восемь. В седьмом периоде металлическими должны быть двадцать девять элементов. Металлические элементы по максимальной валентности, формам и свойствам главных соединений подразделяются на группы и подгруппы. Элементы, составляющие главную подгруппу I группы периодической системы (за исключением водорода), называются щелочными металлами. Элементы главной подгруппы П группы (кроме бериллия) носят название щелочноземельных металлов. [c.200]
В седьмом периоде металлическими должны быть двадцать девять элементов. Металлические элементы по максимальной валентности, формам и свойствам главных соединений подразделяются на группы и подгруппы. Элементы, составляющие главную подгруппу I группы периодической системы (за исключением водорода), называются щелочными металлами. Элементы главной подгруппы П группы (кроме бериллия) носят название щелочноземельных металлов. [c.200]
Современная теория строения атомов и молекул неопровержимо свидетельствует о том, что основой периодического закона является строение электронных оболочек атомов химических элементов. Важнейшая химическая характеристика элементов главных подгрупп — валентность атомов — определяется структурой внешнего электронного слоя, конкретнее — числом неспаренных электронов. Строго обусловленные причины предопределяют периодичность заполнения электронных уровней в атомах с увеличением атомного номера, т. е. с возрастанием числа электронов. Это в свою очередь обусловливает периодическое изменение числа неспаренных элект [c. 18]
18]
Первый вариант системы, который Менделеев разослал многим химикам в феврале 1869 г., был так называемым длиннопериодным. В одной из современных форм такой вариант помещен на втором форзаце. В ней подгруппы в- и р-элементов (главные) помечены буквой А, подгруппы -элементов (побочные) — буквой В рядом с номером группы. Сходство элементов подгрупп А и В одной группы обнаруживается главным образом в высших кислородных соединениях (в соединениях с высшей положительной валентностью). У них гораздо меньше сходства в соединениях с низшей положительной валентностью, мало сходства в простых веществах и совсем нет сходства в водородных соединениях. В строении атомов это сходство проявляется в одинаковом числе электронов, от которых зависит проявление валентности элементов, а различие заключается в том, что эти электроны у главных элементов принадлежат только внешнему уровню, а у побочных распределены по двум уровням (л — 1)й и П8. [c.79]
У элементов главных подгрупп высшая положительная валентность определяется общим числом П5- и пр-электронов внешнего слоя атома. У элементов же побочных подгрупп суммируются пз- и и (п — 1) -электроны внешнего (п) и предвнешнего (п — 1) электронных слоев. Эти суммы и отвечают номеру группы. [c.87]
У элементов же побочных подгрупп суммируются пз- и и (п — 1) -электроны внешнего (п) и предвнешнего (п — 1) электронных слоев. Эти суммы и отвечают номеру группы. [c.87]
Назовите d-элементы IV группы периодической системы, напишите их электронные формулы и укажите различие в строении внешнего электронного слоя нх атомов и атомов элементов главной подгруппы. Приводит ли это к различию в числе валентных электронов Совпадает ли оно с номером группы [c.317]
Из таблицы видно, что в атомах элементов II группы валентными являются п5 -электроны, где п — номер периода. В атомах элементов главной подгруппы пх -электроны служат непосредственной достройкой к оболочке атома соответствующего инертного элемента [c.410]
С увеличением номера периода увеличивается радиус атома и ослабляется связь валентных электронов с ядром. С увеличением номера группы для элементов главных подгрупп увеличивается шсло электронов на внешнем энергетическом уровне, увеличивается заряд ядра и усиливается связь валентных электронов с ядром. [c.77]
[c.77]
Общая характеристика элементов подгруппы титана. Атомы этих элементов имеют электронную конфигурацию (п— )d ns . Их высшая валентность равна четырем, но бывают двух- и трехвалентными. Стабильность высшей валентности немного увеличивается с увеличением порядкового номера, но в главной подгруппе от германия к свинцу она уменьшается. Устойчивость соединений двух- и трехвалентных элементов невелика и убывает от титана к гафнию. Цирконий является немного металличнее титана, а свойства гафния очень близки к цирконию. Отделить гафний от циркония — задача очень сложная. Благодаря лантаноидному сжатию радиусы атома Hf и иона Hf » меньше, чем у циркония, потенциал ионизации (7,3 в) на 0,5 в выше, чем у циркония. Плотность гафния в 2 раза больше плотности циркония, а электродные потенциалы Э/Э у них обоих близки к —1,5 в. Титан обычно не образует ионов Ti . [c.329]
По химической активности и другим химическим свойствам больше всего к щелочным металлам должны приближаться элементы, соседние с ними в периодической системе, образующие главную подгруппу П группы, особенно с большими порядковыми номерами, вследствие этого большими размерами атомов и особенно слабой связью внешних, или валентных, электронов. От атома соседнего щелочного металла атомы элементов рассматриваемого семейства отличаются лишней единицей положительного заряда ядра и добавочным электроном во внешнем слое. Отдавая оба валентных электрона, они обращаются в двукратно положительно заряженные ионы, поэтому во всех соединениях положительно двухвалентны. В качестве представителя таких металлов рассмотрим кальций. [c.132]
От атома соседнего щелочного металла атомы элементов рассматриваемого семейства отличаются лишней единицей положительного заряда ядра и добавочным электроном во внешнем слое. Отдавая оба валентных электрона, они обращаются в двукратно положительно заряженные ионы, поэтому во всех соединениях положительно двухвалентны. В качестве представителя таких металлов рассмотрим кальций. [c.132]
Номер группы периодической системы равняется количеству валентных электронов, находящихся в этой группе элементов. В главных подгруппах помер группы соответствует количеству электронов, находящихся на внеш-етем слое, а в побочных группах номер группы показывает общее количество валентных электронов у данного элемента, т. е. то наибольшее количество электронов, которое атом может отдавать со своего внешнего и предпослед-мего слоя. Исключение составляют элементы восьмой группы и побочной шодгруппы первой группы периодической системы. В восьмой группе, как уже говорилось, не все элементы способны проявлять положительную валентность, равную восьми. Находящиеся в побочной подгруппе первой группы медь, серебро и золото могут проявлять валентность и больше единицы медь бывает двухвалентной, а серебро и золото — трехвалептными. У этих элементов предпоследний 18-й электронный слой еще не является устойчивым. [c.228]
Находящиеся в побочной подгруппе первой группы медь, серебро и золото могут проявлять валентность и больше единицы медь бывает двухвалентной, а серебро и золото — трехвалептными. У этих элементов предпоследний 18-й электронный слой еще не является устойчивым. [c.228]
У благородных газов атомные номера равны 2, 10, 18, 36, 54 и 86. Интервалы равны 2, 8, 8, 18, 18 и 32. За каждым благородным газом следует чрезвычайно химически активный металл, образующий ионы М +. Это щелочные металлы У, Ыа, К, Rb и Сз. Каждому благородному газу предшествует химически активный. ..щелочные металлы неметалл, образующий ионы V . Это галогены стоят друг под другом Р, С1, Вг, I и А1. За щелочными металлами (группа в 1 группе. . 1А, главная подгруппа) следует щелочноземельные металлы Ве, Мд, Са, 5г и Ва,. образующие группу ПА. Галогенам (группа УИБ) предшествуют О, 5, 5е и Те элементы с валентностью, равной 2, свойства которых меняются от неметаллических до металлических. В группы 1ИБ, 1УБ и УБ входят. ..в вертикальные элементы, менее похожие друг на друга. Все они группы входят элементы, проявляют типичную для своей группы валентность, [c.50]
..в вертикальные элементы, менее похожие друг на друга. Все они группы входят элементы, проявляют типичную для своей группы валентность, [c.50]
Алюминий находится в главной подгруппе III группы периодической системы элементов Д. И. Менделеева. Порядковый номер его 13, атомный вес 26,9815. Электронная конфигурация атома алюминия в невозбужденном состоянии ls 2s 2p 3s 3p Валентными являются три электрона s- и р-подуровней последнего слоя, в соответствии с этим алюминий проявляет максимальную валентность 3+. [c.9]
В главные подгруппы попадают s- н р-элемепты, у которых валентными являются s- и р-электроны. Сумма 5- и р-электронов на внещнем уровне равна номеру группы. В побочных подгруппах расположены элементы, в атомах которых происходит заполнение -подуровней предпоследнего уровня. У этих элементов помимо s-электронов внешнего уровня валентными могут быть также -электроны с предпоследнего уровня. Взглянув на периодическую таблицу и подсчитав у какого-нибудь элемента побочной подгруппы П1—VH групп сумму этих S- и -электронов, нетрудно убедиться, что она равна количеству валентных электронов элементов главной подгруппы той же группы. Таким образом, можно сказать, что в основе построения короткой формы периодической таблицы (напомни . еще раз, что она была предложена Д. И. Менделеевым еще в 1871 г. ) лежит заполнение электронами внешнего уровня с учетом -электронов на предпоследнем уровне. [c.117]
Таким образом, можно сказать, что в основе построения короткой формы периодической таблицы (напомни . еще раз, что она была предложена Д. И. Менделеевым еще в 1871 г. ) лежит заполнение электронами внешнего уровня с учетом -электронов на предпоследнем уровне. [c.117]
Магний расположен в главной подгруппе второй группы периодической системы элементов Д. И. Менделеева. Порядковый номер его 12, атомный вес 24,312. Электронная конфигурация атома-магния в невозбужденном состоянии 1х 25 /) 35 валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность 2- -. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации поэтому магний в химич ском отношении очень активен. На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
Группа — совокупность элементов с одинаковым числом валентных электронов, равным номеру группы. Валентные электроны s и р соответствуют элементам главных подгрупп, валентные электроны d и f — элементам побочных подгрупп. [c.84]
Здесь уместно отметить одну важную особенность, свойственную всем элементам побочных подгрупп, кроме ШВ-труппы (подгруппа скандия) усиление химической благородности металлов в пределах группы с увеличением атомного номера элемента. В главных подгруппах и в подгруппе скандия сверху вниз нарастают металлические свойства, а начиная именно с подгруппы титана наблюдается обратная закономерность. С этой точки зрения, элементы IVB-группы, так же как и элементы IVA-группы, являются своеобразной границей, разделяющей две противоположные тенденции. Отмеченное обстоятельство связано с тем, что между IIIB- и IVB-группами вклиниваются семейства /-элементов, что наглядно отражается в развернутой (32-клеточной) форме системы. При этом валентные 6s-электроны тяжелых элементов подгрупп титана, ванадия и т.д., следующих за лантаноидами, обнаруживают эффект проникновения сквозь двойной слой из 5d-и 4/-электронов. Этим и обусловлено ослабление металлических свойств гафния, тантала, вольфрама и т.д. На этой особенности основана интерпретащ1Я закономерностей изменения степеней окисления, кислотно-оснбвных и окислительновосстановительных свойств в группах -элементов. [c.391]
При этом валентные 6s-электроны тяжелых элементов подгрупп титана, ванадия и т.д., следующих за лантаноидами, обнаруживают эффект проникновения сквозь двойной слой из 5d-и 4/-электронов. Этим и обусловлено ослабление металлических свойств гафния, тантала, вольфрама и т.д. На этой особенности основана интерпретащ1Я закономерностей изменения степеней окисления, кислотно-оснбвных и окислительновосстановительных свойств в группах -элементов. [c.391]
Таким образом, валентное число инертных газов равно нулю. Чтобы согласовать номер группы инертных газов с максимальной положительной валентностью, как это сделано для остальных групп периодической системы, эта группа была названа туле-вой группой- ) и помещена в начале периодической системы. При непрерывном расположении элементов, принятом в табл. П (см. приложение), инертные газы попадают в восьмую группу в качестве ее главной подгруппы. Такое расположение согласуется с закономерностями периодической системы, так как при уменьшении отрицательной валентности с возрастанием номера группы, начиная с четвертой главной подгруппы, нулевую валентноать следует ожидать для элементов восьмой главно подгруппы. Двойственность положения инертных газов соответствует их особому характеру по сравнению с элементами остальных главных подгрупп. Подробнее об этом будет сказано в следующей главе. [c.126]
Двойственность положения инертных газов соответствует их особому характеру по сравнению с элементами остальных главных подгрупп. Подробнее об этом будет сказано в следующей главе. [c.126]
Химические свойства элемента определяются количеством валентных электронов. Очень устойчив при химических превращениях благородногазовый октет (s p ). У типических элементов валентные электроны расположены во внешнем слое. Аналоги лития (см. табл. 5.4) имеют только один валентный электрон (s ) У электронов подгруппы бериллия их два (s ) элементы, составляющие главную подгруппу III группы, во внешнем электронном. слое имеют три валентных электрона (s p ), аналоги углерода — четыре электрона (s p ), азота — пять (s p ), кислорода — шесть (s p ) н, наконец, галогенысемь электронов (s p ). Для типических элементов количество валентных электронов совпадает с номером группы в периодической системе элементов. [c.144]
Номера периодов п групп получпли физическое обоснование с точки зрения электронной теории.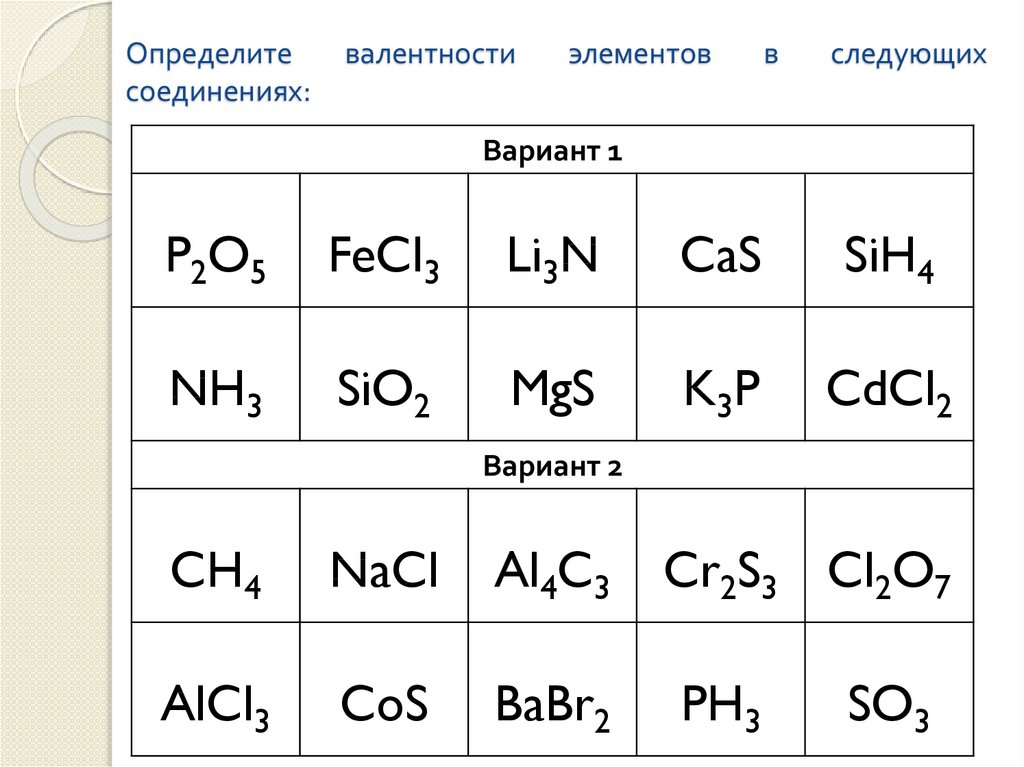 Номер периода равен числу электронных слоёв у атомов данного периода (слои К, L, М, N, О…). Номер группы определяет число валентных электронов у элементов данной группы, причём для элементов всех главных подгрупп и обеих первых групп (I и И) он определяет число электронов во внешнем слое. [c.189]
Номер периода равен числу электронных слоёв у атомов данного периода (слои К, L, М, N, О…). Номер группы определяет число валентных электронов у элементов данной группы, причём для элементов всех главных подгрупп и обеих первых групп (I и И) он определяет число электронов во внешнем слое. [c.189]
Первый период включает всего два элемента, второй и третий периоды — по восемь, четвертый и пятый — по восемнадцать, шестой, седьмой — по тридцать два элемента. Первые три периода называются малыми, а четвертый и с.аедующие—большими. Большие периоды подразделяются на ряды, малые же периоды совпадают с соответствующими рядами. В каждой группе элементы больших периодов подразделяются на две подгруппы — главную и побочную. Элементы малых периодов — второго и третьего — относятся к главной подгруппе. Основанием для помендеиия элементов в ту или иную группу являлась максимально возможная валентность элемента — ее значению соответствует 1юмер группы псключенпе составляют кислород, фтор, неон и элементы побочной подгруппы VIH группы, валентность которых не достигает соответственно шести, семи и восьми, а таклэлементы побочной подгруппы I группы, валентность которых достигает трех. Номер каждого периода совпадает с числом электронных уровней в оболочках атомов, номер группы — с числом электронов па наружном уровне электронной оболочки, хотя это выполняется только для атомов элементов главных подгрупп. [c.36]
Номер каждого периода совпадает с числом электронных уровней в оболочках атомов, номер группы — с числом электронов па наружном уровне электронной оболочки, хотя это выполняется только для атомов элементов главных подгрупп. [c.36]
Для MerajiflOB в соединениях характерно отдавать свои валентные электроны с образованием положительно заряженных ионов. Элементы главных подгрупп имеют число валентных электронов, равное номеру группы. Поэтому [c.73]
Высшая положительная валентность элементов обычно отвечает номеру группы, причем в высших оксидах и гидроксидах кислотный характер растет слева направо по периодам, а основной — ослабевает. У фтора вообще не обнаружена положительная валентность в соединениях он всегда одновалентен. Положительная валентность кислорода проявляется только в соединениях с фтором и равна двум. Железо, кобальт и никель проявляют высшую валентность соответственно шесть, четыре и три, палладий — четыре, родий, иридий и платина — шесть, бром и астат — пять.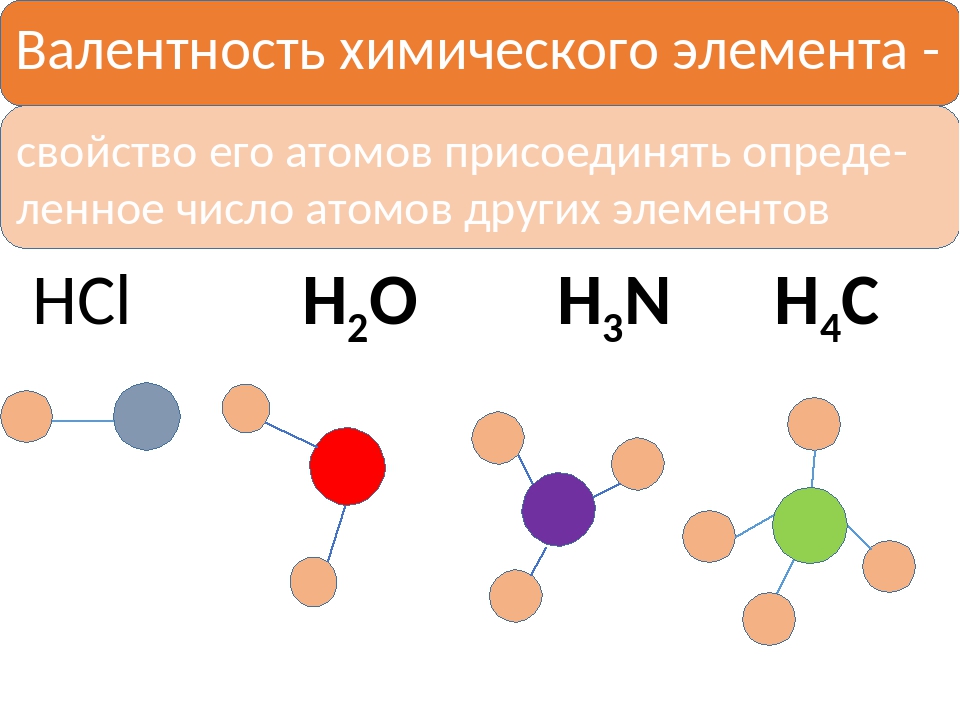 У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
ГАЛОГЕНЫ (галоиды) — химические элементы главной подгруппы VII группы периодической системы элементов Д. И. Менделеева фтор F, хлор С1, бром Вг, иод I и астат At. Название галогены происходит от греч. hais — соль и genes — рождать. Неправильное название галоиды , которое ввел Г. И. Гесс, означает солеподобный . Атомы Г. имеют конфигурацию валентных электронов присоединяя один электрон, приобретают конфигурацию инертного газа s p . Все Г.— активные неметаллы, непосредственно соединяются с большинством элементов, образуя галогениды. Г.— энергичные окислители, их окислительная способность падает от F к I. Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
Г.— энергичные окислители, их окислительная способность падает от F к I. Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
Из приведенных схем видно, что у трехвалентного хрома, двух- и четырехвалентного марганца число валентных электронов меньше числа неспаренных электронов. Данное обстоятельство, а также некоторые другие особенности элементов побочных подгрупп в сильной степени усложняют вопрос о валентностях этих элементов. Объяснить так наглядно и просто валентности элементов побочных подгрупп даже в их простейших соединениях, как это было сделано для элементов главных подгрупп, не представляется возможным. В отличне от элементов главных подгрупп, для которых максимальная валентность равна номеру группы, для некоторых элементов побочных подгрупп могут наблюдаться валентности больше номера группы. Например, для находящихся в первой группе меди и золота наряду с валентностью единица характерна также валентность два и три соответственно. [c.78]
Объяснить так наглядно и просто валентности элементов побочных подгрупп даже в их простейших соединениях, как это было сделано для элементов главных подгрупп, не представляется возможным. В отличне от элементов главных подгрупп, для которых максимальная валентность равна номеру группы, для некоторых элементов побочных подгрупп могут наблюдаться валентности больше номера группы. Например, для находящихся в первой группе меди и золота наряду с валентностью единица характерна также валентность два и три соответственно. [c.78]
В III— VIII группах главных подгрупп расположено 30 р-элементсв и два s-элемента (водород и гелий). В периодах слева направо в атомах р-элементов заполняется электронами р-подуровень от р до р . Валентными являются не только р-электроны, но и s-электроны внешнего уровня атома. Их сумма соответствует номеру группы, в которой расположен элемент, и высшей положительной степени окисления ns p , ns p , ns p , ns p, ns p , ns p . С увеличением числа электронов на внешнем уровне атомов уменьшается восстановительная способность атомов и усиливается их окислительная активность (увеличивается электроотрицательность, сродство к электрону, энергия ионизации элементов). В группах периодической системы сверху вниз у р-элементов заметно усиливаются восстановительные свойства. [c.229]
В группах периодической системы сверху вниз у р-элементов заметно усиливаются восстановительные свойства. [c.229]
Явно выраженная периодичность характерна для энтальпий атомизации простых веществ (рнс. 6). Для элементов малых периодов кривая зависимости энтальпии атомизации от атомного номера нроходит через четко выраженный максимум, приходящийся на элементы IУА-группы (Сал , 31). Это обусловлено, с одной стороны, упрочнением связей в кристаллах по мере увеличения числа валентных электронов от одного до четырех, а с другой — уменьшением прочности кристаллической решетки за счет уменьшения координационного числа ковалентных структур по правилу 8—N после 1УА-группы. Минимумы на кривой соответствуют кристаллам благородных газов, образованным за счет слабых сил межмолекулярного взаимодействия. В больших периодах для 5- и р-элементов (главные подгруппы) эта закономерность также просматривается. Однако на нее накладывается изменение энтальпий в рядах переходных металлов. При этом для металлов первой вставной декады, обладающих кайносимметричными Зй-электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная осо- [c.34]
При этом для металлов первой вставной декады, обладающих кайносимметричными Зй-электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная осо- [c.34]
Кислород — элемент с порядковым номером 8, его относительная атомная масса 15,999ж1 . Находится во втором периоде, в главной подгруппе VI группы. Электронное строение атома кислорода и его валентные возможности рассмотрены выше. [c.355]
Каждый период начинается с s-элемента, которые находятся в IA- и ПА-подгруппах (А — главные подгруппы), уО-элементы находятся в 1ПА- и VIIIA-под-группах. Следовательно, суммарное число валентных (внешних) S- и р-элементов равно номеру группы в периодической системе. Например, электронная формула элемента 2-го периода VIA-подгруппы будет оканчиваться. ..2s 2p (2 + 4 = 6), а электронная формула элемента 5-го периода ПА-подгруппы —. . . (2 + 0) Tl т. д. [c.74]
Перед детальным обсуждением структурной химии этих элементов необ. ходимо обратить внимание на одну особенность, прису-П1ую. многим из нпх. Уже от.мечалось ранее, что элементы Си, Ag и Аи могут использовать для связи d-электроны с главным квантовым числом на единицу меньшим, чем у s- и р-орбиталей, причем медь может терять 1 или 2 Зс -электронов и образовывать ионы Си + и Си +. Однако некоторые элементы последующих Б-подгрупп ведут себя совершенно иначе. Кроме образования обычного иона с потерей всех N электронов внешней оболочки N — номер группы в периодической системе) может происходить потеря только р-электронов, а пара s-электро-пов оставаться связанной с ядром в виде так называемой инерт-нон пары. В случае одноатомного иона это означает, что М должен иметь по крайней мере 3 электрона в валентной оболочке и, следовательно, необходимо искать подтверждения факта существования ионов у металлов группы П1Б и нонов в группе IVB. В состоянии одноатомного газа ртуть сохраняет структуру 78 (2) тогда ион (Hg—ng) + (еслн бы такой свободный ион существовал) сохранял такой же эффективный атомный номер (к этому вопросу мы вернемся позже).
ходимо обратить внимание на одну особенность, прису-П1ую. многим из нпх. Уже от.мечалось ранее, что элементы Си, Ag и Аи могут использовать для связи d-электроны с главным квантовым числом на единицу меньшим, чем у s- и р-орбиталей, причем медь может терять 1 или 2 Зс -электронов и образовывать ионы Си + и Си +. Однако некоторые элементы последующих Б-подгрупп ведут себя совершенно иначе. Кроме образования обычного иона с потерей всех N электронов внешней оболочки N — номер группы в периодической системе) может происходить потеря только р-электронов, а пара s-электро-пов оставаться связанной с ядром в виде так называемой инерт-нон пары. В случае одноатомного иона это означает, что М должен иметь по крайней мере 3 электрона в валентной оболочке и, следовательно, необходимо искать подтверждения факта существования ионов у металлов группы П1Б и нонов в группе IVB. В состоянии одноатомного газа ртуть сохраняет структуру 78 (2) тогда ион (Hg—ng) + (еслн бы такой свободный ион существовал) сохранял такой же эффективный атомный номер (к этому вопросу мы вернемся позже). Чрезвычайно низкую степень ионизации галогенидов ртути Сиджвик рассматривал как доказательство инертности пары бх-электро-нов Hg, однако нет сомнения в том, что в кристаллическом HgFa (структура флюорита) присутствуют ионы Hg +. Доказательство существования нонов можно получить, изучая свойства соединений в растворах нли в расплавах, а также природу нх кристаллических структур. [c.287]
Чрезвычайно низкую степень ионизации галогенидов ртути Сиджвик рассматривал как доказательство инертности пары бх-электро-нов Hg, однако нет сомнения в том, что в кристаллическом HgFa (структура флюорита) присутствуют ионы Hg +. Доказательство существования нонов можно получить, изучая свойства соединений в растворах нли в расплавах, а также природу нх кристаллических структур. [c.287]
Электроотрицательность. Степень окисления и валентность химических элементов / Справочник :: Бингоскул
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
- Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
- СО всех простых веществ соответствует нулю;
- Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
- Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
- Постоянную СО имеют фтор (-1), щелочные металлы (+1), щелочноземельные, а также бериллий, магний, цинк (+2), алюминий (+3). У кислорода СО равна -2, исключение пероксиды (+2). У водорода +1, исключение соединения с металлами (гидриды) -1.
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
- Найдем и проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х».
 — H+13 PX O-24
— H+13 PX O-24 - Используя эти значения составим и решим уравнение с одной неизвестной. (+1) * 3 + (x) * 1 + (-2) * 4 = 0 Следовательно, x=5 или +5. Таким образом, СО у фосфора +5.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
- Проставим известные СО элементов – алюминий и кислород, у азота примем СО за «x». Al+3 (NxO-23)3
- Составим и решим уравнение — (+3) * 1 + 3x + 9 * (-2) = 0. В итоге получаем x=+5, то есть СО у азота в соединении +5.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Валентность обозначается римскими цифрами и указывается над химическим элементом справа вверху и не имеет знака (+ или -). Может быть постоянной или переменной.
Может быть постоянной или переменной.
Для определения валентности применяются определенные правила:
- У металлов главных подгрупп валентность всегда постоянная и определяется по номеру группы.
- У металлов побочных подгрупп и неметаллов валентность переменная. Высшая валентность = номеру группы, а низшая = 8 — номер группы.
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
- Количеством неспаренных электронов;
- Наличием свободных орбиталей;
- Наличием неподеленных пар электронов.
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Атом С способен присоединять и отдавать электроны с образованием ковалентных связей. Валентные возможности углерода очень широкие, он может принимать значение степени окисления от +4 до -4.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Смотри также:
В химических соединениях степень окисления и валентность.
 Чем валентность отличается от степени окисления. Как рассчитать степень окисления элемента в соединении
Чем валентность отличается от степени окисления. Как рассчитать степень окисления элемента в соединенииВидеоурок 2: Степень окисления химических элементов
Видеоурок 3: Валентность. Определение валентности
Лекция: Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность
Электроотрицательность – это способность атомов притягивать к себе электроны других атомов для соединения с ними.
Судить об электроотрицательности того или иного химического элемента легко по таблице. Вспомните, на одном из наших уроков было сказано о том, что она возрастает при движении слева направо по периодам в таблице Менделеева и с перемещением снизу вверх по группам.
К примеру,
дано задание определить какой элемент из предложенного ряда наиболее электроотрицателен: C (углерод), N (азот), O (кислород), S (сера)? Смотрим по таблице и находим, что это О, потому что он правее и выше остальных.
Какие же факторы оказывают влияние на электроотрицательность? Это:
- Радиус атома, чем он меньше, тем электроотрицательность выше.
- Заполненность валентной оболочки электронами, чем их больше, тем выше электроотрицательность.
Из всех химических элементов фтор является наиболее электроотрицательным, потому как у него малый атомный радиус и на валентной оболочке 7 электронов.
К элементам, имеющим низкую электроотрицательность, относятся щелочные и щелочноземельные металлы. У них большие радиусы и очень мало электронов на внешней оболочке.
Значения электроотрицательности атома не могут быть постоянными, т.к. она зависит от многих факторов в числе которых перечисленные выше, а также степень окисления, которая может быть различной у одного и того же элемента. Поэтому принято говорить об относительности значений электроотрицательности. Вы можете пользоваться следующими шкалами:
Значения электроотрицательности вам понадобятся при записи формул бинарных соединений, состоящих из двух элементов. К примеру, формула оксида меди Cu 2 O — первым элементом следует записывать тот, чья электроотрицательность ниже.
К примеру, формула оксида меди Cu 2 O — первым элементом следует записывать тот, чья электроотрицательность ниже.
В момент образования химической связи если разница электроотрицательности между элементами больше 2,0 образуется ковалентная полярная связь, если меньше, ионная.
Степень окисления
Степень окисления (СО) – это условный или реальный заряд атома в соединении: условный – если связь ковалентная полярная, реальный – если связь ионная.
Атом приобретает положительный заряд при отдаче электронов, а отрицательный заряд – при принятии электронов.
Степени окисления записываются над символами со знаком «+»/«-» . Есть и промежуточные СО. Максимальная СО элемента положительная и равна № группы, а минимальная отрицательная для металлов равна нулю, для неметаллов = (№ группы – 8) . Элементы с максимальной СО только принимают электроны, а с минимальной, только отдают. Элементы же, имеющие промежуточные СО могут и отдавать и принимать электроны.
Рассмотрим некоторые правила, которыми стоит руководствоваться для определения СО:
СО всех простых веществ равна нулю.
Равна нулю и сумма всех СО атомов в молекуле, так как любая молекула электронейтральна.
В соединениях с ковалентной неполярной связью СО равна нулю (О 2 0), а с ионной связью равна зарядам ионов (Na + Cl — СО натрия +1, хлора -1). СО элементов соединений с ковалентной полярной связью рассматриваются как с ионной связью (H:Cl = H + Cl — , значит H +1 Cl -1).
Элементы в соединении, имеющие наибольшую электроотрицательность, имеют отрицательные степени окисления, если наименьшую положительные. Исходя из этого можно сделать вывод, что металлы имеют только «+» степень окисления.
Постоянные степени окисления :
Водород +1. Исключение: гидриды активных металлов NaH, CaH 2 и др., где степень окисления водорода равна –1.

Кислород –2. Исключение: F 2 -1 O +2 и пероксиды, которые содержат группу –О–О–, в которой степень окисления кислорода равна –1.
Щелочные металлы +1.
Все металлы второй группы +2. Исключение: Hg +1, +2.
Алюминий +3.
Когда образуется ионная связь, происходит определенный переход электрона, от менее электроотрицательного атома к атому большей электроотрицательности. Так же, в данном процессе, атомы всегда теряют электронейтральность и впоследствии превращаются в ионы. Так же образуются целочисленные заряды. При образовании ковалентной полярной связи, электрон переходит только частично, поэтому возникают частичные заряды.
ВалентностьВалентность – это способность атомов образовать n — число химических связей с атомами других элементов.
А еще валентность – это способность атома удержать другие атомы возле себя. Как вам известно из школьного курса химии, разные атомы связываются друг с другом электронами внешнего энергетического уровня. Неспаренный электрон ищет для себя пару у другого атома. Эти электроны внешнего уровня называются валентными. Значит валентность можно определить и как число электронных пар, связывающих атомы друг с другом. Посмотрите структурную формулу воды: Н – О – Н. Каждая черточка – это электронная пара, значит показывает валентность, т.е. кислород здесь имеет две черточки, значит он двухвалентен, от молекул водорода исходят по одной черточке, значит водород одновалентен. При записи валентность обозначается римскими цифрами: О (II), Н (I). Может указываться и над элементом.
Значит валентность можно определить и как число электронных пар, связывающих атомы друг с другом. Посмотрите структурную формулу воды: Н – О – Н. Каждая черточка – это электронная пара, значит показывает валентность, т.е. кислород здесь имеет две черточки, значит он двухвалентен, от молекул водорода исходят по одной черточке, значит водород одновалентен. При записи валентность обозначается римскими цифрами: О (II), Н (I). Может указываться и над элементом.
Валентность бывает постоянной либо переменной. К примеру, у щелочей металлов она постоянна и равняется I. А вот хлор в различных соединениях проявляет валентности I, III, V, VII.
Как определить валентность элемента?
Вновь обратимся к Периодической таблице. Постоянная валентность у металлов главных подгрупп, так металлы первой группы имеют валентность I, второй II. А у металлов побочных подгрупп валентность переменная. Также она переменная и у неметаллов. Высшая валентность атома равна № группы, низшая равна = № группы — 8. Знакомая формулировка. Не означает ли это то, что валентность совпадает со степенью окисления. Помните, валентность может совпадать со степенью окисления, но данные показатели не тождественны друг другу. Валентность не может иметь знака =/-, а также не может быть нулевой.
Знакомая формулировка. Не означает ли это то, что валентность совпадает со степенью окисления. Помните, валентность может совпадать со степенью окисления, но данные показатели не тождественны друг другу. Валентность не может иметь знака =/-, а также не может быть нулевой.
Второй способ определения валентности по химической формуле, если известна постоянная валентность одного из элементов. Например, возьмем формулу оксида меди: CuО. Валентность кислорода II. Видим, что на один атом кислорода в данной формуле приходится один атом меди, значит и валентность меди равна II. А теперь возьмем формулу посложнее: Fe 2 O 3 . Валентность атома кислорода равна II. Таких атомов здесь три, умножаем 2*3 =6. Получили, что на два атома железа приходится 6 валентностей. Узнаем валентность одного атома железа: 6:2=3. Значит валентность железа равна III.
Кроме того, когда необходимо оценить «максимальную валентность», всегда следует исходить из электронной конфигурации, которая имеется в «возбужденном» состоянии.
Валентность и степень окисления – понятия, часто применяемые в неорганической химии. Во многих химических соединениях значение валентности и степень окисления элемента совпадают, именно по этой причине у школьников и студентов часто возникает путаница. У этих понятий действительно есть кое-что общее, но отличия более существенны. Чтобы понять, чем же отличаются эти два понятия, стоит узнать о них больше.
Сведения о степени окисления
Степень окисления – вспомогательная величина, приписываемая атому химического элемента или группе атомов, которая показывает, каким образом распределены общие пары электронов между взаимодействующими элементами.
Это вспомогательная величина, не имеющая физического смысла как такового. Ее суть достаточно просто объяснить с помощью примеров:
Молекула пищевой соли NaCl состоит из двух атомов – атома хлора и атома натрия. Связь между этими атомами ионная. У натрия на валентном уровне 1 электрон, значит у него с атомом хлора одна общая электронная пара.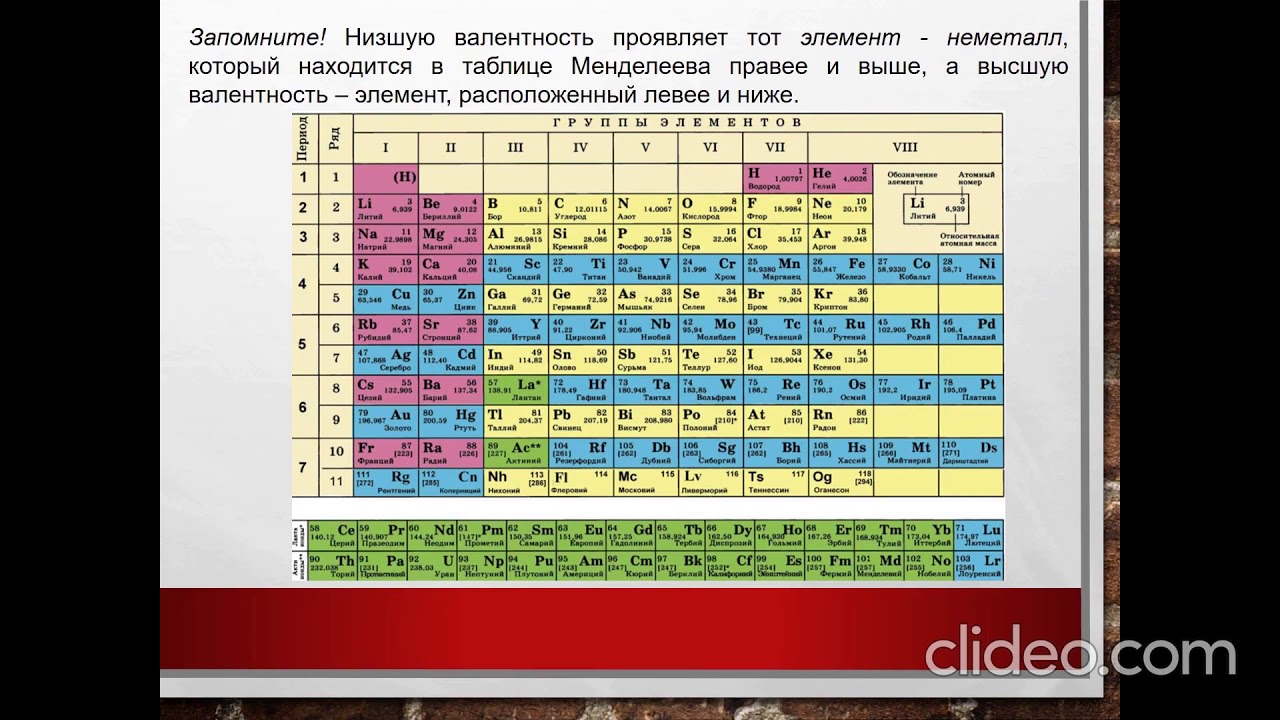 Из этих двух элементов хлор более электроотрицателен (обладает свойством смешать к себе электронные пары), то единственная общая пара электронов сместится к нему. В соединении элемент с более высокой электротрицательностью имеет отрицательную степень окисления, менее электроотрицательный, соответственно, положительную, а ее значение равно количеству общих пар электронов. Для рассматриваемой молекулы NaCl степени окисления натрия и хлора будут выглядеть так:
Из этих двух элементов хлор более электроотрицателен (обладает свойством смешать к себе электронные пары), то единственная общая пара электронов сместится к нему. В соединении элемент с более высокой электротрицательностью имеет отрицательную степень окисления, менее электроотрицательный, соответственно, положительную, а ее значение равно количеству общих пар электронов. Для рассматриваемой молекулы NaCl степени окисления натрия и хлора будут выглядеть так:
Хлор, со смещенной к нему электронной парой, теперь рассматривают как анион, то есть атом, присоединивший к себе дополнительный электрон, а натрий – как катион, то есть атом, отдавший электрон. Но при записи степени окисления на первом месте идет знак, а на втором числовое значение, а при записи ионного заряда – наоборот.
Степень окисления можно определить как число электронов, которых положительному иону не хватает до электронейтрального атома, или которые нужно забрать у отрицательного иона, чтобы окислить до атома. На данном примере очевидно, что положительному иону натрия за счет смещения электронной пары не хватает электрона, а у иона хлора один электрон лишний.
Степень окисления простого (чистого) вещества, не зависимо от его физических и химических свойств, равна нулю. Молекула О 2 , например, состоит из двух атомов кислорода. У них одинаковые значения электроотрицательности, потому общие электроны не смещаются ни к одному из них. Значит, электронная пара находится строго между атомами, потому степень окисления будет нулевой.
Для некоторых молекул бывает сложно определить, куда смещаются электроны, особенно если элементов в ней три или больше. Чтобы высчитать степени окисления в таких молекулах, нужно воспользоваться несколькими простыми правилами:
- Атом водорода почти всегда имеет постоянную степень окисления +1..
- Для кислорода этот показатель равен -2. Исключение из этого правила составляют только оксиды фтора
ОF 2 и О 2 F 2 ,
Так как фтор – элемент с наивысшей электроотрицательностью, потому он всегда смещает к себе взаимодействующие электроны. Согласно международным правилам, элемент с меньшим значением электроотрицаельности записывается первым, потому в этих оксидах кислород на первом месте.
- Если суммировать все степени окисления в молекуле, получится ноль.
- Для атомов металлов характерна положительная степень окисления.
При вычислении степеней окисления нужно помнить, что наибольшая степень окисления элемента равна номеру его группы, а минимальная — номер группы минус 8. Для хлора максимальное возможное значение степени окисления +7, потому что он в 7-ой группе, а минимальная 7-8=-1.
Общие сведения о валентности
Валентность – число ковалентных связей, которые может образовывать элемент в разных соединениях.
В отличии от степени окисления, понятие валентности есть реальный физический смысл.
Самый высокий показатель валентности равен номеру группы в таблице Менделеева. Сера S расположена в 6-ой группе, то есть ее максимальная валентность 6. Но она может быть также 2 (H 2 S) или 4 (SO 2).
Почти для всех элементов характерна переменная валентность. Однако есть атомы, для которых эта величина постоянная. К ним относятся щелочные металлы, серебро, водород (их валентность всегда равна 1), цинк (валентность всегда 2), лантан (валентность равна 3).
К ним относятся щелочные металлы, серебро, водород (их валентность всегда равна 1), цинк (валентность всегда 2), лантан (валентность равна 3).
Что же общего у валентности и степени окисления
- Для обозначения и той, и другой величины используют положительные целые числа, которые пишутся над латинским обозначением элемента.
- Наивысшая валентность, как и наибольшая степень окисления, совпадает с номером группы элемента.
- Степень окисления какого-либо элемента в сложном соединении совпадает с числовым значением одного из показателей валентности. Например, хлор, находясь в 7-ой группе, может иметь валентность 1, 3, 4, 5, 6, или 7, значит возможные степени окисления ±1, +3,+4,+5,+6,+7.
Основные отличия между этими понятиями
- У понятия «валентность» есть физический смысл, а степень окисления – вспомогательный термин, не имеющий реального физического смысла.
- Степень окисления может быть нулевой, больше или меньше нуля.
 Валентность же строго больше нуля.
Валентность же строго больше нуля. - Валентность отображает число ковалентных связей, а степень окисления – распределение электронов в соединении.
Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s 2 2p 5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Разность электроотрицательностей элементов в соединении (ΔX ) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная .
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной , например: связь H-F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными . Например: связь Na-Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисленияСтепень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы.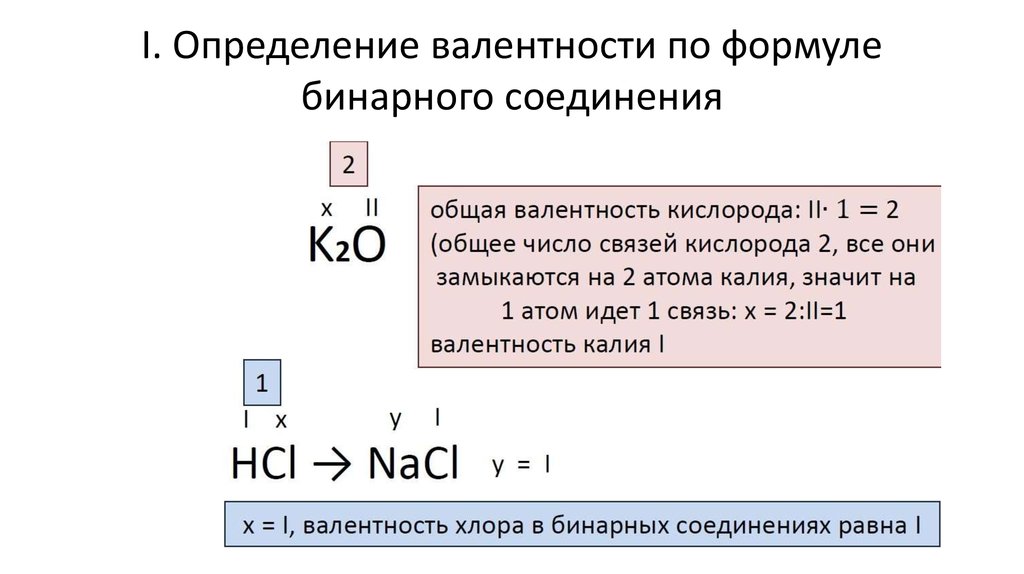 возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
ВалентностьВале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей . Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е. его валентность будет равна n + m . При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N 2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
Учимся определять валентность и степень окисления. Практика показывает, что многие обучающиеся испытывают затруднения при определении валентности и степени окисления. Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления, формирование умения давать количественные оценки и проводить расчеты валентности и степени окисления по химическим формулам в неорганических и органических соединениях, а также способствует подготовке студентов для сдачи ЕГЭ. Пособие направлено на формирование навыков самостоятельной работы с учебным материалом, осуществления поиска и использования информации, формирование и развитие творческого потенциала, повышение интереса к дисциплине. Валентность и степень окисления. Правила определения степеней окисления элементов I . Валентность Валентность – это способность атомов присоединять к себе определенное число других атомов. Правила определения валентности 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. II . Степень окисления Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные. Рассмотрим строение атомов фтора и натрия: — Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? — Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? Оба атома имеют незавершённый внешний уровень? Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня. F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион — анион ) Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион — катион ) Как определить степень окисления атома в ПСХЭ? Правила определения степени окисления атома в ПСХЭ: 1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1) 2. Кислород обычно проявляет СО -2 (исключения: О+2F2, h3O2-1 – перекись водорода) 3. Металлы проявляют только + n положительную СО 4. Фтор проявляет всегда СО равную -1 (F-1) 5. Для элементов главных подгрупп : Высшая СО (+) = номеру группыN группы Низшая СО (-) = N группы –8 Правила определения степени окисления атома в соединении: I. Степень окисления свободных атомов и атомов в молекулах простых веществ равнанулю — Na0, P40, O20 II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду. Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0 [ S +6 O 4 -2 ]2- : (+6)*1+(-2)*4 = -2 Задание 1 – определите степени окисления всех атомов в формуле серной кислоты h3SO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х» (+1)*1+(х)*1+(-2)*4=0 Х=6 или (+6), следовательно, у серы CО +6, т. е. S+6 Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты h4PO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (+1)*3+(х)*1+(-2)*4=0 Х=5 или (+5), следовательно, у фосфора CО +5, т. е. P+5 Задание 3 – определите степени окисления всех атомов в формуле иона аммония (Nh5)+? 1. Проставим известную степень окисления у водорода, а СО азота примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (х)*1+(+1)*4=+1 Х=-3, следовательно, у азота CО -3, т. е. N-3 Алгоритм составления формулы по степени окисления Составление названий бинарных соединений Сравним понятия «валентность» и «степень окисления»: |
Запомни!
Валентность — — это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: h3, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст. ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O2 0 , Cl2 0
II. ст. ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3h4+аммиак)
Нужно помнить, что
Ст. ок. металла всегда положительна
Ст. ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст. ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст. ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1,Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, — S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме + n (ОН) n равна количеству гидроксогрупп.
1. в гидроксогруппе ст. ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст. ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст. ок. водорода +1, кислорода -2
2. ст. ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей степени окисления центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3 угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст. ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, Nh5+Cl- : записываем ион NхН4+1
х + 4∙(+1) = +1
ст. ок. азота -3
Например, определить ст. ок. элементов в гексацианоферрате(III) калия К3
У калия +1: К3+1, отсюда заряд иона 3-
У железа +3 (указано в названии) 3-, отсюда (CN)66-
У одной группы (CN)-
Более электроотрицательный азот: у него -3, отсюда (CхN-3)-
ст. ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст. ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
ст. ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте h4PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
Определим валентность фосфора в этой кислоте.
Известно, что это — одноосновная кислота, поэтому только один атом водорода связан с атомом кислорода. Учитывая, что водород в соединениях одновалентен, а кислород — двухвалентен, получаем структурную формулу, из которой видно, что фосфор в этом соединении имеет валентность пять.
Графический метод определения степени окисления
в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом , при этом получается усредненное значение степени окисления . Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления).
Рассмотрим такой случай:
Пример 1 . Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + h3SO4 ® CO2 + h3O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = — 2/5
В электронном балансе учитываем все 5 атомов углерода:
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = № группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF 2). Расставим известные степени окисления:
Обозначим степень окисления серы как x :
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y :
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать .
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных () орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), треххлористого азота (NCl 3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор() предоставляет ее другому атому с вакантной () орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d -подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5 ? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π -связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O 3 , бензола C 6 H 6 и т.д.
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d -подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s -орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d -подуровня, распаривание электронов s и p- орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H 2 S.
Как мы видим, у атома серы на внешнем уровне появляется d -подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p -подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s -подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO 3 , H 2 SO 4 , SO 2 Cl 2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
таблица или схема постоянной валентности в соединениях и как ее определить по формулам в 8 классе
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
- Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
- Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- Высшая валентность всегда равна № группы.
- Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | Beh3 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, Ch5 |
| 7 | Азот / Nitrogen | N | III, IV | Nh4 |
| 8 | Кислород / Oxygen | O | II | h3O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | Ph4, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | h3S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | Cah3 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, Tih5 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, h4AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | h3SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, Sbh4 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | Teh3, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | Lah4 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, Pbh5 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Источник: https://infotables.ru/khimiya/1071-valentnost-khimicheskikh-elementov
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов
- неподеленных электронных пар на орбиталях валентных уровней
- пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh4), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония Nh5+, азотная кислота и д.р).
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/jelektrootricatelnost-stepen-okislenija-valentnost
Исключений из правила октетов
Неполный октет
Хотя большинство элементов с атомным номером ниже 20 подчиняются правилу октетов, существует несколько исключений, включая соединения бора и алюминия.
Цели обучения
Опишите способы отклонения B, Al, Li и H от правила октетов
Основные выводы
Ключевые моменты
- Правило октетов гласит, что атомы с атомным номером ниже 20 имеют тенденцию объединяться, так что каждый из них имеет восемь электронов в валентных оболочках, что дает им такую же электронную конфигурацию, как у благородного газа.
- Два элемента, которые обычно не заполняют октет, — это бор и алюминий; они оба легко образуют соединения, в которых они имеют шесть валентных электронов, а не обычные восемь, предсказываемые правилом октетов.
- Хотя существуют молекулы, которые содержат атомы с менее чем восемью валентными электронами, эти соединения часто реакционноспособны и могут реагировать с образованием частиц с восемью валентными электронами. Например, BF 3 будет легко связывать фторид-анион с образованием аниона BF 4 — , в котором бор следует правилу октетов.
Ключевые термины
- атомный номер : Число, равное количеству протонов в атоме, которое определяет его химические свойства. Символ: Z. .
- валентные электроны : электроны на внешнем (валентном) основном энергетическом уровне атома, которые могут участвовать в образовании химических связей с другими атомами.
- правило октета : Атомы приобретают, теряют или делятся электронами с другими атомами, чтобы заполнить свой валентный уровень восемью электронами.
Правило октетов и его исключения
Правило октетов гласит, что атомы с атомным номером ниже 20 имеют тенденцию объединяться, так что каждый из них имеет восемь электронов в своих валентных оболочках, что дает им ту же электронную конфигурацию, что и благородный газ. Правило применимо к элементам основной группы, особенно к углероду, азоту, кислороду и галогенам, а также к таким металлам, как натрий и магний.
Валентных электронов можно подсчитать с помощью электронной точечной диаграммы Льюиса.В углекислом газе, например, каждый кислород имеет четыре электрона с центральным углеродом. Эти четыре электрона учитываются как в октете углерода, так и в октете кислорода, поскольку они являются общими.
Двуокись углерода : точечная диаграмма Льюиса для двуокиси углерода.
Водород и литий
Однако многие атомы с атомным номером ниже 20 часто образуют соединения, которые не подчиняются правилу октетов. Например, согласно правилу дуэта первого основного энергетического уровня благородный газ гелий He имеет два электрона на внешнем уровне.Поскольку подоболочки 1p нет, за 1s сразу идут 2s, и, таким образом, на уровне 1 может быть не более , максимум двух валентных электронов. Водороду нужен только один дополнительный электрон, чтобы достичь этой стабильной конфигурации, либо за счет ковалентного обмена электронами, либо за счет превращения в ион гидрида (: H —), в то время как литию необходимо потерять один электрон за счет ионного соединения с другими элементами. Это приводит к тому, что водород и литий имеют по два электрона в валентной оболочке — такую же электронную конфигурацию, что и гелий — когда они образуют молекулы, связываясь с другими элементами.
Бор и алюминий
Есть также множество молекул, в которых слишком мало электронов, чтобы обеспечить октет для каждого атома. Бор и алюминий из группы III (или 13) демонстрируют свойства связывания, отличные от описанных ранее. Каждый из этих атомов имеет по три валентных электрона, поэтому мы можем предсказать, что эти атомы хотят ковалентно связываться, чтобы получить 5 электронов (за счет совместного использования), чтобы выполнить правило октетов. Однако соединения, в которых атомы бора или алюминия образуют пять связей, никогда не наблюдаются, поэтому мы должны сделать вывод, что простые предсказания, основанные на правиле октетов, ненадежны для Группы III.
Рассмотрим трифторид бора (BF 3 ). Связь относительно просто смоделировать с помощью структуры Льюиса, если мы позволим каждому электрону валентного уровня в атоме бора быть разделенными ковалентной связью с каждым атомом фтора. В этом соединении атом бора имеет только шесть электронов валентной оболочки, но правило октета удовлетворяется атомами фтора.
Структура Льюиса трифторида бора : Каждая пара точек представляет пару электронов. При размещении между двумя атомами электроны связаны.Связь можно провести как линию между двумя атомами, которая также указывает на два электрона. Обратите внимание, что центральный атом бора имеет только 6 электронов на окончательной диаграмме / структуре Льюиса этой молекулы.
Из этого одного примера можно сделать вывод, что атомы бора подчиняются правилу секстета. Однако бор образует стабильный ион с водородом, BH 4 —, в котором атом бора действительно имеет полный октет. Кроме того, BF 3 будет реагировать с аммиаком (NH 3 ) с образованием стабильного соединения NH 3 BF 3 , для которого можно нарисовать структуру Льюиса, которая показывает бор с полным октетом.
Комплекс трифторид бора-аммиак : Это ковалентное соединение (NH 3 BF 3 ) показывает, что бор может иметь октет электронов на своем валентном уровне.
Соединения алюминия следуют аналогичным тенденциям. Трихлорид алюминия (AlCl 3 ), гидрид алюминия (AlH 3 ) и гидроксид алюминия (Al (OH) 3 ) указывают на валентность трех для алюминия с шестью валентными электронами в связанной молекуле. Однако стабильность ионов гидрида алюминия (AlH 4 — ) указывает на то, что Al может также поддерживать октет электронов валентной оболочки.
Хотя правило октетов все еще может быть полезно для понимания химии бора и алюминия, соединения этих элементов труднее предсказать, чем для других элементов.
Молекулы с нечетными электронами
Молекулы с нечетным числом электронов не подчиняются правилу октетов.
Цели обучения
Опишите отклонение от правила октетов свободными радикалами
Основные выводы
Ключевые моменты
- В то время как большинство соединений, образованных из атомов с атомным номером ниже 20, подчиняются правилу октетов, существует множество примеров соединений, которые этого не делают.
- Наличие нечетного числа электронов в молекуле гарантирует, что она не следует правилу октетов, потому что правило требует восемь электронов (или два для водорода) вокруг каждого атома.
- Наиболее часто встречающиеся стабильные частицы с нечетным числом электронов — это оксиды азота, такие как оксид азота (NO) и диоксид азота (NO 2 ), оба из которых являются свободными радикалами и не подчиняются правилу октетов.
Ключевые термины
- метастабильное : относящееся к физическому или химическому состоянию или относящееся к нему, которое является относительно долгоживущим, но может распадаться до состояния с более низкой энергией при возмущении.
- свободный радикал : Любая молекула, ион или атом с одним или несколькими неспаренными электронами. Они различаются по реакционной способности и стабильности от высокореактивных, возникающих как временные (короткоживущие) частицы, до метастабильных.
- правило октета : Атомы теряют, приобретают или делятся электронами, чтобы иметь полную валентную оболочку из восьми электронов. Водород является исключением, поскольку он может удерживать максимум два электрона на своем валентном уровне.
Свободные радикалы
Некоторые элементы, в первую очередь азот, могут образовывать соединения, не подчиняющиеся правилу октетов.Один класс таких соединений — это соединения с нечетным числом электронов. Поскольку правило октетов требует восьми электронов вокруг каждого атома, молекула с нечетным числом электронов не должна подчиняться правилу октетов. Молекулы с неспаренными электронами называются «свободными радикалами». Хотя обычно они очень нестабильны и, следовательно, обладают высокой реакционной способностью, некоторые свободные радикалы демонстрируют стабильность в течение нескольких дней, месяцев или даже лет. Эти последние соединения называются «метастабильными», что означает, что они будут разлагаться или реагировать, если им дать достаточно времени, но они достаточно стабильны в течение значительного количества времени, от дней до даже лет, когда подвергаются лишь незначительным нарушениям.
Примеры свободных радикальных молекул
Напомним, что структура Льюиса молекулы должна отображать общее количество валентных электронов от всех атомов, которые связаны вместе.
Оксид азота имеет формулу NO. Общее количество валентных электронов 5 + 6 = 11. Следовательно, независимо от того, как электроны распределяются между атомами азота и кислорода, у азота нет возможности иметь октет.Он будет иметь семь электронов, если предположить, что атом кислорода удовлетворяет октету .
Оксид азота : Оксид азота (NO) является примером стабильного свободного радикала. Он не подчиняется правилу октетов для атома азота. Каждая линия вокруг атомов представляет пару электронов.
Оксид азота является побочным продуктом реакций сгорания, которые происходят в двигателях, таких как автомобильные двигатели и электростанции, работающие на ископаемом топливе. Он также вырабатывается естественным образом при электрическом разряде молнии во время грозы.
Двуокись азота — это химическое соединение с формулой NO 2 . Опять же, диоксид азота не подчиняется правилу октетов для одного из своих атомов, а именно азота. Общее количество валентных электронов 5 + 2 (6) = 17. Азот носит стойкий радикальный характер, поскольку он имеет неспаренный электрон. Два атома кислорода в этой молекуле подчиняются правилу октетов.
Диоксид азота : Диоксид азота — еще одна стабильная молекула, не подчиняющаяся правилу октетов.Обратите внимание на семь электронов вокруг азота. Показаны формальные заряды и резонансные структуры молекулы.
Двуокись азота является промежуточным продуктом промышленного синтеза азотной кислоты, миллионы тонн которой производятся каждый год. Этот красновато-коричневый токсичный газ имеет характерный резкий резкий запах и является заметным загрязнителем воздуха.
Расширенный октет
Элементы основной группы в третьем периоде и ниже образуют соединения, которые отклоняются от правила октетов, имея более 8 валентных электронов.
Цели обучения
Объясните, почему некоторые элементы могут образовывать расширенный октет
Основные выводы
Ключевые моменты
- Элементы основной группы, которые образуют больше связей, чем может быть предсказано правилом октетов, называются гипервалентными соединениями и имеют так называемый «расширенный октет», что означает, что вокруг одного атома находится более восьми электронов.
- Правило октетов может быть «расширено» некоторыми элементами за счет использования d-орбиталей, находящихся на третьем основном энергетическом уровне и за его пределами.Сера, фосфор, кремний и хлор являются обычными примерами элементов, образующих расширенный октет.
- Пентахлорид фосфора (PCl 5 ) и гексафторид серы (SF 6 ) являются примерами молекул, которые отклоняются от правила октетов, имея более 8 электронов вокруг центрального атома.
Ключевые термины
- Элемент основной группы : Элементы, не входящие в блок переходных металлов в периодической таблице.
- расширенный октет : случай, когда атом разделяет более восьми электронов со своими партнерами по связыванию.
- Гипервалентная молекула : Молекула, которая содержит атом из элемента основной группы, который отклоняется от правила октета, разделяя более восьми электронов.
Отклонения от правила октетов
Гипервалентная молекула — это молекула, которая содержит один или несколько элементов основной группы, которые несут более восьми электронов на своих валентных уровнях в результате связывания. Пентахлорид фосфора (PCl 5 ), гексафторид серы (SF 6 ), трифторид хлора (ClF 3 ) и трийодид-ион (I 3 — ) являются примерами гипервалентных молекул.
Для элементов во втором периоде периодической таблицы (основной уровень энергии n = 2) октет составляют s 2 p 6 электронов, и d подуровня не существует. В результате элементы второго периода (точнее, неметаллы C, N, O, F) подчиняются правилу октетов без исключений .
Пентахлорид фосфора : В молекуле PCl 5 центральный атом фосфора связан с пятью атомами Cl, таким образом имея 10 связывающих электронов и нарушая правило октетов.Изображена общая геометрия молекулы (тригонально-бипирамидальная), а валентные углы и длины выделены.
Однако некоторые из элементов третьего периода (Si, P, S и Cl), как было замечено, связаны с более чем четырьмя другими атомами и, следовательно, должны включать более четырех пар электронов, имеющихся в наличии. p 6 октет. Это возможно, потому что для n = 3 существует d-подуровень, и он имеет пять d-орбиталей. Хотя энергия пустых 3d-орбиталей обычно выше, чем энергия 4s-орбиталей, эта разница мала, и дополнительные d-орбитали могут вместить больше электронов.Следовательно, d-орбитали участвуют в связывании с другими атомами, и образуется расширенный октет. Примерами молекул, в которых центральный атом третьего периода содержит расширенный октет, являются пентагалогениды фосфора и гексафторид серы.
Гексафторид серы : В молекуле SF 6 центральный атом серы связан с шестью атомами фтора, поэтому сера имеет вокруг себя 12 связывающих электронов. Изображена общая геометрия молекулы (тетрагонально-бипирамидальная или октаэдрическая), а валентные углы и длины выделены.
Для атомов в четвертом периоде и за его пределами могут использоваться более высокие d-орбитали для размещения дополнительных общих пар за пределами октета. Относительные энергии различных типов атомных орбиталей показывают, что энергетические щели становятся меньше по мере увеличения квантового числа главного энергетического уровня (n), и энергетические затраты на использование этих более высоких орбиталей для размещения связывающих электронов становятся меньше.
6.4: Квантово-механическое объяснение валентности
Атомы гелия в их основном состоянии не образуют стабильную двухатомную молекулу.На самом деле гелий не соединяется ни с одним нейтральным атомом. Его валентность, то есть его способность образовывать химические связи с другими атомами, равна нулю. Электронная конфигурация атома гелия 1 s 2 (↓ ↑), конфигурация с закрытой оболочкой. Когда два атома гелия находятся в контакте, каждый электрон на одном атоме встречает электрон на другом атоме с параллельным спином. Из-за принципа Паули ни один электрон ни на одном из атомов не может концентрировать свою плотность в общей области, между ядрами.Вместо этого плотность передается в антисвязывающие области за каждым ядром, где перекрытие двух распределений атомной плотности является наименьшим. Это тот же эффект, который отмечался ранее для сближения двух атомов водорода с параллельными спинами.
Сравнение серии карт разности плотностей для сближения двух атомов гелия (рис. \ (\ PageIndex {1} \)) с данными, приведенными ранее для H 2 (рис. 6-10), показывает, что один набор представляет собой напротив другого. В обоих случаях области накопления заряда и истощения заряда меняются местами.Диаграммы разности плотностей получают путем вычитания распределения, полученного путем перекрытия плотностей атомных зарядов, из распределения молекулярных зарядов. Следует напомнить, что первое распределение не обеспечивает достаточной плотности заряда в области связывания, чтобы уравновесить силу ядерного отталкивания. Таким образом, из рисунка \ (\ PageIndex {1} \) ясно, что He 2 будет нестабильным, потому что молекулярное распределение создает меньшую плотность заряда в области связывания, чем та, которая получается из перекрытия атомных плотностей.Плотность заряда в He 2 передается в антисвязывающую область, где он оказывает силу, которая, действуя в том же направлении, что и ядерная сила отталкивания, разрывает два ядра. В He 2 преобладают силы отталкивания, и стабильная молекула невозможна.
Рисунок \ (\ PageIndex {1} \): Контурные карты полной плотности молекулярного заряда и разности плотностей для двух атомов He при межъядерном расстоянии 4,0 а.е. и 2.0 у.е. Масштаб контурных значений для карт общей плотности такой же, как на рис. 6-9 для h3. Самый дальний контур составляет 0,002 а.е., а самый внутренний — 2,0 а.е. при R = 4,0 и R = 2,0 а.е. Масштаб, используемый на графиках разности плотностей, такой же, как и на рис. 6-10, начиная с n = 5 для R = 4,0 ат. Е. И с n = 3 для R = 2,0 ат. Ед. Обратите внимание на увеличение величины плотности заряда, передаваемой от связывания к антисвязывающим областям, когда расстояние между двумя атомами уменьшается.Сравнение профилей разности плотностей He 2 (рис. \ (\ PageIndex {2} \)) и H 2 (рис. 6-12) дает поразительный контраст разницы между перераспределениями зарядов, которые в результате в образовании нестабильных и стабильных молекул.
Рисунок \ (\ PageIndex {2} \): Профили карт разности плотностей вдоль межъядерной оси для сближения двух атомов He. Одно ядро остается неподвижным.Этот рисунок следует противопоставить рис. 6-12, соответствующему для h3.
Сила, действующая на ядро гелия в He 2 как функция межъядерного расстояния, является отталкивающей для диапазона значений R , указанного на рисунке \ (\ PageIndex {3} \).
Рис. \ (\ PageIndex {3} \): Форсировать ядро a \ (He \) в \ (He_2 \) как функцию межъядерного разделения. Общая форма этой кривой характерна для нестабильного молекулярного вида.
В отличие от кривой силы для H 2 , на кривой нет глубокого минимума, который представляет диапазон значений \ ( R \) , для которых сила притягивает. Кривая силы для \ (He_2 \) пересекает ось \ ( R \) примерно на расстоянии 6 а.е. (не показано на рисунке \ (\ PageIndex {3} \)) и становится очень немного привлекательной для значений R . больше этого значения. Эта слабая сила притяжения берет свое начало в дальнодействующей взаимной поляризации распределений атомной плотности, которая подробно обсуждалась для сближения двух атомов водорода.Для больших межъядерных разделений, где нет значительного перекрытия атомных орбиталей и, следовательно, нет необходимости ссылаться на принцип исключения Паули, распределения атомных зарядов двух приближающихся атомов гелия поляризованы таким же образом, как и распределения зарядов для двух приближающихся атомов водорода. атомы, и сила притягивает. Однако при меньшем межъядерном разделении, когда перекрытие орбиталей существенно и действует принцип исключения Паули, направление переноса заряда в He 2 меняется на противоположное, и сила быстро трансформируется в силу отталкивания.Если бы не слабые дальнодействующие силы притяжения — силы Ван-дер-Ваальса — газообразный гелий не мог бы конденсироваться в жидкую или твердую фазу. Как бы то ни было, сила притяжения между двумя атомами гелия настолько мала, что при температуре всего 4,2 ° К они обладают достаточной кинетической энергией, чтобы преодолеть силы притяжения между ними и уйти в газовую фазу.
Сила притяжения между двумя атомами гелия настолько мала, что при температуре всего 4,2 ° К они обладают достаточной кинетической энергией, чтобы преодолеть силы притяжения между ними.
Если бы не было необходимости удовлетворять требованиям принципа Паули, электронная плотность накапливалась бы в области связывания He 2 , даже для небольших значений R , поскольку эта область имеет более низкую потенциальную энергию, чем антисвязывание. область, край. Однако, когда каждый электрон обнаруживает другой со схожим спином (когда орбитали перекрываются), они не могут сконцентрировать свою плотность заряда в общей для них области, связывающей области. То, что именно принцип Паули предотвращает образование He 2 , очевидно из того факта, что He 2 + , у которого на один электрон меньше, стабильно ! Когда атом гелия приближается к иону гелия, появляется орбитальная вакансия, и плотность одной пары электронов (с противоположными спинами) может быть сконцентрирована в области связывания.
Все атомы инертных газов обладают замкнутой структурой оболочки, что объясняет их инертность в химических реакциях. В этой группе элементов не обнаружены гомоядерные двухатомные молекулы; все они естественным образом находятся в атомарном состоянии. Соединения Kr и Xe были образованы с фтором по той же причине, по которой возможно образование He 2 + . Фтор имеет очень высокое сродство к электрону и единственную вакансию во внешней квантовой оболочке. Таким образом, один из электронов в замкнутой оболочечной структуре Xe может быть втянут в орбитальную вакансию атома фтора, и его плотность будет сосредоточена в области между ядрами.
Только атом с очень высоким сродством к электронам может связываться с атомом инертного газа. Единственный вид, обладающий достаточным сродством к электрону, чтобы связать атом гелия (который удерживает свои электроны наиболее плотно из всех атомов), — это ион He + . Если атом гелия имеет самый высокий потенциал ионизации из всех элементов, то однозарядный ион He + должен обладать наивысшим сродством к электрону из всех нейтральных или однозарядных атомов.
Элементы второй строки
Давайте теперь попытаемся объяснить изменение валентности, проявляемое элементами во второй строке периодической таблицы.Гидриды этих элементов: LiH, BeH 2 , BH 3 , CH 4 , NH 3 , OH 2 и FH. Валентность атома водорода равна единице, поскольку он имеет один неспаренный электрон и одну орбитальную вакансию. Он может образовывать одну электронную парную связь. Следовательно, валентности, проявляемые в вышеуказанных гидридах, должны быть 1, 2, 3, 4, 3, 2, 1, поскольку это количество связанных атомов водорода в каждом случае. (Между прочим, хотя предсказано, что молекула BH 3 будет стабильной по отношению к разделенным атомам бора и водорода, она не может быть изолирована как таковая, а только в виде ее димера B 2 H 6 ) .
Сначала рассмотрим ВЧ.
Фтор: Электронная конфигурация F составляет с 2 2 с 2 2 с 5 (). Только один из электронов на орбиталях 2 p неспарен. Атомная орбиталь 2 p с вакансией может перекрываться с атомной орбиталью 1 s водорода, и если спин электрона на H спарен со спином электрона на F, все требования для образования будет соблюдена стабильная химическая связь.Валентность F будет равна единице, поскольку он обладает одним неспаренным электроном и может образовывать одну электронную парную связь.
Кислород: Электронная конфигурация кислорода l s 2 2 s 2 2 p 4 (). Кислород имеет два неспаренных электрона, каждый из которых может соединяться с электроном на атоме водорода. Валентность кислорода должна быть равна двум, как это наблюдается. Очевидно, что все требования к химической связи могут быть выполнены для каждого неспаренного электрона, присутствующего во внешней или «валентной» оболочке атома. Таким образом, валентность может быть определена как равная количеству неспаренных электронов, присутствующих в атоме.
Азот: Конфигурация азота l s 2 2 s 2 2 p 3 (), а его гидрид должен быть NH 3 , как это действительно имеет место.
Углерод: Поскольку наиболее стабильной электронной конфигурацией углерода является 1 s 2 2 s 2 2 p 2 (), мы прогнозируем его валентность равной двум.Молекула CH 2 (называемая метиленом) действительно известна. Однако CH 2 очень реакционноспособен, и его продукты нестабильны до тех пор, пока с углеродом не образуются четыре химические связи, как в случае CH 4 . Четыре, а не два — это общая валентность углерода. Как наша теория может объяснить этот факт? Энергия орбитали 2 p не намного больше энергии орбитали 2 s . Из-за этого требуется относительно небольшая энергия для продвижения электрона с орбитали 2 s на углероде на свободную орбиталь 2 p :
C: l s 2 2 s 2 2 p 2 () ® C * l s 2 2 s 1 () 2 p 3 ()
Углерод в активированном состоянии обладает четырьмя неспаренными электронами и теперь может соединяться с четырьмя атомами водорода.Каждая связь с атомом водорода выделяет большое количество энергии. Энергия, необходимая для разрыва пары 2 s электронов и продвижения одного из них на орбиталь 2 p , более чем компенсируется тем фактом, что две новых связей C�H.
Бор: Бор имеет электронную конфигурацию l s 2 2 s 2 2 p 1 (). Его валентность должна быть равна единице, и известно, что существует BH.Однако, опять же, с помощью механизма продвижения, валентность бора может быть увеличена до трех:
B *: l s 2 2 s 1 () 2 p 2 ()
Мы можем задаться вопросом, почему, когда орбиталь 2 p все еще свободна, один из электронов 1 s не продвигается и, таким образом, придает бору валентность, равную пяти. Этого не происходит из-за большой разницы в энергии между 1 s и 2 p орбиталями, как показано на диаграмме орбитальных уровней энергии (рис.5-3).
Бериллий: Бериллий имеет конфигурацию l s 2 2 s 2 и должен иметь нулевую валентность. Внешняя электронная конфигурация Be подобна конфигурации He, замкнутой оболочки из s электронов. Действительно, молекула Be 2 существует только в виде слабосвязанной ван-дер-ваальсовой молекулы. Однако Be отличается от He тем, что в его оболочке с валентностью имеются свободные орбитали.Наблюдаемая валентность двух в молекуле BeH 2 может быть объяснена продвижением к конфигурации l s 2 2 s 1 () 2 p 1 ().
Литий. Литий с конфигурацией l s 2 2 s 1 (), должен иметь только одну валентность.
Таким образом, валентность может быть определена как равная количеству неспаренных электронов, присутствующих в атоме.
Lewis Structures
Концепция связи пары электронов не ограничивается связями с водородом. Единственные требования — наличие неспаренного электрона на каждом атоме (что является другим способом сказать, что на каждом атоме есть орбитальная вакансия) с противоположными спинами. Таким образом, два атома фтора могут объединяться с образованием молекулы фтора F 2 через перекрытие однократно занятой орбитали 2 p на одном атоме с аналогичной орбиталью на другом. Это приведет к тому, что F 2 будет описан как F�F, где единственная линия означает, что одна пара электронов образует связь между двумя атомами.Точно так же три однократно занятые орбитали 2 p на одном атоме азота могут перекрываться с таковыми на другом с образованием молекулы N 2 . Поскольку в этом случае ядра разделяют три пары электронов, мы обозначаем молекулу символом NºN. Электроны в валентной оболочке атома, которые не участвуют в образовании химической связи (поскольку они уже спарены на орбитали на атоме), также могут быть указаны, и полученные символы называются структурами Льюиса .Таким образом, три пары валентных электронов на каждом F (2 s 2 2 p 4 ), не участвующие в связывании, часто обозначаются точками. Например,
(Литий имеет только один внешний электрон, и он является общим в связи.) В соединениях с азотом мы можем указать 2 пары электронов s :
а такжеНапомним, что каждая линия, поскольку она обозначает связь на этих диаграммах, представляет собой пару электронов, разделяемых между двумя атомами, соединенными линией.Если мы сложим линии, соединенные с каждым атомом, умножим на два (чтобы получить количество электронов) и прибавим к этому количество точек, которые представляют оставшиеся валентные электроны, во многих случаях получается число восемь, особенно для второго -рядные элементы ( n = 2 валентные орбитали). Это так называемое правило октетов является результатом того, что многие элементы имеют четыре внешние орбитали ( nsnp x np y np z ), которые вместе могут содержать в общей сложности восемь электронов.Не все восемь электронов принадлежат какому-либо атому в целом, поскольку электроны в связи разделяются (не обязательно в равной степени, как мы увидим) между двумя атомами. Каждая связь содержит два электрона с парными спинами. Таким образом, орбиталь одного атома, используемая для образования связи, в некотором смысле заполнена, поскольку теперь учтены обе возможности спина.
Наличие неподеленной пары электронов в валентной оболочке атома может привести к образованию другой химической связи. Например, неподеленная пара электронов на орбитали 2 s на азоте в аммиаке может притягивать и связывать с молекулой другой протон:
H 3 N: + H + ® NH 4 +Аналогичная реакция происходит с молекулой воды, имеющей две неподеленные пары электронов:
+ H + ®Мы должны изменить наше предыдущее правило, касающееся требований для образования парной связи электронов.Вместо того, чтобы обе орбитали были заполнены наполовину, орбиталь одного из атомов может быть заполнена, если орбиталь другого атома полностью свободна. Молекулы, обладающие неподеленной парой электронов, которые могут быть использованы для связывания другого атома, называются основаниями Льюиса . Только элементы в группах V, VI и VII будут проявлять это свойство. Элементы в группах с I по IV не имеют неразделенных пар. Напротив, химический состав элементов в группах II и III в значительной степени характеризуется орбитальными вакансиями, которые они имеют в своей валентной оболочке.
Соединение трифторид бора представляет собой спаривание трех валентных электронов бора с неспаренными электронами на трех атомах F. Считается, что бор находится в продвинутой конфигурации l s 2 2 s 1 () 2 p 2 () и BF 3 представлен как
A 2 p Орбиталь на боре свободна. Неудивительно, что BF 3 может образовывать другую связь с разновидностью, которая имеет неподеленную пару электронов, т.е.{-2}} \]
Авторы и авторство
Что такое валентные электроны и как их найти? Где они расположены?
Валентные электроны — это те электроны, которые находятся во внешней оболочке, окружающей атомное ядро. Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи в химическом соединении — количество связей, которые могут быть образованы между двумя атомами.
Поскольку ковалентные связи образуются за счет разделения электронов в конечной оболочке, число указывает, сколько связей может быть образовано.
Что такое валентные электроны?
Валентные электроны — это электроны, расположенные на внешней оболочке атома. Другими словами, это электроны, которые могут быть получены или потеряны в ходе химической реакции.
Где валентные электроны?
Независимо от типа химической связи между атомами, будь то ионная, ковалентная или металлическая связь, изменения в атомной структуре ограничиваются электронами во внешней оболочке, т.е.е. валентные электроны.
Самый простой метод — это сослаться на атомную конфигурацию элемента и просто подсчитать электроны в самой внешней оболочке. Однако это будет чрезвычайно трудоемкая задача, поскольку нам, возможно, придется рыться в учебниках, чтобы найти конфигурации, которых мы не знаем.
Тем не менее, не стоит беспокоиться, так как существует гораздо более простой способ определения этого желанного числа. Это более общий подход, требующий всего лишь одного небольшого великолепного прямоугольного листа бумаги — таблицы Менделеева.
Чтобы определить количество валентных электронов элемента, нам нужно только обратиться к периодической таблице и найти положение элемента в ней.
Валентные электроны и таблица Менделеева
Периодическая таблица Менделеева представляет собой четкое расположение всех элементов, открытых до сих пор. Элементы расположены слева направо в порядке возрастания их атомных номеров или количества протонов или электронов, которые они содержат.
Элементы делятся на четыре категории: элементы основной группы, переходные элементы, лантаноиды и актиниды.Последние два также называются внутренними переходными элементами .
Таблица содержит всего 18 столбцов, формально известных как группы , , а также строки, формально известные как периоды . В подтаблице вверху 7 рядов, а внизу — 2 ряда, в которых выделяются более редкие элементы. Переходные элементы образуют мост или закрепляют переход между элементами 2-й и 13-й групп.
Как найти валентные электроны?
Когда мы спускаемся по группе, количество валентных электронов остается прежним, хотя количество оболочек увеличивается.
В то время как валентные электроны за период постепенно поднимаются на единицу, количество оболочек остается неизменным. Номер периода (номер строки, чтобы напомнить вам), в котором можно найти элемент, указывает количество оболочек, окружающих его ядро.
Итак, какое значение имеет номер группы?
Валентные электроны элементов, отличных от переходных — элементы основной группы
В то время как номер периода указывает количество оболочек, номер группы указывает количество валентных электронов во внешней оболочке.В частности, число в разряде единиц. Однако это верно только для основных элементов группы — элементов, населяющих группы 1-2 и 13-18.
Правило неприменимо к элементам перехода и внутренним элементам перехода (мы рассмотрим эту причину через минуту). Например, натрий (Na) находится в периоде 3, группе 1, что означает, что он имеет 3 оболочки и один электрон в валентной оболочке.
Или вы можете рассматривать хлор в Группе 17. Соответственно, чтобы определить его валентные электроны, мы должны искать только число вместо единиц: 7.Как и ожидалось, это именно количество электронов в его валентной оболочке.
Этот метод простого обращения к периодической таблице и определения соответствующего номера группы устранил хлопоты и сложности, которые когда-то сопровождали трудный поиск индивидуальных атомных конфигураций.
А как насчет валентных электронов промежуточных элементов? Конечно, мы не должны забывать о лантаноидах и актинидах…
Краткое объяснение того, как оболочки заполняются электронами
Переходные элементы мало чем отличаются от металлов, которые идут плечом к плечу в элементах основной группы.Они очень похожи на металлы: они пластичны, пластичны и могут проводить как тепло, так и электричество. Тот факт, что два лучших проводника — медь (Cu) и алюминий (Al) — являются переходными металлами, показывает, насколько их свойства перекрываются.
Однако они не дублируют результаты, полученные нами с помощью описанного выше метода. Мы не можем подсчитать их валентные электроны, просто ссылаясь на номер их группы.
Чтобы понять это исключение, нам нужно понять, как электроны занимают оболочки в любом элементе .
Однако сначала мы должны отучиться от школьного метода заполнения оболочек вокруг атомного ядра: помните 2..8..8..18 и так далее? Что ж, есть причина, по которой мы распределяем электроны именно таким образом.
Аналогия с солнечной системой, которая описывает упорядочение электронов вокруг атома, совершенно неверна. Его следует немедленно устранить, но поскольку он облегчает трудности, связанные с представлением модели закона ual , учебники для старших классов в основном полагаются на это элементарное объяснение.
Электроны не занимают твердые оболочки вокруг своего ядра. На самом деле их положение вокруг ядра весьма неопределенно. Они могут занимать только определенные энергетические уровни вокруг ядра. Скорее всего, их там и можно найти. Технически эти уровни называются квантовыми состояниями и обозначаются так называемыми квантовыми числами n .
Теперь следующее предложение может показаться лицемерным, но квантовые числа можно рассматривать как старые добрые оболочки, но теперь с подоболочками, которые технически известны как орбитали (s, p, d, f).Несмотря на это упрощение, он вполне подходит для ускоренного курса, подобного этому.
Существует правило, ограничивающее количество электронов, которое может вместить суб-оболочка: s-2, p-6, d-10 и f-14. Если этого было недостаточно, добавляя к бреду, оболочки можно заполнять только в определенном порядке, указанном ниже. Назовем это правилом правилом .
Электроны должны заполняться только слева направо именно в этом порядке.
Если бы мы бессознательно распределили электроны относительно того, как выстроены суб-оболочки, как показано на рисунке выше, кальций (Ca) с атомным номером 20 имел бы конфигурацию 2,8,10 (2, 2+ 6, 2 + 6 + 2).Любой школьный учебник химии скажет вам, что это неверно, так как точная конфигурация — 2,8,8,2.
Однако, поскольку мы должны соблюдать правило , мы наблюдаем, что 4 должны быть заполнены до 3d, так, что теперь 8 в 3-й оболочке и 2 в 4-й, что составляет конфигурацию: 2,8,8 , 2. Вуаля! Как весело воскликнул бы Ричард Фейнман: «Удовольствие узнавать все! К сожалению, радость наполовину прожита — причина правила сама по себе, эта кажущаяся абсурдность, выходит за рамки данной статьи.
Хорошо, теперь, когда мы знаем, как заполняются оболочки, мы можем пойти дальше и найти количество валентных электронов в переходных элементах.
Валентные электроны лантаноидов и актинидов (переходные и внутренние переходные элементы)
Рассмотрим скандий (Sc) с его атомным номером 21. Заполняя электроны в соответствии с нашим правилом , , мы видим, что 21-й электрон занимает 3d-суб- оболочка. Однако, поскольку ранее заполненная 4-я оболочка (4s) имеет 2 электрона и, по-видимому, является самой внешней оболочкой, количество валентных электронов равно 2.
Аналогично, каждый переходный элемент в 4-м периоде должен иметь 2 валентных электрона. Причина в том, что хотя 3d заполняется раньше, чем 4s, два электрона, расположенные в 4-й оболочке, являются обитателями самой внешней оболочки и по праву заслуживают обозначения валентных электронов.
Фактически, это верно для переходных элементов в каждый период. Рассмотрим Золото (Au), находящееся в 6 периоде (строке) и 11 группе (столбце). В процессе наполнения его раковин можно понять, что после начинки 5d следует начинка 6s.И поскольку 6-я оболочка расположена выше 5-й, количество валентных электронов равно… * барабанная дробь * … 2!
Тем не менее, именно так должны были бы выстроиться электронов в идеале . Энергетические различия между этими оболочками ничтожны, и электроны (или Природа, если на то пошло) жаждут стабильности больше всего на свете. Электрон с радостью совершит прыжок на соседнюю оболочку с относительно эквивалентной энергией, чтобы достичь более стабильной конфигурации.
Хорошим примером является непостоянная конфигурация атома меди (Cu).
Загадочный случай валентных электронов меди
Медь имеет 29 электронов, поэтому самые задние электроны выстраиваются в линию как… 4s2-3d9. Для меди конфигурация немного тревожит — более стабильной конфигурацией было бы 10 электронов в 3d-оболочке, и это именно то, что мы наблюдаем!
Так как энергии оболочек сравнимы, электрон 4s совершает скачок в 3d, чтобы получить стабильную конфигурацию. Количество валентных электронов теперь 1!
Ряд элементов среди переходных элементов демонстрируют эту странность, которая также наблюдается на внутренних переходных элементах из-за сравнимых уровней энергии оболочек f, d и s.
Таким образом, можно сказать, что количество валентных электронов для переходных элементов и внутренних переходных элементов изменяется непредсказуемым образом.
Хотя количество валентных электронов для переходных элементов все еще можно предсказать — и большинство из них в конечном итоге равняется 2, — такое предсказание для внутренних переходных элементов невозможно имитировать.
Статьи по теме
Статьи по теме
Причудливое поведение их валентных электронов, бесконечно дрожащих и подпрыгивающих в нерешительности, отрицает любые попытки получить уникальную стабильную конфигурацию, что делает предсказать количество валентных электронов практически невозможным!
Глава 8: Периодические свойства элементов Карточки
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягиваться и связываться с электронами.Поскольку электроотрицательность является качественным свойством, не существует стандартизированного метода расчета электроотрицательности. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица A2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.Электроотрицательность измеряет склонность атома к притяжению электронов и образованию с ними связей.Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октетов (валентная или внешняя оболочка состоит из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем половину полной валентной оболочки, энергия, необходимая для получения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части таблицы Менделеева обычно теряют электроны при образовании связей. И наоборот, элементы в правой части таблицы Менделеева более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов.Природа электроотрицательности эффективно описывается таким образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
Слева направо через период элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его получения. И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать один.
Сверху вниз по группе электроотрицательность уменьшается. Это связано с тем, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром или увеличивается атомный радиус.
Важные исключения из вышеперечисленных правил включают благородные газы, лантаноиды и актиниды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны. Лантаноиды и актиниды обладают более сложным химическим составом, в котором, как правило, не наблюдается каких-либо тенденций.Следовательно, благородные газы, лантаноиды и актиниды не имеют значений электроотрицательности.
Что касается переходных металлов, хотя у них есть значения электроотрицательности, между ними существует небольшая разница по периоду и по группе вверх и вниз. Это связано с тем, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и на другие элементы.
Валентности лантаноидов | SpringerLink
Андерсон Д.М. и др .: О стабильности и связывании в комплексах бис (η-арен) лантаноидов.J. Chem. Soc., Chem. Commun. 53 (1989)
Бек, Х.П., Шустер, М .: Превращения NdI под высоким давлением 2 . J. Solid State Chem. 100 , 301 (1992)
Артикул Google Scholar
Блейк А.Б .: Обменная стабилизация и изменение энергии ионизации в сериях p n и d n . J. Chem. Educ. 58 , 393 (1981)
Артикул Google Scholar
Чейз, М.W .: JANAF Thermochemical Tables, 4-е изд. Американский институт физики, Нью-Йорк (1998)
Google Scholar
Кордфунке, E.H.P., Конингс, Р.Дж.М .: Энтальпии образования соединений лантаноидов. II. Ln 3+ (водн.). Термохим. Acta 375 , 51 (2001)
Статья Google Scholar
Хлопок, Ф.А., Уилкинсон, Дж .: Продвинутая неорганическая химия, 5-е изд.Уайли, Нью-Йорк (1988)
Google Scholar
Д’Анджело П. и др.: Анализ детальной конфигурации гидратированных ионов лантаноида (III) в водном растворе и кристаллических солях с помощью спектроскопии XANES по K- и L 3 -краю. Chem. Евро. J. 16 , 684 (2010)
Статья Google Scholar
Evans, W.J .: Учебное пособие по роли циклопентадиенильных лигандов в открытии молекулярных комплексов редкоземельных и актинидных металлов в новых степенях окисления.Металлоорганические соединения 35 , 3088 (2016)
Артикул Google Scholar
Физер, М.Э., Макдональд, М.Р., Крулл, Б.Т., Бейтс, Дж. Э., Циллер, Дж. У., Фурче, Ф., Эванс, В. Дж.: Структурное, спектроскопическое и теоретическое сравнение традиционного и недавно открытого Ln 2+ ионы в комплексах [K (2.2.2-криптанд)] [(C 5 H 4 SiMe 3 ) 3 Ln]: переменная природа Dy 2+ и Nd 2+ .Варенье. Chem. Soc. 137 , 369 (2015)
Артикул Google Scholar
Геркин, Р. Э., Реппарт, ВД: Структуры эннеагидратов этилсульфата лантаноида, M (C 2 H 5 SO 4 ) 3 · 9H 2 O [M = La- Lu (кроме Pm)], на 171 K. Acta Crystallogr. Разд. C. 40 , 781 (1984)
Статья Google Scholar
Гримм, Х.Г., Зоммерфельд, А .: Über den. zusammenhang des abschlusses der elektronengruppen im atom mit den chemischen valenzzahlen. Z. Physik 36 , 36 (1926)
Статья Google Scholar
Хичкок, П.Б., Лапперт, М.Ф., Марон, Л., Протченко, А.В .: Лантан действительно образует стабильные молекулярные соединения в степени окисления +2. Энгью. Chem. Int. Эд. 47 , 1488 (2008)
Артикул Google Scholar
Hünenberger, P., Рейф, М .: Одноионная сольватация. Королевское химическое общество, Лондон (2011)
Google Scholar
Джаяраман А., Нараянамурти В., Бухер Э., Мейнс Р.Г .: Непрерывный и прерывистый переход полупроводник-металл в монохалькогенидах самария под давлением. Phys. Rev. Lett. 25 , 1430 (1970)
Артикул Google Scholar
Джонсон, Д.А .: Третьи потенциалы ионизации и энергии сублимации лантаноидов. J. Chem. Soc. A 1525 (1969a)
Джонсон, Д.А .: Вариации относительной стабильности ди-, три- и тетра-положительных степеней окисления лантаноидов и актинидов. J. Chem. Soc. A 1529 (1969b)
Джонсон, Д.А.: Стабильность дихлоридов лантаноидов. J. Chem. Soc. A 2578 (1969c)
Джонсон, Д.А .: Относительная стабильность дипозитных и триположительных ионов лантаноидов в водном растворе.J. Chem. Soc. Dalton Trans. 1671 (1974)
Джонсон, Д.А .: Последние достижения в химии менее распространенных степеней окисления лантаноидов. Adv. Неорг. Chem. Радиочем. 20 , 1 (1977)
Артикул Google Scholar
Джонсон Д. А. Основы химии лантаноидов. J. Chem. Educ. 57 , 475 (1980)
Артикул Google Scholar
Джонсон, Д.А .: Термодинамика перехода полупроводник – металл в моносульфидах лантаноидов. J. Chem. Soc. Dalton Trans. 2269 (1982a)
Джонсон, Д.А.: Некоторые термодинамические аспекты неорганической химии, 2-е изд. Издательство Кембриджского университета, Кембридж (1982b)
Google Scholar
Джонсон Д.А .: Межэлектронное отталкивание и неоднородности в химии переходных рядов. Неорг. Chem. Фокус 3 , 1 (2006)
Google Scholar
Джонсон, Д.А., Корбетт, Дж. Д .: Относительная стабильность дииодидов редкоземельных металлов: трииодидные системы металл-металл для тербия, диспрозия и гольмия. Коллок. Inte. CNRS 180 , 429 (1970)
Google Scholar
Джонсон Д.А., Нельсон П.Г .: Статус теории многоэлектронных атомов Слэтера. Комментарии Неорг. Chem. 34 , 178 (2014)
Артикул Google Scholar
Джонсон, Д.А., Нельсон П.Г .: Энергии ионизации лантаноидов и разрыв суб-оболочки. Часть 1. Вторая энергия ионизации. J. Phys. Chem. Ref. Данные 46 , 013108 (2017a)
Артикул Google Scholar
Джонсон, Д.А., Нельсон, П.Г .: Энергии ионизации лантаноидов и разрыв суб-оболочки. Часть 2. Третья и четвертая энергии ионизации. J. Phys. Chem. Ref. Данные 46 , 013109 (2017b)
Артикул Google Scholar
Йоргенсен, К.К .: «Тетрадный эффект» Пеппарда — это вариация нефелаксетического отношения в третьем знаке после запятой. J. Inorg. Nucl. Chem. 32 , 3127 (1970)
Артикул Google Scholar
Konings, R.J.M., Benes, O .: Термодинамические свойства f-элементов и их соединений. 1. Металлы лантаноиды и актиниды. J. Phys. Chem. Ref. Данные 39 , 043102 (2010)
Артикул Google Scholar
Конингс, Р.J.M. и др.: Термодинамические свойства f-элементов и их соединений. Часть 2. Оксиды лантанидов и актинидов. J. Phys. Chem. Ref. Данные 43 , 013101 (2014)
Артикул Google Scholar
Крамида А., Ральченко Ю., Ридер Дж. И команда NIST ASD: База данных атомных спектров NIST (версия 5.4) [http://physics.nist.gov/asd]. Национальный институт стандартов и технологий, Гейтерсбург, Мэриленд (2016)
Lebègue, S.и др.: Электронная структура и спектроскопические свойства монохалькогенидов тулия. Phys. Ред. B 72 , 245102 (2005)
Артикул Google Scholar
Линк П. и др .: Валентные состояния Yb в YbC 2 : спектроскопическое исследование HERFD-XANES. Неорг. Chem. 50 , 5587 (2011)
Артикул Google Scholar
Мейер, Г., Wickleder, M.S .: Справочник по физике и химии редкоземельных элементов 28 , 53 (2000)
Статья Google Scholar
Нельсон, П.Г .: Валенсия. J. Chem. Educ. 74 , 465 (1997)
Артикул Google Scholar
Ньюджент, Л.Дж .: Теория тетрадного эффекта в сериях лантанидов (III) и актинидов (III). J. Inorg. Nucl. Chem. 32 , 3485 (1970)
Артикул Google Scholar
Пеппард, Д.Ф., Мейсон, Г. В., Льюи, С .: Тетрадный эффект в упорядочении жидкостно-жидкостной экстракции лантаноидов (III). J. Inorg. Nucl. Chem. 31 , 2271 (1969)
Артикул Google Scholar
Перссон И., Д’Анджело П., Де Панфилис С., Сандстрём М .: Гидратация ионов лантаноидов (III) в водном растворе и гидратах, изученная методами EXAFS-спектроскопии и кристаллографии: миф о «Разрыв гадолиния». Chem. Евро. J. 14 , 3056 (2008)
Статья Google Scholar
Рака, Г.: Теория сложных спектров. IV. Phys. Ред. 76 , 1352 (1949)
Артикул Google Scholar
Сиджвик, Н.В .: Электронная теория валентности. Oxford University Press, Oxford (1927)
Google Scholar
Спицин В.И., Мартыненко Л.И., Киселев J.U.M .: Anwendung der edelgasfluoride zur darstellung von verbindungen vierwertiger lanthanoide.Z. Anorg. Allgem. Chem. 495 , 39 (1982)
Артикул Google Scholar
Вагман Д.Д. и др .: Таблицы химических термодинамических свойств NBS. Американский институт физики, Нью-Йорк (1982)
Google Scholar
Чжан, К., Ху, С.-Х., Цюй, Х., Су, Дж., Ван, Г., Лу, Дж .-Б., Чен, М., Чжоу, М., Ли, Дж .: Соединения пятивалентного лантаноида: образование и характеристика оксидов празеодима (V).Энгью. Chem. Int. Эд. 55 , 6896 (2016)
Артикул Google Scholar
Валентность элементов, @ = КАК НАЙТИ ДОСТУПНОСТЬ? = @
Валентность элементов — это свойство, которое проявляется, когда один атом элемента объединяется с атомами других элементов.
В целом валентность валентности равна количество электронов, которые каждый атом приобретает и теряет при объединении, то есть количество электронов, которые выигрывают и теряют, когда элемент достигает стабильная структура, которая часто определяется электронным расположением элемент, в основном крайние электроны.
Теория валентной связи
Химическая связь и молекулярная структура
Конечно, компоновка может также включать метастабильные структуры, состоящие из подслоев, которые могут быть достигнуты внешним подслоем.
Это компенсируется количеством электронов или общие электронные пары атомов в материале.
Валентность элементов означает количество атомов, получающих и теряющих электроны, когда атомы соединяются друг с другом.
Валентность также свойство, которое элементы проявляют при образовании соединений.
Когда элементы комбинируются друг с другом, соотношение количества реагирующих атомов не фиксируется, а определяется в соответствии с количеством электронов во внешнем слое атома. Например, ион натрия (с валентностью +1 и потерянным электроном) должен быть объединен с ионом хлорида (с валентностью -1 и получается электрон).
Ион магния (с валентностью +2 и двумя потерянными электронами) должен быть связан с двумя ионами хлорида.Если валентно-алгебраическая сумма ионов образованного соединения не равна нулю, самый внешний электронный слой аниона и катиона, составляющих ионное соединение, и атом молекулы ковалентного соединения не может быть преобразован в стабильную структуру. Таким образом не могут быть образованы стабильные соединения.
Понятие валентности происходит отсюда, тогда количество элементов вне ядерных электронов, объединенных друг с другом, определяет валентность этого элемента. Валентность установлена для облегчения выражения количества атомов, которые объединены друг с другом.Изучая валентность, вы должны понимать правила валентности элементов в соединениях.
Заданная элементарная молекула, валентность которой равна нулю , независимо от ионных соединений или ковалентные соединения, алгебра n-валентных анионов и ее состав нуль. Ионные соединения, Пример: NaOH (натрий n-1 — валентность двухвалентный, гидроксид-ион валентность является отрицательной одновалентной, взаимно компенсируется на a нулевое соединение , такое как формулировка на учреждение)
Валентность — способность атомов к образуют химические связи.Это химическое свойство, которое образует друг друга элементы в стабильной сложный. (То есть способность достичь способности каждого элемента к образуют устойчивую структуру)
Примечание: «Валентность» элемента — важное свойство элемента, которое проявляется только в сочетании с другими элементами. То есть, когда элемент существует в свободном состоянии, то есть когда он не объединен с другими элементами для образования соединения, валентность элементарного элемента равна «0». Например, , металлы, такие как железо, неметаллы, такие как углерод, и инертные газы, такие как гелий.
Валентность элементов
+1
H, Li, Na, K, Rb, Cs, Ag, Au, Hg, In, Tl, N
+2
Be, Mg, Ca, Sr, Ba, Cu, Ra, Zn, Cd, Hg, Cr, Mn, Fe, Co, Ni, C, Sn, Pb, N, S, O
+3
B, Al, Ga, In, Tl, Sc, Y, La-Lu, N, P, As, Sb, Bi, Cr, Fe, Co, Ni, Au; Ce, Ac
+4
C, Si, Ge, Sn, Pb, Ti, Zr, Hf, Ce, Th, Mn, Tb, N, S
+5
N, P, As, Sb, Bi, V, Nb, Ta
+6
S, Se, Te, Cr, Mo, W, U, Mn, Fe
+7
Cl, Br, I, Mn, Tc, Re
+8
Xe, Ru, Os
–1
F, Cl, Br, I, O
-2
O, S, Se, Te
-3
Н, П, Ас, Сб
(Примечание: валентность атомов в элементе равна 0)
Особая атомная группа
Нитратный корень NO 3 — : одновалентный -1
Сульфит SO 3 2- : -2
Бисульфит HSO 3 — : одновалентный -1
Сульфат SO 4 2- : -2
Карбонат CO 3 2- : -2
Перхлорат ClO 3 — : одновалентный -1
Гидроксид OH — : одновалентный -1
Аммоний NH 4 + : +1 Валентность
Фосфат PO 4 3- : -3
Бикарбонат HC03 3 — : одновалентный -1
Манганат MnO 4 2- : -2
Пермангановая кислота корня MnO 4 — : одновалентный -1
Корневой супероксид O 2 — : одновалентный -1
Пероксидный кислород 2 2- : -2
Ацетат CH 3 COO-: -1
Дигидрофосфат H 2 PO 4 — : — 1 валентность
(Примечание: формула тот же, но не обязательно тот же корень, поскольку перманганат марганца был +6, перманганат марганца как двухвалентный +7)
Фтор, хлор, бром и йод: -1 (кислоты плавиковой кислоты, соляной кислоты, бромистоводородной кислоты и йодистоводородной кислоты)
Неметаллическая Валентность элементов
Поскольку количество электронов во внешнем слое металлического элемента в основном меньше 4, очень легко потерять самый внешний электрон в химической реакции и показать положительную валентность, то есть валентность металлического элемента обычно положительна. (очень немногие металлы могут иметь отрицательную валентность (например, сурьма, -3 валентности в InSb).Когда неметаллический элемент сочетается с металлическим элементом, обычно получается электрон с отрицательной валентностью.
Однако при объединении нескольких неметаллических элементов элементы с более низкой электроотрицательностью будут иметь положительную валентность. Например, , кислород является вторым по величине элементом электроотрицательности и обычно имеет валентность -2. Но когда он встречает наиболее электроотрицательный фтор, он показывает валентность +2, образуя OF2 и дифторид кислорода.
Закон о расчетах
После указания формулы, если вы знаете валентность элемента, вы можете умножить валентность на количество атомов в молекула. Поскольку электрическое свойство валентности равно нулю, произведение валентности предыдущей валентности и количество атомов элемента делится на количество атомов другого элемента в молекула, чтобы получить валентность другого элемента.
Учитывая валентность двух элементов, найдите наименьшее общее кратное абсолютного значения валентности.Затем разделите наименьшее общее кратное на абсолютное значение валентности, чтобы найти количество атомов в молекуле.
Представительство валентности: положительные и отрицательные валентности должны быть отмечены прямо над символ элемента с +1, +2, +3, -1, -2… 0 и т. Д. (Например, Na +1 )
Определите валентность элементов в соединение
(1) Есть положительная и отрицательная валентности
(2) Кислородный элемент обычно имеет валентность -2.
(3) Водородный элемент обычно имеет валентность +1.
(4) Когда металлический элемент сочетается с неметаллическим элементом, металлический элемент показывает положительную цену, а неметаллический элемент показывает отрицательную цену (как правило, положительная цена указывается спереди, а отрицательная. цена написана сзади).
(5) Некоторые элементы могут иметь существенно разные валентности в одном и том же веществе.
(6) Алгебраическая сумма положительной и отрицательной валентностей в соединении равна 0.
(7) Валентность элемента — это свойство, которое атом элемента проявляет при образовании соединения. Следовательно, в элементарных молекулах валентность элемента равна 0.
Как найти валентность элементов
Валентность — это свойство элемента, проявляется только тогда, когда элементы сливаются друг с другом. Алгебраический сумма положительных и отрицательных валентностей в соединении равна нулю, что составляет критерий валентности. Вообще говоря, есть следующие методы:
Химическая формула или радикальная формула
1.Формула валентности элементов A в соединении AmBn:
(Валентность элемента B × количество атомов Б) / число атомов А
2. Найдите формулу валентности неизвестного. валентный элемент в многокомпонентном соединении:
(Алгебраическая сумма валентностей элементов известных валентность) / Число атомов элементов неизвестной валентности
3.Определите валентность элементов (или атомной группы) на основе количества положительных и отрицательных зарядов.
В радикальной формуле алгебраическая сумма общая валентность положительной и отрицательной валентностей равна количеству положительные и отрицательные заряды, переносимые радикальной формулой.
Exercise1: Химическая формула (молекулярная формула) соли — Rm (SO4) n. Какова валентность R?
Массовое отношение элемента
1. (Относительная атомная масса элемента A × валентность элемента B) / (относительная атомная масса элемента B × Валентность элементов) = отношение масс элемента A / отношение масс элемента B
2.Массовое соотношение (или процентный состав) элемента A × валентность A / относительная атомная масса A = отношение масс (или процентный состав) элемента B × валентность B / относительная атомная масса B
Exercise2: В массе 7: 4 соотношение азота и кислорода, какова валентность азота?
Массовая доля
(валентность B × отношение атомных масс A) / (валентность A × относительное атомное отношение масс B) = массовое отношение элемента A / массовое отношение элемент B
Exercise3: Отношение относительной атомной массы элементов A и B составляет 2: 1. В соединении, состоящем только из этих двух элементов, соотношение масс элементов A и B составляет 2: 3, где B отрицательно. валентно, то в этом соединении находится А. Какова валентность элементов?
Найдите валентность
1.Если B равно -2, а C равно -1, когда A нечетное, то А есть:
(количество типа 2AC — количество типа AB) / (тип C количество x цена B-тип количество B x цена A)
2. Если B равно -2 и C равно -1, когда A четное, тогда A:
2 (количество типа AC — количество типа AB) / (тип C количество x B цена-B тип количество x цена A)
3. Если валентности B и C равны то же самое, валентность A равна: (количество в формуле AC — количество в формуле AB) / (C количество по формуле — количество по формуле B)
Метод определения
В химическом отношении валентность используется для обозначения количество межатомных соединений.Это важное свойство элементов. Определение валентности элемента — это базовый навык, который получают в средней школе. студенты должны освоить. Теперь это обобщено в рамках неполной средней школы. чтобы помочь студентам учиться.
Метод другого элемента
Пример 1: — Определить валентность элемента Mn в соединении K2MnO4.
Анализ: Пусть валентность элемента Mn в соединении иметь валентность + x, в соответствии с принципом нулю и алгебраической сумме валентности каждого элемента в соединении, там равны 2 × (+1) + 1 × (+ x) + 4 × (-2) = 0 Решение: x = 6
Следовательно, валентность элемента Mn в K2MnO4 равна +6.
Метод структуры электронного слоя
Пример 2: — Есть один электрон на самом внешнем слое атома элемента X и шесть электронов на самый внешний слой атома элемента Y. Химическая формула соединение, которое может быть образовано двумя элементами X и Y?
A. XY B. X2Y C. XY2 D. X3Y
Анализ: Можно сказать, что ключ к этому вопросу состоит в том, чтобы сначала определить валентность двух элементов X и Y при образовании соединения.Поскольку самый внешний слой X имеет только один электрон, самая высокая положительная цена равна +1, а самый внешний слой Y составляет 6 электронов, что на 2 расстояния от стабильной структуры из 8 электронов.
Следовательно, наименьшая отрицательная цена равна -2, поэтому X, Y Молекулярная формула образованного соединения — X2Y, и следует выбрать B.
Метод массовой доли
Пример 3: — Относительная атомная масса элемента 59, масса доля элемента в оксиде составляет 71%, а его валентность составляет?
А.+1 Б. +2 С. +3 Д. +4
Анализ: Пусть химическая формула оксида этого элемента должна быть RxOy
59x / (59x + 16y) * 100% = 71%
Решить x / y = 2: 3
Следовательно, химическая формула R2O3, а R валентность +3, поэтому выберите C.
Сохранение массы
Пример 4: — Оксид металла реагирует с достаточным количеством соляной кислоты, и соотношение количество молекул хлорида к воде составляет 2: 3, то валентность металла является?
А.+ 1Б. + 2С. + 3D. +4
Анализ: Предположим, что химическая формула образовавшегося хлорида — RClx, согласно соотношению количества молекул в заголовке RClx: h3O = 2: 3 Согласно закону сохранения массы, можно знать, что атомный тип и номер каждого элемента до и после реакции не изменяются, а H и Cl в продукте не изменяются.
Соотношение количества атомов в нем также должно быть 1: 1, поэтому значение x равно 3, тогда валентность R равна +3, выберите C.
Относительная молекулярная масса
Пример 5: — Относительный молекулярная масса оксида металлического элемента равна M, а относительная молекулярная масса масса хлорида в том же валентном состоянии равна N, тогда значение валентности элемент есть?
Анализ: Пусть стихия валентность будет + x, а относительная атомная масса будет MR
(1) Если x — нечетное число, химическая формула оксида — R2Ox, а химическая формула хлорида — RClx.
2MR + 16x = M (1)
MR + 35,5x = N (2)
(2) * 2- (1) Значение x равно
(2) Когда x — четное число, химическая формула оксида — ROx / 2, а химическая формула хлорида — RClx.
MR + 35,5x = N (4)
Таким образом, следует выбрать A и D.
Метод отношения качества
Пример 6: — Металлический элемент ag с относительной атомной массой M реагирует с достаточным количеством разбавленного серной кислоты для образования водорода Bg, а валентность металлического элемента в реакция есть?
Анализ: Пусть металл валентность в реакции равна + x валентность, то металлический элемент имеет следующую связь с образование H 2 :
2R ~ xH 2
2M 2x
ab
Следовательно, следует выбрать B.
Обсуждение сопутствующих факторов
Пример 7: — Наибольшее электронное число атома М элемента меньше 5, химическая формула его оксида — MxOy, а химическая формула хлорида — MClz. Когда y: z = 1: 2, может быть, валентность M?
А. +1 Б. +2 С. +3 Д. +4
Анализ: Валентность M численно равно значению z
Например, y = 1z = 2 (разумно)
y = 2z = 4 (разумно)
y = 3z = 6 (не соответствует крайнему электрону число меньше 5)
Следовательно, следует выбрать B и D.
8.2 Гибридные атомные орбитали — Химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните концепцию гибридизации атомных орбиталей
- Определить гибридные орбитали, связанные с различной молекулярной геометрией
Мыслить в терминах перекрывающихся атомных орбиталей — это один из способов объяснить, как образуются химические связи в двухатомных молекулах. Однако, чтобы понять, как молекулы с более чем двумя атомами образуют стабильные связи, нам нужна более подробная модель.В качестве примера рассмотрим молекулу воды, в которой один атом кислорода связан с двумя атомами водорода. Кислород имеет электронную конфигурацию 1 s 2 2 s 2 2 p 4 , с двумя неспаренными электронами (по одному на каждой из двух орбиталей 2 p ). Теория валентной связи предсказывает, что две связи O – H образуются в результате перекрытия этих двух орбиталей 2 p с орбиталями 1 s атомов водорода.Если бы это было так, угол связи был бы 90 °, как показано на рисунке 1, потому что орбитали p перпендикулярны друг другу. Экспериментальные данные показывают, что валентный угол составляет 104,5 °, а не 90 °. Предсказание модели теории валентных связей не соответствует реальным наблюдениям за молекулой воды; нужна другая модель.
Рис. 1. Гипотетическое перекрытие двух из 2 p орбиталей на атоме кислорода (красный) с 1 s орбиталями двух атомов водорода (синий) дало бы угол связи 90 °.Это не согласуется с экспериментальными данными.Квантово-механические расчеты показывают, почему наблюдаемые валентные углы в H 2 O отличаются от предсказанных перекрытием орбиталей 1 s атомов водорода с орбиталями 2 p атома кислорода. Математическое выражение, известное как волновая функция, ψ , содержит информацию о каждой орбитали и волнообразных свойствах электронов в изолированном атоме. Когда атомы связаны вместе в молекуле, волновые функции объединяются, чтобы произвести новые математические описания, которые имеют разные формы.Этот процесс объединения волновых функций для атомных орбиталей называется гибридизацией и математически выполняется линейной комбинацией атомных орбиталей , LCAO (метод, с которым мы снова столкнемся позже). Новые орбитали, которые возникают в результате, называются гибридными орбиталями . Валентные орбитали в изолированном атоме кислорода представляют собой орбитали 2 s и три орбитали 2 p . Валентные орбитали в атоме кислорода в молекуле воды различаются; они состоят из четырех эквивалентных гибридных орбиталей, которые указывают приблизительно на углы тетраэдра (рис. 2).Следовательно, перекрытие орбиталей O и H должно приводить к тетраэдрическому валентному углу (109,5 °). Наблюдаемый угол 104,5 ° является экспериментальным свидетельством того, что квантово-механические расчеты дают полезное объяснение: теория валентных связей должна включать компонент гибридизации, чтобы давать точные предсказания.
Рис. 2. (a) Молекула воды имеет четыре области электронной плотности, поэтому теория VSEPR предсказывает тетраэдрическое расположение гибридных орбиталей. (b) Две гибридные орбитали на кислороде содержат неподеленные пары, а две другие перекрываются с 1 s орбиталями атомов водорода, образуя связи O – H в H 2 O.Это описание больше соответствует экспериментальной структуре.Следующие идеи важны для понимания гибридизации:
- Гибридные орбитали не существуют в изолированных атомах. Они образуются только в атомах с ковалентной связью.
- Гибридные орбитали имеют форму и ориентацию, которые сильно отличаются от атомных орбиталей в изолированных атомах.
- Набор гибридных орбиталей создается путем объединения атомных орбиталей. Количество гибридных орбиталей в наборе равно количеству атомных орбиталей, которые были объединены для создания набора.
- Все орбитали в наборе гибридных орбиталей эквивалентны по форме и энергии.
- Тип гибридных орбиталей, образующихся в связанном атоме, зависит от его электронной пары геометрии, как предсказывается теорией VSEPR.
- Гибридные орбитали перекрываются, образуя σ-связи. Негибридизованные орбитали перекрываются, образуя π-связи.
В следующих разделах мы обсудим общие типы гибридных орбиталей.
Атом бериллия в газообразной молекуле BeCl 2 является примером центрального атома без неподеленных пар электронов в линейном расположении трех атомов.В молекуле BeCl 2 имеются две области валентной электронной плотности, соответствующие двум ковалентным связям Be – Cl. Чтобы разместить эти два электронных домена, две из четырех валентных орбиталей атома Be смешиваются, образуя две гибридные орбитали. Этот процесс гибридизации включает смешение валентной s орбитали с одной из валентных p орбиталей с получением двух эквивалентных гибридных орбиталей sp , ориентированных в линейной геометрии (рис. 3).На этом рисунке набор орбиталей sp выглядит похожим по форме на исходную орбиталь p , но есть важное отличие. Количество объединенных атомных орбиталей всегда равно количеству образованных гибридных орбиталей. Орбиталь p — это одна орбиталь, которая может удерживать до двух электронов. Набор sp представляет собой две эквивалентные орбитали, расположенные на 180 ° друг от друга. Два электрона, которые первоначально находились на орбите s , теперь распределяются по двум орбиталям sp , которые заполнены наполовину.В газообразном BeCl 2 эти наполовину заполненные гибридные орбитали будут перекрываться с орбиталями атомов хлора с образованием двух идентичных σ-связей.
Рис. 3. Гибридизация орбитали s (синий) и орбитали p (красный) одного и того же атома дает две гибридные орбитали sp (фиолетовый). Каждая гибридная орбиталь ориентирована в основном только в одном направлении. Обратите внимание, что каждая орбиталь sp содержит одну долю, которая значительно больше другой.Набор из двух орбиталей sp ориентирован на 180 °, что согласуется с геометрией двух доменов.Мы проиллюстрируем электронные различия в изолированном атоме Be и в связанном атоме Be на диаграмме орбитальных уровней энергии на рисунке 4. Эти диаграммы представляют каждую орбиталь горизонтальной линией (указывающей ее энергию) и каждый электрон стрелкой. Энергия увеличивается к верху диаграммы. Мы используем одну стрелку, направленную вверх, чтобы указать один электрон на орбитали, и две стрелки (вверх и вниз), чтобы указать два электрона с противоположным спином.
Рис. 4. На этой диаграмме орбитальных уровней энергии показаны гибридизированные орбитали sp на Be в линейной молекуле BeCl 2 . Каждая из двух гибридных орбиталей sp удерживает один электрон и, таким образом, наполовину заполнена и доступна для связывания через перекрытие с орбиталью Cl 3 p .Когда атомные орбитали гибридизуются, валентные электроны занимают вновь созданные орбитали. У атома Be было два валентных электрона, поэтому каждая из орбиталей sp получает один из этих электронов.Каждый из этих электронов соединяется с неспаренным электроном на атоме хлора, когда гибридная орбиталь и орбиталь хлора перекрываются во время образования связей Be – Cl.
Любой центральный атом, окруженный всего двумя областями валентной электронной плотности в молекуле, будет демонстрировать гибридизацию sp . Другие примеры включают атом ртути в линейной молекуле HgCl 2 , атом цинка в Zn (CH 3 ) 2 , который содержит линейное расположение C – Zn – C, и атомы углерода в HCCH и CO 2 .
Посетите веб-сайт Университета Висконсин-Ошкош, чтобы узнать о трехмерной визуализации гибридных орбиталей.
Валентные орбитали центрального атома, окруженные тремя областями электронной плотности, состоят из набора из трех гибридных орбиталей sp 2 и одной негибридизированной орбитали p . Такое расположение является результатом гибридизации sp 2 , смешивания одной орбитали s и двух орбиталей p для получения трех идентичных гибридных орбиталей, ориентированных в тригональной плоской геометрии (рис. 5).
Рис. 5. Гибридизация орбитали s (синий) и двух орбиталей p (красный) дает три эквивалентных sp 2 гибридизированных орбиталей (фиолетовый), ориентированных под углом 120 ° относительно друг друга. Оставшаяся негибридизованная орбиталь p здесь не показана, но расположена вдоль оси z.Хотя квантовая механика дает «пухлые» орбитальные лепестки, как показано на рисунке 5, иногда для ясности эти орбитали рисуются тоньше и без малых лепестков, как на рисунке 6, чтобы не затемнять другие особенности данной иллюстрации.Мы будем использовать эти «более тонкие» представления всякий раз, когда истинное представление слишком тесное, чтобы его можно было легко визуализировать.
Рис. 6. Этот альтернативный способ рисования тригональных плоских sp 2 гибридных орбиталей иногда используется на более скученных фигурах.Наблюдаемая структура молекулы борана, BH 3, предполагает sp 2 гибридизацию бора в этом соединении. Молекула тригонально плоская, а атом бора участвует в трех связях с атомами водорода (рис. 7).Мы можем проиллюстрировать сравнение орбиталей и распределения электронов в изолированном атоме бора и в связанном атоме в BH 3 , как показано на диаграмме орбитальных энергетических уровней на рисунке 8. Мы перераспределяем три валентных электрона атома бора в трех sp 2 гибридных орбиталей, и каждый электрон бора соединяется с электроном водорода при образовании связей B – H.
Рис. 7. BH 3 — электронодефицитная молекула с тригональной планарной структурой. Рис. 8. В изолированном атоме B имеется одна 2 s и три валентные орбитали 2 p . Когда бор находится в молекуле с тремя областями электронной плотности, три орбитали гибридизуются и создают набор из трех орбиталей sp 2 и одной негибридизованной орбитали 2 p . Каждая из трех наполовину заполненных гибридных орбиталей перекрывается с орбиталью атома водорода, образуя три σ-связи в BH 3 .Любой центральный атом, окруженный тремя областями электронной плотности, будет проявлять гибридизацию sp 2 .Сюда входят молекулы с неподеленной парой на центральном атоме, такие как ClNO (рис.9), или молекулы с двумя одинарными связями и двойной связью, соединенными с центральным атомом, как в формальдегиде, CH 2 O, и этене, H 2 ГКН 2 .
Рис. 9. Центральный атом (атомы) в каждой из показанных структур содержит три области электронной плотности и гибридизирован по sp 2 . Как мы знаем из обсуждения теории VSEPR, область электронной плотности содержит все электроны, которые направлены в одном направлении.Каждая неподеленная пара, неспаренный электрон, одинарная связь или множественная связь будет считаться одной областью электронной плотности.Валентные орбитали атома, окруженного тетраэдрическим расположением пар связей и неподеленных пар, состоят из набора из четырех sp 3 гибридных орбиталей . Гибриды являются результатом смешения одной орбитали s и всех трех орбиталей p , что дает четыре идентичных гибридных орбитали sp 3 (рис. 10).Каждая из этих гибридных орбиталей указывает на разные углы тетраэдра.
Рис. 10. Гибридизация орбитали s (синий) и трех орбиталей p (красный) дает четыре эквивалентных sp 3 гибридизированных орбиталей (фиолетовый), ориентированных под углом 109,5 ° относительно друг друга.Молекула метана, CH 4 , состоит из атома углерода, окруженного четырьмя атомами водорода в углах тетраэдра. Атом углерода в метане проявляет гибридизацию sp 3 .Мы проиллюстрировали орбитали и распределение электронов в изолированном атоме углерода и в связанном атоме в CH 4 на рисунке 11. Четыре валентных электрона атома углерода распределены поровну в гибридных орбиталях, и каждый электрон углерода соединяется с водородом. электрон при образовании связей C – H.
Рис. 11. Четыре валентные атомные орбитали от изолированного атома углерода все гибридизуются, когда углерод связывается в молекуле, такой как CH 4 , с четырьмя областями электронной плотности.Это создает четыре эквивалентных sp 3 гибридных орбиталей. Перекрытие каждой из гибридных орбиталей с водородной орбиталью создает связь C – H σ.В молекуле метана 1 s орбиталь каждого из четырех атомов водорода перекрывается с одной из четырех sp 3 орбиталей атома углерода с образованием сигма-связи. Это приводит к образованию четырех сильных эквивалентных ковалентных связей между атомом углерода и каждым из атомов водорода с образованием молекулы метана, CH 4 .
Структура этана, C 2 H 6, аналогична структуре метана в том, что каждый углерод в этане имеет четыре соседних атома, расположенных в углах тетраэдра — три атома водорода и один атом углерода (рис. 12). . Однако в этане орбиталь sp 3 одного атома углерода перекрывается встык с орбиталью sp 3 второго атома углерода, образуя σ-связь между двумя атомами углерода. Каждая из оставшихся sp 3 гибридных орбиталей перекрывается с s орбиталью атома водорода с образованием σ-связей углерод-водород.Структура и общий контур связывающих орбиталей этана показаны на рисунке 12. Ориентация двух групп CH 3 не является фиксированной относительно друг друга. Экспериментальные данные показывают, что вращение вокруг σ-связей происходит легко.
Рис. 12. (a) В молекуле этана, C 2 H 6 , каждый углерод имеет четыре sp 3 орбиталей. (b) Эти четыре орбитали перекрываются, образуя семь σ-связей.Гибридная орбиталь sp 3 также может удерживать неподеленную пару электронов.Например, атом азота в аммиаке окружен тремя парами связей и неподеленной парой электронов, направленной к четырем углам тетраэдра. Атом азота sp 3 гибридизован с одной гибридной орбиталью, занятой неподеленной парой.
Молекулярная структура воды соответствует тетраэдрическому расположению двух неподеленных пар и двух связанных пар электронов. Таким образом, мы говорим, что атом кислорода sp 3 гибридизирован, причем две из гибридных орбиталей заняты неподеленными парами, а две — связующими парами.Поскольку неподеленные пары занимают больше места, чем соединяющие пары, структуры, содержащие неподеленные пары, имеют валентные углы, слегка искаженные от идеала. Совершенные тетраэдры имеют углы 109,5 °, но наблюдаемые углы в аммиаке (107,3 °) и воде (104,5 °) немного меньше. Другие примеры гибридизации sp 3 включают CCl 4 , PCl 3 и NCl 3 .
Чтобы описать пять связывающих орбиталей в тригонально-бипирамидальном расположении, мы должны использовать пять из атомных орбиталей валентной оболочки (орбиталь s , три орбитали p и одна из орбиталей d ), что дает пять sp 3 d гибридные орбитали .При октаэдрическом расположении шести гибридных орбиталей мы должны использовать шесть атомных орбиталей валентной оболочки (орбиталь s , три орбитали p и две орбитали d в ее валентной оболочке), что дает шесть sp 3 d 2 гибридных орбиталей . Эти гибридизации возможны только для атомов, которые имеют d орбиталей в их валентных подоболочках (то есть не в первом или втором периоде).
В молекуле пентахлорида фосфора, PCl 5 , есть пять связей P – Cl (таким образом, пять пар валентных электронов вокруг атома фосфора), направленных к углам тригональной бипирамиды. Мы используем орбитали 3 s , три орбитали 3 p и одну из орбиталей 3 d , чтобы сформировать набор из пяти задействованных гибридных орбиталей sp 3 d (Рисунок 14). в связях P – Cl. Другие атомы, которые демонстрируют гибридизацию sp 3 d , включают атом серы в SF 4 и атомы хлора в ClF 3 и в ClF 4 + .(Электроны на атомах фтора для ясности опущены.)
Рис. 13. Три изображенных соединения демонстрируют sp 3 d гибридизацию в центральном атоме и форму тригональной бипирамиды. SF4 и ClF 4 + имеют одну неподеленную пару электронов на центральном атоме, а ClF 3 имеет две неподеленные пары, придающие ему показанную Т-образную форму. Рис. 14. (a) Для пяти областей электронной плотности вокруг фосфора в PCl 5 требуется пять гибридных sp 3 d орбиталей.(b) Эти орбитали объединяются, образуя тригонально-бипирамидальную структуру, при этом каждая большая доля гибридной орбитали указывает на вершину. Как и раньше, есть небольшие лепестки, указывающие в противоположном направлении для каждой орбитали (не показаны для ясности).Атом серы в гексафториде серы, SF 6 , проявляет гибридизацию sp 3 d 2 . Молекула гексафторида серы имеет шесть пар связей электронов, соединяющих шесть атомов фтора с одним атомом серы.На центральном атоме нет неподеленных пар электронов. Чтобы связать шесть атомов фтора, 3 s орбитали, три 3 p орбиталей и две из 3 d орбиталей образуют шесть эквивалентных sp 3 d 2 гибридных орбиталей, каждая из которых направлена к другому углу октаэдра. Другие атомы, которые проявляют sp 3 d 2 гибридизацию, включают атом фосфора в PCl 6 —, атом йода в межгалогенах IF 6 + , IF 5 , ICl 4 — , IF 4 — и атом ксенона в XeF 4 .
Рис. 15. (a) Гексафторид серы, SF 6 , имеет октаэдрическую структуру, которая требует гибридизации sp 3 d 2 . (b) Шесть орбиталей sp 3 d 2 образуют октаэдрическую структуру вокруг серы. И снова малая доля каждой орбиты не показана для ясности.Гибридизация атома определяется на основе количества окружающих его областей электронной плотности.Геометрические конфигурации, характерные для различных наборов гибридных орбиталей, показаны на рисунке 16. Эти расположения идентичны геометриям электронных пар, предсказываемым теорией VSEPR. Теория VSEPR предсказывает формы молекул, а теория гибридных орбиталей дает объяснение того, как эти формы формируются. Чтобы найти гибридизацию центрального атома, мы можем использовать следующие рекомендации:
- Определите структуру Льюиса молекулы.
- Определите количество областей электронной плотности вокруг атома, используя теорию VSEPR, в которой одинарные связи, множественные связи, радикалы и неподеленные пары считаются как одна область.
- Назначьте набор гибридизированных орбиталей из рисунка 16, который соответствует этой геометрии.
Важно помнить, что гибридизация была разработана для рационализации экспериментально наблюдаемой молекулярной геометрии.Модель хорошо работает для молекул, содержащих небольшие центральные атомы, в которых пары валентных электронов расположены близко друг к другу в пространстве. Однако для более крупных центральных атомов электронные пары валентной оболочки удалены от ядра, и отталкивания меньше. Их соединения демонстрируют структуры, которые часто не согласуются с теорией VSEPR, и гибридизированные орбитали не являются необходимыми для объяснения наблюдаемых данных. Например, мы обсудили валентный угол H – O – H в H 2 O, 104,5 °, что больше согласуется с гибридными орбиталями sp 3 (109.5 °) на центральном атоме, чем с орбиталями 2 p (90 °). Сера находится в той же группе, что и кислород, и H 2 S имеет аналогичную структуру Льюиса. Однако он имеет гораздо меньший валентный угол (92,1 °), что указывает на гораздо меньшую гибридизацию на сере, чем на кислороде. Продолжая вниз по группе, теллур даже больше, чем сера, и для H 2 Te наблюдаемый валентный угол (90 °) согласуется с перекрытием орбиталей 5 p без включения гибридизации. Мы обращаемся к гибридизации там, где необходимо объяснить наблюдаемые структуры.
Пример 1
Назначение гибридизации
Сульфат аммония важен как удобрение. Какова гибридизация атома серы в сульфат-ионе SO 4 2-?
Раствор
Структура Льюиса сульфата показывает, что существует четыре области электронной плотности. Гибридизация — sp 3 .
Проверьте свои знания
Что такое гибридизация атома селена в SeF 4 ?
Ответ:
Атом селена sp 3 d гибридизирован.
Пример 2
Назначение гибридизации
Мочевина, NH 2 C (O) NH 2 , иногда используется в качестве источника азота в удобрениях. Как происходит гибридизация каждого атома азота и углерода в мочевине?
Раствор
Структура Льюиса мочевины —
Атомы азота окружены четырьмя областями электронной плотности, которые образуют тетраэдрическую геометрию электронных пар. Гибридизация в тетраэдрическом расположении — это sp 3 (Рисунок 16).Это гибридизация атомов азота в мочевине.
Атом углерода окружен тремя областями электронной плотности, расположенными в тригональной плоскости. Гибридизация в геометрии тригональной плоской пары электронов имеет вид sp 2 (рис. 16), что представляет собой гибридизацию атома углерода в мочевине.
Проверьте свои знания
Уксусная кислота, H 3 CC (O) OH, представляет собой молекулу, придающую уксусу его запах и кислый вкус.Что такое гибридизация двух атомов углерода в уксусной кислоте?
Ответ:
H 3 C , sp 3 ; C (O) OH, sp 2
Мы можем использовать гибридные орбитали, которые представляют собой математические комбинации некоторых или всех валентных атомных орбиталей, для описания электронной плотности вокруг ковалентно связанных атомов. Эти гибридные орбитали либо образуют сигма (σ) -связи, направленные к другим атомам молекулы, либо содержат неподеленные пары электронов.Мы можем определить тип гибридизации вокруг центрального атома по геометрии областей электронной плотности вокруг него. Две такие области подразумевают гибридизацию sp ; три, sp 2 гибридизация; четыре, sp 3 гибридизация; пять, sp 3 d гибридизация; и шесть, sp 3 d 2 гибридизация. Связи Pi (π) образуются из негибридизованных атомных орбиталей ( p или d орбиталей).
Химия — Упражнения по окончанию главы
- Почему концепция гибридизации требуется в теории валентных связей?
- Придайте форму, описывающую каждый гибридный орбитальный набор:
(а) sp 2
(б) sp 3 d
(в) сп
(г) зр 3 г 2
- Объясните, почему атом углерода не может образовывать пять связей, используя гибридные орбитали sp 3 d .
- Какова гибридизация центрального атома в каждом из следующих элементов?
(а) BeH 2
(б) SF 6
(в) PO 4 3−
(г) PCl 5
- Молекула с формулой AB 3 может иметь одну из четырех различных форм. Придайте форму и гибридизацию центрального атома A для каждого из них.
- Метионин, CH 3 SCH 2 CH 2 CH (NH 2 ) CO 2 H, представляет собой аминокислоту, содержащуюся в белках.Нарисуйте структуру Льюиса этого соединения. Каков тип гибридизации каждого углерода, кислорода, азота и серы?
- Серная кислота производится в результате серии реакций, представленных следующими уравнениями: [латекс] \ text {S} _8 (s) + 8 \ text {O} _2 (g) \ longrightarrow 8 \ text {SO} _2 (g ) [/ латекс]
[латекс] 2 \ text {SO} _2 (g) + \ text {O} _2 (g) \ longrightarrow 2 \ text {SO} _3 (g) [/ latex]
[латекс] \ текст {SO} _3 (g) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {H} _2 \ text {SO} _4 (l) [/ latex]Изобразите структуру Льюиса, спрогнозируйте молекулярную геометрию с помощью VSEPR и определите гибридизацию серы для следующего:
(а) круговая S 8 молекула
(б) SO 2 молекула
(в) SO 3 молекула
(г) H 2 SO 4 молекула (атомы водорода связаны с атомами кислорода)
- Два важных промышленных химиката, этен, C 2 H 4 , и пропен, C 3 H 6 , производятся в процессе парового (или термического) крекинга:
[латекс] 2 \ text {C} _3 \ text {H} _8 (g) \ longrightarrow \ text {C} _2 \ text {H} _4 (g) + \ text {C} _3 \ text {H} _6 (g) + \ text {CH} _4 (g) + \ text {H} _2 (g) [/ latex]
Для каждого из четырех углеродных соединений выполните следующие действия:
(a) Нарисуйте структуру Льюиса.
(b) Предскажите геометрию атома углерода.
(c) Определите гибридизацию каждого типа атома углерода.
- В течение многих лет после их открытия считалось, что благородные газы не могут образовывать соединения. Теперь мы знаем, что это мнение неверно. Смесь газов ксенона и фтора, помещенная в кварцевую колбу и помещенная на подоконник, медленно образует белое твердое вещество. Анализ соединения показывает, что оно содержит 77,55% Хе и 22.45% F по массе.
(а) Какова формула соединения?
(b) Напишите структуру Льюиса для соединения.
(c) Предскажите форму молекул соединения.
(d) Какая гибридизация соответствует предсказанной вами форме?
- Рассмотрим азотистую кислоту, HNO 2 (HONO).
(а) Напишите структуру Льюиса.
(b) Каковы электронная пара и молекулярная геометрия внутренних атомов кислорода и азота в молекуле HNO 2 ?
(c) Какова гибридизация внутренних атомов кислорода и азота в HNO 2 ?
- Спички с нанесением ударов в любом месте содержат слой KClO 3 и слой P 4 S 3 .Тепло, создаваемое трением при ударе спички, заставляет эти два соединения энергично реагировать, что поджигает деревянный стержень спички. KClO 3 содержит ион ClO 3 — . P 4 S 3 — необычная молекула со скелетной структурой.
(a) Запишите структуры Льюиса для P 4 S 3 и иона ClO 3 —.
(b) Опишите геометрию атомов P, S и Cl в этих разновидностях.
(c) Назначьте гибридизацию атомам P, атому S и атому Cl в этих разновидностях.
(d) Определите степени окисления и формальный заряд атомов в ионе P 4 S 3 и ионе ClO 3 —.
- Определите гибридизацию каждого атома углерода в следующей молекуле. (Дано расположение атомов; необходимо определить, сколько связей соединяет каждую пару атомов.)
- Запишите структуры Льюиса для NF 3 и PF 5 .На основе гибридных орбиталей объясните тот факт, что NF 3 , PF 3 и PF 5 являются стабильными молекулами, а NF 5 не существует.
- Помимо NF 3 известны два других фторпроизводных азота: N 2 F 4 и N 2 F 2 . Какие формы вы предсказываете для этих двух молекул? Какова гибридизация азота в каждой молекуле?
Глоссарий
- гибридный орбитальный Орбиталь
- , созданная объединением атомных орбиталей на центральном атоме
- гибридизация Модель
- , описывающая изменения атомных орбиталей атома, когда он образует ковалентное соединение
- sp гибридный орбитальный
- одна из двух орбиталей с линейным расположением, полученная в результате объединения одной s и одной p орбитальной
- sp 2 гибридный орбитальный
- одна из трех орбиталей с тригонально-планарным расположением, полученная в результате объединения одной s и двух p орбиталей
- sp 3 гибридный орбитальный
- одна из четырех орбиталей с тетраэдрическим расположением, полученная в результате объединения одной s и трех p орбиталей
- sp 3 d гибридный орбитальный
- одна из пяти орбиталей с тригонально-бипирамидальным расположением, которое получается в результате объединения одной s , трех p и одной d орбитальной точки
- sp 3 d 2 гибридный орбитальный
- одна из шести орбиталей с октаэдрическим расположением, полученная в результате объединения одной s , трех p и двух d орбиталей
Решения
Ответы на упражнения в конце главы по химии
1.Гибридизация вводится для объяснения геометрии связывающих орбиталей в теории валентных облигаций.
3. В валентной оболочке углерода нет орбиталей d .
5. тригонально планарная, пр 2 ; тригонально-пирамидальный (одна неподеленная пара на A) sp 3 ; Т-образный (две одиночные пары на A sp 3 d или (три одиночные пары на A) sp 3 d 2
7.(a) Каждая S имеет изогнутую (109 °) геометрию, sp 3
(б) Изогнутый (120 °), пр. 2
(в) Тригональная планарная, пр 2
(г) Тетраэдрическая, пр 3
9. а) XeF 2
(б)
(в) линейный (г) sp 3 d
11. (а)
(б) атомы P, тригонально-пирамидальные; Атомы S, изогнутые, с двумя неподеленными парами; Атомы Cl, тригонально-пирамидальные; (c) Гибридизация по P, S и Cl во всех случаях составляет sp 3 ; (d) Степени окисления P +1, [латекс] \ text {S} — 1 \ frac {1} {3} [/ latex], Cl +5, O –2.Официальные сборы: P 0; S 0; Cl +2: O –1
13.
Фосфор и азот могут образовывать гибриды sp 3 с образованием трех связей и удерживать одну неподеленную пару в PF 3 и NF 3 соответственно. Однако азот не имеет валентности d орбиталей, поэтому он не может образовать набор гибридных орбиталей sp 3 d для связывания пяти атомов фтора в NF 5 . Фосфор имеет d орбиталей и может связывать пять атомов фтора с гибридными орбиталями sp 3 d в PF 5 .
.



 Записать индексы при символах элементов
Записать индексы при символах элементов

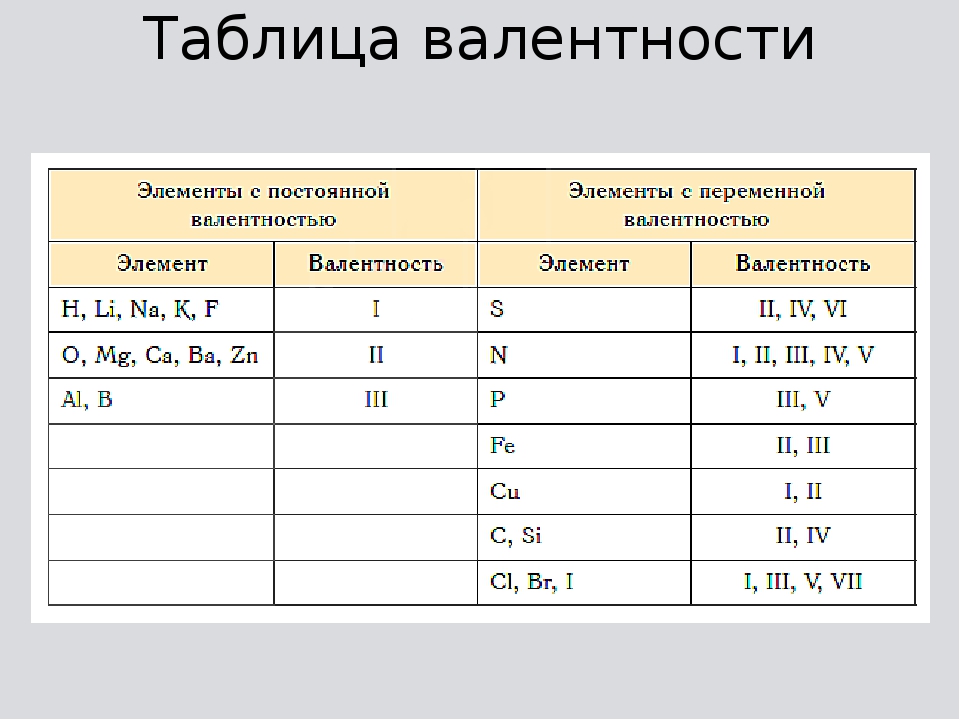

 — H+13 PX O-24
— H+13 PX O-24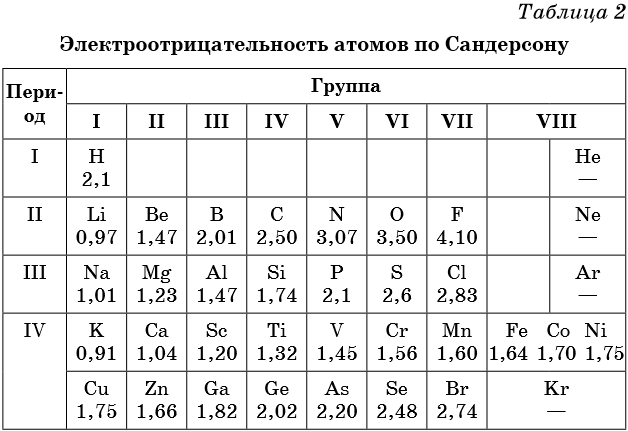
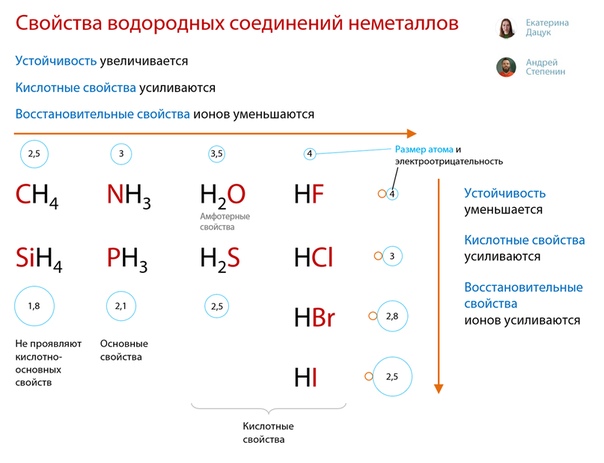 Валентность же строго больше нуля.
Валентность же строго больше нуля.