РАЗНООБРАЗИЕ ВЕЩЕСТВ И МАТЕРИАЛОВ И ИХ ИСПОЛЬЗОВАНИЕ ЧЕЛОВЕКОМ — ТЕЛА И ВЕЩЕСТВА — ПРИРОДОВЕДЕНИЕ 4 КЛАСС — Ирина Жиркова — учебник
ТЕЛА И ВЕЩЕСТВА
§ 64. РАЗНООБРАЗИЕ ВЕЩЕСТВ И МАТЕРИАЛОВ И ИХ ИСПОЛЬЗОВАНИЕ ЧЕЛОВЕКОМ
— Что такое вещество? В каких состояниях могут находиться вещества? Приведите примеры.
На Земле насчитывается несколько миллионов разнообразных веществ. Немало веществ люди используют для своих нужд. Вещества, или их смеси, которые люди используют для изготовления необходимых им вещей, называют материалами.
Большинство материалов, которые использует человек, существуют в природе. Это — поваренная соль, вода, сахар, металлы (алюминий, железо, медь), уксусная кислота, крахмал и т. п (рис. 219).
Алюминий Поваренная соль Графит Крахмал
Рис. 219. Разнообразие природных веществ
— Какие вещества используют у вас дома?
В каждом доме есть поваренная соль в виде белых кристалликов. В природе поваренная соль содержится под землей, в морской воде и воде соленых озер. Ее добывают как полезное ископаемое.
— Какое главное свойство поваренной соли, благодаря которой ее используют люди?
Главное свойство поваренной соли — соленый вкус. Ее используют для подсаливания еды и для консервирования продуктов питания.
Сахар — это вещество, которое по внешнему виду очень подобна к поваренной соли. Но по вкусу их никогда не спутать.
— Какое главное свойство сахара, благодаря которой его используют люди?
Сладкий вкус — главный признак сахара. Поэтому его добавляют к многих продуктов питания.
Крахмал — это белый хрустящий порошок без запаха и вкуса. В холодной воде он не растворяется, а в горячей — набухает. Крахмал содержится во многих продуктах растительного происхождения. Его используют для приготовления киселя. Крахмал является одним из составляющих для производства разнообразных сладостей.
— Рассмотрите изображенные вещи и назовите материалы, из которых они изготовлены (рис. 220).
Рис. 220. Вещи, изготовленные из материалов
Из металлов изготавливают посуду, кухонные принадлежности, трубы, радиаторы. Материалом для изготовления стержней до карандашей является графит, а оболочки — древесина.
Кроме природных веществ, являются многие вещества, которые создал человек. Это — пластмассы, резина, стекло, полиэтилен (рис. 221).
— С чего люди производят материалы, которых не существует в природе?
Сырьем для производства материалов, которых не существует в природе, являются природные вещества. Пластмассу, резину производят из нефти и природного газа. Стекло — из песка и известняка.
Полиэтилен Пластмассы Резина Стекло
Рис. 221. Вещества, созданные человеком
— Рассмотрите изображенные вещи и назовите материалы, из которых они изготовлены (рис. 222).
Рис. 222. Вещи, изготовленные из материалов, созданных человеком
Стеклянная посуда, оконное стекло, резиновые шины, пластмассовые изделия, полиэтиленовые пакеты и много других вещей люди изготавливают из созданных ими материалов.
Вещества, или их смеси, которые люди используют для изготовления различных вещей, называют материалами.
— 1. Какие природные вещества и для чего использует человек? 2. Какие вещества создал человек? 3. Из чего человек изготавливает материалы, которых нет в природе? 4. Какие вещи люди делают из созданных ими материалов?
Газообразные вещества: примеры и свойства
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ — это природные обитатели, формирующиеся естественным путем. Другая половина — искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.

Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью ионизированные газы. И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы — это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород — О2, озон — О3, водород — Н2, хлор — CL2, фтор — F2, азот — N2 и прочие.
Ко второй категории следует относить такие соединения, в состав которых входит несколько атомов. Это и будут газообразные сложные вещества. Примерами служат:
- сероводород — H2S;
- хлороводород — HCL;
- метан — CH4;
- сернистый газ — SO2;
- бурый газ — NO2;
- фреон — CF2CL2;
- аммиак — NH3 и прочие.
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей предельных углеводородов (метан, этан, пропан, бутан, пентан). Общая формула CnH2n+2;
- этилен — С2Н4;
- ацетилен или этин — С2Н2;
- метиламин — CH3NH2 и другие.
К категории газов неорганической природы относятся хлор, фтор, аммиак, угарный газ, силан, веселящий газ, инертные или благородные газы и прочие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия — одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение — жидкость превращается в пар, сублимация — твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.

Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких — сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов — процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
- Амедео Авогадро в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа.
- Ферми — создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт — фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.

Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон — О3). Тип связи — ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях — темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа — I2.

К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений — важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием «газ» обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь — это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.

Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден — кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ — необходимый продукт «питания» для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ — важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы — это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены — газы. Бром — это жидкость при обычных условиях, а йод — легко возгоняющееся твердое вещество. Фтор и хлор — ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
природное вещество на букву В
| Воск | Вещество, вырабатываемое пчелами и служащее им материалом для постройки сот, а также сходное с ним минеральное или органическое вещество 4 буквы |
| Вытеснитель | Вещество, способное вытеснить откуда-либо другое вещество 11 букв |
| Вихрь | Природное явление 5 букв |
| Вихрь | Природное явление; картина Малявина 5 букв |
| Водось | Природное водное образование на диалекте удмуртов (устар.) 6 букв |
| Воск | Вещество для свечи 4 буквы |
| Воск | Пчелиное вещество 4 буквы |
| Ванилин | Душистое вещество 7 букв |
| Взрывчатка | Взрывчатое вещество 10 букв |
| Воск | Вещество, вырабатываемое пчелами 4 буквы |
Какие есть природные вспомогательные вещества?
Крахмал. Состоит из 2-х фракций — амилазы и амилопектина. Амилоза растворяется в теплой воде, а амилопектин только набухает. Крахмал используется в твердых ЛФ. В качестве стабилизатора суспензий и эмульсий используется 10% раствор.
Альгинаты — кислота альгиновая и ее соли. Кислота альгиновая — ВМС, получается из морских водорослей. Используется в качестве разрыхляющих, эмульгирующих, йрологирующих, пленкообразующих вспомогательных веществ, а также для приготовления мазей и паст.
Агароид. В состав входят глюкоза и галактоза, а также минеральные элементы (Са, Мg, S и др.). Получают из морских водорослей. В 0,1% концентрации обладает стабилизирующими, разрыхляющими и скользящими свойствами, в смеси с глицерином в 1,5% концентрации используется в качестве мазевой основы.
Пектин — входит в состав клеточных стенок многих растений. Обладает желатинирующей способностью. Используется для создания детских лекарственных форм.
Микробные ПС — наиболее распространен аубазидан — получаемой при м — б синтезе с помощью дрожжевого гриба Аиreobasidium pullulans. Аубазидан (0,6%) образует гели, которые используются как основа для мазей, 1% — для пленок и губок. Конц. 0,1 — 0,3% — как пролонгатор глазных капель. При этом раствор устойчив при термической стерилизации до 120°C. Эффективный стабилизатор и эмульгатор.
Коллаген. Источником является кожа крупного рогатого скота. Получают путем шелочно -солевой обработки. Коллаген применяется для покрытия ран в виде пленок с фурацилином, кислотой борной, маслом облепиховым, метилурацилом, а также в виде глазных пленок с а/б.
Желатин — получают при выпаривании обрезков кожи, ВМС белковой природы, содержит гликокол, аланин, аргинин, лейцин, лизин, глютаминовая кислота. Благодаря высоким гелеобразующим свойствам используется для изготовления мазей, желатиновых капсул, суппозиториев.
Желатоза — продукт неполного гидролиза желатина. Не обладает способностью желатинироваться, но имеет высокие эмульгирующие свойства.
Из неорганических полимеров чаще используются бентонит, аэросил, тальк.
Бентонит — в виде минералов кристаллической структуры размером частиц 0,01 мм. Имеют сложный состав. Общая формула: Al2O3 · SiO2 · n H2
O (содержит 90% оксидов Al, Si, Mg, Fe, еще катионы K+, Na+, Са2+, Мg2+ — вступают в и — о реакции). Способность к набуханию и гелеобразованию позволяет использовать их в производстве мазей, таблеток, порошков, гранул. Бентониты обеспечивают лекарственным препаратам мягкость, дисперсность, высокие адсорбционные свойства, легкую отдачу лекарственных веществ.Аэросил — кремния диоксид SiO2, очень легкий микронизированный порошок с выраженными адсорбционными свойствами. Применяют для стабилизации суспензий. Загущенную способность аэросила используют при полученипи гелей для мазевых основ. Адсорбционные свойства используют с целью стабилизации сухих экстрактов (уменьшается их гигроскопичность). В порошках применяют при изготовлении гигроскопичных смесей и как диспергатор.
26.05.2015
Разнообразие веществ — урок. Химия, 8–9 класс.
Количество известных в настоящее время веществ воистину невообразимо: по некоторым подсчётам оно уже превысило \(75\) миллионов. Причём благодаря усилиям учёных это число от года к году стремительно возрастает.
Многие из веществ существуют в природе. Так, воздух представляет собой смесь различных газов. В реках, морях и океанах, кроме воды, содержатся растворённые в ней вещества. В твёрдом поверхностном слое нашей планеты находятся многочисленные минералы и горные породы. Чрезвычайно большое количество самых разнообразных веществ находится в живых организмах.
Проводя исследования атмосферы, гидросферы, литосферы и биосферы, учёные выделяют, изучают, классифицируют вновь открытые вещества и присваивают им названия.
Однако многие из ныне известных веществ в природе не существуют, а получены искусственным путём в ходе химических экспериментов. Проводя опыты, учёные используют разнообразные вещества, которые специально приготовлены для научных целей.
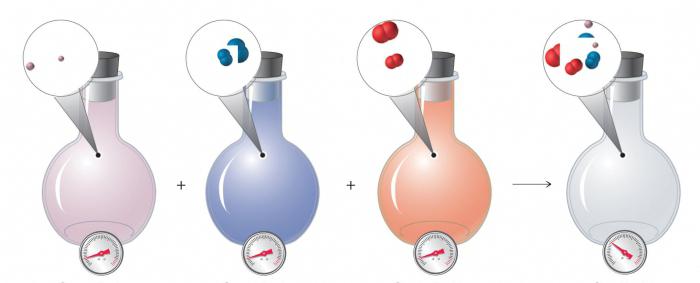
Вещества, которые используются в химических экспериментах, называют химическими реактивами.
 |  |
| Полка с реактивами | Работа с реактивами в лаборатории |
Многие вещества используются для изготовления различных предметов.
Вещества, используемые для изготовления предметов, оборудования, а также в строительстве и других отраслях, называют материалами.
Исторически первыми, используемыми людьми, были природные материалы — древесина, камень, глина. Co временем люди научились выплавлять металлы и стекло, получать известь и цемент. В последние десятилетия на замену традиционным материалам приходят новые, в частности различные пластмассы.
Материалы, используемые человеком, можно сгруппировать по их происхождению
1. Материалы естественного происхождения, т. е. такие, которые находятся в природе.
Это вещества как минеральные (песок, глина, мрамор и другие), так и органические (белки, углеводы и другие).

Добыча мрамора в с. Коелга (Челябинская обл.). Мрамор издавна используется в качестве облицовочного материала и для изготовления памятников.

Кожа — материал животного происхождения. По своему химическому составу кожа является белком. Благодаря высокой прочности используется для изготовления обуви и других изделий.

Лён — волокно растительного происхождения. По своему химическому составу является углеводом (целлюлозой). Ткани, которые изготовлены изо льна, обладают ценными гигиеническими свойствами.
2. Материалы искусственного происхождения — в природе не встречаются, а создаются человеком. Сюда можно отнести цемент, стекло, сталь и чугун, пластмассы (полиэтилен и др.), резину, синтетические волокна (капрон и др.).

Первые сведения о выплавке чугуна относятся в \(VI\) в. до н. э. (Китай).
В Западной Европе первые печи для выплавки чугуна появились в \(XIV\), а в России — в \(XVI\) в.

Цемент — один из основных строительных материалов.
Современная технология его изготовления была разработана в \(XIX\) в. Тогда была найдена необходимая для получения цемента рецептура, а также определена температура обжига сырья.

Полиэтилен — самая распространённая в мире пластмасса. Вещество получено в \(1899\) г. С \(1933\) г. его начали использовать в качестве материала для электрической изоляции кабелей. С \(1950\)-х используется для упаковки пищевых продуктов.
Чего в природе больше — тел или веществ? Почему?
Веществом называется проявление материи, из которой состоит то или иной физическое тело. Данный термин универсален, поскольку его модно применять по отношению к газу, воздуху, твердым предметам, соединениям на основе воды. Химическим элементам.
Чего в природе больше – тел или веществ
Чтобы понять, что в природе больше – тел или веществ, следует более глубоко разобраться в определениями данных терминов:
- Вещество, это проявление материи. Соответственно, вещество обладает специфическими свойствами;
- Вещества способны создавать соединения. Такие соединения образуют более сложные структуры, которые называются телами;
- Вещества могут создавать соединения не только в такими же веществами, но и с другими. В результате получается то или иное тело;
- Телом называется физический объект, обладающий определенными признаками. Поскольку вещество является выражением исходной материи, именно оно и образует тело.
Следовательно, любое тело состоит из вещества или соединений многих веществ. Это значит, что в природе больше веществ, чем тел. Ведь любое тело включает в себя множество соединений разных веществ. Тело имеет более сложную структуру.
Каждая единица тела, это совокупность многих веществ. Поэтому, тел меньше.
Почему тел меньше
Вещество, как материя, состоит из мельчайших частиц – молекул, атомов и еще более мелких. Они соединяются, образуя сложные структуры. Несколько таких структуры способны создать то или иное тело. Наилучшим образом объяснить большее количество веществ, чем тел, можно на примере.
Тело человека является единым сложным целым. Оно состоит из различных тканей, органов. В теле каждого человека имеются кости, кожные покровы, ногти, зубы, глазные яблоки, мозг и так далее. И каждый элемент человеческого тела включает множество веществ. Ведь тело состоит из воды, крови, обязательно присутствуют минеральные вещества, витамины. При этом воды и кровь тоже состоят из множества веществ, более мелких.
Получается, что тело едино. Но оно включает сотни и тысячи различных веществ.