Простые вещества — урок. Химия, 8–9 класс.
Все химические вещества делятся на простые и сложные.
Простыми называют вещества, образованные атомами одного химического элемента.
Некоторые простые вещества состоят из молекул.
Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие.
Из двухатомных молекул состоят водород h3, кислород O2, азот N2, галогены F2, Cl2, Br2, I2.
Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4, восемь — в молекулах серы S8.
Модели молекул водорода и азота
Модель молекулы белого фосфора
Другая группа простых веществ имеет немолекулярное строение. К таким веществам относятся все металлы, а также фосфор красный, алмаз, графит, кремний и другие.
Их химические формулы записывают химическим символом элемента без индекса: Fe, P, C, Si и т. д.
Модель кристалла железа
Химических элементов известно \(118\), а простых веществ — более \(400\). Один химический элемент может образовать несколько простых веществ.
Один химический элемент может образовать несколько простых веществ.
Явление существования нескольких простых веществ, образованных атомами одного химического элемента, называется аллотропией.
Простые вещества, состоящие из атомов одного химического элемента — аллотропные модификации (аллотропные видоизменения).
Пример:
химический элемент кислород образует простые вещества, отличающиеся составом молекул: кислород O2 и озон O3. Кислород — газ без запаха, необходим живым организмам для дыхания. Озон имеет запах, ядовит.
Химический элемент фосфор образует молекулярное вещество фосфор белый P4 и немолекулярное — фосфор красный P. Эти вещества отличаются не только строением, но и свойствами. Белый фосфор имеет запах, самовоспламеняется на воздухе. Красный фосфор без запаха, горит только при нагревании.
Химический элемент углерод образует немолекулярные вещества алмаз и графит. Они обозначаются одинаковой формулой — C, но имеют разное строение и отличаются свойствами. Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий.
Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий.
Алмаз и графит
Химический элемент и простое вещество
Названия химического элемента и простого вещества в большинстве случаев совпадают, поэтому следует различать эти два понятия.
Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение).
Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
Пример:
Химический элемент | Простое вещество |
| Относительная атомная масса кислорода равна \(16\) | Кислород плохо растворяется в воде |
| Азот входит в состав белков | Азот используют для получения аммиака |
| Атомы водорода входят в состав молекул воды | Водород легче воздуха |
химические элементы, которые нас окружают – Москва 24, 17.
 08.2015
08.2015Иллюстрация: Ольга Денисова
Все, что нас окружает, состоит из атомов. В настоящее время Международным союзом теоретической и прикладной химии признаны 114 элементов. Наши друзья из Детского центра научных открытий «ИнноПарк» посмотрели, с какими из них мы имеем дело постоянно, а какие будет непросто отыскать.
Один из самых распространенных элементов – кислород (О), названный так Михаилом Ломоносовым. Это не только газ в составе воздуха. Мы обнаруживаем его в воде, он отвечает за запах после дождя, с ним мы пьем сладкий чай и едим его, когда кусаем яблоко.
Мы ежедневно сталкиваемся и с углеродом (С). Графит в карандаше, бумажные страницы книги, тефлоновое покрытие сковороды, целлофановый пакет, банановый коктейль, круассан и даже молекула ДНК – все это образовано с его помощью. Не говоря уже об углекислом и угарном газах.
Другой наш вездесущий сосед – водород (Н). Его атом открывает таблицу Менделеева. Водород содержится не только в воде, но также и в перекиси, зеленых овощах, сочных фруктах, молоке и душистом мыле.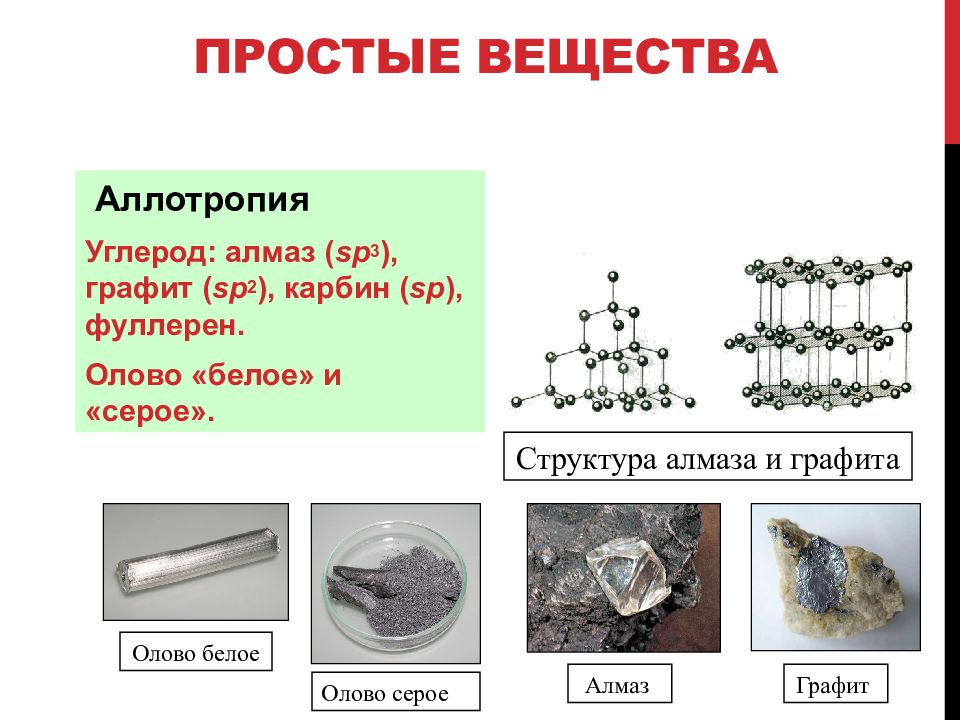
Когда мы едим стейк или диетический творог с орехами, мы глотаем азот (N). Он лежит в основе всех аминокислот, которые стройными рядами образуют белки. Азот – это не только рыба, бобовые и мясо, но и нашатырный спирт, удобрения, взрывчатые вещества, красители и многое другое.
Далеко не со всеми частицами мы контактируем в обычной жизни. Элементы с атомными номерами от 93 и выше не встречаются в природе, их синтезируют в лабораториях. Все эти сверхтяжелые вещества радиоактивны, а некоторые из них существовали лишь доли секунд. Их не используют на практике. Лишь один – америций (Am) – широко применяется в детекторах дыма.
Ссылки по теме
Впрочем, не все вещества, чьи атомные номера предшествуют 93, присутствуют в нашем быту. В земной коре содержится лишь несколько грамм франция (Fr) и астата (At). Нептуний (Np) и плутоний (Pu) также существуют в очень малых количествах, так что вероятность встретиться с ними сводится к нулю.
Некоторые радиоактивные элементы, например, технеций (Tc) и прометий (Pm), существовали в эпоху образования Земли – более 4,5 миллиарда лет назад, – но с тех пор исчезли из-за естественного распада. В целом, человек ежедневно контактирует примерно с 88-ю атомами из той самой таблицы на стене кабинета химии, практический смысл которой не все из нас осознали вовремя.
В целом, человек ежедневно контактирует примерно с 88-ю атомами из той самой таблицы на стене кабинета химии, практический смысл которой не все из нас осознали вовремя.
Наталья Глориозова, Детский центр научных открытий «ИнноПарк»
О «Физике города»
Каждый день, просыпаясь утром, мы погружаемся в город, полный фактур, звуков и красок. Пока мы идем на работу и гуляем в парке, нам в голову приходит миллион вопросов о том, как же все вокруг нас устроено в этом огромном мегаполисе. Почему под нами дрожит земля, когда под нами проезжает поезд метро? И может ли в Москве произойти землетрясение? Какими видят нас люди из космоса?
Аварийно химические опасные вещества
Аварийно химические опасные вещества (аммиак, хлор). Их воздействие на организм человека. Предельно допустимые и поражающие концентрации
Растет ассортимент применяемых в промышленности, сельском хозяйстве и быту химических веществ. Некоторые из них токсичны и вредны. При проливе или выбросе в окружающую среду способны вызвать массовые поражения людей, животных, приводят к заражению воздуха, почвы, воды, растений. Их называют аварийно химические опасные вещества(АХОВ). Определенные виды АХОВ находятся в больших количествах на предприятиях, их производящих или использующих в производстве. В случае аварии может произойти поражение людей не только непосредственно на объекте, но и за его пределами, в ближайших населенных пунктах.
Крупными запасами опасных веществ располагают предприятия химической, целлюлозно-бумажной, оборонной, нефтеперерабатывающей и нефтехимической промышленности, черной и цветной металлургии, промышленности минудобрений.
Значительные их количества сосредоточены на объектах пищевой, мясо-молочной промышленности, холодильниках, торговых базах, различных АО, в жилищно-коммунальном хозяйстве.
Наиболее распространенными из них являются хлор, аммиак, сероводород, двуокись серы (сернистый газ), нитрил акриловой кислоты, синильная кислота, фосген, метилмеркаптан, бензол, бромистый водород, фтор, фтористый водород.
Хлор
При нормальных условиях газ желто-зеленого цвета с резким раздражающим специфическим запахом. При обычном давлении затвердевает при -101 °С и сжижается при -34° С. Тяжелее воздуха примерно в 2,5 раза. Вследствие этого стелется по земле, скапливается в низинах, подвалах, колодцах, тоннелях.
Ежегодное потребление хлора в мире достигает 40 млн. т.
Используется он в производстве хлорорганических соединений (винил хлорида, хлоропренового каучука, дихлорэтана, хлорбензола и др.). В большинстве случаев применяется для отбеливания тканей и бумажной массы, обеззараживания питьевой воды, как дезинфицирующее средство и в различных других отраслях промышленности.
Хранят и перевозят его в стальных баллонах и железнодорожных цистернах под давлением. При выходе в атмосферу дымит, заражает водоемы.
В первую мировую войну применялся в качестве отравляющего вещества удушающего действия. Поражает легкие, раздражает слизистые и кожу.
Первые признаки отравления — резкая загрудинная боль, резь в глазах, слезоотделение, сухой кашель, рвота, нарушение координации, одышка. Соприкосновение с парами хлора вызывает ожоги слизистой оболочки дыхательных путей, глаз, кожи.
Воздействие в течение 30 — 60 мин при концентрации 100 — 200 мг/м3 опасно для жизни.
Если все-таки произошло поражение хлором, пострадавшего немедленно выносят на свежий воздух, тепло укрывают и дают дышать парами спирта или воды.
При интенсивной утечке хлора используют распыленный раствор кальцинированной соды или воду, чтобы осадить газ. Место разлива заливают аммиачной водой, известковым молоком, раствором кальцинированной соды или каустика с концентрацией 60 —80% и более (примерный расход — 2л раствора на 1 кг хлора).
Аммиак
При нормальных условиях бесцветный газ с характерным резким запахом («нашатырного спирта»), почти в два раза легче воздуха. При выходе в атмосферу дымит. При обычном давлении затвердевает при температуре -78°С и сжижается при -34°С. С воздухом образует взрывоопасные смеси в пределах 15 — 28 объемных процентов.
Растворимость его в воде больше, чем у всех других газов: один объем воды поглощает при 20°С около 700 объемов аммиака, 10%-й раствор аммиака поступает в продажу под названием «нашатырный спирт». Он находит применение в медицине и в домашнем хозяйстве (при стирке белья, выведении пятен и т.д.). 18-20%-й раствор называется аммиачной водой и используется как удобрение.
Жидкий аммиак — хороший растворитель большинства органических и неорганических соединений.
Мировое производство аммиака ежегодно составляет около 90 млн.т. Его используют при получении азотной кислоты, азотосодержащих солей, соды, мочевины, синильной кислоты, удобрений, диазотипных светокопировальных материалов.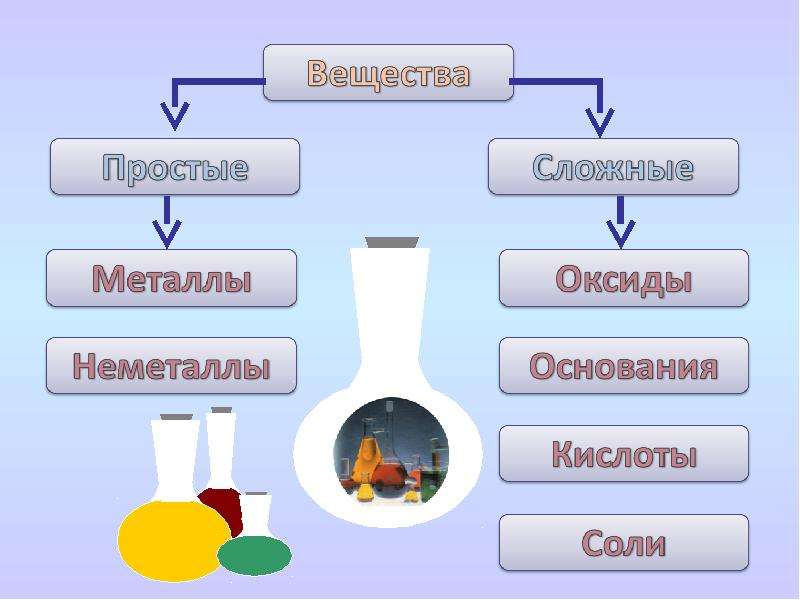 Жидкий аммиак широко применяется в качестве рабочего вещества (хладагента) в холодильных машинах и установках.
Жидкий аммиак широко применяется в качестве рабочего вещества (хладагента) в холодильных машинах и установках.
Перевозится в сжиженном состоянии под давлением. Предельно допустимые концентрации (ПДК) в воздухе населенных мест: среднесуточная и максимально разовая — 0,2 мг/м3, в рабочем помещении промышленного предприятия — 20 мг/м3. Если же его содержание в воздухе достигает 500 мг/м3, он опасен для вдыхания (возможен смертельный исход).
Вызывает поражение дыхательных путей. Признаки: насморк, кашель, затрудненное дыхание, удушье, учащается сердцебиение, нарастает частота пульса. Пары сильно раздражают слизистые оболочки и кожные покровы, вызывают жжение, покраснение и зуд кожи, резь в глазах, слезотечение. При соприкосновении жидкого аммиака и его растворов с кожей возникает обморожение, жжение, возможен ожог с пузырями, изъязвления.
Если поражение аммиаком все же произошло, следует немедленно вынести пострадавшего на свежий воздух. Транспортировать надо в лежачем положении. Необходимо обеспечить тепло и покой, дать увлажненный кислород. При отеке легких искусственное дыхание делать нельзя.
Транспортировать надо в лежачем положении. Необходимо обеспечить тепло и покой, дать увлажненный кислород. При отеке легких искусственное дыхание делать нельзя.
В случае аварии необходимо опасную зону изолировать, удалить людей и не допускать никого без средств защиты органов дыхания и кожи. Около зоны следует находиться с наветренной стороны. Место разлива нейтрализуют слабым раствором кислоты, промывают большим количеством воды. Если произошла утечка газообразного аммиака, то с помощью поливомоечных машин, авторазливочных станций, пожарных машин распыляют воду, чтобы поглотить пары.
Зоны заражения АХОВ
В большинстве случаев при аварии и разрушении емкости давление над жидкими веществами падает до атмосферного, АХОВ вскипает и выделяется в атмосферу в виде газа, пара или аэрозоля. Облако газа (пара, аэрозоля) АХОВ, образовавшееся в момент разрушения емкости в пределах первых 3 минут, называется первичным облаком зараженного воздуха. Оно распространяется на большие расстояния. Оставшаяся часть жидкости (особенно с температурой кипения выше 20°С) растекается по поверхности и также постепенно испаряется. Пары (газы) поступают в атмосферу, образуя вторичное облако зараженного воздуха, которое распространяется на меньшее расстояние.
Оставшаяся часть жидкости (особенно с температурой кипения выше 20°С) растекается по поверхности и также постепенно испаряется. Пары (газы) поступают в атмосферу, образуя вторичное облако зараженного воздуха, которое распространяется на меньшее расстояние.
Таким образом, зона заражения АХОВ — это территория, зараженная ядовитыми веществами в опасных для жизни людей пределах (концентрациях).
Глубина зоны распространения зараженного воздуха зависит от концентрации АХОВ и скорости ветра. Например, при ветре 1 м/с за один час облако от места аварии удалится на 5 — 7 км, при 2 м/с — на 10 — 14, а при З м/с — на 16 — 21 км. Значительное увеличение скорости ветра (6-7 м/с и более) способствует его быстрому рассеиванию. Повышение температуры почвы и воздуха ускоряет испарение АХОВ, а следовательно, увеличивает концентрацию его над зараженной территорией. На глубину распространения АХОВ и величину его концентрации в значительной степени влияют вертикальные перемещения воздуха, как мы говорим, погодные условия.
Форма (вид) зоны заражения АХОВ в значительной мере зависит от скорости ветра. Так, например, при скорости менее 0,5 м/с она принимается за окружность, при скорости от 0,6 до 1 м/с — за полуокружность, при скорости от 1,1 м/с до 2 м/ с — за сектор с углом в 90°, при скорости более 2м/с — за сектор с углом в 45°.
Надо иметь в виду, что здания и сооружения городской застройки нагреваются солнечными лучами быстрее, чем расположенные в сельской местности. Поэтому в городе наблюдается интенсивное движение воздуха, связанное обычно с его притоком от периферии к центру по магистральным улицам. Это способствует проникновению АХОВ во дворы, тупики, подвальные помещения и создает повышенную опасность поражения населения. В целом можно считать, что стойкость АХОВ в городе выше, чем на открытой местности.
Вот почему все население, проживающее вблизи химически опасного объекта, должно знать, какие АХОВ используются на этом предприятии, какие ПДК установлены для рабочей зоны производственных помещений и для населенных пунктов, какие меры безопасности требуют неукоснительного соблюдения, какие средства и способы защиты надо использовать в различных аварийных ситуациях.
Защита от АХОВ
Защитой от АХОВ служат фильтрующие промышленные и гражданские противогазы, промышленные респираторы, изолирующие противогазы, убежища ГО.
Промышленные противогазы надежно предохраняют органы дыхания, глаза и лицо от поражения. Однако их используют только там, где в воздухе содержится не менее 18% кислорода, а суммарная объемная доля паро- и газообразных вредных примесей не превышает 0,5%.
Недопустимо применять промышленные противогазы для защиты от низкокипящих, плохо сорбирующихся органических веществ (метан, ацетилен, этилен и др.)
Если состав газов и паров неизвестен или их концентрация выше максимально допустимой, применяется только изолирующие противогазы ИП-4 и ИП-5.
Коробки промышленных противогазов строго специализированы по назначению (по составу поглотителей) и отличаются окраской и маркировкой. Некоторые из них изготавливаются с аэрозольными фильтрами, другие без них. Белая вертикальная полоса на коробке означает, что она оснащена фильтром.
Белая вертикальная полоса на коробке означает, что она оснащена фильтром.
Рассмотрим несколько примеров по основным АХОВ. Для защиты от хлора можно использовать промышленные противогазы марок А (коробка коричневого цвета), БКФ (защитного), В (желтого), Г (половина черная, половина желтая), а также гражданские противогазы ГП-5, ГП-7 и детские.
А если их нет? Тогда ватно-марлевую повязку, смоченную водой, а лучше 2%-м раствором питьевой соды.
От аммиака защищает противогаз с другой коробкой, марки КД (серого цвета) и промышленные респираторы РПГ-67КД, РУ-60МКД.
У них две сменных коробки (слева и справа). Они имеют ту же маркировку, что и противогазы. Надо помнить, что гражданские противогазы от аммиака не защищают. В крайнем случае надо воспользоваться ватно-марлевой повязкой, смоченной водой или 5%-м раствором лимонной кислоты.
Для защиты от АХОВ в очаге аварии используются в основном средства индивидуальной защиты кожи (СИЗК) изолирующего типа, общевойсковой защитный комплект ОЗК.
Для населения рекомендуются подручные средства защиты кожи в комплекте с противогазами. Это могут быть обычные непромокаемые накидки и плащи, а также пальто из плотного толстого материала, ватные куртки. Для ног — резиновые сапоги, боты, калоши. Для рук — все виды резиновых и кожаных перчаток и рукавицы.
В случае аварии с выбросом АХОВ убежища обеспечивают надежную защиту. Во-первых, если неизвестен вид вещества или его концентрация слишком велика, можно перейти на полную изоляцию (третий режим), можно также какое-то время находиться в помещении с постоянным объемом воздуха. Во-вторых, фильтропоглотители защитных сооружений препятствуют проникновению хлора, фосгена, сероводорода и многих других ядовитых веществ, обеспечивая безопасное пребывание людей.
В крайнем случае при распространении газов, которые тяжелее воздуха и стелются по земле, как хлор и сероводород, можно спасаться на верхних этажах зданий, плотно закрыв все щели в дверях, окнах, задраив вентиляционные отверстия.
Выходить из зоны заражения нужно в одну из сторон, перпендикулярную направлению ветра, ориентируясь на показания флюгера, развевание флага или любого другого куска материи, наклон деревьев на открытой местности.
Первая помощь пораженным АХОВ
Она складывается из двух частей. Первая — обязательная для всех случаев поражения, вторая — специфическая, зависящая от характера воздействия вредных веществ на организм человека.
Итак, общие требования. Надо как можно скорее прекратить воздействия АХОВ. Для этого необходимо надеть на пострадавшего противогаз и вынести его на свежий воздух, обеспечить полный покой и создать тепло. Расстегнуть ворот, ослабить поясной ремень. При возможности снять верхнюю одежду, которая может быть заражена парами хлора, сероводорода, фосгена или другого вещества.
Специфические. Например, при поражении хлором, чтобы смягчить раздражение дыхательных путей, следует дать вдыхать аэрозоль 0,5%-го раствора питьевой соды. Полезно также вдыхать кислород. Кожу и слизистые промывать 2%-м содовым раствором не менее 15 мин. Из-за удушающего действия хлора пострадавшему передвигаться самостоятельно нельзя. Транспортируют его только в лежачем положении. Если человек перестал дышать, надо немедленно сделать искусственное дыхание методом «изо рта в рот».
Полезно также вдыхать кислород. Кожу и слизистые промывать 2%-м содовым раствором не менее 15 мин. Из-за удушающего действия хлора пострадавшему передвигаться самостоятельно нельзя. Транспортируют его только в лежачем положении. Если человек перестал дышать, надо немедленно сделать искусственное дыхание методом «изо рта в рот».
При поражении аммиаком пострадавшему следует дышать теплыми водяными парами 10%-го раствора ментола в хлороформе, дать теплое молоко с боржоми или содой. При удушье необходим кислород, при спазме голосовой щели — тепло на область шеи, теплые водяные ингаляции. Если произошел отек легких, искусственное дыхание делать нельзя. Слизистые и глаза промывать не менее 15 мин водой или 2%-м раствором борной кислоты. В глаза закапать 2-3 капли 30%-го раствора альбуцида, в нос — теплое оливковое, персиковое или вазелиновое масло. При поражении кожи обливают чистой водой, накладывают примочки из 5%-го раствора уксусной, лимонной или соляной кислоты.
youtube.com/embed/wFU4BpqtQvo» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>
Сколько химий на свете?
Н. Е. Аблесимов,
доктор химических наук
«Химия и жизнь» №5, 6, 2009
Химию можно определить как предмет занятий химиков.
Т. Л. Браун, Г. Ю. Лемей
В начале было слово — «ал хеми», или алхимия. Оно восходит к египетскому иероглифу «хми», означавшем черную (плодородную) землю. Этим же иероглифом обозначался и сам Египет, место, где, возможно, возникла алхимия, которую часто называли «египетским искусством». Впервые термин встречается в рукописи Юлия Фирмика (IV век н.э.). Ю. Либих писал про алхимию, что она «никогда не была ничем иным, как химией».
Следующим словом стало «ятрохимия» — направление в естествознании и медицине, появившееся в XVI веке. Оно отводило основную роль в возникновении болезней нарушениям химических процессов в организме и ставило задачу отыскания химических средств их лечения. Зарождение и развитие ятрохимии, получившей наибольшее распространение в Германии и Нидерландах, связано с деятельностью Парацельса (1493–1541), а также врача и анатома Ф. Боэ (1614–1672), сформулировавшего основные ее положения и открывшего при Лейденском университете первую химическую лабораторию для анализов. Представители ятрохимии уделяли внимание изучению процессов пищеварения, а также половых и других желез; различали «кислотные» и «щелочные» болезни. Ятрохимия во второй половине XVIII века перестала существовать как направление в медицине, но дала начало экспериментальной химии.
Зарождение и развитие ятрохимии, получившей наибольшее распространение в Германии и Нидерландах, связано с деятельностью Парацельса (1493–1541), а также врача и анатома Ф. Боэ (1614–1672), сформулировавшего основные ее положения и открывшего при Лейденском университете первую химическую лабораторию для анализов. Представители ятрохимии уделяли внимание изучению процессов пищеварения, а также половых и других желез; различали «кислотные» и «щелочные» болезни. Ятрохимия во второй половине XVIII века перестала существовать как направление в медицине, но дала начало экспериментальной химии.
Большинство химиков XVI–XVIII веков имели медицинское образование и служили аптекарями. Далее, поскольку синтетической химии еще не существовало, вещества для лекарств добывали в естественном состоянии из минералов и растений, а для этого требовались методы анализа, разделения и очистки веществ. Развивается аналитическая химия. Затем военные интересы и запросы потребителей вызвали к жизни остальные разделы химии.
Сейчас химия состоит из пяти крупных разделов. Это аналитическая химия, неорганическая химия, органическая химия, биохимия, физическая химия и техническая химия. А далее они делятся, образуя сотню различных химий. Такое разнообразие заставляет задуматься над тем, что пришло время химии складывать, а не делить.
Академик Ю. А. Косыгин писал: «К концу XX века наука как бы разделилась на слои… Специалист часто замыкался в своем слое, увлекаясь в его пределах деталями… Это создавало узость научного мышления, забвение целостности мира, проблемы которого могут решаться только совместной работой в разных специальностях или их взаимопроникновением. Разделение на специальности создает атмосферу затхлости и беспомощности».
Таким образом, первая задача статьи состоит в показе абсурда такого деления применительно к химии. Разделы взяты из химических энциклопедий, обзоров, web-страниц вузов и НИИ, названий учебников и журналов. Вторая задача — ознакомление неофитов с многообразием химических решений житейских задач. И третья задача. Автору как профессионалу неприятно слышать на всех углах: «выращено без химии», «продукт не содержит химических веществ» и прочие странные лозунги. Куда же вы денетесь без химии!
И третья задача. Автору как профессионалу неприятно слышать на всех углах: «выращено без химии», «продукт не содержит химических веществ» и прочие странные лозунги. Куда же вы денетесь без химии!
Аналитическая химия — разработка методов определения химического состава вещества. Она возникла раньше других химических наук, и до конца XVIII века химию определяли как науку, изучающую химический состав веществ. Исторически это первая научная собственно химия.
Агрохимия — наука о химических процессах в почве и растениях, минеральном питании растений, применении удобрений и средств химической мелиорации почв. Включает определение содержания в почвах и растениях химических элементов, белков, аминокислот, витаминов, жиров, углеводов; установление механического и минералогического состава почв, содержания в них органической части (гумуса), солей, водорослей, микроорганизмов и др. Изучает влияние удобрений на растения и почву. Многие приемы агрохимии вошли в практику земледелия с глубокой древности. Благодаря созданию s новой отрасли агрохимии — химии ядохимикатов — появилась возможность не только улучшать питание растений, но и влиять (с помощью регуляторов роста) на их развитие, а также защищать от болезней, насекомых, клещей, нематод и других вредителей. Огромное влияние на агрохимию оказало открытие избирательных гербицидов. Уничтожение сорняков с их помощью позволило улучшить условия роста растений и более эффективно использовать удобрения, так как они не расходуются на подкормку сорняков.
Благодаря созданию s новой отрасли агрохимии — химии ядохимикатов — появилась возможность не только улучшать питание растений, но и влиять (с помощью регуляторов роста) на их развитие, а также защищать от болезней, насекомых, клещей, нематод и других вредителей. Огромное влияние на агрохимию оказало открытие избирательных гербицидов. Уничтожение сорняков с их помощью позволило улучшить условия роста растений и более эффективно использовать удобрения, так как они не расходуются на подкормку сорняков.
Аналитическая химия элементов. Институт геохимии и аналитической химии РАН (ГЕОХИ, Москва) издает серию монографий, которых уже сейчас насчитывается свыше 50, а в идеале должно быть 109 — по числу известных химических элементов.
Астрохимия изучает химические реакции между атомами, молекулами и зернами пыли в межзвездной среде, включая фазы образования звезд и планет. Синтез гелия можно считать началом всех реакций в природе, первопричиной жизни, света, тепла и метеорологических явлений на Земле. Рождение химических элементов — функция звезд. До железа включительно они рождаются в термоядерных процессах синтеза ядер в недрах бесчисленных солнц. Начиная с кобальта и далее – создаются при взрывах сверхновых через нейтроноизбыточные ядра с последующей серией бета-распадов. Радиоастрономы показали, что темные межзвездные облака содержат многие сложные молекулы (метанол, окись углерода, формальдегид, этанол, синильную кислоту, муравьиную кислоту и другие). Молекулярная радиоастрономия позволила идентифицировать все эти молекулы по их вращательным спектрам в микроволновой области.
Рождение химических элементов — функция звезд. До железа включительно они рождаются в термоядерных процессах синтеза ядер в недрах бесчисленных солнц. Начиная с кобальта и далее – создаются при взрывах сверхновых через нейтроноизбыточные ядра с последующей серией бета-распадов. Радиоастрономы показали, что темные межзвездные облака содержат многие сложные молекулы (метанол, окись углерода, формальдегид, этанол, синильную кислоту, муравьиную кислоту и другие). Молекулярная радиоастрономия позволила идентифицировать все эти молекулы по их вращательным спектрам в микроволновой области.
Бионеорганическая химия изучает комплексы биополимеров или низкомолекулярных природных веществ с ионами металлов, присутствующих в живых организмах (Na+, K+, Ca2+, Mg2+, Fe2+). Исследует роль этих ионов в выполнении биологических функций ферментов. Практическое применение связано с синтезом металлосодержащих лекарственных препаратов.
Биоорганическая химия изучает связь между строением органических веществ и их биологическими функциями. Объекты исследований: биополимеры, витамины, гормоны, антибиотики и другие. Сформировалась на стыке биохимии и органической химии. Биоорганическая химия связана с практическими задачами медицины, сельского хозяйства, химической, пищевой и микробиологической промышленности.
Объекты исследований: биополимеры, витамины, гормоны, антибиотики и другие. Сформировалась на стыке биохимии и органической химии. Биоорганическая химия связана с практическими задачами медицины, сельского хозяйства, химической, пищевой и микробиологической промышленности.
Биохимия изучает входящие в состав организмов химические вещества, их структуру, распределение, превращения и функции. Казалось бы, эта наука должна быть разделом органической химии, однако многочисленные разветвления биохимии превратили ее в отдельное направление. Первый синтез природного вещества мочевины в 1828 году разрушил представление о «жизненной силе», участвующей в образовании веществ организмом. Внедрение в биологию идей и методов физики и химии, а равно стремление объяснить строением и свойствами биополимеров такие биологические явления, как наследственность, изменчивость или мышечное сокращение, привело в середине XX века к выделению из биохимии молекулярной биологии. Потребности народного хозяйства в получении, хранении и обработке различных видов сырья привели к развитию технической биохимии. В конце XX и начале XXI века биохимия стала ведущим химическим направлением, во всяком случае, большинство Нобелевских премий по химии присуждают именно за биохимические работы.
В конце XX и начале XXI века биохимия стала ведущим химическим направлением, во всяком случае, большинство Нобелевских премий по химии присуждают именно за биохимические работы.
Галургия — раздел химической технологии по производству минеральных солей. К галургии в узком смысле относят переработку природных солей. Сырьем для галургического производства служат морская вода, отложения морских солей, а также озерные и подземные рассолы. Прикладные задачи — проектирование калийных, соляных и сульфатных предприятий; проектирование предприятий по добыче и переработке горно-химического сырья: сульфата натрия, фосфоритного, магнийсодержащего сырья и других природных солей.
Геохимия изучает химический состав Земли, распространенность в ней химических элементов и их стабильных изотопов, закономерности распределения химических элементов в различных геосферах, законы поведения, сочетания и миграции элементов в природных процессах. Геохимия исторически сформировалась как химия элементов в геосферах и во многом продолжает оставаться таковой.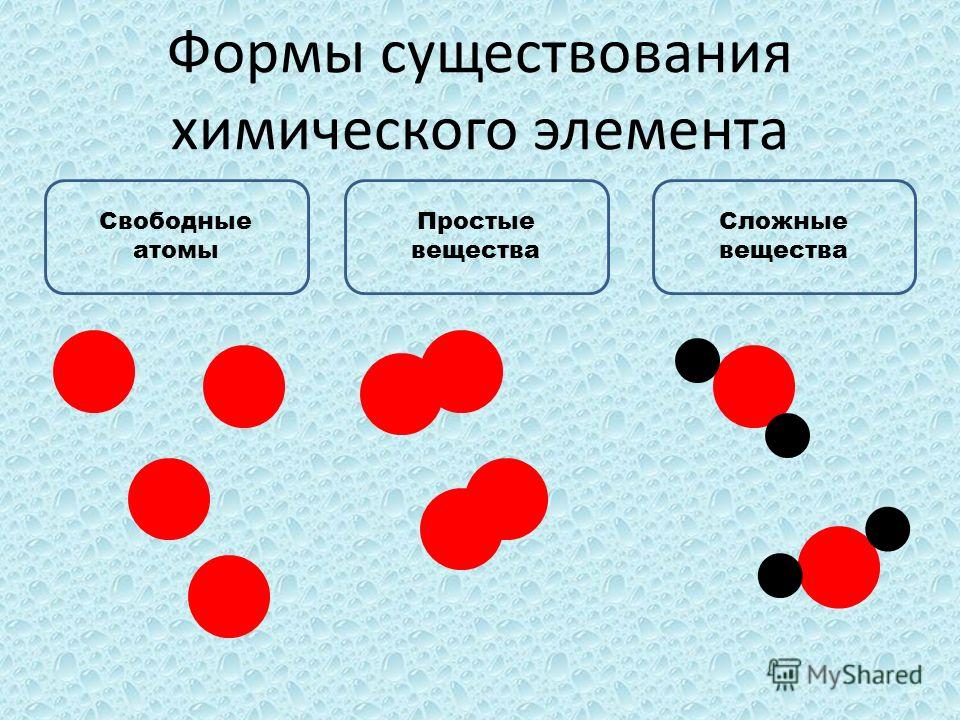 Это было оправданно во времена Ферсмана и Вернадского. Но свойства веществ – это свойства фаз. Один и тот же элемент может находиться в составе различных фаз и сам образовывать множество фаз с очень разными свойствами (вспомним хотя бы фазы углерода). В XX веке появились методы анализа фаз. Поэтому дальнейшее развитие геохимии — это химия фаз в геосферах. Валовой элементный анализ геологических проб должен подкрепляться фазовым анализом. Иначе наблюдается ничем сейчас не оправданный перескок через структурный уровень организации вещества: от химического элемента, минуя минеральную фазу, к породе и геологическому телу.
Это было оправданно во времена Ферсмана и Вернадского. Но свойства веществ – это свойства фаз. Один и тот же элемент может находиться в составе различных фаз и сам образовывать множество фаз с очень разными свойствами (вспомним хотя бы фазы углерода). В XX веке появились методы анализа фаз. Поэтому дальнейшее развитие геохимии — это химия фаз в геосферах. Валовой элементный анализ геологических проб должен подкрепляться фазовым анализом. Иначе наблюдается ничем сейчас не оправданный перескок через структурный уровень организации вещества: от химического элемента, минуя минеральную фазу, к породе и геологическому телу.
Гидрохимия изучает химический состав природных вод и закономерности его изменения под влиянием физических, химических и биологических воздействий. Задача — установление химического состава основных элементов экосистем океанов и морей, процессов их биогеохимической трансформации и эволюции.
Гистохимия — раздел гистологии, изучающий локализацию различных химических веществ и продуктов их метаболизма в тканях. Некоторые методы окрашивания позволяют выявлять в клетках те или иные химические вещества. Возможно дифференциальное окрашивание жиров, гликогена, нуклеиновых кислот, нуклеопротеинов, некоторых ферментов и других химических компонентов клетки. Вклад гистохимии в изучение химического состава тканей постоянно возрастает. Подобраны красители, флуорохромы и ферменты, которые можно присоединить к специфическим иммуноглобулинам (антителам) и, наблюдая связывание этого комплекса в клетке, идентифицировать клеточные структуры. Эта область исследований составляет предмет иммуногистохимии. Использование иммунологических маркеров в световой и электронной микроскопии способствует расширению знаний о биологии клетки, а также повышению точности медицинских диагнозов.
Иммунохимия изучает химические основы иммунитета. Основные проблемы: строение и свойств иммунных белков — антител, природных и синтетических антигенов, а также выявление закономерностей взаимодействия между этими главными компонентами иммунологических реакций у разных организмов. Методами иммунохимии пользуются также в прикладных целях, в частности при выделении и очистке активных начал вакцин и сывороток.
Квантовая химия. Это направление химии на основе квантовой механики рассматривает строение и свойства химических соединений, реакционную способность, кинетику и механизмы химических реакций. Из-за сложности объектов применяют приближенные методы расчета. С квантовой химией неразрывно связана компьютерная химия — дисциплина использующая математические методы для расчета молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, моделирование молекулярного поведения.
Коллоидная химия — наука о дисперсных системах и поверхностных явлениях. Отсюда берет начало популярная нынче нанотехнология. Коллоидные системы – это и человек и холодец. Поскольку у частиц дисперсной фазы и окружающей их среды большая поверхность раздела, поверхностные явления оказывают определяющее влияние на свойства системы в целом. Цель исследований – управление образованием, свойствами и разрушением дисперсных систем и граничных слоев за счет регулирования межмолекулярных взаимодействий на границах раздела фаз. Этого добиваются с помощью поверхностно-активных веществ, способных самопроизвольно концентрироваться на поверхности частиц дисперсной фазы.
Компьютерная химия — см. квантовая химия.
Косметическая химия. Ее предмет – средства и методы улучшения внешности человека. Различают врачебную и декоративную косметику. Известно выражение «кожа — это самый большой орган», и нельзя не задумываться о том, как он функционирует, как действуют вещества, которые мы наносим на его поверхность, к каким последствиям приведет то или иное воздействие. Ответы на эти вопросы ищет косметическая химия.
Космохимия — наука о химическом составе космических тел, законах распространенности и распределения химических элементов во Вселенной, процессах сочетания и миграции атомов при образовании космического вещества. Космохимия исследует преимущественно «холодные» процессы на уровне атомно-молекулярных взаимодействий веществ, в то время как «горячими» ядерными процессами в космосе – плазменным состоянием вещества, нуклеогенезом (процессом образования химических элементов) внутри звезд — занимается физика. Развитие космонавтики открыло перед космохимией новые возможности. Это непосредственное исследование пород Луны при участии космонавтов или в результате забора образцов грунта автоматическими аппаратами и доставки их на Землю. Автоматические спускаемые аппараты сделали возможным изучение вещества и условий его существования в атмосфере и на поверхности других планет Солнечной системы и астероидов, в кометах. Благодаря экстремальным условиям в космическом пространстве протекают процессы и встречаются состояния вещества, несвойственные Земле. В межзвездном пространстве обнаруживаются в крайне малых концентрациях атомы и молекулы многих элементов, а также минералы (кварц, силикаты, графит и другие) и, наконец, идет синтез различных сложных органических соединений из первичных солнечных газов H, CO, NH3, O2, N2, S и других простых соединений в равновесных условиях при участии излучений.
Криохимия изучает химические превращения веществ при низких температурах. Основные задачи — получение соединений, химически неустойчивых при нормальных условиях, выяснение нижних температурных границ химической активности веществ, разработка технологических процессов с использованием низких температур. Продукты криотехнологий — химические реактивы, ферменты, сорбенты, лекарственные вещества, резисторы, композиты, пигменты, катализаторы, электродные и пьезоматериалы, пористая керамика, порошки для стекловарения и выращивания монокристаллов.
Кристаллохимия изучает законы расположения атомов и типы симметрии в кристаллических телах, а также дефекты в их структуре. Центральное понятие кристаллохимии — кристаллическая структура. Определено свыше 120 000 кристаллических структур (около 40 000 неорганических, более 80 000 органических) — от простых веществ до белков и вирусов. Источником данных о структурах служат дифракционные методы исследования: рентгеноструктурный анализ, электронография, нейтронография, мессбауэрография. Причины образования той или иной кристаллической структуры определяются общим принципом термодинамики: наиболее устойчива структура, которая при данных давлении и температуре имеет минимальную свободную энергию. Обнаруженные Е. С. Федоровым 230 пространственных групп симметрии представляют собой естественный закон природы, не имеющий математического выражения (наряду с Периодической системой Д. И. Менделеева).
Лазерная химия изучает химические процессы, стимулируемые лазерным излучением. Высокая монохроматичность лазерного излучения позволяет селективно возбуждать молекулы одного вида, причем молекулы других видов остаются невозбужденными. Возможность фокусировки лазерного излучения позволяет вводить энергию локально, в определенную область объема, занимаемого реагирующей смесью. Лазерное воздействие на химические реакции может быть тепловым и фотохимическим. Лазерная офтальмология и микрохирургия — в конечном счете та же лазерная химия, но на службе у медицины.
Лесохимия изучает химические свойства древесины и способы ее промышленной переработки, чтобы извлечь как можно больше полезных веществ. Целлюлозно-бумажное производство занимает первое место по объемам перерабатываемого сырья и готовой продукции в лесной промышленности. Оно потребляет балансовую и дровяную древесину (80%), отходы лесозаготовок и деревообработки (щепа, опилки — 20%) для выработки целлюлозы, древесной массы и получения из них бумаги, картона. Нитрованием целлюлозы концентрированной азотной кислотой в присутствии концентрированной серной кислоты получают тринитроцеллюлозу, называемую пироксилином, которую применяют в производстве бездымного пороха, поэтому рядом с целлюлозно-бумажным комбинатом следует искать завод боеприпасов. Гидролизные производства в качестве сырья используют отходы лесопиления и деревообработки. Первоначально гидролизу подвергали хвойную древесину, получая 160–180 л этанола в расчете на 1 т абсолютно сухого сырья (в дальнейшем стали производить также дополнительно 35–40 кг кормовых дрожжей из послеспиртовой барды). Затем появились предприятия фурфурольно-дрожжевого профиля (70–80 кг фурфурола и 100 кг дрожжей в расчете на 1 т сухих растительных отходов) и чисто дрожжевого профиля. Отходы этого производства – гидролизный лигнин (30–40% в расчете на абсолютно сухое сырье), который применяют как котельное топливо, а также для получения углей различного назначения, удобрений, уксусной и щавелевой кислот, фенолов, наполнителей для полимерных материалов. Однако чаще всего этот лигнин остается в виде никому не нужных отвалов. Существует и дубильно-экстрактовое производство — источник дубящих веществ. Для их выработки применяют кору ивы, ели, лиственницы, листья бадана, древесину дуба или каштана. Из смолы получают также канифоль. Еще одно направление — пиролизное производство, получение древесного угля из древесины нагреванием ее без доступа воздуха в специальных стальных ретортах и печах.
Магнетохимия изучает связь магнитных и химических свойств веществ, влияние магнитных полей на химические процессы. Спиновая химия как раздел магнетохимии уникальна: она вводит в химию магнитные взаимодействия. Будучи пренебрежимо малыми по энергии, магнитные взаимодействия контролируют химическую реакционную способность и пишут новый, магнитный «сценарий» реакции. Получение молекулярных магнетиков, многоспиновых молекул, содержащих неспаренные электроны, спиновых меток тоже можно отнести к спиновой химии.
Медицинская химия включает в себя аспекты биологии, медицины, фармацевтики. Она занимается обнаружением, дизайном, идентификацией и получением биологически активных соединений, изучением их метаболизма, интерпретацией способа действия на молекулярном уровне и созданием зависимостей «структура – активность». Таким образом, начав с медицины в XVI веке, химия в нее возвращается, несмотря на некоторый скептицизм медиков. Достаточно сказать, что 70% лекарственных препаратов — продукты синтетической химии, а остальные 30% — фитохимии.
Металлургия — область науки и техники, охватывающая процессы получения металлов из руд или других веществ, изменения химического состава, структуры и свойств металлических сплавов. Металлургические процессы применяют и для производства неметаллических материалов, в том числе полупроводников. Различают пирометаллургию (использование процессов, проходящих при высокой температуре), гидрометаллургию (извлечение металлов химическими реакциями в водных растворах) и электрометаллургию (применение электролиза).
Механохимия изучает химические превращения веществ при деформировании, трении, ударном сжатии. Пластическая деформация твердого тела обычно приводит к накоплению в нем дефектов, изменяющих физико-химические свойства, в том числе реакционную способность. Это используют в химии для ускорения реакций, снижения температуры процессов и других путей интенсификации химических реакций в твердой фазе. Механохимическим методом проводят деструкцию полимеров, синтез интерметаллидов и ферритов, получают аморфные сплавы, активируют порошковые материалы.
Нанохимия – химия и технология объектов, размеры которых порядка 10–9 м (кластеры атомов, макромолекулы). Когда речь идет о развитии нанотехнологий, имеют в виду три направления: изготовление электронных схем (в том числе и объемных), элементы которых по размерам сравнимы с атомами; разработка и изготовление наномашин; манипуляция отдельными атомами и молекулами и сборка из них макрообъектов. Место нанохимии в нанотехнологиях – синтез нанодисперсных веществ и материалов, регулирование химических превращений тел нанометрового размера, предотвращение химической деградации наноструктур, способы лечения болезней с использованием наночастиц.
Нейрохимия — раздел биохимии, изучающий химические и клеточные механизмы деятельности нервной системы. Нейрохимия подразделяется на общую, изучающую химические свойства нервной системы вне связи с конкретной физиологической деятельностью, и функциональную (частную), изучающую химические и молекулярные механизмы деятельности нервной системы в процессе реализации той или иной физиологической функции. Познание химических механизмов деятельности мозга не просто одна из задач биологии, оно играет важную роль в стремлении человека к осознанию самого себя как личности, к пониманию своего места на Земле. Поэтому нейрохимия — одна из самых сложных, современных и бурно развивающихся областей биохимии и нейробиологии. Она тесно связана с такими направлениями биологии, как морфология и физиология нервной системы, молекулярная биология и генетика, а также с клиническими дисциплинами, в частности с нейропатологией и психиатрией.
Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений углерода). Обеспечивает создание материалов новейшей техники. Число неорганических веществ приближается к 400 тысячам.
Органическая химия изучает соединения углерода с другими элементами — так называемые органические соединения и законы их превращений. К концу XX века их число превысило 10 млн. Синтез многочисленных органических веществ привел к созданию новых отраслей промышленности — синтетических красителей, полимеров, искусственного жидкого топлива и пищи. Удалось синтезировать витамины, гормоны, ферменты. Многообразие органических соединений во многом обусловлено изомерией – способностью соединений при одинаковом составе и массе различаться строением, физическими и химическими свойствами. Органическая химия делится на огромное число направлений.
Нефтехимия изучает состав, свойства и химические превращения компонентов нефти и природного газа, а также процессы их переработки.
Органическая геохимия изучает химический и изотопный состав органических веществ, заключенных в горных породах, их эволюцию в ходе геологической истории, закономерности распределения, а также роль органического вещества в процессах миграции химических элементов в земной коре, формировании месторождений урана, меди, ванадия, германия, молибдена. Этот раздел химии изучает исходные для органического вещества биохимические соединения (углеводы, белки, лигнин) и продукты их преобразования во внешних геосферах (гумус, сапропель, ископаемые угли, горючие сланцы, нефть) под влиянием бактериальной жизни, температуры, давления и других факторов. Геохимия нефти и угля разделилась на два самостоятельных научных направления. Органическая геохимия близко соприкасается с органической космохимией в части исследования органического вещества космических тел.
Органический синтез изучает пути и методы искусственного создания органических соединений. В 1828 году Ф. Вёлер впервые синтезировал органическое вещество из неорганического вне живого организма – провел перегруппировку цианата аммония в мочевину при нагревании в водном растворе. Цели оргсинтеза – получение веществ с ценными физическими, химическими и биологическими свойствами или проверка предсказаний теории. Современный органический синтез многогранен и позволяет получать практически любые органические молекулы.
Патохимия изучает химические механизмы патологических процессов. Например, проблема отторжения органов при пересадке — во многом проблема патохимии.
Петрохимия изучает распределение химических элементов в горных породах и породообразующих минералах.
Петрургия — производство стеклокристаллических материалов и изделий из расплавов горных пород (например, базальтов и диабазов) и промышленных отходов (например, шлака и золы) методом литья. Петрургические материалы предпочтительнее металлургических, так как устойчивы в окислительной атмосфере Земли и предполагают прямое использование сырья без выделения чистых компонентов. Петрургическое производство вырабатывает трубы, плиты, лотки для защиты рабочих поверхностей бункеров, желобов, узлов горно-обогатительного, металлургического и энергетического оборудования; кислотоупорные плитки и фасонные детали для химической промышленности; футеровку шаровых мельниц, облицовочные материалы и другие изделия, работающие в условиях воздействия кислот, щелочей или абразивных сыпучих материалов и пульп, а также базальтовое (каменное) волокно.
Пегниохимия. Химики тоже шутят, а что остается делать, если в лаборатории горячее и холодное стекло выглядят одинаково! Социологи провели опрос населения. Всем респондентам задавали два вопроса: 1) как вы относитесь к химическим удобрениям? 2) какая у вас в школе оценка по химии? Оказалось: 1) 90% россиян категорически против химических удобрений; 2) остальные 10% имели по химии оценку «5». Институт пегниохимии РАН, может быть, и появится, когда мы поймем единство природы и тупик бесконечного деления знания, и посмеемся над искусством разделять и не властвовать.
К области пегниохимии, несомненно, принадлежит и химический фольклор.
Крутит и вертит мешалку мотор.
В колбе трехгорлой бордовый раствор.
Варится, киснет ацетофенон.
Скоро дойдет до кондиции он.
Только я начал бензол отгонять –
Колба рванула… Кусков не собрать.
Вспыхнул бензол, загорелся халат.
Что-то заметил сосед невпопад.
Пищевая химия. Ее цель — создание качественных продуктов питания и методов анализа в химии пищевых производств. Это один из самых древних экспериментальных разделов химии со времен появления дрожжевого хлеба. Химия пищевых добавок контролирует их ввод в продукты питания для улучшения технологии производства, а также структуры и органолептические свойства продуктов, увеличение сроков хранения, повышение биологической ценности. К числу таких добавок принадлежат консерванты, антиоксиданты, окислители, эмульгаторы, стабилизаторы, красители, вкусовые вещества и ароматизаторы, интенсификаторы вкуса и запаха, витамины, микроэлементы, аминокислоты, пряности. Создание искусственной пищи — тоже предмет пищевой химии. Это продукты, которые делают из белков, аминокислот, липидов и углеводов, предварительно выделенных из природного сырья или полученных направленным синтезом из минерального сырья. Пищевые добавки, а также витамины, минеральные кислоты, микроэлементы и прочие вещества придают конечному продукту не только питательность, но и цвет, запах и нужную структуру. В качестве исходных компонентов используют вторичное сырье мясной и молочной промышленности, семена, зеленую массу растений, гидробионты, биомассу микроорганизмов, например дрожжей. Из них выделяют высокомолекулярные вещества (белки, полисахариды) и низкомолекулярные (липиды, сахара, аминокислоты и другие). Низкомолекулярные пищевые вещества получают также микробиологическим синтезом из сахарозы, уксусной кислоты, метанола, углеводородов, ферментативным синтезом из предшественников и органическим синтезом (включая асимметрический синтез для оптически активных соединений). Различают синтетическую пищу, получаемую из синтезируемых веществ, например диеты для лечебного питания, комбинированные продукты из натуральных продуктов с искусственными пищевыми добавками, такие, как колбасно-сосисочные изделия, фарш, паштеты, и аналоги пищевых продуктов, имитирующие какие-либо натуральные продукты, — скажем, черную икру.
Плазмохимия изучает химические процессы в низкотемпературной плазме. Низкотемпературной принято считать плазму с температурой 103–105 К и степенью ионизации 10–6–10–1 получаемую в электродуговых, высокочастотных и СВЧ газовых разрядах, в ударных трубах, установках адиабатического сжатия и другими способами. В плазмохимии важно разделение низкотемпературной плазмы на квазиравновесную, которая существует при давлениях порядка атмосферного и выше, и неравновесную, которая получается при давлении менее 30 кПа и в которой температура свободных электронов значительно превышает температуру молекул и ионов. Это разделение связано с тем, что кинетические закономерности квазиравновесных процессов определяются только высокой температурой взаимодействующих частиц, тогда как специфика неравновесных процессов обусловлена большим вкладом химических реакций, инициируемых «горячими» электронами. Примером плазмохимической технологии служит: синтез ацетилена из природного газа (электродуговая печь, 1600°С): 2CH4 = С2Н2 + ЗН2.
Прикладная химия. За этим нейтральным словом скрывается самая зловещая химия — химия для войны. Обслуживает в основном нужды военно-промышленного комплекса.
Радиохимия изучает поведение радиоактивных элементов, методы их выделения и концентрирования. Это научная основа получения высокоактивных материалов и регенерации ядерного горючего, разработки методов применения радионуклидов.
Радиационная химия — см. химия высоких энергий.
Сонохимия изучает химические реакции при воздействии ультразвука; это разновидность механохимии, проявляющаяся в жидкости: упругими волнами воздействуют на вещества, чтобы изменить их структуру и свойства. Главный инструмент сонохимии — кавитация, образование в жидкой среде массы пульсирующих пузырьков. Давление в них возрастает до 800 МПа, температура (по теоретическим оценкам) — до 7400 К, образуются электрические разряды, проходит ионизация, возникает явление сонолюминисценции — звук превращается в свет. Оценки показывают, что при сонолюминесценции происходит концентрация энергии в триллион раз, то есть на 12 порядков! Отсюда берет начало одна из заманчивых возможностей ультразвука в жидкости — «пузырьковый термояд».
Спиновая химия — см. магнетохимия.
Стереохимия изучает пространственное строение молекул и его влияние либо на химические свойства (статическая стереохимия), либо на скорость и направление реакций (динамическая стереохимия).
Судебная химия — часть прикладной, преимущественно аналитической химии в широком смысле слова. Это почти необъятная область по изобилию и разнообразию решаемых ею задач, ибо всякое химическое исследование, в сущности, может быть способом судебно-химической экспертизы. Она включает в себя исследование воздуха, воды, почвы, пищевых и вкусовых припасов, предметов потребления, человеческих секретов и экскретов, подозрительных кровяных и семенных пятен, различных технических препаратов, рукописных и напечатанных документов, сырых и обработанных лекарственных веществ. Но и при узком толковании, когда под судебной химией подразумевают ту часть аналитической химии, которая специально занимается открытием ядов при умышленных и неумышленных отравлениях, область судебной химии остается весьма обширной, так как само понятие «яд» представляется чрезвычайно растяжимым. Очевидна связь судебной химии не только с токсикологией и фармакологией, но и с терапией и физиологией. Для окончательного решения вопросов, возникающих при судебно-химических исследованиях о предполагаемых отравлениях, нельзя ограничиваться указаниями на присутствие или отсутствие тех или других ядов, но необходимо установить или исключить зависимость или даже причинную связь между найденным ядом и результатами, подмеченными при вскрытии трупа, выяснить — поскольку результаты могут обусловливаться изменениями, наступившими после смерти; необходимо, наконец, решить крайне важный вопрос о том, может ли обнаруженный яд или выделенное ядовитое вещество вызывать именно те симптомы, что наблюдали при жизни. Здесь врач и химик дополняют друг друга.
Супрамолекулярная химия означает химию, описывающую сложные образования, которые представляют собой результат ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами. Ее главные объекты — супрамолекулярные устройства и ансамбли. Устройства — это структурно организованные системы, молекулярные компоненты которых обладают определенными электро-, ионо-, фото-, термохимическими и другими свойствами. Клатратная химия — самая передовая часть супрамолекулярной химии.
Термохимия изучает тепловые явления, сопровождающие химические реакции. Термохимические данные (значения теплоты образования и сгорания химических соединений, тепловых эффектов реакций) используют в химической технологии, при расчетах тепловых балансов процессов. Они же служат расчетной основой химической термодинамики.
Техническая химия. Сюда можно отнести текстильную химию, химию обработки материалов, химию стекла (а это оптическая промышленность — «глаза» микроскопистов, военных и астрономов), химические аспекты экономики. Элементы технической химии можно найти в XV—XVII веках. В середине XV века была разработана технология воздуходувных горнов. Нужды военной промышленности стимулировали работы по улучшению технологии производства пороха. Выходили фундаментальные труды по производству металлов и различных материалов, используемых в строительстве, при изготовлении стекла, крашении тканей, для сохранения пищевых продуктов, выделки кож. С расширением потребления спиртных напитков совершенствовались методы перегонки, конструировались новые перегонные аппараты. Появились многочисленные производственные лаборатории, прежде всего металлургические. Среди химиков-технологов того времени можно упомянуть Ван-ноччо Бирингуччо (1480–1539), чей классический труд «О пиротехнике» был напечатан в Венеции в 1540 году и содержал десять книг. В них шла речь о рудниках, испытании минералов, приготовлении металлов, перегонке, военном искусстве и фейерверках. Другой известный трактат, «О горном деле и металлургии», написал Георг Агрикола (1494–1555).
Топохимия изучает твердофазные реакции, протекающие в определенных участках твердого тела. Путь топохимии проходит от обжига минерального сырья до молекулярно-лучевой эпитаксии (ориентированного роста одного кристалла на поверхности другого), которую активно применяют в микроэлектронике. Ориентированный рост кристалла внутри объема другого называют эндотаксией. Эндотаксия наблюдается, например, при кристаллизации, коррозии.
Углехимия изучает происхождение, состав, строение, свойства твердых горючих ископаемых, а также методы их переработки. Основная задача углехимии — разработка технологий получения из угля, продуктов его переработки и другого углеродсодержащего сырья новых углеродных материалов и адсорбентов.
Фармакохимия (фармацея) изучает приготовление лекарственных веществ, действующих на организм человека и животных. Проверка их безопасности тоже входит в число задач фармакохимии. Из 400 химических соединений, предлагаемых в качестве лекарств, после испытаний принимается только одно!
Фемтохимия — возможность наблюдать за протеканием элементарных химических реакций в фемтосекундном временном диапазоне (10–15–10–12 с). Эти времена гораздо меньше периода колебаний атомов в молекулах (10–13–10–11 с). Благодаря такому соотношению времен фемтохимия «видит» саму химическую реакцию — как перемещаются во времени и в пространстве атомы, когда молекулы-реагенты преобразуются в молекулы продуктов. Это прямой путь исследования механизмов химических реакций, а значит, и способ управления реакциями. Успехи, достигнутые при использовании фемтосекундных импульсов, привели к открытию другой науки — фемтобиологии.
Физическая химия — наука об общих законах, определяющих строение и химические превращения веществ при изменяющихся внешних условиях. Говорят, что химики работают чистыми методами с грязными веществами, физики — грязными методами с чистыми веществами, ну а физические химики — грязными методами с грязными веществами, то есть исследуют химические явления физическими методами. Вначале это было весовой и объемный анализы, ощущение вкуса и запаха, измерение тепла и цвета. Потом пришли Р. В. Бунзен и Г. Кирхгоф со спектральным анализом, и пошло-поехало. Достижением на рубеже веков стало осознание того факта, что мир веществ скорее неравновесен, чем равновесен. Кроме того, в физхимии сплошь и рядом нарушаются законы арифметики. Вот типичный пример: 50 мл H2O + 50 мл C2H5OH = 96 мл водки + тепло.
Физическая органическая химия уделяет особое внимание исследованию механизмов органических реакций, а также количественной взаимосвязи между химическим строением органических соединений, их свойствами и реакционной способностью. Одно из достижений — открытие и доведение до практического использования стабильных радикалов, которые нашли применение в различных областях науки и техники в качестве спиновых меток, у которых неспаренный электрон служит источником сигнала электронного парамагнитного резонанса, ЭПР.
Фитохимия. Ее забота — создание высокоэффективных лекарственных препаратов на основе веществ растительного происхождения. Другое направление — экологически чистые средства защиты растений. Путь лекарства начинается в лаборатории либо химика-органика, либо фитохимика. Первый создает пока еще не исследованные соединения, второй выделяет вещества из растений. Затем созданные или выделенные вещества передают фармакологу. Он определяет, обладают ли эти вещества нужным эффектом. Чтобы найти активное соединение, применяют два метода. Первый — скрининг, то есть просеивание — перебор имеющихся веществ без предположения о том, с какой именно структурой нужно вещество. Впервые скрининг применил в начале XX столетия П. Эрлих для получения противосифилитических средств на основе органических соединений мышьяка. Второй — направленный синтез: исследователь постепенно накапливает материал, показывающий, какие химические радикалы или иные структуры ответственны за тот или иной вид действия. Природные молекулы растительного происхождения служат моделями для синтеза полезных соединений. Пример такого соединения — салициловая кислота, выделенная из коры ивы. На ее основе было создано такое популярное лекарство, как аспирин (ацетилсалициловая кислота). В настоящее время, несмотря на огромные успехи химиков-синтетиков, из растений получают более трети лекарственных препаратов. Структура многих из них настолько сложна (винбластин, сердечные гликозиды, кокаин, резерпин, хинин, колхицин, пилокарпин), что растения еще долго будут их единственным источником.
Фотохимия изучает реакции, возбуждаемые светом. Практическая фотохимия — фотография, изготовление печатных форм и микросхем методами фотолитографии, фотохимический синтез (например, капролактама). Самый значимый для Земли природный фотохимический процесс — фотосинтез, превращение зелеными растениями и фотосинтезирующими микроорганизмами энергии солнечного света в энергию химических связей органических веществ.
Химическая технология — это наука о методах и средствах рациональной химической переработки сырья, полуфабрикатов и промышленных отходов. Неорганическая химическая технология включает переработку минерального сырья (кроме металлических руд), получение кислот, щелочей, минеральных удобрений. Органическая химическая технология — переработку нефти, угля, природного газа и других горючих ископаемых, получение синтетических полимеров, красителей, лекарственных средств и других веществ.
Химическая физика изучает электронную структуру молекул и твердых тел, молекулярные спектры, элементарные акты химических реакций, процессы горения и взрыва. Сформировалась в 20-х годах XX века в связи с развитием квантовой механики и использованием ее представлений в химии. Граница между химической физикой и физической химией условна, а термин ввел немецкий химик А. Эйкен в 1930 году. Одно из достижений химической физики — теория разветвленных цепных реакций.
Химическое вооружение — боевые отравляющие вещества, средства их применения (ракеты, снаряды, мины, авиационные бомбы и прочие), нейтрализации и защиты. Применение химического оружия запрещено Женевским протоколом 1925 года, который ратифицировали свыше 100 государств. Однако его разработка, производство и накопление в некоторых странах продолжаются до сих пор.
Химия высоких энергий изучает химические реакции и превращения, происходящие в веществе под воздействием нетепловой энергии. Носители нетепловой энергии, воздействующей на вещество, — ускоренные электроны и ионы, быстрые и медленные нейтроны, альфа- и бета-частицы, позитроны, мюоны, пионы, атомы и молекулы при сверхзвуковых скоростях, кванты электромагнитного излучения, а также импульсные электрические, магнитные и акустические поля. Процессы химии высоких энергий различают по временным стадиям на физические, протекающие за фемтосекунды и менее, причем в течение этого времени нетепловая энергия распределяется в среде неравномерно и образуется «горячее пятно», физико-химические, в течение которых проявляются неравновесность и негомогенность в «горячем пятне», и, наконец, химические, в которых превращения вещества подчиняются законам общей химии. В результате образуются такие ионы и возбужденные состояния атомов и молекул, которые при комнатной температуре не могут возникнуть за счет равновесных процессов.
Химия высокомолекулярных соединений — раздел органической химии, объектами исследования которой служат макромолекулы синтетического и природного происхождения, состоящие из повторяющихся мономерных звеньев или молекулярных группировок, соединенных химическими связями и содержащих в главной цепи атомы углерода, а также кислорода, азота и серы. На основе высокомолекулярных соединений (полимеров) разрабатываются многочисленные материалы, в том числе интеллектуальные структуры, с функциональными ингредиентами, что существенно расширяет область их применения. Самая простая макромолекула — это полиэтилен:
…—CH2—CH2—CH2—CH2—CH2—CH2—CH2—…
Химия катализа изучает вещества, изменяющие скорость химических реакций. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Несмотря на появление новых способов активации молекул (плазмохимия, радиационное и лазерное воздействия и другие), катализ — основа химических производств (относительная доля каталитических процессов составляет 80–90%).
«Химия», на которую можно отправить. В 1963 году ЦК КПСС принял курс на химизацию народного хозяйства. Стал популярным лозунг: «Коммунизм есть советская власть плюс электрификация всей страны, плюс химизация народного хозяйства». На фронте химизации ударный корпус составили условно-досрочно освобожденные заключенные. В этой связи в народе называли «химией» условно-досрочное освобождение, условное осуждение с обязательным привлечением к труду. Включает этапирование в спецкомендатуру, где заключенный обязан проживать в спецобщежитии и работать на указанном предприятии. Новый гуманный Уголовный кодекс предусматривает альтернативные виды наказания за незначительные преступления: штрафы, общественные работы по месту жительства.
Химия силикатов — солей кремниевых кислот. Роль катионов в силикатах играют элементы второго, третьего и четвертого периодов таблицы Д. И. Менделеева. В природе силикаты представлены в виде минералов, входят в состав большинства горных пород, слагающих основную часть земной коры. Тесно примыкает керамика, изделия и материалы, получаемые спеканием глин и их смесей с минеральными добавками, а также оксидов и других неорганических соединений.
Химия природных соединений изучает методы получения, строение и свойства природных биоорганических соединений класса углеводов, а также их синтетических аналогов. Например, аромат кофе содержит до 500 различных компонентов. Химия чая — это также химия природных соединений. Работы немецкого химика А. Байера, изучавшего строение и синтез индиговых производных (индол и синтез природного красителя синего индиго — это цвет классических джинсов), привели к созданию химии синтетических красителей и к Нобелевской премии 1905 года «за заслуги в развитии органической химии и химической промышленности благодаря работам по органическим красителям и гидроароматическим соединениям». Это было началом огромной отрасли производства анилиновых красителей.
Химия твердого тела изучает реакции, в которых участвует одно или несколько веществ в твердом состоянии. Находит применение в микроэлектронике, синтезе новых материалов (керметов, сверхпроводников). Один из ярких примеров — самораспространяющийся высокотемпературный синтез (СВС). Современное развитие метода СВС позволило разработать технологии получения сверхтвердых и тугоплавких материалов, таких, как нитрид титана, карбид бора, диборид титана, карбид титана, а также оксидных материалов для футеровки печей (оксид циркония) и даже высокотемпературных сверхпроводников.
Химия элементоорганических соединений — наука о строении и превращениях соединений, содержащих химические связи «элемент-углерод», где «элемент» — любой из элементов Периодической таблицы, за исключением H, O, S, CI, Вг. Основные классы элементоорганических соединений — металлоорганические, кремнийорганические, борорганические, фосфорорганические, фторорганические соединения. Металлоорганические соединения (МОС) содержат в молекуле связь «металл—углерод» (М—С). Цианиды, карбиды, а в некоторых случаях и карбонилы металлов, также имеющие связь М—С, считают неорганическими соединениями. К МОС иногда относят органические соединения B, Al, Si и некоторых неметаллов. Гем — самое известное и полезное природное металлоорганическое соединение — переносчик кислорода в человеческом организме.
В химии живых организмов роль элементоорганических соединений еще не совсем ясна, тем не менее можно с уверенностью сказать, что соединения кремния, фосфора и других элементов играют важную роль в жизнедеятельности живых организмов, стоящих на высоком уровне эволюционного развития, в частности человека.
Исследователи работают над синтезом полимеров с 45 элементами Периодической системы. Оказалось, что В, Al, Si, Ti, Sn, Pb, P, As, Sb, Fe в сочетании с кислородом и азотом способны образовывать неорганические цепи полимерных молекул с боковыми органическими и органосилоксановыми группами.
Прикладные аспекты химии элементоорганических соединений направлены на создание новых веществ и материалов для медицины (лекарственные препараты, материалы для протезирования, шовные нити), радиоэлектроники (фото- и светочувствительные материалы, полупроводники, ферромагнетики), сельского хозяйства (стимуляторы роста растений, пестициды, гербициды) и других отраслей промышленности (катализаторы, регуляторы горения моторных топлив).
Цитохимия изучает химическими методами строение и функции клеток, внутриклеточных структур и продуктов их жизнедеятельности.
Электрохимия изучает свойства систем, содержащих подвижные ионы, а также явления, возникающие на границе двух фаз вследствие переноса заряженных частиц. Это нужно для электролиза, гальванотехники, защиты металлов от коррозии и создания химических источников тока. Электрические аккумуляторы, химические источники тока многократного действия — бытовое воплощение электрохимии.
Ядерная химия — пограничный раздел между ядерной физикой, радиохимией и химической физикой. Изучает взаимосвязь между превращениями атомных ядер и строением электронных оболочек атомов и молекул. Иногда ядерную химию неправильно отождествляют с радиохимией. В ней можно выделить исследование ядерных реакций и химических последствий ядерных превращений, химию «новых атомов» — позитроний (Ps), мюоний (Мu), поиск новых элементов и радионуклидов, новых видов радиоактивного распада.
Статья написана по материалам монографии:
Аблесимов Н. Е. Синопсис химии: Справочно-учебное пособие по общей химии.
Хабаровск: Изд-во ДВГУПС, 2005.
Опасные и легковоспламеняющиеся вещества » Предметы запрещенные для пересылки » Посылка » Бизнес » Omniva
Взрывоопасные и взрывчатые вещества
Определение:
Любые химические соединения, смеси или средства, которые могут вызвать взрыв или использование которых сопровождается риском моментального разогревания и выделения газа. Все взрывчатые вещества запрещены.
Пример:
нитроглицерин, пистоны, ракеты для салюта, зажигательные смеси, взрывчатка, осветительные ракеты, амуниция и т.д.Газы (сжатые, сжиженные или растворенные под давлением)
Определение:
Стабильные газы, которые не сжижаются под воздействием температуры окружающей среды, растворенные в растворителе под давлением. Запрещены:- сжатые и воспламеняющиеся газы: водород, этан, метан, пропан, бутан, зажигалки, газовые цилиндры для примусов, паяльные лампы и т.д.
- токсичные сжатые газы: хлор, фтор и др.
- невоспламеняющиеся сжатые газы: диоксид углерода, азот, неон, огнетушительные аппараты, в которых есть такие газы, и т.п.
- аэрозоли
ВОСПЛАМЕНЯЮЩИЕСЯ ЖИДКОСТИ
Определение:
Жидкости, смеси жидкостей или жидкости, в которых есть твердые частицы в виде раствора или суспензии, создающие горючие пары. Запрещены все жидкости, температура возгорания которых в закрытом сосуде ниже 55ºC.
Пример:
ацетон, бензол, чистящие средства, бензин, горючее для зажигалок, растворители для красок и чистящие средства, керосин, растворители и т.п.ЛЕГКОВОСПЛАМЕНЯЮЩИЕСЯ ТВЕРДЫЕ ВЕЩЕСТВА
Определение:
Твердые материалы. причиной возгорания которых может быть трения, поглощения влаги, спонтанной химической реакции или тепло, удерживаемого в процессе обработки, или которые легко воспламеняется и горят.
Пример:
спички, карбид кальция, целлюлоза, вещества, содержащие нитрат, металлический магний, пленка на базе нитроцеллюлозы, фосфор, калий, натрий, гидрид натрия, порошок цинка, гидрид циркония и т.п.ОКСИДИРУЮЩИЕ ВЕЩЕСТВА И ОРГАНИЧЕСКИЕ ПЕРОКСИДЫ
Определение:
Эти вещества являются самовоспламеняемыми, хоть и не всегда, но они могут вызвать или способствовать воспламенению других веществ. Кроме этого, они могут взорваться, вызвать опасную реакцию, взаимодействовать с другими веществами и создавать угрозу для здоровья.
Пример:
броматы, хлораты, компоненты средств для ремонта изделий из стекловолокна, перхлораты, перманганаты, пероксиды и т.п.ТОКСИЧНЫЕ ВЕЩЕСТВА И ВЕЩЕСТВА, СПОСОБСТВУЮЩИЕ РАСПРОСТРАНЕНИЮ ИНФЕКЦИЙ, ДРУГИЕ МЕДИЦИНСКИЕ ВЕЩЕСТВА
Определение:
Вещества, которые после их заглатывания, вдыхания или соприкосновения с кожей могут вызвать смерть или повреждения. Вещества, содержащие микроорганизмы или их токсины, которые определенно или, возможно, могут способствовать распространению заболеваний.
Пример:
мышьяк, бериллий, цианид, фтор, водород, селенит, ртуть, ртутные соли, иприт, диоксид азота, патогенный материал, крысиный яд, сыворотка, вакцины и т.п.РАДИОАКТИВНЫЙ МАТЕРИАЛ
Определение:
Все материалы, специфическая активность которых выше 74 килобеккерелей на килограмм (0,002 микрокюри на грамм). Все радиоактивные материалы запрещены.
Пример:
распадающиеся вещества (уран 235 и т.п.), радиоактивные отходы, урановая руда или ториевая руда и т.п.ЕДКИЕ ВЕЩЕСТВА
Определение:
Вещества, которые могут причинить серьезный вред, поскольку они оказывают химическое воздействие на живые ткани, товары или транспортное средство.
Пример:
хлорид алюминия, гидроксид натрия, едкая чистящая жидкость, средство для снятия/предотвращения ржавчины, едкое средство для снятия краски, электробатарейки, соляная кислота, азотная кислота, серная кислота и т.п.ДРУГИЕ ОПАСНЫЕ ВЕЩЕСТВА
Определение:
Вещества, создающие угрозу, которую невозможно классифицировать в соответствии с вышеуказанными категориями.
Пример:
асбест, сухой лед, магнетизированный материал с силой магнитного поля 0,159 А или выше на расстоянии 2,1 м от упаковки и т.п.Химические вещества, используемые в косметических средствах. — Akka Hotels
В течение дня мы неосознанно подвергаем наш организм воздействию многих химических веществ. Одна из главных причин, это использование косметической продукции. Химические вещества, входящие в состав шампуней, увлажняющих кремов, солнцезащитных и других косметических средств, наносят вред не только пользователю но и окружающей среде, смешиваясь с водой и проникая в почву. Консерванты, используемые для продления срока годности продукции, встречаются практически во всех косметических средствах. Чтобы избегать продукцию в составе которой есть вредные или ядовитые вещества, способные наносить серьезный вред здоровью человека, нужно научиться их распознавать.Вот основные химические вещества, которые мы часто встречаем в косметической продукции …
Парабен
С этим веществом мы можем сталкиваться в различных формах, таких как «метилпарабен», «бутилпарабен», «этилпарабен» и «пропилпарабен», которые входят в состав практически всей косметической продукции. Причиной такого частого использования, является его способность предотвращать рост бактерий и плесени и тем самым продливать срока службы продукта. Некоторые исследования показали, что парабены могут увеличить риск рака молочной железы, а также оказывать неприятное воздействие на кожу человека, особенно если она чувствительна.Лаурилсульфат натрия (SLS) и Лауретсульфат натрия (SLES)
SLS и SLES, самые распространенные ингредиенты, поверхностно-активные вещества, входящие в состав кремов и лосьонов в качестве увлажнителя поверхности кожи, и в состав чистящих средствах за их пенообразующего свойства. Еще их называют детергентами. Например SLS входит в состав продукции, которые мы используем в повседневной жизни каждый день, это шампунь, зубная паста, моющее средства и гели для душа. Но тем не менее они могут вызвать раздражение кожи и глаз, образовывать язвы во рту и различные воспаления.Диоксин
Диоксин, используется в фармацевтической и косметической промышленности, не смотря на то что может увеличить риск развития рака, накапливаясь в организме при длительном использовании. Благодаря пенообразующей способности, это вещество можно встретить в шампунях, гелях для душа и жидком мыле. Диоксин, также способен повредить иммунную систему, поэтому обращайте внимание на надписи на упаковке продукции: PEG, полисорбат60, полисорбат80, оксинол, ноноксинол, полиэтиленгликоль, полиэтилен, полиоксиэтилен».Синтетические красители
Синтетические красители, используемые в цветных косметических средствах, таких как губная помада, тени для век и пудра, входят в категорию канцерогенов, так так синтезируются химическим путем. Эти химические вещества, забивают поры кожи, вызывают аллергические заболевания и рак. Если вас заботит собственное здоровье, старайтесь избегать косметических средств и упакованных продуктов питания, содержащих вредные красители — D&C или FD&C.Фталаты
Еще одно токсичное вещество, используемое в косметике в качестве пластификаторов для улучшения гибкости, вязкости и блеска материалов, а также как фиксатор запахов. Он может содержаться в таких продуктах, как парфюм, лак для ногтей, лосьон, лак для волос, и в продуктах личной гигиены. Его легко распознать на упаковке по надписи DEP. Фталаты проникают сквозь кожу или легкие при вдыхании и разносятся по всему организму, накапливаясь в органах и тканях. При этом фталаты поражают легкие, печень и почки, и вызывают рак молочной железы.Нефтехимия
Химические вещества, получаемые в процессе нефтепереработки или подругому нефтехимические вещества, являются одними из наиболее часто используемых ингредиентов в косметической промышленности. Их применяют по следующим причинам: способность к увлажнению кожи, продление срока годности и придание гладкости продукции. К ним относятся: парафин, бутилен, пропилен и этилен. Эти вещества, попадая в организм через кожу могут быть весьма вредными для почек, мозга и дыхательной системы, и в целом способны нанести серьезный вред здоровью человека.Космическая химия
Современным астрономам известно около трех с половиной тысяч экзопланет, которые находятся от нас на расстоянии от четырех до двадцати восьми тысяч световых лет. Некоторые из них очень похожи на Землю. Попасть на какую-нибудь из них в обозримом будущем будет сложно — разве что человечество совершит огромный технологический скачок. Тем не менее, экзопланеты уже сегодня представляют собой огромный интерес с точки зрения астрохимии. Об этом — наш новый материал, написанный в партнерстве с Уральским федеральным университетом.
Основную часть вещества Вселенной (если говорить о барионном веществе) составляет водород — около 75 процентов. На втором месте идет гелий (около 23 процентов). Однако в космосе можно найти самые разнообразные химические элементы и даже сложные молекулярные соединения, включая органические. Изучением процессов образования и взаимодействия химических соединений в космосе занимается астрохимия. Представителям этой специальности очень интересно исследовать экзопланеты, потому что на них могут реализоваться самые разные сценарии, которые приведут к появлению необычных соединений.
Радуга на службе у астрономов
Основным инструментом получения информации о химическом составе отдаленных объектов является спектроскопия. Она использует тот факт, что атомы химических элементов (или молекулы соединений) могут излучать или поглощать свет только на определенных частотах, отвечающих переходам системы между различными уровнями энергии. В результате формируется спектр излучения (или поглощения), по которому можно однозначно определить вещество. Это как отпечатки пальцев, только для атомов.
Наглядным примером разложения света в спектр является радуга. Нам переходы от одного цвета к другому кажутся плавными и непрерывными, а на самом деле некоторых цветов в радуге нет, потому что определенные длины волн поглощаются содержащимися в Солнце водородом и гелием. Кстати, гелий впервые открыли именно по наблюдению за спектром Солнца (поэтому он и называется «гелий», от др.-греч. ἥλιος — «солнце»), а в лаборатории его выделили только через 27 лет. Это был первый успешный пример использования спектроскопии для изучения звезд.
Фраунгоферовы линии поглощения на фоне непрерывного спектра фотосферы Солнца.
Wikimedia commons
В простейшем случае атома водорода спектр излучения представляет собой серию линий, отвечающих переходам между уровнями с различными значениями главного квантового числа n (эта картина хорошо описывается формулой Ридберга). Самой известной и удобной для наблюдений является линия Бальмера Hα, имеющая длину волны 656 нанометров и лежащая в области видимого спектра. Например, на этой линии астрономы наблюдают за далекими галактиками и распознают облака молекулярного газа, которые в большинстве своем как раз состоят из водорода. Следующие серии линий (Пашена, Брэкета, Пфунда и так далее) целиком лежат в инфракрасном диапазоне, а серия Лаймана расположена в области ультрафиолетового излучения. Это несколько усложняет наблюдения.
В то же время у молекул сложных соединений есть другой способ излучать кванты света, в каком-то смысле даже более простой. Связан он с тем, что вращательная энергия молекулы квантуется, что также позволяет им излучать в линиях (кроме того, они могут излучать и непрерывный спектр). Энергия таких квантов света не очень большая, поэтому их частота лежит уже в радиодиапазоне. Один из самых простых вращательных спектров принадлежит молекуле угарного газа CO, по ней астрономы тоже часто распознают облака холодного газа, когда не могут разглядеть в них водород. Методы радиоастрономии позволили найти в молекулярных облаках также метанол, этанол, формальдегид, синильную и муравьиную кислоту, а также другие элементы. Например, именно с помощью радиотелескопа ученые обнаружили алкоголь в хвосте кометы Лавджоя.
Что можно найти в космосе
Проще всего методы спектроскопии применять для изучения химического состава звезд. В этом случае астрономы исследуют спектры поглощения, а не излучения элементов. В самом деле, свет от них легко наблюдать, особенно в видимом диапазоне. Правда, химический состав звезд сам по себе обычно не очень интересен: по большей части они состоят из водорода и гелия с небольшой примесью тяжелых элементов.
Более тяжелые элементы образуются во вспышках сверхновых, и их тоже можно наблюдать. Например, некоторые ученые утверждают, что после недавно зарегистрированного слияния двух нейтронных звезд должны были образоваться огромные количества золота, платины и других элементов из последних строк таблицы Менделеева. Но так или иначе, очень сложные или органические соединения в звездах существовать не могут, поскольку они обязательно распадаются из-за больших температур.
Другое дело — облака холодного межзвездного газа. Они очень сильно разрежены и излучают гораздо слабее, чем звезды, зато сами по себе гораздо больше. И состав у них более интересный. В них можно найти огромное число самых разных молекул — начиная от простых двухатомных и заканчивая относительно сложными многоатомными органическими соединениями. Среди сложных молекул особенно стоит выделить «пребиотические» соединения, например, аминоацетонитрил, который может участвовать в образовании глицина, простейшей аминокислоты. Некоторые ученые предполагают, что в молекулярных облаках может образоваться и рибоза, один из основных кирпичиков органической жизни. Если такие соединения попадут в благоприятные условия, это уже будет ступенькой для возникновения жизни.
Изображение туманности Ориона M42, полученное Коуровской астрономической обсерваторией УрФУ. Красный цвет — это результат рекомбинации в линии излучения Hα на длине волны 656,3 нанометра.
УрФУ
Чуть ближе к планетам
К сожалению, для определения химического состава экзопланет метод спектроскопии применить сложно. Все-таки для этого нужно зарегистрировать свет от них, а звезда, вокруг которой вращается планета, мешает это сделать, поскольку она светит намного ярче. Пытаться наблюдать за такой системой — все равно что смотреть на свет спички на фоне прожектора.
Тем не менее, некоторую информацию об экзопланете можно получить, не измеряя спектр ее излучения напрямую. Хитрость заключается в следующем. Если у планеты есть атмосфера, она должна поглощать часть излучения звезды, причем в разных спектральных диапазонах по-разному. Грубо говоря, на одной длине волны планета будет казаться чуть меньше, а на другой длине — чуть больше. Это позволяет строить предположения о свойствах атмосферы, в частности, о ее химическом составе. Такой способ наблюдений особенно хорошо работает на горячих, близко расположенных к звездам планетах, потому что их радиус проще измерять.
Кроме того, химический состав планеты должен быть связан с составом газопылевого облака, из которого она образовалась. Например, в облаках с большим отношением концентраций атомов углерода к атомам кислорода образующиеся планеты будут состоять преимущественно из карбонатов. С другой стороны, химический состав звезды, образовавшейся из такого облака, также должен отражать его состав. Это позволяет строить некоторые предположения, основываясь на изучении спектра одной только звезды. Так, астрономы из Йельского университета проанализировали данные о химическом составе 850 звезд и обнаружили, что в 60 процентах систем концентрации магния и кремния в звезде указывают на то, что рядом с ней могут находиться каменистые планеты, похожие на Землю. В оставшихся 40 процентах химический состав звезд говорит нам о том, что состав планет вокруг них должен существенно отличаться от земного.
Вообще говоря, в последнее время прямая спектроскопия особенно горячих планет на фоне тусклых звезд все-таки стала возможна благодаря возросшей точности измерительных приборов. В этом случае уже можно искать в их свете следы различных химических элементов и сложных соединений. Например, с помощью ИК-спектрографа CONICA, установленного на телескопе VLT и объединенного с системой адаптивной оптики NAOS, ученым удалось измерить спектр экзопланеты HR 8799 c, которая вращается вокруг белого карлика и разогрета так сильно, что сама излучает свет. В частности, из анализа ее спектра следовало, что в атмосфере планеты содержится меньше, чем ожидалось, метана и угарного газа. Также совсем недавно астрономы измерили спектр другого «горячего юпитера», обнаружив в его атмосфере оксид титана. Тем не менее, непосредственные измерения спектра менее горячих каменистых планет (на которых существование жизни более вероятно) до сих пор представляет большую сложность.
Изображение системы HR 8799. Планета HR 8799 c находится в правом верхнем углу
Jason Wang et al / NASA NExSS, W. M. Keck Observatory
Состав планеты можно также определить косвенно, рассчитав ее плотность. Для этого нужно знать радиус и массу планеты. Массу можно найти, наблюдая за гравитационным взаимодействием планеты со звездой или другими планетами, а радиус оценить по изменению блеска звезды при прохождении планеты по ее диску. Очевидно, газовые планеты должны иметь меньшую плотность по сравнению с каменистыми. Например, средняя плотность Земли равна примерно 5,5 грамма на кубический сантиметр, и для поиска обитаемых планет астрономы ориентируются именно на это значение. В то же время плотность «самого рыхлого горячего юпитера» составляет 0,1 грамма на кубический сантиметр.
«Невозможные» соединения
С другой стороны, экзопланеты можно изучать и вовсе не выходя из лаборатории, как бы странно это ни звучало. Речь идет о моделировании (в основном численном) химических и физических процессов, которые должны на них происходить. Из-за того что условия на экзопланетах могут быть самые экзотические (простите за каламбур), вещества на них могут образоваться тоже самые необычные, «невозможные» в привычных для нас условиях.
Большинство открытых экзопланет относится к «горячим юпитерам» — сильно разогретым из-за небольшого расстояния до звезды газовым гигантам. Конечно, это не обязательно означает, что такие планеты преобладают в звездных системах, просто их легко найти. Температура атмосферы таких гигантов может превышать тысячу градусов по Цельсию, и состоит она в основном из паров силикатов и железа (при такой температуре оно начинает испаряться, но еще не кипит). В то же время, давление внутри этих планет должно достигать огромных значений, при которых водород и другие привычные для нас газы переходят в твердые агрегатные состояния. Эксперименты по моделированию подобных экстремальных условий проводятся давно, однако впервые металлический водород удалось получить только в январе этого года.
С другой стороны, в недрах каменистых планет также могут достигаться большие давления и температуры, а «зоопарк» химических элементов там может быть даже больше. Например, по некоторым оценкам, давление внутри каменистых планет с массами в несколько земных масс может достигать значений до 30 миллионов атмосфер (внутри Земли давление не превышает четырех миллионов атмосфер). С помощью компьютерного моделирования удалось выяснить, что в таких условиях начинают образовываться экзотические соединения магния, кремния и кислорода (которых в составе каменистых планет должно быть много). Например, при давлениях более 20 миллионов атмосфер стабильными становится не только привычный для нас оксид кремния SiO2, но и «невозможные» SiO и SiO3. Также интересно, что в недрах особенно массивных планет (до 20 масс Земли) может образоваться MgSi3O12 — оксид, обладающий свойствами электрического проводника.
Нестандартные условия можно моделировать не только на компьютере, но и в лаборатории, пусть и не для такого большого диапазона давлений и температур. С помощью алмазной наковальни можно получить давления до 10 миллионов атмосфер, как раз соответствующие условиям в недрах планет, а разогреть образец до высоких температур можно лазером. Эксперименты по моделированию таких условий действительно активно проводятся в последнее время. Например, в 2015 году группа ученых, в состав которой входили российские исследователи, экспериментально наблюдали образование пероксида магния MgO2 уже при давлениях около 1,6 тысяч атмосфер и температурах больше двух тысяч градусов Цельсия. Подробно об исследованиях поведения вещества при больших давлениях вы можете прочитать в другом нашем материале.
Рентгеновская спектроскопия образца, состоящего из атомов магния и кислорода, при давлении около десяти тысяч атмосфер и температуре около двух тысяч Кельвин. Пунктиром выделена область с повышенным содержанием кислорода.
S. Lobanov et al / Scientific Reports
***
В УрФУ есть группа ученых, которые занимаются изучением протопланетного вещества в дальнем космосе и Солнечной системе. Мы попросили ведущего специалиста Коуровской астрономической обсерватории УрФУ Вадима Крушинского более подробно рассказать об изучении экзопланет.
N +1: Зачем мы изучаем экзопланеты?
Вадим Крушинский: Еще 25 лет назад нам было известно о существовании единственной планетной системы — Солнечной. Теперь же мы уверены в том, что планеты есть у огромного числа звезд, возможно, почти у каждой звезды во Вселенной. Прогресс технологий получения и обработки данных привел к тому, что найти свою экзопланету может даже продвинутый любитель астрономии. Открытие очередного «горячего юпитера» — это открытие целой планетной системы, просто мы видим только самую заметную ее часть. Планеты меньшего размера или находящиеся дальше от родительской звезды открываются гораздо реже, это эффект наблюдательной селекции.
Вадим Крушинский в составе группы ученых Уральского федерального университета работает над проектом по исследованию протопланетного вещества в дальнем космосе, Солнечной системе и на Земле.Это один из шести прорывных научных проектов университета, им занимается стратегическая академическая единица (САЕ) — Институт естественных наук и математики УрФУ — вместе с академическими и индустриальными партнерами из России и других стран. От успеха исследователей зависят позиции университета в российских и международных рейтингах, прежде всего в предметных.
Единичный эксперимент не позволяет делать выводы о наблюдаемом явлении. Эксперимент должен быть повторен многократно и независимо. Каждая открытая экзопланетная система — это отдельный независимый эксперимент. И чем больше их известно, тем надежнее прослеживаются общие законы происхождения и эволюции планетных систем. Нам необходимо набирать статистику!Что же можно узнать об экзопланетах, наблюдая за ними с таких больших расстояний?
Прежде всего нужно определить свойства родительской звезды. Это позволяет вычислить размеры планет, их массу и радиусы орбит. Зная светимость родительской звезды и радиус орбиты, можно оценить температуру поверхности экзопланеты. Кроме того, атмосферы планет имеют разную прозрачность в разных спектральных диапазонах (об этом писал еще Ломоносов). Для наблюдателя это выглядит как разный диаметр планеты при наблюдении в разных фильтрах. Это позволяет обнаружить атмосферу и оценить ее толщину и плотность. Свет родительской звезды, прошедший через атмосферу планеты во время транзита, несет информацию о составе ее атмосферы. А во время вторичного затмения, когда планета прячется за свою звезду, мы можем наблюдать изменения спектра, связанные с отражением от атмосферы и поверхности планеты. Так же, как и у Луны, у экзопланет можно наблюдать фазы. Если изменения блеска системы, вызванные этим эффектом, не постоянны, то это говорит о том, что альбедо планеты (способность отражать свет) меняется. Например, вследствие движения облаков в ее атмосфере.
Свойства экзопланет должны быть связаны со свойствами родительских облаков. Изучая материю на стадии звездообразования, мы вносим вклад в понимание эволюции планетных систем. К сожалению, Земля претерпела значительные изменения в ходе истории, и уже мало напоминает то протопланетное вещество, из которого когда-то родилась. Но совсем рядом с нами летают метеориты и кометы. Некоторые из них даже падают на Землю и попадают в лаборатории. До каких-то из них могут долететь космические аппараты. Прямо перед нами отличный объект исследования! Остается только доказать, что и другие планетные системы эволюционировали так же, как наша.
Можно ли найти жизнь на других планетах?
Для этого нужно обнаружить биомаркеры — проявления жизнедеятельности организмов. Лучшим биомаркером были бы передачи условного «Первого канала», но сойдет и наличие кислорода. Без жизни кислород на Земле был бы связан и исчез из атмосферы за десяток тысяч лет. Обнаружив кислород в атмосферах экзопланет, мы сможем утверждать, что не одиноки во Вселенной. Как его найти, было рассказано выше. Но вот только приборов с достаточной чувствительностью пока нет. Прорыв в этом направлении ожидается после запуска космического телескопа им. Джеймса Вебба (JWST).
Что могут сделать в этой области ученые из России и, в частности, из УрФУ?
Несмотря на то, что в плане изучения экзопланет Россия отстает от остального научного сообщества, у нас есть возможность сократить это отставание. Относительно малобюджетные программы по поиску экзопланетных систем (пилотный проект KPS Коуровской обсерватории УрФУ) позволят сделать первый шаг и помогут в наборе данных для статистического анализа. Высокоточные фотометрические измерения можно проводить и на имеющемся оборудовании, это позволяет искать атмосферы у некоторых экзопланет. Спектральные наблюдения во время транзитов и вторичных затмений относительно доступны для крупнейших телескопов России. Что нужно сделать для старта этих программ — найти заинтересованных людей и оплатить их работу. Немного вложиться в оборудование.
Второе направление — моделирование и интерпретация наблюдаемых эффектов. Это может быть как теоретическая работа, так и экспериментальная — исследование поведения и свойств образцов в условиях космоса и сравнение с наблюдаемыми эффектами. Для этого необходимо создание установки, имитирующей условия космического пространства. В качестве образцов можно использовать метеориты из коллекции УрФУ.
Дмитрий Трунин
Веществ и смесей | Введение в химию
Цель обучения
- Отличить химические вещества от смесей
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на их исходные компоненты.
- Химическое вещество состоит из одного типа атома или молекулы.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию.Для этого разделения вещество может находиться в одной или двух разных фазах.
Условия
- веществоФорма вещества, имеющая постоянный химический состав и характерные свойства. Он состоит из одного типа атома или молекулы.
- элемент: Химическое вещество, состоящее из определенного типа атома, которое не может быть расщеплено или преобразовано с помощью химической реакции.
- смесь: То, что состоит из различных, несвязанных элементов или молекул.
Химические вещества
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства. Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми телами, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из определенного типа атома и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент.Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку.Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями. Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, извлечен ли он из реки или изготовлен в лаборатории.Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза). Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это система материалов, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически. Под смесью понимается физическая комбинация двух или более веществ, в которой сохраняются идентичности отдельных веществ. Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Встречающиеся в природе кристаллы серы Сера встречается в природе в виде элементарной серы, сульфида и сульфатных минералов, а также в виде сероводорода.Это месторождение полезных ископаемых состоит из смеси веществ.Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно визуально различить и легко разделить физическими средствами. Примеры включают:
- смеси песка и воды
- смеси песка и опилок
- каменный конгломерат
- вода и масло
- салат
- трейл микс
- смеси золотого порошка и серебряного порошка
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально. Состав однородных смесей постоянный. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб.В достаточно малом масштабе любую смесь можно назвать гетерогенной, поскольку образец может быть размером с одну молекулу. На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) способами.
Химия 1.2 Classification Matter (Part 1 of 3) — YouTube Введение в классификацию вещества как вещества или смеси веществ. Смеси описываются как гетерогенные или гомогенные. Описываются три распространенных метода разделения. Часть 2 из 3: http://www.youtube.com/watch?v=SoFywULNF3s (Вещества) Часть 3 из 3: http://www.youtube.com/watch?v= LXMyN9kco7E (Диаграммы частиц) Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
2.1. Вещества — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Вещества
- Сводка
- Узнать больше
- Авторы и авторства
Приходилось ли вам когда-нибудь открывать холодильник и видеть что-то, чего вы не узнаете? Не незнакомая еда, а что-то, что изменилось за время хранения в холодильнике.Вы не уверены, что это такое, поэтому называете это «всякой всячиной». Скорее всего, посмотрев на него, вы понимаете, что есть его — плохая идея, поэтому выкидываете его. Если вы не уверены, что это такое, вы, конечно же, не хотите вкладывать это в свое тело.
Вещества
Серебро и обычная поваренная соль — два примера химических веществ . Вещество — это вещество, имеющее однородный и определенный состав. Все образцы веществ, иногда называемые чистыми веществами, обладают одинаковыми свойствами.Когда химики проводят химическую реакцию, они хотят использовать чистые материалы, чтобы точно знать, с чем имеют дело. Они знают, что в реакции участвует определенное вещество, поэтому они ожидают, что одна и та же реакция будет давать одни и те же результаты при каждом запуске.
Одной из характеристик вещества является то, что его нельзя разделить на компоненты с помощью методов физического разделения. Соединение ацетилсалициловая кислота (активный ингредиент аспирина) является веществом, потому что это химическое соединение, которое не может быть далее восстановлено до других материалов физическими средствами.Однако аспирин, содержащий ацетилсалициловую кислоту, представляет собой смесь. В дополнение к активному обезболивающему ингредиенту, аспирин также может содержать воски, кукурузный крахмал и целлюлозу, среди других ингредиентов. Эти добавленные материалы связывают компоненты таблетки в твердую пилюлю и влияют на скорость растворения материала.
Аспирин в таблетках.
Вещества могут быть элементами или чистыми соединениями. Они также могут быть твердыми, жидкими или газообразными.Некоторые элементы (например, серебро) существуют в твердой форме. Другие элементы (ртуть) существуют в жидком виде при комнатной температуре. Такие элементы, как гелий и радон, существуют в виде газов при комнатной температуре. Соединение, такое как вода, может принимать форму твердого вещества, жидкости или газа, в зависимости от температуры.
Сводка
- Вещество — это чистый материал с однородным и определенным составом.
- Вещество нельзя разделить на компоненты физическими средствами.
- Вещество может быть твердым, жидким или газообразным, в зависимости от температуры.
Узнать больше
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
- Что такое вещество? на сайте www.ivy-rose.co.uk/Chemistry/…-substance.php
- Что такое химическое вещество?
- Опишите отношения между веществами, элементами и соединениями.
- Почему вода внесена в список веществ?
- Если бы неон был заморожен в твердом состоянии, он все еще был бы веществом?
- Почему смесь не является веществом?
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Химическое вещество — Энциклопедия Нового Света
Вода и пар — это две разные формы одного и того же химического вещества.Химическое вещество — это любой материал, имеющий определенный химический состав. [1] Более того, чистое вещество не может быть разделено на другие вещества никаким механическим способом. [2] Химические элементы и соединения — вещества, смеси — нет.
Примеры известных химических веществ: чистая вода, поваренная соль (хлорид натрия) и сахар (сахароза).Обычно вещества существуют в твердой фазе , жидкой или газовой фазе , и они могут переходить из одной фазы в другую во время изменений температуры или давления.
Вещество имеет фиксированный состав
Понятие химического вещества утвердилось в конце восемнадцатого века после работы химика Джозефа Пруста по составу некоторых чистых химических соединений, таких как основной карбонат меди. [3] Он пришел к выводу, что: «Все образцы соединения имеют одинаковый состав, то есть все образцы имеют одинаковые массовые пропорции элементов, присутствующих в соединении.«Это стало известно как закон постоянного состава, и это одна из основ современной химии. Например, образец чистой воды имеет те же свойства и такое же соотношение водорода и кислорода, независимо от того, изолирован ли образец от реки ( а затем очищается) или производится в результате химической реакции в лаборатории.
Химические элементы
Химическое вещество, которое не может быть расщеплено или преобразовано с помощью обычных химических процессов в другое вещество, называется химическим элементом ( часто обозначается просто как элемент ).Элемент состоит из частиц, называемых атомов , которые состоят из отрицательно заряженных электронов , распределенных вокруг ядра , положительно заряженных протонов и незаряженных нейтронов . Все атомы в образце элемента имеют одинаковое количество протонов, хотя они могут быть разными изотопами с разным количеством нейтронов.
Известно около 120 элементов, около 80 из которых стабильны, то есть не превращаются в результате радиоактивного распада на другие элементы.Элементы классифицируются как металлы, неметаллы и металлоиды.
Большинство элементов классифицируются как металлов . Эти элементы, такие как железо, медь и золото, имеют характерный блеск. Вообще говоря, металлы являются хорошими проводниками тепла и электричества, они пластичны и пластичны. [4]
Около дюжины элементов [5] , таких как углерод, азот и кислород, классифицируются как неметаллы . Им не хватает металлических свойств, описанных выше.Они также обладают высоким значением электроотрицательности и склонностью к образованию отрицательных ионов, называемых анионами.
Определенные элементы, такие как кремний, обладают некоторыми свойствами металлов и некоторыми неметаллами. Они известны как металлоидов .
Химические соединения
Два или более элемента, объединенных в одно вещество, образуют так называемое химическое соединение . Соединение состоит из атомов элементов , связанных вместе с образованием молекул .
Огромное количество химических соединений может быть произведено путем объединения примерно 120 химических элементов. В настоящее время идентифицировано и охарактеризовано около 30 миллионов соединений. [6] Соединения, основанные в основном на атомах углерода и водорода, называются органическими соединениями , а все остальные называются неорганическими соединениями . Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями .
Соединения, в которых атомы элементов разделяют электроны, известны как ковалентные соединения.Соединения, в которых противоположно заряженные ионы удерживаются вместе за счет электростатических взаимодействий, известны как ионные соединения (или соли).
Вещества по сравнению со смесями
Химические вещества часто тщательно смешиваются вместе, образуя так называемые смеси . Смеси не имеют фиксированного состава. В принципе, их можно разделить на составляющие вещества чисто механическими способами. Раствор сахара (сахарозы) в воде представляет собой смесь.Еще один пример смесей — масло и почва.
Серый чугун и желтая сера являются химическими элементами, и их можно смешивать в любом соотношении с образованием желто-серой смеси. Никакого химического процесса не происходит, и материал можно идентифицировать как смесь по тому факту, что сера и железо могут быть разделены с помощью механического процесса, такого как использование магнита для оттягивания железа от серы.
Напротив, если железо и сера нагреваются вместе в определенном соотношении (56 грамм (один моль) железа на 32 грамма (один моль) серы), происходит химическая реакция и образуется новое вещество, а именно: соединение сульфида железа (II) с химической формулой FeS.Полученное соединение обладает всеми свойствами химического вещества и не является смесью. Сульфид железа (II) имеет свои собственные отличительные свойства, такие как температура плавления и растворимость, и два элемента не могут быть разделены с помощью обычных механических процессов; магнит не сможет восстановить железо, поскольку в соединении нет металлического железа.
Именование химических веществ
Для именования химических веществ химики используют правила, сформулированные Международным союзом теоретической и прикладной химии (IUPAC) или Службой химических рефератов (CAS).Таким образом, каждому химическому веществу дается уникальное систематическое название. Многие соединения также известны под их более распространенными и простыми названиями, многие из которых предшествуют их систематическим названиям. Например, глюкоза — это распространенное название давно известного типа сахара. Его систематическое название — 6- (гидроксиметил) оксан-2,3,4,5-тетрол. Кроме того, многие натуральные продукты и фармацевтические препараты получили более простые названия. Например, легкое болеутоляющее напроксен — более распространенное название химического соединения (S) -6-метокси-α-метил-2-нафталинуксусной кислоты.
Химики часто ссылаются на химические соединения, используя химические формулы, которые содержат более подробную информацию о структуре соединения. Для получения информации о веществах были разработаны удобные для компьютера системы, такие как регистрационный номер CAS, SMILES (упрощенная спецификация ввода строки молекулярного ввода) и Международный химический идентификатор (InChI). Помимо использования в компьютерных базах данных, эти системы, особенно номер CAS, стали полезными в бумажной работе в качестве уникальных кодов для идентификации конкретных веществ.
| Общее название | Систематическое название | Химическая формула | Химическая структура | Регистрационный номер CAS | InChI |
|---|---|---|---|---|---|
| спирт или этиловый спирт 14 | C 2 H 5 OH | [64-17-5] | 1 / C2H6O / c1-2-3 / h4H, 2h3,1h4 |
Выделение, очистка, определение характеристик и идентификация
Часто чистое вещество необходимо изолировать от смеси, например, из природного источника (где образец часто содержит множество химических веществ или после химической реакции (которая часто дает смеси химических веществ).Обычно это делается с использованием физических процессов, таких как дистилляция, фильтрация, жидкостно-жидкостная экстракция и выпаривание. Эти же методы, наряду с другими, такими как перекристаллизация, также могут использоваться для очистки вещества. После приготовления чистого материала можно исследовать его химические и физические свойства, чтобы охарактеризовать вещество. Наконец, химический анализ может быть использован для определения химического состава и определения чистоты.
См. Также
Примечания
- ↑ Hill, J.W., R.H. Petrucci, T.W. МакКрири и С.С.Перри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2005.
- ↑ Ebbing, D. D., and S.D. Гаммон. Общая химия , 7-е изд. Бостон, Массачусетс: Houghton Mifflin, 2002.
- ↑ Hill, J. W., R.H. Petrucci, T.W. МакКрири и С.С.Пэрри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2005.
- ↑ Hill, J. W., R.H. Petrucci, T.У. МакКрири и С.С. Перри. Общая химия , 4-е изд. Аппер-Сэдл-Ривер, Нью-Джерси: Pearson Prentice Hall, 2005.
- ↑ Граница между металлоидами и неметаллами неточная, как объяснялось в предыдущей ссылке.
- ↑ Chemical Abstracts количество веществ Проверено 2 декабря 2007 г.
Ссылки
- Браун-младший, Теодор Л., Х. Юджин ЛеМэй, Брюс Эдвард Бурстен и Джулия Р. Бердж. 2002. Химия: Центральные науки .9 изд. Река Аппер Сэдл, Нью-Джерси: Prentice Hall. ISBN 0130669970
- Чанг, Раймонд, 2006. Химия . 9 изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Science / Engineering / Math. ISBN 0073221031
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Продвинутая неорганическая химия . 4-е изд. Нью-Йорк, штат Нью-Йорк: Wiley. ISBN 0-471-02775-8
- Гринвуд, штат Нью-Йорк, и А. Эрншоу. 1998. Химия элементов . 2-е изд. Оксфорд, Великобритания; Берлингтон, Массачусетс: Баттерворт-Хайнеманн, Elsevier Science.ISBN 0750633654. Онлайн-версия, получено 2 декабря 2007 г.
- Stwertka, Albert. 1998. Путеводитель по элементам . Исправленное издание. Оксфорд, Великобритания: Издательство Оксфордского университета. ISBN 0-19-508083-1
Credits
New World Encyclopedia Писатели и редакторы переписали и завершили статью Wikipedia в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства.Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна для исследователей здесь:
История этой статьи с момента ее импорта в Энциклопедию Нового Света :
Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
Классификация веществ (элементов, соединений, смесей) — Введение в химию
Вещества и смеси
Вещества состоят из чистых элементов или химически связанных элементов, тогда как смеси состоят из несвязанных веществ.
ЦЕЛИ ОБУЧЕНИЯ
Отличить химические вещества от смесей
КЛЮЧЕВЫЕ ДОРОГИ
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси.Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на их исходные компоненты.
- Химическое вещество состоит из одного типа атома или молекулы.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию. Для этого разделения вещество может находиться в одной или двух разных фазах.
Ключевые термины
- смесь : То, что состоит из различных, несвязанных элементов или молекул.
- элемент : химическое вещество, которое состоит из определенного типа атома и не может быть расщеплено или преобразовано с помощью химической реакции.
- вещество : форма вещества, имеющая постоянный химический состав и характерные свойства. Он состоит из одного типа атома или молекулы.
Химические вещества
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства.Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми телами, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из определенного типа атома и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент. Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями.Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, извлечен ли он из реки или изготовлен в лаборатории. Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза).Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это система материалов, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически.Под смесью понимается физическая комбинация двух или более веществ, в которой сохраняются идентичности отдельных веществ. Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Кристаллы серы природного происхождения: Сера встречается в природе в виде элементарной серы, сульфидов и сульфатных минералов, а также в виде сероводорода. Это месторождение полезных ископаемых состоит из смеси веществ.Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно визуально различить и легко разделить физическими средствами.Примеры включают:
- смеси песка и воды
- смеси песка и опилок
- каменный конгломерат
- вода и масло
- салат
- трейл микс
- смеси золотого порошка и серебряного порошка
Interactive: Oil and Water : исследуйте взаимодействия, которые вызывают воду и масло отделить от смеси.
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб. В достаточно малом масштабе любую смесь можно назвать гетерогенной, поскольку образец может быть размером с одну молекулу.На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) способами.
Классифицирующее вещество (3 части): Введение в классификацию вещества как вещества или смеси веществ.Смеси описываются как гетерогенные или гомогенные. Описаны три распространенных метода разделения.
Элементы и соединения
Элемент — это материал, состоящий из одного типа атомов, в то время как соединение состоит из двух или более типов атомов.
ЦЕЛИ ОБУЧЕНИЯ
Различать элементы и соединения и изучать методы разделения
КЛЮЧЕВЫЕ ДОРОГИ
Ключевые моменты
- Элементы — это простейшие законченные химические вещества.Каждый элемент соответствует одной записи в периодической таблице. Элемент — это материал, состоящий из одного типа атомов. Каждый тип атома содержит одинаковое количество протонов.
- Химические связи соединяют элементы вместе, образуя более сложные молекулы, называемые соединениями. Соединение состоит из двух или более типов элементов, удерживаемых вместе ковалентными или ионными связями.
- Элементы не могут быть разделены на более мелкие части без большого количества энергии. Соединения, с другой стороны, могут быть разорваны с помощью практического количества энергии, например тепла от огня.
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси представляют собой физически комбинированные структуры, которые можно разделить на их исходные компоненты.
Ключевые термины
- элемент : Любое одно из простейших химических веществ, которое нельзя изменить с помощью химической реакции или каких-либо химических средств. Состоит из атомов, имеющих одинаковое количество протонов.
- химическая связь : Любая из нескольких сил притяжения, которые служат для связывания атомов вместе с образованием молекул.
- соединение : Вещество, состоящее из двух или более элементов. Состоит из фиксированного соотношения химически связанных атомов. Обладает уникальными свойствами, которые отличаются от свойств отдельных его элементов.
Элементы
Химический элемент — это чистое вещество, состоящее из одного типа атомов. У каждого атома есть атомный номер, который представляет количество протонов, находящихся в ядре одного атома этого элемента.Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Химические элементы делятся на металлы, металлоиды и неметаллы. Металлы, которые обычно находятся в левой части таблицы Менделеева, это:
- часто проводит к электричеству
- податливый
- блестящий
- иногда магнитный.
Алюминий, железо, медь, золото, ртуть и свинец являются металлами.
В отличие от неметаллов, которые можно найти в правой части таблицы Менделеева (справа от лестницы):
- обычно непроводящий
- не податливый
- тусклый (не блестящий)
- немагнитный.
Примеры элементарных неметаллов включают углерод и кислород.
Металлоиды обладают некоторыми характеристиками металлов и некоторыми характеристиками неметаллов. Кремний и мышьяк — металлоиды.
По состоянию на ноябрь 2011 г. было идентифицировано 118 элементов (самым последним из них был идентифицирован ununseptium в 2010 г.). Из этих 118 известных элементов только первые 98 встречаются в природе на Земле. Элементы, которые не встречаются в природе на Земле, являются синтетическими продуктами ядерных реакций, созданных человеком.80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Периодическая таблица Менделеева: Периодическая таблица Менделеева содержит 118 элементов, включая металлы (розовый), неметаллы (синий) и металлоиды (зеленый).Водород и гелий — самые распространенные элементы во Вселенной. Однако железо является самым распространенным элементом (по массе) в составе Земли, а кислород — наиболее распространенным элементом в слое земной коры.
Хотя вся известная химическая материя состоит из этих элементов, сама химическая материя составляет лишь около 15% материи во Вселенной. Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов. Темной материи не хватает протонов, нейтронов или электронов.
Соединения
Чистые образцы изолированных элементов редко встречаются в природе. Хотя 98 природных элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена как узнаваемые, относительно чистые минералы.Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в форме угля, графита и алмазов. Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в их чистых, несвязанных формах в природе. Тем не менее, большинство этих элементов находится в смесях.
Когда два различных элемента химически объединены, то есть между их атомами образуются химические связи, результат называется химическим соединением. Большинство элементов на Земле связываются с другими элементами, образуя химические соединения, такие как натрий (Na) и хлорид (Cl), которые вместе образуют поваренную соль (NaCl).Вода — еще один пример химического соединения. Два или более компонентов соединения можно разделить с помощью химических реакций.
Химические соединения имеют уникальную и определенную структуру, которая состоит из фиксированного соотношения атомов, удерживаемых вместе в определенном пространственном расположении химическими связями. Химические соединения могут быть:
- молекулярных соединений, удерживаемых ковалентными связями
- солей, удерживаемых ионными связями
- интерметаллические соединения, удерживаемые металлическими связями
- комплексов, скрепленных координатными ковалентными связями.
Чистые химические элементы не считаются химическими соединениями, даже если они состоят из двухатомных или многоатомных молекул (молекул, которые содержат только несколько атомов одного элемента, например H 2 или S 8 ).
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНЫЙ АТРИБУЦИЯ
Какие примеры чистых веществ?
Чистое вещество или химическое вещество — это материал, который имеет постоянный состав (однороден) и имеет одинаковые свойства по всему образцу.Чистое вещество участвует в химической реакции с образованием предсказуемых продуктов. В химии чистое вещество состоит только из одного типа атомов, молекул или соединений. В других дисциплинах определение распространяется на однородные смеси.
Примеры чистого вещества
- В химии вещество считается чистым, если оно имеет однородный химический состав. На наноуровне это применимо только к веществу, состоящему из одного типа атомов, молекул или соединений.
- В более общем смысле чистое вещество — это любая однородная смесь.То есть это вещество, которое кажется однородным по внешнему виду и составу, независимо от размера выборки.
- Примеры чистых веществ: железо, сталь и вода. Воздух — это однородная смесь, которую часто считают чистым веществом.
Примеры чистых веществ
Примеры чистых веществ включают олово, серу, алмаз, воду, чистый сахар (сахарозу), поваренную соль (хлорид натрия) и пищевую соду (бикарбонат натрия). Кристаллы, как правило, представляют собой чистые вещества.
Олово, сера и алмаз являются примерами чистых веществ, которые являются химическими элементами. Все элементы — чистые вещества. Сахар, соль и пищевая сода — это чистые соединения. Примеры чистых веществ, которые представляют собой кристаллы, включают соль, алмаз, кристаллы белка и кристаллы сульфата меди.
В зависимости от того, с кем вы разговариваете, гомогенные смеси могут считаться примерами чистых веществ. Примеры гомогенных смесей включают растительное масло, мед и воздух.Хотя эти вещества содержат несколько типов молекул, их состав одинаков во всем образце. Если добавить в воздух сажу, она перестает быть чистым веществом. Загрязнения в воде делают ее нечистой.
Гетерогенные смеси не являются чистыми веществами. Примеры материалов, которые являются , а не чистыми веществами, включают гравий, компьютер, смесь соли и сахара и дерево.
Совет по распознаванию чистых веществ
Если вы можете написать химическую формулу для вещества или если это чистый элемент, это чистое вещество!
Источники
- Хилл, Дж.W .; Petrucci, R.H .; McCreary, T. W .; Перри, С. С. (2005). Общая химия (4-е изд.). Пирсон Прентис Холл. Нью-Джерси.
- ИЮПАК (1997). «Химическая субстанция.» Сборник химической терминологии (2-е изд.) Doi: 10.1351 / goldbook.C01039
Что такое вещество? — Определение, типы и примеры — Видео и стенограмма урока
Типы веществ
Продолжая нашу технологическую схему, мы видим, что чистые вещества можно разделить на две подкатегории: элементы и соединения.
Элементы представляют собой простейшую форму материи, что означает, что они не могут быть разделены на более мелкие компоненты физически или химически. Все элементы перечислены в таблице Менделеева, а человечеству известно как минимум 118 из них! Примеры элементов включают углерод (C), водород (H), кислород (O) и натрий (Na), и это лишь некоторые из них.
Соединения , с другой стороны, состоят из двух или более различных элементов, удерживаемых вместе химическими связями и функционирующих как единое целое.Хотя соединения также являются чистыми веществами, они отличаются от элементов, потому что соединения могут быть разбиты на более простые компоненты (элементы, составляющие соединение). Некоторыми примерами соединений являются диоксид углерода (CO2), ржавчина (Fe2O3) и поваренная соль (NaCl).
Примеры веществ
Давайте обсудим несколько примеров чистых веществ.
Образец кремния состоит только из одного типа атомов: атомов кремния. Следовательно, кремний — чистое вещество. Поскольку эти атомы кремния находятся в своей простейшей форме и не могут быть расщеплены дальше, вещество, кремний, также является элементом.Помните, что простой способ выяснить, является ли что-то элементом, — это найти его в таблице Менделеева. Все, что изображено в таблице Менделеева, является элементом и, следовательно, чистым веществом! Кремний находится под номером 14 в периодической таблице и имеет символ Si.
Сахар имеет химическую формулу C12h32O11. Это говорит нам о том, что он состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода, связанных вместе и функционирующих как единое целое, что означает, что сахар представляет собой соединение (и может быть далее разбит на отдельные элементы: углерод, водород и кислород. ).Таким образом, сахар — это чистое вещество. Простой способ выяснить, является ли что-то составным, — это выяснить, есть ли у него химическая формула. Все, что может быть представлено химической формулой, является химическим соединением и, следовательно, чистым веществом!
Вода — это чистое вещество, в зависимости от его разновидности. Например, дистиллированная вода и морская вода имеют разные свойства. Морская вода содержит молекулы h3O, а также молекулы соли и, вероятно, многие другие ионы и атомы. Таким образом, морская вода считается смесью.Однако дистиллированная вода содержит только молекулы h3O и, следовательно, является чистым веществом. Поскольку молекулы h3O в дистиллированной воде состоят из 2 атомов водорода и 1 атома кислорода, связанных вместе и функционирующих как единое целое, чистое вещество вода классифицируется как соединение и может быть химически разложено на отдельные элементы — водород и кислород.
Резюме урока
Вещество — это просто чистая форма вещества . Другими словами, вещество — это материя, содержащая только один тип атома или молекулы.Чистые вещества можно разделить на две подкатегории: элементы и соединения. Элементы представляют собой простейшую форму материи, что означает, что они не могут быть разделены на более мелкие компоненты физически или химически. Соединения , с другой стороны, состоят из двух или более различных элементов, удерживаемых вместе химическими связями и функционирующих как единое целое.
Два типа чистых веществ
| Элементы | Соединения |
|---|---|
| * Нельзя разделить на более мелкие компоненты * Можно найти в таблице Менделеева * Пример: Железо | * Состоит из двух или более элементов, скрепленных химическими связями и функционирующих как единое целое * Пример: диоксид углерода, вода |
Результаты обучения
Когда вы закончите, вы должны уметь:
- Сформулировать определения вещества, вещества и смеси
- Обсудите два типа чистых веществ
- Приведите примеры чистых веществ
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метанаМетан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Британская энциклопедия, Inc.Британская викторина
Подводки к химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Вся материя Вселенной состоит из атомов более чем 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях. Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени.Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки заключается в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит отдельные молекулы CH 4 .Формула соединения, например CH 4 , указывает типы присутствующих атомов с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
молекула водыМолекула воды состоит из двух атомов водорода и одного атома кислорода. Одиночный атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.Изучите магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому
Ионы — атомы с положительным или отрицательным суммарным зарядом — связываются вместе, образуя ионные соединения.
Encyclopædia Britannica, Inc. См. Все видео для этой статьиПосмотрите, как работают молекулярные связи, когда два атома водорода присоединяются к атому серы, образуя сероводород
Молекулярные соединения образуются при образовании молекул, таких как молекулы метана или воды , соединяются вместе, деля электроны.
Encyclopædia Britannica, Inc. См. Все видео для этой статьи
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ).( См. Ниже Тенденции в химических свойствах элементов, где обсуждается процесс превращения незаряженных атомов в ионы [т.е. частицы с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества служат примером двух основных типов химических веществ. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и еще многие миллионы возможны, но еще не открыты и не синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не меняют способ агрегирования атомов в соединениях. Соединения можно разбить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором изменяется организация атомов. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в способе связывания атомов углерода, водорода и кислорода. в соединениях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасХимические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
ртуть (Hg)Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
© marcel / FotoliaВ рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и т. Д.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития химии было обнаружено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. Когда были раскрыты детали атомной структуры, стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Таблица МенделееваПериодическая таблица элементов.
Encyclopædia Britannica, Inc.Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона, и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, заключается в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает общий заряд +1: Na → Na + + e — .Калий, расположенный непосредственно под натрием в группе 1, также образует +1 ион (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в Группе 16 имеет шесть валентных электронов и, следовательно, ему нужно еще два электрона, чтобы завершить его внешнюю оболочку. Кислород достигает этой договоренности, реагируя с элементами, которые могут терять или делиться электронами.Атом кислорода, например, может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающийся в результате Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет чистого заряда, поскольку содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами в группе 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная теплопроводность и электрическая проводимость. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно мало, находятся в верхнем правом углу периодической таблицы, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов.