Солі | ШКОЛА ХІМІЇ
Солі – це складні речовини, які під част дисоціації утворюють катіони металів (іонів амонію NH4+) та аніони кислотних залишків. Залежно від складу розрізняють такі типи солей: середні (нормальні), кислі, основні, подвійні, мішані та комплексні.
Середні солі – продукти повної нейтралізації кислот основами (NaCl, NH4NO3). Назви середніх солей утворюють з назви металу (NH4+) в називному відмінку і кислотного залишку:
Na2SO4 – натрій сульфат;
FeCl3 – ферум (III) хлорид;
Nh5Br – амоній бромід.
Кислі солі – це продукти неповної нейтралізації багатоосновних кислот основами (NaH2PO4, NaHSO4, NH4HCO3). Називають кислі солі так як і середні з додаванням префікса -гідроген та -дигідроген:
NH4HCO3
Na2H2PO4 – натрій дигідрогенфосфат.
Основні солі – продукти неповної нейтралізації багатокислотних основ кислотами (MgOHCl, AlOHSO4). Назви утворюють аналогічно середнім солям з додаванням -гідроксо та -дигідроксо:
AlOHSO4 – алюміній гідроксосульфат;
Fe(OH)2Cl – ферум (III) дигідроксохлорид.
Подвійні солі – це солі до складу яких входять два різних катіони (KAl(SO4)2, NH4MgPO4). В назвах катіони перераховують в алфавітному порядку:
(NH4)2Fe(SO4)2 – амонійферум (II) сульфат.
Мішані солі – солі які містять два різні кислотні залишки (Ca(OCl)Cl, MgClBr). В назвах змішаних солей кислотні залишки перераховують в алфавітному порядку:
Ca(OCl)Cl – кальцій хлоридгіпохлорит.
Комплексні солі містять в своєму складі комплексний аніон (K
4[Fe(CN)6] – калій гексаціаноферат (II)), комплексний катіон ([Co(H2O)6]Br2 – гексааквакобальт (II) бромід) або одночасно комплексний аніон і катіон ([Fe(H2O)6][Cr(CN)6] – гексаакваферум(III) гексаціанохромат (III)).ГДЗ (відповіді) Хімія 11 клас Ярошенко О.Г. §27 Солі, їх поширення в природі. Середні та кислі солі НОВА ПРОГРАМА 2019 РОКУ » Допомога учням
Інші завдання дивись тут…
Знаємо, розуміємо
Вправа 1 Дайте визначення й наведіть приклади кислих і середніх солей.
Середні солі — продукти повного заміщення атомів Гідрогену йонами металічного елемента в молекулі кислоти. Їхні кислотні залишки не містять атомів Гідрогену
Приклади: Na2SO4, Ca3(PО4)2, K2CO3
Кислі солі — продукт неповного заміщення Гідрогену в кислоті катіонами металічного елемента, тому кислотні залишки таких солей містять Гідроген
Приклади: NaНSO4, NaН2РО4, Na2НРО4, Ca(HSO4)2
Вправа 2 Назвіть хімічні властивості середніх солей. Реагують з металами, що стоять у ряді активності металів ліворуч від металу, що утворив сіль, з лугами, з кислотами, з солями в розчині, деякі (карбонати, силікати, нітрати) розкладаються під час прокалювання
Вправа 3 Що вам відомо про добування кислих солей?
Добування кислих солей:
1. Взаємодія кислот з недостачею основи:
NaOH + H2SO4 = NaHSO4 + H2O
1 моль 1 моль
2. Взаємодія основи з надлишком кислотного оксиду:
Ca(OH)2 + 2CO2 = Ca(HCO3)2
1 моль 2 моль
Вправа 4 Назвіть відомі вам поклади солей в Україні. Родовища кухонної солі в Україні розташовані поблизу Артемівська Донецької області та в Карпатах
Вправа 5 Наведіть приклади використання солей.
Сіль NaCl є харчовою добавкою, консервувальним і лікарським засобами.
Сіль CaSO4 є будівельним матеріалом, її також використовують для виготовлення відбитків форм, статуеток, для накладання пов’язки при переломах.
Сіль KNO3 є добривом, її також використовують у виробництві пороху, сірників.
Вапняк СaCO3використовують у металургії, будівництві, виробництві скла, цементу, кальцій карбіду, негашеного та гашеного вапна, укріплюють дороги, вапнують кислотні ґрунти; крейду СaCO3 використовують у паперовій і гумовій промисловості як наповнювач, у будівництві та під час ремонту приміщень для побілки, вона входить до складу зубного порошку, нею роблять записи на класній дошці; мармур CaCO3використовують у виготовленні скульптур, як облицювальний матеріал у будівництві; ісландський шпат CaCO
Сіль Ca(H2PO4)2 є фосфорним добривом.
Сіль KСl є калійним добривом.
Сіль AgNO3 використовують у посрібленні різних виробів.
Застосовуємо
Вправа 1 Складіть формули солей: кальцій гідрогенкарбонат Сa(HCO3)2, барій ортофосфат Ba3(PO4)2, алюміній хлорид AlCl3, магній гідрогенортофосфат MgHPO4, натрій карбонат Na2CO3, купрум (ІІ) нітрат Cu(NO3)2.
Класифікуйте їх на середні та кислі солі, солі безоксигенових і оксигеновмісних кислот.
Середні: Ba3(PO4)2, AlCl3, Na2CO3, Cu(NO3)2
Кислі: Ca(HCO3)2, MgHPO4
Безоксигенові: AlCl3
Оксигеновмісні: Ca(HCO3)2, Ba3(PO4)2, MgHPO4, Na2CO3, Cu(NO3)2
Вправа 2 Із переліку формул випишіть окремо формули оксидів, основ, кислот, солей.
Оксиди: MgO, CO, N2O5
Основи: KОН, Ва(OH)2, Zn(OH)2
Кислоти: HNO3, H2SiO3
Солі: СuSO4, K2SO4, LiHSO4
Вправа 3 Складіть якомога більше рівнянь реакцій добування ферум (ІІ) хлориду.
1. Взаємодія металу з кислотою:
Fe + 2HCl = FeCl2 + H2↑
2. Взаємодія металу з розчином солі іншого металічного елемента:
Fe + CuCl2 = FeCl2 + Cu↓
3. Взаємодія металу з неметалом (добувають солі безоксигенових кислот):
Fe + Cl2 = FeCl2
4. Взаємодія основного або амфотерного оксиду з кислотою:
FeО + 2HCl = FeCl2 + H2О
5. Взаємодія кислоти з основою:
Fe(ОH)2 + 2HCl = FeCl2 + 2H2О
6. Взаємодія між солями в розчині:
FeSO4 + BaCl2 = FeCl2 + BaSO4↓
Вправа 4 Укажіть, між якими парами речовин відбудеться взаємодія в розчині.
А залізо і станум (ІІ) хлорид
Б цинк і магній сульфат
В свинець і натрій хлорид
Г мідь і цинк сульфат
Відповідь: А
Вправа 5* Через деякий час маса залізної пластинки, зануреної в розчин купрум (ІІ) сульфату, збільшилася на 1,32 г, а катіонів Купруму (2+) в розчині не залишилось. Обчисліть масу солі, що прореагувала.
Відомо: маса залізної пластинки збільшилася на 1,32 г
Знайти: m(CuSO4)-?
Розв’язуванняПрипустимо, що маса залізної пластинки до реакції дорівнює 100 г, тоді після реакції маса залізної пластинки збільшилася за рахунок осідання на ній міді і становить 100 г + 1,32 г = 101,32 г. Нехай х г — маса заліза, що утворилося після реакції. Тоді в реакцію вступило залізо масою (100 — х) г, а утворилася мідь масою (101,32 — х) г.
Запишемо рівняння реакції:
100-х г 101,32-х г
Fe + CuSO4 = FeSO4 + Cu↓
56 г 64 г
M(Fe)=56 г/моль, маса 1 моль=56 г
M(Cu)=64 г/моль, маса 1 моль=64 г
(100-х):56=(101,32-х):64, за властивістю пропорції
(100-х)•64=(101,32-х)•56
6400-64х=5673,92-56х
64х-56х =6400-5673,92
8х=726,08
х=726,08:8
х=90,76 г
m(Fe)=100 г — 90,76 г = 9,24 г — вступило в реакцію
v(Fe)=m(Fe):M(Fe)=9,24 г : 56 г/моль=0,165 моль
За рівнянням реакції v(Fe):v(CuSO
v(CuSO4)=v(Cu)=0,165 моль
M(CuSO4)=160 г/моль
m(CuSO4)=v(CuSO4)•M(CuSO4)=0,165 моль•160 г/моль=26,4 г
Відповідь: 26,4 г
Інші завдання дивись тут…
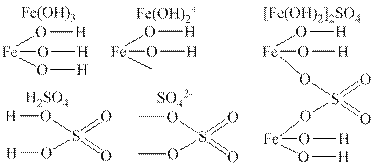
Структурні формули кислих солей
⇐ ПредыдущаяСтр 5 из 5Структурні формули кислих солей складаються таким же чином, як і структурні формули середніх солей, тобто можна скористатись такою послідовністю: структурна формула кислоти → структурна формула кислотного залишку кислої солі → структурна формула кислої солі.
Наприклад: KHSO4

Ca(H2PO4)2

Fe2(HPO
4)3Тобто слід записати структурну формулу кислотного залишку стільки разів, скільки він міститься в формулі кислої солі, і сполучити атоми металу з атомами Оксигену відповідним числом зв’язків у вигляді рисочок.
Номенклатура кислих солей


КНСO3 – калій гідрогенкарбонат;
Nа2НРО4 – натрій гідрогенртофосфат,
NаН2РО4 – натрій дигідрогенортофосфат;
СаНРО4 – кальцій гідрогенртофосфат,
Са(Н2РО4)2 – кальцій дигідрогенортофосфат
Fe(HSO4)3 – ферум (III) гідрогенсульфат;
Mg(HS)2 – магній гідрогенсульфід.
Властивості кислих солей
Кислі солі, завдяки наявності в їх молекулах Гідроген-йонів, проявляють деякі властивості кислот – здатні взаємодіяти з речовинами основного характеру з утворенням середніх солей, взаємодіяти з металами та ін. Наприклад:
Ca(HCO3)2 + Са(ОН)2 = 2СаСO3 + 2H2О,
2KHSO4 + 2NaOH = K2SO4 + Na2SO4 + 2H2О
2NaHSO4 + Zn = ZnSO4 + Na2SO4 + H2↑
У воді кислі солі практично повністю дисоціюють на катіони металу та аніони кислотного залишку.
Na2HРО4 → 2Na+ + НРО42–
Аніони кислотного залишку певною мірою здатні дисоціювати на Гідроген-катіон та аніони кислоти:
НРО42– ↔ H+ + PO43–
Одержання кислих солей
Кислі солі можна одержати:
1) При дії кислоти на середню сіль:
Са3(РO4)2 + 4H3РО4 = ЗСа(Н2PO4)2
2) При неповній нейтралізації кислоти основою:
H2SO4 + NaOH = NaHSO4 + H2O
Основні солі

Іншими словами, основні солі – це речовини, до складу яких входять катіони металу тадва різновиди аніонів – аніони кислотного залишку та гідроксид-йони.
Наприклад:
основа середня сіль основна сіль
Mg(OH)2 MgCl2 MgOHCl
Cu(OH)2 CuSO4 (CuOH)2SO4
В молекулах однокислотних основ (NaOH, TlOHта ін.) є тільки один гідроксид-йон і тому однокислотні основи основних солей не утворюють.
Для полегшення написання хімічних формул основних солей необхідно пам’ятати, щов складі основної солі гідроксид-йони та катіони металу складають єдине ціле – катіон основної солі, валентність якого визначають як алгебраїчну суму валентностей катіону металу та гідроксид-йонів.
Наприклад:
Mg(OH)2 MgOH+ +2 – 1 = +1
Cu(OH)2 CuOH+ +2 – 1 = +1
Fe(OH)3 Fe(OH)2+ +3 – 2 = +1
FeOH2+ +3 – 1 = +2
Знаючи валентність катіону основної солі та кислотного залишку, легко написати хімічну формулу основнoї солі.
Наприклад:
| катіон основної солі | кислотний залишок | основна сіль |
| MgOH+ Fe(OH)2+ FeOH2+ MgOH+ Fe(OH)2+ FeOH2+ | Cl– Cl– Cl– SO42– SO42– SO42– | (MgOH)Cl [Fe(OH)2]Cl (FeOH)Cl2 (MgOH)2SO4 [Fe(OH)2]2SO4 (FeOH)SO4 |
Структурні формули основних солей
Структурні формули основних солей складають виходячи з структурних формул відповідних основ та кислот: зв’язують рисками залишок основи (після відщеплення відповідної кількості груп –ОН) та аніон кислоти. Наприклад:
(MgOH)NO3
[Fe(OH)2]2SO4
Номенклатура основних солей

(MgOH)Cl – магнійгідроксо хлорид,
AlOH(NO3)2 – алюмінійгідроксо нітрат,
Al(OH)2NO3 – алюмінійдигідроксо нітрат;
(FeOH)SО4 – ферум(ІІІ)гідроксо сульфат,
[Fe(OH)2]2SO4 – ферум(ІІІ)дигідроксо сульфат.
Основні солі називають ще гідроксосолями.
Властивості основних солей
Основні солі, завдяки наявності в їх молекулах гідроксид-йонів, проявляють деякі властивості основ. Наприклад, вони взаємодіють з речовинами кислотного характеру з утворенням середніх солей
(FeOH)Cl2 + HCl = FeCl3 + H2O
2(MgOH)Cl + H2SO4 = MgCl2 + MgSO4 + 2H2O
Якщо гідроксид амфотерний, то і основна сіль, яка походить від нього, проявляє амфотерні властивості
[Al(ОН)2]Сl + 2NaOH = NaAlO2 + NaCl + 2H2O
Переважна більшість основних солей, як і основи, від яких вони походять, нерозчинна у воді. Розчинена у воді частина солі дисоціює на катіон основної солі та кислотний залишок.
Наприклад:
[Al(ОН)2]Cl → [Al(ОН)2]+ + Сl–
Дальша дисоціація катіону основної солі практично не відбувається.
Одержання основних солей
Основні солі можна одержати:
1) При дії основи на середню сіль цієї ж основи
MgCl2 + Mg(OH)2 = 2MgOHCl
2) При неповній нейтралізації основи або амфотерного гідроксиду кислотою:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Кислотно-основні взаємодії
У попередніх розділах при огляді властивостей оксидів, основ, кислот і амфотерних гідроксидів, ми вже розглядали рівняння реакцій взаємодії речовин основної природи з речовинами кислотної природи, тобто кислотно–основної взаємодії. Зупинимось ще раз детальніше на складанні рівнянь таких реакцій.
Нагадаємо, що речовини основного характеру (основні оксиди, основи) не здатні взаємодіяти між собою; речовини кислотного характеру (кислотні оксиди, кислоти) також між собою не взаємодіють. Речовини основної природи здатні взаємодіяти з речовинами кислотної природи і продуктом такої взаємодії завжди є солі.
Розглянемо, наприклад, взаємодію сульфатної кислоти Н2SО4 з натрій гідроксидом NaOH:
Н2SО4 + 2NaOH = Na2SО4 + 2Н2О
Продуктом реакції є сіль – натрій сульфат і вода.
Аналогічно відбуваються реакції між кислотами та амфотерними гідроксидами, які у цьому випадку поводять себе як основи.
Для написання формули солі від речовини основного характеру на першому місці записуємо катіон металу, а від речовини кислотного характеру – аніон кислотного залишку і розставляємо індекси у сполуці згідно властивостей металу і кислотного залишку.
Подібно до кислот, взаємодіють з речовинами основного та амфотерного характеру кислотні оксиди.
Наприклад:
SO2 + Ga2O3 →
Для правильного написання формули продукту реакції слід визначити, сіль якої кислоти утворюється. Якщо вам важко відразу написати формулу солі, виведіть під формулою кислотного оксиду формулу відповідної йому кислоти. Для цього слід записати рівняння реакції взаємодії кислотного оксиду з водою
SO2 + Ga2O3 →
(SO2 + H2O = H2SO3)
Отже, утворюється сіль сульфатної кислоти
SO2 + Ga2O3 = Ga2(SO3)3
Розставляємо коефіцієнти в рівнянні реакції:
3SO2 + Ga2O3 = Ga2(SO3)3
При взаємодії з речовинами основного характеру амфотерні сполуки, як відомо, виявляють свою кислотну функцію – поводять себе як кислотні оксиди чи кислоти. При цьому здебільшого утворюються солі метакислот, і тільки при великому надлишкові основи – солі ортокислот.
Пригадаємо спочатку рівняння реакцій для елементів, які виявляють у амфотерних гідроксидах ступінь окиснення +2. Наприклад:
Be(OH)2 + KOH →
У цьому випадку амфотерний гідроксид Be(OH)2, взаємодіючи з основою, поводить себе як кислота. Тому запишемо його формулу у вигляді кислоти:
Be(OH)2 + KOH →
(Be(OH)2 = H2BeO2)
Далі, як звичайно, записуємо формули продуктів реакції – калій берилату та води і підбираємо коефіцієнти:
Be(OH)2 + 2KOH ↔ K2BeO2 + 2H2O
Аналогічно при написанні рівнянь реакцій з основами амфотерних гідроксидів, в яких елементи виявляють ступінь окиснення +3, слід спочатку формулу гідроксиду записати у формі кислоти. Наприклад:
Сr(ОН)3 + KOH →
(Сr(ОН)3 = H3CrO3)
враховуючи, що звичайно утворюються солі метакислоти, слід записати її формулу
(H3CrO3 – H2O = HCrO2)
Далі, як звичайно, записуємо формули продуктів реакції – калій метахроміту та води і підбираємо коефіцієнти:
Cr(OH)3 + KOH ↔ KCrO2 + H2O
Подібно записуємо рівняння реакцій амфотерних оксидів з основами чи основними оксидами. Спочатку виводимо формулу кислоти, яка відповідає амфотерному оксидові, а потім записуємо формули продуктів реакції й підбираємо коефіцієнти.
Наприклад:
а) Al2O3 + 2KOH ↔ 2KAlO2 + Н2О,
(Al2O3 + H2O = 2HAlO2)
б) 3ZnO + Mn2O3 = Mn2(ZnO2)3
(ZnO + H2O = H2ZnO2)
Контрольні питання
1 Що таке мета- та ортокислоти? Наведіть приклади.
2 Класифікація солей. Способи їх одержання.
3 Закінчіть рівняння тих реакцій, які проходять:
Fe(OH)2+H2CrO4→
NiO+HNO3→
KOH+VO→
4 Випишіть формули кислих солей:
(CuOH)NO2, NaClO, BiAsO4, [Cr(OH)2]Cl, Ba(HCO3)2, KPO3, Na2HPO4, (NiOH)NO3, PbS.
5 Випишіть формули основних солей:
(CuOH)NO2, NaClO, BiAsO4, [Cr(OH)2]Cl, Ba(HCO3)2, KPO3, Na2HPO4, (NiOH)NO3, PbS.
6 Випишіть формули середніх солей:
(CuOH)NO2, NaClO, BiAsO4, [Cr(OH)2]Cl, Ba(HCO3)2, KPO3, Na2HPO4, (NiOH)NO3, PbS.
7 Напишіть хімічні формули солей:
амоній нітрит, берилійгідроксо хлорид, калій дигідрогенортоарсенат, ферум(ІІ) гідрогенсульфат, натрій хлорат, берилійгідроксо сульфат, натрій гідрогенортофосфат, кальцій гіпохлорит, хром(ІІІ)дигідроксо нітрат.
8 Чи можуть утворювати основні солі однокислотні основи? Чому?
Солі, їх поширення в природі. Середні та кислі солі
Хімія. Рівень стандарту. 11 клас. Ярошенко
Інформаційна довідка
• Складні речовини із загальною формулою
належать до класу солей.
• Солі — це електроліти, що дисоціюють з утворенням катіонів металічного елемента й аніонів кислотного залишку, наприклад: К2СО3 = 2К+ + СО2-3.
• Усі солі мають твердий агрегатний стан, багато з них добре розчинні у воді, зокрема всі нітрати, усі солі Калію й Натрію.
• Кристалогідрати — солі, які містять кристалізаційну воду, наприклад мідний купорос, залізний купорос.
• Серед неорганічних сполук за поширеністю у природі солі займають друге місце після оксидів.
СЕРЕДНІ СОЛІ. Дотепер ви мали справу переважно з середніми солями. Так називають продукти повного заміщення Гідрогену в молекулі кислоти йонами металічного елемента, наприклад: K2SO4, K3PO4.
Середні солі — продукти повного заміщення атомів Гідрогену йонами металічного елемента в молекулі кислоти. Їхні кислотні залишки не містять атомів Гідрогену:
Як ви знаєте, за сучасною номенклатурою назви середніх солей утворюють з двох слів у називному відмінку: першим називають катіон металічного елемента, другим — аніон кислотного залишку, який є однокорінним із назвою відповідної кислоти, наприклад: СаСl2 — кальцій хлорид (хлоридна кислота), Na3PO4 — натрій ортофосфат (ортофосфатна кислота), KNO3 — калій нітрат (нітратна кислота). Відмінюється тільки друге слово, наприклад: кальцій хлоридом, калій нітрату.
КИСЛІ СОЛІ. Якщо катіони Гідрогену в кислоті неповністю заміщені катіонами металічного елемента, утворюються кислі солі.
Кислі солі — продукт неповного заміщення Гідрогену в кислоті катіонами металічного елемента, тому кислотні залишки таких солей містять Гідроген, наприклад KHSO4, KН2РО4, K2НРО4.
Назви кислотних залишків кислих солей складають так, щоб у них було відображено наявність Гідрогену. Так, кислотний залишок HSO—4 одновалентний і має назву гідрогенсульфат, а сіль KНSO4 — калій гідрогенсульфат. А яка валентність кислотного залишку калій гідрогенортофосфату К2НРО4? Міркуємо так: у молекулі ортофосфатної кислоти Н3РО4 відбулося заміщення двох атомів Гідрогену. Отже, залишок двовалентний. Саме тому у формулі після символу одновалентного Калію стоїть індекс 2.
Наявність двох атомів Гідрогену в назві кислої солі передають приставкою «дигідроген», наприклад: KН2РО4 — калій дигідрогенортофосфат.
ХІМІЧНІ ВЛАСТИВОСТІ КИСЛИХ СОЛЕЙ. Кислі солі багато в чому повторюють хімічні властивості середніх солей, хоча мають певні особливості. Зупинимось на них.
1. Електролітична дисоціація
Кислі солі, утворені сильними кислотами, дисоціюють повністю і в одну стадію:
NaHSO4 = Na+ + Н+ + SO2-4.
Кислі солі, утворені слабкими кислотами, дисоціюють у дві стадії.
На першій — повністю:
NaHCO3 = Na+ + НСО—3,
на другій — частково й дисоціація є оборотною реакцією:
НСО—3 ⇄ Н+ + СО2-3.
2. Кислі солі більш сильної кислоти взаємодіють з кислими солями слабкіших кислот, утворюючи слабкішу кислоту й середню чи кислу сіль сильної кислоти:
ХІМІЧНІ ВЛАСТИВОСТІ СЕРЕДНІХ СОЛЕЙ. Поєднання у складі солей катіонів металічних елементів й аніонів кислотних залишків обумовлює їхні хімічні властивості. Розглянемо хімічні властивості середніх солей.
Попрацюйте групами
Завдання 1. Попрацюйте зі схемою задля відновлення знань про хімічні властивості солей та уміння складати відповідні рівняння реакцій.
Завдання 2. Проілюструйте схему прикладами молекулярних рівнянь реакцій, а для реакцій йонного обміну складіть також повні й скорочені йонні рівняння.
Завдання 3. Позначте рівняння реакцій, які належать до окисно-відновних.
Зверніть увагу! Розчинні у воді карбонати стійкі до розкладання.
ПОШИРЕННЯ СОЛЕЙ У ПРИРОДІ, ЗАСТОСУВАННЯ. Найбільше поширення у природі мають сульфати, карбонати, хлориди.
Природні сульфати — це гіпс CaSO4 · 2Н2О; глауберова сіль Na2SO4 · 10H2О; гірка сіль MgSO4 · 7H2О. Із наведених формул стає зрозуміло, що вони належать до кристалогідратів. Нагріванням гіпсу зменшують вміст у ньому кристалізаційної води й одержують алебастр 2СаSO4 · Н2О. Саме з алебастру накладають пов’язки при переломах кісток. Глауберову сіль Na2SO4 · 10H2О застосовують у виробництві скла, соди, фарб, у медицині. Гірку сіль MgSO4 · 7H2О використовують в обробці тканин, дубінні шкіри, виготовленні медичних препаратів.
КАРБОНАТИ В ПРИРОДІ. Карбонати існують у природі переважно у вигляді кальцій карбонату СаСО3. Крейда, мармур, вапняки, ракушняк — усе це кальцій карбонат з певним умістом некарбонатних домішок. Чистий кальцій карбонат трапляється в природі у вигляді мінералу кальциту (мал. 64, а). Ісландський шпат (кальцій карбонат високої чистоти) (мал. 64, б) застосовують в оптиці.
Мал. 64. Мінерали: а — кальцит; б — ісландський шпат
Серед карбонатів найбільше застосовується вапняк (мал. 65).
Мал. 65. Зразок вапняку
Вапняки різних родовищ відрізняються кількістю домішок, тому мають різне забарвлення — від білого або світло-жовтого до темного. Їх використовують у металургії, будівництві, виробництві скла, цементу, кальцій карбіду, негашеного та гашеного вапна тощо. Вапняками укріплюють дороги, вапнують кислотні ґрунти. Знамениті одеські катакомби — це колишні каменярні, у яких добували ракушняк — вапняк органічного походження (мал. 66).
Мал. 66. Ракушняк: а — зразок; б — природні поклади
До карбонатів органічного походження належить також кальцій карбонат, що входить до складу кісток людини і тварин.
Крейду використовують у паперовій і гумовій промисловості як наповнювач, у будівництві та під час ремонту приміщень для побілки. Звичайно ж вам відомо, що вона входить до складу зубного порошку, нею роблять записи на класній дошці. До українських традицій належить вибілювання хати крейдою (мал. 67). Завдяки чому вона має ошатний привабливий вигляд, а проживання в такому помешканні є безпечним.
Мал. 67. Музей-садиба Г. С. Сковороди у смт Чорнухи
Природні запаси мармуру (мал. 68, а) значно менші, аніж вапняку та крейди. Колір мармуру — білий, проте наявність різних домішок надає йому різного забарвлення. З мармуру виготовляють скульптури (мал. 68, б). У будівництві його використовують як облицювальний матеріал, наприклад станції метрополітену (мал. 68, в).
Мал. 68. Мармур: а — зразок; б — скульптура; в — облицьована мармуром станція метро
Крім карбонатів Кальцію, у природі трапляються карбонати інших металічних елементів: доломіт MgCO3 · CaCO3 (мал. 69, а), сидерит FeCO3 (мал. 69, б), малахіт Cu2(OH)2CO3 (мал. 69, в) та деякі інші.
Мал. 69. Зразки карбонатів: а — доломіт; б — сидерит; в — малахіт
ПОШИРЕННЯ ХЛОРИДІВ У ПРИРОДІ. Україна багата запасами кам’яної солі NaCl, або галіту (мал. 70, а). Ця незамінна харчова добавка та сповільнювач псування багатьох продуктів є у кожній домівці (мал. 70, б). Металічний елемент Калій утворює природні поклади калійної солі, сильвініту, польового шпату, ортоклазу.
Мал. 70. Кам’яна сіль: а — мінерал галіт; б — кухонна сіль
• З раніше вивченого на уроках географії та хімії пригадайте, де в Україні є поклади солей лужних, лужноземельних елементів, Магнію, Купруму, і складіть таблицю з такими колонками: «назва мінералу», «хімічна формула основної складової», «використання».
Світовий океан містить чи не найбільшу кількість солей на нашій планеті. Зважаючи на те, що Земля на 2/3 вкрита водою, вміст металічних елементів у гідросфері не менший, ніж у літосфері. Вода морів та океанів через вміст у ній різних солей солоногірка на смак. 100 г морської води в середньому містять 3,5 г солей, серед яких на натрій хлорид припадає майже 78 %. На схемі (мал. 71) подано окремі приклади застосування солей.
Мал. 71. Використання солей
ДОБУВАННЯ СЕРЕДНІХ СОЛЕЙ. У лабораторії солі можна добувати різними способами. Більшість із них вам відомі.
1. Взаємодія металу з кислотою.
Zn + H2SO4 = ZnSO4 + H2↑
2. Взаємодія основного або амфотерного оксиду з кислотою.
ZnО + H2SO4 = ZnSO4 + H2О
3. Взаємодія основи з кислотою.
Са(ОН)2 + H2SO4 = СаSO4 + 2H2О
4. Взаємодія амфотерного гідроксиду з кислотою.
Zn(ОН)2 + H2SO4 = ZnSO4 + 2H2О
5. Взаємодія солі з кислотою.
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
6. Взаємодія основного або амфотерного оксиду з кислотним оксидом.
Na2O + SO3 = Na2SO4; PbO + CO2 = PbCO3
7. Взаємодія металу з розчином солі іншого металічного елемента.
Fe + CuSO4 = FeSO4 + Cu
8. Взаємодія металу з неметалом (добувають солі безоксигенових кислот).
2Fe + 3Cl2 = 2FeCl3
ДОБУВАННЯ КИСЛИХ СОЛЕЙ.
1. Взаємодія кислот з недостачею основи.
2. Взаємодія основи з надлишком кислотного оксиду.
Хімія — це життя: сторінка природодослідника
Лабораторний дослід 7
Виявлення у розчинах ортофосфат-іонів
Вам знадобляться: пробірки, штативи для пробірок, розчини солі ортофосфатної кислоти й аргентум(І) нітрату.
Завдання. Проведіть реакцію між розчинами натрій ортофосфату й аргентум(І) нітрату. Спостерігайте за явищем, що супроводжує цю реакцію, поясніть його. Запишіть результати спостереження у зошит. Складіть молекулярне, повне і скорочене йонні рівняння проведеної реакції.
У висновку зазначте, за допомогою якої якісної реакції можна виявити в розчині ортофосфат-іони.
Сторінка ерудита
Родовища кухонної солі в Україні розташовані поблизу Артемівська Донецької області та в Карпатах. Людина здавна використовує цю сіль як харчову добавку і консервувальний засіб (соління риби, м’яса, грибів, квашення овочів тощо).
Наші предки знали ціну солі, адже був час, коли вона коштувала дорожче, ніж золото. З давніх часів й дотепер в Україні зберігся звичай зустрічати гостей хлібом-сіллю (мал. 72).
Мал. 72. Зустріч гостей хлібом-сіллю
А ще є приказка: «Щоб пізнати людину, треба з нею пуд солі з’їсти». Один пуд дорівнює 16 кг. І життєвий досвід доводить, що приказка ця небезпідставна. Доросла людина за рік споживає близько 3 кг солі. Неважко підрахувати, що двоє з’їдають пуд солі десь за 2,5-3 роки. Кухонна сіль є цінною сировиною для виробництва натрію, хлору, натрій гідроксиду.
Моря й океани мають різну солоність — так називають вміст солей в одиниці об’єму морської води. Проте якісний склад солей практично однаковий, і вчені схиляються до думки про те, що Світовий океан у давні часи був єдиним.
Морські рослини й тварини пристосувалися до життя в солоній воді. Крім того, їхні організми накопичують у своєму тілі окремі йони, що входять до складу солей морів та океанів. Ось чому морепродукти багаті на Кальцій, Силіцій, Йод, Купрум, Магній, Фосфор та інші елементи.
Знаємо, розуміємо
- 1. Дайте визначення й наведіть приклади кислих і середніх солей.
- 2. Назвіть хімічні властивості середніх солей.
- 3. Що вам відомо про добування і властивості кислих солей?
- 4. Назвіть відомі вам поклади солей в Україні.
- 5. Наведіть приклади використання солей.
Застосовуємо
- 1. Складіть формули солей: кальцій гідрогенкарбонат, барій ортофосфат, алюміній хлорид, магній гідрогенортофосфат, натрій карбонат, купрум(ІІ) нітрат. Класифікуйте їх на середні та кислі солі, солі безоксигенових і оксигеновмісних кислот.
- 2. Із переліку формул випишіть окремо формули оксидів, основ, кислот, солей.
CuSO4, KOH, Ва(ОН)2, K2SO4, MgO, HNO3, CO, LiHSO4, Zn(OH)2, N2O5, NH3, H2SiO3, SiH4.
- 3. Складіть якомога більше рівнянь реакцій добування ферум(ІІ) хлориду.
- 4. Укажіть, між якими парами речовин відбудеться взаємодія в розчині.
А залізо і станум(ІІ) хлорид
Б цинк і магній сульфат
В свинець і натрій хлорид
Г мідь і цинк сульфат
- 5*. Через деякий час маса залізної пластинки, зануреної в розчин купрум(ІІ) сульфату, збільшилася на 1,32 г, а катіонів Купруму(2+) в розчині не залишилось. Обчисліть масу солі, що прореагувала.
Солі, їхня поширеність у природі. Середні та кислі солі
Хімія. Рівень стандарту. 11 клас. Лашевська
Після опрацювання параграфа ви зможете:
- характеризувати поширеність солей у природі;
- називати представників солей за систематичною номенклатурою;
- складати рівняння реакцій, які характеризують хімічні властивості та добування середніх і кислих солей.
Поширеність солей у природі добре відома вам з власного життєвого досвіду, курсів хімії, біології та географії. Тож ви легко впораєтеся із завданням: за наведеними далі рисунками визначити поширеність солей у довкіллі та їхню роль у житті людини.
Рис. 27.1. Поширеність солей у природі та в побуті.
1. Феномени української природи: а) Лемурійське озеро, розташоване за 100 кілометрів від Херсона, поблизу села Григорівни, — уміст натрій хлориду в його воді сягає 35 %; б) крейдяна скеля у Дворічанському районі Харківської області. 2. NaCl, FeSO4 · 7Н2О, CuSO4 · 5Н2О, NH4NO3, СаСО3, NaHCO3, Na2CO3, K2SO4, СаСl2
Цікаво і пізнавально
Маса солей, розчинених в океанічній і морській воді, величезна. Три чверті її припадає на натрій хлорид. В океанічній воді є катіони більшості хімічних елементів (рис. 27.2).
Як називають середні солі за систематичною номенклатурою, ви також знаєте:
НАЗВА МЕТАЛІЧНОГО ЕЛЕМЕНТА (ВАЛЕНТНІСТЬ) + НАЗВА КИСЛОТНОГО ЗАЛИШКУ.
Наприклад, ВаСО3 — барій карбонат, FeCl2 — ферум(ІІ) хлорид.
Якщо сіль містить кристалізаційну воду, до назви добавляють слово гідрат з одним з префіксів — моно-, ди-, три-, тетра-, пента- тощо залежно від кількості молекул води, наприклад CaSO4 · 2Н2О — кальцій сульфат дигідрат, СrСl3 · 6Н2О — хром(ІІІ) хлорид гексагідрат.
• 1. За підписами до рисунку 27.1 складіть назви солей. 2. За підписами до рисунку 27.2 складіть формули солей, унаслідок електролітичної дисоціації яких в океанічній воді перебувають відповідні йони, та назвіть ці солі за систематичною номенклатурою. Якщо вам забракло знань, щоби повністю виконати завдання, поверніться до нього після опрацювання параграфа.
Рис. 27.2. Уміст йонів в океанічній воді масою 1 кг. 1. Вода. 2. Інші компоненти: 3 — Na+; 4 — SO2-4; 5 — Mg2+; 6 — НСО—3; 7 — Са2+; 8 — К+; 9 — інші; 10 — Сl—
Рівняння реакцій, які характеризують хімічні властивості та способи добування середніх солей, ви зможете скласти самостійно, перетворивши на них наведені далі схеми хімічних реакцій (зробіть це та класифікуйте реакції за різними ознаками).
Середні солі
Кислі солі. Одна з них вам добре відома — харчова сода, хімічна формула якої NaHCO3. Чим вона відрізняється від кальцинованої соди, формула якої Na2CO3? Тим, що в її складі крім катіона металічного елемента та аніона кислотного залишку є катіон Гідрогену. Тому назва харчової соди за систематичною номенклатурою — натрій гідрогенкарбонат. Якщо у формулі кислої солі кілька катіонів Гідрогену, їх позначають відповідним префіксом — ди-, три- тощо. Наприклад, кисла сіль, формула якої NaH2PO4, — натрій дигідрогенортофосфат.
• Назвіть за систематичною номенклатурою солі, формули яких Na2HPO4, KHS, NaHSO4, NH4H2PO4.
Кислі солі дисоціюють у водних розчинах:
• Спрогнозуйте реакцію середовища розчинів натрій гідрогенсульфату та натрій гідрогенкарбонату. Порівняйте силу сульфатної та карбонатної кислот. Поясніть, чому натрій гідрогенсульфат дисоціює повністю, а гідрогенкарбонат аніон майже не дисоціює.
Отже, кислі солі є продуктами неповного заміщення атомів Гідрогену в молекулах багатоосновних кислот на катіони металічного елемента, наприклад:
NaOH + H2SO4 = NaHSO4 + H2O.
У таких солях є катіони Н+, здатні заміщуватися на катіони металічних елементів:
NaOH + NaHSO4 = Na2SO4 + Н2О.
Важливою властивістю кислих і середніх солей багатоосновних кислот є їхня здатність до взаємоперетворень. Тобто йдеться про способи добування кислих солей із середніх і навпаки.
• Перетворіть наведені далі схеми реакцій за участі кислих солей на хімічні рівняння. Запишіть їх у повній і скороченій йонних формах.
Наприклад, унаслідок пропускання карбон(ІV) оксиду крізь вапняну воду спочатку випадає білий осад кальцій карбонату, який згодом перетворюється на розчинну кислу сіль:
Са(ОН)2 + СО2 → СаСО3↓ + Н2О;
СаСО3 + Н2О + СО2 → Са(НСО3)2.
Утворену кислу сіль можна знову перетворити на середню, добавивши луг, наприклад гашене вапно:
Са(НСО3)2 + Са(ОН)2 → СаСО3↓ + Н2О.
І навпаки, дією концентрованої багатоосновної кислоти на її середню сіль можна добути кислу сіль:
Na2SO4 + H2SO4 → NaHSO4.
Кислі солі за надлишку кислоти також можуть утворюватися і в інших реакціях, як-от (проаналізуйте наведені далі хімічні рівняння й поясніть, за яких кількісних співвідношень між реагентами це можливо):
Zn + 2H2SO4= H2↑ + Zn(HSO4)2;
NaOH + H2S = H2O + NaHS;
NH3 + H3PO4 = NH4H2PO4;
CaO + H3PO4 = CaHPO4 + H2O;
Na2S + HCl = NaHS + NaCl;
2NH3 + H3PO4 = (NH4)2HPO4.
Унаслідок нагрівання кислі солі, зокрема гідрогенкарбонати, розкладаються:
Кислі солі сильних кислот подібно до них реагують з металами, основними оксидами, основами, солями (проаналізуйте наведені далі схеми реакцій з погляду електролітичної дисоціації й поясніть їхню суть):
KHSO4 + Mg → H2↑ + MgSO4+ K2SO4;
KHSO4 + MgO → H2O + MgSO4 + K2SO4;
KHSO4 + NaOH → H2O + K2SO4 + Na2SO4;
KHSO4 + Cu(OH)2 → H2O + K2SO4 + CuSO4;
KHSO4 + MgCO3 → H2O + CO2↑ + K2SO4 + MgSO4;
KHSO4 + BaCl2 → BaSO4↓ + K2SO4 + HCl.
Знання про властивості середніх і кислих солей, їхні взаємоперетворення стануть вам у пригоді не лише під час опрацювання наступного параграфа, а й у повсякденному житті.
https://www.youtube.com/watch?v=I3BYJDi-q-s
https://www.youtube.com/watch?v=aWJuNZessbM
ПРО ГОЛОВНЕ
• Середні солі реагують з металами, лугами, солями у водних розчинах.
• Кислі солі є продуктами неповного заміщення атомів Гідрогену в молекулах багатоосновних кислот на катіони металічного елемента.
• Кислі та середні солі здатні до взаємоперетворень.
• Кислі солі сильних кислот у водних розчинах реагують з металами, основними оксидами, основами та амфотерними гідроксидами, солями.
Перевірте себе
- 1. Перетворіть розповідні речення рубрики ПРО ГОЛОВНЕ на питальні. Чи можете ви відповісти на ці запитання без допомоги підручника?
Застосуйте свої знання й уміння
- 2. Складіть схему «Класифікація солей».
- 3. Порівняйте: а) хімічні властивості; б) способи добування середніх і кислих солей. Відповідь оформте як діаграми Венна.
Творча майстерня
- 4. Створіть віртуальну колекцію середніх та кислих солей, презентуйте її перед учнівством 11 класу.
ГДЗ (відповіді) Хімія 11 клас Савчин М.М. §32 Кислі солі. Якісні реакції на деякі йони НОВА ПРОГРАМА 2019 РОКУ » Допомога учням
Інші завдання дивись тут…
Вправа 1 Назвіть солі за їхніми формулами: Mg3(PO4)2 — магній ортофосфат, NaHSO4 — натрій гірогенсульфат, FeCl3 — ферум (III) хлорид, K2HPO4 — калій гідрогенортофосфат, NH4NO3 — амоній нітроген, Ca(H2PO4)2 — кальцій дигідрогенортофосфат, (NH4)2SO4 — амоній сульфат, NaHCO3 — натрій гідргенкарбонат, MgHPO4 — магній гідрогенортофосфат, K2SiO3 — калій силікат, Na2CO3 — натрій карбонат
Вправа 2 Допишіть праві частини рівнянь реакцій, доберіть коефіцієнти:
а) NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
б) K2HPO4 + KOH = K3PO4 + H2O
в) Mg3(PO4)2 + 3H2SO4 = 3MgSO4 + 2H3PO4
г) K3РО4 + 3AgNO3 = 3KNO3 + Ag3PO4↓
Вправа 3 Складіть рівняння реакцій за наведеною схемою:
Na2CO3 → CO2 → CaCO3 → CaCl2 → Ca3(PO4)2 → CaНРО4
↓↑
NaHCO3 → Na2CO3
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
Ca3(PO4)2 + Н3РО4 = 3CaНРО4
Na2CO3 + H2CO3 = 2NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
Вправа 4 Крізь розчин кальцій гідроксиду масою 22,2 г пропустили карбон (ІV) оксид до повної взаємодії. Утворився кальцій карбонат масою 25 г. Обчисліть відносний вихід продукту реакції.
Відомо: m(Ca(OH)2)=22,2 г, mпракт.(CaCO3)=25 г
Знайти: η-?
Розв’язування
I спосіб
Записуємо рівняння реакції:
22,2 г х г
Ca(OH)2 + CO2 = CaCO3↓+ H2O
74 г 100 г
M(Ca(OH)2)=74 г/моль, маса 1 моль=74 г
M(CaCO3)=100 г/моль, маса 1 моль=100 г
х=mтеор.(CaCO3)=22,2 г • 100 г : 74 г=30 г
η=mпракт.(CaCO3):mтеор.(CaCO3)•100%=25 г : 30 г • 100%=83,33%
ІІ спосіб
M(Ca(OH)2)=74 г/моль
v(Ca(OH)2)=m(Ca(OH)2):M(Ca(OH)2)=22,2 г : 74 г/моль=0,3 моль
Записуємо рівняння реакції:
Ca(OH)2 + CO2 = CaCO3↓+ H2O
За рівнянням реакції v(Ca(OH)2):v(CaCO3)=1:1, тому
v(CaCO3)=v(Ca(OH)2)=0,3 моль
M(CaCO3)=100 г/моль
mтеор.(CaCO3)=v(CaCO3)•M(CaCO3)=0,3 моль•100 г/моль=30 г
η=mпракт.(CaCO3):mтеор.(CaCO3)•100%=25 г : 30 г • 100%=83,33%
Відповідь: 83,33%
Вправа 5 Натрій ортофосфат масою 40 г піддали дії аргентум (І) нітрату масою 102 г. Обчисліть масу аргентум (I) ортофосфату, що випав в осад.
Відомо: m(Na3PO4)=40 г, m(HNO3)=102 г
Знайти: m(Ag3PO4)-?
Розв’язування
І спосіб
Записуємо рівняння реакції:
x г 102 г у г
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
164 г 510 г 419 г
M(Na3PO4)=164 г/моль, маса 1 моль=164 г
M(AgNO3)=170 г/моль, маса 1 моль=170 г, а маса 2 моль=510 г
M(Ag3PO4)=419 г/моль, маса 1 моль=419 г
x=m(AgNO3)=102 г • 164 г : 510 г=32,8 г
Для повної взаємодії 102 г AgNO3 треба взяти Na3PO4 масою 32,8 г, а за умовою задачі його маса становить 40 г, отже, натрій ортофосфат — у надлишку, тому розрахунок здійснюємо за масою аргентум (I) нітратом.
у=m(Ag3PO4)=102 г • 419 г : 510 г=83,8 г
ІІ спосіб
M(Na3PO4)=164 г/моль, M(AgNO3)=170 г/моль
v(Na3PO4)=m(Na3PO4):M(Na3PO4)=40 г : 164 г/моль=0,24 моль
v(AgNO3)=m(AgNO3):M(AgNO3)=102 г : 170 г/моль=0,6 моль
Записуємо рівняння реакції: Na3PO4+3AgNO3=Ag3PO4↓+3NaNO3
За рівнянням реакції 1 моль Na3PO4 реагує з 3 моль AgNO3, тоді з 1 моль AgNO3 прореагує утричі менша кількість речовини Na3PO4. Отже, з 0,6 моль AgNO3 прореагує 0,2 моль Na3PO4, але кількість речовини цієї солі становить 0,24 моль, отже, сіль взято в надлишку, тому розрахунок здійснюємо за даними аргентум (I) нітрату.
За рівнянням реакції v(AgNO3):v(Ag3PO4)=3:1, тому
v(Ag3PO4)=v(AgNO3):3=0,6 моль:3=0,2 моль
M(Ag3PO4)=419 г/моль
m(Ag3PO4)=v(Ag3PO4)•M(Ag3PO4)=0,2 моль•419 г/моль=83,8 г
Відповідь: 83,8 г
Вправа 6 На калій силікат масою 51,6 г подіяли сульфатною кислотою масою 42 г. Обчисліть масу й кількість речовини утвореної силікатної кислоти.
Відомо: m(K2SiO3)=51,6 г, m(H2SO4)=42 г
Знайти: m(H2SiO3)-?, v(H2SiO3)-?
Розв’язування
І спосіб
Записуємо рівняння реакції:
51,6 г x г у г
K2SiO3 + H2SO4 = K2SO4 + H2SiO3↓
154 г 98 г 78 г
M(K2SiO3)=154 г/моль, маса 1 моль=154 г
M(H2SO4)=98 г/моль, маса 1 моль=98 г
M(H2SiO3)=78 г/моль, маса 1 моль=78 г
x=m(H2SO4)=51,6 г • 98 г : 154 г=32,8 г
Для повної взаємодії 51,6 г K2SiO3 треба взяти H2SO4 масою 32,8 г, а за умовою задачі маса цієї кислоти становить 42 г, отже, сульфатна кислота — у надлишку, тому розрахунок здійснюємо за масою калій силікатом.
у=m(H2SiO3)=51,6 г • 78 г : 154 г=26 г
v(H2SiO3)=m(H2SiO3):M(H2SiO3)=26 г : 78 г/моль=0,33 моль
ІІ спосіб
M(K2SiO3)=154 г/моль, M(H2SO4)=98 г/моль
v(K2SiO3)=m(K2SiO3):M(K2SiO3)=51,6 г : 154 г/моль=0,33 моль
v(H2SO4)=m(H2SO4):M(H2SO4)=42 г : 98 г/моль=0,43 моль
Записуємо рівняння реакції: K2SiO3+H2SO4=K2SO4+H2SiO3↓
За рівнянням реакції 1 моль K2SiO3 реагує з 1 моль H2SO4. Отже, з 0,33 моль K2SiO3 прореагує 0,33 моль H2SO4, але кількість речовини цієї кислоти становить 0,43 моль, отже, її взято в надлишку, тому розрахунок здійснюємо за даними калій силікату.
За рівнянням реакції v(K2SiO3):v(H2SiO3)=1:1, тому
v(H2SiO3)=v(K2SiO3)=0,33 моль
M(H2SiO3)=78 г/моль
m(H2SiO3)=v(H2SiO3)•M(H2SiO3)=0,33 моль•78 г/моль=26 г
Відповідь: 26 г і 0,33 моль H2SiO3
Вправа 7 На амоній хлорид масою 12 г подіяли натрій гідроксидом та отримали натрій хлорид масою 11,7 г. Обчисліть кількість речовини, якій відповідає така маса натрій хлориду, та об’єм амоніаку (н.у.), що утвориться під час реакції.
Відомо: m(NH4Cl)=12 г, m(NaCl)=11,7 г
Знайти: v(NaCl)-?, V(NH3)-?
Розв’язування
Записуємо рівняння реакції:
x г 11,7 г у л
NH4Cl + NaOH = NaCl + NH3↑ + H2O
53,5 г 58,5 г 22,4 л
M(NH4Cl)=53,5 г/моль, маса 1 моль=53,5 г
M(NaCl)=58,5 г/моль, маса 1 моль=58,5 г
За н.у. 1 моль газу займає об’єм 22,4 л
x=v(NH4Cl)=11,7 г • 53,5 г : 58,5 г=10,7 г
Для утворення 11,7 г NaСl прореагувало HN4Сl масою 10,7 г, а за умовою задачі його маса становить 12 г, отже, амоній хлорид — у надлишку, тому розрахунок здійснюємо за масою cолі NaCl.
у=V(NH3)=11,7 г • 22,4 л : 58,5 г=4,48 л
v(NaCl)=m(NaCl):M(NaCl)=11,7 г : 58,5 г/моль=0,2 моль
Відповідь: 0,2 моль NaCl i 4,48 л NH3
Інші завдання дивись тут…
Хімічні властивості солей — доповідь
Солі слід розглядати у вигляді продукту взаємодії кислоти і підстави. В результаті можуть утворюватися:
нормальні (середні) – утворюються при достатньому для повного взаємодії кількості кислоти і підстави. Назви нормальних солей складаються з двох частин. На початку називається аніон (кислотний залишок), потім катіон. кислі – утворюються при надлишку кислоти і недостатній кількості лугу, тому що при цьому катіонів металу стає недостатньо для заміщення всіх катіонів водню, наявних в молекулі кислоти. У складі кислотних залишків даного виду солей ви завжди побачите водень. Кислі солі утворюються тільки багатоосновними кислотами і проявляють властивості як солей, так і кислот. У назвах кислих солей ставиться приставка гідро- до аниону. основні солі – утворюються при надлишку підстави і недостатній кількості кислоти, тому як в даному випадку аніонів кислотних залишків недостатньо для повного заміщення гидроксогрупп, наявних в підставі. основні солі в складі катіонів містять гидроксогрупп. Основні солі можливі для многокіслотних підстав, а для однокіслотних немає. Деякі основні солі здатні самостійно розкладатися, при цьому виділяючи воду, утворюючи оксосолі, що володіють властивостями основних солей. Назва основних солей будується наступним чином: до аниону додається приставка гідроксо-.
Типові реакції нормальних солей
З металами реагують добре. При цьому, більш активні метали витісняють менш активні з розчинів їх солей.
З кислотами, лугами та іншими солями реакції проходять до кінця, за умови утворення осаду, газу або малодіссоцііруемих з’єднань.
У реакціях солей з лугами утворюються такі речовини, як гідроксид нікелю (II) Ni (OH) 2 – осад; аміак Nh4 – газ; вода h3О – слабкий електроліт, малодіссоцііруемое з’єднання:
Солі реагують між собою, якщо утворюється осад або в разі утворення більш стійкого з’єднання.
Багато нормальні солі розкладаються при нагріванні з утворенням двох оксидів – кислотного і основного
Нітрати розкладаються іншим, відмінним від інших нормальних солей чином. При нагріванні нітрати лужних і лужноземельних металів виділяють кисень і перетворюються в нітрити:
Нітрати майже всіх інших металів розкладаються до оксидів:
Нітрати деяких важких металів (срібла, ртуті та ін) розкладаються при нагріванні до металів:
Типові реакції кислих солей
Вони вступають в усі ті реакції, в які вступають кислоти. З лугами реагують, якщо в складі кислої солі і луги є один і той же метал, то в результаті утворюється нормальна сіль.
Якщо ж луг містить інший метал, то утворюються подвійні солі.
Типові реакції основних солей
Дані солі вступають в ті ж реакції, що і підстави. З кислотами реагують, якщо в складі основної солі і кислоти є один і той же кислотний залишок, то в результаті утворюється нормальна сіль.
Якщо ж кислота містить інший кислотний залишок, то утворюються подвійні солі.
Комплексні солі – з’єднання, в вузлах кристалічної решітки якого містяться комплексні іони.