| 1. |
Меры предосторожности при работе с кислотами
Сложность: лёгкое |
1 |
| 2. |
Классификация кислот
Сложность: лёгкое |
1 |
3.
|
Расчёт массовой доли элемента в кислоте
Сложность: лёгкое |
1 |
| 4. |
Массовая доля растворённого вещества в растворе
Сложность: среднее |
2 |
5. |
Взаимодействие кислот с металлами
Сложность: среднее |
2 |
| 6. |
Взаимодействие кислот с основаниями
Сложность: среднее |
2 |
7.
|
Взаимодействие кислот с солями
Сложность: сложное |
3 |
| 8. |
Взаимодействие кислот со смесью металлов
Сложность: сложное |
3 |
9.
|
Вычисления, связанные со сливанием двух растворов
Сложность: сложное |
3 |
| 10. |
Получение кислот
Сложность: среднее |
2 |
11.
|
Свойства кислот
Сложность: среднее |
2 |
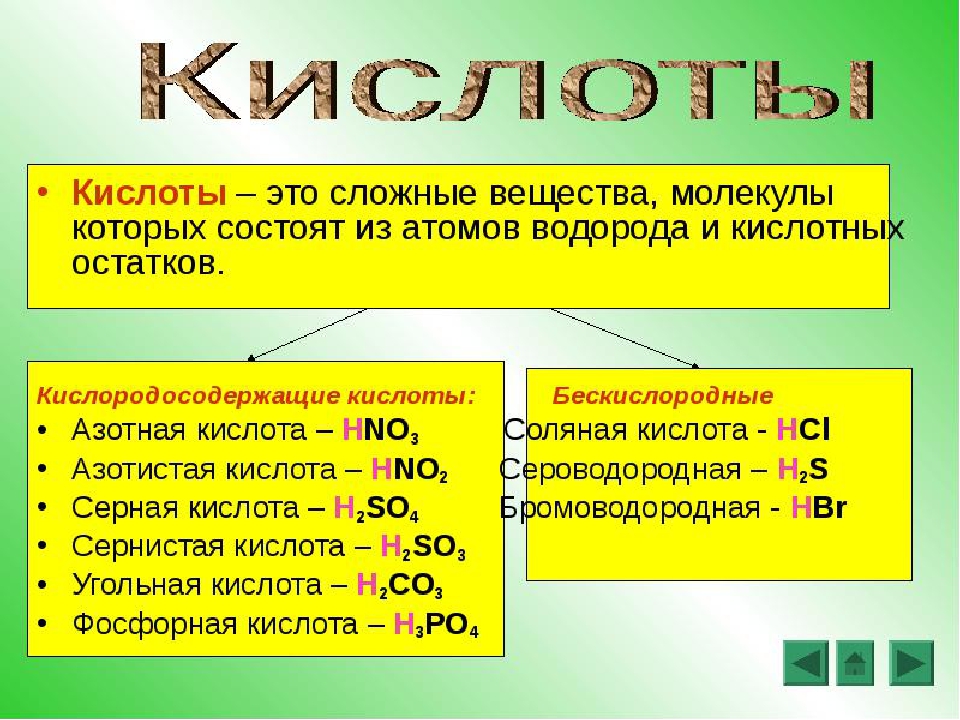
Общая характеристика кислот — урок. Химия, 8–9 класс.
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
Название кислоты | Формула кислоты | Формула кислотного остатка | Название соли этой кислоты |
| Фтороводородная (плавиковая) | HF | −F | Фторид |
| Хлороводородная (соляная) | HCl | −Cl | Хлорид |
| Бромоводородная | HBr | −Br | Бромид |
| Угольная | h3CO3 | =CO3 | Карбонат |
| Кремниевая | =SiO3 | Силикат | |
| Азотная | HNO3 | −NO3 | Нитрат |
Ортофосфорная (фосфорная) | h4PO4 | ≡PO4 | Ортофосфат (фосфат) |
| Серная | h3SO4 | =SO4 | Сульфат |
| Сернистая | h3SO3 | Сульфит | |
| Сероводородная | h3S | =S | Сульфид |
Представителем органических кислот является уксусная кислота Ch4COOH. Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Источники:
Оржековский П. А. и др. Химия: 8-й класс. — Москва: АСТ: Астрель, 2013.
Габриелян О. С. Химия: 8-й класс. — Москва: Дрофа, 2002.
ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ • Большая российская энциклопедия
В книжной версии
Том 6. Москва, 2006, стр. 151
Скопировать библиографическую ссылку:
Авторы: Ю. Н. Огибин
Н. Огибин
ВЫ́СШИЕ ЖИ́РНЫЕ КИСЛО́ТЫ (ВЖК), природные и синтетические алифатич. карбоновые кислоты, содержащие не менее 6 атомов углерода в молекуле. Существуют насыщенные, ненасыщенные В. ж. к., нормального и разветвлённого строения, одно- или многоосновные; кроме карбоксильной группы могут содержать др. функциональные группы.
Насыщенные ВЖК нормального строения состава C6–C9 – жидкости с резким запахом, состава С10 и выше – твёрдые вещества. Большинство разветвлённых и ненасыщенных ВЖК – вязкие жидкости, хорошо растворимы в органич. растворителях, нерастворимы в воде. ВЖК обладают химич. свойствами карбоновых кислот. В природе встречаются, как правило, линейные насыщенные и ненасыщенные кислоты с чётным числом атомов углерода состава C10–C22; в виде глицеридов они содержатся в животных жирах и растит. маслах, в виде эфиров высших жирных спиртов – в природных восках. К важнейшим природным ВЖК относятся стеариновая С17Н35СООН, олеиновая С 17Н33СООН, рицинолевая С17Н32(ОН)СООН, а также участвующие в биосинтезе простагландинов – линолевая С17Н29СООН, линоленовая С17Н27СООН и арахидоновая С19Н31СООН кислоты (см. Незаменимые жирные кислоты).
маслах, в виде эфиров высших жирных спиртов – в природных восках. К важнейшим природным ВЖК относятся стеариновая С17Н35СООН, олеиновая С 17Н33СООН, рицинолевая С17Н32(ОН)СООН, а также участвующие в биосинтезе простагландинов – линолевая С17Н29СООН, линоленовая С17Н27СООН и арахидоновая С19Н31СООН кислоты (см. Незаменимые жирные кислоты).
Природные ВЖК получают гидролизом жиров и растит. масел; синтетич. ВЖК – окислением альдегидов и алканов, гидрокарбоксилированием алкенов. Применяют ВЖК в произ-ве моющих средств, свечей, смазочных, лакокрасочных, текстильно-вспомогат. материалов, ингредиентов для резинотехнич. изделий, искусств. кожи, эмульгаторов латексов и каучуков, присадок к ракетному и дизельному топливам, для синтеза алифатич. аминов и амидов и др.
аминов и амидов и др.
Сериал «Во все тяжкие»: сколько в нем реальной науки?
Автор фото, AMC
Подпись к фото,Уолт Уитман, учитель химии и наркобарон
Известный американский телесериал Breaking Bad («Во все тяжкие») вступил в заключительную фазу — с 11 августа выходят в свет последние восемь эпизодов. Его обожатели строят сейчас предположения, чем закончится история школьного учителя из американской глубинки, который сделался сначала изготовителем метамфитамина, а затем главой преступной группировки. Но вот химика доктора Джонатана Хэйра интересует совсем другой вопрос — насколько достоверна научная подоплека этого незаурядного телеповествования.
«Химию нужно уважать», — говорит главный герой фильма Уолтер Уайт. Он в прошлом блестящий химик, которому по семейным обстоятельствам пришлось оставить научную карьеру и стать учителем химии в заурядной средней школе в городе Альбукерке в штате Нью-Мексико.
Обнаружив, что он болен неоперабельным раком легких, он решает обеспечить семью после своей смерти и принимается за изготовление опаснейшего наркотического средства — метамфетамина — в партнерстве со своим бывшим учеником Джесси Пинкманом.
Хотя отношения между ними поначалу настороженные, и Джесси весьма раздражает учительский тон Уолта, вскоре он убеждается, что его бывший учитель способен производить кристаллы метамфетамина высочайшего качества.
Уолт не может удержаться от учительского соблазна и превращает процесс изготовления или «варки» мефамфетамина в увлекательные уроки химии.
Насколько научно достоверными являются его уроки?
Голубые кристаллы
Изготовляемые Уолтом в походной лаборатории, укрытой в трейлере, кристаллы имеют необычный голубой оттенок и отличаются невероятной чистотой. Это увлекательная подробность, но обычно цвет кристалла не свидетельствует о его химической чистоте. Примеси в минералах типа кварца могут делать их розовыми или фиолетовыми (аметист), но обычно цвет является результатом взаимодействия электронов вещества с видимым светом и не является показателем беспримесности.
Примеси в минералах типа кварца могут делать их розовыми или фиолетовыми (аметист), но обычно цвет является результатом взаимодействия электронов вещества с видимым светом и не является показателем беспримесности.
Фосфиновый газ
Автор фото, AMC
В одной из первых сцен телесериала Уолт оказывается в своей передвижной лаборатории, укрытой в пустыне Нью-Мексико, под дулами пистолетов двух гангстеров. Он на ходу приходит к мысли покончить с ними, бросив порошок красного фосфора в колбу с кипятком. Уолту удается выскочить из автофургона и запереть в нем гангстеров, которые гибнут от образовавшегося в результате реакции фосфинового газа.
Красный фосфор может реагировать с водородом, но не с горячей водой. Так что это не очень правдоподобно с научной точки зрения. Правда, белый фосфор может дать такую реакцию, но только в сочетании с гидроксидом натрия, широко распространенном в быту. Но об этом Уолт ничего не рассказывает Джесси.
Ванна для растворения трупов
Автор фото, AMC
На самом деле от газа гибнет только один из гангстеров. Уолт убивает другого, но теперь ему надо избавиться от трупа. В жуткой сцене Джесси наполняет ванну фтористоводородной кислотой, чтобы растворить в ней тело. Эта кислота, которая еще называется плавиковой, обладает необычными химическими свойствами. Она растворяет стекло и хранить ее приходится в пластиковых емкостях.
Это очень едкая кислота, но ее едкость определяется ее химическими свойствами, а не концентрацией, как говорится в фильме. К сожалению, Джесси не следует настойчивыми указаниям Уолта о приобретении пластиковой бочки, а просто сливает кислоту в обычную чугунную эмалевую ванну. В результате кислота не только растворяет труп, но проедает чугун и бетонное перекрытие, и остатки ванны обрушиваются в подвал.
Самопальная батарея
В другом эпизоде Уолт и Джесс занимаются «варкой» метамфетамина в пустыне, но когда настает время возвращаться, оказывается, что аккумулятор древнего автофургона безнадежно разрядился и мотор не завести. Уолт изготовляет из подручных средств — кислоты, металлических обломков и проводов — новую самодельную батарею и объясняет попутно химическую сторону вопроса Джесси. Если металлическую пару поместить в кислотный раствор или даже электролит типа морской воды, возникает электродвижущая сила.
Уолт изготовляет из подручных средств — кислоты, металлических обломков и проводов — новую самодельную батарею и объясняет попутно химическую сторону вопроса Джесси. Если металлическую пару поместить в кислотный раствор или даже электролит типа морской воды, возникает электродвижущая сила.
Все, кому в детстве делали ртутные пломбы, знают о странном ощущении, которое возникает, если взять в рот кусочек алюминиевой фольги. Это классический пример из урока электрохимии. Слюна выполняет роль электролита, так как является слабой кислотой. Объяснения Уолта вполне правдоподобны, но, к сожалению, изготовленная им батарея не могла дать тока достаточной силы, чтобы провернуть стартер.
Гремучая ртуть
Автор фото, AMC
Еще один эпизод — в нем Уолт решает раз и навсегда покончить с гангстером и убийцей Туко. Он приходит к нему в контору и предлагает ему порцию кристаллов метамфетамина, но при этом требует немедленной оплаты. На самом деле пластиковый мешок с наркотиком, врученный им Туко, содержит кристаллы гремучей ртути. Уолт бросает его на пол и раздается мощный взрыв. Мы видим, как Уолт покидает пылающий дом с мешком денег в руках. Реально ли всё это? Может ли небольшое количество этого вещества произвести такой взрыв?
На самом деле пластиковый мешок с наркотиком, врученный им Туко, содержит кристаллы гремучей ртути. Уолт бросает его на пол и раздается мощный взрыв. Мы видим, как Уолт покидает пылающий дом с мешком денег в руках. Реально ли всё это? Может ли небольшое количество этого вещества произвести такой взрыв?
Гремучая ртуть или фульминат ртути действительно является весьма неустойчивым и взрывоопасным соединением, и в школьной химической лаборатории его можно изготовить без особого труда.
Но уже кристаллы с размерами более 3-5 мм являются крайне неустойчивыми и могут в любой момент взорваться. Пластиковый мешок, который Уолт вручает Туко, по виду содержит граммов 200 крупных кристаллов гремучей ртути. Такое количество должно взрываться от малейшего сотрясения, и у Уолта не было бы ни малейшего шанса донести его до места. Правда, если бы ему это каким-то чудом удалось, взрыв был бы действительно крайне мощным.
Термитная смесь
Уолт и Джесси выжигают замок в стальной двери, чтобы пробраться на склад с химикатами. Уолт рассказывает Джесси, что для этого он применил термитный заряд. Термит представляет собой смесь оксида железа с порошком алюминия или другого металла с высокой реактивной способностью. Температура их реакции обычно очень высока и термитная смесь широко используется при сварке железнодорожных рельсов, например, или при вскрытии сейфов. С научной точки зрения с этим эпизодом всё в порядке.
Уолт рассказывает Джесси, что для этого он применил термитный заряд. Термит представляет собой смесь оксида железа с порошком алюминия или другого металла с высокой реактивной способностью. Температура их реакции обычно очень высока и термитная смесь широко используется при сварке железнодорожных рельсов, например, или при вскрытии сейфов. С научной точки зрения с этим эпизодом всё в порядке.
Seite nicht gefunden — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С точки зрения теории электролитической диссоциации кислоты это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43
(третья
ступень).
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернистая кислота,
H3AsO3 мышьяковистая
кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO хлорноватистая кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная
название
кислоты,
записываем
сначала
водород, а затем
кислотообразующий
элемент. Степень окисления
водорода в
кислотах
всегда +1. Степень
окисления
элемента
отрицательная.
Она равна
номеру
группы ПСЭ (в
которой
находится
элемент)
минус восемь.
Степень окисления
водорода в
кислотах
всегда +1. Степень
окисления
элемента
отрицательная.
Она равна
номеру
группы ПСЭ (в
которой
находится
элемент)
минус восемь.
Например: сероводородная кислота элемент сера, расположен в шестой группе ПСЭ. 6 — 8 = -2. Степень окисления серы 2. Записываем символы водорода и серы Н+S-2, т.к. молекула электронейтральна, то формула кислоты будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например:
метафосфорная
кислота
кислотообразующий
элемент
фосфор.
Суффикс н показывает,
что он имеет
максимальную
степень
окисления,
фосфор в
пятой группе
ПСЭ,
следовательно,
максимальная
степень
окисления +5,
она
сохраняется
и в оксиде
фосфора Р2+5О5-2.
Приставка
мета
говорит о
том, что воды
в кислоте
минимальное
количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O → H6P2O8 → 2H3PO4 ортофосфорная кислота.
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие
2. Бескислородные
Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %) 2. Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые
2. Нерастворимые
Растворимые
2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение соответствующего оксида в воде:
P2O5 + 3H2O → 2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом. Кислоты
имеют кислый
вкус.
Кислоты
имеют кислый
вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
Активные | Средней активности | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
Активные | Средней
актив. | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1. Взаимодействие
кислотного
оксида
Взаимодействие
кислотного
оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3 и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку. Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в
фарфоровую
чашку 10 см3 2
моль/дм3 раствора гидроксида
натрия.
Добавить 12
капли
фенолфталеина,
чтобы
окраска
стала
малиновой,
что подтверждает
наличие
щелочи в
растворе. Затем
в пробирку по
каплям
добавлять
раствор
соляной
кислоты, до
обесцвечивания
раствора.
Выпарить
содержимое
чашки и
убедиться,
что
образовалась
соль.
Написать
уравнение реакции.
Люди химии — Ведомости&
Старейший в мире и единственный в России ресурсный центр технологий переработки фосфатного сырья Научно-исследовательский институт по удобрениям и инсектофунгицидам (НИУИФ) им. Я. В. Самойлова после присоединения к группе «ФосАгро» превратился в перспективный центр разработок для минерально-химической отрасли. В институте исследуют качество выпускаемых удобрений, работают над оптимизацией технологического процесса и проектируют новые заводы «до последнего болта». Молодые и самые заслуженные ученые-химики, работающие в институте, объясняют, как оказались в профессии и чем занимаются сегодня
директор по промышленной технологии НИУИФ, кандидат технических наук
/Евгений Разумный / Ведомости
Диссертация 2014 г. «Разработка технологии диаммонийфосфата из неконцентрированной экстракционной фосфорной кислоты с использованием барабанного гранулятора-сушилки»
«НИУИФ создал науку об удобрениях (российскую, по крайней мере) и внес большой вклад в мировую науку: в 1919 г. об удобрениях понятие было нулевое. Но НИУИФ создал не только науку. Уникальная миссия института в том, что науку и индустрию, в которой эти знания должны применяться, НИУИФ создавал параллельно. Наш институт – самый прикладной из академических. Благодаря институту промышленность минеральных удобрений и кислот Советского Союза была самой мощной в Европе, входила в пятерку мировых и остается такой и сегодня.
об удобрениях понятие было нулевое. Но НИУИФ создал не только науку. Уникальная миссия института в том, что науку и индустрию, в которой эти знания должны применяться, НИУИФ создавал параллельно. Наш институт – самый прикладной из академических. Благодаря институту промышленность минеральных удобрений и кислот Советского Союза была самой мощной в Европе, входила в пятерку мировых и остается такой и сегодня.
Сейчас будущее химии смещается в сторону экологии, наилучших доступных технологий. Устойчивое развитие и зеленая химия становятся определяющими векторами. Поэтому для нас приоритетным направлением будут инновационные виды удобрений с регулируемой растворимостью, с ингибиторами, полным набором макро- и микроэлементов, не содержащие вредных примесей (кадмий, свинец, мышьяк, ртуть, 6-валентный хром и т. д.). Такие удобрения уже сейчас «ФосАгро» производит из уникального сырья – хибинского апатита. Такие удобрения даже в экстремальные годы, сильно увлажненные или засушливые, за счет биомодификации обеспечивают высокую урожайность. Сейчас наш институт отрабатывает технологию производства удобрений с регулируемой скоростью растворения. А еще мы делаем опытно-промышленную установку по производству умных удобрений».
Сейчас наш институт отрабатывает технологию производства удобрений с регулируемой скоростью растворения. А еще мы делаем опытно-промышленную установку по производству умных удобрений».
Дмитрий Юновидов,
руководитель группы экспресс-методов анализа и автоматизации технологических процессов, кандидат технических наук
/Евгений Разумный / Ведомости
Диссертация 2017 г. «Программно-аппаратный рентгенофлуоресцентно-оптический комплекс для анализа сложных фосфорсодержащих удобрений»
«Я окончил химический факультет МГУ, у меня есть экспертиза в физике и химии. Сейчас такое время, что нельзя заниматься чем-то одним, – открытия происходят на стыке наук.
Сейчас направление моей научной работы – поиск новых способов контроля качества продукции, я также работаю с современными физико-химическими экспресс-методами анализа. Для контроля мы используем оптический анализ (для изучения этого процесса была создана моя группа). Как это работает? На производстве мы ставим – условно – «фотокамеру», которая делает «фотографии» гранулированного продукта и определяет его физические свойства. В этой технологии задействованы методы машинного обучения. Это не искусственный интеллект (для наших задач он избыточен) – скорее продвинутая статистика. Мы наблюдаем, насколько качественный продукт производится в конкретное время. Если качество ухудшается, завод анализирует причины. Мы промежуточное звено между технологией, технологами и управлением контроля качества.
Как это работает? На производстве мы ставим – условно – «фотокамеру», которая делает «фотографии» гранулированного продукта и определяет его физические свойства. В этой технологии задействованы методы машинного обучения. Это не искусственный интеллект (для наших задач он избыточен) – скорее продвинутая статистика. Мы наблюдаем, насколько качественный продукт производится в конкретное время. Если качество ухудшается, завод анализирует причины. Мы промежуточное звено между технологией, технологами и управлением контроля качества.
Я пришел в химию благодаря семье: мои родители – инженеры и химики-технологи, занимались коксохимическим производством. Раньше химия представляла собой законченную науку с синтезом неизвестных веществ, с изучением реакций на высоком уровне. А сегодня появились методы и технологии, которые позволяют нам заглянуть внутрь реакций и понять, что все эти взаимодействия физические, электростатические. За последние 10 лет химия как наука стала более фундаментальной, ученые научились предсказывать поведение молекул и атомов, их соединения на основе физических законов. Качество и стандарты вышли на совершенно новый уровень: веяния зеленой химии привели к тому, что мы все больше учимся перерабатывать природные ресурсы так, чтобы не вредить при этом ни экологии, ни планете, ни себе. И развитие производств, технологическое совершенствование предприятий компании «ФосАгро» это подтверждают.
Качество и стандарты вышли на совершенно новый уровень: веяния зеленой химии привели к тому, что мы все больше учимся перерабатывать природные ресурсы так, чтобы не вредить при этом ни экологии, ни планете, ни себе. И развитие производств, технологическое совершенствование предприятий компании «ФосАгро» это подтверждают.
Марина Зеленова-Гюльалиева,
младший научный сотрудник отдела серной кислоты, соискатель кандидатской степени
/Евгений Разумный / Ведомости
«Я окончила Череповецкий государственный университет (ЧГУ) в 2015 г. и работаю над диссертацией «Исследование и разработка технологии производства жидкого сернистого ангидрида на основе серы и кислорода». Жидкий сернистый ангидрид применяется на целлюлозно-бумажном производстве. Небольшое количество используется как консервант в винодельческой промышленности и как реагент при производстве хлорсульфированного полиэтилена. Но в России это вещество не производят, только импортируют из Финляндии. Их технология засекречена. При этом потребность в этом веществе в России – 18 000 т в год. До конца 2019 г. в НИУИФ появится лабораторная установка для получения жидкого сернистого ангидрида. Результатов наших исследований на ней должно быть достаточно, чтобы спроектировать, построить и запустить промышленную установку примерно за три года.
Их технология засекречена. При этом потребность в этом веществе в России – 18 000 т в год. До конца 2019 г. в НИУИФ появится лабораторная установка для получения жидкого сернистого ангидрида. Результатов наших исследований на ней должно быть достаточно, чтобы спроектировать, построить и запустить промышленную установку примерно за три года.
Вообще, я в детстве мечтала быть певицей. Но в школе я поняла, что мне на химии интереснее, чем на других предметах, и к 9–10-му классу точно знала, куда буду поступать. Конечно, многое для этого сделала учительница. Например, мы с научной работой выступали в ЧГУ, когда я была в 10-м классе, и заняли 1-е место.
Основное достижение химии за последнее время – это новые технические решения, которые позволяют уменьшить количество выбросов в атмосферу при производстве серной кислоты. Основные выбросы диоксида серы дает цветная металлургия. Поэтому необходима утилизация диоксида серы, которая возможна путем получения серной кислоты из диоксида серы. Сейчас одна из металлургических компаний обратилась к нам для сотрудничества и решения этой проблемы. Я думаю, в ближайшие пять лет что-то точно в этом плане изменится».
Сейчас одна из металлургических компаний обратилась к нам для сотрудничества и решения этой проблемы. Я думаю, в ближайшие пять лет что-то точно в этом плане изменится».
Павел Федотов,
заместитель начальника отдела технологии удобрений и абсорбции, кандидат технических наук
/Евгений Разумный / Ведомости
Диссертация 2017 г. «Гибкая технология сложных серосодержащих фосфорно-калийных удобрений»
«Я окончил РХТУ им. Менделеева и восемь лет работаю в НИУИФ, пришел еще на 5-м курсе университета. Технология, описанная в моей диссертации, реализована в 2014 г. на предприятии «ФосАгро» в Волхове. Это сложное фосфорно-калийное удобрение, уникальный продукт в виде однородных по химическому составу гранул, больше такого не выпускают нигде в мире. Другие страны выпускают аналоги в виде сухих тукосмесей. В основном это удобрение применяют для бобовых культур, заказ изначально был из Бразилии, но потребители есть и в России, и в Европе.
В школе я хорошо учился, у меня было много вариантов для поступления. Но я написал ЕГЭ по химии на 100 баллов (это был второй год госэкзамена) и получил право поступать в химические вузы без дополнительных испытаний.
Но я написал ЕГЭ по химии на 100 баллов (это был второй год госэкзамена) и получил право поступать в химические вузы без дополнительных испытаний.
На работе каждый день я руковожу отделом, сам лабораторные исследования уже не веду. Организую, помогаю в написании отчетов и выводов. Задачи нашего отдела – разработка технологий новых продуктов и модернизация существующих. В принципе, все наши технологии мы изначально пытаемся сделать более зелеными и экологичными, они все практически безотходные.
Инна Кочетова,
старший научный сотрудник отдела качества и стандартизации, кандидат технических наук
/Евгений Разумный / Ведомости
Диссертация 2019 г. «Влияние структуры гранул сложных NP, NPS и NPK-удобрений на их физико-химические свойства»
«Я окончила Московский институт тонких химических технологий им. Ломоносова (сейчас он называется РТУ МИРЭА). На работе я занимаюсь качеством продукции: мы боремся за улучшение потребительских свойств удобрений – прочности гранул, истираемости, слеживаемости, пылимости. Эти параметры важны потребителю, при транспортировке и внесении удобрений. Всеми этими характеристиками мы управляем на этапе производства. В основном я работаю в лаборатории, исследую физико-химические свойства удобрений. Занимаюсь сканирующей электронной микроскопией и микротомографией – эти методы позволяют исследовать внутреннюю структуру не только гранул удобрений, но и других объектов.
Эти параметры важны потребителю, при транспортировке и внесении удобрений. Всеми этими характеристиками мы управляем на этапе производства. В основном я работаю в лаборатории, исследую физико-химические свойства удобрений. Занимаюсь сканирующей электронной микроскопией и микротомографией – эти методы позволяют исследовать внутреннюю структуру не только гранул удобрений, но и других объектов.
В этом году мы занимаемся разработкой ГОСТа «Экологически чистая продукция», который регламентирует требования к минеральным удобрениям по части токсичных элементов. Сейчас это очень важное направление, поскольку Европа ужесточила требования к ввозимым удобрениям. У «ФосАгро» есть в этом плане преимущество: очень хорошее сырье, фактически свободное от содержания токсичных элементов (кадмия, свинца, ртути, мышьяка и др.).
В школе я хотела стать врачом, но, изучая химию и биологию, увлеклась именно химией. Она показалась мне более логичной, структурированной. Эта наука настолько широка, что любое направление внутри нее интересно.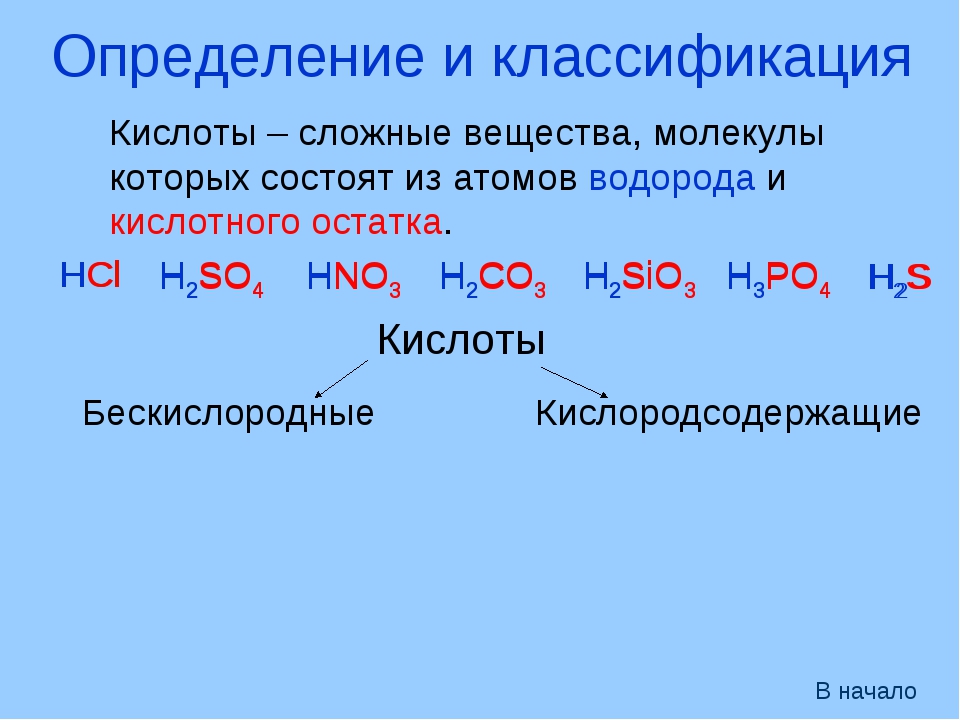 Лично для меня в современной химии больше всего интересны направления, которые связаны с обеспечением человечества продовольствием, со здоровьем человека и разработкой новых лекарств. Например, в 2000-х были сделаны открытия в области катализа, которые позволили более эффективно разделять правовращающие и левовращающие изомеры (оптически активные вещества. – «Ведомости&»), – это важно в фармацевтическом производстве, потому что позволяет получать более чистые реагенты и создавать более эффективные лекарства. На мой взгляд, это один из примеров наиболее значимых достижений за последнее время».
Лично для меня в современной химии больше всего интересны направления, которые связаны с обеспечением человечества продовольствием, со здоровьем человека и разработкой новых лекарств. Например, в 2000-х были сделаны открытия в области катализа, которые позволили более эффективно разделять правовращающие и левовращающие изомеры (оптически активные вещества. – «Ведомости&»), – это важно в фармацевтическом производстве, потому что позволяет получать более чистые реагенты и создавать более эффективные лекарства. На мой взгляд, это один из примеров наиболее значимых достижений за последнее время».
Илья Александренков,
научный сотрудник отдела экстракционной фосфорной кислоты
/Евгений Разумный / Ведомости
«Я окончил Санкт-Петербургский государственный технологический институт. В НИУИФ занимаюсь всеми видами работ: в лаборатории совместно с коллегами проводим пилотные тесты фосфатного сырья, на производстве проводим обследования и испытания существующих систем по производству фосфорной кислоты. Из последнего: мы нарабатывали образец фосфогипса одного из производств компании. Когда я пришел в НИУИФ, для меня самым интересным в первые полгода была именно работа в лаборатории, отработка настоящего технологического режима производства.
Из последнего: мы нарабатывали образец фосфогипса одного из производств компании. Когда я пришел в НИУИФ, для меня самым интересным в первые полгода была именно работа в лаборатории, отработка настоящего технологического режима производства.
Папа у меня офицер запаса, сейчас они вместе с мамой работают в АО «Апатит». После школы я отучился на металлурга, потом поступил в химический вуз. Профессию выбрал еще в школе: у нас была пожилая учительница, которая объясняла, что химия – это хорошо, понадобится везде, и я загорелся ее идеей. Меня впечатлил самый первый школьный химический опыт. Еще запомнилась «фараонова змея»: глюконат кальция поджигают, и за счет реакции окисления получается пористый продукт, похожий на маленькую змейку».
Вячеслав Колпаков,
старший научный сотрудник отдела технологии удобрений и абсорбции, соискатель кандидатской степени
«Я окончил РХТУ им. Д. И. Менделеева по специальности «технология неорганических веществ». Пишу диссертацию по теме «Получение NPK-удобрений путем совместной нейтрализации смеси азотной и фосфорной кислот». Результатом работы стали исходные данные для проектирования нового производства, которое соответствует требованиям Наилучших доступных технологий (НДТ). Оно позволит получать удобрения, которые более безопасны в плане терморазложения, с более высокой концентрацией питательных веществ, и при этом тратить меньше энергии и других ресурсов. С использованием полученных данных уже проведена модернизация одной из технологических систем цеха по производству минеральных удобрений АО «Апатит».
Пишу диссертацию по теме «Получение NPK-удобрений путем совместной нейтрализации смеси азотной и фосфорной кислот». Результатом работы стали исходные данные для проектирования нового производства, которое соответствует требованиям Наилучших доступных технологий (НДТ). Оно позволит получать удобрения, которые более безопасны в плане терморазложения, с более высокой концентрацией питательных веществ, и при этом тратить меньше энергии и других ресурсов. С использованием полученных данных уже проведена модернизация одной из технологических систем цеха по производству минеральных удобрений АО «Апатит».
Одной из самых интересных задач для меня за последнее время было получение водорастворимого моноаммонийфосфата (МАФ). Этот продукт очищен от примесей по сравнению с обычными продуктами, которые производятся на основе экстракционной фосфорной кислоты. Концентрация питательных веществ в нем повышена. Например, содержание азота (N) и фосфора (P2O5) в гранулированном аммофосе составляет 12 и 52%, а в водорастворимом МАФ – 12 и 61%. Основное достоинств водорастворимого МАФ – он полностью растворяется в воде, поэтому его используют в системах капельного орошения и гидропоники в тепличных хозяйствах. Новое производство этого удобрения планируется запустить на площадке Волховского филиала АО «Апатит» до 2023 г.».
Основное достоинств водорастворимого МАФ – он полностью растворяется в воде, поэтому его используют в системах капельного орошения и гидропоники в тепличных хозяйствах. Новое производство этого удобрения планируется запустить на площадке Волховского филиала АО «Апатит» до 2023 г.».
Алексей Морозков,
младший научный сотрудник комплексного отдела международных связей, научно-технической информации и промышленной экологии, соискатель кандидатской степени
/Евгений Разумный / Ведомости
«Я окончил Череповецкий государственный университет с отличием, моя специальность – «химическая технология неорганических веществ», окончил первый год аспирантуры. Готовлю диссертацию по теме «Разработка и усовершенствование способов переработки нефелинового концентрата на востребованные товарные продукты». Сейчас нефелиновый концентрат применяется в России только на двух заводах – это Пикалевский глиноземный завод и Ачинский глиноземный комбинат. Концентрат используют для производства глинозема, соды и галия технического.
Концентрат используют для производства глинозема, соды и галия технического.
В НИУИФ помимо учебы я занимаюсь договорной работой. Химией я увлекся в школе: в этой науке очень интересные и красивые методы решения задач с математической точки зрения. Теперь уже мне нравится практическое применение всех этих знаний, в том числе на производстве.
Многие открытия в химии сделаны давно, а применяться на практике стали только сейчас. Например, на череповецкой площадке «ФосАгро» создано производство карбамида. Это удобрение, но его применяют и в других сферах: и в солях для ванн, и как добавку в дизельное топливо. До 1998 г. лишний углекислый газ, который образовывался при производстве аммиака, выбрасывался в атмосферу. Теперь его перерабатывают в карбамид».
Наталья Николаева,
младший научный сотрудник отдела качества и стандартизации, соискатель кандидатской степени
/Евгений Разумный / Ведомости
«Я окончила РХТУ им. Д. И. Менделеева, факультет «Технология неорганических веществ и высокотемпературных материалов», сейчас окончила 4-й год аспирантуры. Тема моей научной работы – «Изучение физико-механических свойств минеральных удобрений при хранении и транспортировке». Значительная часть нашей продукции поставляется насыпью в страны Юго-Восточной Азии и Южной Америки. Мы исследуем, как температура и влажность окружающего воздуха влияют на сохранность продукта – слеживаемость и пылимость.
Д. И. Менделеева, факультет «Технология неорганических веществ и высокотемпературных материалов», сейчас окончила 4-й год аспирантуры. Тема моей научной работы – «Изучение физико-механических свойств минеральных удобрений при хранении и транспортировке». Значительная часть нашей продукции поставляется насыпью в страны Юго-Восточной Азии и Южной Америки. Мы исследуем, как температура и влажность окружающего воздуха влияют на сохранность продукта – слеживаемость и пылимость.
Мои родители – химики, они работают на химическом предприятии по производству соды. После школы я поступила в химико-технологический техникум в Стерлитамаке, а потом – в РХТУ им. Д. И. Менделеева в Москве. После окончания университета по рекомендации кафедры пришла работать в НИУИФ – как раз в тот момент, когда институт переезжал из Москвы в Череповец в 2015 г.
Больше всего мне понравилась моя первая работа в институте, когда я продолжила исследование, которое начала моя предшественница. После переезда в Череповец мы с коллегами завершили разработку методики, которая позволяет очень точно оценить эффективность обеспыливающих добавок. Сейчас в лаборатории с ее помощью мы подбираем наиболее эффективные кондиционирующие добавки для обработки гранул удобрений».
Сейчас в лаборатории с ее помощью мы подбираем наиболее эффективные кондиционирующие добавки для обработки гранул удобрений».
Юлия Кульпина,
научный сотрудник отдела экстракционной фосфорной кислоты
/Евгений Разумный / Ведомости
«Я окончила Ивановский государственный химико-технологический университет и работаю в НИУИФ два года, планирую поступать в аспирантуру.
Наш отдел сотрудничает как с российскими, так и с зарубежными заказчиками. Мы проводим лабораторные исследования, участвуем в разработке новых методик, анализируем сырье, проводим опыты с полупродуктами и продуктами, участвуем в промышленных испытаниях на площадках «ФосАгро».
Очень люблю работать с микроскопом. Через окуляр микроскопа мелкая песчинка превращается в целый мир. Я была очень любознательным ребенком, родители думали, что я буду биологом. А когда в школе началась химия, она стала моим любимым предметом, и вопросов, куда поступать, не возникло. При этом, честно говоря, в школе химию преподавали слабовато. Поэтому на 1-м курсе университета мне было немного сложнее, чем однокурсникам, учившимся в профильных классах школы. Но в итоге я окончила университет с красным дипломом.
При этом, честно говоря, в школе химию преподавали слабовато. Поэтому на 1-м курсе университета мне было немного сложнее, чем однокурсникам, учившимся в профильных классах школы. Но в итоге я окончила университет с красным дипломом.
Большое впечатление оставила первая работа на установке, это были испытания нового сырья для производства экстракционной фосфорной кислоты: в лаборатории мы воспроизвели основные стадии производства. Я работала с аналитической частью, и нужно было достаточно быстро делать анализы. Я очень переживала, потому что с одним анализом нужно было уложиться в 20 минут, иначе процесс у моих коллег мог нарушиться и восстанавливать его было бы достаточно долго. Я чувствовала груз ответственности. Но все прошло успешно, и теперь это один из моих любимых анализов. Сейчас, когда уже прошло много испытаний, первые вспоминаю с улыбкой».
Определение и примеры в химии
Кислота — это химическое соединение, которое отдает протоны или ионы водорода и / или принимает электроны. Большинство кислот содержат связанный атом водорода, который может высвобождаться (диссоциировать) с образованием катиона и аниона в воде. Чем выше концентрация ионов водорода, производимых кислотой, тем выше ее кислотность и ниже pH раствора.
Большинство кислот содержат связанный атом водорода, который может высвобождаться (диссоциировать) с образованием катиона и аниона в воде. Чем выше концентрация ионов водорода, производимых кислотой, тем выше ее кислотность и ниже pH раствора.
Слово acidus происходит от латинских слов acidus или acere , которые означают «кислый», поскольку одна из характеристик кислот в воде — кислый вкус (напр.г., уксус или лимонный сок).
В этой таблице представлен обзор основных свойств кислот по сравнению с основаниями.
| Обзор кислотных и основных свойств | ||
|---|---|---|
| Имущество | Кислота | База |
| pH | менее 7 | больше 7 |
| лакмусовая бумага | от синего к красному | не меняет лакмусовую бумажку, но может вернуть кислотную (красную) бумагу обратно в синюю |
| вкус | кислый (e. г., уксус) г., уксус) | горькое или мыльное (например, пищевая сода) |
| запах | ощущение жжения | часто без запаха (исключение — аммиак) |
| текстура | липкий | скользкая |
| реактивность | реагирует с металлами с образованием газообразного водорода | реагирует с несколькими жирами и маслами |
Кислоты Аррениуса, Бренстеда-Лоури и Льюиса
Есть разные способы определения кислот.Под «кислотой» обычно подразумевается кислота Аррениуса или Бренстеда-Лоури. Кислоту Льюиса обычно называют «кислотой Льюиса». Причина различий в определениях заключается в том, что эти разные кислоты не включают один и тот же набор молекул:
- Кислота Аррениуса : Согласно этому определению кислота — это вещество, которое увеличивает концентрацию ионов гидроксония (H 3 O + ) при добавлении в воду. Вы также можете рассмотреть возможность увеличения концентрации иона водорода (H + ) в качестве альтернативы.

- Кислота Бренстеда-Лоури : Согласно этому определению кислота — это материал, способный действовать как донор протонов. Это менее ограничительное определение, потому что растворители, кроме воды, не исключаются. По существу, любое соединение, которое может быть депротонировано, представляет собой кислоту Бренстеда-Лоури, включая обычные кислоты, а также амины и спирт. Это наиболее широко используемое определение кислоты.
- Кислота Льюиса : Кислота Льюиса — это соединение, которое может принимать электронную пару с образованием ковалентной связи.Согласно этому определению, некоторые соединения, не содержащие водорода, квалифицируются как кислоты, включая трихлорид алюминия и трифторид бора.
Примеры кислот
Это примеры типов кислот и конкретных кислот:
- Аррениусовая кислота
- Кислота монопротоновая
- Кислота Льюиса
- Кислота соляная
- Серная кислота
- Плавиковая кислота
- Уксусная кислота
- Желудочная кислота (содержащая соляную кислоту)
- Уксус (содержащий уксусную кислоту)
- Лимонная кислота (содержится в цитрусовых)
Сильные и слабые кислоты
Кислоты можно определить как сильные или слабые в зависимости от того, насколько полно они диссоциируют на ионы в воде. Сильная кислота, такая как соляная кислота, полностью диссоциирует на ионы в воде. Слабая кислота только частично диссоциирует на ионы, поэтому раствор содержит воду, ионы и кислоту (например, уксусную кислоту).
Сильная кислота, такая как соляная кислота, полностью диссоциирует на ионы в воде. Слабая кислота только частично диссоциирует на ионы, поэтому раствор содержит воду, ионы и кислоту (например, уксусную кислоту).
Узнать больше
Смотри: В чем разница между кислотами и основаниями?
нуклеиновых кислот | Определение, функции, структура и типы
Нуклеиновая кислота , химическое соединение природного происхождения, способное расщепляться с образованием фосфорной кислоты, сахаров и смеси органических оснований (пуринов и пиримидинов).Нуклеиновые кислоты являются основными молекулами клетки, несущими информацию, и, управляя процессом синтеза белка, они определяют унаследованные характеристики каждого живого существа. Двумя основными классами нуклеиновых кислот являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). ДНК — это главный план жизни и генетический материал всех свободноживущих организмов и большинства вирусов. РНК — это генетический материал некоторых вирусов, но она также присутствует во всех живых клетках, где играет важную роль в определенных процессах, таких как создание белков.
РНК — это генетический материал некоторых вирусов, но она также присутствует во всех живых клетках, где играет важную роль в определенных процессах, таких как создание белков.
Популярные вопросы
Что такое нуклеиновые кислоты?
Нуклеиновые кислоты — это природные химические соединения, которые служат в клетках в качестве основных молекул, несущих информацию. Они играют особенно важную роль в управлении синтезом белка. Двумя основными классами нуклеиновых кислот являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК).
Какова основная структура нуклеиновой кислоты?
Нуклеиновые кислоты — это длинные цепочечные молекулы, состоящие из ряда почти идентичных строительных блоков, называемых нуклеотидами.Каждый нуклеотид состоит из азотсодержащего ароматического основания, присоединенного к пентозному (пятиуглеродному) сахару, которое, в свою очередь, присоединено к фосфатной группе.
Какие азотсодержащие основания встречаются в нуклеиновых кислотах?
Каждая нуклеиновая кислота содержит четыре из пяти возможных азотсодержащих оснований: аденин (A), гуанин (G), цитозин (C), тимин (T) и урацил (U).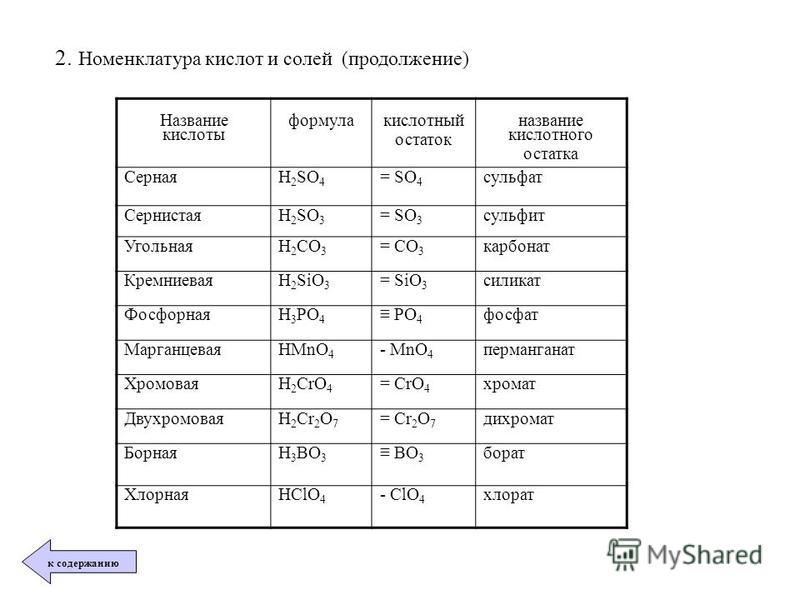 A и G классифицируются как пурины, а C, T и U называются пиримидинами. Все нуклеиновые кислоты содержат основания A, C и G; Однако T находится только в ДНК, а U — в РНК.
A и G классифицируются как пурины, а C, T и U называются пиримидинами. Все нуклеиновые кислоты содержат основания A, C и G; Однако T находится только в ДНК, а U — в РНК.
Когда были открыты нуклеиновые кислоты?
В этой статье рассматривается химия нуклеиновых кислот, описываются структуры и свойства, которые позволяют им служить передатчиками генетической информации. Для обсуждения генетического кода см. Наследственность , а для обсуждения роли нуклеиновых кислот в синтезе белка см. Метаболизм .
Нуклеотиды: строительные блоки нуклеиновых кислот
Основная структура
Нуклеиновые кислоты — это полинуклеотиды, то есть длинные цепочечные молекулы, состоящие из ряда почти идентичных строительных блоков, называемых нуклеотидами.Каждый нуклеотид состоит из азотсодержащего ароматического основания, присоединенного к пентозному (пятиуглеродному) сахару, которое, в свою очередь, присоединено к фосфатной группе. Каждая нуклеиновая кислота содержит четыре из пяти возможных азотсодержащих оснований: аденин (A), гуанин (G), цитозин (C), тимин (T) и урацил (U). A и G классифицируются как пурины, а C, T и U вместе называются пиримидинами. Все нуклеиновые кислоты содержат основания A, C и G; Однако T находится только в ДНК, а U — в РНК. Пентозный сахар в ДНК (2′-дезоксирибоза) отличается от сахара в РНК (рибоза) отсутствием гидроксильной группы (OH) на 2′-атоме углерода сахарного кольца.Без присоединенной фосфатной группы сахар, присоединенный к одному из оснований, известен как нуклеозид. Фосфатная группа соединяет последовательные остатки сахара, соединяя 5′-гидроксильную группу одного сахара с 3′-гидроксильной группой следующего сахара в цепи. Эти нуклеозидные связи называются фосфодиэфирными связями и одинаковы в РНК и ДНК.
A и G классифицируются как пурины, а C, T и U вместе называются пиримидинами. Все нуклеиновые кислоты содержат основания A, C и G; Однако T находится только в ДНК, а U — в РНК. Пентозный сахар в ДНК (2′-дезоксирибоза) отличается от сахара в РНК (рибоза) отсутствием гидроксильной группы (OH) на 2′-атоме углерода сахарного кольца.Без присоединенной фосфатной группы сахар, присоединенный к одному из оснований, известен как нуклеозид. Фосфатная группа соединяет последовательные остатки сахара, соединяя 5′-гидроксильную группу одного сахара с 3′-гидроксильной группой следующего сахара в цепи. Эти нуклеозидные связи называются фосфодиэфирными связями и одинаковы в РНК и ДНК.
Нуклеотиды синтезируются из легкодоступных предшественников в клетке. Рибозофосфатная часть пуриновых и пиримидиновых нуклеотидов синтезируется из глюкозы через пентозофосфатный путь.Сначала синтезируется пиримидиновое кольцо с шестью атомами, которое затем присоединяется к рибозофосфату. Два кольца в пуринах синтезируются, будучи присоединенными к фосфату рибозы во время сборки нуклеозидов аденина или гуанина. В обоих случаях конечный продукт представляет собой нуклеотид, несущий фосфат, связанный с 5′-атомом углерода на сахаре. Наконец, специальный фермент, называемый киназой, добавляет две фосфатные группы, используя аденозинтрифосфат (АТФ) в качестве донора фосфата, с образованием рибонуклеозидтрифосфата, непосредственного предшественника РНК.В случае ДНК 2′-гидроксильная группа удаляется из рибонуклеозиддифосфата с образованием дезоксирибонуклеозиддифосфата. Дополнительная фосфатная группа из АТФ затем добавляется другой киназой с образованием дезоксирибонуклеозидтрифосфата, непосредственного предшественника ДНК.
В обоих случаях конечный продукт представляет собой нуклеотид, несущий фосфат, связанный с 5′-атомом углерода на сахаре. Наконец, специальный фермент, называемый киназой, добавляет две фосфатные группы, используя аденозинтрифосфат (АТФ) в качестве донора фосфата, с образованием рибонуклеозидтрифосфата, непосредственного предшественника РНК.В случае ДНК 2′-гидроксильная группа удаляется из рибонуклеозиддифосфата с образованием дезоксирибонуклеозиддифосфата. Дополнительная фосфатная группа из АТФ затем добавляется другой киназой с образованием дезоксирибонуклеозидтрифосфата, непосредственного предшественника ДНК.
Во время нормального клеточного метаболизма РНК постоянно производится и расщепляется. Остатки пурина и пиримидина повторно используются несколькими путями восстановления для создания большего количества генетического материала.Пурин спасается в форме соответствующего нуклеотида, тогда как пиримидин спасается как нуклеозид.
Что такое кислоты и основания?
Что такое кислоты и основания?
Хотя я уже говорил вам, что кислоты и основания не сложно понять, у меня плохие новости: для описания кислот и оснований используется не одно, а три общих определения: кислоты и основания Аррениуса, кислоты Бренстеда-Лоури. и основания, и кислоты и основания Льюиса. Хотя это звучит так, будто вам придется узнать о кислотах и основаниях трижды, хорошая новость заключается в том, что для многих практических целей эти три определения примерно эквивалентны.
Аррениусовские кислоты и основания
Еще в конце 1800-х наш старый друг Сванте Аррениус придумал определения кислот и оснований, работая над проблемами кинетики.
Согласно Аррениусу, кислоты — это соединения, которые распадаются в воде с выделением ионов гидроксония (H + ). Типичным примером кислоты Аррениуса является соляная кислота (HCl):
Формулы кислот обычно начинаются с водорода, хотя органические кислоты являются заметным исключением. Названия и формулы некоторых распространенных кислот приведены в таблице ниже:
Названия и формулы некоторых распространенных кислот приведены в таблице ниже:
| Название кислоты | Формула |
|---|---|
| соляная кислота | HCl |
| азотная кислота | HNO 3 |
| фосфорная кислота | H 3 PO 4 |
| серная кислота | H 2 SO 4 |
| уксусная кислота | C 2 H 4 O 2 |
Основания Аррениуса определяются как соединения, которые вызывают образование гидроксид-иона при помещении в воду.Одним из примеров основания Аррениуса является гидроксид натрия (NaOH):
Основания обычно содержат «ОН» в своих формулах, хотя есть исключения. Например, аммиак (NH 3 ) не содержит гидроксид-ионы, но образует их, когда вступает в реакцию с водой:
Названия и формулы некоторых распространенных оснований приведены в следующей таблице:
| Название основания | Формула |
|---|---|
| аммиак | NH 3 |
| гидроксид калия | KOH |
| бикарбонат натрия | NaHCO 3 |
| карбонат натрия | Na 2 CO 3 |
| гидроксид натрия | NaOH |
Некоторые оксиды образуют кислоты или основания при добавлении воды.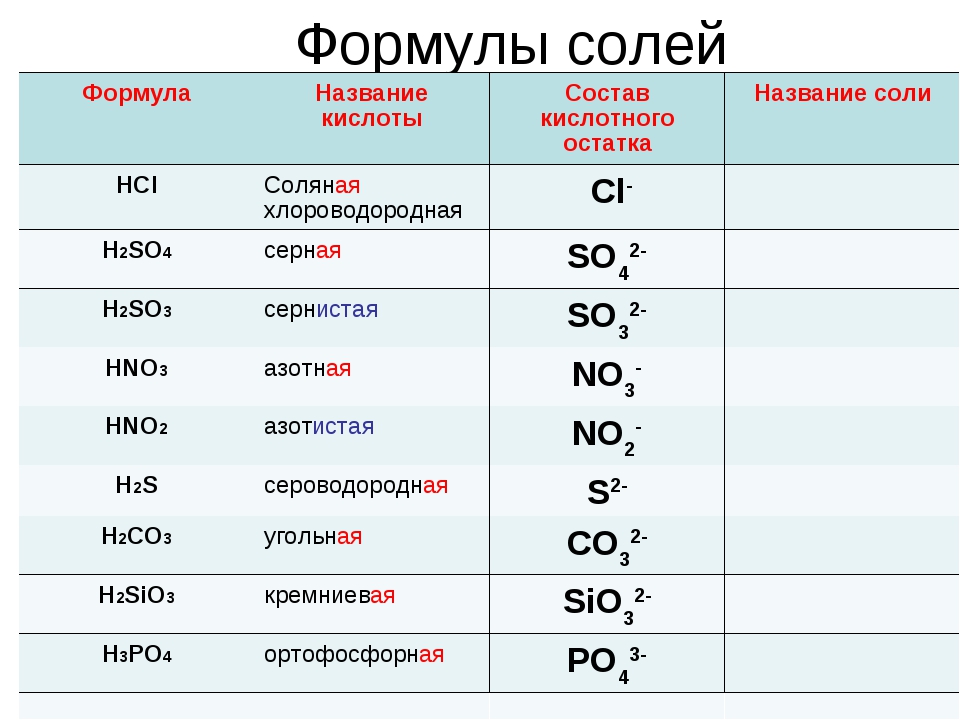 Поскольку эти соединения не содержат ионов H + или OH —, если они не вступают в реакцию с водой, их называют «ангидридами». Обычно оксиды неметаллов представляют собой ангидриды кислот (они образуют кислоту при помещении в воду), а оксиды металлов — ангидриды оснований (образующие основание при помещении в воду).
Поскольку эти соединения не содержат ионов H + или OH —, если они не вступают в реакцию с водой, их называют «ангидридами». Обычно оксиды неметаллов представляют собой ангидриды кислот (они образуют кислоту при помещении в воду), а оксиды металлов — ангидриды оснований (образующие основание при помещении в воду).
Кислоты и основания Брнстеда-Лоури
В начале 1900-х годов Йоханнесом Брнстедом и Томасом Лоури было предложено альтернативное определение кислот и оснований, чтобы учесть тот факт, что аммиак может нейтрализовать кислотность HCl, даже если воды нет. .Это явление показало им, что аммиак является основанием, даже когда нет воды для образования гидроксид-ионов.
Крот говорит
Есть много разных названий и формул, используемых для описания иона гидроксония. Хотя формула была показана ранее как «H + », иногда ее записывают как «H 3 O», потому что это ион, образующийся при соединении H + с водой. Другой распространенный способ обозначать ионы гидроксония — просто назвать их «протонами». Это название происходит от того факта, что H + представляет собой атом водорода (один протон и один электрон), который потерял свой электрон, оставив после себя только голый протон.
Другой распространенный способ обозначать ионы гидроксония — просто назвать их «протонами». Это название происходит от того факта, что H + представляет собой атом водорода (один протон и один электрон), который потерял свой электрон, оставив после себя только голый протон.
Кислота Брнстеда-Лоури определяется как соединение, которое отдает ионы гидроксония другому соединению, например, соляная кислота отдает ионы H + соединениям, с которыми она взаимодействует. Основания Брнстеда-Лоури — это соединения, которые могут принимать ионы гидроксония — когда аммиак получает ион гидроксония из HCl, он образует ион аммония.
Следующее уравнение представляет реакцию кислоты Брнстеда-Лоури с основанием Брнстеда-Лоури:
В этой реакции азотная кислота ведет себя как кислота, потому что она отдает протон аммиаку.Аммиак действует как основание, потому что он принимает протон из азотной кислоты.
Однако, если вы посмотрите на другую сторону уравнения, мы найдем ионы нитрата и аммония. Поскольку нитрат-ион может принимать протоны от иона аммония (с образованием HNO 3 ), нитрат-ион является очень слабым основанием Брнстеда-Лоури. Поскольку ион аммония может отдать дополнительный протон (в данном случае нитрат-ион), это кислота Брнстеда-Лоури.
Поскольку нитрат-ион может принимать протоны от иона аммония (с образованием HNO 3 ), нитрат-ион является очень слабым основанием Брнстеда-Лоури. Поскольку ион аммония может отдать дополнительный протон (в данном случае нитрат-ион), это кислота Брнстеда-Лоури.
Ион нитрата основан на молекуле азотной кислоты, поэтому мы говорим, что это конъюгат основания азотной кислоты.Аналогичным образом ион аммония представляет собой , сопряженную с кислотой аммиака. Вместе кислота с ее сопряженным основанием (например, HNO 3 и NO 3 —) или основание с сопряженной кислотой (например, NH 3 и NH 4 + ) относятся к в виде сопряженной пары кислота-основание.
Кислоты и основания Льюиса
В определении кислот и оснований Брнстеда-Лоури основание определяется как соединение, которое может принимать протон. Однако , как принимает протон?
Основания Брнстеда-Лоури имеют одну общую черту, заключающуюся в том, что они имеют неподеленную пару электронов. Когда ион гидроксония проходит мимо молекулы, иногда неподеленные пары протягивают руку и захватывают ее. Примером этого является случай, когда аммиак принимает протон в кислотном растворе:
Когда ион гидроксония проходит мимо молекулы, иногда неподеленные пары протягивают руку и захватывают ее. Примером этого является случай, когда аммиак принимает протон в кислотном растворе:
Рис. 23.1 Аммиак может захватить протон из азотной кислоты с помощью своей неподеленной пары электронов.
Один из способов взглянуть на этот процесс состоит в том, что атом аммиака отдает свою неподеленную пару протону. Поскольку неподеленные пары управляют этой химической реакцией, у нас есть новое определение кислотности и основности, которое называется «кислотность / основность по Льюису».«Основание Льюиса — это соединение, которое отдает электронную пару другому соединению (аммиак в нашем примере). Кислота Льюиса — это соединение, которое принимает электронную пару (ион H + в нашем примере).
Молекулярные значения
Основания Льюиса — это химические вещества, которые могут отдавать электронные пары. Кислоты Льюиса — химические вещества, которые могут их принимать. аммиак также может реагировать со многими другими соединениями.Например, аммиак может отдать свою неподеленную пару электронов BH 3 следующим образом:
Кислоты Льюиса — химические вещества, которые могут их принимать. аммиак также может реагировать со многими другими соединениями.Например, аммиак может отдать свою неподеленную пару электронов BH 3 следующим образом:
Рис. 23.2 Неподеленная пара на аммиаке присоединяется к BH 3 .
В этом процессе аммиак является основанием Льюиса, а BH 3 — кислотой Льюиса.
Как правило, определение кислот и оснований Льюиса является наиболее полезным, поскольку оно является наиболее всеобъемлющим из трех определений. Например, определение кислоты Брнстедом-Лоури включает HF, но не BH 3 , который не теряет протон при присоединении неподеленными парами на основании Льюиса.
Выдержка из Полное руководство для идиотов по химии 2003 Яна Гуча. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
Кислоты и основания (предыдущая версия) | Химия
Это более старая версия этого модуля.Доступна более новая версия модуля Acids and Bases I
На протяжении тысячелетий люди знали, что уксус, лимонный сок и многие другие продукты имеют кислый вкус. Однако только несколько сотен лет назад было обнаружено, почему эти вещества имеют кислый вкус — потому что все они являются кислотами. Термин «кислота» происходит от латинского термина acere , что означает «кислый». Хотя существует много разных определений кислот и оснований, в этом уроке мы познакомим вас с основами кислотно-щелочной химии.
В семнадцатом веке ирландский писатель и химик-любитель Роберт Бойль впервые назвал вещества кислотами или основаниями (он называл основания щелочами ) в соответствии со следующими характеристиками:
Кислоты кислый на вкус, вызывают коррозию.
Металлы меняют лакмус (краситель, извлекаемый из лишайников) на красный и становятся менее кислыми при смешивании с основаниями.
Основы кажутся скользкими, меняют лакмусовый оттенок и становятся менее щелочными при смешивании с кислотами.
Пока Бойль и другие пытались объяснить, почему кислоты и основания ведут себя как они это делают, первое разумное определение кислот и оснований не будет предложено до 200 лет спустя.
В конце 1800-х годов шведский ученый Сванте Аррениус предположил, что вода может растворять многие соединения, разделяя их на отдельные ионы.Аррениус предположил, что кислоты — это соединения, которые содержат водород и могут раствориться в воде, чтобы высвободить ионы водорода в раствор. Например, соляная кислота (HCl) растворяется в воде следующим образом:
| HCl | H 2 O → | H + ( водн. ) ) | + | Класс — ( водн. ) |
Аррениус определил основания как вещества, которые растворяются в воде, высвобождая гидроксид-ионы (ОН-) в раствор.Например, типичным основанием согласно определению Аррениуса является гидроксид натрия (NaOH):
| NaOH | H 2 O → | Na + ( водн. ) | + | ОН — ( водн. ) |
Определение кислот и оснований Аррениуса объясняет ряд вещей.Теория Аррениуса объясняет, почему все кислоты имеют схожие свойства друг с другом (и, наоборот, почему все основания одинаковы): потому что все кислоты выделяют H + в раствор (а все основания выделяют OH — ). Определение Аррениуса также объясняет наблюдение Бойля о том, что кислоты и основания противодействуют друг другу. Идея о том, что основание может ослабить кислоту и наоборот, называется нейтрализацией.
Определение Аррениуса также объясняет наблюдение Бойля о том, что кислоты и основания противодействуют друг другу. Идея о том, что основание может ослабить кислоту и наоборот, называется нейтрализацией.
Нейтрализация
Как видно из уравнений, кислоты выделяют H + в раствор и основы выпускают OH — .Если бы мы смешали кислота и основание вместе, ион H + будет объединяться с OH — ион для образования молекулы H 2 O, или обычная вода:
Реакция нейтрализации кислоты основанием всегда будет давать воду и соль, как показано ниже:
| Кислота | База | Вода | Соль | |||
|---|---|---|---|---|---|---|
| HCl | + | NaOH | → | H 2 O | + | NaCl |
| HBr | + | КОН | → | H 2 O | + | KBr |
Хотя Аррениус помог объяснить основы химии кислот и оснований, к сожалению, его теории имеют пределы. Например, определение Аррениуса не объясняет, почему некоторые вещества, такие как обычная пищевая сода (NaHCO 3 ), могут действовать как основание, даже если они не содержат гидроксид-ионы.
Например, определение Аррениуса не объясняет, почему некоторые вещества, такие как обычная пищевая сода (NaHCO 3 ), могут действовать как основание, даже если они не содержат гидроксид-ионы.
В 1923 году датский ученый Йоханнес Бронстед и англичанин Томас Лоури опубликовали независимые, но похожие статьи, уточняющие теорию Аррениуса. По словам Бренстеда, «… кислоты и основания — это вещества, способные соответственно отщеплять или поглощать ионы водорода.«Определение Брёнстеда-Лоури расширило аррениусовскую концепцию кислот и оснований.
Определение кислот Бренстеда-Лоури очень похоже на определение Аррениуса: любое вещество, которое может отдавать ион водорода, является кислотой (согласно определению Бренстеда, кислоты часто называют донорами протона , потому что ион H + , водород минус его электрон, является просто протоном.
Определение Бренстеда оснований , однако, сильно отличается от определения Аррениуса. Основание Бренстеда определяется как любое вещество, которое может принимать ион водорода. По сути, основание противоположно кислоте. NaOH и KOH, как мы видели выше, все равно будут считаться основаниями, потому что они могут принимать H + из кислоты с образованием воды. Однако определение Бренстеда-Лоури также объясняет, почему вещества, не содержащие OH — , могут действовать как основания. Пищевая сода (NaHCO 3 ), например, действует как основание, принимая ион водорода из кислоты, как показано ниже:
Основание Бренстеда определяется как любое вещество, которое может принимать ион водорода. По сути, основание противоположно кислоте. NaOH и KOH, как мы видели выше, все равно будут считаться основаниями, потому что они могут принимать H + из кислоты с образованием воды. Однако определение Бренстеда-Лоури также объясняет, почему вещества, не содержащие OH — , могут действовать как основания. Пищевая сода (NaHCO 3 ), например, действует как основание, принимая ион водорода из кислоты, как показано ниже:
| Кислота | База | Соль | ||||
| HCl | + | NaHCO 3 | → | H 2 CO 3 | + | NaCl |
В этом примере образовавшаяся угольная кислота (H 2 CO 3 ) подвергается быстрому разложению до воды и газообразного углекислого газа, и поэтому раствор пузырится, как газ CO 2 .
pH
Согласно определению Бренстеда-Лоури, как кислоты, так и основания связаны с концентрацией присутствующих ионов водорода. Кислоты увеличивают концентрацию ионов водорода, а основания уменьшают концентрацию ионов водорода (принимая их). Следовательно, кислотность или основность чего-либо может быть измерена по концентрации ионов водорода.
В 1909 году датский биохимик Сорен Соренсен изобрел шкалу pH для измерения кислотности. Шкала pH описывается формулой:
| pH = -log [H + ] |
|---|
| Примечание. Обычно для сокращения концентрации используются квадратные скобки, таким образом [H + ] = концентрация ионов водорода.При измерении pH [H + ] выражается в молях H + на литр раствора. |
Например, раствор с [H + ] = 1 x 10 -7 моль / литр имеет pH, равный 7 (более простой способ думать о pH — это то, что он равен экспоненте H + . концентрация, игнорируя знак минус). Шкала pH колеблется от 0 до 14. Вещества с pH от 0 до менее 7 являются кислотами (pH и [H + ] обратно пропорциональны — более низкий pH означает более высокий [H + ]).Вещества с pH от 7 до 14 являются основаниями (более высокий pH означает более низкий [H + ]). Прямо посередине, при pH = 7, находятся нейтральные вещества, например, чистая вода. Взаимосвязь между [H + ] и pH показана в таблице ниже вместе с некоторыми типичными примерами кислот и оснований в повседневной жизни.
концентрация, игнорируя знак минус). Шкала pH колеблется от 0 до 14. Вещества с pH от 0 до менее 7 являются кислотами (pH и [H + ] обратно пропорциональны — более низкий pH означает более высокий [H + ]).Вещества с pH от 7 до 14 являются основаниями (более высокий pH означает более низкий [H + ]). Прямо посередине, при pH = 7, находятся нейтральные вещества, например, чистая вода. Взаимосвязь между [H + ] и pH показана в таблице ниже вместе с некоторыми типичными примерами кислот и оснований в повседневной жизни.
| [H + ] | pH | Пример | |
|---|---|---|---|
| Кислоты | 1 Х 10 0 | 0 | HCl |
| 1 x 10 -1 | 1 | Желудочная кислота | |
| 1 x 10 -2 | 2 | Лимонный сок | |
| 1 x 10 -3 | 3 | Уксус | |
| 1 x 10 -4 | 4 | Сода | |
| 1 x 10 -5 | 5 | Дождевая вода | |
| 1 x 10 -6 | 6 | Молоко | |
| Нейтраль | 1 x 10 -7 | 7 | Чистая вода |
| Базы | 1 x 10 -8 | 8 | Яичные белки |
| 1 x 10 -9 | 9 | Сода пищевая | |
| 1 x 10 -10 | 10 | Тумс ® антацид | |
| 1 x 10 -11 | 11 | Аммиак | |
| 1 x 10 -12 | 12 | Минеральная известь — Ca (OH) 2 | |
| 1 x 10 -13 | 13 | Драно ® | |
| 1 x 10 -14 | 14 | NaOH |
Сводка
Поскольку кислоты и основания были впервые обозначены и описаны в 17 веке, их определение на протяжении веков уточнялось, чтобы отразить возросшее понимание их химических свойств.Этот модуль знакомит с основами кислотно-щелочной химии, включая реакции нейтрализации. Взаимосвязь между концентрацией ионов водорода [H + ] и pH показана вместе с обычными примерами кислот и оснований.
Кислоты и Основания
Определение Бронстеда-Лоури (1923) — Определение кислот и оснований с участием ионов водорода и гидроксида соответственно слишком ограничивает. Более широкое определение было предложено Бронстедом. и Лоури в 1923 году.Основной эффект определения — увеличение количество веществ, выступающих в роли оснований.
| Кислота | База | |
| Отдает ионы водорода | Принимает ионы водорода. | |
| HCl + | HOH —> | H 3 O + + Класс — |
| HOH + | NH 3 —> | NH 4 + + OH — |
Определение вещества как кислоты Бренстеда-Лоури или базу можно сделать только наблюдая за реакцией.В случае HOH это основание в первом случае и кислота в второй случай.
Ссылка на звонок анимация переноса иона аммония в воду — Джереми Харви, Бристольский университет, Англия
См. Пример на рисунке слева:
Чтобы определить, является ли вещество кислотой или основанием, посчитайте водороды в каждом веществе до и после реакции.Если количество атомов водорода уменьшилось, это вещество является кислота (отдает ионы водорода). Если количество водородов увеличено, что вещество является основой (принимает ионы водорода). Эти определения обычно применяются к реагентам на оставил.
Если смотреть в обратном порядке, новая кислота и основание могут быть идентифицированным. Вещества в правой части уравнения называются конъюгированной кислотой и конъюгированным основанием по сравнению с теми налево.
Также обратите внимание, что исходная кислота превращается в сопряженное основание после того, как реакция закончилась.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chem4Kids.com: Реакции: кислоты и основания
Каждая жидкость, которую вы видите, вероятно, будет иметь кислотных или основных признаков. Вода (H 2 O) может быть как кислотой, так и основанием, в зависимости от того, как на нее смотреть.Его можно рассматривать как кислоту в одних реакциях и основание в других. Вода может даже реагировать сама с собой с образованием кислот и оснований. Это происходит в очень небольших количествах, поэтому это никак не повлияет на ваши эксперименты. Это выглядит так:
2H 2 O -> H 2 O + H + + OH — -> H 3 O + + OH —
Видите, как переносился ион водорода?
В большинстве случаев положительные и отрицательные ионы в дистиллированной воде находятся в равных количествах и нейтрализуют друг друга.Большая часть воды, которую вы пьете из-под крана, содержит другие ионы. Эти специальные ионы в растворе делают что-то кислым или щелочным. В вашем теле есть небольшие соединения, называемые аминокислотами. Название говорит вам, что это кислоты. Во фруктах есть лимонная кислота. Это тоже кислота. А как насчет пищевой соды? Когда вы опускаете его в воду, получается базовый раствор. Уксус? Кислота.
Итак, что делает кислоту или основание? Химик Сванте Аррениус придумал способ определения кислот и оснований в 1887 году.Он видел, что когда вы помещаете молекулы в воду, иногда они распадаются и выделяют ион H + (водород). В других случаях вы обнаруживаете высвобождение иона OH — (гидроксид). Когда выделяется ион водорода, раствор становится кислым. Когда высвобождается гидроксид-ион, раствор становится щелочным. Эти два специальных иона определяют, смотрите ли вы на кислоту или на основание. Например, уксус еще называют уксусной кислотой. (Хорошо, это дает ответ.) Если вы посмотрите на его атомы, когда он находится в воде, вы увидите, что молекула CH 3 COOH расщепляется на CH 3 COO — и H + .Этот ион водорода является причиной того, что его называют кислотой. Химики используют слово « диссоциировано, » для описания распада соединения.
Ученые используют так называемую шкалу pH , чтобы измерить кислотность или щелочность жидкости. Хотя в растворе может быть много типов ионов, pH фокусируется на концентрациях ионов водорода (H + ) и гидроксид-ионов (OH — ). Шкала измеряет значения от 0 до 14. Дистиллированная вода — 7 (прямо посередине).Кислоты находятся от 0 до 7. Основания от 7 до 14. Большинство жидкостей, которые вы встречаете каждый день, имеют pH около 7. Они либо немного ниже, либо немного выше этой отметки. Когда вы начинаете смотреть на pH химических веществ, цифры могут доходить до крайности. Если вы когда-нибудь пойдете в химическую лабораторию, вы можете найти растворы с pH 1 и другие с pH 14. Есть также очень сильные кислоты со значением pH ниже 1, например, аккумуляторная кислота. Основания со значением pH около 14 включают очиститель стоков и гидроксид натрия (NaOH).Эти химикаты очень опасны.
Подробнее во второй части.
Подкисление океана в Арктике (видео Геологической службы США)
Полезные ссылки
Британская энциклопедия: КислотыБританская энциклопедия: Оснований
Википедия: Кислоты
Википедия: Базы
Encyclopedia.com: Кислоты
Энциклопедия.com: Базы
.


 Металлы меняют лакмус (краситель, извлекаемый из лишайников) на красный и становятся менее кислыми при смешивании с основаниями.
Металлы меняют лакмус (краситель, извлекаемый из лишайников) на красный и становятся менее кислыми при смешивании с основаниями.