Теории кислот и оснований — Википедия
Теории кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований — двух классов веществ, реагирующих между собой. Задача теории — предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениях кислот и оснований, характеристики их силы и, как следствие — в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.
Кислотно-основные взаимодействия чрезвычайно распространены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах.
На основе современной теории кислот и оснований разработаны такие разделы химических наук, как химия водных и неводных растворов электролитов, рН-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
Эволюция представлений о кислотно-основных взаимодействиях[править | править код]

Представления о кислотно-основных взаимодействиях относятся к числу фундаментальных химических положений. Понятия «кислота» и «основание» сформировались ещё в XVII веке, однако их содержание неоднократно пересматривалось и уточнялось. Так Р. Бойль считал, что кислоты — это тела, атомы которых имеют острые выступы (и, соответственно, острый вкус), а основания — поры (и вяжущий вкус). По его мнению, реакция нейтрализации сводилась к тому, что выступы кислоты входили в поры основания[источник не указан 2453 дня ].
Образная теория кислот и оснований была предложена Н. Лемери. В своем «Курсе химии» (1675) он попытался объяснить физические и химические свойства веществ на языке их формы и структуры. Согласно представлениям Лемери кислоты на своей поверхности имеют острые шипы, вызывающие на коже колющие ощущения. Основания, названные им щелочами, состоят из пористых тел. «Шипы» кислот проникают в «поры», при этом они ломаются или притупляются, и кислоты превращаются в нейтральные соли[1].
Научные представления о природе кислот и оснований начали формироваться в конце XVIII в. В работах А. Лавуазье кислотные свойства связывались с наличием в составе вещества атомов кислорода. Известные тогда минеральные и органические кислоты, действительно, содержали кислород. Эта гипотеза быстро показала свою несостоятельность, когда благодаря работам Г. Дэви и Ж. Гей-Люссака стал известен целый ряд кислот, не содержащих кислорода (например, галогеноводороды, синильные кислоты), в то время, как многие кислородсодержащие соединения не проявляют кислотных свойств.
С начала XIX века кислотами стали считать вещества, способные к взаимодействию с металлом с выделением водорода (Ю. Либих, 1839). Примерно в это же время Й. Берцелиус выдвинул идею, объясняющую кислотно-основные свойства веществ их электрической «дуалистической» природой. Так, к кислотам он относил электроотрицательные оксиды неметаллов и некоторых металлов (например, хрома, марганца и др.), а электроположительные оксиды металлов считал основаниями. Таким образом, кислотность или основность Берцелиусом рассматривается как функциональное, а не абсолютное свойство соединения. Берцелиус впервые сделал попытку количественной оценки и предсказания силы кислот и оснований[2].
C появлением теории электролитической диссоциации С. Аррениуса (1887) возникла возможность описания кислотно-основных свойств исходя из продуктов ионизации электролита. Благодаря работам В. Оствальда теория получила развитие для слабых электролитов.
В начале XX в. американские химики Г. Кэди, Э. Франклин и Ч. Краус создали теорию сольвосистем, распространившую положения теории Аррениуса — Оствальда на все растворители, способные к самодиссоциации.
В основу современных теорий кислот и оснований положены представления Й. Брёнстеда и Г. Льюиса. Имеются вполне успешные попытки создать обобщенные теории (М. Усанович, 1939), но они не находят широкого применения[3].
Определения. Кислота — вещество, способное реагировать с металлом с выделением водорода. Понятие «основание» в этой теории отсутствует.
Продукты реакции. При реакции кислоты с металлом образуется соль и водород.
Примеры. Кислота — HCl:
Реакция:
- Zn+2HCl→ZnCl2+h3↑{\displaystyle {\mathsf {Zn+2HCl\rightarrow ZnCl_{2}+H_{2}\uparrow }}}
Критерии протекания реакции. С сильными кислотами реагируют металлы, стоящие в ряду активностей левее водорода. Чем слабее кислота, тем более активный металл нужен для реакции между ними.
Количественные характеристики. Поскольку теория используется редко, количественные характеристики силы кислоты (а значит, и предсказания направления реакции) в рамках данной теории не разработаны.
Область применимости. Предсказание взаимодействия водородсодержащих веществ с металлами в любых растворителях.
Специфические черты. В соответствии с этой теорией этанол и аммиак являются слабыми кислотами, так как способны реагировать со щелочными металлами:
- 2C2H5OH+2Na→2C2H5ONa+h3{\displaystyle {\mathsf {2C_{2}H_{5}OH+2Na\rightarrow 2C_{2}H_{5}ONa+H_{2}}}}
- 2Nh4+2Na→2NaNh3+h3{\displaystyle {\mathsf {2NH_{3}+2Na\rightarrow 2NaNH_{2}+H_{2}}}}
Теория электролитической диссоциации Аррениуса — Оствальда[править | править код]
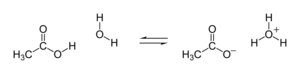
Определения. Кислоты — это вещества, образующие в водном растворе гидратированные катионы водорода Н+ (ионы гидроксония) и анионы кислотного остатка.
Основания — вещества, диссоциирующие в водном растворе с образованием катионов металла или аммония и гидроксид-анионов ОН−.
Соли — вещества, диссоциирующие с образованием катиона металла или аммония и аниона кислотного остатка.
Продукты реакции. В реакции кислоты с основанием (реакция нейтрализации) образуется соль и воды.
Примеры. Кислота — HCl (кислотный остаток Cl—):
- HCl+h3O⇄h4O++Cl−{\displaystyle {\mathsf {HCl+H_{2}O\rightleftarrows H_{3}O^{+}+Cl^{-}}}}
Основание — NaOH:
- NaOH⇄Na++OH−{\displaystyle {\mathsf {NaOH\rightleftarrows Na^{+}+OH^{-}}}}
Реакция нейтрализации (соль — NaCl):
- HCl+NaOH→NaCl+h3O{\displaystyle {\mathsf {HCl+NaOH\rightarrow NaCl+H_{2}O}}}
Критерии протекания реакции. Сильные кислоты реагируют с сильными основаниями. Чем слабее кислота, тем более сильное основание нужно для реакции.
Количественные характеристики. Сила кислоты и основания характеризуются их константами диссоциации Ka{\displaystyle {\mathsf {K_{a}}}} и Kb{\displaystyle {\mathsf {K_{b}}}}.
- Для кислоты HA
- HA⇄H++A−{\displaystyle {\mathsf {HA\rightleftarrows H^{+}+A^{-}}}}
- Ka=[H+][A−][HA]{\displaystyle {\mathsf {K_{a}={\frac {[H^{+}][A^{-}]}{[HA]}}}}}
- Для основания BOH
- BOH⇄B++OH−{\displaystyle {\mathsf {BOH\rightleftarrows B^{+}+OH^{-}}}}
- Kb=[B+][OH−][BOH]{\displaystyle {\mathsf {K_{b}={\frac {[B^{+}][OH^{-}]}{[BOH]}}}}}
Чтобы прошла реакция между кислотой и основанием, произведение их констант диссоциации должно быть больше, чем 10−14 (ионное произведение воды).
Область применимости. Она вполне удовлетворительно описывает реакции достаточно сильных кислот и оснований друг с другом и свойства их водных растворов. На основе представлений о степени и константе диссоциации было закреплено деление электролитов на сильные и слабые, введено понятие водородного показателя, распространение которого на щелочные среды требует, однако, дополнительных допущений (введения ионного произведения воды).
Теорию можно применять для описания гидролиза солей и реакции кислот и оснований с солями, однако при этом требуется весьма громоздкий аппарат — протонная теория (см. ниже) гораздо удобнее.
Применимость теории Аррениуса — Оствальда ограничивается водными растворами. кроме того, она не позволяет объяснить наличие основных свойств аммиака, фосфина и других соединений, не содержащих гидроксогрупп.
Протолитическая теория Брёнстеда — Лаури[править | править код]
![{\mathsf {K_{b}={\frac {[B^{+}][OH^{-}]}{[BOH]}}}}](/800/600/https/upload.wikimedia.org/wikipedia/commons/thumb/4/4d/LewisAcid.png/400px-LewisAcid.png)
Сравнение моделей
кислотно-основного взаимодействия
по Льюису и Брёнстеду
Протолитическая (протонная) теория кислот и оснований была предложена в 1923 году независимо друг от друга датским учёным Й. Брёнстедом и английским учёным Т. Лаури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии (А — кислота, В — основание):
- A→B+H+{\displaystyle {\mathsf {A\rightarrow B+H^{+}}}}
Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны (акцепторы). Кислоты и основания получили общее название протолитов.
Сущностью кислотно-основного взаимодействия является передача протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Брёнстедом сопряженными:
- A1+B2→A2+B1{\displaystyle {\mathsf {A_{1}+B_{2}\rightarrow A_{2}+B_{1}}}}
Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами выступает в роли основания:
- H++h3O→h4O+{\displaystyle {\mathsf {H^{+}+H_{2}O\rightarrow H_{3}O^{+}}}}
а реагируя с аммиаком — в роли кислоты:
- Nh4+h3O→Nh5++OH−{\displaystyle {\mathsf {NH_{3}+H_{2}O\rightarrow NH_{4}^{+}+OH^{-}}}}
Теория сольвосистем — расширение теории Аррениуса — Оствальда на другие ионные (в частности, протонные растворители). Предложена американскими химиками Г. Кэди, Э. Франклин и Ч. Краусом.
Определения. Ионный растворитель — растворитель, самодиссоциирующий на катион и анион. Катион при этом называется ионом лиония, а анион — ионом лиата. Протонный растворитель — растворитель, способный к автопротолизу, то есть передаче иона H+ от одной молекулы к другой:
- 2HL⇄h3L++L−{\displaystyle {\mathsf {2HL\rightleftarrows H_{2}L^{+}+L^{-}}}}
Это растворители, содержащие достаточно полярную связь с участием водорода и неподеленную электронную пару на каком-либо другом неметалле (чаще всего, азоте, кислороде или фторе).
Примечание: в данном определении «зашита» протонная теория, ибо автопротолиз есть кислотно-основная реакция по Брёнстеду — Лаури. В нём также «зашита» теория Льюиса, поскольку именно она объясняет причины образования ионов лиония.
Ион H2L+ при этом называется ионом лиония, а L— — ионом лиата.
Кислоты — это вещества, образующие в данном растворителе ион лиония.
Основания — вещества, образующие в данном растворителе ион лиата.
Соли — вещества, диссоциирующие в данном растворителе с образованием катиона и аниона, не являющихся лионием и лиатом.
Продукты реакции. В реакции кислоты с основанием (реакция нейтрализации образуется соль и растворитель.
Примеры.
Количественные характеристики и критерии протекания реакции. Силы кислот и оснований характеризуются их константой диссоциации. Константы диссоциации зависят от растворителя. Протонные растворители с высоким константами автодиссоциации («кислотные растворители», например HF) дифференцируют кислоты (в них кислоты становятся слабыми и различающимися по силе), но нивелируют основания (все основания становятся сильными, правращаясь в ион лиата). Протонные растворители с низкими константами автодиссоциации («основные растворители», например NH3) дифференцируют основания, но нивелируют кислоты (которые становятся сильными, превращаясь в лионий).
Реакция идёт от сильных кислот к слабым.
Область применимости. Позволяет предсказывать кислотно-основные реакции в любых растворителях. Управление кислотно-основными процессами при помощи растворителя. Расширяет на неводные растворы понятие водородного показателя (pH) как концентрацию ионов лиония. Описывает основные свойства веществ, не содержащих групп ОН.
Однако для многих задач теория слишком громоздкая.
Специфические черты Некоторые кислотно-основные реакции в этой теории могут встать «с ног на голову», например, в расплавленном KCl:
- KOH (кислота) + HCl (основание) = KCl (растворитель) + H2O (соль)
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены.
Примеры химических реакций между кислотами и основаниями Льюиса:
- AlCl3+Cl−→[AlCl4]−{\displaystyle {\mathsf {AlCl_{3}+Cl^{-}\rightarrow [AlCl_{4}]^{-}}}}
- BF3+F−→[BF4]−{\displaystyle {\mathsf {BF_{3}+F^{-}\rightarrow [BF_{4}]^{-}}}}
- PCl5+Cl−→[PCl6]−{\displaystyle {\mathsf {PCl_{5}+Cl^{-}\rightarrow [PCl_{6}]^{-}}}}
Наиболее общая теория кислот и оснований была сформулирована М. Усановичем в 1939 году. В основе теории лежит представление о том, что всякое кислотно-основное взаимодействие — это реакция солеобразования. Согласно этой теории «кислота — это частица, которая может отщеплять катионы, включая протон, или присоединять анионы, включая электрон. Основание — частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы» (формулировка 1964 г.). В отличие от Льюиса Усанович в основе понятий «кислота» и «основание» использует знак заряда частицы, а не строение электронной оболочки.
По Усановичу, в реакции гидролиза
- SO3+2h3O→h4O++HSO4−{\displaystyle {\mathsf {SO_{3}+2H_{2}O\rightarrow H_{3}O^{+}+HSO_{4}^{-}}}}
вода, отдавая анион OH—, является основанием, а триоксид серы, присоединяя этот анион — кислотой. Аналогично в реакции:
- SnCl4+2KCl→K2[SnCl6]{\displaystyle {\mathsf {SnCl_{4}+2KCl\rightarrow K_{2}[SnCl_{6}]}}}
тетрахлорид олова, присоединяющий анионы хлора, выступает в роли кислоты.
Таким образом, данная формулировка кислот и оснований позволяет отнести к кислотно-основным взаимодействиям и все окислительно-восстановительные реакции.
Теория Усановича фактически отменяет один из основополагающих принципов классической химии — представления о классах кислот и оснований: «кислоты и основания — это не классы соединений; кислотность и основность — это функции вещества. Будет ли вещество кислотой или основанием, зависит от партнера»[4].
К недостаткам теории Усановича относят её слишком общий характер и недостаточно чёткую определённость формулировки понятий «кислота» и «основание». К недостаткам относят также то обстоятельство, что она не описывает неионогенные кислотно-основные превращения. Наконец, она не позволяет делать количественные предсказания[5].
- Современные теории кислот и оснований: Учеб. пособие. — Новочеркасск: УПЦ Набла. — 2003. — 52 с.
- Геворкян А. А. Обобщенная теория кислот и оснований. Новое воззрение на реакционную способность атомов и молекул. — Гитутюн, 2006. — 158 с.
- Москва В. В. Понятие кислоты и основания в органической химии (недоступная ссылка) // Соросовский образовательный журнал. — 1996. — № 12. — с. 33—40.
- Фиалков А. Я. Не только в воде. — Л.: Химия, 1989.
- ↑ Аналитическая химия. Проблемы и подходы. — В 2 тт. / Под ред. Р. Кельнера. — М.: Мир, АСТ. — 2004.
- ↑ Джуа М. История химии. — М.: Мир, 1975. — 450 с.
- ↑ Угай Я. А. Общая и неорганическая химия. — М.: Высшая школа, 1997. — 527 с.
- ↑ Цит. по Кусаинова К. М. Нет ни кислот, ни оснований! Об одной полузабытой теории и её творце // Химия и жизнь. — 2004. — № 6. — С. 41—44.
- ↑ Танганов Б. Б. Химические методы анализа. — Улан-Удэ, 2005. — 550 с.
Кислотно-основные реакции — Википедия
Материал из Википедии — свободной энциклопедии
Кисло́тно-основны́е реа́кции — это химические реакции между кислотой и основанием[1]. Сопровождаются передачей протона[2].
При типичной кислотно-основной реакции происходит передача одного или нескольких ионов водорода H+ между частицами вещества. Эти частицы вещества могут быть как электрически нейтральными (то есть молекулами: воды H2O, уксусной кислоты CH3CO2H и т. п.), так и заряженными (то есть ионами: аммонием NH4+, гидроксид-ионом OH—, карбонат-ионом СО32− и т. п.)[3].
При этом в более общем случае в кислотно-основной реакции могут участвовать молекулы и ионы, имеющие кислотный характер, но не выделяющие ионов водорода (такие как хлорид алюминия AlCl3, ион серебра AG+)[3].
Идея о делении веществ на кислоты и основания почти так же стара, как химия. Термины кислота, основание и соль встречаются ещё в трудах средневековых алхимиков[3].
Первая попытка подвести теорию под поведение кислот была предпринята в конце XVII века Антуаном-Лораном Лавуазье[3].
В настоящее время существуют несколько самостоятельных теорий, по которым химические вещества делят на кислоты и основания: теория Аррениуса,, теория Брёнстеда — Лоури, теория Льюиса (которую позже развил Пирсон) и теория Усановича[4].
Соответственно, кислотно-основные реакции тоже можно рассматривать с позиций разных теорий.
Так, согласно теории Аррениуса они являются реакциями нейтрализации[5]. Наиболее же удобна для химиков протолитическая теория Брёнстеда — Лоури[4], согласно которой эти реакции представляют собой борьбу за протон[5].
Химические свойства кислот — 8 класс — Уроки химии — Классная комната
Рассмотрим важнейшие химические свойства кислот.1. Действие растворов кислот на индикаторы.Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ — индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый — тоже в красный цвет.
2. Взаимодействие кислот с основаниями.
Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
h3SO4 + Ca(OH)2 = CaSO4 + 2 h3O
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями — такими как NaOH и KOH:
h3SiO3 + 2 NaOH = Na2SiO3 + 2h3O
3. Взаимодействие кислот с основными оксидами.
Поскольку основные оксиды — ближайшие родственники оснований — с ними кислоты также вступают в реакции нейтрализации:
2 HCl + CaO = CaCl2 + h3O
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
4. Взаимодействие кислот с металлами.
Для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, ртуть и некоторые другие металлы с кислотами не реагируют. Такие металлы как натрий, кальций, цинк — напротив — реагируют очень активно с выделением газообразного водорода и большого количества тепла.
Активные металлы вытесняют водород из кислот. В этом легко убедиться на опыте. Возьмем для испытаний цинк Zn и медь Cu. Добавим соляную кислоту в пробирку с цинком – начинается реакция с выделением водорода.
Zn + 2HCl = ZnCl2 + h3 ↑
Цинк восстанавливает водород из кислот, в ряду напряжения он расположен левее водорода.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, h3, Cu, Hg, Ag, Au
Медь не реагирует с соляной кислотой: в ряду напряжения медь — правее водорода.
Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать с металлом. Под силой кислоты понимают ее способность отдавать ионы водорода H+.
Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
С другой стороны, такие сильные кислоты как серная или соляная (хлороводородная) способны реагировать со всеми металлами, стоящими в ряду активности металлов до водорода.
уровень1
В связи с этим существует еще одна классификация кислот — по силе.
Классификация кислот на сильные и слабые кислоты. В таблице в каждой из колонок сила кислот уменьшается сверху вниз.
Сильные кислоты Слабые кислоты
HI иодоводородная HF фтороводородная
HBr бромоводородная h4PO4 фосфорная
HCl хлороводородная h3SO3 сернистая
h3SO4 серная h3S сероводородная
HNO3 азотная h3CO3 угольная
h3SiO3 кремниевая
Следует помнить, что в реакциях металлов с некоторыми кислотами может ярко проявиться окислительная способность неметалла – кислотообразующего элемента. Так, при взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель — азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N+5, а не H+, как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа.
Cu + 4 HNO3 (конц.) = Cu (NO3)2 + 2 NO2 + 2 h3O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 h3O
8 K + 5 h3SO4(конц.) = 4 K2SO4 + h3S + 4 h3O
3 Zn + 4 h3SO4(конц.) = 3 ZnSO4 + S + 4 h3O
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами — серной кислотой и азотной кислотой.
Эти металлы — Al, Fe, Cr, Ni и некоторые другие — при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Продукты окисления, образующие прочные пленки, могут растворяться в водных растворах кислот, но нерастворимы в кислотах концентрированных.
Тест для обобщения свойств кислот. Уровень 2
Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.