Кислоты. Видеоурок. Химия 11 Класс
Тема: Основные классы неорганических соединений.
Урок: Кислоты
Кислоты – это вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными связями. Чем больше поляризована связь между атомом водорода, способным отщепляться, и электроотрицательным атомом (кислорода, серы или атомом галогена), то тем более эта связь склонна диссоциировать по гетеролитическому пути. А значит, тем больше в растворе будет катионов водорода и тем кислее будет среда. Большое значение имеет не только полярность, но и поляризуемость связи. Поляризуемость – это способность связи поляризоваться под действием определенных реагентов. Например, молекул воды.
Классификация кислот
Классификация кислот по содержанию атомов кислорода, по количеству атомов водорода, по растворимости и другим признакам. См. Табл. 1.
|
Признаки классификации |
Группы кислот |
Пример |
|
Наличие кислорода |
Кислородсодержащие |
Н2SO4, HNO3 |
|
Бескислородные |
Н2S, HCl |
|
|
Основность (число атомов водорода, способных замещаться на металл) |
Одноосновные |
HNO3 , HCl |
|
Двухосновные |
Н2S, Н2CO3 |
|
|
Трёхосновные |
H3PO4 |
|
|
Растворимость |
Растворимые |
Н2SO4, HNO3 |
|
Нерастворимы |
Н2SiO3 |
|
|
Летучесть |
Летучие |
HCl |
|
Нелетучие |
Н2SO4 |
|
|
Степень электролитической диссоциации |
Сильные |
Н2SO4, HNO3, HCl |
|
Слабые |
Н2S, Н2CO3 |
|
|
Стабильность |
Стабильные |
H3PO4, Н2SO4, HCl |
|
Нестабильные |
Н2CO3, Н2SO3 |
Табл. 1.
1.Реакция с металлами.
Металлы, расположенные в ряду напряжений металлов (Рис. 1.) до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑

Рис. 1.
С концентрированной азотной и серной кислотой реакции идут за счет анионного остатка. Водород не выделяется. Рис. 2.
Cu + 4HNO3(конц) = Cu (NO3)2 + 2NO2↑ + H2O
Cu + 2H2SO4(конц) = Cu SO4 + SO2↑ + H2O

Рис. 2
2. Реакция с основными и амфотерными оксидами с образованием соли и воды.
K2O+ HNO3 = KNO3 + H2O
Al2O3 + 6HCl = 2AlCl
3.Реакция с солями. Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок, поскольку образование нерастворимых соединений смещает равновесие вправо и делает её практически необратимой.
Н2SO4 + BaCl2 = BaSO4↓ +2 HCl
H2CO3 + BaCl2 = BaCO3↓ +2 HCl
4. Реагируют с основаниями и амфотерными гидроксидами.
KOН+ HNO3 = KNO3 + H2O
Al(OН)3 + 3HCl = AlCl3 + 3H2O
NaOH + HNO3 = NaNO3 + H2O
5. Обнаружение кислот при помощи кислотно-основных индикаторов.
В кислой среде лакмус приобретает красную окраску. Метиловый оранжевый – красную, а фенолфталеиновый – бесцветный.

Рис. 3
Основные способы получения кислот
1. Бескислородные кислоты можно получить из простых веществ.
H2 + Cl2 2HCl
2HCl
H2 + S  H2S
H2S
2. Кислородсодержащие кислоты можно получить гидратацией соответствующих кислотных оксидов.
N2O5 + H2O → 2HNO3
SO3 + H2O → H2SO4
3. Получение кислот вытеснением слабых кислот сильными, летучих – нелетучими, растворимых – нерастворимыми. Например, сильная соляная кислота вытесняет слабую уксусную из растворов их солей.
Сh4COONa + HCl = Ch4COOH + NaCl
NaСl (тв.) + H2SO4= NaНSO4 + HCl↑
4. Кислоты можно получить при гидролизе некоторых солей или галогенидов.
Al2 S3 +6 H2O → 2Al (OH)3↓+ 3H2S↑
PCl5 + H2O → H3PO4 + 5HCl

Рис. 4.
Существует большое количество теорий кислот и оснований. Одна из первых – это появившаяся в конце XVIII века благодаря Антуану Лавуазье (рис. 4), согласно которой кислотные свойства связывались с наличием в веществе кислорода. Именно благодаря этой теории появилось название элемента №8 (кислород – рождающий кислоты). Но эта гипотеза очень быстро доказала свою несостоятельность, когда стал известен целый ряд кислот, не содержащих кислород, например галогеноводородные кислоты.

Рис. 5.
Теория кислот и оснований Сванте Аррениуса (рис. 5). Она базируется на теории электролитической диссоциации. Согласно ей, кислоты – это вещества, образующие в водном растворе гидратированные ионы водорода и анионы кислотного остатка. А соответственно, основания – это вещества, диссоциирующие в водном растворе на катионы металла и анионы гидроксогруппы.
Теория Брёнстеда и Лоури. Согласно этой теории, кислоты – это молекулы или ионы, которые в данной реакции являются донорами протонов, а основания – это молекулы или ионы, которые принимают протоны, т. е. акцепторы.
В органической химии существует теория Льюиса (рис. 6). Кислота – это молекула или ион, имеющая вакантные валентные орбитали, вследствие чего они способны принимать электронные пары, например, ионы водорода, ионы металлов, некоторые оксиды, а также ряд солей. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонсодержащие кислоты рассматриваются, как частный случай класса кислот.

Рис. 6.
Основание по теории Льюиса – это молекула или ион, способные быть донорами электронных пар: все анионы, аммиак, амины, вода, спирты, галогены.
Пример реакции между кислотами и основаниями Льюиса.
AlCl3+ Cl— → Cl4—
Это взаимодействие лежит в основе галогенирования ароматических соединений.
Теория Усановича (Рис. 7). В этой теории кислота – это частица, которая способна отщеплять катионы или присоединять анионы. Соответственно, основание наоборот. Этой теорией пользуются очень редко, потому что она получилась слишком общей. Согласно ей, любые взаимодействия с участием ионов можно свести к кислотно-основным. А это не очень удобно.

Рис. 7.
Для количественной характеристики того, как кислота диссоциирует на ионы, кроме понятия степени электролитической диссоциации используют понятие константа диссоциации. Константа диссоциации – это вид константы равновесия, которая показывает склонность некоторого большого объекта (кислоты, соли или комплексного соединения) обратимо диссоциировать с образованием более маленьких объектов. Константа диссоциации определяется как произведение концентраций ионов в степени их стехиометрических коэффициентов, делённое на недиссоциированную форму.

В случае диссоциации вещества с многовалентными ионами, диссоциация происходит ступенчато. Для каждой ступени существует собственное значение константы диссоциации.
Пример диссоциации трехосновной борной кислоты H3BO3.
I ступень: Н3ВО3 ↔ Н+ + Н2ВО3—
I ступень: Н2ВО3— ↔ Н+ + НВО32-
I ступень: НВО32- ↔ Н+ + ВО33-
Выражение констант диссоциации по каждой из этих ступеней будет выглядеть так:


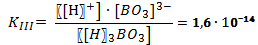
Из значения констант диссоциации делаем вывод, что многоосновные вещества в основном диссоциируют по первой ступени.
В организме человека большую роль играют три неорганических кислоты. Это – фосфорная кислота, угольная и соляная. Фосфорная кислота входит в состав буферных систем крови. Буферными называются такие растворы, которые при добавлении небольших количеств кислот или оснований изменяют свой водородный показатель рН. Эти системы нужны для того, чтобы поддерживать кислотность крови в определенном и довольно узком интервале. Остатки фосфорной кислоты входят в остатки многих биологически активных веществ, например нуклеиновых кислот и многих ферментов. Наши кости состоят из гидроксида фосфата кальция Сa10(PO4)6(OH)2 или гидроксиапатита кальция, а зубы включают в себя фторапатит кальция Сa10(PO4)6F2. Рис. 8.

Рис. 8.
Угольная кислота также входит в состав буферных систем крови. За счёт действия легких такие системы можно быстро и легко регулировать и можно варьировать количество углекислого газа в крови.
Соляная кислота содержится в желудочном соке. Она способствует денатурации и набуханию белков, что облегчает их последующее расщепление ферментами. Она создает кислую среду, необходимую для действия ферментов. Она ответственна за антибактериальную среду желудочного сока.
Подведение итога урока
В ходе урока были изучены такие неорганические соединения, как кислоты. Вы узнали о классификации кислот, их химических свойствах и методах получения.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик.ру (Источник).
Домашнее задание
1. №№2-4 (с. 187) Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
2. Как можно определить наличие кислоты в продуктах питания?
3. Как вы думаете, откуда произошло название муравьиной кислоты?
interneturok.ru
Сколько всего в химии кислот?
много, есть неорганические и органические
Например))))) ) Некоторые распространённые кислоты Неорганические (минеральные) кислоты Серная кислота Соляная кислота Ортофосфорная кислота Ортокарбоновая кислота Азотная кислота Борная кислота Сернистая кислота Сероводородная кислота Фтороводородная кислота Йодоводородная кислота Хлорноватистая кислота Хлорноватая кислота Хлористая кислота Хлорная кислота Азотистая кислота Бромоводородная кислота Кремниевая кислота Марганцовая кислота Угольная кислота Синильная кислота Плавиковая кислота Роданистоводородная кислота Тиосерная кислота Иодная кислота Иодноватая кислота Мышьяковая кислота Молибденовая кислота Органические кислоты Муравьиная кислота Уксусная кислота Лимонная кислота Молочная кислота Щавелевая кислота Масляная кислота Аскорбиновая кислота (витамин C) Салициловая кислота Лизергиновая кислота Дезоксирибонуклеиновая кислота (ДНК) Азелаиновая кислота Мочевая кислота Лауриновая кислота Винная кислота
Мадам Райса оказалась глупей вопроса.
touch.otvet.mail.ru
«Кислоты» — Яндекс.Знатоки
1 В каком из рядов указаны вещества, каждое из которых реагирует с водным раствором NaOH Be, AL(NO3)3, FE AL, ZnO, ZnCl2 BeO, BeCL2, Ca Al2O3, CuSO4, Cu 2 С каким из веществ реагирует соляная кислота P2O5 NO2 Cu Zn 3 Вкакой из приведенных пар вещества не реагируют между собой Ca(OH)2+Li2O h3SO4(конц)+h3S Ba(OH)2+NO2 Sr(OH)2+P2O5 4 Какой гидроксид не способен диссоциировать по типу кислоты Cr(OH)3 Mg(OH)2 Sn(OH)2 Pb(oh)2 5 Вкаком из рядов представлены металлы, каждый из которых проявляет амфотерные свойства Cu, Al, Ra Pb, Cr, Ba Sn, Cr, Sr Be, Zn, Al 6 Какую пару веществ нельзя использовать для практического получения гидроксида меди (2) в водном растворе (Ch4COO)2Cu+NaOH *? Cu(NO3)2+Sr(OH)2 CuCl2+KOH CuSO4+Ba(OH)2 7 Сила кислот в ряду HClO4—>HClO3—>HClO2—>HClO не изменяется увеличивается уменьшается изменяется немонотонно 8 Какая кислота может образовывать кислые соли сероводородная бромоводородная этановая акриловая 9 Какие из указанных кислот и оснований могут быть получены непосредственным растворение оксидов в воде а)r(OH)3 б)Ba(OH)2 в)h3SiO3 г)h3SO3 в,г б,в б,г а,б 10 Врезультате какой реакции образуется кислота FeSO4+KOH Ca(OH)2+Ca(HCO3)2 SO2+h3O CO2+MgO 11 Вкаком из рядов указаны формулы только двухосновных кислот плавиковая, уксусная, фосфористая фосфорная, кремниевая, серная сернистая, угольная, сероводородная фталевая, терефталевая, азотистая 12 Скаким веществом не взаимодействует гидроксид калия Cr(OH)3 Ch4COOH Ca(OH)2 Zn(OH)2 13 В каком из рядов приведены формулы оснований, каждое из которых при нагревании образует оксид Zn(OH)2, Cr(OH)3, Mg(OH)2 Fe(OH)3,Zn(OH)2, NaOH Ca(OH)2, Be(OH)2, KOH LiOH, Cu(OH)2, NaOH 14 Укажите азотный ангидрид N2O5 NO N2O3 NO2 15 Все вещества какого ряда реагируют с серной кислотой CrO3, Be(OH)2, Ca(PO4)2 Ba(OH)2, CaSO4, Ca(HSO4)2 AlO3, Fe(OH)3, N2O ZnO, KOH, Cl2O7 16 Укажите формулу кислоты, которой рне соответствует фосфорный ангидрид h5P2O7 h4PO4 h5P2O6 HPO3 17 Какая из кислот может образовать кислую соль Ch4COOH h4PO2 h4PO4 HCrO2 18 В каком из рядов указаны формулы только сильных кислот HBr, HNO3, h3SO4 Hl, h4PO4, HClO4 Hf, HC1, HBr HNO3, HNO2, Ch4COOH 19 Какой из гидроксидов не обладат амфотерными свойствами Be(OH)2 Zn(OH)2 Sn(OH)2 Mg(OH)2 20 Названия только бескислородных кислот указаны в ряду соляная, уксусная, угольная акриловая, кремниевая, циановодородная плавиковая, сероводородная, селеноводородная бромоводородная, метановая, борная
yandex.ru