Количество вещества Википедия
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы)[1]. Единица измерения количества вещества в Международной системе единиц (СИ) и в системе СГС — моль[2]. Без конкретизации объекта рассмотрения термин «количество вещества» не используют[K 1].
Применение[ | ]
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например, для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул в единицах «штука», их измеряют в молях. Фактическое количество единиц «штука» в 1 моле вещества называется числом Авогадро (NA = 6,02214076⋅1023 «штука»/моль[4]
).Количество вещества обозначается латинской n{\displaystyle n} (эн) и не рекомендуется обозначать греческой буквой ν{\displaystyle \nu } (ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент
Количество вещества
Чем больше атомов или молекул в макроскопическом теле, тем, очевидно, больше вещества содержится в нем. Число молекул в макроскопических телах огромно. Поэтому удобно указывать не абсолютное число атомов, а относительное.
Принято сравнивать число молекул или атомов в данном теле с числом атомов, содержащихся в углероде массой 12 г. Относительное число атомов или молекул в теле характеризуется особой физической величиной, называемой количеством вещества.
Количеством вещества v называют отношение числа молекул N
 (2.2.2)
(2.2.2)
* Если вещество состоит из отдельных атомов, не объединенных в молекулы, то здесь и в дальнейшем под числом молекул надо подразумевать число атомов.
Зная количество вещества v и число NA, мы тем самым знаем число молекул N в веществе. Количество вещества выражают в молях.
Моль — это количество вещества, содержащего столько же молекул, сколько атомов содержится в углероде массой 12 г.
Если количество вещества равно, например, 2,5 моль, то это означает, что число молекул в теле в 2,5 раза превышает число атомов в 12 г углерода, т. е. равно 2,5 NA.
Постоянная Авогадро
Число молекул или атомов в моле вещества называют постоянной Авогадро. Это название дано в честь итальянского ученого XIX в. А. Авогадро**.** А. Авогадро (1776—1856) — итальянский физик и химик; автор четырехтомного труда, который был первым руководством по молекулярной физике.
Согласно определению моля постоянная Авогадро одинакова для всех веществ. Она равна, в частности, числу атомов в моле углерода, т. е. в 12 г углерода.
Для вычисления постоянной Авогадро надо найти массу одного атома углерода (или любого другого атома). Грубую оценку массы можно сделать так, как это было выполнено для массы молекулы воды. Наиболее точные методы определения массы основаны на отклонении пучков ионов электромагнитным полем. Измерения дают для массы атома углерода т0С = 1,995·10-23 г. Отсюда постоянная Авогадро равна
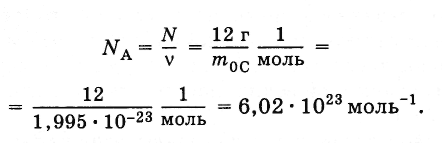
Наименование моль-1 указывает, что NA — число атомов любого вещества, взятого в количестве одного моля. Если количество вещества v = 2,5 моль, то число молекул в теле N = vNA = 1,5·1024.
Существует много других методов определения постоянной Авогадро, не связанных с нахождением масс атомов. Все они приводят к одним и тем же результатам. Постоянная Авогадро играет важнейшую роль во всей молекулярной физике и является универсальной постоянной.
Огромная величина постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры.
Молярная масса
Наряду с относительной молекулярной массой
Мr, в физике и химии широко используется понятие молярной массы М.Молярной массой называют массу вещества, взятого в количестве одного моля.
Согласно этому определению молярная масса равна произведению массы молекулы на постоянную Авогадро:
 (2.2.4)
(2.2.4)
Молярная масса простым образом связана с относительной молекулярной массой. Подставив в формулу (2.2.4) выражения т0 из (2.2.2) и NA из (2.2.3), получим:
 (2.2.5)
(2.2.5)
Например, молярная масса воды Н2О равна 18 г/моль, или 0,18 кг/моль, так как относительная молекулярная масса воды приближенно равна 18.
Масса m произвольного количества вещества v и молярная масса М связаны соотношением:
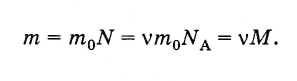 (2.2.6)
(2.2.6)
Так, масса 3 моль воды равна: m = 3 моль·0,018 кг/моль = 0,054 кг.
Используя формулы (2.2.6) и (2.2.2), можно получить формулу для числа молекул в теле в зависимости от массы тела m и молярной массы М:
 (2.2.7)
(2.2.7)
Нужно запомнить значение постоянной Авогадро: достаточно знать порядок величины 1023. Столько молекул содержится в 12 г углерода, в 18 г воды и т. д. Формулы (2.2.1), (2.2.2) и (2.2.4) дают определения новым физическим величинам: относительной молекулярной массе, количеству вещества и молярной массе. Вывести их нельзя, их надо просто запомнить. Остальные формулы можно вывести, и запоминать их необязательно.
Урок по химии на тему » Количество вещества. Молярная масса».
Тема 2. 8класс.
Урок 18 — 19
Тема урока. Количество вещества. Молярная масса.
Цели урока: 1.ввести понятие о количестве вещества и единицах его измерения: моль, ммоль, кмоль, молярная масса.
2.Дать представление о постоянной Авогадро.
3.Показать взаимосвязь массы, количества вещества и числа частиц и молярной массы.
Задачи урока: 1.Способствовать формированию мировоззренческих представлений учащихся о взаимосвязи разных свойств явлений окружающего мира.
2. Развивать умение учащихся устанавливать причинно-следственные связи, а также наблюдать, обобщать и делать выводы.
Основные термины:
Неметаллы – химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Моль – это такое количество любого вещества, которое содержит столько же структурных элементов, сколько атомов содержится в 12г. нуклида углерода-12.
ХОД УРОКА: 1.Организационная часть урока.
2. Изучение программного материала.
1. Количество вещества.
В химии (а также в физике и других естественных науках) приходиться иметь дело с большими количествами мельчайших частиц – с так называемыми структурными элементами материи (молекулами, атомами, ионами, электронами и др.).
Для того чтобы выражать количество таких частиц, ввели единицу количества – моль. 1 моль – это такое количество любого вещества, которое содержит столько же структурных элементов, сколько атомов содержится в 12г. нуклида углерода-12. Экспериментально найдено, что число структурных элементов, отвечающих 1 моль, равно 6,02∙1023 (постоянную 6,02∙1023 моль-1 называют постоянной Авогадро. Цилиндры с веществами в 1моль).

Рис. 1. Постоянная Авогадро
Иллюстрация следствия из закона Авогадро
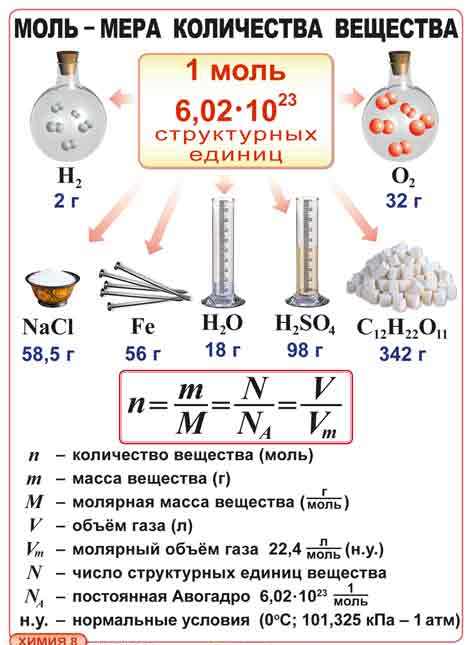
Рис. 2. Моль – единица количества вещества
Моль – единица количества вещества

Рис. 3. Количество вещества.
У этой порции вещества есть масса, которая называется молярной массой. Обозначается М, которая находится по формуле М = m/n. Предположите, в каких единицах будет измеряться молярная масса?
Молярная масса по значению совпадает с относительной атомной или молекулярной массой, но различаются единицами измерения (М – г/моль; Mr, Аr – безразмерные величины).
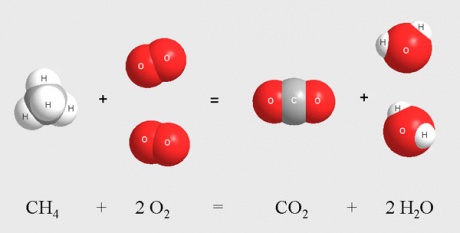
Рис. 4. Количество вещества в молях

Рис. 5. Молярная масса
2. Закрепление материала.
№1.
Масса 3 моль h3O составляет ____ г
Масса 20 моль h3O составляет ____ г
№2.
36 г Н2О составляют ______ моль
180г Н2О составляют _______ моль
3.Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
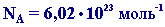
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
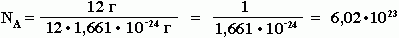
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 1023молекул. Следовательно, количество вещества в этом образце составляет:

В общем виде:
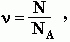
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
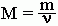
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
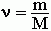
или найти массу вещества по числу молей и молярной массе:
m = ν • M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.

Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
m(CH4) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
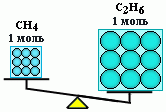
n(CH4) = n(С2Н6), но m(CH4) < m(С2Н6)Вычисление ν используется практически в каждой расчетной задаче.
Алгоритмы решения задач
Задача №1. Вычислите массу (г) железа, взятого количеством вещества 0, 5 моль?
Дано: ν(Fe)=0,5 моль
Найти: m(Fe) — ?
Решение:
m = M · ν
M(Fe) = Ar(Fe) = 56 г/моль ,
m (Fe) = 56 г/моль · 0,5 моль = 28 г
Ответ: m (Fe) =28 г
Задача №2. Вычислите массу (г) 12,04 · 1023 молекул оксида кальция CaО?
Дано: N(CaO)= 12,04 * 1023 молекул
Найти: m(СaO) — ?
Решение:
m = M · ν, ν= N/Na,
следовательно, формула для расчёта m = M · (N/Na)
M(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 г/моль
m= 56 г/моль · (12,04 * 1023/6.02 · 1023 1/моль) = 112 г
Ответ: m= 112 г
4. Задания для закрепления.
Задача 1. Вычислите массу воды (г), взятой количеством вещества 5 моль?
Задача 2. Вычислите массу 24,08 *1023 молекул серной кислоты H2SO4?
Задача 3. Определите число атомов в 56 г железа Fe?
5. Задание на дом: п.15,упр.1-4.
Количество вещества
Следует различать массу и количество: 2 кг яблок – это масса, а 2 яблока – это количество. В жизни мы часто используем определённые порции, например, коробок спичек или мешок зерна, ведь никто из нас не будет поштучно покупать спички или зерно.

В химии для измерения количество вещества была выбрана единица, которая объединила в себе число частиц и массу. Эта единица называется моль и обозначается буквой n (эн). Чтобы измерить 1 моль любого вещества, нужно взять его столько грамм, какова относительная атомная или относительная молекулярная масса вещества.
Давайте посмотрим на вещества количеством один моль: сравните, как отличается 1 моль воды, соли, кислоты и сахара. Почему? У этих веществ различная относительная молекулярная масса. У воды – 18, соли – 58,5, кислоты – 98, а сахара – 332, поэтому и масса вещества их тоже различна.

Например, 1 моль воды имеет массу 18 г, т.к. относительная молекулярная масса вода равна 18; 1 моль азота имеет массу 28 г, потому что относительная молекулярная масса его равна 28; 1 моль меди равен 64 г, т.к. относительная молекулярная масса ее равна 64.

А если нам нужно узнать, какую массу имеет вода количеством 2 моль, то мы 2 умножим на 18, т.е. 36 г; 0,5 моль азота имеет массу 14 г, т.к. 0,5 умножить на 28, будет 14.

Количество вещества не только связано с массой, но и с числом частиц.

Установлено, что 1 моль любого вещества содержит одинаковое число частиц. Это число равно 6,02 · 1023. Это число называется постоянной Авогадро, в честь итальянского ученого А. Авогадро и обозначается оно NA.

Т.е. 1 моль воды имеет массу 18 г и содержит 6,02 · 1023 частиц; 2 моль воды имеет массу 36 г и содержит 12,04 · 1023 частиц; 0,5 моль азота имеет массу 14 г и содержит 3,01 · 1023 частиц.

Для того чтобы узнать число частиц (N), которое содержится в определенном количестве вещества, можно использовать формулу:
N = NA · n
где n – количество вещества, т.е. число молей; N – число частиц.
Из этой формулы верны и следующие выражения:
NA = N/ n
n = N/ NA
Теперь дадим определение понятия моль – это такое количество вещества, в котором содержится 6,02 · 1023 частиц этого вещества.
Используя новые формулы, решим задачи.
1. Определите количество вещества кислорода, в котором содержится 18,06 · 1023 молекул.
Нам дано число молекул кислорода, найти нужноколичество вещества кислорода. Для решения этой задачи используем формулу n = N/ NA, подставляем значения в выражение и находим результат (величина NA является потоянной). Получается 3 моль. Следовательно, количество кислорода равно 3 моль.

2. Определите число молекул хлора (Cl2) которое, содержится в порции этого газа количеством вещества 0,1 моль.
В этой задаче по условию нам дано количество вещества хлора. Найти нужно число молекул. Следовательно, используем формулу N = NA · n, подставим данные в формулу, получаем результат 0,602 · 1023 молекул. Получается, что порция хлора количеством 0,1 моль содержит 0,602 · 1023 молекул.

Количество вещества. Моль
Количество вещества. Моль
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.Моль – это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов, электронов или других частиц), сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12С.
Зная массу одного атома 12С, можно подсчитать число атомов NA в 0,012 кг углерода 12С:Число структурных единиц, которое содержит 1 моль любого вещества, всегда одно и то же. Оно равно 6,02•1023 и называется постоянной Авогадро (обозначается NA, размерность моль-1).
Поэтому используется также следующее определение:
Моль – это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов, электронов или других), равное постоянной Авогадро, то есть 6,02·1023 моль-1.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню).- где N – число структурных единиц данного вещества;
NA – число структурных единиц, которое содержит 1 моль вещества (постоянная Авогадро).
Заметим, что вычисление ν используется практически в каждой расчётной задаче.
Количество вещества моль и молярная масса
1. В каком случае применяют физическую величину «количество вещества» и в каких единицах ее измеряют? Ответ поясните примерами.
Количество вещества применяют в случаях, когда интересует отношение количества частиц, вступающих и/или образующихся в процессе химической реакции.
При горении водорода 2 молекулы водорода соединяются с 1 молекулой кислорода и образуют 2 молекулы воды:
2H2 + O2 = 2H2O
При горении метана 1 молекула метана вступает в химическое взаимодействие с 2 молекулами кислорода и образованием 2 молекул воды и 1 молекулы углекислого газа:
CH4 + 2O2 = CO2 + 2H2O
2. Что означает величина «молярная масса» и чем она отличается от физических величин «относительная молекулярная масса» и «относительная атомная масса»?
Молярная масса — масса одного моля вещества. А один моль это количество вещества, содержащее столько же частиц, сколько их содержится в 12 г углерода, масса которого равна 12 а. е. м.
Или, другими словами: молярная масса — это масса вещества, содержащего столько же частиц, сколько их содержится в 12 г углерода, масса которого равна 12 а. е. м.
Количество частиц, содержащихся в 1 моле вещества это постоянная величина, называемая числом или постоянной Авогадро, и равная 6,02 * 1023.
Поэтому можно сказать, что молярная масса — это масса 6,02 * 1023 частиц (атомов, молекул, ионов) данного вещества.
Относительная атомная (молекулярная) масса — значение массы атома (молекулы), выраженное в атомных единицах массы. Определяется как отношение массы атома данного элемента к 1/12 массы нейтрального атома изотопа углерода 12C.
§ 11 Относительная атомная масса химических элементов
3. Рассчитайте молярные массы воды H2O, углекислого газа CO2, серной кислоты H2SO4, сероводорода H2S.
Молярная масса численно совпадает с относительной молекулярной массой вещества:
M (H2O) = 2*1 + 16 = 18 г/моль
M (CO2) = 12 + 2*16 = 44 г/моль
M (H2SO4) = 2*1 + 32 + 4*16 = 98 г/моль
M (H2S) = 2*1 + 32 = 34 г/моль
4. Дано уравнение реакции 2Mg + O2 = 2MgO. Согласно этому уравнению по аналогии с таблицей 6 составьте таблицу, показывающую соотношения между массой реагирующих веществ в граммах, числом атомов и количеством вещества.
| Масса (m) | Число атомов | Количество вещества (n) | |||
|---|---|---|---|---|---|
| Mg | O | Mg | O | Mg | O |
| 48 г | 32 г | 12,04 * 1023 | 6,02 * 1023 | 2 моль | 1 моль |
| 24 г | 16 г | 6,02 * 1023 | 3,01 * 1023 | 1 моль | 0,5 моль |
| 12 г | 8 г | 3,01 * 1023 | 1,505 * 1023 | 0,5 моль | 0,25 моль |
5. Составьте 2-3 уравнения известных вам химических реакций и поясните, в каких массовых и количественных соотношениях реагируют вещества.
Количественное соотношение кальция и воды 1 к 2.
Чтобы найти массовое соотношение, нудно найти молярную массу вещества, а затем выразить ее через количественное соотношение:
M (Ca) = 40 г/моль
M (H2O) = 18 г/моль
Так как 1 атом кальция вступает во взаимодействие сразу с 2-мя молекулами воды, то соотношение масс будет:
m (Ca) : m (H2O) = 40 : 2*18 = 40 : 36
Для реакции
2Na + 2H2O = 2NaOH + H2
Количественное отношение 1:1, массовое отношение 23:18.
Для реакции
Fe + S = FeS
Количественное отношение 1:1, массовое отношение 56:32.
Тестовые задания
1. Медь, взятая количеством вещества 6 моль, имеет массу
1) 60 г 2) 192 г 3) 384 г 4) 400 г
Ar (Cu) = 64 а. е. м.
Поэтому
m (Cu) = 6 * Ar (Cu) = 6 * 64 = 384 г
Ответ: 3.
2. Масса 0,1 моль алюминия равна
1) 0,1 г 2) 2,7 г 3) 260 г 4) 540 г
Ответ: 2.
3. Количество вещества, соответствующее 32 кг оксида железа (III), — это
1) 10 моль 2) 20 моль 3) 100 моль 4) 200 моль
n = m / Mr = 32 000 / 160 = 200 моль
Ответ: 4
3. Количество вещества, соответствующее 560 г карбоната кальция CaCO3, — это
1) 0,56 моль 2) 5,6 моль 3) 6,5 моль 4) 10 моль
n = m / Mr = 560 / 100 = 5,6 моль
Ответ: 2.
Химическое количество вещества | Химическая энциклопедия
В жизни мы часто не различаем понятия «масса» и «количество». А это разные понятия. В химической практике помимо массы или объема часто необходимо знать число структурных единиц (т. е. атомов, молекул, формульных единиц), которые содержатся в данной порции вещества, поскольку именно они участвуют в химических реакциях. Поэтому в химии, как и в других естественных науках, используют физическую величину, характеризующую число частиц в рассматриваемой порции вещества. Эта физическая величина называется количеством вещества или, как следует называть ее при химических расчетах, – химическое количество вещества.
Химическое количество вещества – физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества. Другими словами, химическое количество вещества – это порция данного вещества, содержащая определенное число его структурных единиц.
Химическое количество вещества обозначают латинской буквой n. Это одна из семи основных физических величин Международной системы единиц (СИ).
Моль – единица химического количества вещества.
Каждая из основных физических величин имеет свою единицу. Например, единица длины – метр (м), массы – килограмм (кг), времени – секунда (с). Единицей химического количества является моль. Моль – порция вещества (т. е. такое его химическое количество), которое содержит столько же структурных единиц, сколько атомов содержится в 0,012 кг углерода.
Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое – «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале XX века. Автор этого термина известный немецкий химик и физик В. Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула». Вам необходимо включить JavaScript, чтобы проголосовать