Азотная кислота свойства — Знаешь как
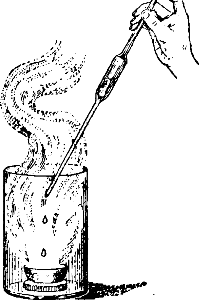
Рис. 97. Воспламенение скипидара в азотной кислоте
Чистая азотная кислота — бесцветная жидкость уд. веса 1,53, кипящая при 86°, а при —41° застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана.
С водой азотная кислота смешивается в любом отношении, причем 68%-ный раствор кипит при 120,5° и перегоняется без изменения. Такой состав имеет обыкновенная продажная азотная кислота уд. веса 1,4. Концентрированная кислота, содержащая 96—98% HNO3 и окрашенная растворенной в ней двуокисью азота в красно-бурый цвет, известна под названием дымящей азотной кислоты.
Азотная кислота не отличается особенной химической прочностью. Уже под влиянием света она постепенно разлагается на воду, кислород и двуокись азота:
4HNO3 = 2Н2O + 4NO2 + O2
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Поэтому получаемая из селитры азотная кислота всегда бывает окрашена двуокисью азота в желтоватый цвет. Чтобы избежать разложения, перегонку ведут под уменьшенным давлением, под которым азотная кислота закипает при температуре, близкой к 20°.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она сполна распадается на ионы Н• и NO3′.
Самым характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота — один из энергичнейших окислителей. Многие металлоиды легко окисляются ею, превращаясь в соответствующие кислоты. Так, например, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную и т. д. Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, но ярко разгорается, разлагая кислоту с образованием красно-бурой двуокиси азота.
Иногда при окислении выделяется так много тепла, что окисляющееся вещество само собой загорается без предварительного подогревания.
Нальем, например, в фарфоровую чашку немного дымящей азотной кислоты, поставим чашку на дно широкого стакана и, набрав в пипетку скипидара, будем по каплям пускать его в чашку с кислотой. Каждая капля, попадая в кислоту, воспламеняется и сгорает, образуя большое пламя и облако копоти (рис. 97). Нагретые древесные опилки также загораются от капли дымящей азотной кислоты. Азотная кислота действует почти на все металлы, за исключением золота, платины и некоторых редких металлов, превращая их в азотнокислые соли. Так как последние растворимы в воде, то азотной кислотой постоянно пользуются на практике для растворения металлов, особенно таких, как медь, серебро, свинец, на которые другие кислоты не действуют или действуют очень медленно.
Замечательно, что, как нашел еще М В, Ломоносов, некоторые металлы (железо, алюминий и др.), легко растворяющиеся в разбавленной азотной кислоте, не растворяются в холодной концентрированной азотной кислоте. По видимому, это происходит вследствие образования на их поверхности тонкого, очень плотного слоя окисла, защищающего металл от дальнейшего действия кислоты. Такие металлы после обработки их концентрированной азотной кислотой становятся «пассивными», т. е. утрачивают способность растворяться также и в разбавленных кислотах.
Окислительные свойства азотной кислоты обусловливаются неустойчивостью ее молекул и присутствием в них азота в его высшем состоянии окисления, отвечающем положительной валентности, равной 5. Производя окисление, азотная кислота последовательно восстанавливается в следующие соединения:
HNO3→NO2→HNO2→NO→N2O→N2→NH3
Степень восстановления азотной кислоты зависит как от ее концентрации, так и от % активности восстановителя. Чем более кислота разбавлена, тем сильнее она восстанавливается. Концентрированная азотная кислота всегда восстанавливается до NO2. Разбавленная азотная кислота восстанавливается обычно до NO или при действии более активных металлов, как, например, Fe, Zn, Mg, — до N2O. Если же кислота очень разбавлена, то главным продуктом восстановления является NH3, образующий с избытком кислоты аммонийную соль NH4NO3.Для иллюстрации приведем схемы нескольких реакций окисления при помощи азотной кислоты;
1) Pb + HNO3 → Pb(NO3)2 + NO2 + Н2O
2) Сu + HNO3 → Cu(NO3)2 + NO + H2O
разбавл,
3) Mg + HNO3 → Mg(NO3)2 + N2O + H2O
разбавл,
4) Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
очень разбавл.
Учащемуся рекомендуется самому составить полные уравнения этих реакций.
Следует отметить, что при действии разбавленной азотной кислоты на металлы водород, как правило, не выделяется.
При окислении металлоидов азотная кислота обычно восстанавливается до NO. Например:
S + 2HNO3 = H2SO4+2NO
Приведенные выше схемы иллюстрируют наиболее типичные случаи окислительного действия азотной кислоты. Вообще же необходимо заметить, что все реакции окисления, идущие с уча-стием азотной кислоты, протекают очень сложно вследствие одновременного образования различных продуктов восстановления и до сих пор не могут считаться вполне выясненными.
Смесь, состоящая из 1 объема азотной и 3 объемов соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не растворяющиеся в азотной кислоте, в том числе и «царя металлов» — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную кислоту с выделением свободного хлора и образованием хлористого нитрозила NOCl:
HNO3 + 3HCl = Сl2 + 2Н2O + NOCl
Хлористый нитрозил является промежуточным продуктом реакции и разлагается на окись азота и хлор:
2NOCl = 2NO + Сl2
Выделяющийся хлор соединяется с металлами, образуя хлориды металлов, поэтому при растворении металлов в царской водке получаются соли соляной, а не азотной кислоты:
Au + 3HCl+ HNO3 = AuCl3 +NO + 2H2O
На многие органические вещества азотная кислота действует таким образом, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами — NO2. Этот процесс, получивший название нитрования, играет чрезвычайно важную роль в органической химии.
При действии на азотную кислоту фосфорного ангидрида последний отнимает от азотной кислоты элементы воды и в результате образуются азотный ангидрид и метафосфорная кислота.
2HNO3 + P2O5 = N2O5 + 2HPO3
Для чего азотная кислота
Азотная кислота является самым важным соединением азота благодаря разнообразному применению, которое она находит в народном хозяйстве.
В больших количествах азотная кислота расходуется в производстве азотных удобрений и органических красителей. Она применяется как окислитель во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, служит для растворения металлов, для получения нитратов, применяется для изготовления целлюлозных лаков, кинопленки и в ряде других химических производств. Азотная кислота идет также на изготовление бездымного пороха и взрывчатых веществ, необходимых для обороны страны и широко используемых в горнорудном деле и при различных земляных работах (строительство каналов, плотин и т. п.).
141 142 143
Вы читаете, статья на тему Азотная кислота свойства
znaesh-kak.com
Кислоты — окислители | Дистанционные уроки
30-Авг-2018 | Нет комментариев | Лолита Окольнова
Давайте рассмотрим свойства
и продукты их реакций
Автор статьи — Саид Лутфуллин
Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она
Pb + H2SO4 ≠
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
Раз сера – окислитель, то она будет восстанавливаться:

Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до h3S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:

- Активные металлы восстанавливают серную кислоту до h3S:
8Li + 5H2SO4 конц → 4Li2SO4 + h3S ↑ + H2O
4Mg + 5H2SO4 конц → 4MgSO4 + h3S ↑ + H
- Металлы средней активности восстанавливают серную кислоту до S:
3Mn + 4H2SO4 конц → 3MnSO4 + S ↓ + 4H2O
3Zn + 4H2SO4 конц → t→ 3ZnSO4 + S ↓ + 4H2O
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Cu + 2H2SO4 конц → CuSO4 + SO2 ↑ + 2H2O
2Ag + 2H2SO4 конц → Ag2SO4 + SO2 ↑ + 2H2O
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:

2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
2P + 5H2SO4 конц → 2H3PO4 + 5SO2 ↑+ 2H2O
2B + 3H2SO4 конц → 2H3BO3 + 3SO2 ↑
Угольная кислота не образуется – получается углекислый газ:
C + 2H2SO4 конц → CO2 ↑ + 2SO2 ↑+ 2H2O
Концентрированная серная кислота окисляет серу:

3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
2KF тв + H2SO4 конц → K2SO4 + 2HF↑
2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:

А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
2HBr + H2SO4 конц → Br2 + SO2 ↑ + 2H2O
8HI + H2SO4 конц → 4I2 ↓+ H2S ↑ + 4H2O
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
4NH3+5O2 → кат., t°→ 4NO+6H2
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
2NO+O2→2NO2
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:

Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:

Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
NaNO3 тв + H2SO4 → t → NaHSO4 + HNO3 ↑
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:

Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – Nh5NO3.
4Ca + 10HNO3 разб → 4Ca(NO3)2 + NH4NO3 + 3H2O
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Cu + 4HNO3 конц → Cu(NO3)2 + 2NO2 ↑+ 2H2O
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N2O ↑ + 5H2O
3Cu + 8HNO3 разб → 3Cu(NO3)2 + 2NO ↑ + 4H2O

Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
Чтобы провести реакцию нужно нагреть:

С разбавленной кислотой эти металлы реагируют и без нагревания:

2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).

В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
I2 + 10HNO3 конц → t → 2HIO3 + 10NO2 ↑ + 4H2O
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.
- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
KF + HNO3 → HF + KNO3
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.

Еще на эту тему:
Обсуждение: «Кислоты — окислители»
(Правила комментирования)distant-lessons.ru
Азотная кислота реакции с металлами
Составить уравнения реакций взаимодействия разбавленной азотной кислоты с металлами (в скобках указана валентность) а) цинком (И) б) медью (II) в) алюминием (III) г) натрием (I). Составить уравнения реакций взаимодействия концентрированной азотной кислоты с металлами д) медью (II) е) цинком (И) ж) кальцием (И), [c.99]Fe+2H l=Es» lj+Hj 2Ре+ЗС1=2Е » Оз Большую часть подобных реакций удобнее рассматривать с помощью метода электронно-ионного баланса. Однако мы продемонстрируем, что при хорошем владении методом электронного баланса Вы вполне сможете подобрать коэффициенты для таких реакций. Как пример рассмотрим взаимодействие азотной кислоты с металлами. Известно, что в этих реакциях не выделяется водород, поскольку окислительная способность азота в степени окисления +5 значительно выше, чем протона Н . При этом азотная кислота [c.97]
Написать уравнения соответствующих реакций. Сделать общие выводы о характере взаимодействия азотной кислоты с металлами. [c.179]
Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот Какие ионы являются окислителем в первом случае и какие — во втором Приведите примеры реакций. [c.125]
Переходя к рассмотрению возможных вариантов реакций между менее концентрированными растворами азотной кислоты и металлами с меньшим алгебраическим значением нормального электродного потенциала [c.187]
Что представляет собой бурый газ, выделяющийся при действии концентрированной азотной кислоты на металлы Из каких молекул он состоит Почему его окраска усиливается при повышении температуры и ослабляется при ее понижении Будет ли этот газ подчиняться закону Бойля — Мариотта, если подвергать его сжатию при постоянной температуре Составить уравнения реакций, происходящих при растворении этого газа в воде и в растворе щелочи. [c.230]
Выполнение работы. В две пробирки — одну с концентрированной хлороводородной кислотой (6 н.), другую с концентрированной -азотной кислотой (плотность 1,2 г/см ) опустить по кусочку металлического хрома или феррохрома. Наблюдать в первой пробирке выделение газа (какого ) и появление синей окраски раствора, характерной для ионов Сг +. Реагирует ли металл с кислотой во второй пробирке Слить азотную кислоту, промыть металл дистиллированной водой и добавить хлороводородную кислоту (6 н.). Протекает ли реакция в этом случае Какое действие оказала азотная кислота на хром [c.229]
Специфические свойства азотной кислоты рассмотрены в курсе неорганической химии. Теперь ознакомимся с окислительными свойствами азотной кислоты более подробно. Может возникнуть вопрос чем объясняется характер взаимодействия азотной кислоты с металлами, т. е. почему в этих реакциях вместо водорода преимущественно выделяются различные оксиды азота и даже азот и аммиак (При действии наиболее активных металлов на разбавленные водные растворы азотной кислоты происходит и частичное выделение водорода.) Все это связано с исключительно сильными окислительными свойствами атома азота со степенью окисления — -5, который, окисляя атомы металлов, изменяет свою степень окисления до +4, +2, +1 и даже до О и —3 (табл. 30, с. 136). Рассмотрим примеры. [c.135]
В лаборатории оксид азота(IV) можио получить термическим разложением нитрата свинца (соли азотной кислоты) и по реакции концентрированной азотной кислоты с металлами [c.151]
Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот Какой атом или ион является окислителем в первом случае и какой во втором Составьте уравнения реакций взаимодействия разбавленной азотной кислоты с ртутью и с кальцием, приняв во внимание положение этих металлов в ряду напряжений, [c.227]
При реакциях азотной кислоты с металлами практически никогда не выделяется водород. Например, в реакции [c.241]
Иллюстрацией к этой схеме могут быть следующие реакции взаимодействия азотной кислоты с металлами [c.352]
Ярким примером протекания параллельных реакций может служить взаимодействие металлов с азотной кислотой. Рис. 10.7 иллюстрирует сказанное и одновременно показывает условность рассуждений о продуктах реакции азотной кислоты с металлами всегда образуется смесь таких продуктов восстановления кислоты, и лишь в некоторых случаях можно сказать о наличии преимущественного пути. [c.224]
В три пробирки (одну с конц. хлороводородной кислотой (6 н), вторую с конц. азотной кислотой, третью — с конц. серной кислотой) опустить по кусочку металлического хрома. Наблюдать в первой пробирке вьщеление газа (какого ), появление синей окраски раствора, характерной для ионов и ее быстрое изменение. Протекает ли реакция во второй и в третьей пробирках Во второй пробирке слить азотную кислоту, промыть металл дистиллированной водой и добавить хлороводородную кислоту (6 н.). Протекает ли реакция в этом случае Какое действие оказала азотная кислота на хром Составить уравнения протекающих реакций. [c.42]
Аммиак и азотная кислота, вообще, являются любимыми темами вступительного экзамена. Редкий билет не содержит задач, связанных с восстановительными свойствами аммиака, термическим разложением солей аммония или реакциями азотной кислоты с металлами или неметаллами. В вузах, где химия является профилирующим экзаменом, часто встречаются задания на написание окислительно-восстановительных реакций с участием азотной кислоты или оксидов азота со сложными веществами. [c.108]
НЫОз —сильная кислота и сильный окислитель. Поэтому она взаимодействует почти со всеми металлами. При взаимодействии азотной кислоты с металлами водород, как правило, не выделяется он окисляется, образуя воду. Кислота же, в зависимости от концентрации и активности металла, может восстанавливаться до N02, N0, N20, N2 или NHэ. Третьим продуктом реакции является соль азотной кислоты. [c.228]
Решение. 1. Медь окисляется кислотой до наиболее характерной для этого металла степени окисления +2, т. е. образуется соль нитрат меди (II) Си(КО,)а. Продуктом восстановления разбавленной азотной кислоты малоактивным металлом является оксид азота (II) N0. Записываем схему реакции [c.88]
В этом разделе мы рассмотрели те
www.chem21.info