Массовая доля — что это такое? Как найти? Формула
Что такое массовая доля
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
— масса вещества;
— масса раствора.
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (A r) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову
Важно
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
или .
или .
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
, значит .
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Ar(H) = 1.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
или .
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
Важно
Указание массовой доли вещества — один из способов выражения концентрации раствора.В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
, а значит .
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ:
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Вычисление массовой доли элемента или вещества
Как вычислить массовую долю элемента в веществе
Массовая доля элемента ω(Э) % — это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).
Массовую долю элемента выражают в долях от единицы или в процентах:
ω(Э) = m (Э) / Мr(в-ва) (1)
ω% (Э) = m(Э) · 100%/Мr(в-ва)
Сумма массовых долей всех элементов вещества равна 1 или 100%.
Как правило, для расчетов массовой доли элемента берут порцию вещества, равную молярной массе вещества, тогда масса данного элемента в этой порции равна его молярной массе, умноженной на число атомов данного элемента в молекуле.
Так, для вещества АxВy в долях от единицы:
ω(A) = Ar(Э) · Х / Мr(в-ва) (2)
Из пропорции (2) выведем расчетную формулу для определения индексов (х, y) в химической формуле вещества, если известны массовые доли обоих элементов и молярная масса вещества:
Х = ω%(A) · Mr(в-ва) / Аr(Э) · 100% (3)
Разделив ω% (A) на ω% (В) , т.е. преобразовав формулу (2), получим:
ω(A) / ω(В) = Х · Ar(А) / У · Ar(В) (4)
Расчетную формулу (4) можно преобразовать следующим образом:
Х : У = ω%(A) / Ar(А) : ω%(В) / Ar(В) = X(А) : У(В) (5)
Расчетные формулы (3) и (5) используют для определения формулы вещества.
Если известны число атомов в молекуле вещества для одного из элементов и его массовая доля, можно определить молярную массу вещества:
Mr(в-ва) = Ar(Э) · Х / W(A)
Примеры решения задач на вычисление массовых долей химических элементов в сложном веществе
Пример 1. Определите массовые доли химических элементов в серной кислоте H2SO4 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
Пример 2. Определите массовые доли химических элементов в оксиде алюминия Al2
O3 и выразите их в процентах.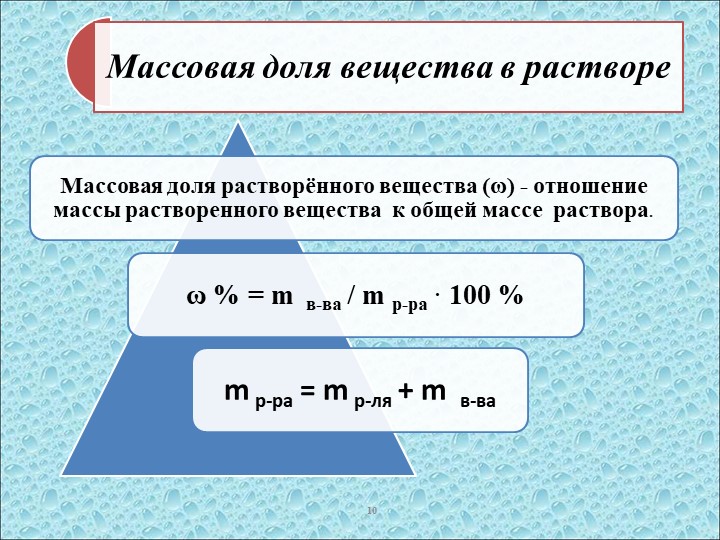
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr( Al2O3) = 27 · 2 + 16 · 3 = 102
2. Вычисляем массовые доли элементов:
ω(Al) = 54 : 102 = 0,53 = 53%
ω(O) = 48 : 102 = 0,47 = 47%
Как вычислить массовую долю вещества в кристаллогидрате
Массовая доля вещества — отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) = m(Х) / m,
где ω(X) — массовая доля вещества Х,
m(X) — масса вещества Х,
m — масса всей системы
Массовая доля — безразмерная величина. Её выражают в долях от единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
Молярная масса BaCl2·2H2O составляет:
М(BaCl2·2H2O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl2·2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H2O. Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
m(h3O) = 2 · 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
ω(H2O) = m(H2O)/m(BaCl2 · 2H2O) = 36 / 244 = 0,1475 = 14,75%.
Пример 2. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г m = 25 г | Решение Определяем количество вещества серебра, находящегося в аргентите: n(Ag ) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль. Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита: n(Ag2S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль Рассчитываем массу аргентита: m(Ag2S) = n(Ag2S) · М(Ag2S) = 0,025 · 248 = 6,2 г . Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г. ω(Ag2S) = m(Ag2S) / m = 6,2/25 = 0,248 = 24,8%. |
Найти: ω(Ag2S) = ? |
Определение массовой доли
Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого. Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.
 ) являются массовые, мольные и объёмные доли отдельных компонентов.
) являются массовые, мольные и объёмные доли отдельных компонентов.Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение: ω(вещества) = m(вещества) / m(смеси). Массовую долю элемента в веществе можно определить, используя молярные массы:ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.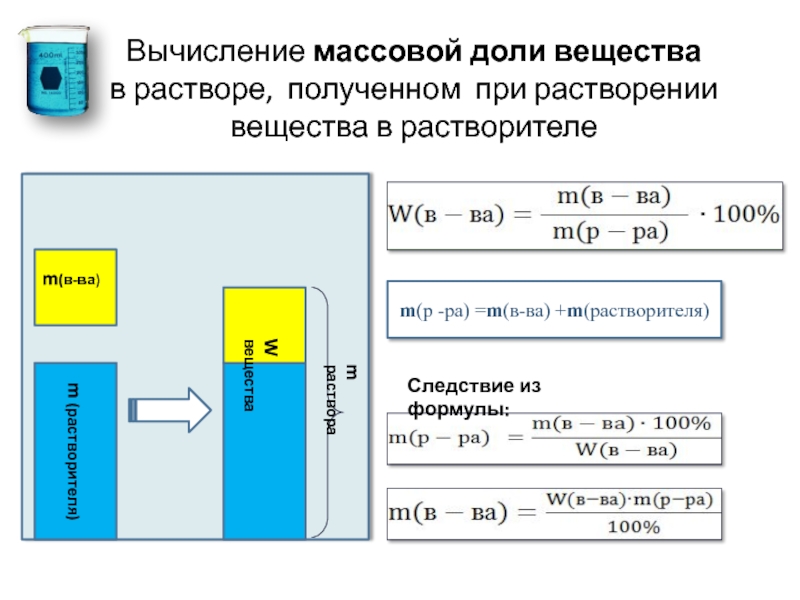
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.
Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
РешениеПри сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции:
Массовая доля (в процентах) растворенного вещества
Расчеты no определению массовой доли растворенного вещества (в процентах) в растворе и массы растворенного вещества по известной массовой доле его в растворе [c. 174]
174]Массовая доля растворенного вещества, выраженная в процентах, часто называется процентной концентрацией и показывает число граммов растворенного вещества в 100 г раствора. [c.102]
Массовая доля показывает, какую часть от данной массы раствора составляет масса растворенного вещества т . Это безразмерная величина, выражаемая в долях единицы или в процентах (ранее называлась процентной концентрацией). Если обозначить массовую долю через С%, то можно записать [c.18]
Концентрация — это один из способов выражения состава раствора. Кроме того состав раствора выражают через безразмерные относительные величины — доли. Объемная доля — отношение объема растворенного вещества к объему раствора массовая доля — отношение массы растворенного вещества к объему раствора мольная доля — отношение количества растворенного вещества (число молей) к суммарному количеству всех компонентов раствора. Эти величины выражают в долях единицы или в процентах. [c.247]
Эти величины выражают в долях единицы или в процентах. [c.247]
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами — долями или процентами, либо величинами размерными — концентрациями. Ниже приведены наиболее употребляемые в химии способы выражения концентрации растворенного вещества в растворе. Массовая доля (С) — процентное отношение массы растворенного вещества к общей массе раствора например, С = 9,25% (масс). [c.49]
Массовую долю растворённого вещества в процентах (%) часто называют процентной концентрацией раствора. [c.167]
Массовую долю можно выражать и в процентах. Например, если в 1000 г раствора содержится 12 г хлорида натрия, то массовая доля (%) этого вещества равна [c.69]
Массовая доля растворенного вещества, или процентная концентрация, (Р) — отношение массы растворенного вещества к массе раствора выражается в процентах [% или % (масс. )]. В 100 г 30%-го раствора азотной кислоты содержится 30 г НЫОз и 70 г НгО. [c.132]
)]. В 100 г 30%-го раствора азотной кислоты содержится 30 г НЫОз и 70 г НгО. [c.132]
Концентрации жидких растворов обычно представляют по одному из двух способов, различающихся тем, что количество отдельных ингредиентов и всей смеси выражают в одних и тех же или разных единицах измерения. По первому способу наиболее употребительны концентрации, выраженные в массовых, объемных или мольных долях (или процентах). Они представляют собой массу, объем или количество молей растворенного вещества, отнесенных соответственно к массе, объему или количеству молей всего раствора или растворителя (для получения процентов результат необходимо умножить на 100). По второму способу наиболее часто пользуются следующими вариантами выражения концентрации моляльностью, т.е. числом молей растворенного вещества в 1 кг растворителя молярностью (мольностью), т.е. числом молей растворенного вещества в 1 л раствора нормальностью, т.е. числом грамм — эквивалентов растворенного вещества в 1 л раствора титрами, т. е. числом граммов (килограммов) растворенного вещества в 1 мл (л) раствора. [c.55]
е. числом граммов (килограммов) растворенного вещества в 1 мл (л) раствора. [c.55]
Массовая доля растворенного вещества (w-дубль-вэ) выражается в долях единицы, процентах (%), промилле %о (тысячная часть) и в миллионных долях (млн ). Массовая доля численно равна отношению массы растворенного вещества к общей массе раствора [c.58]
Массовую долю растворенного вещества выражают в долях единицы или в процентах. Например, если в 100 г раствора находится 1 г КВг, то vv Br = 0.01 (I»/ )- Такой раствор называют однопроцентным. [c.54]
Массовую долю растворенного вещества обычно выражают в долях единицы или в процентах. Например, массовая доля растворенного вещества — серной кислоты — в воде равна 0,05 или 5%. Это означает, что в растворе серной кислоты массой 100 г содержится серная кислота массой 5 г и вода массой 95 г. [c.140]
Массовая доля — это отношение массы растворенного вещества к массе раствора ее также выражают в долях единицы или в процентах. [c.57]
[c.57]
Массовая доля растворенного вещества А, XV (А) w(A) — 100% т(р — р) w(A) — масса вещества А т(р-р) — масса раствора Проценты (или доли единицы) [c.122]
Метод позволяет титровать микро- и макроколичества вещества, причем точность определения в большинстве случаев составляет доли процента. При массовом анализе методику можно упростить, проводя титрование анализируемого раствора до тех пор, пока потенциал раствора не сравняется с потенциалом в точке эквивалентности последний определяют предварительно по полной кривой титрования. Процесс титрования можно автоматизировать для этого устанавливают некоторое критическое значение потенциала, при котором специальное приспособление прекращает подачу титранта. Для многократного титрования веществ одного типа очень удобно пользоваться автоматическими титра-торами. В некоторых установках используются самописцы, которые существенно облегчают работу экспериментатора. [c.420]
В курсе количественного анализа массовую долю, как правила, измеряют в процентах. Она характеризует содержание компонента в твердом веществе или растворе [c.12]
Она характеризует содержание компонента в твердом веществе или растворе [c.12]
Массовые проценты массовая доля, процентная концентрация) — отношение массы растворенного вещества к массе всего раствора, выраженная в долях единицы или в процентах [c.26]
Массовая доля (н>в) показывает, какую часть массы раствора составляет масса растворенного вещества. Массовая доля — величина безразмерная. Если значение умножить на 100, то получим массовую долю, выраженную в процентах. Запись w (H l, [c.13]
Концентрацию растворов высокомолекулярных соединений обычно выражают в массовых, объемных долях или процентах растворенного вещества, а также числом граммов полимера в 100 мл раствора. [c.95]
При проведении анализа без операции двойного разбавления раствора массовую долю калия в сухом веществе в пересчете на К2О (X и X/) в процентах вычисляют по формулам при анализе удобрений с массовой долей К2О более 25% [c. 528]
528]
В научных исследованиях часто пользуются мольными долями, моляльностью или массовыми процентами (они не зависят от температуры). При провес,ении реакций между растворенными веществами удобно пользоваться растворами, концентрация которых выражена через нормальность. [c.141]
Процентная концентрация (или массовая доля, выраженная в процентах) показывает количество гра,ммов растворенного вещества в 100 г раствора (обозначается С асс%, или просто С%). Таким образом, [c.82]
Условные обозначения g — массовый процент С — молярность N — нормальность т — моляльность N2 — молярная доля р — плотность раствора М2 — молекулярная масса растворенного вещества М] — молекулярная масса растворителя Эг —грамм-эквивалент растворенного вещества. [c.144]
Количественный анализ отвечает на вопросов каких количествах компоненты присутствуют в анализируемой пробе. При этом задачей количественного анализа может быть как установление абсолютного количества данного компонента в исследуемой пробе, так и его относительного содержания, т. е. его доли в пробе. Когда анализируемая проба является твердым веществом, относительное содержание обычно выражается в массовых процентах, при анализе растворов — чаще всего в различных единицах концентрации моль/л, г/л, г/мл и др. [c.201]
е. его доли в пробе. Когда анализируемая проба является твердым веществом, относительное содержание обычно выражается в массовых процентах, при анализе растворов — чаще всего в различных единицах концентрации моль/л, г/л, г/мл и др. [c.201]
Равновесное состояние определяется концентрацией насыщения раствора, т. е. растворимостью, которая, как правило, выражается в г/л или кг/м (с), в мольных долях (х), в массовых процентах (С) или числом граммов растворяющегося вещества в 100 г растворителя (я). Если плотность раствора обозначить р (кг/м ), то для указанных величин можно написать следующие переходные формулы [c.11]
Для характеристики состава раствора пользуются концентрациями, выраженными следующим образом мольными и массовыми процентами числом молей в единице массы или объема раствора массой растворенного вещества в граммах на 100 г растюрителя и др. Наиболее часто выражают составы растворов в массовых или мольных долях. [c. 61]
61]
К первой группе относятся часто встречающиеся массовые долил массовые проценты, удобные для применения во многих химических расчетах мольные доли и мольные проценты, а также часто используемую моляль-ность, которая указывает число молей растворенного вещества на 1 кг растворителя. Ко второй группе относятся выражения концентрации в виде парциального давления, а также применяемая для разбавленных растворов [c.231]
Массовая доля, гип процентное содержание растворенною вегцества, есть отношение jua u растворенною вещества к Aia e раствора, выраженное в процентах. Так, 12%-ный раствор КОН должен содержать 12 единиц массы КОН в 100 единицах массы раствора, и для его приготовления следует взять 12 единиЦ массы КОН и 88 единиц массы растворителя. [c.49]
Многообразие условий задач создается, во-иервых, те.м, что известное и неизвестное могут относиться то к одним, то к другим веществам. Во-вторых, число вариантов задач увеличивается за счет того, что данные о веществах указываются с ис-пользонанием разных величин массы (в г), количества вещества (в моль), объема (в л), если речь идет о газах. Кроме того, в-третьих, нередко известное дано в неявном виде, например дана масса не чистого вещества, а его раствора с известной массовой долей растворенного вещества (в процентах), или дана масса вещества, загрязненного примесями, массовая доля которых известна. В этих случаях приходится проводить дополнительные вычисления массы (пли объема) чистого вещества. Какие бы ни были варианты, принцип решения всегда одни — составление пропорции пз четырех данных и ее решение. [c.48]
Во-вторых, число вариантов задач увеличивается за счет того, что данные о веществах указываются с ис-пользонанием разных величин массы (в г), количества вещества (в моль), объема (в л), если речь идет о газах. Кроме того, в-третьих, нередко известное дано в неявном виде, например дана масса не чистого вещества, а его раствора с известной массовой долей растворенного вещества (в процентах), или дана масса вещества, загрязненного примесями, массовая доля которых известна. В этих случаях приходится проводить дополнительные вычисления массы (пли объема) чистого вещества. Какие бы ни были варианты, принцип решения всегда одни — составление пропорции пз четырех данных и ее решение. [c.48]
Массовая доля—безразмерная величина. Ее выражают в долях от единищл, в процентах или промилле. Например, водный раствор серной кислоты с массовой долей 10% содержит 10 единиц массы НгЗОд в 100 единицах массы раствора. Следовательно, в 100 единицах массы раствора содержится 10 единиц массы растворенного вещества (в данном случае НзЗОд) и 90 единиц массы растворителя (в данном случае воды).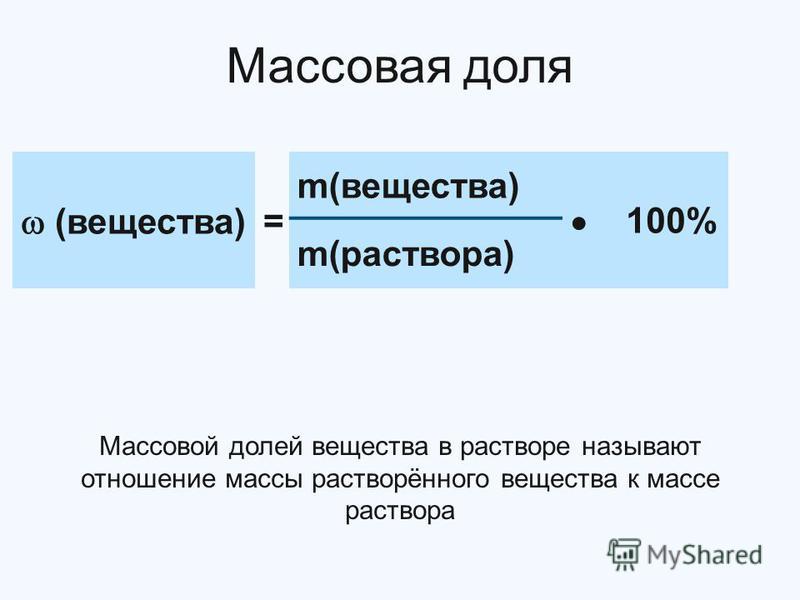 [c.33]
[c.33]
Состав вещества необходимо знать для определения направления и скорости массообменного прЪцесса. Его выражают в массовых процентах (мае. %) и массовых долях или чаще в молярных процентах (мол. %) или молярных долях. Если рассматривать смесь, состоящую из двух компонентов — А и В, и принять, что а — массовой процент легколетучего компонента А Ь = —а — массовый процент компонента В Мд — молекулярная масса комнонен-та Л тИв —молекулярная масса компонента В Ха — молекулярная доля легколетучего вещества А в растворе, то связь между массо-«выми а, й и молярными Ха и Хв долями компонентов выражается формулами [c.153]
Отношение массы (объема, числа молей) растворенного вещества к общей тмассе (объему, числу молей) раствора — массовая (объемная, мольная) доля. Обычно находят отношение этих характеристик для 100 единиц раствора. Полученная таким образом величина в 100 раз больше соответствующей доли и называется массовой (объемной, мольной) процентной концентрацией. Объемные проценты обычно используются как характеристики газовых растворов, массовые и мольные проценты — во всех случаях. [c.99]
Объемные проценты обычно используются как характеристики газовых растворов, массовые и мольные проценты — во всех случаях. [c.99]
Массовая доля элемента в сложном веществе
С XIX века химия перестала быть описательной наукой. Учёные широко стали использовать методы измерения различных параметров веществ.
Массовая доля элемента – это отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или в процентах).
Массовая доля элемента в веществе обозначается латинской буквой ω (дубль-вэ) и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Массовая доля элемента в веществе выражается в долях единицы или в процентах. Часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Например,
в состав оксида ртути HgO входит два элемента –
ртуть и кислород. При нагревании этого вещества массой 50 г получается 46,3 г
ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
При нагревании этого вещества массой 50 г получается 46,3 г
ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
Рассчитаем массовую долю кислорода в веществе. Для этого массу кислорода разделим на массу смеси. Подставим значения масс веществ. Получаем:
Учитывая, что сумма массовых долей элемента в веществе равна единице, или 100 %, массовую долю кислорода можно найти по разности:
Для того, чтобы найти массовую долю элемента в веществе, нужно относительную атомную массу этого элемента умножить на число атомов данного химического элемента в веществе и разделить на относительную молекулярную массу вещества.
Определим массовую долю кислорода в серной кислоте. Для этого найдём относительную молекулярную массу серной кислоты. Необходимо значения все относительных атомных масс элементов сложить.
Mr (H2SO4) = Ar (H) · 2 + Ar (S) + Ar (O) · 4 = 1 · 2 + 32 + 16 · 4 = 98
Найдём массовую долю кислорода. Для
этого нужно относительную атомную массу кислорода умножить на 4 и разделить на
относительную молекулярную массу всего вещества. Получается 0,653, или 65,3 %.
Для
этого нужно относительную атомную массу кислорода умножить на 4 и разделить на
относительную молекулярную массу всего вещества. Получается 0,653, или 65,3 %.
Рассчитаем массовые доли элементов в метане, формула которого CH4. Для этого определим относительную молекулярную массу метана. Подставим значения относительных атомных масс и получим 16.
Mr (CH4) = Ar (C) + Ar (H) · 4 = 12 + 1 · 4 = 16
Затем найдём массовую долю углерода в метане. Для этого 12 умножим на 1 и разделим на 16. В результате образуется 0,75, или 75 %.
Для того, чтобы найти массовую долю водорода в метане, следует от 1 вычесть массовую долю углерода. Получается 0,25, или 25 %.
Пирит,
или золотая обманка, имеет ярко-жёлтый золотистый цвет, похож на золото,
поэтому и получил название «золото дураков». Испанские завоеватели грабили
индейцев ради изделий из пирита и увозили их домой в Европу. Пирит путали с
золотом и во время золотой лихорадки на Аляске. Это хорошо описано в книге
Джека Лондона. Минерал пирит, состоящий из 46,6 % железа и 53,4 % серы, внешним
видом очень напоминает золото. Вычислим химическую формулу пирита.
Пирит путали с
золотом и во время золотой лихорадки на Аляске. Это хорошо описано в книге
Джека Лондона. Минерал пирит, состоящий из 46,6 % железа и 53,4 % серы, внешним
видом очень напоминает золото. Вычислим химическую формулу пирита.
Обозначим формулу пирита FexSy. Затем найдём соотношение индексов x и y. Для этого значения массовых долей разделим на относительные атомные массы элементов. Подставим значения и получим соотношение 0,0083 : 0,0167.
Приведём соотношения индексов к целым числам. Для этого нужно каждое значение разделить на меньшее число в соотношении. Получим 1 : 2. Значит, формула пирита FeS2.
§ 34. Массовая доля растворенного вещества
Задание 1
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант и знания параграфа.
Задание 2
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант. Помни формулу вычисления массовой доли.
Задание 3
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант и знания параграфа. Запомни отличия концентрированного раствора от насыщенного. В концентрированном растворе высокое содержание растворенного вещества, а в насыщенном, растворенных вещество достигает максимальной концентрации.
Задание 4
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант. Помни формулу вычисления массовой доли.
Задание 5
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант.Помни формулу вычисления массовой доли
Задание 6
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант. Помни формулу вычисления массовой доли.
Задание 7
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант. Помни формулу вычисления массовой доли Первым действием найди массу растворенного вещества.
Задание 8
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант. Помни формулу вычисления массы через объём и плотность.
Задание 9
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант. Помни формулу вычисления плотности.
Тест
Условие:
Решение:
Советы:
Никогда не списывай слово в слово. Попробуй подумать и ответить самостоятельно, основываясь на предложенный вариант.
Что такое массовая доля элемента в веществе и для чего её вычисляют? | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема: Химические системы [смеси и растворы]
Что такое массовая доля элемента в веществе? Химические формулы — важный источник информации о веществах.
Также по формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в его состав.
Массовая доля элемента w(E) в соединении — это отношение массы этого элемента в соединении к массе соединения.
То есть
w(E) = n • Ar(E) / Mr (вещества),
где n — количество атомов химического элемента Е; Ar(E) — относительная атомная масса элемента; Мr (вещества) — относительная молекулярная масса вещества. Символ массовой доли произносят «дубль-вэ» или «дабл-ю».
Символ массовой доли произносят «дубль-вэ» или «дабл-ю».
Массовая доля не имеет размерности. Тем не менее довольно часто содержание химического элемента в веществе выражают в процентах.
Для чего вычисляют массовые доли? Понятие доли применимо не только для характеристики содержания химических элементов в составе вещества. Например — содержание (объемные доли) азота, кислорода и других газов в воздухе, массовая доля растворенного вещества в растворе.
Для золотых и серебряных сплавов указывают массовую долю драгоценного металла — так называемую пробу (рис. 10.1, 1-2). На этикетках лекарственных препаратов (рис. 10.1, 3) есть информация о содержании (массовой доле) компонентов.
Сведения о массовых долях металлических элементов в рудах нужны металлургам. А производители минеральных удобрений — аммиачной селитры, мочевины — обязательно указывают на упаковках массовую долю азота. Материал с сайта http://worldofschool.ru
Материал с сайта http://worldofschool.ru
| Рис. 10.1. 1. Памятная монета «Телец». На аверсе монеты из серебра — обозначение металла, его пробы: Ag 925 (w(Ag) = 92,5%). 2. Юбилейная монета «Киевский псалтырь». На аверсе этой монеты находятся обозначение и проба драгоценного металла Au 900 (w(Au) = 90,0%). 3. Лекарственные препараты |
Химия решебник процентная концентр растворов
Что такое массовая доля элемента в веществе.
процентов по массе и массовым фракциям Учебное пособие по химии
процентов по массе и массовой фракции Учебное пособие по химии Больше бесплатных руководств Становиться участником Члены Вход & тире; в Связаться с намиХотите игры по химии, упражнения, тесты и многое другое?
Вам необходимо стать членом AUS-e-TUTE!
Ключевые понятия
- Массовая доля также известна как массовая доля.
 Массовая доля
Массовая доляобозначена символом m / m 1
массовая доля обозначена символом w / w - Массовый процент также известен как массовый процент.
процентов по массе обозначается символом m / m% (или мас.%).
процентов по массе обозначается символом мас.% (Или мас.%) - Массовая доля (массовая доля) и массовые проценты (массовые проценты) являются измерениями концентрации растворенного вещества.
- Массовая доля (массовая доля) — это отношение массы одного компонента раствора к общей массе раствора. 2
- Массовая доля (а) = масса (а) ÷ (масса (а) + масса (б) + масса (в) +…)
масса (а) = масса компонента а
масса (b) = масса компонента b
масса (c) = масса компонента cДля двухкомпонентного раствора, состоящего из растворенного вещества, растворенного в растворителе:
массовая доля (растворенное вещество) = масса (растворенное вещество) ÷ (масса (растворенное вещество) + масса (растворитель) )
- При сложении массовая доля (массовая доля) каждого компонента в растворе должна равняться единице:
массовая доля (а) + массовая доля (б) + массовая доля (в) +.
 … = 1
… = 1Для двухкомпонентного раствора, состоящего из растворенного вещества, растворенного в растворителе:
массовая доля (растворенное вещество) + массовая доля (растворитель) = 1
- Масса (вес) может быть в любых единицах, если они являются одинаковыми единицами для всех компонентов.
- Процент по массе (процент по массе) — это процент от общей массы раствора, который составляет один компонент.
Массовый процент = массовая доля × 100
ИЛИ
Массовый процент = массовая доля × 100Это также можно выразить как:
мас.% A = масса (а) ÷ (масса (а) + масса (б) + масса (в) + …) × 100
вес. % а = вес (а) ÷ (вес (а) + вес (б) + вес (в) + …) × 100 - При сложении массовый процент (или вес) всех компонентов в растворе равен 100:
мас.
 % A + мас.% B + мас.% C +…. = 100
% A + мас.% B + мас.% C +…. = 100
ИЛИ
мас.% A + мас.% B + мас.% C + …. = 100Для двухкомпонентного раствора, состоящего из растворенного вещества, растворенного в растворителе:
мас.% (Растворенное вещество) + мас.% (Растворитель) = 100
ИЛИ
мас.% (Растворенное вещество) + мас.% (Растворитель) = 100
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Массовая доля (массовая доля) Расчет концентрации
Вопрос 1. Какова массовая доля (массовая доля) хлорида натрия в водном растворе, содержащем 560 мг хлорида натрия и 10,4 г воды?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (NaCl) и растворителя (H 2 O).
масса (NaCl) = 560 мг
масса (H 2 O) = 10,4 г - Преобразование всех единиц массы в одни и те же единицы (например, все массы в граммах):
масса (NaCl) = 560 мг = 560 × 10 -3 г = 0.
 560 г
560 г
масса (H 2 O) = 10,4 г - Напишите уравнение для расчета массовой доли (массовой доли) хлорида натрия:
массовая доля (NaCl) = масса (NaCl) ÷ (масса (NaCl) + масса (H 2 O) )
- Подставьте значения в уравнение и решите:
массовая доля (NaCl) = 0.560 ÷ (0,560 + 10,4) = 0,051
Вопрос 2. Если в 500 г водного раствора сахарозы массовая доля воды составляет 0,65, какая масса сахарозы присутствует?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (сахароза) и растворителя (вода).
масса (водный раствор) = 500 г
массовая доля (вода) = 0.65
масса (сахароза) =? г - Рассчитайте массовую долю сахарозы:
массовая доля (сахароза) + массовая доля (вода) = 1
массовая доля (сахароза) = 1 — массовая доля (вода) = 1 — 0,65 = 0,35
- Рассчитайте массу присутствующей сахарозы:
массовая доля (сахароза) = масса (сахароза) ÷ общая масса (раствор)
масса (сахароза) = массовая доля (сахароза) × масса (раствор)
масса (сахароза) ) = 0. 35 х 500 = 175 г
35 х 500 = 175 г
Массовый процент (массовый процент) Расчет концентрации
Вопрос 1. Водный раствор хлорида калия содержит 78% воды по массе.
Каков массовый процент хлорида калия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества, хлорида калия (KCl), и растворителя, воды (H 2 O).
мас.% (Вода) = 78%
мас.% (KCl) =? % - Напишите уравнение для расчета массовых% (KCl):
мас.% (KCl) + мас.% (H 2 O) = 100
Перепишите уравнение, чтобы найти% KCl по массе:
мас.% (KCl) = 100 — мас.% (H 2 O) - Подставьте значения в уравнение и решите:
мас.% (KCl) = 100 — 78 = 22%
Вопрос 2. Водный раствор содержит 700 г воды и 45 г гидроксида натрия.
Какой процент по массе гидроксида натрия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (NaOH) и растворителя (H 2 O).
масса (H 2 O) = 700 г
масса (NaOH) = 45 г
мас.% (NaOH) =? % - Напишите уравнение для нахождения% масс:
мас.% NaOH = масса (NaOH) ÷ (масса (NaOH) + масса (H 2 O) ) × 100
- Подставьте значения (все массы должны иметь одинаковые единицы измерения) в уравнение и решите:
мас.% NaOH = 45 ÷ (45 + 700) × 100 = 6.04%
Вопрос 3. Водный раствор содержит 42% этанола по массе.
Какая масса этанола содержится в 250 г раствора?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (этанол) и растворителя (вода).

мас.% Этанола = 42%
масса (раствор) = масса (этанол) + масса (вода) = 250 г
масса (этанол) =? г - Напишите уравнение для нахождения этанола в% по массе:
мас.% Этанола = масса (этанол) ÷ масса (раствор) × 100
Переставьте уравнение, чтобы найти массу этанола:
масса (этанол) = мас.% Этанола × масса (раствор) ÷ 100
- Подставьте значения в уравнение и решите:
масса (этанол) = 42 × 250 ÷ 100 = 105 г
1.НЕ путайте м / м с м / м.
м / м относится к массовой доле
м / м относится к расчету в молях, моль = масса ÷ молярная масса
2. НЕ путайте процент по массе (или весовой концентрации) с процентной концентрацией по весу.
процентов по массе = масса (растворенного вещества) ÷ масса (раствор) × 100
массовое соотношение процентная концентрация = масса (растворенного вещества) ÷ масса (растворитель) × 100
Предупреждение!
Некоторое содержимое на этой странице не может быть отображено.
Пожалуйста, включите JavaScript и всплывающие окна для просмотра всего содержимого страницы.
© AUS-e-TUTEwww.ausetute.com.au
Определение, примеры, проблемы, расчет ~ ChemistryGod
Массовая доля — это свойство смеси. Смесь — это физическая комбинация двух или более различных веществ. Типы смесей — растворы, суспензии и коллоиды.
Рис. 1. Типы смесей: растворы (соль и вода), суспензии (почва и вода) и коллоиды (молоко) (слева направо).[Источники изображений: Викимедиа, Flickr и общественное достояние]
В области химии, большинство смесей представляют собой растворы, гомогенную смесь растворенного вещества и растворителя.Но приведенное ниже определение массовой доли применимо и к другим типам.
Содержание
Определение и формула
Массовая доля вещества в смеси — это отношение массы вещества к общей массе смеси. Он также известен как массовый процент или массовый процент при выражении в процентах. Поскольку массовая доля представляет собой отношение массы к массе, это безразмерная величина.
Поскольку массовая доля представляет собой отношение массы к массе, это безразмерная величина.
Для смеси
Здесь w i — массовая доля компонента i th , m i — масса компонента i th , и м T — общая масса смеси.
Общая масса смеси — это сумма масс каждого компонента.
Используя два приведенных выше уравнения,
Примечание: сумма всех массовых долей равна единице.
Примечание: массовая доля вещества не зависит от давления, температуры и местоположения; это интенсивное количество. Он остается постоянным, если не происходит химического изменения или чистого физического переноса какого-либо вещества. Итак, массовый процент вина (в приведенном выше примере) постоянен во всем мире.
Массовая доля растворенного вещества в растворе определяется как отношение массы растворенного вещества к массе раствора.
Пусть m растворенного вещества будет массой растворенного вещества и m раствора , масса раствора. Массовая доля растворенного вещества выглядит следующим образом:
Массовая доля растворенного вещества выглядит следующим образом:
Массовый процент
Массовая доля также известна как массовый процент, массовый процент, массовый процент или массовый процент, когда выражается в процентах.Это сокращенно мас.% Или мас.%.
Для раствора:
Связь с другими величинами
Массовая доля — это одна из величин, используемых для выражения состава смеси. Но есть и другие величины, такие как мольная доля, молярность, массовая концентрация и другие. Некоторые из них обсуждаются ниже.
Пропорция смешивания
Пропорция смешивания компонента — это относительное содержание этого компонента в смеси по сравнению с другими компонентами. Пусть m 1 будет массой чистого вещества 1 и m 2 , чистого вещества 2.Соотношение смеси составляет х м .
Теперь мы можем выразить w 1 и w 2 через r m .
Мольная доля
Мольная доля широко используется в химии и технике. Это также безразмерная величина, представляющая собой отношение молей компонента к общему количеству молей смеси. Обычно обозначается как x i .
Пусть n i будет моль i th компонента смеси.Общее количество моль в смеси
. Мольная доля компонента i th составляет x i .Мы также знаем, что моль вещества — это отношение массы ( m i ) к молярной массе ( M i ).
Используя два приведенных выше уравнения,
Здесь
— средняя молярная масса смеси. Но мы тоже это знаем.Подставив
,Таким образом, мы установили связь между мольной долей и массовой долей.
Объемная доля
Объемная доля ( v i ) — это объем компонента ( V i ) к общему объему смеси ( V mix ).
Объем делится на массу, разделенную на плотность.
Массовая концентрация
Массовая концентрация растворенного вещества ( ρ i ) — это отношение массы растворенного вещества ( m i ) к объему раствора ( V ).
Здесь
— плотность раствора ( ρ ).Из приведенного выше уравнения массовая концентрация растворенного вещества — это массовая доля растворенного вещества, умноженная на плотность раствора.
Молярность или молярная концентрация
Молярность или молярная концентрация ( C i ) — это моль растворенного вещества ( n i ) на единицу объема раствора ( V ). Объем раствора обычно выражается в дециметровых кубах (дм 3 ).
Моль вещества — это масса, деленная на молярную массу. А плотность — это масса, разделенная на объем.
Процентный состав
Составное соединение состоит из различных элементов. Когда рассчитывается массовая доля элемента, она называется процентным составом этого элемента. Короче говоря, массовая доля и процентный состав одинаковы, когда речь идет об элементах соединения.
Когда рассчитывается массовая доля элемента, она называется процентным составом этого элемента. Короче говоря, массовая доля и процентный состав одинаковы, когда речь идет об элементах соединения.
Решенные проблемы
Проблема 1: Воздух
Заявление: Воздух содержит 21% кислорода и 79% азота.Молярная масса кислорода и азота составляет 15,999 г моль -1 и 14,007 г моль -1 .
Решение: Вышеуказанные проценты даны не по массе, а в молях. Итак, в 100 моль воздуха содержится 21 моль кислорода и 79 моль азота.
Преобразование моля в грамм,
Пусть w O 2 и w N 2 будут массовыми долями кислорода и азота соответственно.
Таким образом, массовая доля кислорода и азота составляет 23% и 77%.
Проблема 2: Газовая труба
Утверждение: Газовая труба содержит 2 моля диоксида углерода, 10 моль кислорода, 52 моль азота и 1,3 моль метана. Молярная масса водорода, углерода, азота и кислорода составляет 1,008 г моль -1 , 12,011 г моль -1 , 14,007 г моль -1 и 15,999 г моль -1 .
Молярная масса водорода, углерода, азота и кислорода составляет 1,008 г моль -1 , 12,011 г моль -1 , 14,007 г моль -1 и 15,999 г моль -1 .
Решение: молярная масса диоксида углерода, кислорода, азота и метана должна быть M CO 2 , M O 2 , M N 2 и М СН 4 .
Преобразование моля в грамм,
Массовая доля рассчитывается как:
Задача 3: Серная кислота
Утверждение: Молярная концентрация серной кислоты составляет 2,0 М или 2 моль дм −3 . Молярная масса серной кислоты составляет 98,08 г · моль -1 . Плотность раствора 1,19 г · см −3 .
Решение. Возьмите 1 л (или 1 дм −3 ) раствора.
Моль серной кислоты в 1 л раствора составляет
Если перевести моль в грамм,
Таким образом, в 1 л раствора содержится 196. 16 г серной кислоты.
16 г серной кислоты.
Плотность раствора 1,19 г см −3 . На 1 л раствора масса раствора составляет
Массовая доля серной кислоты в 1190 г раствора составляет
Практические задачи
Найдите массовую долю в следующих задачах.
Задача 1: Изопропиловый спирт
Раствор изопропилового спирта содержит 40 г изопропилового спирта и 20 г воды. Молярная масса изопропилового спирта и воды составляет 60 г моль -1 и 18 г моль -1 .
Задача 2: гидроксид натрия
Молярность раствора гидроксида натрия составляет 0,51 М. Молярная масса гидроксида натрия составляет 40 г · моль -1 . Плотность раствора 1,02 г · см −3 .
Проблема 3: Выхлоп из дымохода
Выхлоп из дымохода содержит 10 моль кислорода (O 2 ), 53 моль азота (N 2 ) и 37 моль диоксида углерода (CO 2 ). Молярная масса кислорода, азота и диоксида углерода составляет 32 г моль -1 , 28 г моль -1 и 44 г моль -1 .
- 0,67 изопропилового спирта и 0,33 воды.
- 0,020 гидроксида натрия.
- 0,09 кислорода, 0,43 азота и 0,48 диоксида углерода.
Связанные статьи
2,10: Процентный состав — Химия LibreTexts
цели обучения
- Введите массовый процент и мольную долю
- Расчет массового процента по химическим формулам
Введение
Процент и дробь по сути говорят вам об одном и том же, они описывают отношение части к целому.Поскольку химическое соединение имеет постоянный состав, который определяется молекулярной формулой или формулой соединения, доля каждого типа элемента должна быть постоянной. Например, вода имеет 3 атома, один водород и два атома кислорода. Таким образом, доля кислорода составляет 1/3 (33,3%), а доля водорода — 2/3 (66,7%), как показано на левой круговой диаграмме на Рисунке \ (\ PageIndex {1} \). Но вода весит в 16 раз больше водорода, и поэтому, если бы вы могли взвесить молекулу воды, масса кислорода была бы 16 дальтон, а масса двух атомов водорода была бы 2 дальтон, так что на основе массы вода равна 88. 9% кислорода и 11,1% водорода. Поэтому, когда мы говорим о фракционном или процентном составе, нам нужно определить, как мы его определяем. Обычно, но не всегда, химики используют процентное соотношение для массы и доли для молей (количества частиц).
9% кислорода и 11,1% водорода. Поэтому, когда мы говорим о фракционном или процентном составе, нам нужно определить, как мы его определяем. Обычно, но не всегда, химики используют процентное соотношение для массы и доли для молей (количества частиц).
| Молярная доля / процент воды | Массовая доля / процент воды |
Рисунок \ (\ PageIndex {1} \): мольные (слева) и массовые (справа) доли (или проценты) кислорода и водорода в воде.
Итак, вода — это в основном кислород или водород? Ну, это смотря как на это смотреть. Если считать атомы, это в основном водород. Если вы измеряете массу, это в основном кислород.
Массовый процент
Массовый процент любого элемента в соединении равен 100-кратной массе элемента, деленной на общую массу
\ [\ mathrm {Масса \: \% \: element = \ dfrac {масса \: element} {масса \: соединение} \ times100 \%} \]
Один моль воды весит 18 граммов, из которых 2 грамма — водород, а 16 — кислород, поэтому доля водорода составляет 2/18 (0. 1111), а доля кислорода составляет 16/18 (0,8889), и обратите внимание, что сумма фракций равна 1. Процентное содержание элемента в соединении в 100 раз больше доли, поэтому для воды массовый процент водорода составляет 11,11%. и массовый процент кислорода составляет 88,89%.
1111), а доля кислорода составляет 16/18 (0,8889), и обратите внимание, что сумма фракций равна 1. Процентное содержание элемента в соединении в 100 раз больше доли, поэтому для воды массовый процент водорода составляет 11,11%. и массовый процент кислорода составляет 88,89%.
\ [\ mathrm {Масса \: \% H = \ dfrac {масса \: H} {масса \: соединение} \ times100 \%} \]
\ [\ mathrm {Масса \: \% O = \ dfrac {масса \: O} {масса \: соединение} \ times100 \%} \]
для воды
\ [\ mathrm {Масса \: \% H = \ dfrac {2g} {18g} \ times100 \%} = 11.11% \]
\ [\ mathrm {Масса \: \% O = \ dfrac {16g} {18g} \ times100 \%} = 89,99% \]
Уравнения 2.10.4 и 2.10.5 описывают правую круговую диаграмму на рисунке \ (\ PageIndex {1} \), и обратите внимание, что они добавляют к 100%.
Видео \ (\ PageIndex {1} \) демонстрирует метод вычисления процентного состава формулы, который сводит к минимуму объем работы, которую вам необходимо выполнить.
ПРИМЕЧАНИЕ: Несмотря на то, что масса выражается в единицах, массовый процент выражается без единицы измерения, поэтому необходимо проявлять осторожность, чтобы определить, к чему относится процент или доля. Кроме того, поскольку образец чистого вещества состоит из молекул или ионных соединений одной формулы, процентное или дробное значение не зависит от размера образца. Итак, одна молекула воды имеет тот же процентный состав, что и галлон [чистой] воды.
Кроме того, поскольку образец чистого вещества состоит из молекул или ионных соединений одной формулы, процентное или дробное значение не зависит от размера образца. Итак, одна молекула воды имеет тот же процентный состав, что и галлон [чистой] воды.
Также следует отметить, что, как показывают следующие два видео, некоторые формулы имеют одинаковый процентный состав, даже если они представляют собой разные молекулы, например, ацетилен (C 2 H 2 ) и бензол (C 6 H 6 ).
Упражнение \ (\ PageIndex {1} \)
Каков массовый процент кислорода в гептоксиде дихлора?
- Ответ
Масса Cl в 1 моль Cl 2 O 7 , 2 Cl: 2 x 35,45 г = 70,90 г
Масса O в 1 моль Cl 2 O 7 , 7 O: 7 x 16,00 г = 112,00 г
Молярная масса of Cl 2 O 7 = 182,90 г / моль
\ [\% \: \ ce {O} = \ frac {112.
 00 \: \ text {g} \: \ ce {O}} {182.90 \: \ text {g}} \ times 100 \% = 61.24 \% \: \ ce {O} \ nonumber \]
00 \: \ text {g} \: \ ce {O}} {182.90 \: \ text {g}} \ times 100 \% = 61.24 \% \: \ ce {O} \ nonumber \]
Молярная доля
Мольная доля каждого элемента в образце — это количество молей этого элемента в образце, деленное на общее количество молей в образце, и это может быть определено с помощью химической формулы, где это количество атомов этого элемента. элемент в формуле, деленный на общее количество атомов в формуле.
\ [\ mathrm {моль \: фракция \: из \: \: элемент \: = \ dfrac {моль \: из \: \: элемент} {всего \: моль \: в \: соединение}} \ ]
показывает номера каждого типа элементов, поэтому один моль воды (H 2 O) содержит два моля водорода и один моль воды.То есть мольная доля водорода составляет 2/3 (0,6667), а мольная доля кислорода составляет 1/3 (0,33333), что означает, что мольная доля воды составляет 67% водорода и 33% кислорода.
\ [\ mathrm {моль \: фракция \: H = \ dfrac {моль \: H} {общая \: моль \: в \: соединение}} \]
\ [\ mathrm {моль \: фракция \: O = \ dfrac {моль \: O} {общая \: моль \: в \: соединение}} \]
для воды
\ [\ mathrm {моль \: фракция \: H = \ dfrac {2 \: моль \: H} {3 \: mol} \: = \: 0. 667} \]
667} \]
\ [\ mathrm {моль \: фракция \: O = \ dfrac {1 \: моль \: O} {3 \: mol} \: = \: 0.333} \]
Уравнения 2.10.9 и 2.10.10 описывают правую круговую диаграмму на рисунке \ (\ PageIndex {1} \).
Упражнение \ (\ PageIndex {2} \)
Какова мольная доля кислорода в гептоксиде дихлора?
- Ответ
моль Cl в 1 моль Cl 2 O 7 = 2 моль Cl
Моль O в 1 моль Cl 2 O 7 = 7 моль
Всего молей в Cl 2 O 7 = 9
\ [моль \: фракция \: \ ce {O} = \ frac {7 \: \ text {mol O}} {9 \ text {общее количество молей}} =.778 \ nonumber \]
Авторы и авторство
Роберт Э. Белфорд (Арканзасский университет Литл-Рока; факультет химии). За широту, глубину и достоверность этой работы отвечает Роберт Э. Белфорд, [email protected]. Вам следует связаться с ним, если у вас возникнут какие-либо вопросы. Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
- Рония Каттум (учебные цели)
Как рассчитать соотношение массовых долей химический класс 10 CBSE
Совет: Вы можете просто узнать массовую долю при вычислении мольной доли.Это отношение массы этого компонента к общей массе смеси. Получается массовая доля, для преобразования ее в проценты необходимо умножить ее на 100 долларов. При разделении учтите, что единицы грамма аннулируются. Полный пошаговый ответ:
Прежде чем перейти к точному решению задачи, давайте посмотрим, что такое массовая доля. Массовая доля — это доля данного конкретного компонента в данной смеси. Предположим, у вас есть азот, водород и гелий в контейнере, мы все знаем, что это газы, поэтому массовая доля, скажем, водорода — это количество водорода из этой смеси.
Формулу можно записать как- $ Масса \, фракция ({H_2}) = \ dfrac {{Масса \, из \, водорода \, газа}} {{Общая \, масса \, из \, \, смеси }} $
Или, в более общем смысле, мы можем сказать, $ Mass \, дробь \, of \, a \, component = \ dfrac {{Mass \, of \, that \, component}} {{Total \, mass \, of \, the \, смесь}} $
Теперь рассмотрим пример для вашего лучшего понимания, у нас есть $ 70 \, g \, {N_2} $, $ 20 \, g \, {O_2} $, $ 5 \, g \, He $, $ 5 \, g \, {H_2} $ в контейнере. Итак, чтобы найти массовую долю каждого компонента, давайте сначала вычислим общую массу смеси, которая составляет- $ 100 \, г $
Итак, чтобы найти массовую долю каждого компонента, давайте сначала вычислим общую массу смеси, которая составляет- $ 100 \, г $
Теперь для массовой доли азота $ Mass \, фракция ({N_2}) = \ dfrac { {Масса \, азота \, газа}} {{Общая \, масса \, \, \, смесь}} $
Подставляя значения в приведенную выше формулу, мы получаем уравнение следующего типа $ Масса \, дробь ({N_2}) = \ dfrac {{70 \, g}} {{100 \, g}} $
$ Масса \, дробь ({N_2}) = 0.70 \, g $
Аналогично возьмем массовую долю кислорода, который также присутствует в контейнере,
$ Mass \, фракция ({O_2}) = \ dfrac {{Масса \, of \, кислорода \, газа}} {{Общая \, масса \, из \, \, смесь}} $
$ Масса \, фракция ({O_2}) = \ dfrac {{20 \, g}} {{100 \, g}} $ = $ 0.20 \, g $
Теперь, если мы рассчитаем для других оставшихся газов, таких как гелий и водород, у них также будут те же вычисления —
Для газообразного гелия, $ Mass \, фракция (He) = \ dfrac {{5 \, g}} {{100 \, g}} $ = $ 0,05 \, g $
Для $ 5 \, g $ водорода, $ Mass \, дробь ({H_2}) = \ dfrac {{5 \, g}} {{100 \ , g}} $
Интересный факт о массовой доле, по которому вы можете легко проверить свои ошибки, заключается в том, что общая массовая доля всех газов, присутствующих в баллоне, равна $ 1 $. Эта сумма точно такая же, как мольная доля, которую мы обычно изучаем в наших книгах, что общая мольная доля всех компонентов равна $ 1 $. Если у нас есть двухкомпонентная система, в которой у нас есть два газа, то мольная доля одного компонента равна $ (1 — \, моль \, доля \, of \, other \, component) $.
Эта сумма точно такая же, как мольная доля, которую мы обычно изучаем в наших книгах, что общая мольная доля всех компонентов равна $ 1 $. Если у нас есть двухкомпонентная система, в которой у нас есть два газа, то мольная доля одного компонента равна $ (1 — \, моль \, доля \, of \, other \, component) $.
Примечание. Не умножайте на 100 долларов, поскольку нам нужна только массовая доля, а не массовый процент. Проверьте свои ошибки, суммируя массовую долю всех компонентов, добавляя их, если вы получаете 1 доллар, это означает, что ваш расчет верен.Убедитесь, что обе массы указаны в одной и той же единице, они обе могут быть в граммах или килограммах.
Конспект лекций RMP
Конспект лекций RMPПеременные процесса: Состав
Большинство материальных потоков в технологических установках представляют собой смеси соединений. Мы описываем состав потока по-разному.
Состав фракций
Доли композиции могут быть основаны на массе или на молях.
Используемые единицы измерения массы не имеют значения, пока верхняя и внизу соотношения используются те же единицы:
ПРИМЕР: Поток содержит 20 г газообразного кислорода, 70 г азота, 5 г гелия и 5 г водорода. Найти массовую и мольную доли, масса и составы в мольных процентах.
Во-первых, вам нужно найти массу каждого компонента (заданную), общую массу (добавить их вверх). Вам также необходимо рассчитать количество молей каждого компонента (разделить масса по молекулярной массе) и общее количество молей.
Теперь у вас есть все необходимое для расчета фракций состава. Результаты дроби можно проверить, сложив их — они должны равняться 1,0. Умножьте фракции на 100, чтобы получить процентный состав. Единица концентрации, часто встречающаяся при использовании в окружающей среде, составляет частей на
млн или частей на миллион . Это граммы растворенного вещества в 1 млн г
решение. PPM (или ppb) — это особый вид массовой доли.
PPM (или ppb) — это особый вид массовой доли.
Часто вам будут давать состав в процентном или дробном виде, но для решения задачи вам необходимо знать массы отдельных компонентов (если только перевести в молярный состав).Позаботьтесь об этом, приняв база 1 кг, 100 моль и т.д. и работать оттуда. Ведь если смесь состоит из 21 мольного процента кислорода, не имеет значения, если у вас есть 5 г или 30 фунтов или 200 моль — процентный или фракционный состав такой же.
ПРИМЕР: Воздух содержит около 78 мольных процентов азота, 21 молярный процент. кислород и 1 процент аргона. Каков его массовый состав?
Вы не знаете, сколько у вас воздуха (общее количество молей или общая масса), но это не имеет значения.Поэтому выберите базовую сумму, при которой расчет легкий. Когда составы даны в процентах, за основу принимается 100 всегда хорошо, так как не требует умножения или деления. Я думаю, я буду работать в фунтах-молях.
ОСНОВА: 100 моль воздуха ЗАПИШИТЕ!
Средний молекулярный вес смеси рассчитывается из
молярный состав и молекулярная масса. Это средневзвешенное значение — молекулярные массы усредняются с использованием мольных долей в качестве веса.
Это средневзвешенное значение — молекулярные массы усредняются с использованием мольных долей в качестве веса.
ПРИМЕР: Рассчитайте средний молекулярный вес воздуха.
Предположим, что воздух состоит на 79 мол.% Азота и 21 мол.% Кислорода.
ОСНОВА: 1 гмоль воздуха.
Таким образом, после учета значащих цифр ответ будет 29 г / моль.НЕ ДОЛЖНЫ пытаться рассчитать среднюю плотность или средний удельный вес. с использованием средневзвешенного арифметического. Если вы посмотрите, что это делает, единицы не получается. Вы должны использовать взвешенное гармоническое среднее.
Концентрация
Часто используются термины «состав» и «концентрация».
взаимозаменяемо.На этом этапе мы хотим прояснить разницу. Концентрация основана на объеме и является одним из способов выражения
сочинение. Массовая концентрация — это
масса компонента на единицу объема, аналогично молярная концентрация равна
молей на единицу объема.
ПРИМЕР: Если я растворю 1 г соли в 1000 литров воды, что концентрация смеси?
Предположим, что объемов добавки.
Концентрация — это граммы растворенного вещества, деленные на объем смеси (вода и растворенное вещество).
Чтобы упростить задачу, обратите внимание, что объем соли, вероятно, очень велик. намного меньше, чем у воды; следовательно, пренебрежем громкостью соль. НАПИШИТЕ «Предположим, что количество соли незначительно». Если бы это была важная проблема, мы, вероятно, захотели бы вернуться и обосновать наше предположение, посмотрев плотность соли и оценив, как Во многом предположение изменило ответ.В этом примере я предполагал дополнительные объемы. Вообще говоря, если мы добавить 1 м 3 компонента A к 1 м 3 компонента B, мы не может быть гарантированно получить 2 м 3 смеси.Когда это правда, мы говорим, что «объемы прибавляются» или что «объем добавляется».
Объемы складываются только в том случае, если смесь «идеальная». Детали
Идеальность будет обсуждаться в термодинамике ЧЭ, но пока
обычно принимают за идеальных решения. Это, наверное, нормально, если все
компоненты аналогичны, и если температура и давление не
крайность, но необходимо заявить об идеальности.
Детали
Идеальность будет обсуждаться в термодинамике ЧЭ, но пока
обычно принимают за идеальных решения. Это, наверное, нормально, если все
компоненты аналогичны, и если температура и давление не
крайность, но необходимо заявить об идеальности.
Когда концентрация рассчитывается в гмоль / литр, она называется Молярность , сокращенно M.
ПРИМЕР: Сколько КОН содержится в 5 мл 2 М раствора?
Концентрация — это граммы растворенного вещества, деленные на объем смеси (вода и растворенное вещество).
Вы ДОЛЖНЫ иметь возможность переключаться между объемным, массовым и молярным составом и течет быстро и без борьбы. Иначе все проблемы в этом классе займет намного больше времени, чем следовало бы.
Умный инженер обычно будет работать с проблемами в массе или кроте.
единиц, конвертируя при необходимости в единицы объема и обратно.Пытаюсь работать
Проблемы в основном в единицах объема часто являются источником проблем.
Артикул:
- Р.М. Felder & R.W. Rousseau, Элементарные основы химии Процессы (2-е изд.), Джон Вили, 1986, стр. 50-55.
- Д.М. Химмельблау, Основные принципы и расчеты в химической Engineering (6-е изд.), Prentice Hall, 1996, стр. 16-17, 22-26.
R.M. Цена
Оригинал: 02.06.94
Изменен: 24.08.95, 14.08.96, 26.08.98; 24.05.2004
Авторские права 1998, 2004 Р.М. Прайс — Все права защищены.
Сезонные колебания массовой доли водорастворимого органического углерода в аэрозолях в двух долинах Французских Альп
27 октября 2005 г.
27 октября 2005 г.
Ж.-Л. Яффрезо 1 , Г. Аймоз 1 , г. Делаваль 1 и J. Cozic 1, * Дж. -L. Jaffrezo et al.
Ж.-Л. Яффрезо 1 , Г. Аймоз 1 , г. Делаваль 1 и J. Cozic 1, *
-L. Jaffrezo et al.
Ж.-Л. Яффрезо 1 , Г. Аймоз 1 , г. Делаваль 1 и J. Cozic 1, * - 1 Laboratoire de Glaciologie et Géophysique de l’Environnement (LGGE), 54 rue Molière, 38 402 Saint Martin d’Hères Cedex, France
- * сейчас находится в Лаборатории химии атмосферы, Институт Поля Шеррера, 5232 Виллиген, PSI, Швейцария
- 1 Laboratoire de Glaciologie et Géophysique de l’Environnement (LGGE), 54 rue Molière, 38 402 Saint Martin d’Hères Cedex, France
- * сейчас находится в Лаборатории химии атмосферы, Институт Поля Шеррера, 5232 Villigen, PSI, Switzerland
Концентрации водорастворимого органического углерода (WSOC) и фракции WSOC по отношению к органическому углероду (OC) были измерены на двух городских участках в долинах Французских Альп в течение двух с половиной лет. Концентрации достигали 10–15 мкг С / м 3 зимой, но существует четкий сезонный цикл фракции WSOC с минимумами, приходящимися на зиму. Это отражает заметную зависимость от температуры, при этом средняя фракция WSOC стабильна на уровне 54,8 ± 7,7% и 75,9 ± 6,3% для температур в диапазонах от -10 до + 3 ° C и от 12 до 24 ° C, соответственно. В этой эволюции следует отметить несколько моментов. Во-первых, существуют ограничивающие факторы, которые предотвращают более низкие массовые доли в низкотемпературном диапазоне и более высокие массовые доли в высокотемпературном диапазоне.Во-вторых, массовая доля при более низкой температуре довольно высока, что явно противоречит тому, что ОС в основном нерастворимы вблизи источников выбросов. В-третьих, диапазон изменения фракции WSOC между этими экстремальными условиями в 20% действительно довольно узок по сравнению с оценками вторичной (и предположительно водорастворимой) фракции OC, предложенными в литературе, при этом большинство опубликованных значений относятся к диапазон от 40 до 70%.
Концентрации достигали 10–15 мкг С / м 3 зимой, но существует четкий сезонный цикл фракции WSOC с минимумами, приходящимися на зиму. Это отражает заметную зависимость от температуры, при этом средняя фракция WSOC стабильна на уровне 54,8 ± 7,7% и 75,9 ± 6,3% для температур в диапазонах от -10 до + 3 ° C и от 12 до 24 ° C, соответственно. В этой эволюции следует отметить несколько моментов. Во-первых, существуют ограничивающие факторы, которые предотвращают более низкие массовые доли в низкотемпературном диапазоне и более высокие массовые доли в высокотемпературном диапазоне.Во-вторых, массовая доля при более низкой температуре довольно высока, что явно противоречит тому, что ОС в основном нерастворимы вблизи источников выбросов. В-третьих, диапазон изменения фракции WSOC между этими экстремальными условиями в 20% действительно довольно узок по сравнению с оценками вторичной (и предположительно водорастворимой) фракции OC, предложенными в литературе, при этом большинство опубликованных значений относятся к диапазон от 40 до 70%. Сравнение динамики концентраций WSOC с динамикой дикарбоновых кислот (DCA) четко указывает на влияние двух режимов в образовании WSOC: одного при более высоких температурах, классически связанного с увеличением концентрации DCA и связанного с процессами окисления, а другого — при более высоких температурах. более низкие температуры, сопровождающиеся гораздо меньшим увеличением концентрации DCA.Мы предложили несколько гипотез, связанных с процессами, которые могут быть ответственны за высокие концентрации WSOC в фазе твердых частиц на наших участках в зимнее время.
Сравнение динамики концентраций WSOC с динамикой дикарбоновых кислот (DCA) четко указывает на влияние двух режимов в образовании WSOC: одного при более высоких температурах, классически связанного с увеличением концентрации DCA и связанного с процессами окисления, а другого — при более высоких температурах. более низкие температуры, сопровождающиеся гораздо меньшим увеличением концентрации DCA.Мы предложили несколько гипотез, связанных с процессами, которые могут быть ответственны за высокие концентрации WSOC в фазе твердых частиц на наших участках в зимнее время.
Массовая доля (химия)
В общем, массовая доля (обозначение: ω или y или ξ, часто упрощенное до w), ранее также массовая доля компонента в смеси, относительная масса компонента в общей массе смеси.Таким образом, он является одним из содержательных элементов информации.
Определение и расчет
Рассчитана массовая доля при разбивке массы компонента на общую массу смеси.
В которой:
С n компонентами:
Таким образом, массовая доля является мерой относительной массы компонента в смеси и в основном используется в Tw — фазовых диаграммах. Если массовая доля 1 соответствует компоненту в чистом виде, она равна 0, он не входит в смесь.
Умножая массовую долю на 100%, так что она также может быть выражена в процентах. Укажите размер; иногда это еще не формулировки DIN, которые необходимо найти в процентах по массе (Сокращение: вес -%) и в процентах по массе (сокращение: Ma% m или%).
Поскольку такая мера очень универсальна, она вытекает из его многочисленных приложений в различных областях, в частности, в химии (смешанная фаза), а также в минералогии, петрологии, материаловедении и материаловедении, например, состав горных пород, минералов (смешанный кристалл) и сплавы описать.
Решения
Для примера раствора рассчитывается соответствующая массовая доля растворителя и растворенных компонентов следующим образом:
При n растворенных компонентов:
Для приблизительных расчетов в частном случае предполагается, что массовая доля компонента по отношению к раствору пренебрежимо мала, и поэтому вы можете установить массовую долю раствора равной 1.


 Помни формулу вычисления массовой доли
Помни формулу вычисления массовой доли
 Массовая доля
Массовая доля … = 1
… = 1 % A + мас.% B + мас.% C +…. = 100
% A + мас.% B + мас.% C +…. = 100  560 г
560 г  35 х 500 = 175 г
35 х 500 = 175 г
 00 \: \ text {g} \: \ ce {O}} {182.90 \: \ text {g}} \ times 100 \% = 61.24 \% \: \ ce {O} \ nonumber \]
00 \: \ text {g} \: \ ce {O}} {182.90 \: \ text {g}} \ times 100 \% = 61.24 \% \: \ ce {O} \ nonumber \]