Сиcтематические названия некоторых кислот
Формулы:
НС1O
Название:
H2CO3
Триоксокарбонат (IV) водорода
H2Cr2O7
Гептаоксодихромат (VI) водорода
HClO4
Тетраоксохлорат (VI) водорода
HClO3
Триоксохлорат (V) водорода
HClO2
Диоксохлорат (III) водорода
HClO
Oксохлорат (I) водорода
HNO3
Триоксонитрат (V) водорода
HNO2
Диоксонитрат (III) водорода
H3PO4
Тетраоксофосфат (V) водорода
H2SO4
Тетраоксосульфат (VI) водорода
H2SO3
Триоксосульфат (IV) водорода
1.3.3. Графическое изображение формул кислот.
В бескислородных кислотах атомы водорода непосредственно связаны с атомом неметалла.
Н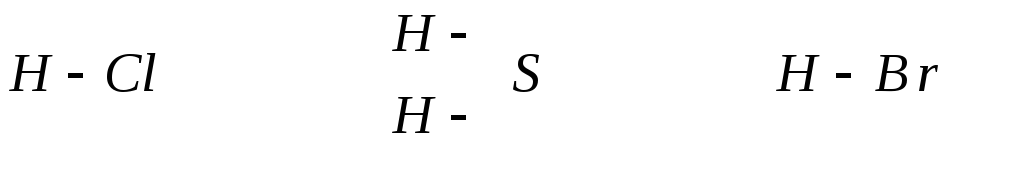 апример:
апример:
HCl H2S HBr
В кислородсодержащих кислотах атомы водорода, определяющие основность кислоты, связаны с атомом кислотообразующего элемента через атом кислорода. Атомы кислорода, не связанные с водородом, соединены c атомом кислотообразующего элемента кратными связями или же образуют кислородные мостики.
Н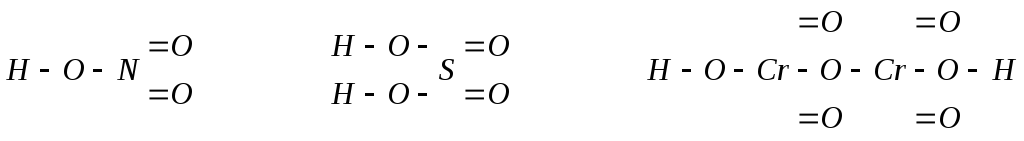
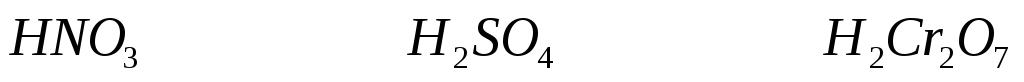
1.3.4. Физические свойства кислот.
Большинство кислот представляют собой жидкости (Н2SО4, НNО3 и др.) или твердые вещества (H3PO4, H2SiO3, H3BO3). Растворимые в воде кислоты придают раствору кислый вкус (за счет свободных ионов водорода), разъедают растительные и животные ткани, окрашивают индикаторы (лакмус, метилоранж и метилрот) в красный цвет.
1.3.5. Химические свойства кислот.
1. Кислоты взаимодействуют с основаниями (реакция нейтрализации), образуя соль и воду:
H2SO4 + 2КОН = K2SO4
+ 2Н2О2НNО3 + Мg(ОН)2 = Мg(NO3)2 + 2Н2О
Кислоты взаимодействуют с основными и амфотерными оксидами, образуя соль и воду:
Н2SО4 + СuO = СuSO4 + Н2О
6НС1 + Al2O3 = 2AlCl3 + ЗН2О
3. Кислоты могут взаимодействовать с солями более слабых или более летучих кислот, образуя новую соль и новую кислоту:
2НС1 + K2
Н2SО4 + 2NаС1 = Na2SO4 + 2НС1↑
в данных реакциях НСl и Н2SО4 вытесняют более слабую (Н2СО3) и более летучую (НСl) кислоты из их солей.
Кислоты реагируют с активными металлами с образованием соли и водорода:
2HCl + Мg = MgCl2 + Н2↑
Са + 2СН3СООН = Са(СН3СОО)2 + Н
2↑Так реакции будут протекать с любой растворимой в воде и не проявляющей специфического окислительного действия кислотой.
При реакциях металлов с кислотами — окислителями, например, Н2SO4 (концентрированный раствор) или HNO3 (раствор любой концентрации) водород практически не выделяется:
Cu + 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
8HNO3 (конц.) + 3Мg = 3Mg(NO3)2 + 2NO↑
Такие реакции специфичны и рассматриваются в теме «Окислительно-восстановительные реакции»
1.3.6. Способы получения кислот.
1. Бескислородные кислоты могут быть получены непосредственным синтезом из элементов, с последующим растворением полученного соединения в воде:
Н2 + С12 = 2НС1
Н2 + S = H2S
2. Кислородсодержащие кислоты могут быть получены взаимодействием некоторых кислотных оксидов (ангидридов кислот) с водой:
SO3 + H2O = Н2SО4
N2O5 + Н2О = 2HNO 3
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакции обмена между солями и кислотами:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
AgNO3 + HCl = AgCl↓ + НNO3
FeS + 2HCI = FeCl2 + H2S↑
CuSO4 + H2S = CuS↓ + H2SO4
Разница между одноосновными двухосновными и трехосновными кислотами
Основное отличие — одноосновные против двухосновных против трехосновных кислот
Кислоты — это химические соединения, обладающие кислотными свойствами. Кислота также может быть определена как химическое вещество, которое может реагировать с основанием, образуя соль и воду. Существует два основных типа кислот: сильные кислоты и слабые кислоты. Кислоты также можно разделить на три группы: одноосновные кислоты, двухосновные кислоты и трехосновные кислоты. Кислоты сгруппированы таким образом в соответствии с количеством протонов, которые они имеют, чтобы реагировать с основанием. Двухосновные и трехосновные кислоты вместе называют многоосновными кислотами. Эти одноосновные и многоосновные кислоты могут быть сильными или слабыми кислотами. Основное различие между одноосновными двухосновными и трехосновными кислотами состоит в том, что
Ключевые области покрыты
1. Что такое одноосновные кислоты
— определение, диссоциация и примеры
2. Что такое двухосновные кислоты
— определение, диссоциация и примеры
3. Что такое трехосновные кислоты
— определение, диссоциация и примеры
4. В чем разница между одноосновными двухосновными и трехосновными кислотами
— Сравнение основных различий
Основные термины: кислота, двухосновная кислота, одноосновная кислота, соль, трехосновная кислота
Что такое одноосновные кислоты
Одноосновные кислоты представляют собой кислотные соединения, которые имеют один замещаемый атом водорода на одну молекулу кислоты. В водном растворе эти кислоты могут удалить один протон (атом водорода). Поэтому они называются монопротонные кислоты, Одноосновная кислота может отдавать только один атом водорода для реакции между одноосновной кислотой и основанием.
Так как диссоциация одноосновной кислоты дает в систему только один атом водорода, уравнение для константы диссоциации одноосновной кислоты включает концентрацию только одного Н+ ион. Диссоциация одноосновной кислоты может быть показана ниже.
HA(Водно) → H+(Водно) + А–(Водно)
или же
HA(Водно) + H2О(Л)→ А–(Водно) + H3О+(Водно)
Константа диссоциации Ka = [H+(Водно)] [A–(Водно)] / [HA(Водно)]
Рисунок 1: Структура соляной кислоты (атом водорода показан красным)
Существуют органические и неорганические одноосновные кислоты. Некоторые из них являются сильными кислотами, тогда как другие являются слабыми кислотами. Сильные одноосновные кислоты, такие как HCl, HNO3HBr может полностью диссоциировать и отдавать один водород до основания. Слабые одноосновные кислоты, такие как уксусная кислота (СН3COOH) частично диссоциированы.
Что такое двухосновные кислоты
Двухосновные кислоты представляют собой химические соединения, которые имеют два заменяемых атома водорода на молекулу кислоты. Следовательно, эти двухосновные кислоты могут отдавать два атома водорода для реакции между двухосновной кислотой и основанием. В водном растворе двухосновные кислоты диссоциируют с образованием двух ионов водорода (H+) в систему. Поэтому они также называются дипротоновые кислоты.
Диссоциация двухосновной кислоты может быть приведена ниже. Двухосновная кислота имеет два значения константы диссоциации. Это для первой диссоциации и второй диссоциации.
ЧАС2В(Водно) → 2H+(Водно) + B-2(Водно)
или же
ЧАС2В(Водно) → H+(Водно) + HB–(Водно) ; Ka1
HB–(Водно) → H+(Водно) + B-2(Водно) ; Ka2
Константа диссоциации Ka1 = [H+(Водно)] [HB–(Водно)] / [H2В(Водно)]
Константа диссоциации Ka2 = [H+(Водно)] [B-2(Водно)] / [HB–(Водно)]
Рисунок 2: Структура серной кислоты (два атома водорода показаны красным)
Двухосновные кислоты также можно отнести к двум типам: сильные двухосновные кислоты и слабые двухосновные кислоты. Сильные двухосновные кислоты полностью диссоциируют на два атома водорода и сопряженный ион кислоты. Их первая ионизация сильна. Но слабые двухосновные кислоты частично диссоциируют на два атома водорода и сопряженный ион кислоты. Некоторые распространенные примеры двухосновных кислот включают Н2ТАК4, Ч2Колорадо3 и H2С2О4.
Что такое трехосновные кислоты
Трехосновные кислоты представляют собой химические соединения, которые имеют три замещаемых атома водорода. Эти кислоты могут пожертвовать три иона водорода для реакции между трехосновной кислотой и основанием. Так как они могут удалить три H+ ионы (протоны), эти кислоты также называют трипротонные кислоты.
Диссоциация трехосновной кислоты обеспечивает три иона водорода в системе. Следовательно, диссоциация трехосновной кислоты имеет три константы диссоциации.
ЧАС3С(Водно) → 3H+(Водно) + C-3(Водно)
и
Многоосновная кислота — Большая Энциклопедия Нефти и Газа, статья, страница 2
Многоосновная кислота
Cтраница 2
Многоосновные кислоты при потенциометрическом титровании ведут себя как смесь двух или нескольких кислот с характерной для каждой ступени диссоциации величиной р / С. [16]
Многоосновные кислоты при взаимодействии с аммиаком ( основанием) тоже образуют аммонийные соли. Поскольку ион аммония Nh5 несет единичный положительный заряд, в формулы солей многоосновных кислот должно входить несколько таких ионов. [17]
Многоосновные кислоты обычно являются слабыми кислотами и диссоциируют ступенчатэ. [19]
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. [20]
Многоосновные кислоты ( НзРО4, Н СОз, и т.п.), а также многокислотные основания [ Ва ( ОН) 2, Mg ( OH) 2 и др. ] диссоциируют по ступеням. [21]
Многоосновные кислоты, содержащие в молекулах по два или несколько атомов водорода, способных замещаться на атомы металла, обычно являются слабыми электролитами и диссоциируют ступенчато, причем каждая следующая стадия протекает в значительно меньшей степени, чем предыдущая. [22]
Многоосновная кислота, растворимая в воде, основа аденозин-5 — трифосфата. [23]
Многоосновные кислоты при вычислении рН можно рассматривать как одноосновные, так как они диссоциируют постепенно в несколько ступеней, причем наиболее значительно выражена диссоциация в первой ступени. [24]
Многоосновные кислоты, например серная, щавелевая и фосфорная, не отщепляют сразу всех ионов водорода, способных замещаться на металл. [25]
Многоосновные кислоты при вычислении рН можно рассматривать как одноосновные, так как они диссоциируют постепенно в несколько ступеней, причем наиболее значительно выражена диссоциация в первой ступени. [26]
Многоосновные кислоты и их ангидриды обычно применяют для отверждения эпоксидных смол с повышенным молекулярным весом; чаще всего используют малеиновый и фталевый ангидриды. Процесс отверждения эпоксидных смол кислотами и их ангидридами происходит только при температурах 100 — 180 С. [27]
Многоосновные кислоты при вычислении рН можно рассматривать как одноосновные, так как они диссоциируют постепенно в несколько ступеней, причем наиболее значительно выражена диссоциация в первой ступени. [28]
Многоосновные кислоты ( моноалкилфосфорная, моноалкил-фосфоновая и др.) ассоциированы сильнее. [29]
Многоосновная кислота имеет несколько констант диссоциации, соответствующих последовательному отщеплению ионов водорода. [30]
Страницы: 1 2 3 4
Кислота многоосновные — Справочник химика 21
Ароматические карбоновые кислоты. Классификация. Изомерия и номенклатура. Бензойная-кислота и ее производные. Хлористый бензоил. Антраниловая. л-аминобензойная, суль-фобензойкая и салициловая кислоты. Непредельные одноосновные кислоты. Многоосновные ароматические кислоты. Фталевая кислота и фталевый ангидрид. Лавсан. [c.171]Кривые титрования многоосновных кислот. Многоосновные кислоты, как известно, диссоциируют последовательно, по ступеням. Для сильных кислот такая ступенчатая диссоциация не отражается на характере кривых титрования, которые имеют такой же вид, как для одноосновных кислот. Поэтому кривые титрования одно [c.234]
Восстановление одноосновных кислот, многоосновных кислот и оксикислот [c.144]
Кривые титрования многоосновных кислот, многоосновных оснований, смесей слабых и сильных кислот или слабых и сильных оснований характеризуются наличием нескольких скачков pH, число которых соответствует числу ступеней диссоциации этих кислот, оснований или числу одноосновных кислот или одноосновных оснований, входящих в состав данной анализируемой смеси. [c.138]
Кривые титрования многоосновных кислот. Многоосновные кислоты, как известно, диссоциируют последовательно, по ступеням. Для сильных кислот такая ступенчатая диссоциация не отражается на характере кривых титрования, которые имеют такой же вид, как для одноосновных кислот. Поэтому кривые титрования одноосновной соляной и двухосновной серной кислоты имеют одну точку эквивалентности. [c.196]
Если кислота многоосновная, то ионизация идет ступенчато [c.89]
Примером может служить процесс нейтрализации фосфорной кислоты едким натром. Ортофосфорная кислота многоосновна, относится к электролитам средней силы, степень диссоциации ее а= 27%. Следовательно, нз 100 молекул только 27 распадаются на ионы, причем распад молекул на ионы происходит ступенчато [c.49]
Хотя фосфорная и серная кислоты-многоосновные кислоты, но определение двойной соли включает еще одно условие, а именно [c.431]
Большинство солей аммония непрочны и сравнительно легко разлагаются при нагревании. Характер разложения зависит от аниона кислоты. Если соль образована летучей кислотой, то продуктом разложения является кислота и аммиак, которые прн охлаждении могут снова соединяться, образуя исходную соль. Если кислота многоосновна, нелетуча и не является окислителем, то при разложении образуется аммпак и кислая соль аммония (при более полном разложении — кислота). Если же аммонийная соль образована кислотой, анион которой является сильным окислителем, то разложение соли сопровождается окислением аммиака до свободного азота и иногда до оксидов азота. [c.138]
Взаимодействие спиртов с кислородсодержащими неорганическими кислотами является общим способом получения сложных эфиров неорганических кислот. Многоосновные кислоты дают как кислые, так и средние эфиры. [c.21]
В табл. 43 приведена рецептура (в вес. ч.) получения оранжевого крона из двухосновного ацетата, а также из глета, обработанного уксусной и соляной кислотами (многоосновного ацетата). [c.340]
Многоосновные кислоты. Многоосновные кислоты диссоциируют ступенями. Каждая ступень имеет свою характерную константу ионизации, которая отвечает отщеплению соответствую- [c.25]
То, что щавелевая, винная и лимонная кислоты многоосновны, не имеет существенного значения для комплексообразования. В растворах малоновой, янтарной и адипиновой кислот ниобиевая кислота не растворяется. Так же ведет себя ниобиевая кислота и в растворах кислых аммонийных со-лей этих кислот. Лишь в малоновой кислоте происходит очень слабое растворение, вероятно, обусловленное образованием менее стойкого шестичленного кольца. В -окси-масляной кислоте растворимость ниобиевой кислоты также незначительна. Однако обнаружено, что в щелочном растворе сульфо-салицилата натрия ниобиевая кислота образует желто-зеленый раствор, содержащий комплексы состава 1 1 и 1 2 [142], хотя салицилаты образуют с ниобиевой и танталовой кислотами нерастворимые осадки. [c.50]
Титрование многоосновных кислот. Многоосновные кислоты, как известно, диссоциируют ступенчато. Например, ионизация [c.180]
Титрование смесей кислот или многоосновных кислот. Многоосновные кислоты рассматривают, как смесь кислот обеих ступеней диссоциации. Значение р при первой точке эквивалентности [c.338]
Концентрация ионов водорода в растворе слабой многоосновной кислоты. Многоосновные кислоты диссоциируют в несколько стадий. Т к, например, диссоциация двухосновной кислоты может быть выражена следующими схемами [c.88]
В основе метода ацидолиза лежит реакция обменного разложения триглицеридов жирных кислот многоосновными кислотами. Реакция в этом случае протекает следующим образом [c.13]
Кривые титрования многоосновных кислот, многоосновных оснований, смесей слабых и сильных кислот или слабых и сильных оснований характеризуются наличием нескольких скачков pH, число которых соответствует числу ступеней диссоциации этих кислот, оснований или [c.98]
Титрование сильных и слабых кислот, многоосновных кислот и сопей слабых оснований в пиридине. [c.551]
Последовательная диссоциация многоосновной кислоты. Многоосновная кислота имеет несколько констант диссоциации, соответствующих последовательному отщеплению ионов водорода. Для фосфорной кислоты Н3РО4 [c.357]
Относительно объемов должно заметить, что если серная кислота или другие кислоты соединяются с СаСОз, с ВаО, то при образовании таких соединений происходит сжатие, особенно если кислота многоосновная так что, если сравним объем соли с объемом находящихся в ней безводного основания и безводной кислоты, то увидим, что сумма последних больше. Но кремнекислые соли не имеют этого непременного свойства. В них объем соли или равен, или более, или менее суммы объемов входящих в них окислов. Например, роданит объем МпО относится к объему кремния, как 87 144, следовательно, объемы вместе равны 231, а объем роданита равен 230. В полевом шпате объ
Карбоновые кислоты
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
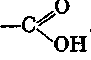
Число карбоксильных групп характеризует основность кислоты.
В зависимости от количества карбоксильных групп карбоновые кислоты подразделяются на одноосновные карбоновые кислоты (содержат одну карбоксильную группу), двухосновные (содержат две карбоксильные группы) и многоосновные кислоты.
В зависимости от вида радикала, связанного с карбоксильной группой, карбоновые кислоты делятся на предельные, непредельные и ароматические. Предельные и непредельные кислоты объединяют под общим названием кислоты алифатического или жирного ряда.
Одноосновные карбоновые кислоты
1.1 Гомологический ряд и номенклатура
Гомологический ряд одноосновных предельных карбоновых кислот (иногда их называют жирными кислотами) начинается с муравьиной кислоты
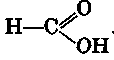
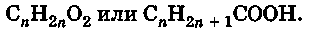
Формула гомологического ряда
Номенклатура ИЮПАК разрешает сохранять для многих кислот их тривиальные названия, которые обычно указывают на природный источник, из которого была выделена та или иная кислота, например, муравьиная, уксусная, масляная, валериановая и т.д.
Для более сложных случаев названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания -овая и слова кислота. Муравьиная кислота Н—СООН называется метановой кислотой, уксусная кислота СН3—СООН — этановой кислотой и т. д.
Таким образом, кислоты рассматриваются как производные углеводородов, одно звено которых превращено в карбоксил:
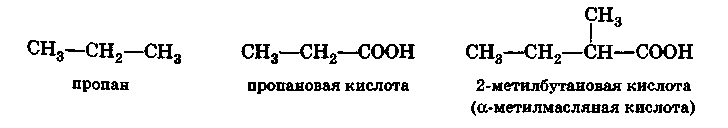
При составлении названий кислот с разветвленной цепью по рациональной номенклатуре их рассматривают как производные уксусной кислоты, в молекуле которой атомы водорода замещены радикалами, например, триметилуксусная кислота (СН3)3С – СООН.
1.2 Физические свойства карбоновых кислот
Только с чисто формальных позиций можно рассматривать карбоксильную группу как комбинацию карбонильной и гидроксильной функций. Фактически их взаимное влияние друг на друга таково, что полностью изменяет их свойства.
Обычная для карбонила поляризация двойной связи С=0 сильно возрастает за счет дополнительного стягивания свободной электронной пары с соседнего атома кислорода гидроксильной группы:
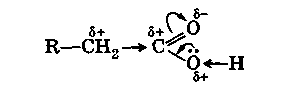
Следствием этого является значительное ослабление связи О—Н в гидроксиле и легкость отщепления атома водорода от него в виде протона (Н+). Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С—С к карбоксильной группе и появлению (как у альдегидов и кетонов) пониженной электронной плотности (δ +) на α-углеродном атоме кислоты.
Все карбоновые кислоты обладают кислой реакцией (обнаруживается индикаторами) и образуют соли с гидроксидами, оксидами и карбонатами металлов и с активными металлами:
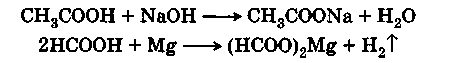
Карбоновые кислоты в большинстве случаев в водном растворе диссоциированы лишь в малой степени и являются слабыми кислотами, значительно уступая таким кислотам, как соляная, азотная и серная. Так, при растворении одного моля в 16 л воды степень диссоциации муравьиной кислоты равна 0,06, уксусной кислоты — 0,0167, в то время как соляная кислота при таком разбавлении диссоциирована почти полностью.
Для большинства одноосновных карбоновых кислот рКа = 4,8, только муравьиная кислота имеет меньшую величину рКа (около 3,7), что объясняется отсутствием электронодонорного эффекта алкильных групп.
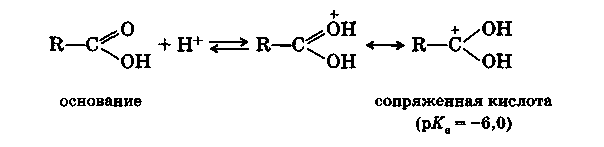
В безводных минеральных кислотах карбоновые кислоты протонируются по кислороду с образованием карбкатионов:
Сдвиг электронной плотности в молекуле недиссоциированной карбоновой кислоты, о котором говорилось выше, понижает электронную плотность на гидроксильном атоме кислорода и повышает ее на карбонильном. Этот сдвиг еще больше увеличивается в анионе кислоты:
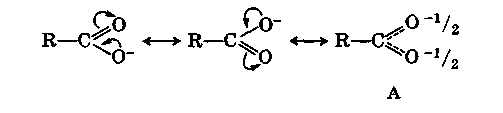
Результатом сдвига является полное выравнивание зарядов в анионе, который фактически существует в форме А — резонанс карбоксилат-аниона.
Первые четыре представителя ряда карбоновых кислот — подвижные жидкости, смешивающиеся с водой во всех отношениях. Кислоты, в молекуле которых содержится от пяти до девяти атомов углерода (а также изомасляная кислота), — маслянистые жидкости, растворимость их в воде невелика.
Высшие кислоты (от С10) — твердые тела, практически нерастворимы в воде, при перегонке в обычных условиях они разлагаются.
Муравьиная, уксусная и пропионовая кислоты имеют острый запах; средние члены ряда обладают неприятным запахом, высшие кислоты запаха не имеют.
На
физических свойствах карбоновых кислот
сказывается значительная степень
ассоциации вследствие образования
водородных связей. Кислоты образуют
прочные водородные связи, так как
связи О—Н в них сильно поляризованы.
Кроме того, карбоновые кислоты способны
образовывать водородные связи с участием
атома кислорода карбонильного
диполя, обладающего значительной
электроотрицательностью. Действительно,
в твердом и жидком состоянии карбоновые
кислоты существуют в основном в виде
циклических димеров:
Такие димерные структуры сохраняются в некоторой степени даже в газообразном состоянии и в разбавленных растворах в неполярных растворителях.
Многоосновные кислоты и основания — Справочник химика 21
Многоосновные кислоты и основания [c.46]Тот же принцип используется при изучении характера гидролиза солей многоосновных кислот и оснований. При этом сле- [c.315]
Многоосновные кислоты и основания диссоциируют ступенчато. Соответственно для каждой ступени равновесного состояния существует своя константа диссоциации [c.210]
Многоосновные кислоты и основания диссоциируют ступенчато — вначале от молекулы отщепляется один из ионов, затем другой и т. д. Каждая ступень диссоциации характеризуется своим значением константы диссоциации. [c.165]
Многоосновные кислоты и основания диссоциируют на ионы ступенчато [c.72]
Основания и кислоты—это диаметрально противоположные по свойствам соединения. Взаимодействуя между собой, они образуют соль и воду. Данная реакция называется нейтрализацией. В зависимости от соотношения многоосновной кислоты и основания образующиеся соли могут быть средними, кислыми или основными. [c.149]
Потенциометрическое титрование в методах нейтрализации применяют для растворов кислот и оснований с константой диссоциации не меньше 10 «. Можно также титровать смеси двух кислот, двух оснований, многоосновные кислоты и основания, применяя платиновый индикаторный водородный электрод. [c.501]
Ступенчато диссоциируют многоосновные основания, соли многоосновных кислот и оснований. Например [c.94]
Существование многоосновных кислот и оснований обусловливает наличие трех групп солей— нормальных, кис.шх и основных. При со- [c.254]
Слабые многоосновные кислоты и основания прн растворении в воде диссоциируют на ионы ступенчато, последовательно отдавая в раствор один, два и более ионов водорода или гидроксила. [c.170]
Потенциометрическим методом можно определять смеси слабых кислот и оснований или многоосновных кислот и оснований, если константы определяемых соединений равны или больше Ю» . В этих условиях имеет место заметное изменение pH и потенциала электрода вблизи соответствующих точек эквивалентности. Титрование сильной кислоты (сильного основания) в присутствии слабой кислоты (слабого основания) возможно при условии, когда константа диссоциации слабой кислоты равна 10 [c.405]
Многоосновные кислоты и основания диссоци ируют по ступеням, причем каждой ступени соответствует своя константа диссоциации. Например, для ортофосфорной кислоты приходится учитывать следующие ступени диссоциации и их константы (см. табл. II) [c.66]
Гидролиз солей многоосновных кислот и оснований протекает через отдельные сталии, каждая из к-рых характеризуется своей константой Г. Напр., если гидролизуется соль ВгА двухосновной слабой кислоты Н Л и щелочного металла, то Г. состоит из реакций А — — -+ НцО = НА ОН НА -f НгО =Н2А ОН. Для этих стадий справедливы соотношения [c.460]
Слабые многоосновные кислоты и основания при растворении в воде диссоциируют на ионы ступенчато, последовательно отдавая в раствор один, два и более ИОНОВ водорода или гидроксид-ионов. Рассмотрим примеры ступенчатой диссоцнацин многооснов-ных кислот, [c.224]
Поэтому то увеличение врэ цения, которое претерпевают оптически активные вещества с несколькими гидроксильными или карбоксильными группами при своем взаимодействии с многоосновными кислотами и основаниями (при образовании боратов, молибдатов, вольфраматов, арсениатов, соединений сурьмы, солей урана), пытались объяснить также тем, что эти комплексные соединения могут иметь циклический характер, так как в них имеются связи, обусловленные и главными и побочными валентностями. Так, например [c.151]
Гидролиз солей многоосновных кислот и оснований протекает через отдельные стадии, каждая из к-рых характеризуется своей константой Г. Напр., ес.ли гидролизуется соль В А двухосновной слабой кислоты НаА и щелочного металла, то Г. состоит иа реакций А -I—Ь НгО = НА- -ь ОН- НА- -ь Н2О =НгА+ ОН-. Дляэтих стадий справедливы соотноптеиия [c.460]
Пусть центральный атом или группа атомов Ме присоединяют максимум N лигандов А в случае образования комплексов ШеАп, где п= I, 2, 3. .. N. Такой подход соответствует типам комплексов, перечисленных в табл. VIH. —VHI.4, причем Ме — ион металла, А — лиганд (например, хлорид, цианид, гидроксил, аммоний). Он пригоден и для одноосновных и многоосновных кислот и оснований, но в этом случае Ме — наиболее основная форма, а лиганд А — ион водорода. [c.270]
Для многоосновных кислот и оснований диссоциация происходит ступенчато, соответственно для диссоцигщии этих соединений существует несколько констант диссоциации (см. ззг дачи 5.2-5.4). [c.43]
Рассмотренные соотношения справедливы независимо оттого, является ли кислота ВН нейтральной частицей (НСООН, СНзСООН), катионом (ЫН , АЦНгО) ) или анионом (Н50Г, НР04 ). Аналогично проводится потенциометрическое титрование многоосновных кислот и оснований. [c.21]
Изменение в соотношении силы электролитов. Под влиянием растворителей изменяется не Только сила электролитов, но и соотношенле в их силе. Указанное положение особенно применимо к кислотам и основаниям различной природы, растворимым в растворителях с низкой диэлектрической проницаемостью. Это дает возможность осуществлять дифференцированное титрование смесей кислот или оснований, а также многоосновных кислот и оснований. [c.414]
Многоосновные кислоты и многокислотные основания
Итак, при гидролизе солей, образованных одноосновными кислотами и однокислотными основаниями, единственными продуктами гидролиза будут кислота и основание. Соли многоосновных кислот и многокислотных оснований подвергаются ступенчатому гидролизу и в числе продуктов могут образоваться соответственно кислые и основные соли. [c.275]Дифференцированное титрование смеси кислот и оснований или многоосновных кислот и многокислотных оснований выполняют в соответствующих условиях в рН-метрическом варианте с применением. лабораторного рН-метра или автотитратора. [c.173]
Соли, образованные многоосновными кислотами и многокислотными основаниями, гидролизуются по ступеням. Докажите, что полная константа гидролиза равна произведению констант гидролиза всех ступеней гидролиза. [c.219]
Многоосновные кислоты и многокислотные основания обычно диссоциируют ступенчато, например [c.63]
III. Гидролиз солей многоосновных кислот и многокислотных оснований также может быть представлен четырьмя вариантами [c.277]
Потенциометрический метод анализа позволяет дифференцированно титровать смеси слабых кислот и оснований или многоосновных кислот и многокислотных оснований с точностью до 1%, если К К2 Кз и т. д. 10 , где К — соответствующие константы диссоциации определяемых соединений. В этих условиях обеспечивается достаточно заметное изменение pH или индикаторного электрода вблизи соответствующих т. э. [c.125]
Закон разведения разъясняет явление ступенчатой диссоциации многоосновных кислот и многокислотных оснований они имеют несколько ступеней диссоциации и соответственно несколько констант диссоциации [c.71]
Для многоосновных кислот и многокислотных оснований характерна ступенчатая диссоциация с отрывом одного нона Н+ или ОН по каждой ступени. Таким образом, число ступеней определяется основностью кислоты или кислотностью основания. Поскольку первый ион отрывается от нейтральной частицы, а последующие от частиц с зарядом противоположного знака, который увеличивается с каждой ступенью на единицу, то степень электролитической диссоциации сильно уменьшается при переходе от первой ступени к каждой следующей. Примером может быть фосфорная кислота при с=0,1 моль/л [c.204]
Логарифмические рН-диаграммы многоосновных кислот и многокислотных оснований [c.133]
При титровании многокомпонентных растворов многоосновной кислоты и многокислотного основания на интегральных кривых получается соответственно несколько перегибов, а на дифференциальных кривых— пиков. В некоторых потенциометрах — титрометрах имеются самопишущие устройства для записи кривых потенциометрического титрования. [c.169]
Солями называются соединения, состоящие из атомов металла и кислотных остатков. Соли можно рассматривать как продукты реакции нейтрализации, когда атомы водорода кислоты замещаются на атомы металла, а гидроксогруппы основания— на кислотный остаток. Если в реакции нейтрализации участвуют многоосновная кислота и многокислотное основание, то в зависимости от соотношения количеств кислоты и основания могут образовываться три типа солей. [c.66]
Гидролиз солей многоосновных кислот и многокислотных оснований. Факторы, влияющие на процесс гидролиза [c.143]
Гидролиз солей многоосновных кислот и многокислотных оснований протекает ступенчато (что часто связано с повышением температуры). Пример гидролиз карбоната натрия Naj Oa. [c.217]
Особую задачу представляет титрование многоосновных кислот и многокислотных оснований, а также смесей различных кислот или [c.368]
Действительно, при взаимодействии одних и тех же веществ возможно образование разных продуктов в зависимости от мольного соотношения реагентов. Наиболее распространенным типом таких взаимодействий являются реакции нейтрализации с участием многоосновных кислот и многокислотных оснований. [c.48]
Что называют ступенчатой диссоциацией Чем определяется число ступеней для многоосновных кислот и многокислотных оснований Как и по какой причине изменяются значения а и Кд от первой ступени к последней [c.209]
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например [c.87]
Многоосновные кислоты и многокислотные основания диссоциируют в растворе ступенчато, н каждой ступени диссоциации соответствует своя константа диссоциации. Например, для диссоциации фосфорной кислоты [c.93]
Константы, относящиеся к последовательным ступеням диссоциации многоосновных кислот и многокислотных оснований, отмечены римскими цифрами, заключенными в скобки. Если для этих соединений приведена только одна константа, то она относится к первой ступени диссоциации. [c.51]
Гидролиз солей многоосновных кислот и многокислотных оснований протекает ступенчато (что часто связано с повышением температуры). [c.260]
Домашняя подготовка. Теория электролитической диссоциации Аррениуса. Соли, кислоты и основания с точки зрения теории электролитической диссоциации. Сильные и слабые электролиты. Зависимость степени электролитической диссоциации от концентрации раствора. Ступенчатая диссоциация многоосновных кислот и многокислотных оснований. Равновесие в растворах электролитов. Приложение закона действия масс к электролитической диссоциации. Константа диссоциации. Произведение растворимости. [c.117]
Так же происходит диссоциация других многоосновных кислот и многокислотных оснований. У последних ионы ОН отщепляются постепенно [c.82]
Гидролиз солей многоосновных кислот и многокислотных основан [c.84]
Многоосновные кислоты и многокислотные основания [c.164]
МНОГООСНОВНЫЕ КИСЛОТЫ И МНОГОКИСЛОТНЫЕ ОСНОВАНИЯ 165 [c.165]
Б. МНОГООСНОВНЫЕ КИСЛОТЫ и МНОГОКИСЛОТНЫЕ ОСНОВАНИЯ 171 [c.171]