Атом, молекула, вещество – HIMI4KA

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Атомное ядро состоит из элементарных частиц протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям двигаются электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы (а.е.м.) и зарядом +1 условную единицу.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы.
Число нейтронов в ядре N определяют по формуле:
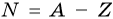
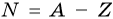
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Электрон (е–) — элементарная частица с массой 1/1836 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома.
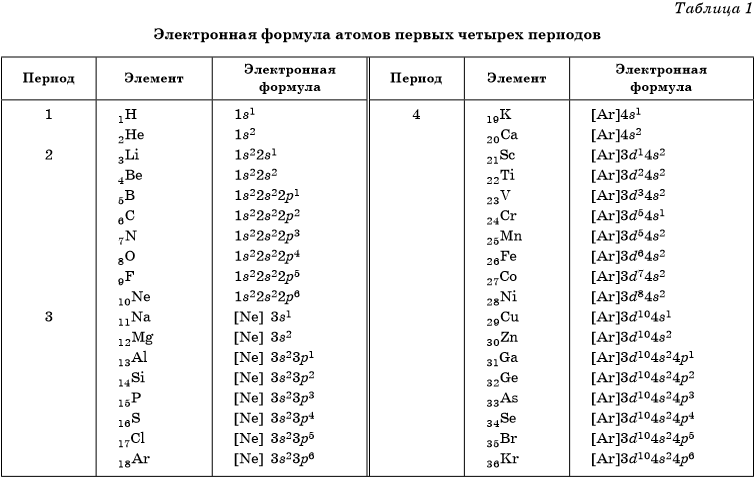
В таблице 1 приведены электронные конфигурации атомов химических элементов первых четырех периодов.

Химический элемент — совокупность атомов с определенным значением (величиной) заряда ядра.
Изотопы — атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Молекула — наименьшая электронейтральная частица вещества, способная к самостоятельному существованию и обладающая его химическими свойствами.
Вещество — любая совокупность атомов и молекул.
Простое вещество образуют одинаковые атомы (например, H2, N2).
Сложное вещество образуют атомы двух и более видов (например, H2SO4, NH3).
Свойства веществ (температуры плавления и кипения, плотность, цвет и т.д.) относятся к совокупности атомов.
Из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Это практически все органические вещества, большинство неметаллов, углекислый газ и вода. У них сравнительно низкие температуры плавления и кипения.
В узлах веществ с атомными кристаллическими решетками находятся отдельные атомы, соединенные между собой очень прочными ковалентными связями. Для этих веществ характерны высокая прочность, высокие температуры плавления (например, алмаз, диоксид кремния).
В узлах веществ с металлическими кристаллическими решетками находятся ионы, между которыми двигаются электроны, общие для всего образца. Это обусловливает общие для металлов свойства: высокую электро- и теплопроводность, характерный металлический блеск.
В узлах веществ с ионными кристаллическими решетками находятся ионы. Их образуют вещества с ионной связью. К таким веществам относятся соли, некоторые оксиды и гидроксиды металлов. Вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий базового уровня сложности с кратким ответом.
himi4ka.ru
Вещество, атом, молекула
Согласно современным представлениям основные положения атомно-молекулярной теории сводятся к следующим тезисам:
- Частицы веществ непрерывно движутся.
- Между частицами вещества действуют силы взаимного притяжения и отталкивания.
- Между составляющими частицами вещества существуют расстояния, размер которых зависит от агрегатного состояния.
- Молекулы состоят из атомов.
- Молекулы сохраняются при физических явлениях и разрушаются во время химических реакций.
- Атомы во время химических процессов остаются неделимыми, но перегруппировываются, в результате чего образуются новые соединения.
- Разнообразие веществ в природе обусловлена различными сочетаниями атомов, благодаря чему могут возникать вещества с молекулярным или немолекулярным строением.
Важнейшие понятия атомно-молекулярного учения
Согласно атомно-молекулярному учению, главными объектами химии являются атомы, молекулы, химические элементы, простые и сложные вещества.
Атом
Атом — это наименьшая, химически неделимая, электронейтральная частица элемента, которая состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атом — это система, состоящая из ядра и электронной оболочки. В состав атомного ядра, радиус которого в 10000 раз меньше (10-14 -10-15 м) радиуса атома (~ 10-10 м), входят ядерные частицы нуклоны.
Нуклоны — это положительно заряженные протоны и электронейтральные нейтроны. Электронная оболочка, размер которой определяет радиус всего атома — это совокупность электронов. Положительный заряд ядра определяется количеством протонов и равна по абсолютной величине отрицательному заряду электронной оболочки, который соответствует количеству электронов. Благодаря равенству по абсолютной величине зарядов протонов и электронов, атом электронейтрален. Протоны, нейтроны и электроны объединяются общим названием — субатомные частицы.
Массы протона и нейтрона практически одинаковы, а масса электрона в 1836 раз меньше, поэтому вся масса атома фактически сосредоточена в его ядре. По этой причине плотность вещества в ядре фантастически велика — порядка 1013 -1014 г / см3 . Массы атомов различных элементов колеблются от 1,67 · 10-27 кг (атом водорода) до 4,42 · 10-25 кг (атом мейтнерия — элемента № 109).
Количественными характеристиками атома является заряд ядра и относительная атомная масса Аr . Эти величины указываются в периодической системе элементов.
Заряд ядра атома равен порядковому номеру элемента (закон Мозли).
Поскольку массы атомов очень малы, в химии внедрена внесистемная единица измерения, называемая атомной единицей массы (а.е.м.) и равна одной двенадцатой массы атома изотопа углерода-12 (m (атома
Относительная атомная масса Аr — это физическая величина, равная отношению средней массы атома элемента к одной двенадцатой массы атома изотопа углерода-12:
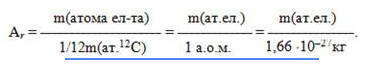
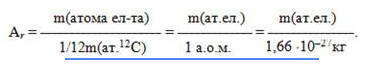
В системе измерений СИ Аr — безразмерная величина. Внесистемная единица измерения относительной атомной массы — а.е.м. Абсолютная масса атома равна произведению его относительной атомной массы на 1/12 массы атома углерода — 12 , например
m (ат.О) = А r (О) · 1,66 · 10— 27 = 16 · 1,66 · 10— 27 = 26,56 · 10— 27 кг.
Атом носителем химических свойств элемента . Вместе с этим у атомов одного элемента могут быть разные массы вследствие явления изотопии , при котором атомы одного элемента содержат одинаковое количество протонов в ядре, но разное количество нейтронов, что сказывается на их массе .
Молекула
Молекулы — это реально существующие природные объекты, что подтверждается многими экспериментально доказанными фактами.
Молекула — это наименьшая частица вещества, которая способна самостоятельно существовать и имеет все химические свойства вещества.
Как материальные частицы молекулы имеют размеры и массы. Размеры молекул колеблются в пределах 10-10 — 10-7 м. Масса отдельной молекулы чрезвычайно мала. Так, масса молекулы воды составляет 2,895×10-26 кг.
Молекула сохраняет химические свойства вещества. Известно, что вещество характеризуется определенными физическими и химическими свойствами. Физические свойства — это агрегатное состояние, плотность, температуры кипения и плавления, электропроводность, диэлектрическая проницаемость, цвет, запах, вкус и тому подобное. Понятно, что перечисленные свойства веществ могут быть присущи не одной молекуле, а достаточно большой их совокупности. Однако молекула имеет и собственные физические свойства: дипольный и магнитный моменты, способность к поляризации и тому подобное. А химические свойства вещества (способность вступать в химическое взаимодействие с другими веществами) в полной мере относятся и каждой отдельной молекуле.
Молекулы состоят из атомов, которые соединены между собой химическими связями в определенной последовательности и определенным образом ориентированы в пространстве. Количество атомов в молекуле колеблется от двух (Н2, О2, НСl) до нескольких тысяч (витамины, гормоны, белки). Атомы благородных газов (He, Ne, Ar, Kr, Xe, Rn) иногда называют одноатомными молекулами. Состав молекулы — важнейшая характеристика молекулы и вещества — описывается химическими формулами.
Схематическое модель молекулы Nh4 Между молекулами есть расстояния, обусловленные агрегатным состоянием вещества: в газах они составляют 10-8 — 10-7 м, в твердых телах — примерно 10-10 м.При физических явлениях молекулы сохраняются, а при химических превращениях — разрушаются, образуя новые вещества.
Количественной характеристикой молекулы является относительная молекулярная масса Мr .
Относительная молекулярная масса Мr— это отношение средней массы молекулы вещества к 1/12 массы атома углерода-12.
В системе СИ относительная молекулярная масса Mr — безразмерная величина, а внесистемной единицей ее измерения является а.е.м.
Относительная молекулярная масса Мr равна сумме относительных атомных масс Аr элементов, входящих в состав молекулы, с учетом количества атомов каждого элемента , например:
M r (SO 2 ) = A
Абсолютная масса молекулы определяется как произведение Мr на атомную единицу массы:
m (молекулы SO 2 ) = M r (SO 2 ) · 1,66 · 10 — 27 = 64 · 1,66 · 10 — 27 = 1,06 · 10 — 25 кг.
Молекулярное строение имеют органические соединения и часть неорганических веществ, но большинство неорганических веществ состоит из ионов, в которых носителями химических свойств является условные частицы — ассоциаты ионов. Поэтому к веществам ионной строения невозможно применять понятие «молекула» так же как и к металлов и их сплавов, кристаллическая решетка которых имеет свои специфические особенности. Таким образом, с современной точки зрения молекула — это наименьшая электронейтральна замкнутая совокупность атомов, образует определенную структуру с помощью химических связей.
Химический элемент
Сейчас известно 118 химических элементов: из них 89 обнаружены в природе, а другие получены искусственно при проведении ядерных реакций.
Химический элемент — это вид атомов с одинаковым зарядом ядра.
Каждый элемент имеет свое название и символ. Названия элементов с порядковыми номерами 104-109 утверждены советом IUPAC (1997.) Позже были названы другие элементы. Теперь элемент №104 имеет следующие название и символ: Резерфорд Rf, №105 — Дубний Db, №106 — Сиборгий Sg, №107 — Борий Bh, элемент №108 — Хассий Hs, №109 — Мейтнерий Mt, №110 — Дармштадтий Ds. Химические элементы №№111-118 еще не получили официальных названий, поэтому их пока называют по порядковым номерам, например: №111 — Унунуний Uuu (один, один, один) №112 — Унунбий Uub (один, один, два) и т.д.
Химический символ означает, во-первых, название элемента, во-вторых, — один атом этого элемента при записях формул химических реакций.
Носителем свойств химических элементов является атом. Входя в состав различных веществ, атомы каждого элемента придают им определенных свойств. Так, вещества NaCl, Na
Основной количественной характеристикой элемента является заряд ядра его атомов Z , совпадающей с порядковым номером элемента. В природе отсутствуют различные химические элементы, которые должны одинаковый заряд ядра, поэтому можно однозначно определить элемент с зарядом ядра его атома. Относительная атомная масса Аr тоже в определенной степени может служить количественной характеристикой элемента, но не исчерпывающей, так как по величине Аr невозможно определить элемент. Существуют атомы различных элементов с одинаковыми Аr — так называемые изобары. С другой стороны, как уже упоминалось, существуют атомы одного и того же элемента с различными Аr
— изотопы.Формулы изотопов конечно записывают с помощью символа химического элемента, отметив заряд ядра (слева снизу) и массового числа (слева сверху). Исключением являются изотопы элемента водорода, для которых наряду с традиционной символикой допускаются и индивидуальные названия и обозначения.
Простые и сложные соединения
Поскольку вещество — это любая совокупность атомов или молекул, то по составу все соединения можно разделить на простые и сложные.
Простыми веществами называются вещества, которые состоят из атомов одного элемента; простые вещества — это форма существования химического элемента в свободном состоянии.
Насчитывается более 500 простых веществ, а элементов известно всего 118. Такое расхождение объясняется явлением под названием аллотропия.
Аллотропия — это способность элемента образовывать несколько простых, отличающихся по свойствам веществ, которые называются аллотропными модификациями, или алотропамы.
Простые вещества могут иметь молекулярное и немолекулярное строение — атомное или металлическое. Молекулярное строение присуще кислороду, галогенам; атомное — благородным газам, алмазу, графиту; металлическое — металлам в разном состоянии.
Сложными веществами называются вещества, содержащие атомы различных элементов, то есть это форма существования элементов в связанном состоянии.
Сложные вещества могут иметь как молекулярное строение (Н2S, CH4, HCl, H2O), так и немолекулярное: ионное (NaCl, Na2O, NaOH) или металлическое (Fe3C — карбид железа).
Химические реакции, их классификация
Химическими реакциями являются процессы, при которых изменяется состав соединений вследствие разрушения связей в одних веществах и образования новых соединений.
Химические реакции — это явления, при которых происходят превращения одних веществ в другие без изменения состава атомных ядер.
Для условного записи химических реакций применяют уравнения химических реакций, где в левой части указывают формулы исходных веществ, а в правой — конечных продуктов, образовавшихся в результате реакции Перед формулами всех веществ проставляют необходимые стехиометрические коэффициенты — числа, с помощью которых сравнивают количества атомов каждого элемента слева и справа.
Итак, уравнение химической реакции — условный запись, в которой с помощью химических формул соединений и стехиометрических коэффициентов отмечают состав и количество исходных веществ и продуктов реакции .
Химические реакции всегда сопровождаются физическими эффектами, которые подтверждают протекание реакции. Визуальными признаками химических реакций обычно является выделение газа, выпадение осадка, изменение окраски реакционной среды или тепловой эффект.
Для химических реакций, проходящих между неорганическими реагентами, чаще всего используются такие классификации:
- По признаку изменения количества и состава исходных веществ и конечных продуктов все реакции делятся на типы:
- реакции разложения, в которых из одного сложного вещества образуется несколько продуктов. В общем виде:
- реакции соединения , в которых из нескольких веществ относительно простого состава образуется одна сложное вещество:
- реакции замещения, в которых простое вещество замещает составную часть сложного вещества, в результате чего образуются другие простая и сложная вещества: A + B C→ A B + CA+BC→AB+C.
- реакции обмена, в которых молекулы сложных веществ обмениваются своими составными частями: A B + CD → A D + B CAB+CD→AD+BC.
- По признаку изменения валентных состояний атомов выделяют:
- окислительно-восстановительные реакции, при которых происходит изменение степеней окисления у атомов одного или нескольких исходных веществ. Этот тип реакций подробно будет рассматриваться позже, а здесь мы ограничимся только примером окислительно-восстановительной реакции с указанием степеней окисления:
- реакции невалентных преобразований, в процессе которых меняется только состав веществ, а электронные оболочки отдельных атомов остаются неизменными, а значит и степени окисления в атомах всех элементов не изменяются. Типичными случаями реакций невалентных преобразований являются реакции обмена, а также некоторые реакции соединения и разложения.
- В зависимости от направления течения реакции делятся на:
- оборотные, при которых протекание реакций происходит как в прямом, так и в обратном направлении. Следует помнить, что при записи оборотных реакций вместо знаков равенства или стрелочки (= или →→) Ставят две стрелки, направленные в противоположные стороны (↔↔ или ⇔⇔).
- необратимые, идущие в одном направлении до полного расходования хотя бы одного из реагентов. Как правило, необратимые реакции имеют одну из следующих признаков: а) продукты, получаемые, выходят из реакционной среды в виде осадка или газа; b) образуются малодиссоциированные соединения (то есть слабые электролиты: вода, слабая кислота или слабое основание) с) выделяется большое количество теплоты (горение, взрыв).
- По агрегатному или фазовым состоянием реакции делятся на следующие группы:
- гомогенные, при которых вещества, содержащиеся в системе, не отделяются друг от друга поверхностью раздела фаз;
- гетерогенные, характеризующихся наличием поверхности раздела фаз, то есть хоть одно соединение находится в другом агрегатном состоянии, чем остальные веществ.
- По характеру энергетического воздействия выделяют следующие реакции:
- термохимические, которые сопровождаются тепловым эффектом, то есть энергия подводится или отводится в форме теплоты. По знаку тепловых эффектов реакции делятся на следующие типы:
- экзотермические, сопровождающиеся выделением теплоты;
- эндотермические, при которых теплота поглощается;
- фотохимические, которые происходят под действием света сопровождаются излучением световой энергии
- электрохимические, протекающих под действием электрической энергии или сами являются источником электрического тока. Электрохимические реакции происходят в гальванических элементах, при электролизе и при коррозии металлов.
- термохимические, которые сопровождаются тепловым эффектом, то есть энергия подводится или отводится в форме теплоты. По знаку тепловых эффектов реакции делятся на следующие типы:
- В зависимости от природы реагирующих частиц реакции могут быть:
- молекулярными, при которых взаимодействие между веществами проходит результате столкновения отдельных молекул реагирующих веществ;
- ионными, протекающих при взаимодействии между ионами;
- радикальными, при которых одной из взаимодействующих частиц является радикал. Радикалы при записи обозначают с помощью точки рядом с формулой (∙∙).
- При наличии постороннего влияния на скорость реакции они делятся на:
- каталитические, протекающих в присутствии катализаторов — специальных веществ, которые ускоряют реакцию;
- некаталитические, в которых ускоряющий влияние катализатора отсутствует.
Одна и та же реакция в зависимости от признака рассматриваемого может классифицироваться по-разному. Например, синтез NH3 с N2 и H2 в присутствии железного катализатора является реакцией сообщения и одновременно относится к окислительно-восстановительным, гомогенным, молекулярным, каталитическим, термохимическим и оборотным реакциям.
www.polnaja-jenciklopedija.ru
Урок «Атомы. Молекулы. Химические элементы» (8-й класс)
Цель урока: формирование понятия молекула, атомом, химический элемент.
Задачи урока:
- дать понятие: молекула, атом, химический элемент;
- познакомить учащихся с этимологическими началами названий химических элементов;
- формировать навыки самостоятельной работы с учебным материалом через работу на компьютере;
- развитие пространственного воображения через использование новых информационных технологий;
- совершенствовать умственную деятельность: умение анализировать, делать выводы, планировать свою деятельность;
- развивать познавательные способности и интерес у учащихся на уроке химии за счет цифровых образовательных ресурсов.
ОУУН:
- готовить доклады, составлять презентации;
- определять точку зрения;
- классифицировать по нескольким признакам;
- выступать перед аудиторией;
- придерживаться определенного стиля выступления.
Оборудование:
- компьютер;
- проектор;
- Internet.
Тип урока: комбинированный.
Методы: проблемное изложение материала.
Формы: групповая, парная, индивидуальная.
Ожидаемые результаты:
- знать определение: молекула, атом, химический элемент;
- знать знаки химических элементов, историю происхождения названий элементов;
- правильно называть химические элементы;
- классифицировать по нескольким признакам;
- готовить домашнее задание с использованием компьютера;
- выступать перед аудиторией.
Структура урока:
- Организационный момент.
- Актуализация знаний: межпредметные связи (химия + природоведение).
- Изучение нового материала.
- Систем. Закрепление.
- Итог.
Ход урока
1. Организационный момент.
2. Актуализация знаний учащихся.
В 5-м классе на уроках природоведения вы рассматривали понятие атом и молекула. Что это такое? (Учащиеся дают определение, которое помнят с уроков природоведения).
Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. Во многих случаях атомы не существуют по одиночке, а объединяются в группы – молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике.
Осознать значение числа радиуса атомного ядра очень сложно. Например, радиус атома углерода равен 1,5–10 м. Возьмите карандаш (графит – это углерод), проведите отрезок прямой линии длиной 3 см. (Учащиеся проводят линию).
Как вы думаете, сколько атомов углерода содержится в проведенной вами линии?
Учащиеся дают свои ответы.
Полученная линия содержит 100 мл атомов углерода в длину и около 1 мл в ширину.
Рассмотрим пример с сахаром: Какими свойствами обладает сахар? (Учащиеся отвечают: растворяется в воде, сладкий, белый). Представим, что крупинки сахара это молекулы. Раздробим молекулы до атомов, (учитель растирает сахар в ступке, ученик по желанию ему помогает). А сейчас смотрим, мы размельчили наши «молекулы», свойства сахара изменились? (Учащиеся отвечают, что нет). Какой вывод мы можем сделать? (Учащиеся отвечают, что свойства при измельчение не изменяются).
Какое определение вы дадите молекуле и атому? С химической точки зрения.
Дети дают определения, потом записывают их в тетрадь: молекула — это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию; молекулы построены из атомов; атом – это мельчайшая неделимая частица вещества, являющаяся носителем его свойств.
3. Изучение новой темы.
Слайд 1 (приложение 1).
На следующем слайде мы видим, что молекула воды состоит из атомов двух видов. Это атомы водорода и кислорода.
Рассмотрев изображение модели молекулы воды, какой мы можем сделать вывод?
Учащиеся отвечают, что вода состоит из двух атомов водорода и одного атома кислорода.
Слайды 2, 3 (приложение 1, портреты Роберт Бойль, Джон Дальтон).
В конце 17 столетия английский ученый Роберт Бойль впервые использовал в науке понятие о химическом элементе как составной части вещества. Он считал химический элемент – это вещество, которое нельзя разложить на более простые. Более чем через 100 лет другой английский ученый – Джон Дальтон связал понятие о химическом элементе с атомной гипотезой о строении вещества. Определение, которое дал Дальтон, химики используют и в наши дни.
Химический элемент – это совокупность атомов определенного вида. (Дети записывают определение).
В природе найдено 89 различных химических элементов. Достижения ядерной физики позволили получить ряд элементов искусственным путем. Поэтому в настоящее время изучено более 110 химических элементов. Каждый химический элемент имеет условное обозначение – химический знак или символ, название. А сейчас мы прослушаем домашнее задание.
Презентация домашнего задания «Химические элементы в древности», (приложение 2).
Задание: «Придумайте такие обозначения для химических элементов, чтобы их легко было воспроизвести. Какими ассоциациями Вы пользовались?» Когда большая часть учащихся выполнит это задание в тетради, следует попросить двух – трех учеников записать изобретенные ими символы на доске рядом с алхимическими. (Сравнение записанных на доске символов приводит к идее унификации способов обозначения химических элементов. Эту задачу успешно решил шведский естествоиспытатель Й. Я. Берцелиус).
Учащиеся задают вопросы.
В 1813 году Берцелиус предложил для обозначения химических элементов использовать буквы латинского алфавита. Система Берцелиуса очень проста. Химический элемент обозначают первой буквой латинского названия элемента. В некоторых случаях к первой букве добавляют еще букву с середины названия. Разработанными им знаками мы пользуемся до сих пор. Знаки химических элементов читаются по определенным правилам. Некоторые знаки читаются как буквы латинского алфавита. Исключение Н, который читают как букву Франц. алфавита.
Предложение Берцелиуса было принято всеми учеными, так как такие символы оказались очень удобным: их легко написать в тетради и напечатать в книге, они понятны каждому образованному человеку, независимо от того, на каком языке он говорит. Знаки 10 элементов читают как латинское название этих элементов. Знаки остальных элементов читаются как русские названия.
Слайд 4 (приложение 1).
Для обозначения химических элементов используют одинаковые знаки во всех странах мира. Знаки химических элементов вы можете найти во всех блицах периодической системы разных стран.
Слайды 5, 6, 7 (приложение 1).
Ребята обратите внимание: калий и кальций, в название кальция есть буква «цэ», с которой и начинается написание знака, в название калия ее нет. Магний и марганец. Натрий и азот. (Обратить внимание на эти знаки их некоторые учащиеся путают)
Презентация домашнего задания «Биография химических элементов» (приложение 3).
Презентация домашнего задания «Происхождение названий химических элементов» (приложение 4)
Вопрос: Ученые древних времен считали, что как слова состоят из букв, так и вещества состоят из элементов. Даже великий французский химик Лавуазье принимал термины элемент и простое вещество как равнозначные. Только Менделеев начал различать эти понятия. Что же такое химический элемент и простое вещество? (химический элемент – это один атом или их совокупность. Простое вещество – форма существования конкретного химического элемента. (Углерод – элемент, уголь, алмаз – простые тела).
Давайте подведем итог урока, что нового вы узнали сегодня на уроке?
Учащиеся отвечают.
4. Систем. Закрепление.
А сейчас ребята проверим, как вы усвоили материал.
Проверочная работа в форме егэ.
Учащиеся выполняют работу по карточкам (см. приложение 5).
5. Итог.
Итоги урока: выставление оценок. Домашнее задание.
urok.1sept.ru
Атомы — урок. Химия, 8–9 класс.
Термин «атом» предложил Дж. Дальтон в начале \(19\) века. Он назвал атомами мельчайшие частицы, не изменяющиеся в химических реакциях.
Атомы — мельчайшие химически неделимые частицы, из которых состоят вещества.
На сегодняшний день известно \(118\) видов атомов. Более \(90\) из них существуют в природе, а остальные получены искусственно.
Атомы характеризуются:
- определёнными очень малыми размерами;
- определённой, тоже очень малой, массой;
- определённым строением.
Размеры атомов настолько малы, что увидеть их невозможно даже в самый мощный микроскоп. Радиусы атомов составляют \(0,046\)–\(0,25\) нм (\(1\) нм \(=\) 10−9 м). Самый маленький — атом гелия, а самый большой — франция.
Атомы гелия и франция
Массы атомов тоже ничтожно малы. Так масса атома водорода составляет всего 1,67⋅10−24 г.
До конца \(19\)-го столетия атомы считали неделимыми частицами. Но учёные доказали, что атом имеет сложное строение.
Согласно современным представлениям каждый атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. Электроны имеют отрицательный заряд и нейтрализуют положительный заряд ядра.
Ядро намного меньше самого атома. Так, радиус атома водорода составляет \(0,046\) нм, а радиус его ядра — всего \(0,00000065\) нм. В его состав входят ещё более мелкие частицы: протоны (\(p\)) и нейтроны (\(n\)). Протоны заряжены положительно и определяют заряд ядра. Нейтроны — частицы без заряда.
Заряд протона равен по величине заряду электрона, а число протонов в ядре равно числу электронов в атоме. Поэтому атомы нейтральны.
Атомы различаются между собой строением (числом содержащихся в них частиц), а также массой и размерами.
Атом гелия

Атом кислорода
В химических реакциях атомы не изменяются, а только перегруппировываются — объединяются в новых комбинациях.
Атом — мельчайшая химически неделимая электронейтральная частица вещества, состоящая из положительного ядра и отрицательных электронов.
Атомы не изменяются в химических реакциях, но существуют ядерные реакции, при протекании которых их строение изменяется.
Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число вариантов соединения атомов практически бесконечно, и их относительно небольшое число приводит к образованию огромного количества разнообразных веществ.
Пример:
атомы кислорода образуют два вещества. Когда они соединяются попарно, то образуется кислород.
Молекула кислорода
Если же три атома кислорода образуют молекулу, то образуется озон.
Молекула озона
В молекулах атомы соединены друг с другом химическими связями.
www.yaklass.ru
Атомы химических элементов
Для начала выясним что такое элемент?
Элемент — это вещество, которое состоит исключительно из атомов одного вида.
Например кусок висмута содержит только атомы висмута, причем все они химически идентичны. Мы можем этот кусок размельчить кузнечным молотом, а затем размолоть в порошок. Однако каждый кусок, каждая отдельная частичка порошка — это все еще висмут. Мы можем нагревать его до тех пор, пока он не потечет как вода, или пока он не закипит, и каждый атом не вылетит в воздух. Но мы все еще будем иметь те же атомы химического элемента висмута и ничего более.
Большинство атомов способно соединяться с другими, образуя при этом молекулы. Атом одного химического элемента может соединяться с другими подобными атомами. Так, два атома кислорода образуют молекулу кислорода. Атом может также соединяться с одним или с несколькими атомами других элементов, образуя молекулы или химические соединения.
Удивительно в химическом процессе то, что при соединении двух различных атомов образуется совершенно иное вещество с новыми свойствами. Сильно воспламеняющийся газ — водород, соединяясь с кислородом, образует воду. Два ядовитых вещества: газообразный хлор и мягкий серебристо-белый металл натрий, соединяясь, образуют обычную столовую соль.
Другое хорошо известное соединение — сахар удается без труда разложить на более простые составные части. Для этого нужно положить некоторое количество сахара в реторту и нагреть ее. Вскоре молекулы сахара начнут распадаться. Образующийся черный остаток указывает на то, что сахар частично состоит из углерода. Другие атомы, которые были связаны в молекуле сахара, разъединяются, испаряются и конденсируются в виде капелек, которые стекают в стакан. Оказывается, эти капли — обычная вода. Мы можем пойти еще дальше и пропустить электрический ток через полученную воду, поместив ее в аппарат для электролиза. При этом молекула воды разлагается на водород и кислород, которые выделяются в виде отдельных пузырьков.
Сахар, таким образом, состоит из следующих химических элементов: углерода, водорода и кислорода. Каждая молекула сахара содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.Значит, химическая формула сахара выглядит так: С12Н22О11.
В реторте мы имели дело с миллиардами миллиардов молекул сахара, но интересно выяснить, что же происходит с каждой молекулой в отдельности.
Наглядное представление об этом процессе можно получить с помощью модели.
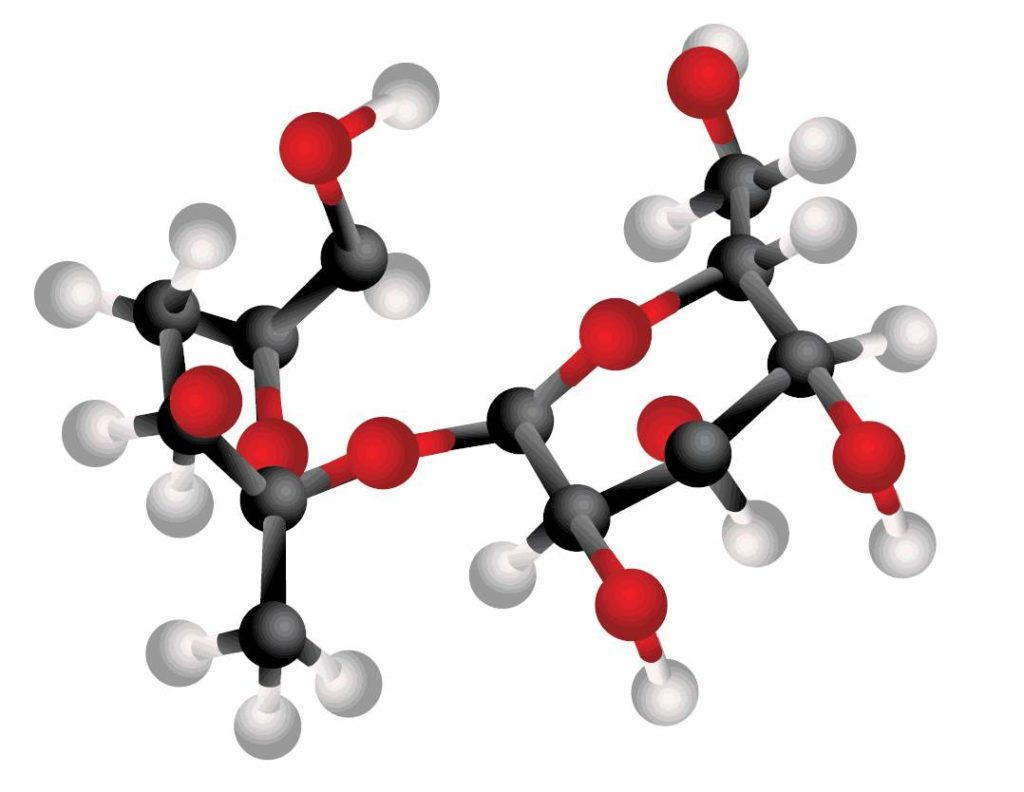

Черные шарики изображают атомы углерода, белые — атомы водорода и красные — атомы кислорода. Палочки показывают химические связи, которые удерживают отдельные атомы элемента вместе. Это, конечно, не совсем та молекула сахара, которая оказалась бы на самом деле, если бы мы могли увидеть ее, но все же модель хорошо иллюстрирует общее расположение атомов внутри молекулы.
При нагревании молекула разлагается. 12 атомов углерода остаются на дне реторты, а 11 молекул воды переходят в пар. Этот результат можно выразить таким уравнением:
С12Н22О11 — 12С +11Н20.
Другими словами, из одной молекулы сахара образуется 12 атомов углерода и 11 молекул воды. Наконец, когда молекулы воды разлагаются, из них возникают 22 атома водорода и 11 атомов кислорода. Они соединяются парами, образуя 11 молекул водорода (Н2) и 51/2 молекул кислорода (О2) на каждую разложенную молекулу сахара.
Можно написать эту реакцию при помощи целых чисел, если удвоить число молекул воды, участвующих в реакции:
22Н2О — 22Н2 + 1102.
В другом эксперименте будем нагревать химическое соединение — окись ртути, представляющее собой порошок красного цвета. Название этого соединения говорит о том, что оно состоит из ртути и кислорода.
Вначале окись ртути изменяет окраску. Затем она закипает и начинает испаряться из колбы. Образовавшиеся газы, после того как они вырываются через шейку реторты, охлаждаются. Ртуть образует капли, которые собираются в стакане. Кислород также выделяется из реторты.
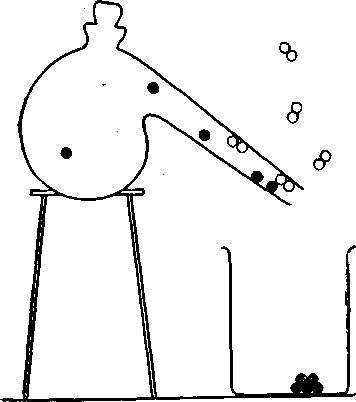

Мы не можем увидеть газообразный кислород, но зато сможем установить его присутствие, поднеся к реторте тлеющую деревянную лучинку. В атмосфере почти чистого кислорода лучинка загорается ярким пламенем.
Таким образом, нами установлено, что сухой красный порошок состоит из блестящего жидкого металла и газа, способного поддерживать горение. Молекула окиси ртути намного проще молекулы сахара. Она состоит всего лишь из двух атомов — ртути (символ которой — Hg) и кислорода. Это сразу видно из формулы окиси ртути: HgO.
При нагревании молекулы окиси ртути разлетаются в стороны, ударяются друг о друга или о стенки реторты. Каждая молекула разрушается, атом кислорода отскакивает от атома ртути.
Одиночные атомы ртути проходят через шейку реторты,, как обычный газ, и при охлаждении конденсируются в форме капелек. Атомы кислорода соединяются попарно и выделяются в виде газа. Этот процесс можно совсем просто записать с помощью химических символов:
HgO — Hg+O.
Однако, так как молекулы кислорода состоят из двух атомов, то свободный кислород, т. е. молекулу кислорода, надо обозначить символом О2. Так что мы должны поправить эту запись, заменив одну молекулу окиси ртути на две:
2HgO — 2Hg + 02
Это означает, что две молекулы HgO образуют два атома ртути и одну молекулу кислорода, которая, естественно, содержит два атома кислорода. Таким образом, окись ртути, как и сахар, является скоплением одинаковых молекул, каждая из которых построена из атомов более чем одного сорта.
Пять чистых жидкостей, которые мы испытывали ранее, также были простыми соединениями (точнее, последняя из них была раствором двух соединений). Кстати, все пять жидкостей состояли только из газообразных или из газообразных и твердых элементов. Эти жидкости:
- Вода (водород и кислород).
- Ацетон (водород, кислород и углерод) — та жидкость, которая воспламенялась.
- Четыреххлористый углерод (углерод и хлор) — та жидкость, которая гасила пламя.
- Азотная кислота (водород, кислород, азот) — та, которая химически реагировала с медной пластинкой.
- Раствор кобальта-60 (вода плюс нитрат, азот и кислород, радиоактивного кобальта) — та, которая заставляла счетчик Гейгера трещать, как пулемет.
Для получения пяти различных жидкостей было использовано всего шесть элементов. Но даже если взять всего два элемента — водород и углерод, то из них можно получить тысячи различных соединений, в частности парафин, керосин, пластмассы.
Свойства таких углеводородов зависят только от относительного числа атомов углерода и водорода в каждой молекуле, а также от способа, по которому атомы соединяются вместе.
Химические формулы для различных углеводородов сразу показывают нам числа атомов углерода и водорода в каждой молекуле. Например, СН4 — это метан. А вот и некоторые другие соединения:
- С2Н2 — ацетилен,
- С2Н4 — этилен,
- С8Н18 — октан,
- C10H18 — декагидронафталин.
Конечно, нужно взять много квадриллионов молекул, чтобы получить видимые или весомые количества углеводорода или какого-либо другого соединения. Ведь размер атома углерода порядка одной пятидесятимиллионной сантиметра.
Свойства атомов химических элементов
Что же касается атомного ядра, то оно еще меньше атома: диаметр атома превосходит диаметр его ядра примерно в десять тысяч раз. Если мы представим себе атом углерода увеличенным до размеров футбольного поля, то электроны будут похожи на мух, летающих над стадионом, а ядро — на футбольный мяч, причем этот мяч будет а тысячи раз тяжелее всех мух (т. е. электронов) вместе взятых.
Это означает, что более 99,9% всего вещества Вселенной сконцентрировано в очень маленьких ядрах атомов. И таким образом, атом является в основном пустым пространством.
О весе атома можно получить представление, основываясь на том, что равные объемы всех простых газов и паров содержат одинаковое число молекул. Если мы на каждую чашку весов положим колбы горловинами вниз, мы уравновесим один литр воздуха другим. Если теперь одну из колб наполнить водородом, вытеснив из нее воздух, то разница в весах этих колб покажет, насколько литр воздуха тяжелее литра водорода.
Можно пересчитать это на одну молекулу — путем очень длинного деления. Ведь известно, что в каждой колбе имеется одинаковое число молекул — примерно 26 870 000 000 000 000 000 000.
Число атомов будет вдвое больше, ибо свободные азот и кислород (основные компоненты воздуха), как и водород, имеют по два атома в молекуле.
Равные объемы некоторых металлов также весят по-разному, в зависимости от весов их атомов* Например, одинаковые кубики магния, железа, свинца и урана, подвешенные на одинаковых резинках, растянут их на разную длину.
Это, однако, дает только приблизительное представление об относительных весах атомов. Получить же их точные веса несравненно труднее: надо знать, насколько тесно атомы твердых элементов упакованы в различных материалах. Действительные атомные веса, взятые относительно веса атома кислорода, принятого равным 16, указаны в периодической системе. Они приблизительно равны: 238 — для урана, 207 — для свинца, 56 — для железа и 24 — для магния.
Следовательно, атом урана весит приблизительно столько, сколько весят 238 атомов водорода или 15 атомов кислорода.
Таково одно из многих сведений, содержащихся в периодической таблице. Периодическая таблица указывает также основные данные, которые необходимы для выяснения того, как атомы соединяются между собой.
Строение атомов химических элементов
Начнем с первого элемента — водорода, потому что его ядро представляет собой всего-навсего один протон. А протоны, как нам уже известно, являются основными частицами, из которых состоят ядра всех других элементов.
Каждый материальный объект во Вселенной состоит из атомов одного или более элементов. Общее число элементов немного больше ста, так что мы будем правы, если назовем атомы химическтх элементов строительными кирпичиками материи.
Но все элементы построены из одних и тех же основных ( фундаментальных ) частиц — протонов, нейтронов и электронов. Что же делает один элемент отличным от другого? Не что иное, как число протонов, нейтронов и электронов, входящих в его состав.
Протон — это частица с единичным зарядом положительного электричества. Он в то же время является ядром атома водорода и составляет более 99,9% его атомного веса.
Итак, ядро водорода — протон имеет заряд 1, как можно видеть из периодической таблицы, в которой указано, что атомный номер водорода равен 1. Мы можем изобразить его в виде кружочка со знаком +. Если мы добавим к протону вторую частицу такого же веса, но без электрического заряда, то такая система будет иметь вес, равный двум. Но ее заряд остается равным 1, так как в ней имеется только один протон. Нейтральная частица — нейтрон имеется в ядре каждого элемента, за исключением обычного водорода. Если теперь добавить сюда второй протон и второй нейтрон, то получится сложная частица с зарядом 2 и весом 4.
Из периодической таблицы нетрудно установить, что эта частица представляет собой ядро атома гелия, у которого атомный номер равен 2, а массовое число — 4. Массовое число — это общее число протонов и нейтронов, т. е. это атомный вес элемента, округленный до целого числа.
Если мы добавим к ядру гелия третий протон и третий нейтрон, то получим ядро лития, называемое литием-6. Это ядро имеет положительный заряд 3 и массовое число 6.
Наиболее распространенной формой этого серебристо-белого металла является литий-7, в состав которого входит еще один нейтрон. 92% природного лития состоит из лития-7, имеющего атомный вес 7,02 и массовое число 7. Средний же атомный вес природного лития (содержащего литий-6 и литий-7) равен 6,940.
Прибавляя протоны и нейтроны к этому ядру, мы будем получать ядра все более тяжелых элементов.
Но атом не станет атомом до тех пор, пока ядро не будет окружено соответствующим числом электронов — по одному электрону на каждый протон. Электрон — это единичный заряд отрицательного электричества, и он точно уравновешивает положительный заряд протона.
Таким образом, атом водорода состоит из одного протона и единственного электрона, вращающегося вокруг него.
Для атома химического элемента гелия потребуются два электрона, чтобы уравновесить положительный заряд 2, обусловленный его двумя протонами. Для атома характерно то, что только строго определенное число электронов может находиться на каждой данной орбите, или оболочке. Орбита, ближайшая к ядру, может иметь только два электрона. В этом случае считается, что первая оболочка заполнена, и далее начнет заполняться следующая орбита, на которой может находиться 8 электронов. Так, в атоме лития, как и в атоме гелия имеются два электрона на первой оболочке и, кроме того, третий электрон, одиноко вращающийся на внешней орбите.
В действительности орбиты трехмерны, а электроны движутся по поверхности воображаемой сферы. Причем их реальные пути намного сложнее, чем можно представить себе из нашего упрощенного описания.
Рассмотрев следующие семь элементов, мы обнаружим, что у них постепенно заполняется вторая оболочка. Последний из них, неон, имеет 10 протонов в ядре и 10 электронов на двух оболочках.
В атоме неона вторая оболочка с ее восемью свободными местами заполнена до предела. Внутренняя, двухэлектронная оболочка, конечно, тоже заполнена. Таким образом, неон, подобно гелию, является также «укомплектованным» атомом — в нем нет свободных мест или внешних, избыточных электронов.
После неона идет натрий, имеющий 11 протонов и 11 электронов. Одиннадцатый электрон одиноко вращается на третьей оболочке. Натрий, который в периодической таблице помещен непосредственно под литием и водородом, имеет, так же как и они, единственный электрон на своей внешней орбите.
Теперь мы начинаем понимать, почему мы говорим — периодическая таблица элементов. Мы установили, что определенные свойства атомов периодически повторяются, если располагать элементы по порядку возрастания их атомных номеров.
Важно, что каждый раз, когда к ядру прибавляется один протон, атом также должен получить и один дополнительный электрон. Этот электрон, обычно помещаемый на внешнюю орбиту, необходим для того, чтобы сохранить электрическую нейтральность атома в целом.
Следовательно, от числа протонов в ядре зависит количество электронов, вращающихся вокруг ядра. В нейтральном атоме должно находиться всегда одинаковое число протонов и электронов.
Число этих электронов и характер их размещения на возможных орбитах — это и определяет химические свойства любого данного элемента. Химические свойства просто означают, как элемент должен соединяться (или отказываться соединяться) с другими элементами. Они указывают также на то, насколько легко элемент должен соединяться и насколько устойчиво будет это соединение.
Химические свойства зависят от числа и расположения электронов в атоме и никак не связаны с протонами и нейтронами, находящимися в самом ядре.
Число нейтронов в атомном ядре, однако, различно для различных изотопов одного и того же элемента. Слово изотоп означает: занимающий то же самое, или равное (iso), место (topos). Изотопы элемента занимают одно и то же место в периодической системе и имеют одинаковое число протонов и электронов. Хорошим примером может служить природный литий, который содержит два изотопа: литий-6 и литий-7.
Главное, что отличает изотопы,— это их разные атомные веса, а нередко и радиоактивность.
Если мы возьмем атом водорода (протон с вращающимся вокруг него электроном) и добавим к его ядру нейтрон, то нам нет нужды прибавлять электрон: нейтрон не имеет заряда и не нуждается в электроне для сохранения электронейтральности атома. А так как мы не изменили числа электронов, то не изменили и химических свойств атома.
Единственное, что изменено, так это вес атома. У водорода имеется три изотопа: обычный водород, содержащий только протон в ядре; дейтерий, который имеет еще нейтрон, и поэтому его атомный вес равен 2; наконец, радиоактивный тритий, который имеет вес примерно три атомных единицы и содержит 1 протон и 2 нейтрона в ядре.
Природный уран — это, главным образом, изотоп U-238 с 92 протонами и 146 нейтронами в ядре. Но в природном уране содержится и другой хорошо известный изотоп U-235, способный к делению и служащий поэтому источником атомной энергии. U-235 имеет также 92 протона, но только 143 нейтрона, т. е. три единицы меньше атомного веса U-238. Наличие изотопов означает, что мы были не совсем точны, когда определяли элемент как вещество, все атомы которого идентичны.
Ядро атома трехмерное, а не плоское, каким мы его изображали. Некоторые ядра имеют почти сферическую форму, подобно футбольному мячу. Зато другие, в частности уран, более похожи на мяч для игры в регби (по форме он напоминает дыню).
www.polnaja-jenciklopedija.ru
Тема 1. Первоначальные химические понятия Урок 7
Теоретический материал
|
|
|||
machfi.narod.ru
Атомы и химические элементы, молекулы
Вы уже знаете, из чего образованы все тела. Правильно, из веществ. А из чего состоят вещества? «Кирпичиками», из которых образуются вещества, своеобразным строительным материалом веществ, являются атомы. Ученые доказали, что атомы имеют очень малые размеры. Так, в точке, поставленной на бумаге графитовым стержнем карандаша, атомов больше, чем звезд на ночном небе.
Атомы бывают разных видов. Сейчас известно более 100 видов атомов, которые отличаются между собой строением. Причем атомы одного вида могут входить в состав различных веществ. Например, одни и те же виды атомов входят в состав и сахара, и масла.
Химическая азбука
Атомы одного вида называют химическим элементом. Важно, что атомы одного вида имеют одинаковое строение независимо от того, в состав вещества они входят.
Как и буквы алфавита, каждый химический элемент имеет свое название и письменное обозначение, называют химическим символом. В таблице приведены названия, символы и произношение символов некоторых химических элементов. Пока вам достаточно запомнить только эти, важнейшие элементы.
| Название химического элемента | химический символ |
| водород | H |
| кислород | O |
| углерод | C |
| азот | N |
| кремний | Si |
| Железо | Fe |
| алюминий | Al |
В таблице не случайно приведены 7 элементов. Кремний, кислород, железо, алюминий — это элементы-рекордсмены по распространению на Земле. Атомы кислорода, азота, углерода, водорода распространены в телах живой природы. А еще водород — основной химический элемент Солнца.
С помощью химических символов обозначают состав веществ так же, как из букв азбуки составляют слова.
Молекулы и их движение
Атомы могут сочетаться между собой и образовывать молекулы. Многие вещества состоят именно из молекул, например вода, водород, кислород. Молекула — это наименьшая частица вещества, которая обладает теми же свойствами что само вещество.
Схема образования из атомов водорода и кислорода молекул воды, а из них — вещества и тела изображена на рисунке.
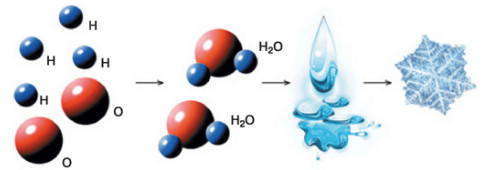

Итак, теперь вы знаете, что в образовании молекул участвуют атомы.
Ученые доказали, что молекулы находятся в непрерывном движении. Когда, рисуя акварелью, ты промываешь щеточку в стакане с водой, то она приобретает цвет акварельной краски. Тот же результат можно получить, если акварельную краску поместить на дно стакана с водой и оставить на время. Двигаясь, молекулы краски заполнят промежутки между молекулами воды, и вода в стакане окрасится. Это явление получило название диффузии.
Значительно быстрее диффузия происходит в газах, ведь расстояния между молекулами намного больше. (Вспомните, как быстро распространяются запахи освежителей воздуха, духов пр.)
В твердых телах диффузия тоже происходит, но очень медленно.
Выполните простой опыт. Для этого понадобятся две тарелки, вода. Поставьте тарелки на освещенный солнцем подоконник. Налейте в каждую из них по две столовые ложки воды. Для одной тарелки создайте тень. Наблюдайте за уменьшением количества воды в обеих тарелках.
Результаты наблюдения запишите в тетрадь. В какой из тарелок вода быстрее перешла из жидкого агрегатного состояния в газообразное? Объясните почему.
Заключение
Вещества образуются из атомов, размеры которых чрезвычайно малы. Химический элемент — совокупность атомов одного вида. Каждый вид атомов имеет свое обозначение — химический символ.
Молекулы — самые маленькие частицы вещества, имеющие его свойства. Молекулы находятся в постоянном движении.
Диффузия — явление проникновения (распространения) частиц одного вещества между частицами другого.
www.polnaja-jenciklopedija.ru