что это такое и какова формула вещества
Вещества молекулярного строения образуются с помощью особого вида взаимосвязи. Ковалентная связь в молекуле, полярная и неполярная, также называется атомной. Это название происходит от латинского «co» — «совместно» и «vales» — «имеющий силу». При таком способе образования соединений пара электронов делится между двумя атомами.
Свойства
Что такое ковалентная полярная и неполярная связь? Если новое соединение образуется таким образом, то происходит обобществление электронных пар. Обычно такие вещества имеют молекулярное строение: Н2, О3, HCl, HF, CH4.
Есть и немолекулярные вещества, в которых атомы связаны таким образом. Это так называемые атомные кристаллы: алмаз, диоксид кремния, карбид кремния. В них каждая частица связана с четырьмя другими, в результате получается очень прочный кристалл. Кристаллы с молекулярной структурой обычно не отличаются высокой прочностью.


Свойства такого способа образования соединений:
- кратность;
- направленность;
- степень полярности;
- поляризуемость;
- сопряжение.
Кратность — это количество поделенных электронных пар. Их может быть от одной до трех. У кислорода до заполнения оболочки двух электронов не хватает, поэтому она будет двойной. У азота в молекуле N2 она тройная.
Это интересно! Как самостоятельно определить валентность по таблице Менделеева
Поляризуемость — возможность образования ковалентной полярной связи и неполярной. При этом она может быть более или менее полярна, ближе к ионной или наоборот — в этом заключается свойство степени полярности.
Направленность означает, что атомы стремятся соединиться таким образом, чтобы между ними осталась как можно большая электронная плотность. О направленности имеет смысл говорить тогда, когда соединяются p или d-орбитали. S-орбитали сферически симметричны, для них все направления равноценны. У p-орбиталей неполярная или полярная ковалентная связь направлена вдоль их оси, так что две «восьмерки» перекрываются вершинами. Это σ-связь. Существуют и менее прочные π-связи. В случае p-орбиталей «восьмерки» перекрываются боковыми сторонами вне оси молекулы. В двойном или тройном случае p-орбитали образуют одну σ-связь, а остальные будут типа π.
Сопряжение — это чередование простых и кратных, делающее молекулу более стабильной. Такое свойство характерно для сложных органических соединений.


Виды и способы образования химических связей
Полярность
Важно! Как определить, вещества с неполярной ковалентной или полярной связью перед нами? Это очень просто: первая всегда возникает между одинаковыми атомами, а вторая — между разными, имеющими неодинаковую электроотрицательность.
Примеры ковалентной неполярной связи — простые вещества:
- водород Н2;
- азот N2;
- кислород О2;
- хлор Cl2.
Схема образования ковалентной неполярной связи показывает, что с помощью объединения электронной пары атомы стремятся дополнить внешнюю оболочку до 8 или 2 электронов. Например, фтору не хватает одного электрона до восьмиэлектронной оболочки. После образования поделенной электронной пары она заполнится. Распространенная формула вещества с ковалентной неполярной связью — двухатомная молекула.


Полярно обычно связываются только элементы-неметаллы:

 Но бывают и исключения, такие как AlCl3. Алюминий обладает свойством амфотерности, то есть в одних соединениях он ведет себя как металл, а в других — как неметалл. Разница в электроотрицательности в этом соединении небольшая, поэтому алюминий соединяется с хлором именно так, а не по ионному типу.
Но бывают и исключения, такие как AlCl3. Алюминий обладает свойством амфотерности, то есть в одних соединениях он ведет себя как металл, а в других — как неметалл. Разница в электроотрицательности в этом соединении небольшая, поэтому алюминий соединяется с хлором именно так, а не по ионному типу.В этом случае молекулу образуют разные элементы, но разница в электроотрицательности не так велика, чтобы электрон полностью перешел от одного атома к другому, как в веществах ионного строения.
Схемы образования ковалентной структуры этого типа показывают, что электронная плотность смещается к более электроотрицательному атому, то есть поделенная электронная пара находится к одному из них ближе, чем ко второму. Части молекулы приобретают заряд, который обозначается греческой буквой дельта. В хлороводороде, например, хлор становится заряжен более отрицательно, а водород — более положительно. Заряд будет частичный, а не целый, как у ионов.
Важно! Не следует путать полярность связи и полярность молекулы. В метане СН4, например, атомы связаны полярно, а сама молекула неполярна.
Полезное видео: полярная и неполярная ковалентная связь
Механизм образования
Образование новых веществ может проходить по обменному или донорно-акцепторному механизму. При этом объединяются атомные орбитали. Возникает одна или несколько молекулярных орбиталей. Они отличаются тем, что охватывают оба атома. Как и на атомной, на ней может находиться не более двух электронов, причем их спины тоже должны быть разнонаправленными.
Как определить, какой механизм задействован? Это можно сделать по числу электронов на внешних орбиталях.
Это интересно! Что такое алканы: строение и химические свойства
Обменный
В этом случае электронная пара на молекулярной орбитали образуется из двух неспаренных электронов, каждый из которых принадлежит своему атому. Каждый из них стремится заполнить свою внешнюю электронную оболочку, сделать ее устойчивой восьми- или двухэлектронной. Так обычно образуются вещества с неполярной структурой.
Для примера рассмотрим соляную кислоту HCl. У водорода на внешнем уровне один электрон. У хлора — семь. Нарисовав схемы образования ковалентной структуры для него, увидим, что для заполнения внешней оболочки каждому из них не хватает по одному электрону. Поделив между собой электронную пару, они смогут завершить внешнюю оболочку. По такому же принципу образуются и двухатомные молекулы простых веществ, например, водорода, кислорода, хлора, азота и других неметаллов.


Механизм образования
Донорно-акцепторный
Во втором случае оба электрона представляют собой неподеленную пару и принадлежат одному атому (донору). У другого (акцептора) есть свободная орбиталь.
Формула вещества с ковалентной полярной связью, образованной таким образом, например, ион аммония NH4+. Он образуется из иона водорода, в котором есть свободная орбиталь, и аммиака Nh4, содержащего один «лишний» электрон. Электронная пара из аммиака обобществляется.
Гибридизация
Когда электронная пара обобществляется между орбиталями различной формы, например, s и р, образуется гибридное электронное облако sp. Такие орбитали сильнее перекрываются, поэтому связываются прочнее.
Это интересно! Уроки химии: что это такое галогены
Так устроены молекулы метана и аммиака. В молекуле метана СН4 должны были образоваться три связи по p-орбиталям и одна по s. Вместо этого орбиталь гибридизируется с тремя р-орбиталями, получаются три гибридные sp3-орбитали в форме вытянутых капель. Это происходит потому, что электроны 2s и 2p имеют близкую энергию, они взаимодействуют друг с другом при соединении с другим атомом. Тогда можно образовать гибридную орбиталь. Получившаяся молекула имеет форму тетраэдра, водород располагается в его вершинах.
Другие примеры веществ с гибридизацией:
- ацетилен;
- бензол;
- алмаз;
- вода.
Для углерода характерна spЗ-гибридизация, поэтому она часто встречается в органических соединениях.
Полезное видео: ковалентная полярная связь
Вывод
Ковалентная связь, полярная или неполярная, характерна для веществ молекулярного строения. Неполярно связаны атомы одного элемента, а полярно — разных, но с ненамного отличающейся электроотрицательностью. Обычно таким образом соединяются элементы-неметаллы, но бывают и исключения, такие как алюминий.
Вконтакте
Одноклассники
Мой мир
znaniya.guru
Урок 3. Схема образования молекул – HIMI4KA
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.


Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
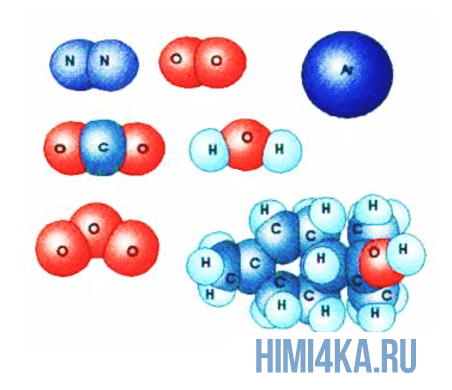

Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах


Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
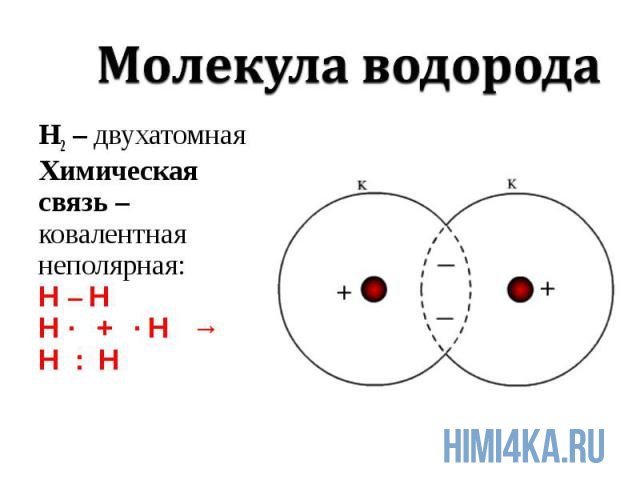

Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.


Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
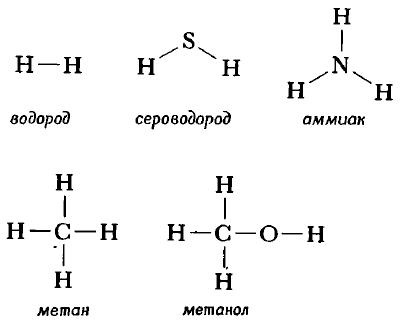

Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
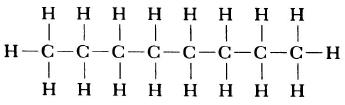
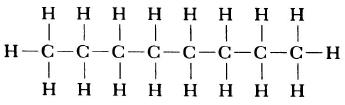
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
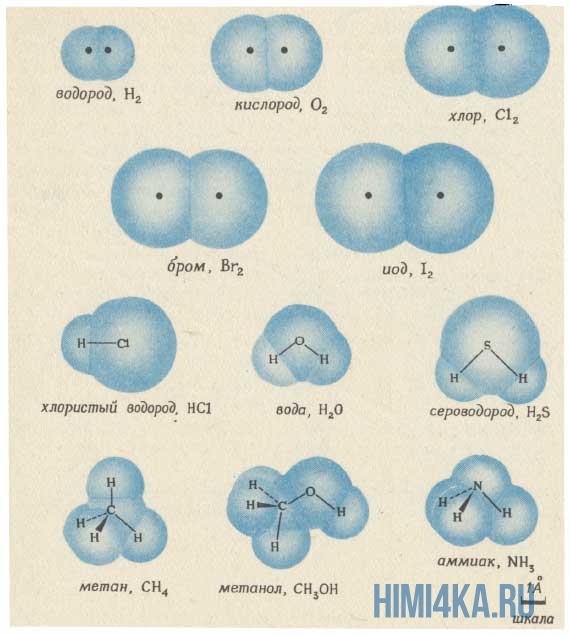

Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:


Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Упражнение: 1 Атомы водорода и фосфора имеют одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина РН3? В молекуле фосфина РН3 ковалентная неполярная химическая связь. Упражнение: 3 В какой из молекул – хлороводорода HCl или фтороводорода HF — ковалентная химическая связь более полярна? На основании ряда электроотрицательности неметаллов фтор электроотрицательнее хлора, потому ковалентная связь в молекуле фтороводорода HF более полярная, чем в молекуле хлороводорода HCl. Упражнение: 4 В следующих предложениях вставьте пропущенные слова и выражения: «Ковалентная химическая связь образуется за счет … . По числу общих электронных пар она бывает … . По ЭО ковалентную связь делят на … и …». | Упражнение: 2 Определите тип химической связи и запишите схему ее образования для веществ с формулами: а) S2, K2O, H2S; б) N2, Li3N, Cl3N. а)ковалентная неполярная: S2 б)ковалентная неполярная: N2 |
reshebnikxim.narod.ru
Задачи к разделу Химическая связь и строение молекул
Решение. CH3Br
— ковалентная связь. Ковалентная связь возникает между атомами с близкими или равными значениями электроотрицательностей. Эта связь может рассматриваться как электростатическое притяжение ядер двух атомов к общей электронной паре.В отличие от ионных соединений, молекулы ковалентных соединений удерживаются вместе за счет «межмолекулярных сил», которые намного слабее химических связей. В связи с этим, ковалентной связи характерна насыщаемость – образование ограниченного числа связей.
Известно, что атомные орбитали ориентированы в пространстве определенным образом, поэтому при образовании связи, перекрывание электронных облаков происходит в определенном направлении. Т.е. реализуется такое свойство ковалентной связи как направленность.
СаО – ионная связь. Отдельные атомы какого-либо элемента будут стремиться к устойчивой восьмиэлектронной структуре, теряя или приобретая электроны. Атомы, захватившие электроны, имеют отрицательный заряд и называются
Ионные соединения часто имеют сходные свойства. Они стремятся образовывать группы, которые, в свою очередь, образуют еще более крупные группировки, типа LinClm. Такие образования называются кристаллами. Это происходит из-за того, что для данного типа связи не характерна направленность и насыщаемость.
J2 – Ковалентная неполярная связь. Если ковалентная связь в молекуле образована одинаковыми атомами или атомами с равной электроотрицательностью , то такая связь не имеет полярности , т.е электронная плотность распределяется симметрично. Называется она неполярной ковалентной связью. Связи могут быть как одинарными, так и двойными, тройными.
NH4Cl — донорно-акцепторная связь. Является частным случаем ковалентной связи, когда один атом выступает в роли донора электронной пары, а другой атом — его акцептором (предоставляет свободную орбиталь). Данную связь часто называют координационной, т.к. она часто возникает при образовании комплексных соединений. При образовании донорно-акцепторной связи электронная оболочка атома-акцептора пополняется парой электронов. В роли доноров и акцепторов
Между NH4+ и Cl— — ионная связь. Между азотом и водородом ковалентная полярная и одна донорно-акцепторная связи.
zadachi-po-khimii.ru