Урок 32. состав – структура – свойства — Естествознание — 10 класс
Естествознание, 10 класс
Урок 32. Состав – структура — свойства
Перечень вопросов, рассматриваемых в теме:
- Какова структура вещества? Все ли вещества имеют молекулярную структуру?
- В чем причина многообразия веществ? Как структура молекул влияет на свойства веществ?
- Можно ли прогнозировать свойства вещества, зная его структуру (строение)?
Глоссарий по теме:
Генезис (греч. — genesis) — происхождение, становление и развитие, результатом которого является определенное состояние изучаемого объекта. Генезис природных и социальных явлений интересовал и интересует философию и науку с античности до наших дней (философский словарь).
Структу́ра (от лат. Structūra — «строение»), или строе́ние — внутреннее устройство чего-либо / Ожегов С.И. и Шведова Н.Ю. Толковый словарь русского языка.
Качественный состав – это перечень всех образующих вещество химических элементов.
Количественный состав – это число атомов каждого химического элемента в составе мельчайшей частицы вещества – его молекулы.
Запись, выражающая качественный и количественный состав вещества с помощью хими-ческих знаков, называется химической формулой.
Закон постоянства состава: Многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Химическая связь – это совокупность сил, связывающих и удерживающих атомы или другие частицы в устойчивых структурах (молекулах и др.).
Гибридизация атомных орбиталей – это их перемешивание в пространстве с целью выравнивания и обеспечения наиболее полного перекрывания.
Аллотропия – это явление, при котором один и тот же химический элемент образует несколько простых веществ.
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Основная и дополнительная литература по теме урока:
Основные источники:
- Еремин В.В. Теоретическая и математическая химия для школьников. – М.: МЦНМО, 2007.
- Миттова И.Я., Самойлов А.М. История химии с древнейших времен до конца XX века: учебное пособие в 2-х томах. Т. 1. – Долгопрудный: ИД «Интеллект», 2009.
- Папулов Ю.Г, Левин В.П., Виноградова М.Г. Строение вещества в естественнонаучной картине мира: Молекулярные аспекты. Учебное пособие, 2-ое издание. Тверь: ТвГУ, 2005 — 208 с.
Дополнительные источники:
- Травень В. Ф. «Органическая химия», в 2-х томах.
 Москва, ИКЦ «Академкнига», 2004.
Москва, ИКЦ «Академкнига», 2004. - Химия. Школьная энциклопедия. Гл. ред. Ю.А.Золотов. М.: Большая российская энциклопедия, 2003.
- Энциклопедия для детей. Том 17. Химия. Гл. ред. В.А.Володин. — М.: Аванта+, 2000.
Теоретический материал для самостоятельного изучения
Учение о молекуле лежит в основе всех
других обобщений, так что современную химию
можно по праву назвать молекулярной химией.
А. М. Бутлеров, (1828-1886), русский химик, создатель теории химического строения органических веществ, учёный-пчеловод и лепидоптеролог, общественный деятель
Установление взаимосвязи между свойствами веществ и строением молекул составляет фундаментальную научную проблему химии. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении порядка расположения атомов (связей) в исходных соединениях и характера изменений при образовании из них других соединений.
Мы знаем, что молекула представляет собой микрочастицу, образованную из атомов и способную к самостоятельному существованию, обладающую его главными химическими свойствами. Она имеет постоянный состав входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать молекулы одного вида от молекул другого. Число атомов в молекуле может быть различным: от двух до сотен тысяч. Молекулы простых веществ состоят из одинаковых атомов, сложных – из разных атомов. Существует большое количество соединений, молекулы которых состоят из многих тысяч атомов — макромолекулы.
Первые представления о структуре молекул основывались на химическом анализе. Со времен М.В. Ломоносова (1741), который высказал мысль, что свойства вещества зависят от рода, числа и расположения «элементов» (атомов), составляющих его «корпускулу» (молекулу), представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволило определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле, составленной на основе качественного и количественного анализа, а также закона постоянства состава (Ж. Пруст). В дальнейшем А.М. Бутлеров (1861) ввел понятие химического строения (как порядка связи атомов в молекуле) и показал, что свойства вещества определяются его составом и химическим строением. Стереохимическая гипотеза Я. Вант-Гоффа и Ле Беля (1874) расширила понятие строения. Оказалось, что свойства вещества зависят как от химического (в топологическом плане), так и пространственного строения молекул. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов.
Пруст). В дальнейшем А.М. Бутлеров (1861) ввел понятие химического строения (как порядка связи атомов в молекуле) и показал, что свойства вещества определяются его составом и химическим строением. Стереохимическая гипотеза Я. Вант-Гоффа и Ле Беля (1874) расширила понятие строения. Оказалось, что свойства вещества зависят как от химического (в топологическом плане), так и пространственного строения молекул. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов.
«Пространственное строение частиц в зависимости от типа гибридизации». Приведите свои примеры веществ.
Тип гибриди-зации центрального атома | Пространственное строение частицы | Условное изображение | Примеры |
sp | Линейное | ВеС12, ZnCl2, С2Н2 | |
sp2 | Плоскостно-тригональное | BCl3, N03—,CO32-, C2H4, C6H6 | |
sp3 | Тетраэдр | CH4, NH4+, SO42-, CC14 | |
sp3 | Тригональная пирамида | NH3, H30+ | |
sp3 | Угловое | Н20 |
Чем различаются понятия «свойства молекулы» и «свойства вещества»?
Подсказка. Допустим, вы открыли химический справочник и в статье «Азот» прочитали: «N2 – газ без цвета и запаха, tкип = –196 °С, tпл = –210 °С, энергия химической связи 940 кДж/моль». Какие из этих характеристик относятся к свойствам молекулы азота, а какие к свойствам простого вещества?
Допустим, вы открыли химический справочник и в статье «Азот» прочитали: «N2 – газ без цвета и запаха, tкип = –196 °С, tпл = –210 °С, энергия химической связи 940 кДж/моль». Какие из этих характеристик относятся к свойствам молекулы азота, а какие к свойствам простого вещества?
В состав молекулы может входить различное число атомов. Так, молекулы благородных газов одноатомны, молекулы таких веществ, как водород, азот, — двухатомны, воды — трехатомны и т.д. Молекулы наиболее сложных веществ — высших белков и нуклеиновых кислот — построены их такого количества атомов, которое измеряется сотнями тысяч. При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико.
Все ли вещества состоят из молекул?
Подсказка. Для ответа на этот вопрос обратитесь к строению таких веществ как металлы, алмаз, графит, хлорид натрия.
Не во всех случаях частицы, образующие вещество, представляют собой молекулы.
Многие вещества в твердом и жидком состоянии, например, большинство солей, имеют не молекулярную, а ионную структуру. Некоторые вещества имеют атомное строение. В веществах, имеющих ионное или атомное строение, носителем химических свойств являются не молекулы, а те комбинации ионов или атомов, которые образуют данное вещество.
Вспомните, какие типы связей и кристаллических решеток существуют? Чем определяются свойства веществ?
В зависимости от природы частиц, образующих кристалл, различают
атомные, молекулярные, ионные и металлические кристаллические решеткиТаблица 2 «Зависимость свойств веществ от типа связи и кристаллических решеток»
Тип кристаллической решетки | Характерный вид химической связи | Частицы, располагающиеся в узлах решетки | Примеры веществ и их характерные свойства |
Атомная | Ковалентная неполярная | Атомы | Некоторые неметаллы, оксиды и др. |
Молекулярная | Ковалентная неполярная и полярная | Молекулы | Неметаллы, оксиды, кислоты и др. Разнообразны по агрегатному состоянию и другим свойствам. Легко переходят из одного агрегатного состояния в другое. Летучи, легкоплавки. |
Ионная | Ионная | Ионы | Соли, щелочи и др. Твердые вещества с высокими температурами плавления. Малолетучи. Хорошо растворяются в полярных растворителях. |
Металлическая | Металлическая | Атомы и катионы металла | Металлы. Твердые вещества (кроме ртути) с металлическим блеском. Ковки, пластичны. Обладают тепловой и электрической проводимостью. |
В настоящее время известен не один десяток миллионов разнообразных веществ. При этом все они образованы значительно меньшим числом химических элементов (современной науке достоверно известно 112 химических элементов).
Как объяснить такое разнообразие веществ?
Что такое аллотропия?
Приведите примеры аллотропных модификаций известных вам химических элементов. Дайте сравнительную характеристику их свойств.
Явление аллотропии характерно для большинства неметаллов и многих металлов. При этом образуемые ими аллотропные модификации могут различаться по составу, строению и типу кристаллических решеток.
Между аллотропными модификациями одного элементы возможны взаимные переходы. При этом все они имеют разную устойчивость. Как правило, при одних и тех же условиях более стабильна лишь одна из модификаций, обладающая минимальным запасом энергии. Остальные модификации при этих же условиях будут неустойчивы и рано или поздно перейдут в более устойчивую форму.
Что такое изомерия?
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Приведите примеры известных вам изомеров. Укажите, в чем заключаются различия их строения и свойств.
Явление изомерии характерно и для неорганических, и для органических веществ. Однако особенно ярко оно проявляется среди органических соединений, являясь важнейшей причиной их многообразия.
Таблица Изомерия органических соединений
Виды изомерии органических соединений | |||||
Структурная изомерия | |||||
Углеродного скелета | Положения функциональных групп | Положения кратных связей | Межклассовая | ||
Пространственная изомерия | |||||
Конформационная | Геометрическая | Оптическая | |||
Проиллюстрируйте указанные в таблице виды изомерии примерами.
Выводы:
- Молекулы — это очередной после атомов качественный уровень строения и эволюции вещества.

- Вещества имеют разный состав и строение.
- Свойства веществ определяются их строением: характером связей, типом кристаллической решетки, пространственным расположением, порядком соединения атомов.
- Зная строение вещества можно прогнозировать его свойства.
Примеры и разбор решения заданий тренировочного модуля:
Задание 1. Вещество, в узлах кристаллической решетки которого находятся ионы, это…
Тип вариантов ответов: (Текстовые, Графические, Комбинированные).
а) CaС12;
б) NH3;
в) I2;
г) C (графит).
Правильный вариант/варианты (или правильные комбинации вариантов): а
Подсказка: В узлах ионных решеток располагаются, чередуясь, положительно и отрицательно заряженные ионы. К соединениям с ионной связью, образующим ионные решетки, относится большинство солей и небольшое число оксидов.
Задание 2. Соедините попарно прямоугольники с овалами так, чтобы каждому типу гибридизации атомных орбиталей углерода соответствовал пример молекулы. |
Правильный вариант: Подсказка: Тип гибридизации атомных орбиталей углерода определяется числом заместителей при этом атоме углерода:
|
Выход есть! Решение задач с массовой долей выхода продуктов
При обучении учащихся решению расчётных задач по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности задач и хода их решения;
- не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык, математические действия и обозначение физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить учащихся анализировать условия задач, через составление логической схемы решения конкретной задачи. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
Цели урока:
- формирование умения анализировать условие задачи;
- формирование умения определять тип расчетной задачи, порядок действий при ее решении;
- развитие познавательных, интеллектуальных и творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с использованием понятия “массовая доля выхода продукта реакции от теоретического”;
- отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего отношение к производственным процессам;
- стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.

Ход урока
Определяем причину и сущность ситуации, которые описываются в задачах “на выход продукта от теоретического”.
В реальных химических реакциях масса продукта всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят до конца.
- При взаимодействии органических веществ часто образуются побочные продукты.
- При гетерогенных реакциях вещества плохо перемешиваются, и часть веществ просто не вступает в реакции.
- Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может остаться в растворе.
Вывод:
- масса теоретическая всегда больше практической;
- объём теоретический всегда больше объёма практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению реакции, — теоретический выход, соответствует 100%.
Доля выхода продукта реакции ( — “этта”) — это отношение массы полученного вещества к массе, которая должна была бы получиться в соответствии с расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта реакции. Определить выход продукта.
2. Даны массы исходного вещества и выход продукта реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта. Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г хлора, было получено 24,3 г хлорида железа (III). Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для восстановления оксида железа (III), если получено 11,2г железа с выходом 80% от теоретически возможного.
Анализ задач.
Каждая задача складывается из совокупности данных (известные вещества) – условия задачи (“выход” и т.п.) – и вопроса (вещества, параметры которых требуется найти). Кроме этого, в ней есть система зависимостей, которые связывают искомое с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически возможного.
1. Запишите уравнение химической реакции и расставьте коэффициенты.
2. Под формулами веществ напишите количество вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся практическую массу к теоретической и умножив на 100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен выход продукта.
1. Запишите “дано” и “найти”, запишите уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества для исходных веществ. n =
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем продукта реакции.
m = M * n или V = Vm* n
5. Вычислите практические массу или объем продукта реакции (умножьте массу теоретическую или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе, найдите теоретический объём или массу (используя долю выхода продукта).
2. Найдите теоретическое количество вещества для продукта.
3. Найдите теоретическое количество вещества для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества найдите массу или объем исходных веществ в реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н. у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили 95 г аммиака NH3 с выходом 35%. Какие объёмы азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Презентация по химии «Символы химических элементов периодической системы Д.И. Менделеева»
Каждый химический элемент — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Ядро атома состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным. Разновидности атомов одного и того же химического элемента, имеющие различные массовые числа (равные сумме масс протонов и нейтронов, образующих ядро), называется изотопами.
В природе многие химические элементы представлены двумя или большим числом изотопов. Известно 276 стабильных изотопов, принадлежащих 81 природному химическому элементу, и около 2000 радиоактивных изотопов. Изотопный состав природных элементов на Земле, как правило, постоянен; поэтому каждый элемент имеет практически постоянную атомную массу, являющуюся одной из важнейших характеристик элемента. Известно более 110 химических элементов, они, преимущественно нерадиоактивные, создают все многообразие простых и сложных веществ.
Простое вещество — форма существования элемента в свободном виде. Некоторые химические элементы существуют в двух или более аллотропных модификациях (например, углерод в виде графита и алмаза), различающихся по физическим и химическим свойствам; число простых веществ достигает 400. Иногда понятия «элемент» и — «простое вещество» отождествляются, поскольку в подавляющем большинстве случаев нет различия в названиях химических элементов и образуемых ими простых веществ; «. ..тем не менее в понятиях такое различие должно всегда существовать», — писал в 1869 году Д. И. Менделеев.
..тем не менее в понятиях такое различие должно всегда существовать», — писал в 1869 году Д. И. Менделеев.
Тейлор Г. Основы органической химии для студентов нехимических специальностей.- М.:1989. Сложное вещество — химическое соединение — состоит из химически связанных атомов двух или нескольких различных элементов; известно более 100 тыс. неорганических и миллионы органических соединений.
Для обозначения химических элементов служат химические знаки, состоящие из первой или первой и одной из последующих букв латинского названия элемента (С одним исключением, вторая буква химического Элемента Кюрия, названного в честь Марии Складовской-Кюри, «m» означает Мария). В химических формулах и химических уравнениях каждый такой знак (символ) выражает, кроме названия элемента, относительную массу химического Элемента, равную его атомной массе. Изучение химических Элементов составляет предмет химии, в частности неорганической химии. Артеменко А.И. Органическая химия.- М.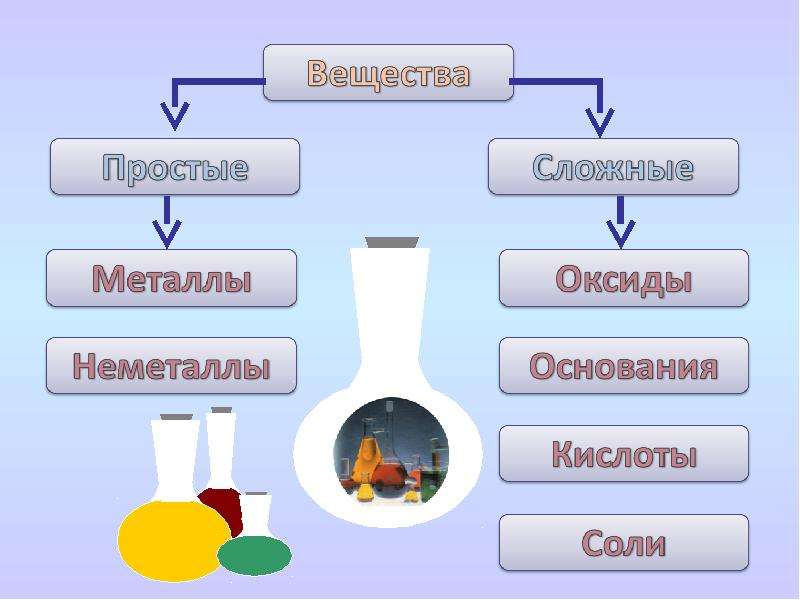 , 2007
, 2007
Историческая справка.
В донаучный период химии как нечто непреложное принималось учение Эмпедокла о том, что основу всего сущего составляют четыре стихии: огонь, воздух, вода, земля. Это учение, развитое Аристотелем, полностью восприняли алхимики.
В 8-9 веках они дополнили его представлением о сере (начале горючести) и ртути (начале металличности) как составных частях всех металлов. В 16 веке возникло представление о соли как начале нелетучести, огнепостоянства. Против учения о 4 стихиях и 3 началах выступил Р. Бойль, который в 1661 году дал первое научное определение химических элементов как простых веществ, которые не состоят из каких-либо других веществ или друг из друга и образуют все смешанные (сложные) тела.
В 18 веке почти всеобщее признание получила гипотеза И. И. Бехера и Г. Э. Шталя, согласно которой тела природы состоят из воды, земли и начала горючести — флогистона. В конце 18 века эта гипотеза была опровергнута работами А. Л. Лавуазье. Он определил химические элементы как вещества, которые не удалось разложить на более простые и из которых состоят другие (сложные) вещества, то есть по существу повторил формулировку Бойля. Но, в отличие от него, Лавуазье дал первый в истории науки перечень реальных химических Элементов.
Л. Лавуазье. Он определил химические элементы как вещества, которые не удалось разложить на более простые и из которых состоят другие (сложные) вещества, то есть по существу повторил формулировку Бойля. Но, в отличие от него, Лавуазье дал первый в истории науки перечень реальных химических Элементов.
В него вошли все известные тогда (1789) неметаллы (О, N, H, S, Р, С), металлы (Ag, As, Bi, Co, Ca, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn), а также «радикалы» [муриевый (Cl), плавиковый (F) и борный (В) ] и «земли» — еще не разложенные известь СаО, магнезия MgO, барит ВаО, глинозем Аl2О2 и кремнезем SiO2 (Лавуазье полагал, что «земли» — вещества сложные, но пока это не было доказано на опыте, считал их химическими элементами). Как дань времени он включил в список химических элементов невесомые «флюиды» — свет и теплород.
Едкие щелочи NaOH и KOH он считал веществами сложными, хотя разложить их электролизом удалось позже — только в 1807 году (Г. Дэви). Разработка Дж. Дальтоном атомной теории имела одним из следствий уточнение понятия элемента как вида атомов с одинаковой относительной массой (атомным весом).
Дальтоном атомной теории имела одним из следствий уточнение понятия элемента как вида атомов с одинаковой относительной массой (атомным весом).
Дальтон в 1803 составил первую таблицу атомных масс (отнесенных к массе атома водорода, принятой за единицу) пяти химических элементов (О, N, С, S, P). Тем самым Дальтон положил начало признанию атомной массы как главной характеристики элемента. Дальтон, следуя Лавуазье, считал химические Элементы веществами не разложимыми на более простые Артеменко А.И. Органическая химия.- М., 2007.
Последующее быстрое развитие химии привело, в частности, к открытию большого числа химических элементов. В списке Лавуазье было всего 25 химических элементов, включая «радикалы», но не считая «флюидов» и «земель». Ко времени открытия периодического закона Менделеева (1869) было известно уже 63 элемента. Открытие Д. И. Менделеева позволило предвидеть существование и свойства ряда неизвестных тогда химических Элементов и явилось основой для установления их взаимосвязи и классификации.
Открытие радиоактивности в конце 19 века поколебало более чем столетнее убеждение в том, что атомы нельзя разложить. В связи с этим почти до середины 20 века продолжалась дискуссия о том, что такое химические Элементы. Конец ей положила современное теория строения атома, которая позволила дать строго объективную дефиницию химических элементов, приведенную в начале статьи.
Распространенность в природе.
Распространенность химических элементов в космосе определяется нуклеогенезом внутри звезд. Образование ядер химических элементов связано с различными ядерными процессами в звездах.
Поэтому на разных этапах своей эволюции различные звезды и звездные системы имеют неодинаковый химические состав. Распространенность и распределение химических элементов во Вселенной, процессы сочетания и миграции атомов при образовании космического вещества, химические состав космических тел изучает космохимия. Основную массу космического вещества составляют H и He (99,9%). Наиболее разработанной частью космохимии является геохимия Ахметов Н.С. Общая и неорганическая химия.- М., 2003.
Наиболее разработанной частью космохимии является геохимия Ахметов Н.С. Общая и неорганическая химия.- М., 2003.
Из 111 химических элементов только 89 обнаружены в природе, остальные, а именно технеций (атомный номер Z = 43), прометий (Z = 61), астат (Z = 85), франций (Z = 87) и трансурановые элементы, получены искусственно посредством ядерных реакций (ничтожные количества Тс, Pm, Np, Fr образуются при спонтанном делении урана и присутствуют в урановых рудах). В доступной части Земли наиболее распространены 10 элементов с атомными номерами в интервале от 8 до 26.
Открытый урок в 8 классе
Открытый урок в 8 классе — «Посвящение в химики»
Конкурс учащихся 8-го класса
Проект данного урока, на мой взгляд, является актуальным, так как здесь можно увидеть динамику формирования предметных умений: ставить и решать проблемы, рассуждать по аналогии, работать над образом, делать выводы на основе сравнений и обобщений. Тема позволяет раскрыть внутренний мир ребенка, его нравственные суждения, отношения к тем или иным жизненным событиям. Проект направлен на коррекцию самооценки, на уверенность в себе, на определение выбора действий. Основная цель урока заключается в осмыслении изученного, обобщении, систематизации знаний и умении применять эти знания в жизненных ситуациях. Тип данного урока — исследовательский с элементами дискуссии, что позволяет использовать данный материал на уроке и во внеклассной работе.
Тема позволяет раскрыть внутренний мир ребенка, его нравственные суждения, отношения к тем или иным жизненным событиям. Проект направлен на коррекцию самооценки, на уверенность в себе, на определение выбора действий. Основная цель урока заключается в осмыслении изученного, обобщении, систематизации знаний и умении применять эти знания в жизненных ситуациях. Тип данного урока — исследовательский с элементами дискуссии, что позволяет использовать данный материал на уроке и во внеклассной работе.
Цель: развивать и повышать познавательный интерес учащихся к предмету химия; развивать навыки и умения в применении химических знаний, безопасного обращения с веществами; углубить представление учащихся о химическом элементе, веществе; повышать интеллектуальный уровень учащихся; воспитывать любознательность к предмету.
Задачи урока:
1. Создать условия для закрепления таких понятий как классификация веществ; названия, свойства и их применение (предметный результат).
2.Способствовать развитию интеллектуальных умений учащихся (сравнение, синтез, анализ, вывод), максимально включая их в процесс самореализации, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование познавательного интереса к изучению химии, формирование культуры монологической речи (химического языка), формирование управлять своей учебной деятельностью и адекватной самооценки (личностный результат).
Добрый день! Я рада приветствовать всех кто собрался в нашем гостеприимном кабинете.Прошло совсем немного времени с того момента, как вы ребята, переступили порог химического кабинета и начали изучать самый интересный, самый занимательный, для кого-то сложный, не очень безопасный, но все же самый полезный в жизни предмет – химию.
Химия – наука, полная удивительных загадок, явлений. Она всегда сопровождается красочными эффектами и «чудесами». И так было всегда.
Сегодня мы отправимся в химическое путешествиеи мы должны ответить на вопрос: «Достойны ли вы, стать гражданами великой химической страны?» Ведь лишь самым умным, смелым и настойчивым эта страна приоткрывает свои тайны.
Сегодня у нас не обычное мероприятие,а какое вы ребята попробуйте расшифровать его название сами после прочтения мною отрывка из басни.Но, вопреки их тяжким мукам, тот воз стоит и ныне там.Как ни впрягались – справ, слева, как ни вставали – в профиль, в фасНо все не впрок: то неработа– мука. Еще Крылов об этом написал.Силач Медведь и самый мелкий гад.Так и стояла бы повозка, и простояла бы века,Она решила дело споро, махнув на трудности крылом.Понять несложно эту басню, ее мораль весьма проста:Правильно, у нас сегодня «Посвящение в химики!
1. Конкурс (разминка) — «Викторина»
1. Какой элемент всегда рад? (радон).
2. Какой газ утверждает, что он не он? (неон).
3. Какой элемент является лесом? (бор).
4. Название какого элемента состоит из названий 2-х животных? (мышьяк).
5. Название какого металла несет в себе волшебника? (магний).
6. Какой металл жидкий при комнатной температуре? (ртуть).
7. Какой элемент утверждает, что он может воду родить? (водород).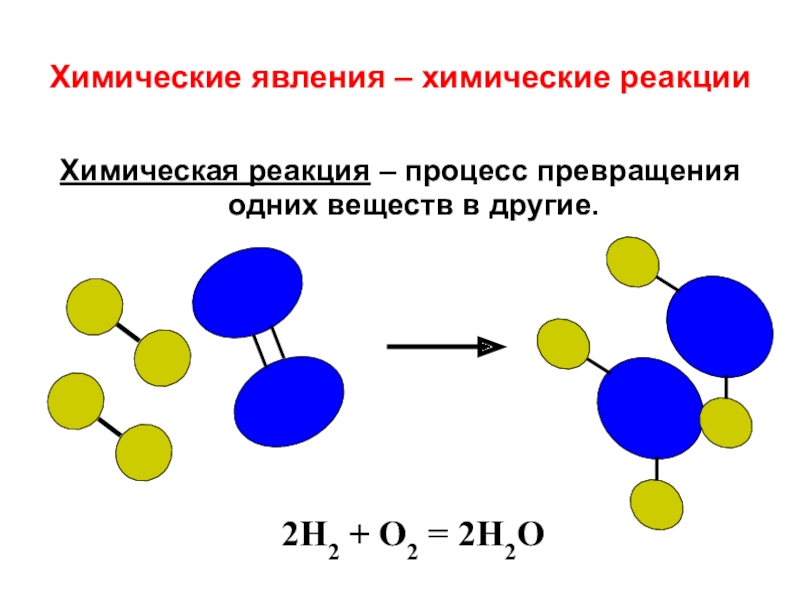
8. Какой элемент утверждает, что он может кислоту родить? (кислород).
9. Какой элемент является настоящим гигантом? (титан)
10. Какой элемент «вращается» вокруг Солнца? (уран)
2. Конкурс «Химические эрудиты» (крестики — нолики). выберите выигрышный вариант.
а) «металлы»
S Na N
Fe Mg Cl
Ca Zn O
б) «неметаллы»
O N Cu
K C P
Si Al H
в) «кислоты»
NaCl KOH h3SO4
HNO3 HCl h3CO3
h3S h4PO4 CuSO4
3. Конкурс для команд “Смотри в оба”.
На столе под салфеткой разложена химическая посуда. Вам необходимо, посмотрев несколько секунд, назвать химическую посуду.
1 команда — пробирка, держалка (держатель), химический стакан.
2 команда — пипетка, ложечка для сжигания веществ, мерный цилиндр.
3 команда — воронка, ершик, спиртовка.
4 команда-ячейка, выпарительная (или фарфоровая) чашка, стеклянная палочка.
4. Конкурс «О каком веществе идет речь?»
1 команда
Задание: Из букв сложить название вещества, записать его формулу, указать где находит применение это вещество.
Это сложное вещество в старину называли властителем жизни и смерти. Его приносили в жер¬тву богам, а иногда поклонялись ему как божеству.Оно служило мерилом богатства, могущества, стойкости, власти, считалось хранителем молодос¬ти и красоты.Оно и стада хранило, и урожай берегло, и рыбу в реке приманивало — нигде без него не об-ходились.По поверьям, оно обладает способностью по¬могать человеку во всех его делах, спасать от бед и напастей. Начиная день, проглоти его кристаллик — жди удачи. Вошел в дом незнакомый человек — не¬заметно брось щепотку его в огонь: спасет от «дур¬ного глаза». Собираясь в дальнюю дорогу, заверни его в тряпицу и повесь на грудь — принесет удачу.На пирах у киевского князя его ставили в зо¬лотой посуде лишь на стол, где сидели князь и его приближенные. А гости попроще с княжеского пира уходили «несолонохлебавши».
(поваренная соль).
2 команда
Задание: Из букв сложить название вещества, записать его формулу, рассказать где применяется это вещество. Раньше это вещество использовали в медицине и изготовлении красок.В древние времена это вещество было символом богатства. В X в. возле дворца мавританского короля Абдар Рахмана III постоянно работал фонтан с этим веществом, а правитель спал на матрасе, который плавал в бассейне с этим вещество.Долгое время ничего не было известно о том, что это вещество очень опасно для организма, оно легко испаряется, ее пары попадают в легкие, где полностью задерживаются и вызывает отравление всего организма.Сейчас его используют для измерения температуры. (ртуть).
Раньше это вещество использовали в медицине и изготовлении красок.В древние времена это вещество было символом богатства. В X в. возле дворца мавританского короля Абдар Рахмана III постоянно работал фонтан с этим веществом, а правитель спал на матрасе, который плавал в бассейне с этим вещество.Долгое время ничего не было известно о том, что это вещество очень опасно для организма, оно легко испаряется, ее пары попадают в легкие, где полностью задерживаются и вызывает отравление всего организма.Сейчас его используют для измерения температуры. (ртуть).
3 команда
Задание: Из букв сложить название вещества, записать его формулу, рассказать где применяется это вещество.Древние копты называли его «камнем неба». Изделия из него ценились дороже золота. Сре¬ди сокровищ египетских пирамид, где было много золота, ученые нашли несколько украшений из это¬го вещества. Только очень богатые люди могли иметь изготовленные из него кольца или броши. Древнегреческий географ и историк Страбон писал, что в глубине Африки живут племена, кото¬рые за слиток этого металла дают 10 слитков золота. В «Одиссее» Гомера рассказывается, что по¬бедителям в спортивных состязаниях вручали ку¬сок этого металла и кусок золота — самые большие в те времена драгоценности. Алхимики считали его настолько неблагород¬ным металлом, что им не стоило и заниматься. (железо).
В «Одиссее» Гомера рассказывается, что по¬бедителям в спортивных состязаниях вручали ку¬сок этого металла и кусок золота — самые большие в те времена драгоценности. Алхимики считали его настолько неблагород¬ным металлом, что им не стоило и заниматься. (железо).
4 команда
Задание: Из букв сложить название вещества, записать его формулу, рассказать где применяется это вещество.
Я дружу с человеком очень давно. Я красив, больше всего мне идёт жёлтый цвет. Меня легко повредить, так как характер у меня очень мягкий, но многие ругают меня, называют кровожадным. Никто не может обойтись без меня, когда совершает покупки, строит храмы, запускает искусственные спутники Земли. Мой небесный покровитель – Солнце. Меня называют царём металлов и металлом царей. (золото).
Физкультминутка по теме: «Воздух» в 8 классе
Очень химию мы любим!
Шеей влево, вправо крутим.
Воздух это атмосфера.
Если правда, топай смело!
В атмосфере есть азот,
Делай вправо поворот.
Воздух обладает массой —
Мы попрыгаем по классу.
Есть в нем углекислый газ,
Шагом марш на месте класс!
Чем выше вверх, тем воздух реже,
Друг другу улыбнулись нежно.
5. Конкурс экспериментальный (практический) «Жизнь моя в опасности без правил безопасности».
Задание для первой команды:Зажечь спиртовку, нагреть воду в пробирке, потушить спиртовку. Объяснить свои действия.
Задание для второй команды:Дана смесь соли с песком. Какая это смесь? Отделите песок от соли. Объясните свои действия.
Задание для третьей команды: Дана смесь железа и серы. Чем смесь отличается от сложного вещества? Объясните как и с помощью чего можно разделить эту смесь.
Задание для четвертой команды: Дан раствор соли. Выделите соль из раствора и объясните свои действия. Какие способы разделения смесей вы знаете?
6. Конкурс «Гонка за лидером»
(кто быстрее)
I. (10 вопросов для 1 и 2 команд).
(10 вопросов для 1 и 2 команд).
1.Наука, изучающая вещества и их превращения. (химия)
2. Великий русский химик. (М.В. Ломоносов)
3. Молярная масса измеряется…(г/моль)
4. Жидкий металл. (ртуть)
5. Сколько агрегатных состояний имеет вода? (три)
6. Вещество, в состав которого входит один элемент. (простое)
7. Вертикальный ряд сходных по свойствам элементов (группа)
8. Наименьшая неделимая частичка. (атом)
9. Количество вещества измеряется в… (молях)
10. Вода в газообразном состоянии. (пар)
II. (10 вопросов для 3 и 4 команд).
1.Жидкость жизни (вода)
2.Самый легкий элемент. (водород)
3. Используют во время тушения пожаров в пенных огнетушителях. (углекислый газ)
4. Горизонтальный ряд химических элементов. (период)
5. В цент ре атома находится …(ядро)
6. Кто составил периодическую таблицу? (Менделеев)
7. Число, которое пишется перед формулой. (коэффициент)
8. Бытовое название продукта разрушения железа под действием влажного воздуха. (ржавчина)
(ржавчина)
9. Газ, используемый для сварки и резки металлов. (кислород)
10. Какой элемент убивает микроорганизмы? (серебро)
Клятва химиков
Клянусь быть химиком приличным,
Учиться только на «отлично».
Буду послушным, не строптивым,
Ронять не буду реактивы.
В уме и памяти клянусь
Не пробовать их все на вкус!
Клянусь не буду я взрывать
Машину папину, кровать.
Клянусь не подливать кислоты
Всем в суп, в котлеты и компоты!
Клянусь оставить целой школу,
Не смешивать спирт с Кока-Колой!
Клянусь я химию любить!
Алхимиком хорошим быть
И формулы открою сам,
Что приведет нас к чудесам!!!
Рефлексия «По кругу»
1. Сегодня я узнал(а)…
2. Было интересно…
3. Было трудно…
4. Я выполнял(а) задания…
5. Я понял(а), что…
6. Теперь я могу…
7. Я почувствовал(а), что…
8. Я приобрел(а)…
9. Я научился(научилась)…
10. У меня получилось…
11. Я смог(смогла)…
12. Я попробую…
Я попробую…
13. Меня удивило…
14. Мне захотелось…
15. Я запомнил(а)…
16. Мне захотелось похвалить…
17. Урок дал мне для жизни…
Учитель: Вот и закончилось наше путешествие и я вижу, что вы вполне готовы для того, чтобы продолжить свое многолетнее путешествие по стране науки химии. Вам предстоит узнать много нового и интересного. Пока уважаемое жюри подводит итоги урока, позвольте мне вручить каждому из вас удостоверение о присвоении звания юного химика.
Технологическая карта урока
Учитель: Фадеева И.Г.
Предмет: Химия Класс: 8 Учебник (УМК): О.С. Габриелян «Химия, 8 класс».
Тема урока: «Посвящение в химики».
Дидактическая цель: развивать и повышать познавательный интерес учащихся к предмету химия; развивать навыки и умения в применении химических знаний, безопасного обращения с веществами; углубить представление учащихся о химическом элементе, веществе; повышать интеллектуальный уровень учащихся; воспитывать любознательность к предмету.
Задачи урока:
1. Создать условия для закрепления таких понятий как классификация веществ; названия, свойства и их применение (предметный результат).
2.Способствовать развитию интеллектуальных умений учащихся (сравнение, синтез, анализ, вывод), максимально включая их в процесс самореализации, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование познавательного интереса к изучению химии, формирование культуры монологической речи (химического языка), формирование управлять своей учебной деятельностью. (личностный результат).
Планируемые результаты:
Личностные: :развивать дисциплинированность, трудолюбие, упорство в достижении поставленных целей; уметь оказывать помощь своим сверстникам; формировать адекватное понимание успешности/ неуспешности учебной деятельности.
Метапредметные:
Коммуникативные: оформлять свою мысль в устной речи, сотрудничать, общаться со сверстниками, формулировать и высказывать собственное мнение, вести диалог, распределять функции и роли в процессе выполнения групповой работы.
Регулятивные: определять цели деятельности, планировать, контролировать и оценивать результаты собственной учебной деятельности и деятельности других, рационально строить самостоятельную работу и работу в группе.
Познавательные: анализировать, сравнивать, сопоставлять, обобщать и делать выводы; поиску необходимой информации.
Предметные:
Образовательные: повторить основные понятия темы, анализировать и систематизировать вещества по их строению.
Развивающие: развивать мышление, долговременную память , интерес к предмету.
Воспитательные: :воспитывать культуру химического эксперимента: соблюдение правил техники безопасности при работе, поведение в кабинете химии.
Тип урока: систематизации и обобщения знаний и умений (урок — игра).
Методы обучения: эвристический, информационный (интерактивный), практический.
Формы организации познавательной деятельности учащихся:фронтальная беседа, групповая, индивидуальная лабораторные опыты.
Используемая технология: технология обучения в сотрудничестве, ИКТ.
Структура урока:
Этапы урока Деятельность учителя Деятельность
учащихся УУД
1. Организационный момент. Определяет готовность учащихся к работе, сосредотачивает внимание учащихся на теме урока. Помогает сформировать группы. Самостоятельно готовятся к уроку. Подготавливают рабочее место для урока, формируют группы. Регулятивные (планирование)
2. Целеполагание. Определить тему урока, привлечь учащихся к постановке цели урока. Участвуют в целеполагании.
Регулятивные (целеполагание, планирование)
Коммуникативные (постановка вопросов)
Личностные («какое значение, смысл имеет для меня тема урока»
3. Мотивация. Мотивировать познавательную деятельность учащихся.
Сегодня мы отправимся в химическое путешествиеи мы должны ответить на вопрос: «Достойны ли вы, стать гражданами великой химической страны?» Анализируют вопрос, определяют, что они должны сделать в конце урока. Личностные (ценностно-смысловая ориентация).
Личностные (ценностно-смысловая ориентация).
Регулятивные (организация учащимися своей учебной деятельности)
4. Актуализация знаний и умений. Определение темы и целей урока.
Сегодня у нас не обычное мероприятие,а какое вы ребята попробуйте расшифровать его название сами после прочтения мною отрывка из басни.
Учитель: как помним, Лебедь, Рак и Щука тянули воз по сторонам,
Но, вопреки их тяжким мукам, тот воз стоит и ныне там.
И им помочь решить проблему не мог ни глобус, ни компас.
Как ни впрягались – справ, слева, как ни вставали – в профиль, в фас
И Рак свистел, волну гоняла Щука, и Лебедь злобно гоготал,
Но все не впрок: то не работа – мука. Еще Крылов об этом написал.
Им весь лесной народ советом помогал:
Силач Медведь и самый мелкий гад.
Но как ни суетились, воз застрял, не сдвинуть ни вперед и ни назад.
Так и стояла бы повозка, и простояла бы века,
Но в это время в нужном месте вдруг появляется Сова
Она решила дело споро, махнув на трудности крылом.
Впряглася в воз, и очень скоро уже легко катился он
Понять несложно эту басню, ее мораль весьма проста:
Чтоб сдвинуть что-то с мертвой точки, нужны дела, а не слова!
Учащиеся формулируют свои варианты темы урока, а учитель направляет их к правильному варианту.
Коммуникативные (постановка вопросов – инициативное сотрудничество в поиске и сборе информации)
Познавательные (осознанное и произвольное построение речевого высказывания в устной и письменной форме)
5. Осознание и осмысление учебного материала. Предлагает задания учащимся в соответствии с их уровнем обучаемости. Выполняют задание; анализируют вариант решения проблемы. Личностные (установление учащимися связи между целью учебной деятельности и ее мотивом).
6. Закрепление учебного материала. (Обмен информацией). Привлекает к обсуждению вопросов. Координирует результаты самостоятельной деятельности учащихся. Дают ответы. Заслушивают ответы партнёров по группам; дополняют, уточняют результаты. Личностные (нравственно-этическая ориентация — действие нравственно – этического оценивания усваиваемого содержания)
7. Обобщение и рефлексия. Предлагает алгоритм рефлексии, высказывает собственное суждение о достижении цели учебного занятия. Самооценка результатов деятельности. Личностные (этическое оценивание усваиваемого содержания).
Обобщение и рефлексия. Предлагает алгоритм рефлексии, высказывает собственное суждение о достижении цели учебного занятия. Самооценка результатов деятельности. Личностные (этическое оценивание усваиваемого содержания).
химия может уйти из старших классов — Российская газета
Может ли виртуальная реальность заменить реальные колбы и пробирки? Как изменится ЕГЭ по химии? Почему этот предмет рискует исчезнуть из старшей школы? Самые острые проблемы обсуждались на Всероссийском съезде учителей и преподавателей химии в МГУ имени М.В. Ломоносова.
Нынешний год официально назван в честь Периодической таблицы химических элементов: открытые уроки, лекции, яркие эксперименты… Школьников и студентов ждет масса «активностей». А специалисты тем временем бьют тревогу: уровень базовой химической грамотности у старшеклассников ухудшается из года в год. Сухие цифры: 40 процентов десятиклассников не смогли набрать больше 10 баллов во время исследования качества образования, которое проводил Рособрнадзор. Максимально возможный балл — 52 — не набрал вообще никто из 25 тысяч участников. А 80 процентов не смогли «перешагнуть» даже половинный рубеж. По сути, у большинства ребят была или «двойка», или вообще «кол».
Максимально возможный балл — 52 — не набрал вообще никто из 25 тысяч участников. А 80 процентов не смогли «перешагнуть» даже половинный рубеж. По сути, у большинства ребят была или «двойка», или вообще «кол».
— Я была экспертом и проверила около восьми тысяч ответов, — рассказывает доцент Нижегородского института развития образования Лидия Асанова. — К сожалению, официальные результаты полностью совпали с моими впечатлениями. Картина нерадостная. Школьники ошибаются при нахождении молярной массы вещества, переводе массы из килограмма в граммы, сравнении отрицательных температур. У многих не сформированы навыки вычислений с использованием понятий «массовая доля элемента», «процент».
Причина? Сегодня в старших классах химию изучают на базовом уровне всего час в неделю, на углубленном — три часа. Ни того, ни другого, как признаются учителя, недостаточно. Но скоро и этого может не быть. По новым образовательным стандартам (ФГОС) химия у 10-11 классов станет предметом по выбору.
— Старшие классы начнут учиться по новым образовательным стандартам в 2020 году. В них химия обозначена как один из предметов естественно-научного цикла. Можно будет изучать на выбор физику, химию, биологию или естествознание, — говорит учитель школы №1505 Галина Шипарева. — ФГОС старшей школы несколько московских школ уже апробировали. В итоге уже сегодня некоторые старшеклассники химию как предмет не изучают даже на базовом уровне. Если мы здесь ничего не сделаем, химия уйдет из школы, как ушла когда-то астрономия.
К чему это может привести? Как минимум, к проблемам в вузах. К примеру, школьник изучает профильную математику и физику, сдает по ним ЕГЭ, а химию «задвинул» подальше. В техническом вузе, куда он поступит, от курса химии ему все равно не уйти. Причем вузовская программа не делает скидку на то, кто какой ЕГЭ сдавал. Поступил? Покажи хорошую базовую подготовку. Не «тянешь»? Отчисляйся…Проблемы появляются и с другими предметами. Для медицинских вузов, например, все типичнее картина, когда сдававшие биологию и химию школьники сильно «проседают» по физике.
Что делать? Возможно, ситуацию удастся выправить. В 2019 году в министерстве просвещения должна быть утверждена концепция преподавания химии в школе. Кроме того, новые образовательные стандарты в этом году снова серьезно обновятся: в них будет предельно ясно прописано, что и в каком классе должен знать ученик.
Вслед за принятой концепцией преподавания химии, за образовательными стандартами будут меняться и учебные планы, и учебники, и экзамены. В следующем учебном году, например, государственная итоговая аттестация в девятых классах будет проходить по-новому, с реальными химическими опытами.
Старшеклассники смогут выбрать, например, биологию, при этом химию не изучать даже на базовом уровне
— Одно из заданий — подтверждение химических свойств вещества, находящегося в пробирке. Ученику предложат несколько реактивов, из которых он должен выбрать те, с которыми это вещество будет реагировать. Необходимо проанализировать состав веществ, спрогнозировать их свойства, составить алгоритм действий, провести опыты и описать наблюдения, — рассказал руководитель комиссии разработчиков КИМ для ГИА по химии Дмитрий Добротин. — Причем весь эксперимент с реактивами будет проходить строго под контролем специалиста — эксперта-наблюдателя, который и будет следить за соблюдением правил техники безопасности.
— Причем весь эксперимент с реактивами будет проходить строго под контролем специалиста — эксперта-наблюдателя, который и будет следить за соблюдением правил техники безопасности.
Правда, и тут могут быть проблемы: в России сегодня пять тысяч школ (в основном сельских), которые не имеют химических лабораторий. И это не говоря уже об устаревшем оборудовании, о проблемах с реактивами, их низким качеством или вовсе нехваткой… Частично проблему может решить виртуальная реальность. 3D-лаборатории сейчас активно входят в образовательный процесс. Но учителя подчеркивают: без реальной практики — никуда.
— Виртуальные лаборатории — это здорово. Их можно использовать на начальном этапе, чтобы поднять мотивацию учеников, — говорит преподаватель КИРО, учитель химии гимназии №1 города Курчатова Оксана Осетрова. — Но я практик. И считаю, что ребята, которые идут на экзамен по химии осознанно, должны уметь проводить эксперимент руками, знать все оборудование и технику безопасной работы. Вместе с тем я сторонник новых технологий. Например, мы постоянно проводим онлайн-уроки с аспирантами и студентами МГУ. Это увлеченные своим делом исследователи. Дети тянутся за ними, продолжают потом общаться в соцсетях, активно интересоваться предметом. В итоге 8-9 из 25 учеников сознательно идут на ЕГЭ по химии. Это очень хорошо. И если раньше они поступали в основном в медвузы, то теперь все чаще выбирают специальности, связанные с новыми видами производства, с нефтегазовым комплексом.
Например, мы постоянно проводим онлайн-уроки с аспирантами и студентами МГУ. Это увлеченные своим делом исследователи. Дети тянутся за ними, продолжают потом общаться в соцсетях, активно интересоваться предметом. В итоге 8-9 из 25 учеников сознательно идут на ЕГЭ по химии. Это очень хорошо. И если раньше они поступали в основном в медвузы, то теперь все чаще выбирают специальности, связанные с новыми видами производства, с нефтегазовым комплексом.
Главная проблема на школьном уровне, по мнению Оксаны Осетровой, — педагогические кадры. Средний возраст учителя — «50+». Молодые приходят, но им нужны хорошие наставники. И все это на фоне того, что требования к подготовке выпускников резко возросли. ЕГЭ по химии позволяет вузам выбирать самых сильных абитуриентов со всей страны — это действительно сложный экзамен. Однако далеко не каждый педагог в силах подготовить ребенка так, чтобы он выдержал высокую конкуренцию.
— Чаще всего у ребят «проседают» физическая и органическая химия. Вызывают трудность задачи, которые требуют пространственного воображения, — говорит замдекана химфака МГУ по дополнительному образованию Владимир Миняйлов. — Еще одна «проблемная» область — практика. Надо рассказывать, как применять знания в реальных жизненных ситуациях. Организовывать экскурсии на предприятия, в научные лаборатории и классические университеты. Если же натаскивать ученика только на решение типовых задач, в отрыве от того, как они работают на практике, дети просто не будут понимать, зачем им нужен этот предмет. Сегодня они задают этот вопрос постоянно.
Вызывают трудность задачи, которые требуют пространственного воображения, — говорит замдекана химфака МГУ по дополнительному образованию Владимир Миняйлов. — Еще одна «проблемная» область — практика. Надо рассказывать, как применять знания в реальных жизненных ситуациях. Организовывать экскурсии на предприятия, в научные лаборатории и классические университеты. Если же натаскивать ученика только на решение типовых задач, в отрыве от того, как они работают на практике, дети просто не будут понимать, зачем им нужен этот предмет. Сегодня они задают этот вопрос постоянно.
Онлайн урок: Предметы и задачи Химии по предмету Химия 8 класс
Химия – наука для любопытных! Мы с вами уже узнали о том, что химия изучает вещества и их превращения.
Теперь пришло время разобраться: что же такое вещество, какие вещества бывают, из чего они состоят, какими свойствами обладают, и как они могут изменяться под воздействием различных факторов. Все это вы узнаете в процессе изучения такого интересного предмета, как химия.
Итак, начнем.
Вещество – это то, из чего состоят тела, то есть совокупность одинаковых атомов и молекул.
Каждое вещество имеет свои определенные свойства, присущие только ему. Например, плотность, цвет, пластичность, запах, вкус и другие.
Тело имеет форму и объем. Это его основные характеристики.
Чтобы было понятнее, рассмотрим простой пример.
Пластилин – это вещество. Оно имеет свои, присущие только ему, свойства.
Если мы возьмем кусок пластилина и разделим его на две части, то мы получим тот же самый пластилин.
Его свойства при этом останутся неизменными. Он по-прежнему будет мягким, липким и пластичным.
А вот если мы придадим ему определенную форму, скажем, слепим пластилиновую ворону или собаку (кому что больше нравится), то мы получим физическое тело.
В окружающем мире много примеров тел и веществ, из которых они состоят.
Телефон – тело, а пластмасса, стекло и медь, из которых он сделан, – вещества.
Стол и древесина. Ваза и глина. А какие примеры тел и веществ можете привести вы?
Химия – это наука, которая изучает все разнообразие веществ в нашем мире, а также их превращения под воздействием тех или иных факторов.
Для чего же это нужно человеку? – спросите вы.
Давайте поговорим и об этом. Человек в процессе своего развития постоянного познает окружающий его мир, стремится сделать свою жизнь безопаснее и комфортнее.
Трудно представить, как бы развивался человек и мир вокруг него без знаний и открытий, которые делают замечательные ученые-химики.
Создание новых тканей, техники, лекарств и многих других необходимых нам вещей было бы невозможным без химической науки.
Таким образом, химия – это наука, без которой не может быть технического прогресса и дальнейшего развития человечества.
В тесной взаимосвязи с другими, не менее важными науками (физикой, математикой, биологией) химия ежедневно меняет наш мир к лучшему. Впереди еще множество новых вершин.
И как знать, может быть, кто-то из вас станет гениальным ученым-химиком и получит Нобелевскую премию за свое исследование или открытие.
Окружающая среда — Материалы Всемирного банка для учащихся «А знаешь ли ты… ?»
Окружающая среда
Что это значит?
Окружающая среда – это то, что находится вокруг вас, и то, как оно влияет на ваше развитие.
Говоря научным языком, окружающая среда – это комплекс окружающих человека или другой живой организм физических, географических, биологических, социальных, культурных и политических условий, который определяет форму и характер его существования.
Окружающая среда влияет на жизнь людей и развитие общества в целом. Вследствие этого люди, прогресс, развитие и окружающая среда тесно взаимосвязаны.
Окружающая среда может также нести в себе угрозу. Загрязненный воздух, инфекции, передающиеся с водой, токсичные химические вещества и природные катастрофы представляют собой только часть тех угроз для человечества, которые таит в себе окружающая среда.
Во многих странах загрязнение природных ресурсов, земли, воды и лесов> происходит с угрожающей скоростью, и если все это исчезнет, то исчезнет навсегда.
Если мы хотим, чтобы развитие было устойчивым, т.е. удовлетворяло сегодняшние потребности, не ставя под угрозу возможности будущих поколений, страны должны заботиться не только об экономическом прогрессе, но и о защите окружающей среды.
В борьбе с нищетой одним из важных аспектов является забота об окружающей среде во всем мире, так как самые неимущие живут в наиболее уязвимых регионах.
Почему это касается меня?
Подумайте об этом
Одна из проблем, связанных с окружающей средой
Чрезмерный рыбный промысел может на несколько лет увеличить доход рыбаков. Однако если рыбу не сберегать должным образом и если это приведет к уничтожению рыболовства, то гораздо большее число людей лишится источника дохода и основных продуктов питания.
Каждый год в мире:
- три миллиона человек преждевременно умирают из-за инфекций, передающихся с водой;
- только в одной Индии свыше 700 000 детей в возрасте до 5 лет умирают от диареи;
- два миллиона человек умирают от того, что они вдыхают дым от плит, расположенных внутри жилища. Около половины таких смертей приходится на Индию и Китай. В основном жертвами являются женщины и дети из семей сельских бедняков, не имеющих доступа к чистой воде, санитарии и современным видам топлива для хозяйственных нужд;
- один миллион человек, в основном в странах Африки к югу от Сахары, умирает от малярии;
- один миллион человек умирает от загрязненного городского воздуха.

- Согласно докладу Всемирной организации здравоохранения «Глобальное бремя болезней», в развивающихся странах причиной 20% смертей являются респираторные инфекции, диарея и малярия.
Более серьезные последствия загрязнения воздуха включают в себя:
- уничтожение рыбного промысла;
- повреждение посевов зерновых культур;
- рост производственных затрат у предприятий, которым приходится очищать воздух и воду, чтобы обеспечить должное качество продукции.
Природные катастрофы небывалой силы (торнадо, наводнения, ураганы) становятся все более частым явлением, затрагивающим жизнь как никогда ранее большого числа людей. Бедняки в наибольшей степени подвержены вредному воздействию окружающей среды.
По мере того, как люди перемещаются из сельских районов в большие города, острота экологических проблем будет возрастать. Зачастую стремительный рост городов за счет сельских жителей, которые меняют место жительства в поисках лучшей работы и условий жизни, приводит к ухудшению и без того ужасных условий жизни в трущобах.
Что делает международное сообщество?
Экологическая устойчивость является одной из важнейших глобальных проблем и одной из Целей в области развития, сформулированных в Декларации тысячелетия ООН.
Многие организации занимаются поиском способов сохранения природных ресурсов, с тем чтобы ими могли пользоваться не только мы, но и будущие поколения.
Международные организации, такие как Всемирный банк, сотрудничают с развивающимися странами, помогая им решать экологические проблемы и задачи, возникающие по мере развития этих стран.
Только факты
Судьба общины зависит от природных катастроф
Природная катастрофа в мгновение ока может изменить судьбу общины и уничтожить результаты многолетних усилий в области развития.
- В мае 2008 года в китайской провинции Сычуань произошло землетрясение, которое унесло жизни более чем 69 000 человек и оставило миллионы людей без крыши над головой.

- Цунами, произошедшее в декабре 2004 года в Индийском океане, опустошило прибрежные зоны стран, омываемых океаном, причинило огромный ущерб деревням и городам, в результате чего выжившие остались без крова.
Страны и общества могут по-разному расставлять приоритеты в отношении окружающей среды, но их решения в любом случае должны основываться на тщательном анализе и участии всех социальных групп, которые могут быть затронуты этими решениями.
Сохранение баланса и одновременное продвижение по пути обеспечения экономического, социального и экологического развития, является сложным делом, зачастую требующим сложных компромиссов. Эти компромиссы между поколениями, социальными группами и странами влияют на то, как разные люди воспринимают устойчивое развитие.
Забота о здоровой окружающей среде во всем мире — одно из основных направлений в деятельности Всемирного банка по борьбе с нищетой. В рамках этой деятельности особое значение имеет решение задачи по улучшению окружающей среды для того, чтобы миллионы людей могли жить в более здоровых условиях.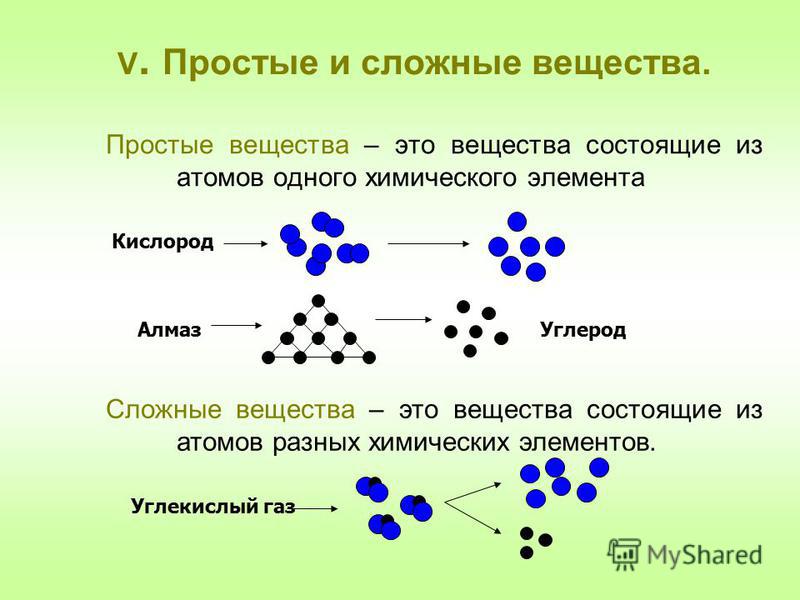
Всемирный банк предоставляет кредиты странам на реализацию проектов по защите окружающей среды. Кроме того, при выделении денег на проекты в целях развития Всемирный банк требует экологических гарантий.
Международные инициативы, касающиеся окружающей среды:
- Глобальный экологический фонд (ГЭФ) занимается вопросами сохранения биологического разнообразия, изменения климата, веществами, разрушающими озоновый слой, а также вопросами, касающимися международных вод.
- Целевой фонд Многостороннего фонда для осуществления Монреальского протокола работает над решением проблемы обращения вспять процесса разрушения озонового слоя Земли.
- В рамках Углеродного финансирования, являющегося частью международных усилий по борьбе с изменением климата, ведется работа по созданию мирового углеродного рынка в целях сокращения выбросов парниковых газов.
- Фонд партнерского сотрудничества по охране важнейших экосистем сотрудничает с развивающимися странами для сохранения биологического разнообразия в наиболее уязвимых районах.

- Союз Всемирного банка и Всемирного фонда дикой природы для сохранения и устойчивого использования лесных ресурсов нацелен на создание и защиту районов, находящихся в наибольшей опасности, а также сертификацию продуктивных лесов в качестве устойчивых.
Что могу сделать я?
Станьте активистом ради своей планеты! Для начала изучите вопрос о том, действительно ли «хорошие товары» являются таковыми, посетив сайт, где вы найдете результаты исследований вещей, которыми мы пользуемся каждый день.
Дополнительные ресурсы
Дополнительная информация на веб-сайте Всемирного банка
Химия для начальной школы — видео и уроки
Цель этой главы — обеспечить, чтобы учащиеся начальной и средней школы полностью усвоили основы химии. В видеороликах главы, предназначенных для просмотра в Интернете, используется разговорный язык, чтобы научить молодых учащихся значению и истории химии, а также изучить ее многочисленные разделы. Подробно объясняются различные химические процессы, а рабочие листы предназначены для содействия обучению учащихся.
Подробно объясняются различные химические процессы, а рабочие листы предназначены для содействия обучению учащихся.
Увлекательные видео- и текстовые уроки короткие, обычно менее десяти минут. Индивидуальная поддержка предоставляется учащимся, которые представляют свои вопросы по химии в интерактивном режиме. Теги видео можно использовать для перехода от одного предмета к другому, а письменные стенограммы иногда включают термины, выделенные жирным шрифтом, которые ученики начальной и средней школы могут изучать дальше.
| Урок | Цель |
|---|---|
| Что такое химия? — Урок для детей | В этом уроке дается определение химии, а также несколько ее разделов, включая науку о растениях, физику, биологию и медицину. |
| Урок периодической таблицы для детей: структура и использование | Объясняется назначение периодической таблицы. |
| Твердые вещества, жидкости и газы Урок для детей | Учащиеся могут изучить различия между твердыми телами, газами и жидкостями. |
| Уроки газов для детей | Учащиеся могут узнать о свойствах газов и законах, которые к ним относятся. |
| Урок по изменению состояния материи для детей | Этот урок содержит информацию об изменяющихся физических и химических состояниях материи. |
| Урок химических реакций для детей: определение и примеры | Учащиеся начальной и средней школы могут узнать, как происходят химические реакции. |
| Урок химических изменений для детей: определение и примеры | Объясняются различия между химическими и физическими изменениями материи. |
| Урок физического изменения для детей | Учащиеся изучат процесс физического изменения. |
| Урок тепловой энергии для детей: определение и примеры | На этом уроке изучается тепло и энергия, которую оно производит. |
| Урок плотности для детей: определение и факты | В этом уроке определяется плотность. |
| Урок плотности жидкостей для детей | Учащиеся узнают, как можно рассчитать плотность жидкости. |
| Урок диффузии для детей | В этом уроке описывается, что происходит в процессе диффузии. |
| Урок осмоса для детей | В ходе этого урока рассматриваются понятия, связанные с осмосом. |
| Урок горения для детей | На этом уроке химии обсуждается процесс горения. |
| Урок электролиза для детей | Учащиеся могут узнать об электролизе и связанных с ним процессах. |
| Урок природного газа для детей | На этом уроке дается определение природного газа и описываются его различные способы использования. |
| Что такое парниковые газы? — Урок для детей | На этом образовательном уроке даны определения парниковых газов и рассмотрено их воздействие. |
| Что такое радиация? — Урок для детей: определение и примеры | Этот урок химии рассказывает учащимся о радиации и ее воздействии. |
Советы по изучению химии | Кафедра химии
Итак, вы тратите много времени на учебу и все еще испытываете трудности на экзаменах. Что теперь? Прежде всего, знайте, что вы не одиноки — у некоторых из лучших учеников в какой-то момент были проблемы с химией, так что продолжайте в том же духе!
Изучение химии требует времени!
ВРЕМЯ НА ЗАДАЧУ!
Точно так же, как вам нужно уделять время занятиям спортом или изучению иностранного языка, вам нужно уделять время изучению химии .Мы не ожидаем, что вы получите все сразу; на самом деле, некоторые из лучших студентов этих курсов должны были бороться с материалом, прежде чем действительно все поняли. Убедитесь, что вы выделяете достаточно времени для повторения материала курса и регулярно практикуетесь в решении проблем.
Есть причина, по которой эти курсы не предназначены для чтения по назначению: все части — практические задачи, чтение, лекция, раздел, лабораторные работы, рабочее время, самостоятельное обучение или с друзьями, репетиторство — работают лучше всего, когда вы используете их вместе.
Углубитесь в практические задачи.
Простое выполнение большого количества практических задач не обязательно поможет вам лучше решать проблемы. Вы никогда не увидите экзаменационную задачу, которая выглядит точно так же, как практическая задача, поэтому выполнение всех возможных задач — не лучшая стратегия. Вместо этого, когда вы будете решать практическую задачу, которую мы вам дали, убедитесь, что вы можете объяснить, почему и когда вы будете делать каждый шаг в своем решении. Уметь объяснять
- почему определенная информация полезна для вас
- почему часть информации может быть ненужной
- какие преобразования нужно сделать, чтобы можно было правильно использовать информацию
- почему вы используете конкретную формулу
- как изменить формулу, чтобы найти новый параметр
- почему нужно учитывать ту или иную реакцию
- когда вы сможете сделать какие-либо предположения, которые вы делаете
- какие структуры полезно понять
Легко попасть в ловушку, читая ключ решения и думая, что это имеет смысл. Но если вы не сможете обосновать каждый шаг чем-то большим, чем просто утверждением «просто потому что», вам будет сложно применить эти навыки к другой проблеме.
Но если вы не сможете обосновать каждый шаг чем-то большим, чем просто утверждением «просто потому что», вам будет сложно применить эти навыки к другой проблеме.
Читай и решай задачи ПЕРЕД лекцией.
Если вы уже ознакомились с материалом в своем собственном темпе перед лекцией, то вы можете более продуктивно использовать время лекции для закрепления и отработки этих понятий. Чем больше раз вы слушаете и практикуете материал (например, наборы задач, лекцию, раздел, учебное время…), тем легче он будет становиться.
Лабораторные секции действительно имеют значение.
Разделы составлены таким образом, чтобы выделить и направить вас по особенно важным понятиям и химическим явлениям. Перед следующим экзаменом убедитесь, что вы можете применить основные понятия каждого раздела. Хороший способ проверить, применяете ли вы концепции, а не запоминаете их, — проверить, можете ли вы объяснить ПОЧЕМУ каждый шаг, который вы делаете в задаче. Также не забудьте решить все дополнительные практические задачи, предлагаемые в разделе и в лабораторных записях.
Задавайте много-много вопросов!
Ученые постоянно задают вопросы! Особенно ПОЧЕМУ! Преподаватели всегда ценят, когда студенты задают вопросы, потому что это показывает, что они слушают и действительно обдумывают материал.
- Спросите: «Что это на самом деле означает?» в каждом разделе, пока вы читаете главу.
- Спросите «почему» проблемы, когда вы решаете, о чем она спрашивает и как ее решить.
Задавайте вопросы по лекции и раздельным материалам.Если вы просматриваете материал самостоятельно , запишите эти вопросы . Если вы можете ответить на них самостоятельно, отлично! Если вы застряли, то возьмите их с собой в рабочее время или в учебную группу. Тогда вы не забудете и убедитесь, что получите более полное представление обо всем.
Изучай химию, когда не спишь!
Мы все склонны откладывать сложные дела, но это означает, что вы можете закончить изучение химии в самом конце дня, когда вы уже измотаны и слишком устали, чтобы хорошо думать. И, если вы никогда не будете практиковать, то это никогда не станет легче!
И, если вы никогда не будете практиковать, то это никогда не станет легче!
Вместо этого попробуйте каждый день выделять время, когда вы знаете, что будете бдительны и готовы к работе. Это не обязательно должен быть огромный блок времени, но таким образом вы, по крайней мере, получите некоторое время, чтобы сблизиться со своей химией.
Учитесь эффективнее, а не просто больше!
- Одним из первых шагов в разработке эффективной стратегии обучения является оценка того, что из всего, что вы делаете для учебы, помогает вам больше всего? Что придало вам наибольшей уверенности? Если есть вещи, с которыми вы уже знакомы, возможно, потратьте меньше времени на их рассмотрение и больше времени на концепции, которые все еще сложны.
- Потратьте некоторое время, чтобы оценить, где у вас возникли трудности на экзаменах. Когда вы вернетесь на экзамен, повторите все задачи, которые вы пропустили (ДО просмотра решений). Вы получаете дальше, чем вы сделали во время экзамена? Вы действительно можете закончить их с большим количеством времени или в менее стрессовой обстановке? Вы застреваете на концепциях или определениях? по математике? при запуске проблемы?
- Подведение итогов экзамена помогает выявить концептуальные пробелы, которые необходимо изучить заново, по сравнению с ошибками, которые могли возникнуть в результате тестовой нагрузки или неправильного прочтения вопроса.

- Если вы сможете начать определять, где и как у вас возникают трудности с экзаменом, вы можете подумать о том, как лучше использовать свое учебное время при подготовке к следующему экзамену.
Воспользуйтесь советами по обучению от VPTL:
- https://vptl.stanford.edu/students/academic-skills содержит полезные краткие советы по сдаче экзаменов, ведению заметок, стратегиям обучения и т. д., которые могут помочь вам подумать о том, как вы хотите более эффективно организовать свое учебное время. .
- Например, когда вы читаете конспекты глав или лекций, постоянно задавайте себе вопросы и отвечайте на них по мере чтения.На этом веб-сайте есть несколько хороших стратегий для этого (см. «Эффективность чтения» в формате pdf или система ведения заметок Корнелла), которые могут помочь вам глубже погрузиться в чтение и увидеть взаимосвязь между новыми понятиями. Это также может помочь вам структурировать чтение или конспекты лекций более полезным способом.
 https://vptl.stanford.edu/students/academic-skills/study-tips-resources
https://vptl.stanford.edu/students/academic-skills/study-tips-resources - Вы также можете организовать персональный академический коучинг с Адиной Гликман , чтобы обдумать для вас более конкретные стратегии обучения.adinag@stanford.edu
Используйте рабочее время!
Рабочие часы предназначены не только для решения задач — вопросы по всему курсу – лекции, лабораторные работы, чтение книг, учебные советы и т. д. – все это честная игра, поэтому, пожалуйста, не стесняйтесь, приходите. Часы работы доступны, чтобы помочь вам!
- Держите список вопросов, когда вы читаете или решаете проблемы. Если вы не можете обосновать определенный шаг в решении, это отличный вопрос для рабочих часов. Студенты часто получают больше в нерабочее время, если приходят подготовленными с вопросами о том, чего они не понимают.
Используйте учебную группу!
Многие исследования показывают, что учащиеся, которые регулярно участвуют в учебных группах, в конечном итоге получают более высокие оценки.
- При обучении с одноклассниками воспользуйтесь этой возможностью, чтобы объяснить и обсудить концепции или стратегии решения проблем с другими.
- Когда вы вместе просматриваете наборы задач, вместо того, чтобы просто понять, как подходить к этой конкретной проблеме, посмотрите, сможете ли вы придумать несколько разных способов, которыми мы могли бы задать другие вопросы об этой системе.Есть ли другой параметр, который мы могли бы попросить вас решить? Как изменится задача в других условиях? Это поможет вам обдумывать и практиковать различные стратегии решения проблем.
- У вас нет учебной группы? Общайтесь со студентами в рабочее время, в секциях, на площади, в репетиторстве и т. д.!
Органическая химия трехмерна!
Вы обнаружите, что почти все учебные навыки, развитые в общей химии, точно так же применимы и в органике: вам все еще нужно тратить время на маринование понятий, вам нужно глубоко копаться в проблемах, и вы должны быть в постоянном напряжении. бдительность, чтобы спросить «почему».Однако в органической химии необходимо учитывать новый визуальный компонент: важно начать рассматривать молекулы в трех измерениях (а не в виде двухмерных линий и букв на бумаге), поскольку трехмерная структура сильно влияет на реальную химию. Чтобы начать визуализировать эти структуры , используйте комплект моделей для построения молекул каждый раз, когда вы занимаетесь органической химией (чтение, практические задачи и т. д.). Принесите комплект модели в раздел. Ваши модели покажут важные свойства молекул, такие как пространственные отношения между различными атомами или то, насколько легко может вращаться связь. Всегда держите набор моделей при себе и пользуйтесь им!
бдительность, чтобы спросить «почему».Однако в органической химии необходимо учитывать новый визуальный компонент: важно начать рассматривать молекулы в трех измерениях (а не в виде двухмерных линий и букв на бумаге), поскольку трехмерная структура сильно влияет на реальную химию. Чтобы начать визуализировать эти структуры , используйте комплект моделей для построения молекул каждый раз, когда вы занимаетесь органической химией (чтение, практические задачи и т. д.). Принесите комплект модели в раздел. Ваши модели покажут важные свойства молекул, такие как пространственные отношения между различными атомами или то, насколько легко может вращаться связь. Всегда держите набор моделей при себе и пользуйтесь им!
Прежде всего, продолжайте пытаться!! Все учатся с разной скоростью и разными способами. Здесь есть много ресурсов для вас, потому что мы знаем, что вы можете сделать это с помощью правильных инструментов. Если вы не знаете, с чего начать, просто спросите — встретьтесь с одним из ассистентов, преподавателей или преподавателей курса. Мы все здесь, чтобы помочь ВАМ УСПЕТЬ!
Мы все здесь, чтобы помочь ВАМ УСПЕТЬ!
4.5: Введение в химическую номенклатуру
Цели обучения
Разные инструкторы предъявляют самые разные требования к химической номенклатуре.Вероятно, чаще всего ожидаются следующие:
.- Вы должны знать названия и символы как минимум первых двадцати элементов, а также всех групп галогенов и инертных газов (группы 17-18).
- Назовите любую бинарную молекулу, используя стандартные префиксы от 1 до 10.
- Все часто встречающиеся ионы.
- Соли и другие соединения ионного происхождения, включая перечисленные здесь кислоты. В некоторых курсах вам не нужно будет знать -ous/-ic названия солей меди, железа и т.д., но в других вы будете.
- Узнайте у преподавателя, какие органические соединения вы должны уметь называть.
Химическая номенклатура — слишком большая тема, чтобы рассматривать ее всесторонне, и было бы бесполезно пытаться сделать это в начальном курсе; большинство студентов, изучающих химию, усваивают химические названия и правила, регулирующие их использование. Но вряд ли мы можем говорить о химии, не упомянув некоторых химических веществ, у всех из которых есть названия, а часто и более одного! Все, что мы попытаемся сделать здесь, это рассказать о том, что вам нужно знать, чтобы понять химию первокурсников.Для тех из вас, кто планирует продолжить изучение химии, самое интересное будет позже!
Но вряд ли мы можем говорить о химии, не упомянув некоторых химических веществ, у всех из которых есть названия, а часто и более одного! Все, что мы попытаемся сделать здесь, это рассказать о том, что вам нужно знать, чтобы понять химию первокурсников.Для тех из вас, кто планирует продолжить изучение химии, самое интересное будет позже!
Существует более 100 миллионов названий химических веществ. Кто придумывает названия всем этим химическим веществам? Есть ли опасность исчерпать новые имена? Ответ на последний вопрос — «нет» по той простой причине, что подавляющее большинство названий не «придумано»; существуют сложные правила присвоения названий химическим веществам на основе их строения. Они называются систематических названий ; они могут быть немного громоздкими, но они однозначно идентифицируют данное вещество.Правила для этих имен определяются международным органом. Но чтобы упростить индексацию и идентификацию, каждое известное химическое вещество имеет свой собственный числовой «персональный идентификатор», известный как регистрационный номер CAS. Например, кофеин однозначно идентифицируется регистрационным номером 58-08-2. Ежедневно выдается около 15 000 новых номеров.
Например, кофеин однозначно идентифицируется регистрационным номером 58-08-2. Ежедневно выдается около 15 000 новых номеров.
Общие имена и систематические имена
Многие химические вещества настолько прочно вошли в нашу жизнь, что мы знаем их по знакомым названиям, как и других наших друзей.У данного вещества может быть несколько общих или тривиальных названий ; обычный тростниковый сахар, например, более официально известен как «сахароза», но если вы попросите его за обеденным столом под этим именем, это, скорее всего, станет поводом для разговора, и я даже не рискну предсказать результат, если вы попытаетесь использовать его. его систематическое название в том же контексте:
«пожалуйста, передайте α-D-глюкопиранозил-(1,2)-β-D-фруктофуранозид!»
Но слово «сахароза» было бы вполне уместно, если бы вам нужно было отличить именно этот сахар от сотен других названных сахаров.Единственное место, где вы встретите систематическое название, подобное довольно громоздкому, упомянутому здесь, — это когда вы ссылаетесь (в печати или в компьютерной базе данных) на сахар, у которого нет общепринятого названия.
Химические вещества были частью ткани цивилизации и культуры на протяжении тысячелетий, и современная химия сохраняет большую часть этого древнего багажа в виде терминов, скрытые культурные и исторические связи которых добавляют красок и интереса к предмету. Многие распространенные химические названия дошли до нас только после удивительно долгих путешествий во времени и пространстве, что иллюстрируют следующие два примера.
Аммиак
Название аммиак (\(NH_3\)) у большинства людей ассоциируется с газом, имеющим резкий запах; систематическое название «тригидрид азота» (которое редко используется) подскажет вам его формулу. Чего он не скажет вам, так это того, что дым от сжигания верблюжьего помета (основного топлива в Северной Африке) конденсируется на холодных поверхностях, образуя кристаллический осадок. Древние римляне впервые заметили это на стенах и потолке храма, который египтяне построили богу Солнца Амону в Фивах, и они назвали этот материал аммиаком, что означает «соль Амона». В 1774 году Джозеф Пристли (первооткрыватель кислорода) обнаружил, что при нагревании нашатырного спирта образуется газ с резким запахом, который восемь лет спустя Т. Бергман назвал «аммиаком».
В 1774 году Джозеф Пристли (первооткрыватель кислорода) обнаружил, что при нагревании нашатырного спирта образуется газ с резким запахом, который восемь лет спустя Т. Бергман назвал «аммиаком».
Алкоголь
Алкоголь вошел в английский язык в 17 веке со значением «сублимированного» вещества, затем стал «чистым духом» чего-либо и стал ассоциироваться с «духом вина» только в 1753 году. Наконец, в 1852 году он стал часть химической номенклатуры, обозначающая общий класс органических соединений.Но по-прежнему принято называть конкретное вещество CH 3 CH 2 OH «алкоголем», а не его систематическое название этанол .
Арабская алхимия дала нам ряд химических терминов; например, считается, что слово «алкоголь» происходит от арабского слова «al-ghawl», первоначальным значением которого был металлический порошок, используемый для затемнения женских век (kohl).
Общей практикой среди химиков является использование более распространенных химических названий всякий раз, когда это целесообразно, особенно в устной или неофициальной письменной коммуникации. Для многих самых простых соединений (включая большинство тех, с которыми вы столкнетесь на курсе первого года обучения) систематические и общеупотребительные названия совпадают, но там, где есть разница и если это позволяет контекст, обычно используется общее название предпочтительно.
Для многих самых простых соединений (включая большинство тех, с которыми вы столкнетесь на курсе первого года обучения) систематические и общеупотребительные названия совпадают, но там, где есть разница и если это позволяет контекст, обычно используется общее название предпочтительно.
Многие из «общих» имен, на которые мы ссылаемся в этом уроке, известны и используются в основном научным сообществом. Химические вещества, используемые в быту, искусстве или промышленности, получили традиционные или «народные» названия, которые широко используются до сих пор.Многие, как упомянутый выше нашатырный спирт, могут рассказать увлекательные истории.
В 4 О 7 ·10х3О| популярное имя | химическое название | формула |
|---|---|---|
| бура | тетраборат натрия декагидрат | |
| каломель | ртуть(I) хлорид | Hg 2 Cl 2 |
| магнезиальное молоко | гидроксид магния | Мг(ОН) 2 |
| соляная кислота | соляная кислота | HCl (водный) |
| масло купоросное | серная кислота | H 2 SO 4 |
| селитра | нитрат натрия | NaNO 3 |
| гашеная известь | гидроксид кальция | Са(ОН) 2 |
Минералы : Минералы представляют собой твердые материалы, встречающиеся в земле, которые классифицируются и называются в соответствии с их составом (который часто варьируется в непрерывном диапазоне) и расположением атомов в их кристаллических решетках. Всего насчитывается около 4000 названий полезных ископаемых. Многие названы в честь мест, людей или свойств и чаще всего заканчиваются на -ite.
Всего насчитывается около 4000 названий полезных ископаемых. Многие названы в честь мест, людей или свойств и чаще всего заканчиваются на -ite.
Запатентованные названия: Химия является основной отраслью промышленности, поэтому неудивительно, что многие вещества продаются под торговыми марками. Это особенно распространено в фармацевтической промышленности, которая использует компьютеры для штамповки имен, которые, как они надеются, будут отличать новый продукт от продуктов его конкурентов. Пожалуй, самым известным из них является аспирин, название которого было придумано немецкой компанией Bayer в 1899 году.Это торговое наименование было конфисковано правительством США после Первой мировой войны и больше не является охраняемой торговой маркой в этой стране.
Названия и символы Элементов
Наименование химических веществ начинается с названий элементов . Первооткрыватель элемента традиционно имел право дать ему имя, и в этих именах можно найти интересную человеческую и культурную историю, многие из которых относятся к свойствам элемента или географическому положению. Только некоторые из недавно открытых (и искусственно созданных) элементов названы в честь людей. Некоторые элементы на самом деле не были «открыты», но известны с древних времен; многие из них имеют символы, полученные от латинских названий элементов. Есть девять элементов, латинские символы которых вы должны знать (таблица \(\PageIndex{2}\)).
Только некоторые из недавно открытых (и искусственно созданных) элементов названы в честь людей. Некоторые элементы на самом деле не были «открыты», но известны с древних времен; многие из них имеют символы, полученные от латинских названий элементов. Есть девять элементов, латинские символы которых вы должны знать (таблица \(\PageIndex{2}\)).
имя элемента | символ | Латинское название |
|---|---|---|
| сурьма | Сб | сурьма |
| медь | Медь | медь |
| золото | Золото | золотой |
| железо | Фе | железо |
| свинец | Пб | свинец |
| ртуть | рт. ст. ст. | гортензия |
| калий | К | калий |
| натрий | На | натрий |
| банка | Сн | станнум |
Во многих из этих имен много истории и традиций.Например, латинское название ртути Hydrargyrum означает «водяное серебро» или ртуть. Название «шарлатан» применительно к некомпетентному врачу является искажением фламандского слова, обозначающего ртуть, и происходит от использования соединений ртути в медицине 17 века. Название «Меркурий» имеет алхимическое происхождение и, конечно, происходит от имени греческого бога, в честь которого названа планета; загадочные свойства этого элемента, в то же время металлического, жидкого и испаряющегося, предполагают того же посланника с крылатыми ногами, который кружит по небесам близко к солнцу.
Именование бинарных молекул
Система, используемая для обозначения химических веществ, зависит от природы молекулярных единиц, составляющих соединение. Обычно это ионы или молекулы; к каждому применяются разные правила. В этом разделе мы обсудим простейшие бинарные (двухатомные) молекулы.
Часто бывает необходимо различать соединения, в которых одни и те же элементы присутствуют в разных пропорциях; угарный газ CO и углекислый газ CO 2 знакомы всем.Химики, возможно, надеясь, что это узаконит их как ученых, используют греческие (а иногда и латинские) префиксы для обозначения чисел в именах; вы будете часто сталкиваться с ними, и вы должны их знать:
| 1/2 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| геми | моно | по | три | тетра | пента | шестигранник | гепта | окта | нона | дека |
Время от времени вы будете встречать такие названия, как di водород и di хлор, которые используются для того, чтобы отличить общие формы этих элементов (H 2 , Cl 2 ) от атомов, которые имеют то же имя, когда он требуется для ясности.
Примеры:
- N 2 O 4 — тетроксид диазота [обратите внимание на отсутствие a перед гласной]
- N 2 O — закись азота [чаще закись азота ]
- SF 6 — гексафторид серы
- P 4 S 3 — трисульфид тетрафосфора [чаще полуторный сульфид фосфора ]
- Na 2 HPO 4 — гидрофосфат динатрия
- H 2 S — сероводород [мы пропускаем di и mono ]
- CO — монооксид углерода [ моно — чтобы отличить его от диоксида]
- CaSO 4 ·½H 2 O — гемигидрат сульфата кальция [В этом твердом веществе две единицы CaSO 4 делят между собой одну гидратную воду; чаще называемый гипсом]
Из этих примеров видно, что химики имеют привычку позволять себе некоторые вольности в применении строгих числовых префиксов к более широко известным веществам.
Эти двухэлементные соединения обычно довольно легко назвать, потому что большинство из них следуют систематическому правилу добавления суффикса -ide к корневому названию второго элемента, который обычно является более «отрицательным». Несколько таких примеров показаны выше. Но, как отмечалось выше, есть несколько важных исключений, в которых общие или тривиальные имена имеют приоритет над систематическими именами:
- H 2 O ( вода , не диоксид водорода)/
- H 2 O 2 ( перекись водорода , не двуокись водорода)
- H 2 S ( сероводород , не сероводород)
- NH 3 ( аммиак , не тригидрид азота)
- NO ( оксид азота , не монооксид азота)
- N 2 O ( закись азота , не закись азота)
- CH 4 ( метан , не тетрагидрид углерода)
Именование ионов
Ион — это электрически заряженный атом или молекула, то есть такая, в которой число электронов отличается от числа ядерных протонов. Многие простые соединения можно рассматривать, по крайней мере формально, как состоящие из пары ионов, имеющих противоположные знаки заряда. Положительные ионы, также известные как катионы , в основном относятся к металлическим элементам, которые просто берут название самого элемента.
Многие простые соединения можно рассматривать, по крайней мере формально, как состоящие из пары ионов, имеющих противоположные знаки заряда. Положительные ионы, также известные как катионы , в основном относятся к металлическим элементам, которые просто берут название самого элемента.
кальций | натрий | магний | кадмий | калий |
|---|---|---|---|---|
Ca 2 + | На + | Мг 2 + | Cd 2 + | К + |
Единственные важные неметаллические катионы, о которых вам нужно знать, это
водород | гидроксоний | аммоний |
|---|---|---|
Н + | Н 3 О + | НХ 4 + |
(Позже, когда вы будете изучать кислоты и основания, вы узнаете, что первые два представляют собой один и тот же химический вид. )
)
Некоторые ионы металлов являются многовалентными , что означает, что они могут иметь более одного электрического заряда. Для них существуют систематические названия, в которых используются римские цифры, и гораздо более старые и менее громоздкие общие названия, в которых в основном используются латинские названия элементов с окончаниями — ous и — ic для обозначения более низких и более высоких зарядов. соответственно (Таблица \(\PageIndex{4}\)). (В случаях, когда возможно более двух значений заряда, используются систематические названия.{4+}\)
Таблица \(\PageIndex{4}\): Металлические именамедь(I)
медь(II)
железо(II)
железо(III)
ртуть(I)
ртуть(II)
олово(II)
олово(IV)
медь
медь
черные
железо
ртутный
ртутный
олово
олово
* Ион ртути представляет собой уникальный двойной катион , который иногда неправильно представляется как Hg + .
Неметаллические элементы обычно образуют отрицательных ионов ( анионов ). Все названия одноатомных анионов заканчиваются суффиксом -ide :
.Класс – | С 2– | О 2– | С 4– | I – | Н – |
|---|---|---|---|---|---|
хлорид | сульфид | оксид | карбид | йодид | гидрид |
Существует ряд важных многоатомных анионов, которые для обозначения можно разделить на несколько категорий. Некоторые следуют образцу одноатомных анионов:
Некоторые следуют образцу одноатомных анионов:
ОХ – | CN – | О 2 – |
|---|---|---|
гидроксид | цианид | пероксид |
Оксианионы
Наиболее распространенные кислородсодержащие анионы ( оксианионы ) имеют имена, оканчивающиеся на -ate , но если существует вариант, содержащий небольшое количество атомов кислорода, он принимает суффикс -ite .
СО 3 2– | № 3 – | № 2 – | СО 4 2– | СО 3 2– | Заказ на поставку 4 3– |
|---|---|---|---|---|---|
карбонат | нитрат | нитрит | сульфат | сульфит | фосфат |
Вышеуказанные ионы (за исключением нитрата) также могут соединяться с H+ с образованием «кислотных» форм с меньшим отрицательным зарядом. По довольно неясным историческим причинам некоторые из них имеют общие имена, начинающиеся с — bi , которые, хотя официально не рекомендуются, все еще широко используются:
По довольно неясным историческим причинам некоторые из них имеют общие имена, начинающиеся с — bi , которые, хотя официально не рекомендуются, все еще широко используются:
ион | систематическое название | общее название |
|---|---|---|
ОХС 3 – | гидрокарбонат | бикарбонат |
ХСО 4 – | гидросульфат | бисульфат |
ХСО 3 – | гидросульфит | бисульфит |
Хлор и, в меньшей степени, бром и йод образуют более обширный ряд оксианионов, который требует несколько более сложного обозначения:
ClO – | ClO 2 – | ClO 3 – | ClO 4 – |
|---|---|---|---|
гипохлорит | хлорит | хлорат | перхлорат |
Соединения ионного происхождения
Эти соединения формально образуются из положительных ионов ( катионов ) и отрицательных ионов ( анионов ) в соотношении, которое дает электрически нейтральную единицу. Соли, из которых обычная «соль» (хлорид натрия) является наиболее распространенным примером, все являются твердыми веществами при обычных условиях. Небольшое количество из них (например, NaCl) действительно сохраняет составляющие ионы и правильно называется «ионными твердыми веществами». Однако во многих случаях ионы теряют свой электрически заряженный характер и образуют преимущественно неионогенные твердые вещества, такие как CuCl 2 . Термин «твердые вещества ионного происхождения» охватывает оба этих класса соединений.
Соли, из которых обычная «соль» (хлорид натрия) является наиболее распространенным примером, все являются твердыми веществами при обычных условиях. Небольшое количество из них (например, NaCl) действительно сохраняет составляющие ионы и правильно называется «ионными твердыми веществами». Однако во многих случаях ионы теряют свой электрически заряженный характер и образуют преимущественно неионогенные твердые вещества, такие как CuCl 2 . Термин «твердые вещества ионного происхождения» охватывает оба этих класса соединений.
Большинство катионов и анионов, описанных выше, могут соединяться с образованием твердых соединений, обычно известных как соли .Одно из основных требований состоит в том, что полученное соединение должно быть электрически нейтральным: таким образом, ионы Ca 2+ и Br – объединяются только в соотношении 1:2 с образованием бромида кальция CaBr 2 . Поскольку никакая другая простейшая формула невозможна, нет необходимости называть ее «дибромидом кальция».
Поскольку некоторые металлические элементы образуют катионы, имеющие разные положительные заряды, названия ионных соединений, производных от этих элементов, должны содержать некоторое указание на заряд катиона.В старом методе используются суффиксы -ous и -ic для обозначения более низких и более высоких сборов соответственно. В случаях с железом и медью используются латинские названия элементов: железный , медный .
Эта система до сих пор широко используется, хотя она была официально вытеснена более точной, хотя и несколько громоздкой системой Stock, в которой заряд катиона (фактически, степень окисления) указывается с помощью римских цифр, следующих за символом катиона.В обеих системах название аниона оканчивается на — иде .
формула | систематическое название | общее название |
|---|---|---|
| CuCl | хлорид меди(I) | хлорид меди |
| CuCl 2 | хлорид меди(II) | хлорид меди |
| Hg 2 Cl | ртуть(I) хлорид | хлорид ртути |
| HgO | оксид ртути(II) | оксид ртути |
| ФС | сульфид железа(II) | сульфид железа |
| Fe 2 S 3 | сульфид железа(III) | сульфид железа |
Кислоты
Большинство кислот можно рассматривать как комбинацию иона водорода H + с анионом; название аниона отражено в названии кислоты. Обратите внимание, что в случае оксикислот анионные суффиксы -ate и -ite становятся -ic и -ous соответственно в названии кислоты.
Обратите внимание, что в случае оксикислот анионные суффиксы -ate и -ite становятся -ic и -ous соответственно в названии кислоты.
анион | название аниона | кислота | название кислоты |
|---|---|---|---|
| Класс – | ион хлорида | HCl | соляная кислота |
| CO 3 2– | карбонат-ион | Н 2 СО 3 | угольная кислота |
| № 2 – | нитрит-ион | HNO 2 | азотистая кислота |
| № 3 – | нитрат-ион | HNO 3 | азотная кислота |
| СО 3 2– | сульфит-ион | Н 2 SO 3 | сернистая кислота |
| СО 4 2– | сульфат-ион | Н 2 SO 4 | серная кислота |
| CH 3 COO – | ацетат-ион | СН 3 СООН | уксусная кислота |
Органические соединения
Поскольку органические (углеродные) соединения составляют подавляющее большинство всех известных химических веществ, органическая номенклатура сама по себе является огромной темой. Мы представляем здесь только самую основную ее часть, которую вам необходимо знать на первом курсе химии — гораздо больше ждет тех из вас, кому предстоит испытать удовольствие от курса органической химии позже. Простейшие органические соединения построены из прямых цепочек атомов углерода, которые называются приставками, обозначающими количество атомов углерода в цепи. Используя условное обозначение C n для обозначения прямой цепи из n атомов (даже не спрашивайте о разветвленных цепях!), префиксы для длин цепей от 1 до 10 приведены здесь:
Мы представляем здесь только самую основную ее часть, которую вам необходимо знать на первом курсе химии — гораздо больше ждет тех из вас, кому предстоит испытать удовольствие от курса органической химии позже. Простейшие органические соединения построены из прямых цепочек атомов углерода, которые называются приставками, обозначающими количество атомов углерода в цепи. Используя условное обозначение C n для обозначения прямой цепи из n атомов (даже не спрашивайте о разветвленных цепях!), префиксы для длин цепей от 1 до 10 приведены здесь:
| С 1 | С 2 | С 3 | С 4 | С 5 | С 6 | С 7 | С 8 | С 9 | С 10 |
|---|---|---|---|---|---|---|---|---|---|
| мет- | эт- | опора- | а- | задержано- | шестнадцатеричный | гепт- | окт- | не | дек- |
Как видите, в цепочках, начиная с C 5 и далее, используются греческие числовые префиксы, так что здесь не так много нового для изучения. Простейшими из этих соединений являются углеводороды, имеющие общую формулу C n H 2 n +2 . Обычно они известны как алканы , и все их названия сочетают в себе соответствующий числовой префикс с окончанием -ан :
Простейшими из этих соединений являются углеводороды, имеющие общую формулу C n H 2 n +2 . Обычно они известны как алканы , и все их названия сочетают в себе соответствующий числовой префикс с окончанием -ан :
СН 4 | С 2 Н 6 | С 3 Н 8 | С 8 Н 18 |
|---|---|---|---|
С | С–С | С–С–С | С–С–С–С–С–С–С–С |
метан | этан | пропан | октановое число |
Все атомы углерода должны иметь четыре присоединенные к ним связи; обратите внимание на общепринятое соглашение не показывать явно атомы водорода.
Функциональные группы
и более высоких цепей заместитель может находиться более чем в одном месте, что приводит к образованию множества изомеров .формула | общее название | систематическое название |
|---|---|---|
CH 3 OH | спирт метиловый | метанол |
СН 3 СН 2 ОН | спирт этиловый | этанол |
С 8 Н 15 ОХ | Спирт октиловый | октанол |
формула | общее название | систематическое название |
|---|---|---|
НСООН | муравьиная кислота | метановая кислота |
СН 3 СООН | уксусная кислота | этановая кислота |
С 4 Н 9 СООН | масляная кислота | бутановая кислота |
класс | пример | имя |
|---|---|---|
амин | метиламин | CH 3 NH 2 |
кетон | ацетон (диметилкетон) | СН 3 -СО-СН 3 |
эфир | диэтиловый эфир | C 2 H 5 -O-C 2 H 5 |
Авторы и авторство
Натуральные и синтетические химикаты — это серая материя
Нас, потребителей, засыпают рекламой натуральных и органических продуктов. Существует множество веб-сайтов и новостных статей, посвященных распространению следующего сообщения: «рукотворное — это плохо, а естественное — это хорошо». Растущая популярность этого убеждения показывает, что этот вопрос остро нуждается в разъяснении.
Существует множество веб-сайтов и новостных статей, посвященных распространению следующего сообщения: «рукотворное — это плохо, а естественное — это хорошо». Растущая популярность этого убеждения показывает, что этот вопрос остро нуждается в разъяснении.
Идея о том, что природа может навредить нам, не нова. Вы когда-нибудь слышали о малярии, ВИЧ, туберкулезе, ботулизме или столбняке? Почему же тогда так много людей убеждены, что все натуральное полезнее для нас, чем синтетические продукты? Это правда, что современная химия принесла нам ряд токсичных химических веществ, таких как ДДТ и диоксины, но вы действительно думаете, что природные химические вещества менее вредны для вас? На самом деле, самые токсичные для человека химические вещества абсолютно естественны! Мало того, есть много свидетельств того, что натуральные пестициды, разрешенные в органическом земледелии, так же токсичны, как и синтетические пестициды.Было бы замечательно, если бы это была просто тема черного против белого.
К сожалению, споры о натуральных и синтетических веществах остаются в тени, и каждое химическое вещество или класс химикатов необходимо рассматривать в индивидуальном порядке. Ситуация усугубляется тем, что количество полезных и доступных для потребителей ресурсов ограничено, так как большая часть «информации» в Интернете и в новостях является необоснованной и без ссылок. Неудивительно, что эта идея так хорошо прижилась! Цель этого поста — кратко обсудить наиболее распространенные заблуждения о натуральных и синтетических химикатах:
1.Синтетические химические вещества более токсичны, чем натуральные химические вещества.
2. Органически выращенные продукты полезнее, потому что они полностью натуральные.
3. Синтетические копии натуральных химикатов не так хороши для вас.
Я хочу быстро отметить, что я забыл указать на противоречия между натуральными и синтетическими заменителями. Настоящие постеры по этой теме — подсластители, и об этом рассказывает мой коллега в нашем блоге.
Прежде чем мы перейдем к мельчайшим деталям, нам нужны некоторые определения, поскольку существует огромное расхождение между тем, что означают термины «натуральный» и «синтетический».Эта диаграмма Венна помогает объяснить мои определения природных, природных и синтетических химических веществ:
Натуральные и синтетические Диаграмма Венна
Натуральные и синтетические Диаграмма Венна: Природные химические вещества производятся природой без какого-либо вмешательства человека. Синтетические химические вещества производятся людьми с использованием методов, отличных от тех, которые используются в природе, и эти химические структуры могут встречаться или отсутствовать в природе. Это определение означает, что синтетический химикат может быть изготовлен из натурального продукта (т.е. природного происхождения). Обратите внимание, что в пищевой промышленности вместо «синтетического» используется «искусственный».
Заблуждение 1: Синтетические химикаты более токсичны, чем натуральные химикаты.
Двумя наиболее токсичными для человека химическими веществами, которые нам известны, являются ботулинический токсин и тетаноспазмин. Ботулизм вызывается ботулиническим токсином, представляющим собой белок и нейротоксин, вырабатываемый спорами бактерий. Тетаноспазмин — нейротоксин, вырабатываемый бактериями, вызывающими столбняк. Я создал гистограмму, чтобы помочь нам визуализировать относительную токсичность наиболее токсичных природных и синтетических химических веществ для человека:
Относительная токсичность наиболее токсичных природных и синтетических химических веществ
Этот график показывает, что наиболее токсичным природным химическим веществом является ботулотоксин. более чем в миллион раз более токсичен, чем все синтетические химические вещества, кроме диоксина.Прошу прощения, потому что шкала визуально не точно отображает относительное количество диоксина, которое составляет 0,00001 по этой шкале, но все же показывает, что даже диоксин существенно менее токсичен (примерно в сто тысяч раз меньше)! Данные, ресурсы и дополнительную информацию о химических веществах, показанных на гистограмме, можно найти на моем веб-сайте.
Этот тезис хорошо подытожили исследователи из Калифорнии, изучавшие природные и синтетические химические вещества в рационе человека в 2001 г. и написавшие: «Среди агентов, определенных Международным агентством по изучению рака как канцерогены для человека, 62% встречаются в природе: 16 природные химические вещества, 11 представляют собой смеси природных химических веществ и 10 представляют собой инфекционные агенты.Таким образом, идея о том, что химикат «безопасен», потому что он натуральный, неверна».
Заблуждение 2: Органически выращенные продукты лучше для вас, потому что они полностью натуральные
Что вы думаете об органическом земледелии? Как вы думаете, нам полезнее есть? Интересно, сколько людей, выступающих за органическое производство, знают о том, что влечет за собой органическое земледелие, и что оно по-прежнему связано с токсичными химическими веществами? Прежде чем идти дальше, я должен упомянуть, что количество токсичных химических веществ, синтетических или натуральных, в нашей продукции ничтожно мало по сравнению с другими вредными химическими и биологическими видами, которым мы подвергаемся. Тем не менее, я вижу и слышу, как люди постоянно говорят и пишут об употреблении в пищу органических продуктов, потому что в них меньше токсичных химических веществ, поэтому я чувствую себя обязанным включить это. Это правда, что существует и было множество ужасающих синтетических химикатов, используемых в сельскохозяйственной промышленности, особенно пестицидов. Эти токсичные химические вещества очень важны с экологической точки зрения (выщелачивание в почву и воду, воздействие на жизнь животных в прилегающих районах и т. д.), но это совсем другая тема для обсуждения.
Тем не менее, я вижу и слышу, как люди постоянно говорят и пишут об употреблении в пищу органических продуктов, потому что в них меньше токсичных химических веществ, поэтому я чувствую себя обязанным включить это. Это правда, что существует и было множество ужасающих синтетических химикатов, используемых в сельскохозяйственной промышленности, особенно пестицидов. Эти токсичные химические вещества очень важны с экологической точки зрения (выщелачивание в почву и воду, воздействие на жизнь животных в прилегающих районах и т. д.), но это совсем другая тема для обсуждения.
В органическом сельском хозяйстве все еще могут использоваться пестициды природного происхождения — на самом деле, они могут использовать даже некоторые синтетические пестициды! Если вы мне не верите, не стесняйтесь ознакомиться со списком «Материалы для органического растениеводства» Министерства сельского хозяйства США. Научные исследования показали, что как органические, так и обычные продукты питания имеют одинаковую питательную ценность, и оба содержат остатки синтетических пестицидов (хотя в органических продуктах их меньше, чем в обычных продуктах). Гораздо меньше известно о токсичности природных пестицидов и пестицидов природного происхождения, но некоторые исследования показывают, что они могут быть столь же вредными и канцерогенными.В обзоре оценки риска природных и синтетических пестицидов есть большое резюме, чтобы завершить этот пункт:
Гораздо меньше известно о токсичности природных пестицидов и пестицидов природного происхождения, но некоторые исследования показывают, что они могут быть столь же вредными и канцерогенными.В обзоре оценки риска природных и синтетических пестицидов есть большое резюме, чтобы завершить этот пункт:
«1. Биологическая активность химического вещества является функцией его структуры, а не его происхождения.
2. Биологические свойства, особенно безопасность, химического вещества зависят от его структуры и способа использования химического вещества (т. е. воздействия).
3. Воспринимаемые риски не всегда соответствуют реальным рискам».
Дополнительные материалы по органическим и традиционным продуктам питания: Обзорная статья об органически выращенных продуктах питания, Изучение канцерогенности природных и синтетических пестицидов.
Заблуждение 3: Синтетические копии натуральных химикатов не так хороши для вас.
Химическая структура синтезированного соединения точно такая же, как у природного соединения, которое оно должно дополнять, например, аскорбиновой кислоты, которая является основной формой витамина С. Оно будет иметь такой же вкус, такой же запах и будет функционировать так же в вашем теле. Это верно для большинства случаев, однако иногда встречаются дополнительные и непреднамеренные продукты. Например, природный витамин Е называется d-α-токоферол, а синтетический витамин Е называется dl-α-токоферол.Разница между ними заключается в том, что «dl» относится к смеси как d-, так и l-α-токоферола. Нет никаких доказательств того, что версия «l» вообще вредна для человеческого организма, но она примерно в 1,4 раза менее эффективна, чем натуральный витамин Е (научная статья). Поскольку это обсуждаемая тема, понятно, что потребители могут захотеть придерживаться натуральных источников витамина Е, но это не означает, что синтетический витамин Е токсичен.
Оно будет иметь такой же вкус, такой же запах и будет функционировать так же в вашем теле. Это верно для большинства случаев, однако иногда встречаются дополнительные и непреднамеренные продукты. Например, природный витамин Е называется d-α-токоферол, а синтетический витамин Е называется dl-α-токоферол.Разница между ними заключается в том, что «dl» относится к смеси как d-, так и l-α-токоферола. Нет никаких доказательств того, что версия «l» вообще вредна для человеческого организма, но она примерно в 1,4 раза менее эффективна, чем натуральный витамин Е (научная статья). Поскольку это обсуждаемая тема, понятно, что потребители могут захотеть придерживаться натуральных источников витамина Е, но это не означает, что синтетический витамин Е токсичен.
Неактивные ингредиенты могут различаться между натуральными и синтетическими продуктами, такими как добавки, наполнители, побочные продукты и дополнительные химические вещества, извлеченные естественным путем (они могут быть активными, но не являются целевым соединением) в продуктах природного происхождения./169260900-56a132c15f9b58b7d0bcf728.jpg) Их важно учитывать в любом продукте, независимо от того, получен он естественным путем или синтетическим. Например, некоторые синтетические пищевые красители были запрещены из-за предполагаемой канцерогенности.
Их важно учитывать в любом продукте, независимо от того, получен он естественным путем или синтетическим. Например, некоторые синтетические пищевые красители были запрещены из-за предполагаемой канцерогенности.
Экстракты мелатонина и белокопытника являются интересными примерами натуральных продуктов, к которым потребители должны относиться с осторожностью. Мелатонин — популярное натуральное «снотворное», а мелатонин природного происхождения поступает из шишковидных желез животных, которые могут содержать вирусный материал. Синтетический мелатонин имеет точно такое же молекулярное строение, и его гораздо безопаснее принимать.
Белокопытник — это растения, содержащие противовоспалительное соединение под названием петазин, которое является естественным средством для лечения и профилактики мигрени. К сожалению, растения белокопытника также содержат пирролизидиновые алкалоиды (ПА), которые могут вызвать серьезное повреждение печени, поэтому важно, чтобы экстракт белокопытника очищался от ПА.
Чтобы узнать больше о синтетических и природных химикатах и узнать больше об их синтезе, вам следует обратиться к главе 4 «Отличаются ли НЧ от синтетических химикатов?» в книге Ричарда Фирна «Химические вещества природы: натуральные продукты, сформировавшие наш мир».
Убедил ли я вас, что натуральные и синтетические химические вещества — это серое вещество?
Мы все должны признать, что дебаты о природных и синтетических химических веществах — это не проблема черного и белого, а на самом деле это сложное и массивное серое вещество. Как природные, так и синтетические химические вещества необходимо рассматривать в каждом конкретном случае для нашего личного здоровья, будь то лекарство, пищевая добавка или пестициды, используемые для наших культур.
Фото: Апельсины на диаграмме Венна, Эван-Амос, Wikimedia Commons; Fruit in Venn Diagram Марисы ДеМеглио (Flickr) через Wikimedia Commons; Виноделие в диаграмме Венна от Crosslers (Flickr) через Wikimedia Commons.
Чему вы научитесь по химии?
В химии есть пять фундаментальных дисциплин:
- Аналитическая химия
- Биохимия
- Неорганическая химия
- Органическая химия
- Физическая химия
Многие студенты понятия не имеют, что есть в этих курсах, даже после прочтения курса описания, поэтому на этой странице мы пытаемся дать дополнительную информацию о содержание и методы различных занятий по химии.
Департамент также предлагает курсы медицинской химии и химии окружающей среды.
Аналитическая химия
На курсах аналитической химии вы научитесь отвечать на вопросы
- Что это?
- Сколько его там?
Современные химики-аналитики используют приборы, такие как
- УФ/видимый спектрометр
- АА-спектрометр
- ВЭЖХ
- ГХ/МС
- Флуориметр
- Потенциостат
, чтобы узнать информацию о образцах.На лекции по аналитической химии вы
узнаете о теории каждого инструмента, о том, как он работает, и о данных, которые
вы можете получить от него. В лаборатории у вас будет возможность проанализировать образцы
на каждом приборе и выполнить независимый проект, в котором вы анализируете образец
по своему выбору с использованием наиболее подходящего инструмента.
В лаборатории у вас будет возможность проанализировать образцы
на каждом приборе и выполнить независимый проект, в котором вы анализируете образец
по своему выбору с использованием наиболее подходящего инструмента.
Биохимия
На курсах биохимии вы будете изучать структуру, свойства и реакционную способность молекул в живых организмах.Четыре важных класса биомолекул:
- Белки
- Нуклеиновые кислоты
- Углеводы
- Липиды
Темы, затронутые в лекции, включают:
- Белковая структура
- Механизмы катализируемых ферментами реакций
- Метаболизм (как пища расщепляется на основные строительные блоки и как тело собирается молекулы, которые ему нужны из этих строительных блоков)
- Репликация ДНК, транскрипция и трансляция
- Взаимодействие белок-ДНК
Методы, которые вы изучите в лаборатории, включают:
- Очистка белка
- Определение концентрации белка
- Определение активности ферментов
- Использование флуориметра и ВЭЖХ для анализа нуклеиновых кислот
Неорганическая химия
На занятиях по неорганической химии в колледже Гуше основное внимание уделяется структуре, связыванию
и реакционная способность комплексов переходных металлов, включая оба координационных комплекса
металлоорганические комплексы). Полное понимание структуры и связи требует
обширное изучение теории молекулярных орбиталей, включая использование теории групп
для получения молекулярных орбиталей. В последней части курса рассматриваются приложения
Металлоорганические комплексы как катализаторы органических реакций.
Полное понимание структуры и связи требует
обширное изучение теории молекулярных орбиталей, включая использование теории групп
для получения молекулярных орбиталей. В последней части курса рассматриваются приложения
Металлоорганические комплексы как катализаторы органических реакций.
В рамках лабораторного курса вы подготовите и охарактеризуете три важных переходных металла. комплексы: ферроцен, катализатор асимметричного эпоксидирования Якобсена и катализатор Граббса. катализатор метатезиса олефинов.Проведение этих синтезов познакомит вас с разнообразными передовых методов, включая использование линий Шленка для обработки чувствительных к воздуху соединения. Вы также изучите кинетику реакции замещения лиганда.
Органическая химия
Органическая химия изучает соединения, содержащие углерод. Приложения
органической химии многочисленны:
Приложения
органической химии многочисленны:
- Важные классы биомолекул (см. выше)
- Наркотики
- Пластик
- Нефтепродукты
В первом семестре курса органической химии вы изучите все основы в том числе:
- Органические функциональные группы
- Как называть органические соединения
- Трехмерная структура органических молекул, включая хиральность и стереоизомерию
- Понятие о механизме органической реакции
- Важные органические реакции, включая кислотно-щелочные реакции, реакции замещения, элиминирования и реакции карбонила.
 добавление
добавление - Определение органической структуры с помощью ЯМР, ИК и масс-спектрометрии
- Многостадийный органический синтез
Второй семестр продолжает изучение реакций присоединения карбонила и многостадийных реакций. синтез.Дополнительные темы включают реакции алкенов, ароматических соединений и аминов, свободнорадикальные реакции и химия углеводов.
Физическая химия
В физической химии вы будете использовать исчисление как инструмент для получения многих важных
уравнения, которые вы выучили в общей химии из первых принципов. Физическая химия
курсы можно проходить в любом порядке.Осенний семестр посвящен увлекательному
мир квантовой механики и как ее можно использовать для описания структуры молекул. Вы также познакомитесь с различными типами спектроскопии (ИК, Рамановская, УФ/видимая,
флуоресценция, ЯМР) можно использовать для получения подробной информации о структуре
молекул. В весеннем семестре вы выведете законы термодинамики и
кинетика, связывающая поведение макроскопических величин материи с
свойства отдельных молекул.
Вы также познакомитесь с различными типами спектроскопии (ИК, Рамановская, УФ/видимая,
флуоресценция, ЯМР) можно использовать для получения подробной информации о структуре
молекул. В весеннем семестре вы выведете законы термодинамики и
кинетика, связывающая поведение макроскопических величин материи с
свойства отдельных молекул.
Кафедра химии и химической биологии
Кафедра химии и химической биологии, расположенная в кампусе Буша Университета Рутгерса в Пискатауэе, стремится обеспечить исключительное образование посредством обучения в классе и лабораторной подготовки ученых-исследователей. Мы стремимся продвигать область химии и области, связанные с ней, и решать постоянно меняющиеся проблемы и возможности, стоящие перед нашим государством и нашим миром в таких областях, как здоровье, энергетика и окружающая среда.
Мы признаем и приветствуем разнообразие нашего сообщества, полагаясь на него, чтобы направлять и информировать о нашей приверженности образованию и обслуживанию. Являясь национальным лидером в области химических исследований и образования, мы предоставляем нашим аспирантам и студентам бакалавриата возможности мирового уровня в рамках широких междисциплинарных академических и исследовательских программ, готовя их к тому, чтобы стать лидерами в промышленности, научных кругах и правительстве.
Являясь национальным лидером в области химических исследований и образования, мы предоставляем нашим аспирантам и студентам бакалавриата возможности мирового уровня в рамках широких междисциплинарных академических и исследовательских программ, готовя их к тому, чтобы стать лидерами в промышленности, научных кругах и правительстве.
Благодаря современному исследовательскому оборудованию и всемирно признанному профессорско-преподавательскому составу у нас есть инструменты и люди, необходимые для разработки и изучения новаторских идей во многих областях, связанных с химией.
Химия является краеугольным камнем экономики Нью-Джерси, на ее долю приходится более четверти годового экспорта штата. Это дает нашим студентам и исследователям уникальную возможность взаимодействовать со многими крупными и малыми химическими компаниями по всему штату.
В сентябре 2018 года мы открыли новое фирменное здание с гибкими лабораториями; современное оборудование; а также современное обучение, конференции и другие помещения, способствующие сотрудничеству, это здание способствовало развитию нашего образования и исследований. Он будет продолжать развивать наши широкие междисциплинарные академические и исследовательские программы, способствуя дальнейшему укреплению экономики и общества нашего региона.
Он будет продолжать развивать наши широкие междисциплинарные академические и исследовательские программы, способствуя дальнейшему укреплению экономики и общества нашего региона.
ТЕКУЩИЙ СТАТУС РАБОТЫ: Все лица в кампусе должны носить лицевые покрытия, будь то на открытом воздухе, когда социальное дистанцирование нецелесообразно, или в закрытых закрытых помещениях (например, в местах общего пользования, ванных комнатах).
Смеси и растворы | CPD
Каким образом знание химических смесей предотвратило крупный инцидент в лондонском метро?
Когда случайная утечка влажного быстросохнущего бетона затопила диспетчерскую станции лондонского метрополитена Виктория, сообразительность и химические знания инженеров предотвратили полную катастрофу.Они подмешали в бетон большое количество сахара, что замедлило процесс схватывания и дало им время на устранение разлива. (Читать полностью: rsc. li/EiC-бетон)
li/EiC-бетон)
Смеси и растворы – обычное явление в нашей повседневной жизни. Это воздух, которым мы дышим, еда и напитки, которые мы потребляем, и ткани, которые мы носим. Изучая, как химики отличают чистые вещества от смесей и растворов, студенты начнут понимать, как материя организована на атомном уровне.Обладая этими знаниями, мы можем манипулировать материей, чтобы улучшить свое здоровье и качество жизни.
Что нужно знать учащимся о смесях и растворах?
- Смеси – это материалы, которые содержат два или более химических вещества, диспергированных между собой (смешанных вместе).
- Если при смешивании двух материалов не происходит химической реакции, они образуют смесь. Химические свойства компонентов не меняются.
- Смеси можно разделить физическими методами.
- Существует два основных типа смесей: гомогенные и гетерогенные.
- Гомогенные смеси: частицы веществ смешаны друг с другом (частицы не слипаются) – например, воздух.

- Растворы представляют собой гомогенные смеси: частицы одного вещества (растворенного вещества) смешиваются с частицами другого вещества (растворителя) – например, соленой воды.
- Гетерогенные смеси: большие скопления (комки) веществ смешиваются друг с другом – например, эмульсии типа масла в воде.
Когда учащиеся изучают, как правильно использовать технический язык, количество новых слов, которые нужно выучить, и требуемая точность их использования могут пугать их. Слово «вещь» является полезной отправной точкой: хотя это и не общепринятый научный термин, оно имеет осязаемое значение для большинства студентов, а значит, является полезным лингвистическим плацдармом.
Учащиеся понимают, что мир состоит из вещества, а разные вещества обладают разными свойствами. Наша задача — помочь им выйти за пределы своего представления о мире, основанного на их чувствах, в субмикроскопический мир, в котором различные химические вещества устроены по-разному. Пакет «Материалы и субстанции» программы Gatsby Science Enhancement Program предлагает множество простых действий и анимаций.
Пакет «Материалы и субстанции» программы Gatsby Science Enhancement Program предлагает множество простых действий и анимаций.
Учащиеся понимают, что мир состоит из вещества, а разные вещества обладают разными свойствами. Наша задача — помочь им выйти за пределы своего представления о мире, основанного на их чувствах, в субмикроскопический мир, в котором различные химические вещества устроены по-разному. Пакет «Материалы и вещества» Программы развития науки Гэтсби предоставляет множество простых действий и анимаций (бит.ly/2DoV2o1).
Идеи для классной комнаты
Использование физических моделей дает учащимся возможность развить свое понимание. Например, подарите им набор горшков, содержащих одинаковые простые бусины, бусины одинакового размера, но разного цвета, а также бусины одного цвета, но разных размеров.
После того, как у них было пару минут, чтобы посмотреть на них и обсудить, задать вопросы…
Какой из горшков содержит смеси? Как вы можете сказать? Какие свойства содержимого вы используете, чтобы принять это решение?
Учащиеся должны назвать последние две бусины смесью, так как они содержат бусины разного размера или цвета. Попросите учащихся представить классу свои рассуждения и попросите других согласиться или не согласиться и объяснить, почему. Бросьте вызов тем, кто представляет изощренные аргументы, чтобы расширить свои рассуждения. Например, для третьего горшка: «Достаточно ли сказать, что бусины разные, потому что они разного размера?» Смогли бы вы привести такой же аргумент в пользу яблок разного размера?» Этот тип вопросов может помочь учащимся выйти за рамки поверхностных свойств и рассмотреть, существуют ли другие более важные свойства объектов и веществ.
Попросите учащихся представить классу свои рассуждения и попросите других согласиться или не согласиться и объяснить, почему. Бросьте вызов тем, кто представляет изощренные аргументы, чтобы расширить свои рассуждения. Например, для третьего горшка: «Достаточно ли сказать, что бусины разные, потому что они разного размера?» Смогли бы вы привести такой же аргумент в пользу яблок разного размера?» Этот тип вопросов может помочь учащимся выйти за рамки поверхностных свойств и рассмотреть, существуют ли другие более важные свойства объектов и веществ.
Повторите и дополните задание другими «химическими» примерами, предоставив учащимся запечатанные пробирки с солью, песком, солью и песком, а также кусочки цинка и медную стружку.
Хотите попробовать это задание со своим классом? Загрузите слайды PowerPoint для пошагового руководства в классе (ppt или pdf).
Хотите попробовать это задание со своим классом? Загрузите слайды PowerPoint для пошагового руководства для занятий (rsc. li/2Gnctsm).
li/2Gnctsm).
Как только учащиеся смогут определять и объяснять смеси, переходите к свойствам смесей.Учащиеся должны понимать, что вещества в смесях сохраняют свои свойства, а свойства смеси представляют собой совокупность этих свойств. Реальные примеры могут помочь студентам с этими понятиями. Например, сахар сладкий, вода влажная, раствор сахара сладкий и влажный. Упражнение «Разделение смесей» в Learn Chemistry обеспечивает полезную подсказку для понимания учащимися.
Как только учащиеся смогут определять и объяснять смеси, переходите к свойствам смесей.Учащиеся должны понимать, что вещества в смесях сохраняют свои свойства, а свойства смеси представляют собой совокупность этих свойств. Реальные примеры могут помочь студентам с этими понятиями. Например, сахар сладкий, вода влажная, раствор сахара сладкий и влажный. Упражнение «Разделение смесей» в Learn Chemistry предоставляет полезную подсказку для понимания учащимися (rsc.li/2tIg0yJ).
Продемонстрируйте приготовление растворов путем растворения сахара в воде и наоборот путем осторожного нагревания небольших объемов раствора в чашках для выпаривания. Покажите смешивающиеся жидкости (жидкости, которые смешиваются) и несмешиваемые жидкости (жидкости, которые не смешиваются) путем смешивания спирта и воды, масла и воды соответственно. Продемонстрируйте другие виды смесей, такие как суспензии, гели и пены, с мукой в воде, желе и взбитых сливках.
Покажите смешивающиеся жидкости (жидкости, которые смешиваются) и несмешиваемые жидкости (жидкости, которые не смешиваются) путем смешивания спирта и воды, масла и воды соответственно. Продемонстрируйте другие виды смесей, такие как суспензии, гели и пены, с мукой в воде, желе и взбитых сливках.
Студенты будут встречаться со многими примерами смесей во время изучения химии, предоставляя им регулярные возможности закрепить свое понимание смесей и растворов.
Например:
- воздух — однородная смесь, содержащая кислород, азот, аргон и другие газы;
- железных опилок с порошком серы — обычно используемая гетерогенная смесь;
- соленая вода представляет собой раствор, содержащий частицы соли, смешанные с частицами воды.
Предложите учащимся найти собственные примеры из своего дома.
Нужно вдохновение для планирования урока? Загрузите этот пример плана урока, который включает эти идеи (MS Word или pdf).
Нужно вдохновение для планирования урока? Загрузите этот пример плана урока, который включает эти идеи (rsc. li/2Gnctsm).
li/2Gnctsm).
Распространенные заблуждения
Большинство «чистых» материалов, с которыми мы сталкиваемся в повседневной жизни, на самом деле представляют собой смеси нескольких химических веществ.Разница между бытовой чистотой (например, «100% чистый апельсиновый сок») и химической чистотой (т. е. материалами, содержащими частицы только одного химического вещества) вызывает значительную путаницу. Полезно подчеркнуть, что изучение науки — это не только изучение нового языка, но и изучение понятий и навыков.
Когда образуются растворы, многие студенты думают, что масса растворенного вещества теряется, когда оно растворяется в растворе, хотя они с готовностью описывают сладкую воду как сладкую на вкус.Они редко осознают, что свойства смеси зависят от ее точного состава.
Наконец, учащиеся редко признают воду (очень распространенный растворитель) частицей. Нарисованные учащимися изображения растворения сахара в воде часто показывают частицы сахара на непрерывном фоне воды.
Химические заблуждения содержит много полезных идей и рабочих листов, которые помогут диагностировать мышление учащихся. «Элементы, соединения и смеси» (rsc.li/1pXL7iV) и разделы «Масса и растворение» (rsc.li/2HuAT2F) особенно полезны.
Пример диагностического вопроса
У вас есть стакан с водой весом 200 г. Вы добавляете 10 г сульфата меди в стакан с водой. Сначала в воде можно увидеть твердое вещество сульфата меди, но через 10 минут твердое вещество исчезает, и вода становится синей.
Какова масса стакана и его содержимого при первом добавлении медного купороса? Какова масса, когда все это окончательно растворится в воде? Объясните свои ответы.
Формирующее оценивание
Студенты не получат четкого представления о смесях и растворах, когда впервые столкнутся с этими идеями. Регулярная формирующая оценка поможет им развить свое понимание. Например, попросите учащихся:
- написать объяснение для описания материала как смеси или раствора;
- нарисовать диаграмму частиц вещества, четко различая различные компоненты;
- пройти короткий тест по определениям ключевых слов.

Затем предоставьте им обратную связь и попросите их выполнить задание заново.
Повышение до 14–16 лет
Природа химических веществ — фундаментальное понятие в химии, лежащее в основе большей части химии 14–16. Понятия элементов, соединений, атомов и молекул добавят понимания смесей и растворов, наряду с методами разделения. Эти концепции будут закреплены и контекстуализированы в возрасте 14–16 лет, когда учащиеся изучают такие материалы, как сырая нефть и каменные руды.Учащиеся также должны понимать природу химических моделей. Подумайте о том, чтобы освежить свои знания в этой области с помощью бесплатного онлайн-курса «Разработка и использование моделей».
Природа химических веществ — фундаментальное понятие в химии, лежащее в основе большей части химии 14–16. Понятия элементов, соединений, атомов и молекул добавят понимания смесей и растворов, наряду с методами разделения. Эти концепции будут закреплены и контекстуализированы в возрасте 14–16 лет, когда учащиеся изучают такие материалы, как сырая нефть и каменные руды.
 Москва, ИКЦ «Академкнига», 2004.
Москва, ИКЦ «Академкнига», 2004. Чаще твердые вещества, обладающие высокой прочностью. Тугоплавки. Полупроводники и диэлектрики.
Чаще твердые вещества, обладающие высокой прочностью. Тугоплавки. Полупроводники и диэлектрики.






 https://vptl.stanford.edu/students/academic-skills/study-tips-resources
https://vptl.stanford.edu/students/academic-skills/study-tips-resources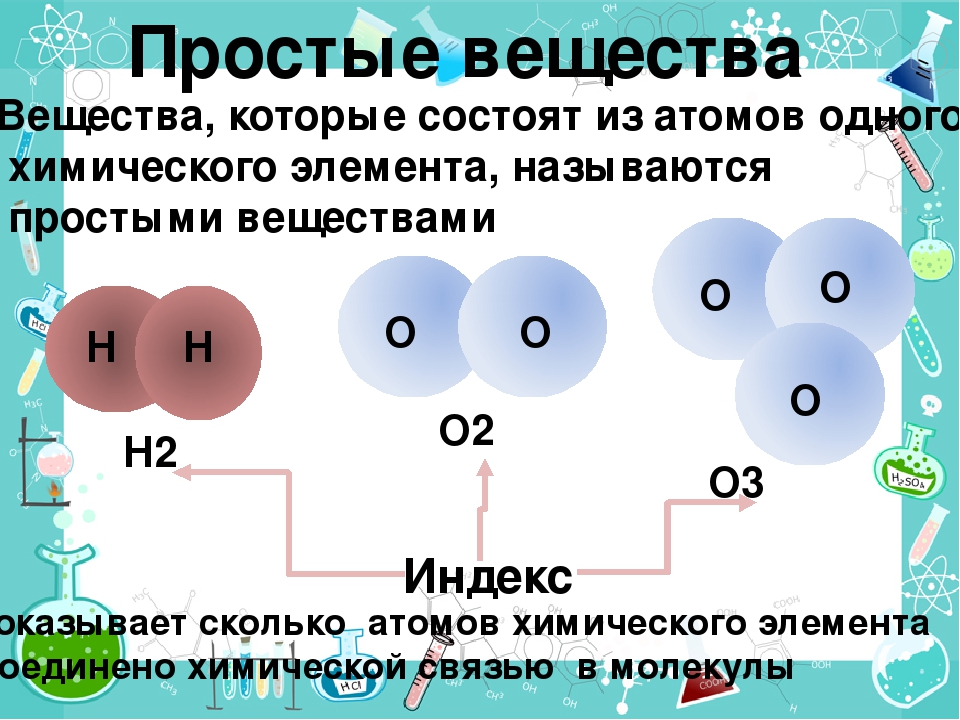 ..
.. добавление
добавление
