Амины | 10 класс
Амины
Вариант 1
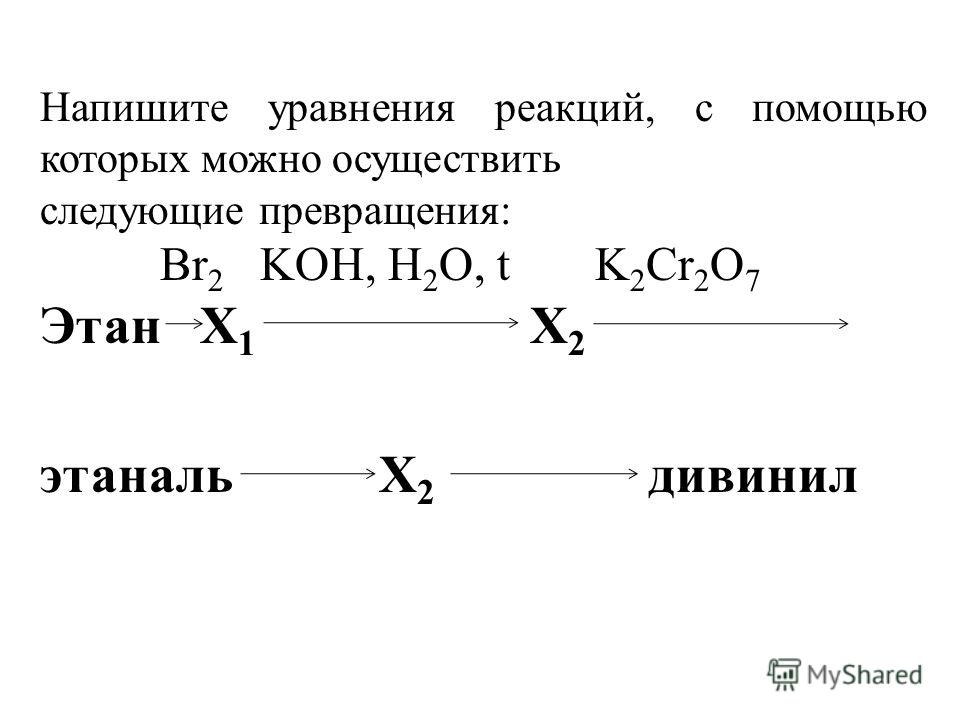
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → А → бензол → Б → анилин. Укажите названия веществ А и Б.
2. Объясните в свете электронной теории проявление аминами основных свойств. Ответ подтвердите уравнениями реакций.
3. Рассчитайте массу 2, 4, 6-триброманилина, который может быть получен при взаимодействии анилина массой 18,6 г с бромом массой 104 г. (Ответ: 66 г.)
Вариант 2
1. Даны вещества: соляная кислота, гидроксид натрия, вода, хлорид натрия. С какими из них будет реагировать этиламин? Напишите уравнения реакций и укажите названия образующихся веществ.
2. Напишите уравнение реакции получения хлорида фениламмония (солянокислого анилина).
3. Рассчитайте массу анилина, который можно получить при восстановлении нитробензола массой 246 г, если массовая доля выхода продукта составляет 90%. (Ответ: 167,4 г.)
Вариант 3
1. Напишите уравнение реакций, которые происходят при взаимодействии с водой: а) метиламина; б) диметиламина; в) триметиламина. Какие вещества при этом образуются и каковы их свойства?
2. Расположите в ряд по увеличению основности следующие вещества: анилин, метиламин, диметиламин, аммиак, дифениламин. Ответ обоснуйте.
3. Рассчитайте объем азота (н.у.), который образуется при сгорании метиламина объемом 20 л, содержащего 2% примесей. (Ответ: 9,8 л).
Вариант 4
1. Напишите уравнения реакций между: а) анилином и серной кислотой; б) метиламином и соляной кислотой; в) анилином и бромом; г) хлороводородом и этиламином. Укажите названия образующихся веществ.
Укажите названия образующихся веществ.
2. Напишите структурные формулы всех изомерных аминов состава C₃N₉H. Назовите эти вещества.
3. При восстановлении нитробензола массой 24,6 г получен анилин массой 17 г. Рассчитайте массовую долю выхода анилина. (Ответ: 91%.)
Уравнения химических реакций: свойства, коэффициенты и схемы
Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
- Соединение. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное.
 Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
- Обмен. Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Уравнения реакций — Справочник химика 21
Поскольку электроны не могут существовать в растворе в свободном состоянии, атомы окислителя должны получить в общей сложности ровно столько электронов, сколько их отдают атомы восстановителя. Этим условием определяются как коэффициенты в уравнениях реакций окисления — восстановления, так и весовые о- ношения в этих реакциях. Отсюда ясно, что при подсчете величин грамм-эквивалентов окислителей и восстановителей следует И1 ходить из количества электронов, получаемых или отдаваемых п >и реакции одной молекулой вещества.Нетрудно понять, что хорошая точность анализа не может служить доказательством его правильности. Чтобы убедиться в этом, рассмотрим следующий пример.
 Положим, что при ряде повторных титрований равных объемов исследуемого раствора щелочи раствором соляной кислоты были израсходованы весьма близкие между собой объемы ее это указывает на хорошую точность выполнения анализа. Однако для получения окончательного результата анализа необходимо по затраченному объему раствора H I и его концентрации вычислить из уравнения реакции соответствующее количество определяемой щелочи. Если концентрация раствора H I была в свое время определена неверно, то эта ошибка в качестве постоянной систематической ошибки отразится на всех результатах отдельных определений и, несмотря на хорошую воспроизводимость, полученные результаты будут совершенно неправильными. [c.50]
Положим, что при ряде повторных титрований равных объемов исследуемого раствора щелочи раствором соляной кислоты были израсходованы весьма близкие между собой объемы ее это указывает на хорошую точность выполнения анализа. Однако для получения окончательного результата анализа необходимо по затраченному объему раствора H I и его концентрации вычислить из уравнения реакции соответствующее количество определяемой щелочи. Если концентрация раствора H I была в свое время определена неверно, то эта ошибка в качестве постоянной систематической ошибки отразится на всех результатах отдельных определений и, несмотря на хорошую воспроизводимость, полученные результаты будут совершенно неправильными. [c.50]Стандартный потенциал пары Сс1 /Сс1 правей —0,40 в. Какие электрохимические процессы будут происходить при работе гальванического элемента, построенного из этой пары и нормального водородного электрода Составьте общее уравнение реакции. [c.376]
Л. ЛЯ того чтобы осаждение того или иного иона могло быть практически полным, нужно, очевидно, взять достаточное количество осадителя. Сколько его потребуется, можно приблизительно вычислить по уравнению реакции. [c.71]
ЛЯ того чтобы осаждение того или иного иона могло быть практически полным, нужно, очевидно, взять достаточное количество осадителя. Сколько его потребуется, можно приблизительно вычислить по уравнению реакции. [c.71]
Сплав свинца с приблизительно 10% натрия и небольшим количеством магния расплавляют в чугунных ящиках в атмосфере азота. Затем этот сплав дробят на куски размером с горошину и загружают в автоклавы, где под повышенным давлением при 50—75° проводят реакцию с хлористым этилом. В большинстве случаев добавляют также катализатор, например хлористый алюминий или хлорное железо. К концу реакции температуру повышают до 100°. После сброса давления в автоклаве тетраэтилсвинец отпаривают водяным паром для удаления газообразных углеводородов и избытка хлористого этила [182]. Как видно из уравнения реакции, в тетраэтилсвинец превращается лишь около 25% свинца остальное количество после переработки возвращается в процесс.
До настоящего времени не удалось достигнуть практически удовлетворительной работы над железным катализатором без давления. Технически приемлемую глубину превращения достигают только после повышения давления не менее чем до 15 ат. В этих условиях удается получать выходы продуктов синтеза, примерно соответствующие получаемым над кобальтовым катализатором. Основное уравнение реакции, протекающей при синтезе над железным катализатором, отличается от уравнения реакции над кобальтовым катализатором и выражается соотношением [c.112]
Технически приемлемую глубину превращения достигают только после повышения давления не менее чем до 15 ат. В этих условиях удается получать выходы продуктов синтеза, примерно соответствующие получаемым над кобальтовым катализатором. Основное уравнение реакции, протекающей при синтезе над железным катализатором, отличается от уравнения реакции над кобальтовым катализатором и выражается соотношением [c.112]
Кроме рассмотренных факторов следует отметить также влияние избытка маскирующего агента. Чем больше его концентрация в растворе, тем сильнее понижается степень ионизации комплекса, а значит, и концентрация связываемого иона. Например, расчет показывает, что при употреблении соответствующего уравнению реакции количества K N осадок Agi при действии KI должен выпадать. И только вследствие того, что фактически всегда прибавляют некоторый избыток K N, Ag+-noH оказывается замаскированным. [c.96]
Из ионного уравнения реакции видно, что два тиосульфат-иона 820з превращаются в один тетратионат-ион З Об».
Уравнение реакции сульфоокисления [c.492]
Посмотрим теперь, насколько полным будет осаждение РЬЗО при употреблении вычисленного по уравнению реакции количества осадителя. Так как с этим количеством его на каждый РЬ + ИОН вводят в раствор также по одному ЗО -иону, концентрации указанных ионов по окончании осаждения должны быть, очевидно, равны между собой. Поскольку произведение их равняется [c.72]
Прежде всего рассмотрим процесс образования осадков. Этот процесс, несомненно, сложнее, чем можно ожидать на основании уравнения реакции. Так, судя по уравнению [c.98]
Почему определению при помощи реакции с диметилглиоксимом мешает присутствие Ре + Как устраняют его влияние Уравнение реакции [c.192]
Уравнения реакций (19.1), (19.2) и (19.3) представляют собой суммарное выражение процесса катодного выделения водорода при различных условиях электролиза.
Отсчитав по бюретке израсходованный на титрование объем р (Створа реагента и зная его титр, перемножают эти величины и получают израсходованное на реакцию количество реагента (в граммах). Отсюда по уравнению реакции уже нетрудно вычислить количество определяемого вещества в исследуемом растворе, а если известен объем последнего, то и титр раствора . [c.196]
Прежде всего рассчитаем, какова будет величина pH раствора в тот момент, когда оттитровано 50% уксусной кислоты (т. е. к раствору прибавлено вдвое меньше щелочи, чем требуется по уравнению реакции, именно 50 мл щелочи на 100 мл кислоты).
Сложив почленно оба написанных уравнения, получим общее уравнение реакции, происходящей при работе данного элемента [c.346]
Причина отклонений заключается в сложности этих реакции. Действительно, в процессе реакций часто происходит не только переход электронов, но и изменение состава участвующих в реакции ионов. Такое изменение состава наблюдается, например, при восстановлении анионов МпОГ и СгаО до катионов Мп + и Сг +. Сложные реакции проходят всегда через ряд промежуточных стадий, так что уравнения реакций не отражают действительного течения процесса, а являются лишь суммарными. Скорость же всего процесса зависит именно от скоростей течения отдельных промежуточных стадий и потому не может быть заранее определена на основании суммарного уравнения реакции. [c. 372]
372]
Почленно складывая уравнения (2), (3) и (4), получаем суммарное уравнение реакции (1). [c.373]
Приводим уравнения реакций, на которых основаны эти опре-дел(иия [c.399]
Уравнения (7.4) и (7.6) неопределенны в том смысле, что не всегда можно достаточно четко установить, какие именно из участников реакции следует принимать за исходные вещества, а какие — за ее продукты. Поэтому, ссли не ввести дополнительных условий, то для одной и той же электрохимической системы, в зависимости от порядка написания уравнения реакции, значения
Осаждение такого вещества, как РЬ504, при употреблении эквивалентного (т. е. соответствующего уравнению реакции) количества осадителя весьма неполно, однако применяя избыток осадителя, можно достигнуть гораздо более полного осаждения этой соли. [c.73]
Решение. Процесс сгорания серы описывается уравнением реакции [c.66]
Количество воздуха, необходимое для горения топлива, определяется на основе уравнений реакций горения. В нефтезаводских печах при сжигании ишдкого и газообразного топлива обычно имеет место практически полное горение. [c.109]
В нефтезаводских печах при сжигании ишдкого и газообразного топлива обычно имеет место практически полное горение. [c.109]
Перечислите важнейшие типы плавней, применяемых при сплавлении осадков. Составьте уравнения реакций, происходящих при сплавлении осадков. Составьте уравнения реакций, происходящих при сплавлении а) AI2O3 с KHSO4 [c.160]
С технической точки зрения решающее значение нрн синтезе Фишера— Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования окиси углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза, особенно иа кобальтовом катализаторе, где она должна выдерживаться практически в пределах 1°. В противном случае значительно возрастает нежелательное метанообразование. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации. Из уравнений реакции на кобальтовом и железном катализаторах можно рассчитать, что на 1 нм сйнтеэ-газа, вошедшего в реакцию, выделяется по меньшей мере 600—700 ккал, т. е. количество тепла, достаточное (в адиабатических условиях) для нагрева синтез-газа примерно до 1500°. Отсюда ясно, какие конструктивные трудности возникают при эксплуатации установок крупного размера в связи с требованием соблюдать практически постоянную температуру синтеза. [c.67]
е. количество тепла, достаточное (в адиабатических условиях) для нагрева синтез-газа примерно до 1500°. Отсюда ясно, какие конструктивные трудности возникают при эксплуатации установок крупного размера в связи с требованием соблюдать практически постоянную температуру синтеза. [c.67]
Совместное действие двуокиси серы и брома на парафиновые углеводороды ведет к лишь едва заметному образованию сульфобро-мндов, но реакция сейчас же начинается и протекает очень быстро п гладко, если половину брома заменить хлором. Как видно из следующего уравнения реакции, бром вместе с двуокисью серы вступает в молекулу парафина с одновременным выделением хлористого водорода [c.383]
Применение органических осадителей требует создания определенных услови1[ и прежде всего надлежащей величины pH раствора. Причину этого понять нетрудно. Выше указывалось, что при образовании внутрикомплексных солей происходит замещение водорода кислотной группы реагента ионами металла при этом в раствор переходят ионы водорода, как это следует, например, из приведенного выше уравнения реакции между N1 + и диметилглиоксимом. Ясно, что положение равновесия должно зависеть от концентрации Н» , т. е. от величины pH раствора. Диметил-глиоксим (и другие подобные ему органические реагенты) ведет себя как слабая кислота. Поэтому к рассматриваемой реакции применимо все то, что говорилось ранее о значении величины pH при осаждении малорастворимых солей слабых кислот. И здесь, если известна величина ПР осадка и константа кислотной ионизации реагента, можно вычислить величину pH, при которой достигается полное осаждение. [c.125]
Ясно, что положение равновесия должно зависеть от концентрации Н» , т. е. от величины pH раствора. Диметил-глиоксим (и другие подобные ему органические реагенты) ведет себя как слабая кислота. Поэтому к рассматриваемой реакции применимо все то, что говорилось ранее о значении величины pH при осаждении малорастворимых солей слабых кислот. И здесь, если известна величина ПР осадка и константа кислотной ионизации реагента, можно вычислить величину pH, при которой достигается полное осаждение. [c.125]
Согласно ионному уравнению реакции при гидролизе на каждый обр 1зующийся ОН—И0Н в растворе появляется одна молекула НАп, откуда [НАп] = [ОН ]. [c.263]
Решение. Рр = 1п (известняка)/ т (извести). Запишем уравнение реакцпп СаСО , = СаО+СОа- -ДЛ/, Опреде,лнм молярную массу СаСО, и СаО если Л1г(СаС0з) = 100,1, то М(СаСОз) = = 100,1 г/моль, п. И 100-10- т/моль. Таким же способом вычисляется молекулярная масса если Мг(СаО) =56,1, то (СаО) =56,1 г/моль, нлн 56-10- т/моль. Вычислим массу вещества оксида кальция, содержащегося в 1 т извсстн 6 сао = 1-0,94 = 0,94. Количество оксида кальция будет гс.ао = 0,94/56-И)- = 1 б 857. ( огласно уравнению реакции количество вещества карбоната кальция также равно [c.46]
Вычислим массу вещества оксида кальция, содержащегося в 1 т извсстн 6 сао = 1-0,94 = 0,94. Количество оксида кальция будет гс.ао = 0,94/56-И)- = 1 б 857. ( огласно уравнению реакции количество вещества карбоната кальция также равно [c.46]
Когда в уравнении реакции, происходящей при превращении окисленной формы в восстановленную, имеются стехиометрические коэффициенты, не равные единице, они входят в уравнение Нерн-ста в качестве показателей степени при соответствующих концент-piiUHHX. Например, для пары Brs/2Br- можно написать [c.352]
Особенный интерес представляют те точки на кривой титрования, которые соответствуют 0,1 мл недостатка и 0,1 мл избытка КМпОд, так как они определяют собой величину скачка потенциала около точки эквивалентности. Вычислим первую из этих точек (начало скачка). Поскольку в этот момент прилито 99,9 мл КМп04, т. е. на 0,1 мл меньше, чем требуется по уравнению реакции, в растворе осталось неоттитрованным железо(И) в объеме 0,1 мл и оттитровано (т. е. преврашено в Fe +) все остальное количество Fe2+, находившееся в объеме 99,9 мл первоначального раствора. Следовательно, для этого момента [c.361]
е. преврашено в Fe +) все остальное количество Fe2+, находившееся в объеме 99,9 мл первоначального раствора. Следовательно, для этого момента [c.361]
Так как в точке эквивалентности Мп07-ионы вводятся в раствор в количестве, соответствующем уравнению реакции 5Ре2+ + МпОГ + 8Н+ 5 5Ре + + Мп2+ + 4НгО, то и при равновесии па каждый оставшийся в растворе МпОТ-ион должно приходиться бРе -ионов. Следовательно, в точке эквивалентности концентрация Ре в пять раз больше концентрации МпОГ, т. е. [c.362]
Как видно из приведенного уравнения, реакция идет с участием Н+-И0И0В, и поэтому ее следует проводить в кислой среде. Однако для количественного протекания реакции далеко не безразлично, с какой кислотой вводят Н+-ионы. Опыт показывает, что при титровании в сернокислой среде расход перманганата строго соответствует содержанию i e2+ и результат определения получается правильным. Наоборот, при титровании в присутствии НС1 или хлоридов наблюдается повышенный расход КМПО4. Это указывает на то, что он затрачивается на какую-то побочную реакцию. Если учесть, что титруемый раствор пахнет хлором, станет ясным, что эта реакция протекает следующим образом [c.375]
Это указывает на то, что он затрачивается на какую-то побочную реакцию. Если учесть, что титруемый раствор пахнет хлором, станет ясным, что эта реакция протекает следующим образом [c.375]
Аналогично определяют ряд других восстановителей, способных восстанавливать Ь до Г-иона. Таковы, например, соли НаЗОз, НзАзОз и Нз5ЬОз, НгЗ, 5пС12 и другие вещества. Приведем уравнения реакций, протекающих при титровании этих соединений иодом [c.397]
I Для определения свинца в руде взята иавеска руды 5,0000 г. После растворения ее в кислоте РЬ -ион осажден в виде РЬСгО,, осадок отфильтрован, промыт и растворен в смеси НС и KI (уравнение реакций ). Выделенный при этой реакции иод оттитровал 0,5000 н, раствором NajSjOa и его израсходовано [c.419]
Такнм образом, по Писаржевскому, переход ионов из металла в раствор совершается не за счет физически неясной электролитической упругости растворения металла, а в результате его взаимодействия с молекулами растворителя. Явление электролитической диссоциации электролитов и возникновение электродного потенциала основаны, следовательно, на одном и том же процессе сольватации (в случае водных растворов — гидратации) ионов. Из уравнения реакции (10.20) следует, что при растворении образуются не свободные, а сольватированные ионы, свойства которых зависят от и >ироды растворителя. Поэтому в отхичие от теории Нернста значение стандартного потенциала данного электрода должно меняться при переходе от одного растворителя к другому. Подобная зависимость была действительно обнаружена и послужила предметом исследований многих авторов (Изгарышева, Бродского, Плескова, Хартли, Измайлова и др.). Было установлено, что изменение электродного потенциала при переходе от одного растворителя к другому оказывается тем большим, чем М зньше радиус и выше заряд иона, участвующего в электродной реакции. По Плескову, меньше всего изменяются потенциалы цезиевого, рубидиевого и йодного электродов, в установлении равновегия на которых участвуют одновалентные ионы значительных размеров.
Явление электролитической диссоциации электролитов и возникновение электродного потенциала основаны, следовательно, на одном и том же процессе сольватации (в случае водных растворов — гидратации) ионов. Из уравнения реакции (10.20) следует, что при растворении образуются не свободные, а сольватированные ионы, свойства которых зависят от и >ироды растворителя. Поэтому в отхичие от теории Нернста значение стандартного потенциала данного электрода должно меняться при переходе от одного растворителя к другому. Подобная зависимость была действительно обнаружена и послужила предметом исследований многих авторов (Изгарышева, Бродского, Плескова, Хартли, Измайлова и др.). Было установлено, что изменение электродного потенциала при переходе от одного растворителя к другому оказывается тем большим, чем М зньше радиус и выше заряд иона, участвующего в электродной реакции. По Плескову, меньше всего изменяются потенциалы цезиевого, рубидиевого и йодного электродов, в установлении равновегия на которых участвуют одновалентные ионы значительных размеров. Напротив, эти изменения особенно велики в случае ионов водорода и поливалентных катионов малых размеров. Именно такой зависимости электродных потенциалов от природы растворителя следовало ожидать на основе представлений Писаржевского о роли сольватационных явлений в образовании скачка потенциала металл — раствор. Для количественного сравнения потенциалов в разных растворителях применяют в качестве стандартного нулевого электрода цезиевый [c.221]
Напротив, эти изменения особенно велики в случае ионов водорода и поливалентных катионов малых размеров. Именно такой зависимости электродных потенциалов от природы растворителя следовало ожидать на основе представлений Писаржевского о роли сольватационных явлений в образовании скачка потенциала металл — раствор. Для количественного сравнения потенциалов в разных растворителях применяют в качестве стандартного нулевого электрода цезиевый [c.221]
Последняя стадия определяет скорость всего процесса. Для реализации этой стадии необходимо, чтобы, во-первых, разряд водородных ионов протекал беспрепятственно (или во всяком случае егче, чем разряд восстанавливаемых частиц) и, во-вторых, присоединение атома водорода к частиц(з Ох совершалось с меньшими затруднениями, чем рекомбинация двух водородных атомов. Эти условия лучше всего должны выполняться на металлах групп платины и железа, а также на других металлах, у которых рекомбинация водородных атомов или является замедленной стадией, или протекает с малой скоростью. Накопление водородных атомов на поверхности этих металлов в ходе их катодной поляризации способствует быстрому протеканию реакции гидрирования. Электрохимическое восстановление при подобном механизме становится сходным с процессом каталитического гидрирования с той разницей, что атомы водорода в первом случае поставляются током, а во втором — диссоциацией молекулярного водорода иа поверхности катализатора. В согласии с уравнением реакции (21.15) для илотности тока, идущего на реакцию восстановления, можно наиисать следующее выражение [c.438]
Накопление водородных атомов на поверхности этих металлов в ходе их катодной поляризации способствует быстрому протеканию реакции гидрирования. Электрохимическое восстановление при подобном механизме становится сходным с процессом каталитического гидрирования с той разницей, что атомы водорода в первом случае поставляются током, а во втором — диссоциацией молекулярного водорода иа поверхности катализатора. В согласии с уравнением реакции (21.15) для илотности тока, идущего на реакцию восстановления, можно наиисать следующее выражение [c.438]
Реи гнае. Из уравнений реакци [c.120]
VII. Какие пз приведенных уравнений реакции имеют место прп х([ми сской деа.эрацни воды [c.127]
Самостоятельная работа по химии. 8 класс. Тема: «Реакции соединения». Вариант 3
{module Адаптивный блок Адсенс в начале статьи}
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
РЕАКЦИИ СОЕДИНЕНИЯ
ВАРИАНТ 3
1. Напишите уравнения реакций соединения между простыми веществами:
Напишите уравнения реакций соединения между простыми веществами:
а) кислородом и кремнием,
б) алюминием и хлором,
в) кальцием и фосфором,
приводящие к образованию бинарных соединений.
Ответ:
а) Si + O2 = SiO2;
б) 2Al + 3Cl2 = 2AlCl3;
в) 3Ca + 2P = Ca3P2.
2. Напишите уравнения реакций соединения между водой и оксидами:
а) оксидом рубидия,
б) оксидом фосфора (III),
в) оксидом азота (III),
приводящие к образованию соответствующих гидроксидов.
Ответ:
а) Rb2O + H2O = 2RbOH;
б) P2O3 + 3H2O = 2H3PO3;
в) N2O3 + H2O = 2HNO2.
3. Осуществите цепочки превращений:
а) Sr →SrO → Sr(OH)2,
б) Р → Р2О5 → Н3РО4.
Ответ:
а) 2Sr + O2 = 2SrO; SrO + H2O = Sr(OH)2;
б) 4Р + 5О2 = Р2О5; Р2О5 + 3Н2О = 2Н3РО4.
4. Для получения аммиака (NH3) смесь азота и водорода пропускают над железом. Для протекания реакции требуется первоначальное нагревание, дальше реакция протекает самопроизвольно. Приведите уравнение реакции. Какую роль играет железо в этом процессе? Укажите тип реакции по тепловому эффекту.
Ответ: N2 + 3H2 = 2NH3, железо — катализатор, реакция — экзотермическая.
{module Адаптивный блок Адсенс в конце статьи}
Изучить химию — просто!: 2017
§14.Составьте уравнения химических реакций
1) Расставьте коэффициенты
1. P + Cl2 = PCl5
2. Ch5 = C + h3
3. Na + S = Na2S
4. HCl + Mg = MgCl2 + h3
5. ZnSO4 + KOH = K2SO4 + Zn(OH)2
6.
 BaCl2 + Na2SO4 = BaSO4 + NaCl
BaCl2 + Na2SO4 = BaSO4 + NaCl7. AlCl3 + NaOH = NaCl + Al(OH)3
8. Fe(OH)3 = Fe2O3 + h3O
9. h3SO4 + Al = Al2(SO4)3 + h3
10. P2O5 + Na2O = Na3PO4
11. Al2(SO4)3 + Ba(NO3)2 = Al(NO3)3 + BaSO4
12. HCI + Al → AlCI3 + h3
13. Fe + O2 → Fe2O3
14. NaNO3 → NaNO2 + O2
15. Fe2O3 + h3 → Fe + h3O
16. KCIO3 → KCI + O2
17. K2O + h3O → KOH
18. Na + h3O → NaOH + h3
19. P2O5 + h3O → h5P2O7
20. CuO + C → Cu + CO2
21. KMnO4 → K2MnO4 + MnO2 + O2
22. NaHCO3 → Na2CO3 + CO2 + h3O
23. CaO + CO2 → CaCO3
24. N2O5 + h3O → HNO3
25. Ch5 → C2h3 + h3
26. C2h3 → C6H6
2)Закончите уравнения химических реакций и расставьте коэффициенты
27. Li + O2 → ?
28. Ca + O2 → ?
29. B + O2 → ?
30. Si(IV) + O2 → ?
31. Nh4 + O2 → N2 + ?
32. HgO → ? + ?
33. Na + N2(III) → ?
34. Al + CI2 → ?
35. K + S(II) → ?
36. Ch5 + O2 → CO2 + ?
37. P(V) + Br2 → ?
38. S(II) + h3 → ?
39.
 Fe(II) + N2(III) → ?
Fe(II) + N2(III) → ?40. Cr(III) + O2 → ?
41. Cu(I) + O2 → ?
42. Na + h3 → ?
43. Si(IV) + C(IV) →?
§15-17
Подготовка к контрольной работе
Обобщение и систематизация знаний по теме: «Кислород»
1. Закончите схемы реакций. Распределите вещества на простые и сложные. Дайте названия оксидам.
А) ? + ? → MgO Б) S + O2 → ? В) Ch5 + O2 → ? + ?
Г) Ca + O2 → ? Д) Cu + O2 → ? Е) ZnS + O2 → ? + ?
2. Запишите уравнения реакций, с помощью которых можно осуществить цепочки превращений. Укажите тип химической реакции:
А) h3O2 → O2 → CO2 Б) h3 → h3O → O2 → BaO
В) KClO3 → O2 → Fe3O4
3. Найдите массу вещества P2O3, которое образовалось при взаимодействии фосфора массой 6,2 г с достаточным количеством кислорода.
4. Найдите объем вступившего в реакцию кислорода, если при его взаимодействии с магнием получили 16 г вещества MgO.
*5. В промышленности серную кислоту получают по схеме реакций:
S + O2 → SO2
SO2 + O2 → SO3
SO3 + h3O → h3SO4
Определите массу серной кислоты, которую можно получить из 6,4 г серы.

(Тема «Решение расчетных задач по уравнению химической реакции») нет в программе!
АлгоритмРешения задач по уравнению химической реакции
1. Внимательно прочитать условие задачи. Кратко записать условие (что дано и что требуется найти), используя известные обозначения.
2. Определить, какие вещества исходные, а какие – продукты реакции.
3. Записать данный химический процесс в виде уравнения химической реакции, расставить коэффициенты.
4. Подчеркнуть формулы веществ в уравнении, которые даны одной чертой, которые найти – двумя.
5. По коэффициентам определить и записать под формулами значения величин химического количества тех веществ, для которых есть данные (массы, объема, химического количества вещества и др.) или стоит вопрос в условии задачи.
6. Перевести массы (или объемы) известных в задаче веществ в количество вещества, используя формулы математической зависимости.
7. Найденное количество надписать над формулой данного вещества в уравнении реакции. Искомое вещество обозначается за Х.
Искомое вещество обозначается за Х.
8. Составляем и решаем пропорцию исходя из количественных соотношений. Таким образом, находим искомое количество вещества.
9. Перевести (если требуется в задаче) найденное количество вещества в массу (или объем), используя формулы математической зависимости.
10. Записать ответ.
Решите задачи
1. Какой объем кислорода необходим для полного сжигания Ca массой 80 г?
3. Какая масса продукта образуется в результате реакции сгорания 96 г Mg в кислороде? Вычислите массовую долю кислорода в образовавшемся продукте.
4. При сгорании фосфора в кислороде образовалось вещество P2O5. Какое число молекул кислорода может вступить в реакцию с фосфором массой 100 г?
5. Могут ли 2,68 г кислорода полностью прореагировать с 0,25 г водорода с образованием воды?
6.* Смесь массой 10 г, состоящую из Ca и CaO, прокалили длительное время в кислороде.
 В результате этого масса смеси увеличилась на 1,6 г. Определите массу CaO, в исходной смеси.
В результате этого масса смеси увеличилась на 1,6 г. Определите массу CaO, в исходной смеси.§12. Тема «Явления физические и химические»
Выберите физические и химические явления
1. При нагревании в колбе йода фиолетового цвета, колба заполняется газом фиолетового цвета.
2. При сливании двух бесцветных растворов выпал осадок белого цвета
3. При горении дров образуется зола
4. При открывании газированной воды выделяются пузырьки углекислого газа.
5. При внесении в колбу с кислородом стальной проволоки, она ярко светится.
6. Изгибание железного гвоздя.
7. Приготовление пищи (варка яиц)
8. При добавлении сахара в воду мы получаем сладкую воду.
9. При добавлении к соде раствора уксусной кислоты выделяется газ.
10. Cu(NO3)2 → CuO + NO2 + O2
Химические реакции — Химия в школе № 302 Фрунзенского района Санкт-Петербурга
Реакция обмена между оксидом меди и серной кислотой
youtube.com/embed/frzou7o4WSU?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Восстановление меди водородом из оксида меди
CuO + h3 → Cu + h3O (реакция замещения)
Получение водорода и проверка его на чистоту
Zn + 2HCl → ZnCl2 + h3↑ (реакция замещения)
Образование и разрушение кристаллогидратов
CuSO4*5h3O → CuSO4 + H2O (реакция разложения)
CuSO4 + h3O → CuSO4*5h3O (реакция соединения)CuSO4*5h3O медный купорос
CuSO4 сульфат меди
Химические свойства нерастворимых оснований
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4 (реакция обмена)
Cu(OH)2 → CuO + h3O (реакция возможна при нагревании) (реакция разложения)
youtube.com/embed/I_50Yj-ZVKU?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Взаимодействие кислот с солями
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (реакция обмена)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (реакция обмена)
Взаимодействие кислотных оксидов с водой
SiO2 + h3O (реакция не возможна, так как h3SiO3 — нерастворимая в воде кислота)
P2O5 + 3h3O → 2h4PO4 (реакция соединения)
Реакции нейтрализации
NaOH + HCl → NaCl + h3O (реакция обмена)
youtube.com/embed/MxgIliQuaug?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Взаимодействие хлора с железом
2Fe + 3Cl2 → 2FeCl3 (реакция соединения)
Взаимодействие соды с соляной кислотой
Na2CO3 + 2HCl → NaCl + h3O + CO2↑ (реакция обмена)
Химические свойства углекислого газа
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (реакция разложения)
CO2 + Ca(OH)2 → CaCO3↓ + h3O (реакция обмена)
CO2 + 2Mg → C + 2MgO (реакция замещения)
com/embed/J8JdVrETC5A?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Получение углекислого газа и его свойства
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (реакция обмена)
CO2 + Ca(OH)2 → CaCO3↓ + h3O (реакция обмена)
Электрохимический ряд напряжений вытеснение водорода металлами
Mg + 2HCl → MgCl2 + h3↑ (реакция замещения)
2Al + 6HCl → 2AlCl3 + 3h3↑ (реакция замещения)
Fe + 2HCl → FeCl2 + h3↑ (реакция замещения)
Cu + HCl (реакция не возможна, так как медь в электрохимическом ряду напряжений стоит после водорода)
Взаимодействие металлов с солями
Сu + 2AgNO3 → 2Ag + Cu(NO3)2 (реакция замещения)
Fe + CuSO4 → Cu + FeSO4 (реакция замещения)
Zn + Pb(NO3)2 → Pb + Zn(NO3)2 (реакция замещения)
youtube.com/embed/ym9tdNR5SY0?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Взаимодействие брома с алюминием
2Al + 3Br2 → 2AlBr3 (реакция соединения)
Получение йодида алюминия
2Al + 3I2 → 2AlI3 (реакция соединения)
Распознавание растворов натрия и калия
NaCl + AgNO3 → NaNO3 + AgCl↓ (реакция обмена)
NaBr + AgNO3 → NaNO3 + AgBr↓ (реакция обмена)
KI + AgNO3 → KNO3 + AgI↓ (реакция обмена)
youtube.com/embed/M_kkppaavJw?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Получение гидроксида железа (II) и растворение его в соляной кислоте
FeSO4 + 2KOH → Fe(OH)2↓ + K2SO4 (реакция обмена)
Fe(OH)2 + 2HCl → FeCl2 + 2h3O (реакция обмена)
Получение и растворение гидроксида железа (III) в соляной кислотеFeCl3 + 3KOH → Fe(OH)3↓ + 3KCl (реакция обмена)
Fe(OH)3 + 3HCl → FeCl3 + 3h3O (реакция обмена)
Горение железа в кислороде
3Fe + 2O2 → Fe3O4 (реакция соединения)
Fe3O4 — это смешанный оксид, его формулу можно записать FeO*Fe2O3
youtube.com/embed/9UTfvqfrnps?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Термическое разложение нитрата калия
2KNO3 → 2KNO2 + O2↑ (реакция разложения)
Взаимодействие галогенидов с хлорной водой
NaCl + Cl2 → реакция невозможна
NaBr + Cl2 → NaCl + Br2 (реакция замещения)
KI + Cl2 →KCl + I2 (реакция замещения)
Получение железа алюмотермией
3Fe3O4 + 8Al → 4Al2O3 + 6Fe (реакция замещения)
Практична робота » Реакції йонного обміну»
Практична робота №1
Тема: Реакції обміну між розчинами електролітів, які відбуваються з утворенням осадів, газів і малодисоційованих сполук
Мета: Закріпити набуті знання про реакції обміну та навички їх практичного здійснення.
Реактиви: розчини хлориду калію, хлориду натрію, нітрату срібла, хлориду барію, карбонату натрію, гідроксидів натрію та барію, сульфату калію, соляної, сірчаної кислот, сульфіду натрію, силікату натрію, сульфат міді(ІІ).
Обладнання: пробірки.
Хід роботи:
Дослід 1. Реакції з утворенням осадів
а) До розчинів хлоридів натрію і калію долийте розчин нітрату срібла. Що відбувається? Складіть рівняння реакцій у повному та скороченому іонному виглядах.
б) У три пробірки налийте розчини: у першу – хлорид барію, у другу – карбонат натрію, в третю – хлорид калію. Долийте в першу пробірку розчин сульфату калію, в другу – хлориду калію, в третю – нітрату срібла. Що спостерігається в кожній пробірці? Складіть рівняння реакцій в повному та скороченому іонному виглядах.
Дослід 2. Реакції з утворенням газу
а) До концентрованого розчину карбонату натрію долийте краплями розчин соляної кислоти. Чим пояснити спостережуване явище? Складіть молекулярне та іонне рівняння реакції.
Чим пояснити спостережуване явище? Складіть молекулярне та іонне рівняння реакції.
Дослід 3. Реакції з утворенням слабкого електроліту
а) Утворення слабкої основи. У дві пробірки налийте розчин мідного купоросу і долийте до однієї порції розчин їдкого натру. Що спостерігається в кожній з пробірок? Напишіть рівняння реакцій в молекулярному та іонному виглядах.
Завдання №1
Для реакцій, що відбуваються в розчині до кінця, напишіть молекулярне, повне та скорочене йонне рівняння:
а) аргентум нітрат і алюміній хлорид;
б) калій нітрат і натрій хлорид;
в) барій хлорид і ферум(ІІІ) сульфат;
г) купрум нітрат і натрій карбонат;
д) натрій силікат і сульфатна кислота.
Завдання №2
Яка з реакцій відбувається у розчині до кінця і чому:
а) літій сульфат + калій гідроксид →
б) купрум (ІІ) сульфат + натрій хлорид →
в) цинк сульфат + алюміній хлорид →
г) натрій карбонат + цинк хлорид →
Завдання №3
Підберіть молекулярні рівняння до даних скорочених йонних:
Fe3+ + OH— → Fe(OH)3
NH4+ + OH— → NH3 + H2O
Ba2+ +PO43- → Ba3(PO4)2
Запитання до теми.
- Коли реакції йонного обміну проходять до кінця (навести приклади).
- Які речовини називаємо електролітами, неектролітами?
- Які йони називаємо катіонами, аніонами і чому?
- Що таке електроліз? Коли проходить електроліз? Написати електроліз розчину таких солей: NaCl; Na2SO4; CuSO4; CuBr2.
Как написать химическое уравнение?
Как написать химическое уравнение?
Все химические реакции представлены химическими уравнениями . Химическое уравнение — это сокращенное представление химической реакции с использованием символов и формул вещества, участвующего в химической реакции.
Символы и формулы веществ (элементов или соединений) расположены так, чтобы показать реагенты и продукты химической реакции.
Химическая реакция происходит, когда исходные вещества реагируют с образованием новых веществ.
(a) Исходные вещества называются реагентами .
(b) Новые образовавшиеся вещества называются продуктами .
В уравнении реагенты записываются в левой части, а продукты записываются в правой части.
Например:
Люди также спрашивают
Построение химических уравнений
1. Согласно закону сохранения массы, материя не может быть создана или разрушена. Это означает, что количество атомов до и после химической реакции одинаково.Следовательно, химическое уравнение должно быть сбалансировано.
2. В таблице ниже показано, как можно построить химическое уравнение.
Таблица: Построение химического уравнения.
| Реакция: Железные опилки реагируют с хлоридом меди (II) с образованием раствора хлорида железа (III) и меди. | |
| Шаг | Объяснение и пример |
| Определите реагенты, продукты и их формулы. | Реагенты: хлорид железа, Fe и меди (II), CuCl 2 Продукты: хлорид железа (III), FeCl 3 и медь, Cu |
Напишите основную часть уравнения. | Fe + CuCl 2 ⟶ FeCl 3 + Cu Реагенты Продукты |
| Определите количество атомов каждого элемента в обеих частях уравнения. | Левая сторона Правая сторона Атом Fe: 1 атом Fe: 1 Атом Cu: 1 атом Cu: 1 Атом Cl: 2 атома Cl: 3 Число атомов не сбалансировано. |
| Выровняйте уравнение, настроив коэффициенты. (Примечание: коэффициенты — это числа перед формулами.) | Атомы Cl уравновешены. Fe + 3CuCl 2 ⟶ 2FeCl 3 + Cu В результате количество атомов Fe и Cu не сбалансировано. Затем атомы Fe уравновешиваются. 2Fe + 3CuCI 2 ⟶ 2FeCI 3 + Cu Наконец, атомы Cu уравновешены. 2Fe + 3CuCI 2 ⟶ 2FeCI 3 + 3Cu |
| Убедитесь, что уравнение сбалансировано. | Левая сторона Правая сторона Атом Fe: 2 атома Fe: 2 Атом Cu: 3 атома Cu: 3 Атом Cl: 6 Атом Cl: 6 Теперь уравнение сбалансировано.  |
| Поместите государственный символ каждого вещества. | 2Fe (s) + 3CuCl 2 (aq) ⟶ 2FeCl 3 (aq) + 3Cu (s) |
3. Символы состояния, (l) и (g) представляют собой твердое, жидкое и газообразное состояния соответственно.Символ (водный) представляет водный раствор.
4. Иногда символ «↑» используется для обозначения выпуска газа.
5. Иногда над стрелкой пишут «», чтобы показать, что нагревание необходимо для начала химической реакции.
Правила написания химического уравнения:
При написании химического уравнения необходимо соблюдать определенные правила.
- Реагенты, участвующие в реакции, записываются их символами или молекулярными формулами в левой части уравнения.
- Знак плюс (+) добавлен между формулами реагентов.
- Продукты реакции записаны их символами или молекулярными формулами в правой части уравнения.
- Знак плюс (+) добавлен между формулами продуктов.

- Между реагентами и продуктами вставлена стрелка (⟶), показывающая, в каком направлении происходит реакция.
A + B ⟶ C + D
В этом химическом уравнении A и B — реагенты, а C и D — продукты.Стрелка указывает, что реакция идет к образованию C и D.
Как сбалансировать химические уравнения?
Первым шагом в балансировании уравнения является подсчет количества атомов каждого элемента в обеих частях уравнения. Например, реагенты X и Y 2 реагируют с образованием соединения XY. Словесное уравнение для этой реакции будет
X + Y 2 ⟶ XY
Число атомов элементов X и Y в вышеупомянутом уравнении показано ниже.
| Элемент | Количество атомов в правой части | Количество атомов в правой части |
| X | 1 | 1 |
| Y | 2 | 1 |
Для баланса Y с обеих сторон умножьте правую часть на 2, т. е.
е.
X + Y 2 ⟶ 2XY
Теперь уравновешено количество атомов Y, но не количество атомов X. Следовательно, умножьте X на левой стороне на 2. Таким образом, уравнение принимает вид
2X + Y 2 ⟶ 2XY
Это сбалансированное уравнение, поскольку количество атомов X и Y с обеих сторон равно.
Помня об этих шагах, давайте теперь напишем химическое уравнение образования оксида магния.
Шаг 1: Магний сгорает в кислороде с образованием оксида магния. Здесь реагентами являются магний и кислород. Продукт — оксид магния.
Шаг 2: Таким образом, словесное уравнение:
Магний + Кислород ⟶ Оксид магния
Шаг 3: Заменяя названия символами и формулами, мы получаем химическое уравнение как
Mg + O 2 ⟶ MgO
Шаг 4: Число атомов элементов составляют
| Элемент | Число атомов в LHS | Число атомов в RHS |
| Магний | 1 | 1 |
| Кислород | 2 | 1 |
Чтобы уравновесить кислород с обеих сторон, умножьте RHS на 2, т. е.е.,
е.е.,
Mg + O 2 ⟶ 2MgO
Теперь количество атомов кислорода уравновешено, а количество атомов магния — нет. Следовательно, умножьте магний на LHS на 2. Таким образом, уравнение принимает вид
2Mg + O 2 ⟶ 2MgO
Это вычисленное химическое уравнение.
Построение сбалансированных химических уравнений
Цель: Построение сбалансированных химических уравнений.
Материалы: Порошок карбоната меди (II), известковая вода, концентрированная соляная кислота, концентрированный раствор аммиака
, раствор нитрата свинца (II) и раствор йодида калия.
Аппарат: Пробирки, пробки, резиновая пробка с подающей трубкой, держатель для пробирок, горелка Бунзена и стеклянная пробирка.
Процедура:
A. Нагревание карбоната меди (II)
- Половину шпателя порошка карбоната меди (II) помещают в пробирку.
- Устройство настроено, как показано на рисунке.

Рисунок: Нагревание карбоната меди (II) - Карбонат меди (II) нагревается, и полученный газ пропускается через известковую воду.
- Наблюдаются изменения карбоната меди (II) и известковой воды.
- Когда реакция завершится, подающую трубку вынимают из известковой воды и снимают горелку Бунзена.
B. Образование хлорида аммония
- Используя стеклянную трубку, в пробирку капают три или четыре капли концентрированной соляной кислоты. Пробирку закрывают пробкой и оставляют на несколько минут.
- Используя чистую стеклянную трубку, шаг 1 повторяют с использованием концентрированного раствора аммиака.
- Обе пробки снимаются, и горловины пробирок соединяются, как показано на рисунке.
- Все наблюдения записываются.
C. Осаждение иодида свинца (II)
- 2 см 3 раствора йодида калия добавляют к 2 см 3 раствора нитрата свинца (II), как показано на рисунке.

- Смесь встряхивают и наблюдают за любыми изменениями.
Наблюдения:
| Раздел | Наблюдение | Вывод |
| A | Карбонат меди (II) меняет цвет с зеленого на черный. Известковая вода становится молочной. | Карбонат меди (II) разлагается на оксид меди (II), который имеет черный цвет. Выделяется углекислый газ. |
| B | Густые белые пары выделяются на входе в пробирки. | Белый дым — твердый хлорид аммония. |
| C | Образуется желтый осадок. | Желтый осадок — иодид свинца (II). |
Обсуждение:
- Когда карбонат меди (II) нагревается, он разлагается на оксид меди (II) и диоксид углерода.Присутствие углекислого газа определяется известковой водой.
- Следовательно, сбалансированное уравнение для нагревания карбоната меди (II):
- Концентрированная соляная кислота и концентрированный раствор аммиака оставляют на несколько минут для получения газообразного хлористого водорода и газообразного аммиака соответственно.

- Когда газообразный хлористый водород и газообразный аммиак объединяются, они реагируют с образованием мелких белых твердых частиц хлорида аммония. Они выглядят как густые белые пары.
- Сбалансированное уравнение для образования хлорида аммония:
- При добавлении бесцветного раствора нитрата свинца (II) к бесцветному раствору иодида калия образуется желтый осадок иодида свинца (II). Одновременно производится также бесцветный раствор нитрата калия.
- Вычисленное уравнение осаждения иодида свинца (II):
Качественные и количественные аспекты химических уравнений
- Химические уравнения дают нам следующую качественную информацию.
(а) Реагенты и продукты химической реакции.
(b) Физические состояния реагентов и продуктов. - В качестве примера возьмем следующее уравнение.
2C (т) + O 2 (г) ⟶ 2CO (г)
Из уравнения мы знаем, что реагентами являются твердый углерод и газообразный кислород. Продуктом реакции является газообразный оксид углерода.
Продуктом реакции является газообразный оксид углерода. - Количественно , коэффициенты в сбалансированном уравнении говорят нам точные пропорции реагентов и продуктов в химической реакции.
В качестве примера возьмем следующее уравнение.
Из уравнения мы знаем, что 2 моля нитрата меди (II) разлагаются на 2 моля оксида меди (II), 4 моля газообразного диоксида азота и 1 моль газообразного кислорода. - На микроскопическом уровне коэффициенты химической реакции говорят нам о количестве частиц 1, участвующих в реакции.
- Химическое уравнение играет важную роль; коммуникативный инструмент для химиков.
(a) Химическое уравнение точно описывает химическую реакцию.
(b) Химики используют химические уравнения для решения количественных задач.
Примечание:
- В качественном отношении газообразный водород реагирует с газообразным кислородом с образованием воды.
- Качественно 2 молекулы (или 2 моля) газообразного водорода реагируют с 1 молекулой (или 1 моль) газообразного кислорода с образованием 2 молекул (или 2 моль) воды.

Уравнения реакций — Chemistry LibreTexts
Ключевые слова
- Энергия, экзотермическая реакция, эндотермическая реакция
- Физические реакции, химические реакции, фазовые переходы
- Реактивы, продукты
- Стехиометрия реакции
Навыки для развития
- Чтобы отличить химические изменения от физических изменений.
- Написать химические уравнения для описания химической реакции.
- Чтобы сбалансировать химические уравнения.
- Для расчета требуемых количеств реагентов или количеств, образующихся в химической реакции.
Изменения в материале или системе называются реакциями , и они делятся на химические и физические реакции. Энергия — движущая сила всех изменений, как физических, так и химических реакций. В этих реакциях всегда участвует энергия.Если система более устойчива за счет потери некоторой энергии, происходит реакция с высвобождением энергии.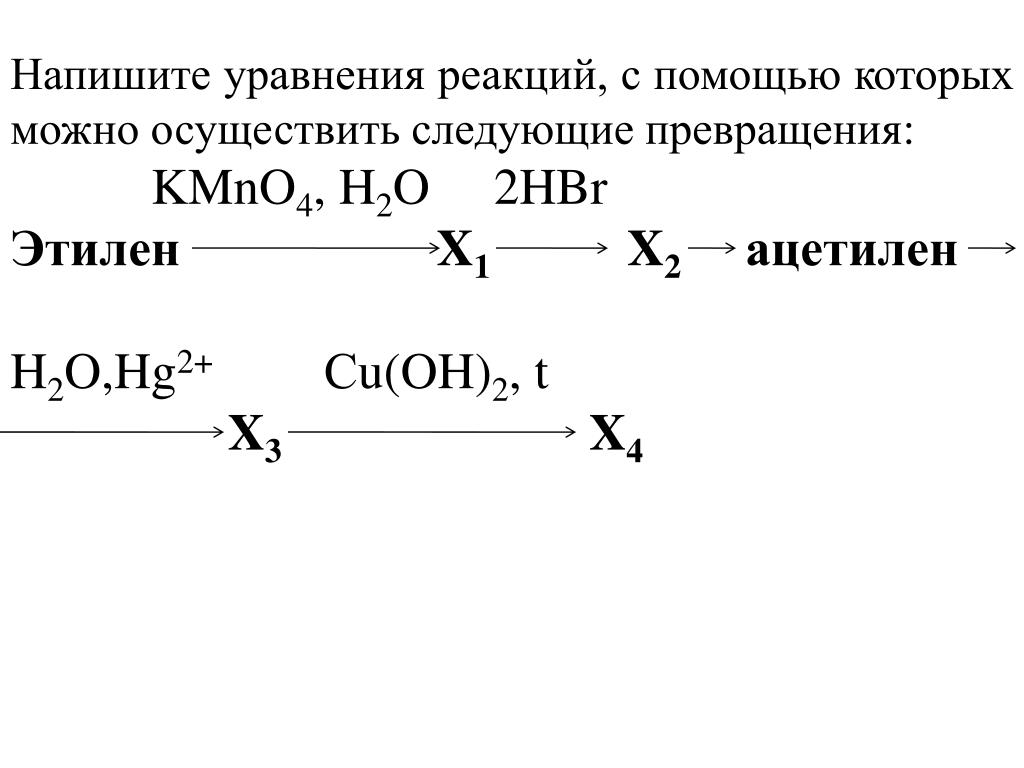 Такая реакция называется экзотермической . Подача энергии в систему также вызывает реакцию. Реакции поглощения энергии называются эндотермическими реакциями . Иногда количество энергии, участвующей в реакции, может быть настолько малым, что изменение энергии не сразу заметно.
Такая реакция называется экзотермической . Подача энергии в систему также вызывает реакцию. Реакции поглощения энергии называются эндотермическими реакциями . Иногда количество энергии, участвующей в реакции, может быть настолько малым, что изменение энергии не сразу заметно.
Уравнение может использоваться для описания физической реакции , которая включает изменение состояний.Например, плавление, сублимация, испарение и конденсация можно представить следующим образом. В этих уравнениях (s) обозначает твердое тело, (l) — жидкость (l) и (g) — газ.
- плавление: \ (\ mathrm {H_2O (s) \ rightarrow H_2O (l)} \)
- сублимация: \ (\ mathrm {H_2O (s) \ rightarrow H_2O (g)} \)
- испарение: \ (\ mathrm {C_2H_5OH (l) \ rightarrow C_2H_5OH (g)} \)
- конденсация: \ (\ mathrm {NH_3 (g) \ rightarrow NH_3 (l)} \)
При этих изменениях химические связи не разрываются и не образуются, а молекулярная идентичность веществ не изменилась.
Является ли фазовый переход между графитом и алмазом химической или физической реакцией?
\ (\ mathrm {C (графит) \ rightarrow C (алмаз)} \).
Кристаллическая структура алмаза и графита сильно различается, и связь между атомами углерода также различается в двух твердых состояниях. Поскольку химические связи разрываются и образуются новые связи, фазовый переход алмаза и графита является химической реакцией.
Химические вещества или вещества изменяются, превращаясь в одно или несколько других веществ, и эти изменения называются химическими реакциями .На молекулярном уровне атомы или группы атомов перестраиваются, что приводит к разрыву и образованию некоторых химических связей в химической реакции. Вещества, претерпевающие изменения, называются реагентами , а вновь образованные вещества называются продуктами . Внешний вид продуктов часто отличается от реагентов. Химические реакции часто сопровождаются появлением газа, огня, осадка, цвета, света, звука или запаха. Эти явления связаны с энергией и свойствами реагентов и продуктов.Например, при окислении пропана выделяется тепло и свет, а быстрая реакция — взрыв,
Эти явления связаны с энергией и свойствами реагентов и продуктов.Например, при окислении пропана выделяется тепло и свет, а быстрая реакция — взрыв,
\ (\ mathrm {C_3H_8 + 5 O_2 \ rightarrow 3 CO_2 + 4 H_2O} \)
Сбалансированное уравнение также показывает макроскопическую количественную зависимость. Это сбалансированное уравнение реакции показывает, что пять моль кислорода реагируют с одним моль пропана, образуя три моля диоксида углерода и четыре моля воды, всего 7 моль продуктов реакции сгорания.
На молекулярном уровне это уравнение показывает, что для каждой молекулы пропана требуется 5 молекул кислорода.Три атома углерода превращаются в три молекулы диоксида углерода, тогда как 8 атомов водорода в пропане окисляются до 4 молекул воды. Количество атомов \ (\ ce {H} \), \ (\ ce {C} \) и \ (\ ce {O} \) одинаково в обеих частях уравнения.
Мы изучаем свойства веществ, чтобы знать, как их использовать. Склонность вещества реагировать сама по себе или с другими веществами — важные химические свойства. Под свойствами мы понимаем химические реакции, которые лучше всего изучать путем экспериментов и наблюдений.Проведя множество экспериментов, вы можете обобщить определенные правила и факты. Знание этих правил и фактов позволяет вам решать проблемы, с которыми вы еще не сталкивались.
Под свойствами мы понимаем химические реакции, которые лучше всего изучать путем экспериментов и наблюдений.Проведя множество экспериментов, вы можете обобщить определенные правила и факты. Знание этих правил и фактов позволяет вам решать проблемы, с которыми вы еще не сталкивались.
Самый важный аспект химической реакции — знать, каковы реагенты и каковы продукты. Для этого лучше всего описать реакцию написать уравнение реакции. Уравнение химической реакции дает реагенты и продукты, а сбалансированное уравнение химической реакции показывает мольные отношения реагентов и продуктов.Часто указывается количество энергии, участвующей в реакции. Количественный аспект химических реакций называется стехиометрией реакции .
Например, когда грейфер \ (\ ce {CaCO3} \) нагревается, выделяется газ \ (\ ce {CO2} \), оставляя белый порошок (твердый \ (\ ce {CaO} \) ) позади. Уравнение реакции записывается как:
\ [\ mathrm {CaCO_3 \ rightarrow CaO + CO_2} \]
Уравнение показывает, что один моль \ (\ ce {CaCO3} \) дает по одному моль каждого из \ (\ ce {CaO} \) и \ (\ ce {CO2} \). Количества веществ, представленные химическими формулами, были введены на двух предыдущих страницах, и эти концепции должны помочь выяснить стехиометрию реакций, когда дано уравнение реакции.
Количества веществ, представленные химическими формулами, были введены на двух предыдущих страницах, и эти концепции должны помочь выяснить стехиометрию реакций, когда дано уравнение реакции.
Пример 1
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \ (\ ce {CaO} \), сколько оксида кальция должно быть получено? Если получено всего 5,0 грамма \ (\ ce {CaO} \), каков фактический выход?
СОВЕТ
В идеальных условиях количество вещества в уравнении реакции указано ниже:
\ (\ begin {alignat} {2}
\ ce {& CaCO_3 \ rightarrow && CaO + && CO_2} \\
& \: 100.0 && \: \: 56 && \: 44 \: \: \: \ mathrm {г / моль \: (формула \: веса)}
\ end {alignat} \)
\ [\ mathrm {10.0 \: g \: CaCO_3 \ times \ dfrac {1 \: mol \: CaCO_3} {100 \: g \: CaCO_3} \ times \ dfrac {1 \: mol \: CaO} {1 \: mol \: CaCO_3} \ times \ dfrac {56 \: g \: CaO} {1 \: mol \: CaO} = 5.6 \: g \: CaO} \]
ОБСУЖДЕНИЕ
Здесь приводится неэффективное преобразование, но метод показывает детали рассмотрения. Если полученное количество \ (\ ce {CaO} \) не составляет 5,6 г, можно сделать вывод, что образец не может быть чистым.
Если полученное количество \ (\ ce {CaO} \) не составляет 5,6 г, можно сделать вывод, что образец не может быть чистым.
Пример 2
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \ (\ ce {CaO} \), сколько \ (\ ce {CO2} \) выделяется при стандартных условиях?
СОВЕТ
\ [\ mathrm {CaCO_3 \ rightarrow CaO + CO_2} \]
\ [\ mathrm {10.0 \: g \: CaCO_3 \ times \ dfrac {1 \: mol \: CO_2} {100 \: g \: CaCO_3} \ times \ dfrac {22.4 \: L \: CO_2} {1 \: моль \: CO_2} = 2,24 \: L \: CO_2} \]
ОБСУЖДЕНИЕ
Мы сделали более короткий путь в этой рецептуре по сравнению с примером 1.Примеры 1 и 2 иллюстрируют оценку количеств в г и в л.
Написание уравнений для химических реакций
Уравнения химических реакций действительно отражают изменения материалов. Для многих реакций мы можем написать уравнения только для общих реакций. Например, здравый смысл подсказывает нам, что когда сахар полностью окисляется, конечными продуктами являются углекислый газ и вода. Реакция окисления такая же, как реакция горения. Таким образом, мы пишем
Например, здравый смысл подсказывает нам, что когда сахар полностью окисляется, конечными продуктами являются углекислый газ и вода. Реакция окисления такая же, как реакция горения. Таким образом, мы пишем
\ [\ ce {C12h32O11 + 12 O2 \ rightarrow 12 CO2 + 11 h3O} \]
Это иллюстрирует методы, используемые для написания уравнений сбалансированной реакции:
- Определите реагенты и продукты : В данном случае продуктами являются \ (\ ce {CO2} \) и \ (\ ce {h3O} \), определенные здравым смыслом.Мы знаем это.
- Примените фундаментальный принцип сохранения атомов. Число атомов каждого сорта должно быть одинаковым до и после реакции.
- Уравновесить один тип атомов в момент времени : Для начала мы можем использовать \ (\ ce {H} \) или \ (\ ce {C} \). Поскольку слева находится 12 атомов \ (\ ce {C} \), коэффициент для \ (\ ce {CO2} \) равен 12. Точно так же 22 \ (\ ce {H} \) атома производят 11 \ (\ ce {h3O} \) молекул.

- Сбалансируйте атомы кислорода с обеих сторон: Всего 35 атомов \ (\ ce {O} \) справа, а коэффициент для \ (\ ce {O2} \) должен быть 11.
Пример 3
Соединение \ (\ ce {N2O5} \) неустойчиво при комнатной температуре. Он разлагается с образованием коричневого газа \ (\ ce {NO2} \) и кислорода. Напишите сбалансированное уравнение химической реакции его разложения.
СОВЕТ
Первый шаг — написать несбалансированное уравнение, указывающее только реагент и продукты:
\ [\ ce {N2O5 \ rightarrow NO2 + O2} \]
Молекула \ (\ ce {N2O5} \) распадается на две молекулы \ (\ ce {NO2} \) и половину \ (\ ce {O2} \).
\ [\ ce {N2O5 \ rightarrow 2 NO2 + \ dfrac {1} {2} O2} \]
Чтобы дать уравнению целое число стехиометрических коэффициентов , мы умножаем все стехиометрические коэффициенты на 2.
\ [\ ce {2 N2O5 \ rightarrow 4 NO2 + O2} \]
ОБСУЖДЕНИЕ
Этот пример иллюстрирует шаги, используемые для написания сбалансированного уравнения химической реакции. Это сбалансированное уравнение не говорит нам, как распадается молекула \ (\ ce {N2O5} \), оно только иллюстрирует общую реакцию.
Это сбалансированное уравнение не говорит нам, как распадается молекула \ (\ ce {N2O5} \), оно только иллюстрирует общую реакцию.
Пример 4
При смешивании растворов \ (\ ce {CaCl2} \) и \ (\ ce {AgNO3} \) образуется белый осадок. Такой же осадок наблюдается при смешивании раствора \ (\ ce {NaCl} \) с раствором \ (\ ce {AgCh4CO2} \). Напишите сбалансированное уравнение реакции между \ (\ ce {CaCl2} \) и \ (\ ce {AgNO3} \).
СОВЕТ
Общие ионы между \ (\ ce {NaCl} \) и \ (\ ce {CaCl2} \) являются ионами \ (\ ce {Cl -} \), а ионы \ (\ ce {Ag +} \) являются общими между двумя серебросодержащими соединениями.2 +} \) и \ (\ ce {NO3 -} \) — ионов-наблюдателей.
Химические реакции
Одна из важнейших тем химии — химическая реакция . На этой странице мы сосредоточимся только на стехиометрии, выраженной уравнениями реакции. Другие темы, связанные с химическими реакциями:
- Избыточные и ограничивающие реагенты или реагенты, оставшиеся или использованные
- Особенности химических реакций или классификация реакций
- Химическая кинетика или скорости реакции
- Механизм реакции или как на самом деле протекает реакция
Балансировка окислительно-восстановительных реакций
Уравновешивание уравнений реакции окисления и восстановления немного сложнее, чем то, что мы обсуждали здесь. Вы должны уметь определять степени окисления, объяснять окисление и восстановление с точки зрения изменения степени окисления и писать уравнения половинных реакций. Тогда вы сможете сбалансировать окислительно-восстановительные реакции. Все это описано в следующем модуле по химическим реакциям.
Вы должны уметь определять степени окисления, объяснять окисление и восстановление с точки зрения изменения степени окисления и писать уравнения половинных реакций. Тогда вы сможете сбалансировать окислительно-восстановительные реакции. Все это описано в следующем модуле по химическим реакциям.
Проблемы развития навыков
- Какие продукты содержат углерод при сжигании метана \ (\ ce {Ch5} \) на воздухе?
Подсказка: \ (\ ce {CO2} \)
Обобщение:
Сжигание \ (\ ce {C} \) — содержащих соединений превращает все \ (\ ce {C} \) в \ (\ ce {CO2} \).
- Воспользуйтесь методом здравого смысла, чтобы найти молекулярную формулу сероводорода, молекулярная масса которого составляет 34,1. (Атомный вес, \ (\ ce {H} \) , 1,008; \ (\ ce {S} \) , 32,066)
Подсказка: \ (\ ce {h3S} \)
Обобщение:
Сера и кислород являются элементами группы 6 и образуют \ (\ ce {h3O} \) и \ (\ ce {h3S} \).
- Когда 30,0 г \ (\ ce {Al} \) (атомная масса 27,0) нагревается в кислороде (атомная масса 16.0) образуется оксид алюминия \ (\ ce {Al2O3} \) . Сколько оксида должно быть получено?
Подсказка: 56,7 г
A Вариант:
Сколько (в г) кислорода требуется?
- При нагревании \ (\ ce {KClO3} \) он разлагается с образованием твердого вещества \ (\ ce {KCl} \) и газообразного кислорода. Если собрать 0,500 моль \ (\ ce {O2} \) , сколько граммов \ (\ ce {KCl} \) должно быть получено? (Атомный вес: \ (\ ce {K} \) , 39.098; \ (\ ce {Cl} \) , 35.453)
Подсказка: 24,9 г
Предложенный метод:
Для реакции: \ (\ ce {2 KClO3 \ rightarrow 2 KCl + 3 O2} \)
предложенный рецептурный состав:
\ (\ mathrm {0. 50 \: mol \: O_2 \ times \ dfrac {2 \: mol \: KCl} {3 \: mol \: O_2} \ times \ dfrac {74.6 \: g \: KCl} {1 \: моль \: KCl} = \: ??.? \: g \: KCl} \)
50 \: mol \: O_2 \ times \ dfrac {2 \: mol \: KCl} {3 \: mol \: O_2} \ times \ dfrac {74.6 \: g \: KCl} {1 \: моль \: KCl} = \: ??.? \: g \: KCl} \)
- Раствор, содержащий чистый \ (\ ce {BaCl2} \) , обрабатывают избыточным количеством \ (\ ce {h3SO4} \) , а осадок \ (\ ce {BaSO4} \) собирается и сушится.Если собрать 13,2 г \ (\ ce {BaSO4} \) , сколько молей ионов \ (\ ce {Cl -} \) останется в растворе?
Атомный вес: \ (\ ce {H} \) , 1,008; \ (\ ce {O} \) , 16,00; \ (\ ce {S} \) , 32,06; \ (\ ce {Cl} \) , 35,45; \ (\ ce {Ba} \) , 137,33.
Намек: 0,113 моль
Варианты:
Сколько (в г) \ (\ ce {BaCl2} \) присутствует в растворе?
Сколько нитрата серебра требуется для осаждения всех хлорид-ионов?
Реакция следующая: \ (\ mathrm {BaCl_2 + H_2SO_4 \ rightarrow BaSO_4 + 2 H ^ + + 2 Cl ^ -} \). -} {1 \: mol \: BaSO_4} = 0,113 \: mol} \)
-} {1 \: mol \: BaSO_4} = 0,113 \: mol} \)
- Электростанция сжигает уголь, и этот процесс эквивалентен сжиганию 999 кг серы в день. Сколько кг \ (\ ce {SO2} \) выбрасывается в день, если на электростанции нет устройств контроля загрязнения для извлечения серы? Атомный вес: \ (\ ce {C} \) , 12,00; \ (\ ce {O} \) , 16,00; \ (\ ce {S} \) , 32.06.
Подсказка: 1998 кг
Дальнейшее рассмотрение:
Молекулярная масса \ (\ ce {SO2} \) примерно в два раза больше атомной массы \ (\ ce {S} \).Таким образом, вес \ (\ ce {SO2} \) вдвое больше веса \ (\ ce {S} \).
Варианты: Сколько (в молях и литрах) \ (\ ce {SO2} \) вырабатывается за день?
Если весь \ (\ ce {SO2} \) преобразовать в \ (\ ce {h3SO4} \), сколько (в моль и кг) серной кислоты образуется? (3055 кг)
- Сколько молей воды образуется, когда один моль пропана \ (\ ce {C3H8} \) сгорает в избыточном количестве воздуха?
Намек: 4 моля; \ (\ ce {C3H8 + 5 O2 \ rightarrow 3 CO2 + 4 h3O} \)
Skill:
Составьте уравнение реакции.
Варианты:
Сколько граммов воды будет произведено?
Сколько молей \ (\ ce {CO2} \) будет произведено?
- Смесь, содержащая \ (\ ce {Na2SO4} \) , но не содержащий других сульфатов, анализируют путем осаждения с \ (\ ce {BaCl2} \) . Образец смеси 2,37 г дает 2,57 г осадка \ (\ ce {BaSO4} \) . Какое процентное содержание \ (\ ce {Na2SO4} \) в смеси?
Подсказка: 66.0%
Навык:
Задача иллюстрирует стратегию химического анализа.
- Предположим, что 2,33 г смеси \ (\ ce {CaCl2} \) и \ (\ ce {Ca (NO3) 2} \) дает 2,22 г \ (\ ce {AgCl} \) когда \ (\ ce {Ag (NO3)} \) используется в качестве реагента для осаждения ионов хлорида \ (\ ce {Cl -} \) . Какое процентное содержание \ (\ ce {CaCl2} \) в смеси?
Подсказка: 36. 9%
9%
Атомный вес: \ (\ ce {N} \) , 14,0; \ (\ ce {O} \) , 16,0; \ (\ ce {Cl} \) , 35.5; \ (\ ce {Ca} \) , 40,1; \ (\ ce {Ag} \) , 107,9.
Навык:
Эта проблема также иллюстрирует стратегию химического анализа.
Авторы и авторство
химических реакций
химических реакцийХимическая промышленность Реакция
Поскольку атомы не создаются и не разрушаются в химическом реакции, общая масса продуктов в реакции должна быть такая же, как и общая масса реагентов.
Химические уравнения
Химические реакции описываются химическими уравнениями.
Пример: реакция между водородом и кислородом с образованием вода представлена следующим уравнением.
2 H 2 + O 2 2 H 2 O
Часто бывает полезно указать, реагенты или
продукты являются твердыми телами, жидкостями или газами, написав s , l ,
или г в скобках после символа реагентов или
продукты, как показано в следующих уравнениях.
2 H 2 ( г ) + O 2 ( г ) 2 H 2 O ( г )
2 Al ( s ) + Fe 2 O 3 ( s ) Al 2 O 3 ( s ) + 2 Fe ( l )
Потому что так много реакций происходит, когда решения двух растворенные в воде вещества смешиваются, специальный символ, вод. , используется для описания этих водных растворов .
Процесс растворения образца в воде будет обозначается следующими уравнениями.
| H 2 O | ||
| C 12 H 22 O 11 ( s ) | C 12 H 22 O 11 ( водн. ) |
Химическое уравнение — это утверждение того, что может случиться ,
не обязательно что произойдет . Следующее уравнение,
например, не гарантирует, что водород будет реагировать с
кислород с образованием воды.
Следующее уравнение,
например, не гарантирует, что водород будет реагировать с
кислород с образованием воды.
2 H 2 ( г ) + O 2 ( г ) 2 H 2 O ( г )
Можно наполнять баллон смесью водорода. и кислород, и вы обнаружите, что никакой реакции не происходит, пока вы не коснетесь воздушный шар с пламенем.Сбалансированное уравнение этой реакции описывает соотношение между количествами водорода и потребляется кислорода и образуется вода, если или когда эта реакция инициирован.
Уравнения на атомной и макроскопическая шкала
Химические уравнения могут использоваться для представления того, что происходит на либо в атомном, либо в макроскопическом масштабе.
2 H 2 ( г ) + O 2 ( г ) 2 H 2 O ( г )
Это уравнение можно прочитать одним из следующих способов.
- Если или когда водород вступает в реакцию с кислородом, две молекулы водорода и одна молекула кислорода расходуются на каждые две молекулы воды.
- Если или когда водород вступает в реакцию с кислородом, два моля водород и один моль кислорода расходуются на каждый произведено два моля воды.
Химические уравнения должны быть сбалансированы — они должны иметь то же самое количество атомов каждого элемента в обеих частях уравнения.В виде в результате масса реагентов должна быть равна массе продукты реакции. В атомном масштабе следующие уравнение сбалансировано, поскольку общая масса реагентов равна равняется массе изделий.
| 2 H 2 ( г ) | + | O 2 ( г ) | 2 H 2 O ( г ) | |
2 x 2 а.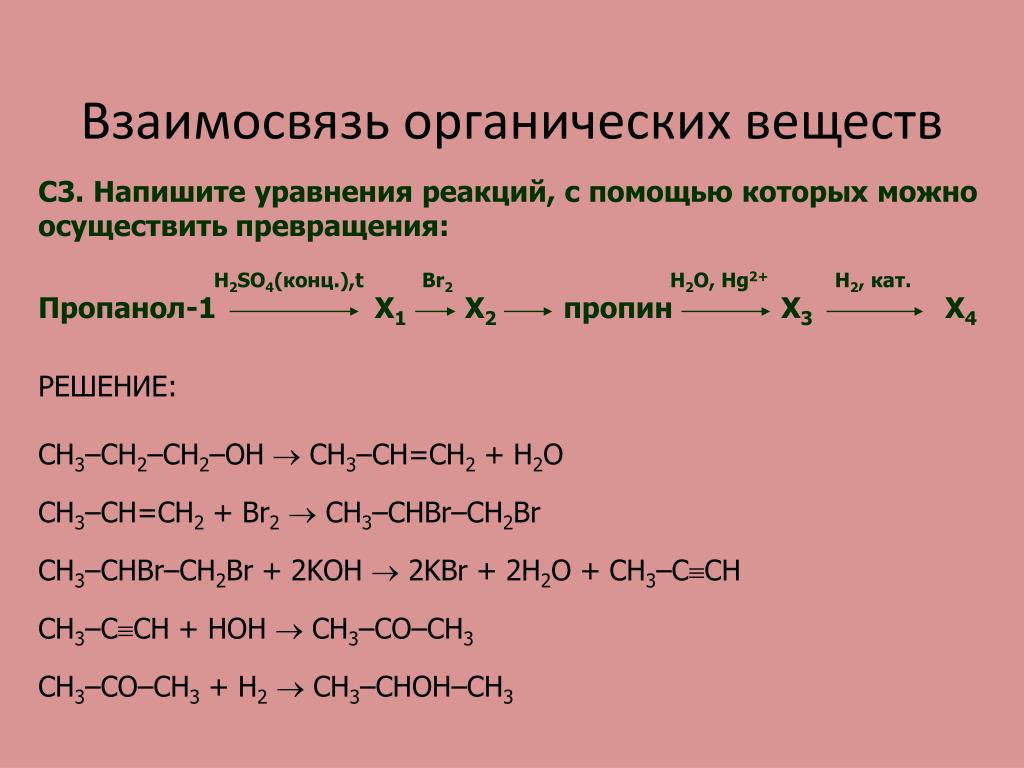 е.м. е.м. | + | 32 а.е.м. | 2 x 18 а.е.м. | |
| 36 а.е.м. | 36 а.е.м. | |||
В макроскопическом масштабе он уравновешен, потому что масса два моля водорода и один моль кислорода равны массе двух молей воды.
| 2 H 2 ( г ) | + | O 2 ( г ) | 2 H 2 O ( г ) | |
| 2 x 2 г | + | 32 г | 2 x 18 г | |
| 36 г | 36 г | |||
Балансирующий химикат Уравнения
Не существует последовательности правил, которым можно было бы слепо следовать, чтобы
получите сбалансированное химическое уравнение. Управляйте коэффициентами
написано перед формулами реагентов и продуктов
пока количество атомов каждого элемента по обе стороны от
уравнения такие же.
Управляйте коэффициентами
написано перед формулами реагентов и продуктов
пока количество атомов каждого элемента по обе стороны от
уравнения такие же.
Обычно неплохо взяться за самую легкую часть проблема первая.
Пример: рассмотрим, что происходит, когда пропан (C 3 H 8 ) горит на воздухе с образованием CO 2 и H 2 О. Первый то, что нужно искать, когда балансирующие уравнения являются отношениями между двумя сторонами уравнения.
_____ C 3 H 8 + _____ O 2 _____ CO 2 + _____ H 2 O
Легче сбалансировать атомы углерода и водорода в
уравнения, чем атомы кислорода в этой реакции, потому что все
атомы углерода в пропане попадают в CO 2 и все
атомы водорода попадают в H 2 O, но некоторые из
атомы кислорода попадают в каждое соединение. Это означает, что нет
способ предсказать количество молекул O 2 , которые
расходуется в этой реакции, пока вы не узнаете, сколько CO 2 и H 2 O образуются молекулы.
Для начала отметим, что в каждая молекула C 3 H 8 . Таким образом, три CO 2 молекулы образуются для каждого C 3 H 8 молекула израсходована.
1 C 3 H 8 + _____ O 2 3 CO 2 + _____ H 2 O
Если в каждом восемь атомов водорода C 3 H 8 молекулы должно быть восемь атомов водорода, или четыре H 2 O молекулы в правой части уравнения.
1 C 3 H 8 + _____ O 2 3 CO 2 + 4 H 2 O
Теперь, когда атомы углерода и водорода уравновешены, мы можем
попробуйте уравновесить атомы кислорода. В нем шесть атомов кислорода.
три молекулы CO 2 и четыре атома кислорода в четырех H 2 O
молекулы. Чтобы сбалансировать 10 атомов кислорода в продуктах этого
реакции нам понадобится пять молекул O 2 среди
реагенты.
1 C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O
Теперь есть три атома углерода, восемь атомы водорода и 10 атомов кислорода с каждой стороны уравнения. Таким образом, сбалансированное уравнение этой реакции записывается как следует.
C 3 H 8 ( г ) + 5 O 2 ( г ) 3 CO 2 ( г ) + 4 H 2 O ( г )
Мольные отношения
Сбалансированное химическое уравнение позволяет предсказать, что произойдет. когда происходит реакция.Мольное отношение преобразует моли одного соединения в сбалансированное химическое уравнение в моли другого соединения.
Пример: фейерверк, освещающий небо каждую четверть
Июль основан на реакции магния и кислорода на
образуют оксид магния.
2 мг ( с ) + O 2 ( г ) 2 MgO ( с )
Вычисленное уравнение реакции можно использовать для построить два единичных фактора , которые описывают соотношение между количеством потребляемого магния и кислорода в этой реакции.
Сосредоточив внимание на элементах этой проблемы, мы можем выбрать правильное мольное соотношение для преобразования молей магния в эквивалентное количество молей кислорода. Предположим, например, что мы хотим рассчитать количество молей кислорода, необходимое для сжигания 0,40 моль металлического магния.
| 0.40 моль Mg | x | 1 моль O 2 | = | 0,20 моль O 2 |
| 2 моль магния |
Прогнозирование массы Потребляемые реагенты или продукты, выделяемые в химической реакции
Сбалансированные химические уравнения могут использоваться для прогнозирования
соотношение между количествами израсходованных реагентов и
количества продуктов, образующихся в химической реакции.
Пример: чтобы спрогнозировать количество кислорода, которое необходимо вдохнуть. чтобы переварить 10,0 грамма сахара, мы можем предположить, что сахар в нашем диета приходит к нам как C 12 H 22 O 11 молекулы и что наши тела сжигают этот сахар в соответствии с следующее уравнение.
C 12 H 22 O 11 ( s ) + 12 O 2 ( г ) 12 CO 2 ( г ) + 11 H 2 O ( л )
Возможно, лучший способ начать — это спросить: «Что мы пытаетесь найти? «, а затем резюмируйте важные части информация в проблеме.
Цель : Узнать, сколько граммов O 2 расходуется при сжигании 10,0 граммов сахара.
Факт : Начнем с 10 граммов сахара.
Факт : сахар имеет формулу C 12 H 22 O 11 .
Факт : Рассчитанное уравнение этой реакции может быть
написано следующим образом.
С 12 В 22 О 11 + 12 О 2 12 CO 2 + 11 H 2 O
Поскольку мы знаем молекулярную массу сахара, мы можем преобразовать известную массу сахара на количество молей сахара.
Теперь у нас есть сбалансированное химическое уравнение, и мы знаем количество моль сахара в образце . Как шаг к цель задачи мы можем вычислить количество моль кислорода израсходовано в реакции. Уравнение для этого реакция предполагает, что 12 моль O 2 расходуются на каждый моль сахара в этой реакции. Таким образом, мы можем вычислить количество молей кислорода, необходимое для сжигания 0.02921 моль сахар следующим образом.
Теперь у нас есть необходимая информация, чтобы добраться до цели
наш расчет. Нам известно количество O 2 , потребленное в
эта реакция выражается в молях, и мы можем вычислить массу
0,3505 моль O 2 от молекулярной массы
кислород.
Согласно этому расчету требуется 11,2 грамма O 2 для сжигания 10.0 грамм сахара.
Ограничивающие реагенты
Требуется 1,70 г аммиака и 4,00 г кислорода, чтобы получают 3,00 грамма оксида азота по следующей реакции.
4 NH 3 ( г ) + 5 O 2 ( г ) 4 НО ( г ) + 6 H 2 O ( г )
Что произойдет с количеством NO, произведенного в этом
реакция, если оставить количество O 2 прежним (4.00 г)
но увеличивает количество присутствующего NH 3 изначально? Выход реакции останется прежним. Нет
сколько бы NH 3 мы ни добавили в систему, не более НЕТ
получается, потому что реакция исчерпывает O 2 до
весь NH 3 израсходован. Когда это происходит,
реакция должна прекратиться. Независимо от того, сколько NH 3 добавлено в
система, мы не можем получить более 3,00 граммов NO из 4,00
граммы кислорода.
Когда O 2 недостаточно для использования всего NH 3 в реакции количество O 2 ограничивает количество НЕТ, что может быть произведено. Таким образом, кислород ограничивает. реагент в этой реакции. Потому что там больше NH 3 чем нам нужно, это избыток реагента .
Концепция ограничивающего реагента важна, потому что химики часто запускаются реакции, в которых только ограниченное количество одного из реагенты присутствует.
Ключом к ограничению проблем с реагентами является следующая последовательность шагов.
|
|
|
|
|
|
Написание сбалансированных химических уравнений — Справка
Чтобы успешно ответить на этот вопрос, вам необходимо уметь переводить слова, обозначающие реагенты и продукты, в химические формулы. И вам нужно знать, как сбалансировать химическое уравнение.
И вам нужно знать, как сбалансировать химическое уравнение.Есть три шага к этому вопросу. На первом этапе вам нужно будет определить количество реагентов и продуктов. Это должно быть легко. Изучите приведенные слова и посчитайте количество реагентов и количество продуктов. Затем пролистайте графику, пока не найдете тот, который показывает такое количество реагентов и продуктов.
Второй шаг в этом вопросе немного сложнее. Вам нужно будет определить формулу каждого реагента и продукта.Если реагент является элементом, имейте в виду, что это может быть двухатомный элемент. Есть семь элементов, которые существуют в двухатомной форме, когда они не объединены с другими элементами в соединении или не присутствуют в водном растворе. Эти семь элементов — водород (H), кислород (O), азот (N), хлор (Cl), бром (Br), идоин (I) и фтор (F). Чтобы вспомнить этот список из 7 элементов, вы можете вспомнить имя HONClBrIF (произносится как «Хонклебриф»).
Если реагент или продукт представляет собой соединение, вам необходимо знать, как написать формулу соединения. Правила написания формул соединений зависят от того, является ли соединение молекулярным (два неметаллических элемента вместе) или ионным соединением (металлический элемент в сочетании с неметаллическим элементом). С правилами написания таких формул можно ознакомиться по двум ссылкам ниже.
Правила написания формул соединений зависят от того, является ли соединение молекулярным (два неметаллических элемента вместе) или ионным соединением (металлический элемент в сочетании с неметаллическим элементом). С правилами написания таких формул можно ознакомиться по двум ссылкам ниже.
После того, как вы определили формулы, пришло время для третьего и последнего шага вопроса — уравновешивания химического уравнения. Это процесс проб и ошибок, который включает в себя вставку коэффициентов перед формулами и выполнение подсчета атомов, чтобы увидеть, одинаково ли количество атомов каждого элемента в противоположных частях химического уравнения.На информационном рисунке ниже представлены некоторые подробности и пошаговая процедура для этого. Изучите информационный рисунок и примените принципы, чтобы сбалансировать уравнение в этом вопросе.
4.1 Составление и балансировка химических уравнений — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Получите химические уравнения из повествовательных описаний химических реакций.

- Напишите и сбалансируйте химические уравнения в молекулярном, общем ионном и чистом ионном форматах.
В более ранней главе этого текста было введено использование символов элементов для представления отдельных атомов. Когда атомы приобретают или теряют электроны, чтобы образовать ионы, или объединяются с другими атомами для образования молекул, их символы изменяются или комбинируются для создания химических формул, которые надлежащим образом представляют эти частицы. Расширение этой символики для представления как идентичностей, так и относительных количеств веществ, претерпевающих химическое (или физическое) изменение, требует написания и уравновешивания химического уравнения.Рассмотрим в качестве примера реакцию между одной молекулой метана (CH 4 ) и двумя молекулами двухатомного кислорода (O 2 ) с образованием одной молекулы диоксида углерода (CO 2 ) и двух молекул воды (H 2 O). . Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка 4. 2, а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
2, а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
Фигура 4.2 Реакция между метаном и кислородом с образованием диоксида углерода и воды (показана внизу) может быть представлена химическим уравнением с использованием формул (вверху).
Этот пример иллюстрирует фундаментальные аспекты любого химического уравнения:
- Вещества, вступающие в реакцию, называются реагентами, и их формулы помещаются в левой части уравнения.
- Вещества, образующиеся в результате реакции, называются продуктами, а их формулы помещаются в правую часть уравнения.
- Знак плюс (+) разделяет формулы отдельных реагентов и продуктов, а стрелка (⟶) (⟶) разделяет реагент и продукт (левую и правую) части уравнения.
- Относительные количества реагентов и продуктов представлены коэффициентами (числа, помещенные непосредственно слева от каждой формулы). Коэффициент 1 обычно не указывается.
Обычной практикой является использование наименьших возможных целочисленных коэффициентов в химическом уравнении, как это сделано в этом примере. Однако следует понимать, что эти коэффициенты представляют собой относительных чисел реагентов и продуктов, и, следовательно, их можно правильно интерпретировать как отношения.Метан и кислород реагируют с образованием диоксида углерода и воды в соотношении 1: 2: 1: 2. Это соотношение выполняется, если количество этих молекул составляет соответственно 1-2-1-2, или 2-4-2-4, или 3-6-3-6 и так далее (рисунок 4.3). Аналогичным образом, эти коэффициенты можно интерпретировать относительно любой единицы количества (числа), и поэтому это уравнение можно правильно прочитать многими способами, включая:
Однако следует понимать, что эти коэффициенты представляют собой относительных чисел реагентов и продуктов, и, следовательно, их можно правильно интерпретировать как отношения.Метан и кислород реагируют с образованием диоксида углерода и воды в соотношении 1: 2: 1: 2. Это соотношение выполняется, если количество этих молекул составляет соответственно 1-2-1-2, или 2-4-2-4, или 3-6-3-6 и так далее (рисунок 4.3). Аналогичным образом, эти коэффициенты можно интерпретировать относительно любой единицы количества (числа), и поэтому это уравнение можно правильно прочитать многими способами, включая:
- Одна молекула метана и две молекулы кислорода реагируют с образованием одной молекулы диоксида углерода и двух молекул воды.
- Одна дюжина молекул метана и две дюжины молекул кислорода вступают в реакцию с образованием одной дюжины молекул углекислого газа и двух дюжин молекул воды.

- Один моль молекул метана и 2 моля молекул кислорода реагируют с образованием 1 моль молекул углекислого газа и 2 моля молекул воды.
Фигура 4.3 Независимо от абсолютного числа задействованных молекул, отношения между числами молекул каждого вида, которые вступают в реакцию (реагенты), и молекулами каждого вида, которые образуются (продукты), одинаковы и задаются уравнением химической реакции.
Балансировочные уравнения
Химическое уравнение, описанное в разделе 4.1, сбалансировано, что означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено на сторонах реагента и продукта. Это требование, которому уравнение должно удовлетворять, чтобы соответствовать закону сохранения материи. Это можно подтвердить, просто суммируя количество атомов по обе стороны от стрелки и сравнивая эти суммы, чтобы убедиться, что они равны. Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на нижний индекс элемента в формуле.Если элемент присутствует более чем в одной формуле на данной стороне уравнения, количество атомов, представленных в каждой, необходимо вычислить, а затем сложить. Например, оба продукта реакции, CO 2 и H 2 O, содержат элемент кислород, поэтому количество атомов кислорода на стороне продукта уравнения составляет
Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на нижний индекс элемента в формуле.Если элемент присутствует более чем в одной формуле на данной стороне уравнения, количество атомов, представленных в каждой, необходимо вычислить, а затем сложить. Например, оба продукта реакции, CO 2 и H 2 O, содержат элемент кислород, поэтому количество атомов кислорода на стороне продукта уравнения составляет
Уравнение реакции между метаном и кислород для получения диоксида углерода и воды, как подтверждено, сбалансированы в соответствии с этим подходом, как показано здесь:
Ch5 + 2O2⟶CO2 + 2h3OCh5 + 2O2⟶CO2 + 2h3O| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| С | 1 × × 1 = 1 | 1 × × 1 = 1 | 1 = 1, да |
| H | 4 × × 1 = 4 | 2 × × 2 = 4 | 4 = 4, да |
| О | 2 × × 2 = 4 | (1 × × 2) + (2 × × 1) = 4 | 4 = 4, да |
Сбалансированное химическое уравнение часто можно получить на основе качественного описания некоторой химической реакции с помощью довольно простого подхода, известного как балансирование путем осмотра. Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированным химическим уравнением :
Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированным химическим уравнением :
Сравнение количества атомов H и O по обе стороны от этого уравнения подтверждает его дисбаланс:
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 1 × × 2 = 2 | 1 × × 2 = 2 | 2 = 2, да |
| О | 1 × × 1 = 1 | 1 × × 2 = 2 | 1 2, № |
Число атомов H в реагирующей и продуктивной частях уравнения одинаково, а количество атомов O — нет. Для достижения баланса коэффициенты уравнения могут быть изменены по мере необходимости. Имейте в виду, конечно, что индексы формулы частично определяют идентичность вещества, и поэтому они не могут быть изменены без изменения качественного смысла уравнения. Например, изменение формулы реагента с H 2 O на H 2 O 2 приведет к сбалансированному количеству атомов, но при этом также изменится идентичность реагента (теперь это перекись водорода, а не вода).Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2.
Для достижения баланса коэффициенты уравнения могут быть изменены по мере необходимости. Имейте в виду, конечно, что индексы формулы частично определяют идентичность вещества, и поэтому они не могут быть изменены без изменения качественного смысла уравнения. Например, изменение формулы реагента с H 2 O на H 2 O 2 приведет к сбалансированному количеству атомов, но при этом также изменится идентичность реагента (теперь это перекись водорода, а не вода).Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2.
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × × 2 = 4 | 1 × × 2 = 2 | 4 ≠ 2, № |
| О | 2 × × 1 = 2 | 1 × × 2 = 2 | 2 = 2, да |
Баланс атомов H был нарушен этим изменением, но его легко восстановить, изменив коэффициент для произведения H 2 на 2.
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × × 2 = 4 | 2 × × 2 = 4 | 4 = 4, да |
| О | 2 × × 1 = 2 | 1 × × 2 = 2 | 2 = 2, да |
Эти коэффициенты дают равное количество атомов H и O на сторонах реагента и продукта, поэтому сбалансированное уравнение имеет вид:
2h3O⟶2h3 + O22h3O⟶2h3 + O2Пример 4.1
Балансировка химических уравнений
Напишите сбалансированное уравнение реакции молекулярного азота (N 2 ) и кислорода (O 2 ) с образованием пятиокиси азота.
Решение
Сначала напишите неуравновешенное уравнение. N2 + O2⟶N2O5 (несимметричный) N2 + O2⟶N2O5 (несимметричный)Затем подсчитайте количество атомов каждого типа, присутствующих в несбалансированном уравнении.
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 1 × × 2 = 2 | 1 × × 2 = 2 | 2 = 2, да |
| О | 1 × × 2 = 2 | 1 × × 5 = 5 | 2 ≠ 5, № |
Хотя азот сбалансирован, необходимо изменить коэффициенты, чтобы сбалансировать количество атомов кислорода. Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O индексы в этих двух формулах).
Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O индексы в этих двух формулах).
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 1 × × 2 = 2 | 2 × × 2 = 4 | 2 ≠ 4, № |
| О | 5 × 2 = 10 | 2 × × 5 = 10 | 10 = 10, да |
Баланс атомов азота был нарушен этим изменением; восстанавливается изменением коэффициента для реагента N 2 на 2.
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 2 × × 2 = 4 | 2 × × 2 = 4 | 4 = 4, да |
| О | 5 × × 2 = 10 | 2 × × 5 = 10 | 10 = 10, да |
Число атомов N и O по обе стороны уравнения теперь равно, и уравнение сбалансировано.
Проверьте свои знания
Напишите сбалансированное уравнение разложения нитрата аммония с образованием молекулярного азота, молекулярного кислорода и воды. (Подсказка: балансируйте кислород в последнюю очередь, поскольку он присутствует более чем в одной молекуле в правой части уравнения.)
(Подсказка: балансируйте кислород в последнюю очередь, поскольку он присутствует более чем в одной молекуле в правой части уравнения.)Отвечать:
2Nh5NO3⟶2N2 + O2 + 4h3O2Nh5NO3⟶2N2 + O2 + 4h3OИногда удобно использовать дроби вместо целых чисел в качестве промежуточных коэффициентов в процессе балансировки химического уравнения. Когда баланс достигнут, все коэффициенты уравнения можно затем умножить на целое число, чтобы преобразовать дробные коэффициенты в целые числа без нарушения атомного баланса.Например, рассмотрим реакцию этана (C 2 H 6 ) с кислородом с образованием H 2 O и CO 2 , представленных несбалансированным уравнением:
C2H6 + O2⟶h3O + CO2 (несбалансированный) C2H6 + O2⟶h3O + CO2 (несбалансированный)Следуя обычному подходу к проверке, можно сначала уравновесить атомы C и H, изменив коэффициенты для двух видов продукта, как показано:
C2H6 + O2⟶3h3O + 2CO2 (несимметричный) C2H6 + O2⟶3h3O + 2CO2 (несимметричный) Это приводит к семи атомам O на стороне продукта уравнения, нечетному числу — нельзя использовать целочисленный коэффициент с реагентом O 2 для получения нечетного числа, поэтому вместо этого используется дробный коэффициент 72,72. чтобы получить предварительное сбалансированное уравнение:
чтобы получить предварительное сбалансированное уравнение:
Обычное сбалансированное уравнение с коэффициентами только для целых чисел получается путем умножения каждого коэффициента на 2:
2C2H6 + 7O2⟶6h3O + 4CO22C2H6 + 7O2⟶6h3O + 4CO2Наконец, что касается сбалансированных уравнений, напомним, что соглашение диктует использование наименьших целочисленных коэффициентов .Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
3Н2 + 9х3⟶6Нх43Н2 + 9х3⟶6Нх4коэффициенты не являются наименьшими возможными целыми числами, представляющими относительное количество молекул реагента и продукта. Разделив каждый коэффициент на наибольший общий множитель, 3, мы получим предпочтительное уравнение:
Н2 + 3х3⟶2Нх4Н2 + 3х3⟶2Нх4Ссылка на обучение
Воспользуйтесь этим интерактивным учебным пособием, чтобы попрактиковаться в уравнениях балансировки.
Дополнительная информация по химическим уравнениям
Физические состояния реагентов и продуктов в химических уравнениях очень часто указываются с аббревиатурой в скобках после формул. Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и водн. для веществ, растворенных в воде ( водных растворов , как было введено в предыдущей главе). Эти обозначения проиллюстрированы здесь в примере уравнения:
2Na (s) + 2h3O (l) ⟶2NaOH (водн.) + H3 (g) 2Na (s) + 2h3O (l) ⟶2NaOH (водн.) + H3 (g) Это уравнение представляет реакцию, протекающую при помещении металлического натрия в воду.Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистой форме, но легко растворяется в воде).
Особые условия, необходимые для реакции, иногда обозначаются написанием слова или символа над или под стрелкой уравнения. Например, реакция, проводимая при нагревании, может быть обозначена прописной греческой буквой дельта (Δ) над стрелкой.
CaCO3 (т) ⟶ΔCaO (т) + CO2 (г) CaCO3 (т) ⟶ΔCaO (т) + CO2 (г)Другие примеры этих особых условий будут рассмотрены более подробно в следующих главах.
Уравнения для ионных реакций
Учитывая обилие воды на Земле, само собой разумеется, что очень много химических реакций происходит в водных средах. Когда ионы участвуют в этих реакциях, химические уравнения могут быть записаны с различными уровнями детализации, соответствующими их предполагаемому использованию. Чтобы проиллюстрировать это, рассмотрим реакцию между ионными соединениями, протекающую в водном растворе. Когда водные растворы CaCl 2 и AgNO 3 смешиваются, происходит реакция с образованием водного Ca (NO 3 ) 2 и твердого AgCl:
CaCl2 (водный) + 2AgNO3 (водный) ⟶Ca (NO3) 2 (водный) + 2AgCl (s) CaCl2 (водный) + 2AgNO3 (водный) ⟶Ca (NO3) 2 (водный) + 2AgCl (s) Это сбалансированное уравнение , полученное обычным способом, называется молекулярным уравнением, потому что оно не представляет явным образом ионные частицы, присутствующие в растворе. Когда ионные соединения растворяются в воде, они могут диссоциировать на составляющие ионы, которые впоследствии гомогенно диспергируются по всему полученному раствору (подробное обсуждение этого важного процесса приведено в главе, посвященной растворам). Ионные соединения, растворенные в воде, поэтому более реалистично представлены как диссоциированные ионы, в данном случае:
Когда ионные соединения растворяются в воде, они могут диссоциировать на составляющие ионы, которые впоследствии гомогенно диспергируются по всему полученному раствору (подробное обсуждение этого важного процесса приведено в главе, посвященной растворам). Ионные соединения, растворенные в воде, поэтому более реалистично представлены как диссоциированные ионы, в данном случае:
В отличие от Эти три ионных соединения AgCl не растворяются в воде в значительной степени, что обозначено обозначением его физического состояния, s .
Явное представление всех растворенных ионов приводит к полному ионному уравнению. В этом конкретном случае формулы растворенных ионных соединений заменяются формулами их диссоциированных ионов:
Ca2 + (aq) + 2Cl− (aq) + 2Ag + (aq) + 2NO3− (aq) ⟶Ca2 + (aq) + 2NO3− (aq) + 2Ag Cl (s) Ca2 + (aq) + 2Cl− (aq) + 2Ag + (водн. ) + 2NO3− (водн.) ⟶Ca2 + (водн.) + 2NO3− (водн.) + 2Ag Cl (s)
) + 2NO3− (водн.) ⟶Ca2 + (водн.) + 2NO3− (водн.) + 2Ag Cl (s)Изучение этого уравнения показывает, что два химических вещества присутствуют в идентичной форме по обе стороны стрелки: Ca 2+ ( водн. ) и NO3- (водн.).NO3- (водн.). Эти ионы-наблюдатели — ионы, присутствие которых требуется для поддержания нейтральности заряда — ни химически, ни физически не изменяются в процессе, поэтому их можно исключить из уравнения, чтобы получить более сжатое представление, называемое чистым ионным уравнением:
Ca2 + (aq) + 2Cl− (aq) + 2Ag + (aq) + 2NO3− (aq) ⟶Ca2 + (aq) + 2NO3− (aq) + 2AgCl (s) 2Cl− (aq) + 2Ag + (aq) ⟶2AgCl ( s) Ca2 + (aq) + 2Cl− (aq) + 2Ag + (aq) + 2NO3− (aq) ⟶Ca2 + (aq) + 2NO3− (aq) + 2AgCl (s) 2Cl− (aq) + 2Ag + (aq) ⟶ 2AgCl (т)Следуя соглашению об использовании наименьших возможных целых чисел в качестве коэффициентов, это уравнение записывается следующим образом:
Cl− (водный раствор) + Ag + (водный раствор) ⟶AgCl (s) Cl− (водный раствор) + Ag + (водный раствор) ⟶AgCl (s) Это чистое ионное уравнение показывает, что твердый хлорид серебра может быть получен из растворенных ионов хлорида и серебра (I), независимо от источника этих ионов. Эти молекулярные и полные ионные уравнения предоставляют дополнительную информацию, а именно об ионных соединениях, используемых в качестве источников Cl — и Ag + .
Эти молекулярные и полные ионные уравнения предоставляют дополнительную информацию, а именно об ионных соединениях, используемых в качестве источников Cl — и Ag + .
Пример 4.2
Ионные и молекулярные уравнения
Когда диоксид углерода растворяется в водном растворе гидроксида натрия, смесь реагирует с образованием водного карбоната натрия и жидкой воды. Напишите сбалансированные молекулярные, полные ионные и чистые ионные уравнения для этого процесса.Решение
Начните с определения формул для реагентов и продуктов и их правильного оформления в форме химического уравнения: CO2 (водн.) + NaOH (вод.) ⟶Na2CO3 (водн.) + H3O (л) (несбалансированный) CO2 (водн.) + NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л) (несбалансированный)В этом случае баланс легко достигается путем изменения коэффициента для NaOH на 2, в результате чего получается молекулярное уравнение для этой реакции:
CO2 (водн. ) + 2NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л) CO2 (водн.) + 2NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л)
) + 2NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л) CO2 (водн.) + 2NaOH (водн.) ⟶Na2CO3 (водн.) + H3O (л)Два растворенных ионных соединения, NaOH и Na 2 CO 3 , могут быть представлены как диссоциированные ионы, чтобы получить полное ионное уравнение:
CO2 (водн.) + 2Na + (водн.) + 2OH− (водн.) ⟶2Na + (вод. ) + CO32− (водн.) + H3O (l)Наконец, определите ион-наблюдатель, в данном случае Na + ( водн. ), и удалите его с каждой стороны уравнения, чтобы получить чистое ионное уравнение:
CO2 (водн.) + 2Na + (водн.) + 2OH− (водн.) ⟶2Na + (водн.) + CO32− (водн.) + H3O (л) CO2 (водн.) + 2OH− (водн.) ⟶CO32− (водн. л) CO2 (водн.) + 2Na + (водн.) + 2OH− (водн.) ⟶2Na + (водн.) + CO32− (водн.) + h3O (l) CO2 (водн.) + 2OH− (водн.) ⟶CO32− (водн.) + h3O (л)Проверьте свои знания
Двухатомный хлор и гидроксид натрия (щелок) являются товарными химическими веществами, которые производятся в больших количествах вместе с двухатомным водородом путем электролиза рассола в соответствии со следующим несбалансированным уравнением: NaCl (водный) + h3O (l) → электричество NaOH (водный) + h3 (g) + Cl2 (g) NaCl (водный) + h3O (l) → электричество NaOH (водный) + h3 (g) + Cl2 (g) Напишите сбалансированные молекулярные, полные ионные и чистые ионные уравнения для этого процесса.
Отвечать:
2NaCl (водн.) + 2h3O (ж) ⟶2NaOH (водн.) + H3 (г) + Cl2 (г) (молекулярный) 2NaCl (водн.) + 2h3O (ж) ⟶2NaOH (водн.) + H3 (г) + Cl2 (г ) (молекулярный)2Na + (aq) + 2Cl− (aq) + 2h3O (l) ⟶2Na + (aq) + 2OH− (aq) + h3 (g) + Cl2 (g) (полный ионный) 2Na + (aq) + 2Cl− (aq) + 2h3O (l) ⟶2Na + (aq) + 2OH− (aq) + h3 (g) + Cl2 (g) (полностью ионный)
2Cl− (водн.) + 2h3O (l) ⟶2OH− (водн.) + H3 (g) + Cl2 (g) (чистый ионный) 2Cl− (водн. ) + Cl2 (г) (чистый ионный)
Химия: написание полных уравнений
Написание полных уравнений
Как и в рецептах, все химические уравнения включают практическую информацию для создания нашего продукта.В рецепте чили упоминалось, что мы должны «тушить не менее двух часов». В химических уравнениях мы используем несколько иные термины.
Ниже приведены символы, которые обычно используются в химических уравнениях для обозначения состояний продуктов и реагентов, а также требуемых условий реакции.
Символы состояния
Чтобы обозначить состояния продуктов и реагентов в реакции, мы пишем следующие символы в виде нижних индексов после каждого химического вещества в уравнении.
| Символ | Что это означает | Пример |
|---|---|---|
| (s) | Химическое вещество — твердое вещество | Fe (s) |
| (l) | Химическое вещество — жидкость | h3O (л) |
| (г) | Химическое вещество представляет собой газ | N 2 (г) |
| (водн.) | Химическое вещество растворено в воде | AgNO 3 (aq) |
Иногда легко определить, какие символы состояния следует использовать, а иногда нет.Например, вода часто бывает в жидкой форме. Однако, если мы проводим химическую реакцию, в которой требуется большое количество тепла, это может быть газ (пар).
Условия реакции
Часто символы пишутся вокруг стрелки в химической реакции, чтобы указать читателю, какие процедуры необходимо выполнить, чтобы химическая реакция произошла. Вот некоторые из наиболее распространенных символов:
| Символ | Что это означает |
|---|---|
| ? | Добавьте энергии / тепла к реагентам. |
| 100 C | Нагрейте реагенты до заданной температуры. |
| 2 атм. | Реагенты следует объединить при заданном давлении. |
| орошение | Непрерывно нагрейте реагенты до кипения и повторно конденсируйте пар. |
| химическая формула | Указанное химическое вещество необходимо для протекания реакции или является растворителем. |
| 3 часа | Реакция должна продолжаться в течение указанного количества времени. |
Стрелки
w3.org/1999/xhtml»> У вас проблемы Задача 2: Напишите полные химические уравнения для следующих реакций:
(a) Когда растворенный нитрат свинца (II) добавляют к водному раствору иодида калия, свинец (II) ) иодид выпадает в осадок с образованием растворенного нитрата калия.
(b) При нагревании порошка железа в присутствии газообразного кислорода образуется порошок оксида железа (III).
Иногда можно увидеть стрелки, написанные сразу после химической формулы продуктов химической реакции.Стрелка, направленная вверх (как в случае с CO2?), Указывает на то, что продукт будет образовывать газ, который будет пузыриться из раствора. Стрелка, указывающая вниз (как в PbI2?), Указывает на то, что продукт самопроизвольно выпадет в осадок из раствора. («Осаждение» в этом смысле означает образование твердого вещества из комбинации двух водных растворов.)
Символы, которые я указал в предыдущей таблице, ни в коем случае не единственные, которые вы найдете в химических уравнениях. ; в зависимости от типа вашей реакции могут быть и другие.Однако их чаще всего можно увидеть на вводном курсе химии.
; в зависимости от типа вашей реакции могут быть и другие.Однако их чаще всего можно увидеть на вводном курсе химии.
В качестве примера добавим соответствующие символы в уравнение образования воды из водорода и кислорода. Реакция протекает следующим образом: при добавлении энергии к смеси газов водорода и кислорода образуется пар. Используя символы, которые мы обсуждали, полное уравнение этой реакции:
- 2 H 2 (г) + O 2 (г) ? ? 2 H 2 O 2 (g)
Выдержка из The Complete Idiot’s Guide to Chemistry 2003, написанного Яном Гучем.Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon. com и Barnes & Noble.
com и Barnes & Noble.
Word Уравнения для химических реакций Учебное пособие
Ключевые концепции
- В ходе химической реакции вещества реагируют с образованием новых веществ.
- Вещества, с которых мы начинаем, называются реагентами.
Реагенты могут быть элементами или соединениями.
- Новые производимые вещества называются продуктами.
Продукты могут быть элементами или соединениями.
- Словесное уравнение — это сокращенный способ описания химической реакции.
реагент (-ы) → продукт (-ы)
- Словесное уравнение показывает названия реагентов слева.
Если присутствует более одного реагента, названия каждого реагента разделяются знаком плюс (+).
- Стрелка показывает направление реакции: →
- Словесное уравнение показывает названия продуктов справа от стрелки.
Если присутствует более одного продукта, названия каждого продукта разделяются знаком плюс (+).
- Иногда условия, необходимые для протекания химической реакции, такие как тепло или свет, будут указаны над стрелкой.

реактивы тепло
→товаров - Общая форма словесного уравнения показана ниже:
реактивы → товаров Общее словесное уравнение: Реагент A + Реагент B → продукт C + изделие D
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Идентификация реагентов и продуктов в химических реакциях
Реагенты — это вещества, с которых мы начинаем.
Продукты — это новые вещества, которые образуются в результате химической реакции между реагентами.
Реагенты и продукты могут быть элементами или соединениями.
Элемент имеет имя, состоящее из одного слова.
Вы можете найти названия элементов в периодической таблице элементов.
Названия партий металлических элементов заканчиваются на «ium», например sod ium , calc ium , magnes ium , alumin ium (ПРИМЕЧАНИЕ, hel ium является исключением, потому что это элемент но это неметалл!).
Но названия некоторых металлов не оканчиваются на «ium», например, железо, серебро, золото, медь, цинк, свинец, ртуть, никель.
Названия некоторых неметаллических элементов оканчиваются на «ине», например, фтор ине , хлор ине , бром ине , йод ине .
Названия других неметаллов заканчиваются на «en», например, Hydrog en , oxyg en , nitrog en .
Имена некоторых неметаллических элементов заканчиваются на «on», например, carb на , ne на , arg на , krypt на , rad на .
Фосфор и сера также являются неметаллами.
Обычно название соединения состоит из двух слов.
Есть много исключений! Например, вода — это соединение, аммиак — это соединение, этанол — это соединение. Однако вы не найдете этих названий в периодической таблице элементов, поэтому это НЕ элементы, мы делаем вывод, что они должны быть составными.
Чтобы определить, смотрите ли вы на имя двух элементов или на имя соединения, мы можем воспользоваться подсказками из грамматики английского языка.
Если я хочу перечислить элементы, я разделяю два названия знаком «и», например, натрий и кислород .
Но, если я имею в виду название соединения, то «и» будет отсутствовать, например, оксид натрия — это название соединения.
Если я хочу разделить имена более чем двух элементов, я использую запятую, например, водород, углерод и кислород (список из 3 элементов).
Но гидрокарбонат (одно слово) или гидрокарбонат (два слова, но не и между ними) — это название соединения.
Давайте посмотрим, сможем ли мы идентифицировать названия реагентов (веществ, с которых мы начинаем) в следующем описании химической реакции:
Когда кусок цинка помещается в стакан, содержащий соляную кислоту , на поверхности металла образуются пузырьки водорода.
Для этой химической реакции у нас есть два вещества для начала, то есть у нас есть два реагента. Два реагента:
- цинк
(название элемента, являющегося металлом, вы найдете это имя в периодической таблице) - соляная кислота
(название соединения, у нас есть два слова без «и» между ними, и вы не найдете этого названия в периодической таблице).
Давайте посмотрим, сможем ли мы идентифицировать новое произведенное вещество, то есть найдем название продукта этой химической реакции:
Когда кусок цинка помещается в стакан, содержащий соляную кислоту, на поверхности металла образуются пузырьки водорода .
Водород — это продукт, это новое вещество, которое образуется, когда мы смешиваем реагенты (цинк и соляную кислоту) вместе.
Водород НЕ присутствовал вначале, он образовался в результате химической реакции.
Рассмотрим приведенное ниже описание приготовления сульфата бария, белого твердого вещества, которое используется в медицине (известного как «бариевая мука»):
Сульфат бария можно получить добавлением серной кислоты к раствору нитрата бария.
Какие реагенты вступают в эту химическую реакцию?
Реагенты — это вещества, с которых мы начинаем, серная кислота, которую мы добавляем к нитрату бария, поэтому есть два реагента; серная кислота и нитрат бария.
Что является продуктом этой химической реакции?
Продукт — это новое производимое вещество (или изготовленное, или сформированное, или приготовленное).
Информация говорит нам, как приготовить сульфат бария, то есть эта химическая реакция будет производить (или производить) сульфат бария, следовательно, продукт химической реакции — сульфат бария.
Написание словесных уравнений для химических реакций
Химические реакции происходят вокруг вас каждый день и каждую ночь.
На обед у меня был бутерброд.
Хлеб в бутерброде содержит крахмал.
Когда я ем крахмал, во рту происходит химическая реакция, которая расщепляет крахмал на сахара.
Продолжая жевать бутерброд, я чувствую сладость этих сахаров в процессе их производства.
Если я хочу написать словесное уравнение для представления этой химической реакции, первое, что мне нужно сделать, это определить названия реагентов и продуктов.
Реагент — это вещество, с которого мы начинаем, вещество, которое присутствует до начала химической реакции.
Реагентом в моем хлебе является крахмал.
Продукт реакции — это вещество, которое образуется или производится в результате протекающей химической реакции.
Продукт химической реакции, когда я ем крахмал, — это сахара, которые образуются.
Словесное уравнение показывает реакцию реагента с образованием продукта:
реагент → продукт
Стрелка в общей форме приведенного выше уравнения показывает направление, в котором протекает химическая реакция:
, то есть мы начинаем с «реагента» и заканчиваем «продуктом».
Чтобы написать словесное уравнение, описывающее химическую реакцию, я должен:
- напишите название реагента (крахмала)
- нарисуйте стрелку, чтобы указать направление химической реакции, →
- напишите название продукта (сахара) справа от стрелки
Итак, мое словесное уравнение для расщепления крахмала на сахар во рту:
| реагент | → | товар | |
|---|---|---|---|
| слово уравнение | крахмал | → | сахара |
Реагент может распадаться с образованием более одного нового вещества, то есть более одного продукта.
Сегодня я выпил банку колы с бутербродом на обед. Кола — это газированный напиток (или газировка), и он газированный, потому что постоянно образуются пузырьки углекислого газа. Эти пузыри пробиваются сквозь ваш напиток, пока не достигают поверхности, откуда они наконец могут выбраться и присоединиться к атмосфере. Этот газообразный диоксид углерода образуется, когда углекислота в напитке разлагается (распадается). Другой продукт этой химической реакции — вода.
Я хочу написать уравнение для описания химической реакции, в которой углекислота разлагается с образованием диоксида углерода и воды:
реагент → продукты
Чтобы написать словесное уравнение, описывающее химическую реакцию, я должен:
- напишите название реагента (углекислота)
- нарисуйте стрелку, чтобы указать направление химической реакции, →
- напишите названия каждого продукта, разделенные знаком плюс (+) справа от стрелки (диоксид углерода + вода)
Итак, мое словесное уравнение для разложения угольной кислоты в моем напитке кола:
| реагент | → | товаров | |||
|---|---|---|---|---|---|
| слово уравнение | угольная кислота | → | двуокись углерода | + | вода |
В химической реакции может присутствовать более одного реагента.
Только после того, как я закончил обед и испытал дискомфорт от несварения желудка, я вспомнил, почему я никогда не пью газированные напитки. Расстройство желудка вызвано повышенным уровнем кислоты в желудке. В желудке содержится кислота, известная как соляная кислота. Я могу нейтрализовать избыток соляной кислоты, приняв таблетку от расстройства желудка. Мои таблетки от расстройства желудка содержат вещество, известное как карбонат кальция. Карбонат кальция реагирует с некоторым количеством соляной кислоты с образованием хлорида кальция, воды и газообразного диоксида углерода.Углекислый газ выделяется в виде приятной отрыжки, от которой вы чувствуете себя намного лучше!
Я хочу написать словесное уравнение для описания химической реакции, в которой соляная кислота реагирует с карбонатом кальция с образованием хлорида кальция, диоксида углерода и воды:
реактивы → продукты
Чтобы написать словесное уравнение, описывающее химическую реакцию, я должен:
- напишите названия каждого из реагентов, разделенных знаком плюс (+) (соляная кислота + карбонат кальция)
- нарисуйте стрелку, чтобы указать направление химической реакции, →
- напишите названия каждого продукта, разделенные знаком плюс (+) справа от стрелки (хлорид кальция + диоксид углерода + вода).

Итак, мое словесное уравнение для реакции, протекающей между соляной кислотой и карбонатом кальция, выглядит следующим образом:
| реактивы | → | товаров | |||||||
|---|---|---|---|---|---|---|---|---|---|
| слово уравнение | соляная кислота | + | карбонат кальция | → | хлорид кальция | + | двуокись углерода | + | вода |
Расшифровка словарного уравнения
Словесное уравнение — это быстрый и сокращенный способ сообщить нам название реагента (ов), который нам нужно использовать для химической реакции, и названия нового вещества (веществ), продукта (ов), которые будет производиться в результате химической реакции.
Если мы видим записанное словесное уравнение, мы можем следовать указаниям, которые оно дает, чтобы создать новое вещество (а).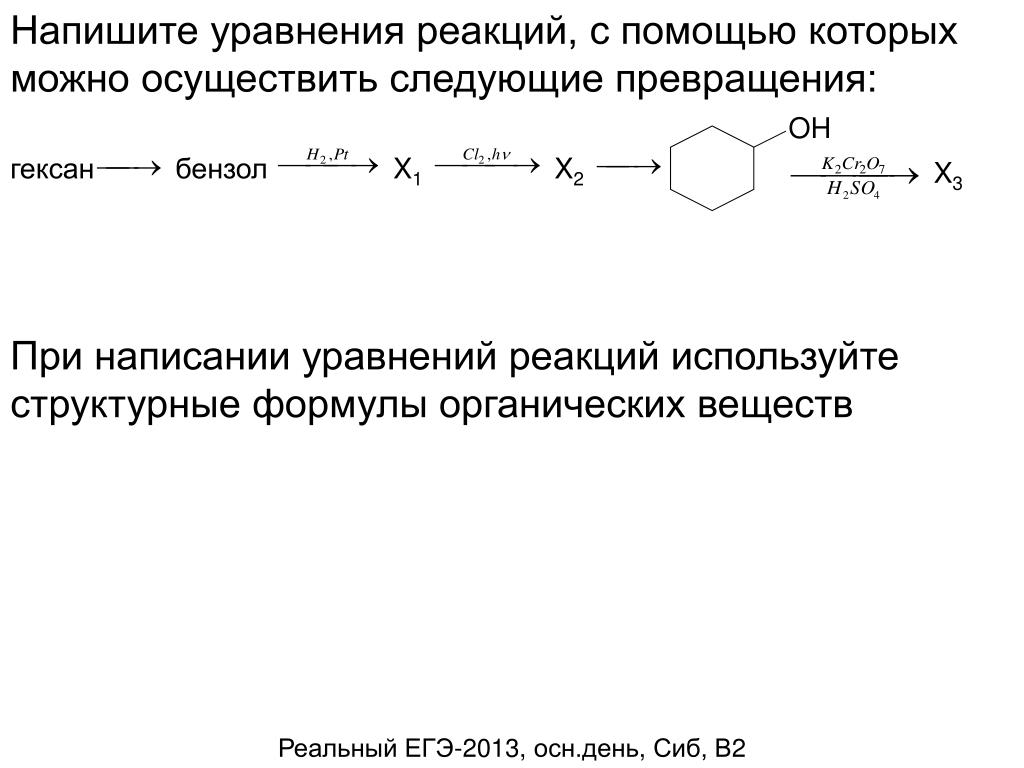
Например, рассмотрим приведенное ниже уравнение слова:
магний + кислород → оксид магния
Это химическое уравнение говорит нам, что если мы подвергнем магний (блестящий металл) воздействию кислорода (бесцветный газ в атмосфере), будет образовано новое вещество, называемое оксидом магния (которое представляет собой серо-белое твердое вещество).
Вот еще один пример словесного уравнения:
соляная кислота + железо → хлорид железа + водород
Это химическое уравнение говорит нам, что если мы добавим соляную кислоту к железу (металлу) в лабораторном стакане, то они будут реагировать с образованием двух новых веществ; хлорид железа и водород (бесцветный газ, который легко горит).
В равной степени он говорит нам, что если бы мы съели немного железа, тогда, когда это железо достигло нашего желудка, содержащего соляную кислоту, произошла бы химическая реакция, в которой образовались бы хлорид железа и водород.Газообразный водород будет отрыгивать!
Если я добавляю соляную кислоту к железу, я получаю хлорид железа и водород.
Если я добавляю железо к соляной кислоте, я получаю хлорид железа и водород.
Порядок, в котором мы перечисляем реагенты, не имеет значения. Но реагенты ДОЛЖНЫ быть написаны слева от стрелки (→).
Порядок, в котором мы перечисляем товары, не имеет значения. Но продукты ДОЛЖНЫ быть написаны справа от стрелки (→).
Химическая реакция между железом и соляной кислотой с образованием хлорида железа и водорода может быть описана любым из следующих способов, потому что все они представляют одну и ту же химическую реакцию:
соляная кислота + железо → хлорид железа + водород
железо + соляная кислота → хлорид железа + водород
железо + соляная кислота → водород + хлорид железа
соляная кислота + железо → водород + хлорид железа
Решение проблем
| Задача: Химик Крис собрал группу студентов на улице для демонстрации химической реакции. Когда студенты находились на безопасном расстоянии, Крис очень осторожно добавил небольшой кусочек металлического натрия в немного воды в стакане. Студенты ахнули от изумления, когда маленький кусочек натрия полетел в химическом стакане, а газообразный водород вырвался из стакана. Когда химическая реакция закончилась и химический стакан остыл на ощупь, Крис и студенты проанализировали другой продукт реакции и обнаружили, что это соединение, известное как гидроксид натрия.Гидроксид натрия является активным ингредиентом многих бытовых продуктов, предназначенных для очистки забитых сточных вод. Напишите уравнение для описания химической реакции, которую Крис продемонстрировал студентам. |
Решение проблемы
(с использованием подхода StoPGoPS к решению проблем)
| СТОП | СТОП! Задайте вопрос. | ||||||||||||||||||||||||||
| Что вас просят сделать? Напишите словесное уравнение. | |||||||||||||||||||||||||||
| ПАУЗА | ПАУЗА для подготовки плана игры | ||||||||||||||||||||||||||
| (1) Какую информацию (данные) вы указали в вопросе? (а) Название реагентов: натрий и вода (б) Наименование продуктов: водород и гидроксид натрия (2) Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить? Общее словесное уравнение: реагент (-ы) → продукт (-ы) Название каждого реагента отделено знаком плюс (+) с левой стороны стрелки. Название каждого продукта отделено знаком плюс (+) с правой стороны стрелки. | |||||||||||||||||||||||||||
| ГО | GO с планом игры | ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| ПАУЗА | ПАУЗА, чтобы обдумать правдоподобие | ||||||||||||||||||||||||||
| Вы ответили на вопрос? Да, мы написали словесное уравнение. Правдоподобен ли ваш ответ? Расшифруйте написанное вами словесное уравнение, чтобы попытаться воссоздать демонстрацию Криса. | |||||||||||||||||||||||||||
 Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества. 
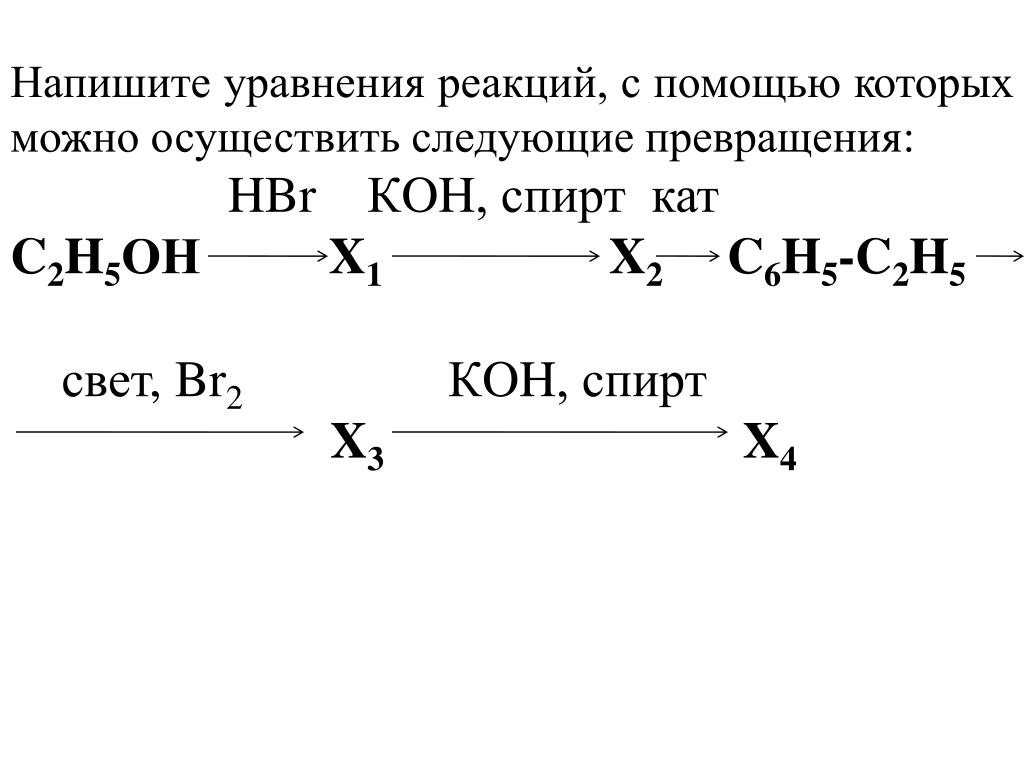


 Продуктом реакции является газообразный оксид углерода.
Продуктом реакции является газообразный оксид углерода.