Кислород и сера в природе, их получение
Многие колебания распространенностей изотопов в природе являются следствием химического обмена, а также различной скорости химических реакций для различных изотопов. Известны химические реакции, при которых может происходить изотопное обогащение водорода, бора, лития, углерода, азота, кислорода, серы и некоторых других элементов. Так же как и в двух предыдущих процессах, для получения большого коэффициента разделения необходимо использовать противоток. В случае обмена лития использовали две несмешивающиеся жидкости различной плотности амальгама лития и спиртовый раствор хлористого лития но обычно для получения противотока газ пропускают через жидкость. Примером получения высокообогащенных изотопов является выделение изотопа с чистотой 99,8% [914[ [c.460]Кислород и сера в природе, их получение. . . 10. Применение кислорода, серы и их соединений. [c.316]
Соотношение между серой, металлами и кислородом. Сера в природе. Извлечение (391), свойства, изменения серы. Диморфизм и аллотропия серы. ]3ес ее частицы. Сероводород (403), образование, получение, свойства, реакции с металлическими солями. Свойства сернистых металлов (415). Многосернистый водород. [c.58]
Только некоторые металлы находятся в природе в самородном состоянии, большинство же их прочно связано с атомами кислорода (оксиды), серы (сульфиды), в силикатных минералах. Наименее активные металлы, расположенные в ряду стандартных электродных потенциалов между оловом и золотом, встречаются как в свободном состоянии (самородные металлы), так и в виде соединений с другими химическими элементами. Активные металлы находятся в природе только в соединениях с другими химическими элементами и входят в состав минералов и горных пород. Минералы и горные породы, пригодные для промышленного получения металлов, называются рудами, а месторождения металлов, которые экономически целесообразно разрабатывать на данном уровне развития технологии, называются рудными месторождениями. [c.142]
Получение простых веществ из их природных соединений есть всегда окислительно-восстановительный процесс, кроме тех случаев, когда простые вещества встречаются в самородном состоянии. В последнем случае их обычно выделяют из смесей физическими методами (разгонка сжиженного воздуха при получении N2, Оз, благородных газов, процессы флотации и т. п.). Все металлы (кроме самородных) находятся в природе в окисленном состоянии и их выделение из соединений сводится к восстановлению. Неметаллы в природных соединениях могут находиться как в окисленном, так и в восстановленном состоянии. При этом наиболее активные неметаллы (галогены, кислород) находятся в природных соединениях исключительно в восстановленном состоянии. Халькогены находятся преимущественно в восстановленном состоянии, хотя, например, в сульфатах сера окислена. Азот, фосфор, кремний, бор, сурьма, висмут в природе встречаются всегда в окисленной форме (нитраты, фосфаты, силикаты, сульфиды сурьмы и висмута и т. п.).
Серовато-белый металл относительно мягкий, очень тягучий, ковкий, тугоплавкий. В особых условиях образует губчатую платину (с сильно развитой поверхностью), платиновую чернь (тонкодисперсный порошок) и коллоидную платину. Благородный металл занимает последнее (самое электроположительное) место в электрохимическом ряду напряжений. Легко сплавляется с платиновыми металлами (кроме рутения и осмия), а также с Fe, Со, Ni, u, Au и другими, с трудом сплавляется с Sb, Bi, Sn, Pb, Ag. Химически весьма пассивный не реагирует с водой, кислотами (за исключением царской водки ), щелочами, гидратом аммиака, монооксидом углерода. Переводится вводный раствор хлороводородной кислотой, насыщенной С1г. При нагревании окисляется кислородом, галогенами, серой, при комнатной температуре тетрафторидом ксенона Губчатая платина и платиновая чернь активно поглощают значительное количество Нг, Не, О2. В природе встречается в самородном виде (в сплавах с Ru. Rh, Pd, Os, Ir). Получение см. 907 917 919 [c.454]
Желтый металл, более мягкий, чем медь и серебро ковкий, тяжелый, высокоплавкий. Устойчив в сухом и влажном воздухе. В особых условиях образуется коллоидное золото. Благородный металл не реагирует с водой, кислотами-не-окислителями, концентрированными серной и азотной кислотами, щелочами, гидратом аммиака, кислородом, азотом, углеродом, серой. В растворе простых катионов не образует. Переводится в раствор действием царской водки , смесями галогенов и галогеноводородных кислот, кислородом в присутствии цианидов щелочных металлов. При нагревании реагирует с галогенами, селеновой кислотой. Окисляется нитратом натрия при сплавлении, дифторидом криптона. Со ртутью образует амальгаму. В природе встречается в самородном виде. Получение см. 57б 579 580 .
Серебристо-белый металл семейства платины очень твердый, хрупкий, весьма тугоплавкий, высококипящий. В особых условиях получен коллоидный иридий. Благородный металл не реагирует с водой, кислотами, царской водкой , щелочами, гидратом аммиака. Катион 1г » в растворе окрашен в желтый цвет. Переводится в раствор концентрированной хлороводородной кислотой в присутствии О2. Реагирует с сильными окислителями (при сплавлении), кислородом, галогенами, серой. Встречается в природе в самородном виде (сплавы с осмием и платиной). Получение см. 895 , 897 , 899 , 900 , 901 . [c.450]
Этот метод получения масел отличается тем, что при гидрировании исходного сырья происходят глубокие химические изменения некоторых его компонентов, которые зависят от режима гидрирования и природы взятого катализатора. При этом из сырья удаляется значительная часть серы, азота и кислорода, а органические соединения, содер-жаш ие эти элементы, претерпевают глубокие изменения. Ароматические углеводороды полностью или частично гидрируются при более жестких режимах гидрирования происходит распад парафиновых и нафтеновых углеводородов. [c.60]
Возможно, что влияние уксусного ангидрида заключается в разрушении ассоциатов гетероатомных соединений нефти и высвобождении из них оснований. Уже неоднократно отмечалось, что при выделении нефтяных оснований в виде концентратов в последние попадает значительное количество сернистых и кислородных соединений. Извлечение этих соединений, идущее симбатно с извлечением оснований, нельзя объяснить повышенной растворимостью их в водных или водно-спиртовых растворах минеральных кислот. Более детальное изучение состава концентратов показало, что разделение, например, азотистых соединений, обладающих свойствами оснований и сульфидов,
Нахождение кислорода в природе. Круговорот кислорода в природе
С момента появления химии человечеству стало понятно, что все вокруг состоит из вещества, в состав которого входят химические элементы. Многообразие веществ обеспечивается различными соединениями простых элементов. На сегодня открыто и внесено в периодическую таблицу Д. Менделеева 118 химических элементов. Среди них стоит выделить ряд ведущих, наличие которых определило появление органической жизни на Земле. В этот перечень входят: азот, углерод, кислород, водород, сера и фосфор.
Кислород: история открытия
Все эти элементы, а также ряд других, способствовали развитию эволюции жизни на нашей планете в том виде, в котором мы сейчас наблюдаем. Среди всех компонентов именно кислорода в природе больше остальных элементов.
 Кислород как отдельный элемент был открыт 1 августа 1774 года Джозефом Пристли. В ходе эксперимента по получению воздуха из окалины ртути путём нагревания при помощи обычной линзы он обнаружил, что свеча горит необычно ярким пламенем.
Кислород как отдельный элемент был открыт 1 августа 1774 года Джозефом Пристли. В ходе эксперимента по получению воздуха из окалины ртути путём нагревания при помощи обычной линзы он обнаружил, что свеча горит необычно ярким пламенем.Долгое время Пристли пытался найти этому разумное объяснение. На тот момент этому явлению было дано название «второй воздух». Несколько ранее изобретатель подводной лодки К. Дреббель в начале XVII века выделил кислород и использовал его для дыхания в своём изобретении. Но его опыты не оказали влияния на понимание того, какую роль играет кислород в природе энергообмена живых организмов. Однако учёным, официально открывшим кислород, признан французский химик Антуан Лоран Лавуазье. Он повторил эксперимент Пристли и понял, что образующийся газ является отдельным элементом.
Кислород взаимодействует практически со всеми простыми и сложными веществами, кроме инертных газов и благородных металлов.
Нахождение кислорода в природе
Среди всех элементов нашей планеты наибольшую долю занимает кислород. Распространение кислорода в природе весьма разнообразно. Он присутствует как в связанном виде, так и в свободном. Как правило, являясь сильным окислителем, он пребывает в связанном состоянии. Нахождение кислорода в природе как отдельного несвязанного элемента зафиксировано только в атмосфере планеты.
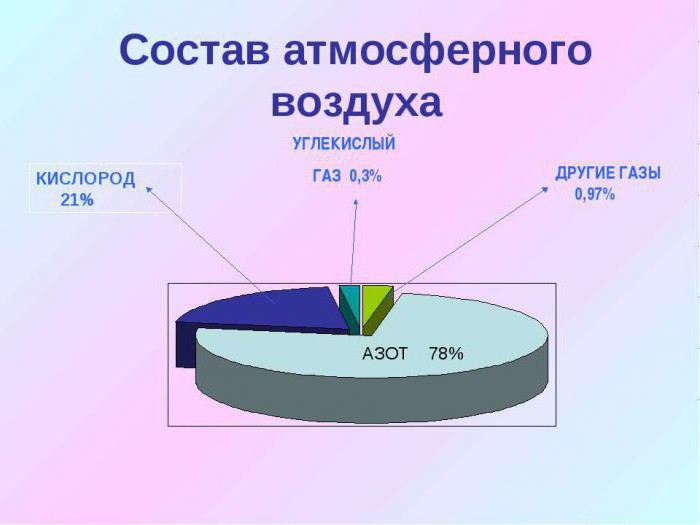
Содержится в виде газа и представляет собой соединение двух атомов кислорода. Составляет около 21 % от общего объёма атмосферы.
Кислород в воздухе, кроме обычной своей формы, имеет изотропную форму в виде озона. Молекула озона состоит из трёх атомов кислорода. Голубой цвет неба непосредственно связан с наличием этого соединения в верхних слоях атмосферы. Благодаря озону, жёсткое коротковолновое излучение от нашего Солнца поглощается и не попадает на поверхность.

В случае отсутствия озонового слоя органическая жизнь была бы уничтожена, подобно поджаренной еде в микроволновой печи.
В гидросфере нашей планеты этот элемент находится в связанном виде с двумя молекулами водорода и образует воду. Доля содержания кислорода в океанах, морях, реках и подземных водах оценивается около 86- 89 %, с учётом растворенных солей.
В земной коре кислород находится в связанном виде и является наиболее распространённым элементом. Его доля составляет около 47 %. Нахождение кислорода в природе не ограничивается оболочками планеты, этот элемент входит в состав всех органических существ. Его доля в среднем достигает 67 % от общей массы всех элементов.
Кислород – основа жизни
Из–за высокой окислительной активности кислород достаточно легко соединяется с большинством элементов и веществ, образуя оксиды. Высокая окислительная способность элемента обеспечивает всем известный процесс горения. Кислород также участвует в процессах медленного окисления.
Роль кислорода в природе как сильного окислителя незаменима в процессе жизнедеятельности живых организмов. Благодаря этому химическому процессу происходит окисление веществ с выделением энергии. Её живые организмы используют для своей жизнедеятельности.
Растения — источник кислорода в атмосфере
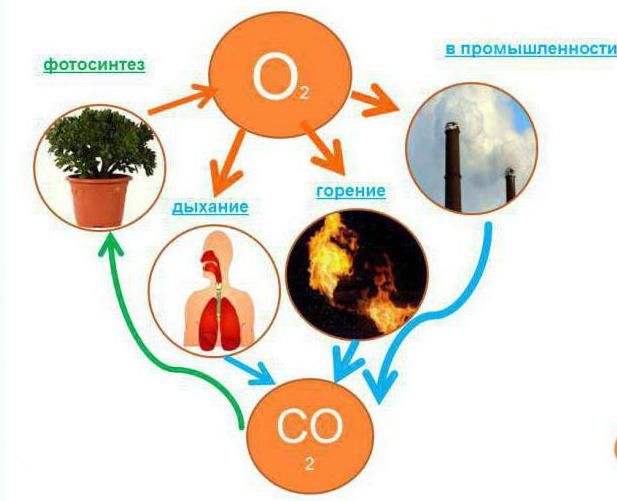
На начальном этапе образования атмосферы на нашей планете существующий кислород находился в связанном состоянии, в виде двуокиси углерода (углекислый газ). Со временем появились растения, способные поглощать углекислый газ.

Данный процесс стал возможен благодаря возникновению фотосинтеза. Со временем, в ходе жизнедеятельности растений, за миллионы лет в атмосфере Земли накопилось большое количество свободного кислорода.
По мнению учёных, в прошлом его массовая доля достигала порядка 30 %, в полтора раза больше, чем сейчас. Растения, как в прошлом, так и сейчас, существенно повлияли на круговорот кислорода в природе, обеспечив тем самым разнообразную флору и фауну нашей планеты.
Значение кислорода в природе не просто огромно, а первостепенно. Система метаболизма животного мира чётко опирается на наличие кислорода в атмосфере. При его отсутствии жизнь становится невозможной в том виде, в котором мы знаем. Среди обитателей планеты останутся только анаэробные (способные жить без наличия кислорода) организмы.
Интенсивный круговорот кислорода в природе обеспечен тем, что он находится в трёх агрегатных состояниях в объединении с другими элементами. Будучи сильным окислителем, он очень легко переходит из свободной формы в связанную. И только благодаря растениям, которые путём фотосинтеза расщепляют углекислый газ, он имеется в свободной форме.
Процесс дыхания животных и насекомых основан на получении несвязанного кислорода для окислительно-восстановительных реакций с последующим получением энергии для обеспечения жизнедеятельности организма. Нахождение кислорода в природе, связанного и свободного, обеспечивает полноценную жизнедеятельность всего живого на планете.
Эволюция и «химия» планеты
Эволюция жизни на планете опиралась на особенности состава атмосферы Земли, состава минералов и наличия воды в жидком состоянии.
 Химический состав коры, атмосферы и наличие воды стали основой зарождения жизни на планете и определили направление эволюции живых организмов.
Химический состав коры, атмосферы и наличие воды стали основой зарождения жизни на планете и определили направление эволюции живых организмов.Опираясь на имеющуюся «химию» планеты, эволюция пришла к углеродной органической жизни на основе воды как растворителя химических веществ, а также использовании кислорода как окислителя с целью получения энергии.
Иная эволюция
На данном этапе современная наука не опровергает возможность жизни в иных средах, отличных от земных условий, где за основу построения органической молекулы может быть взят кремний или мышьяк. А среда жидкости, как растворителя, может представлять собой смесь жидкого аммиака с гелием. Что касается атмосферы, то она может быть представлена в виде газообразного водорода с примесью гелия и других газов.
Какие метаболические процессы могут быть при таких условиях, современная наука пока не в состоянии смоделировать. Однако такое направление эволюции жизни вполне допустимо. Как доказывает время, человечество постоянно сталкивается с расширением границ нашего понимания окружающего мира и жизни в нем.
Презентация к уроку «Общая характеристика подгруппы кислорода. Аллотропные модификации кислорода и серы. Физические и химические свойства серы. Нахождение в природе. Применение серы.»

Кислород и сера

План изучения
- Положение в ПСХЭ
- Строение атома, возможные степени окисления
- Нахождение в природе
- Физические свойства
- Химические свойства

Положение кислорода и серы в периодической системе химических элементов Д.И. Менделеева

Положение в периодической системе
КИСЛОРОД и СЕРА
элементы VIA группы периодической системы
Элементы этой группы имеют общее название — ХАЛЬКОГЕНЫ, что означает «рождающие руды»

Строение атома кислорода
Электронные конфигурации атома:
Валентность кислорода равна двум
Степени окисления кислорода:
-2, 0, +2

Строение атома серы
Размещение электронов по уровням и подуровням
1s 2 2p 2 2p 6 3s 2 3p 4
Размещение электронов по орбиталям (последний уровень)
Степень окисления
+2, -2
Валентность
II
+4
+6
IV
VI

Нахождение серы в природе
Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде .

Сера также встречается в виде сульфатов — солей серной кислоты — мирабилит

Пирит – «огненный камень» (соединение серы в природе)

Сера в природе
Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.

Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца

Аллотропные модификации кислорода.
О 3
озон
(простое вещество)
«пахнущий»
Х. Ф. Шёнбейн 1839 г.
О 2
кислород
(простое вещество)
«рождающий кислоты»
К. В. Шееле 1772 г.
Дж. Пристли 1774 г.
А. Лавуазье 1777г.

Физические свойства аллотропных модификаций кислорода
название
веществ
агрегатное состояние при н. у.
кислород
раствори-мость в воде
O 2
газ,
цвет
озон
малораств. в воде,
O 3
бесцветный , в жидком состоянии — голубой
газ,
запах
М=32 г/моль
без запаха
хорошо растворим в воде,
нетоксичен
М=48 г/моль
голубой
РЕАКЦИОН.
резкий, но приятный запах (свежести)
токсичен
ВЫСОКАЯ
t 0 плавл
-218
и
СПОСОБНОСТЬ
ОЧЕНЬ
-183
кипен
ВЫСОКАЯ
-251
-112
0 C

ДИАГРАММА ЭЙЛЕРА – ВЕННА

Аллотропные модификации серы
Ромбическая
Моноклинная
Пластическая

Ромбическая сера
Ромбическая
( α-сера) – S 8 , желтого цвета,
t°пл.=113°C; Наиболее устойчивая модификация

Моноклинная сера
Моноклинная
( β –сера) — S 8 , темно-желтые иглы,
t°пл. = 119°C; устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую

Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу

Физические свойства серы
- Твёрдое кристаллическое вещество желтого цвета, без запаха
- Плохо проводит теплоту и не проводит электрический ток
- Сера в воде практически не растворяется
- Температура плавления 120 0 С

Ответы
- 1- желтые
- 2 – запаха
- 3 – тепла
- 4 – электричества
- 5 – нерастворима
- 6 – кристаллическое
- 7 – жидкость
- 8 — пластическая

Химические свойства серы (восстановительные)
Сера проявляет в реакциях с сильными окислителями:
S — 2ē S +2 ; S — 4ē S +4 ; S — 6ē S +6
1) C кислородом:
S + O 2 t S +4 O 2
2S + 3O 2 t ;Рt 2S +6 O 3
2) С галогенами (кроме йода)
S + Cl 2 S +2 Cl 2

Химические свойства серы (окислительные)
S 0 + 2ē S -2
3) Сера реагирует со щелочными металлами без нагревания:
2 Na + S Na 2 S
c остальными металлами (кроме Au, Pt) — при повышенной t :
2Al + 3S – t Al 2 S 3
Cu + S – t CuS
4) С некоторыми неметаллами сера образует бинарные соединения:
H 2 + S H 2 S
C + 2S CS 2

Применение серы
Производство спичек
Медицина
Производство резины
Сельское хозяйство
Производство взрывчатых
веществ
Производство
серной
кислоты
Красители

Сера используется для производства спичек

Процесс химического взаимодействия каучуков с серой в технике называется вулканизацией. При вулканизации изменяется молекулярная структура полимера, что влечет за собой изменение его физико-механических свойств: резко возрастает прочность при растяжении и эластичность каучука, а пластичность почти полностью исчезает Вулканизированный каучук называется резиной


Издавна было известно и важнейшее соединение серы — серная кислота. Один из создателей ятрохимии, монах Василий Валентин, в 15 веке подробно описал получение серной кислоты путем прокаливания железного купороса (старинное название серной кислоты — купоросное масло). Серная кислота-основа химической промышленности

Сера защищает растения от болезней. Для этого используется готовая «коллоидная сера» — тончайший порошок, который смешивают с мыльной водой и опрыскивают им растения. Сера как ядохимикат хороша тем, что практически безвредна для человека, не накапливается в организме и легко удаляется с листьев и плодов растений обычной водой

Применение серы в производстве удобрений имеет важное значение для получения полноценного минерального удобрения

Серу применяют в целлюлозно-бумажной промышленности и для производства красок, светящихся составов (люминисцентных и флюрисцентных).
15

В медицине для наружного употребления применяют: 1) раствор серы в льняном и терпентинном маслах , гарлемский бальзам — снаружи для втирания и для перевязок при подагрических страданиях, при паразитарных заболеваниях кожи, при ознобах. 2) Серное мыло — смесь 35 частей мыльного порошка, 5 частей серного цвета и соответствующего количества спирта (парфюмируется бергамотным маслом) — против чесотки.

Сера используется в косметологии. Наиболее известно «молочко Видаля» — болтушка, содержащая 5% серы осажденной. Готовые средства от прыщей также могут содержать серу очищенную (например, крем «Клерасил», гель «Делакс-Акне»). Хорошо себя зарекомендовала сера при использовании в мыле для лечения перхоти. Применяется при лечении заболеваний, вызванных повышенной секрецией сальных желез

Демеркуриза́ция — удаление ртути и её соединений физико-химическими или механическими способами с целью исключения отравления людей и животных. Металлическая ртуть высокотоксична и имеет высокое давление паров при комнатной температуре, поэтому при случайном проливе (а также в случае повреждения ртутных термометров, ламп, манометров и других содержащих ртуть приборов) подлежит удалению из помещений.
Ртуть вступает с серой в химическую реакцию и превращается в сульфид ртути HgS – нелетучий и, следовательно, неопасный. Обработку пола и других заражённых поверхностей необходимо проводить многократно, поэтому качественная демеркуризация занимаетнесколько дней

ПОЛУЧЕНА ЛИ НОВАЯ ИНФОРМАЦИЯ О КИСЛОРОДЕ И СЕРЕ?
Методическая разработка урока «Общая характеристика подгруппы кислорода. Аллотропные модификации кислорода и серы. Физические и химические свойства серы. Нахождение в природе. Применение серы»
КИСЛОРОД И СЕРА
Урок изучения новых знаний
Чтобы совершенствовать ум, нужно
больше раздумывать, чем заучивать
Рене Декарт
Цель урока:
дать сведения о положении неметаллических элементов O и S в периодической системе Д.И.Менделеева и строении их атомов, спрогнозировать влияние строения атома на свойства вещества, познакомить с понятием аллотропии, выяснить местонахождение кислорода и серы в природе, физические и химические свойства образованных ими простых веществ;
формировать научное мировоззрение, развивать умение критически мыслить, анализировать, обобщать, делать выводы;
воспитывать чувство солидарности, стремление постичь сущность, способность высказывать свое мнение, слушать других.
1. Организационный этап урока
2. Мотивация учебно-познавательной деятельности учащихся
Сегодня на уроке мы будем говорить о кислороде — самом распространённом на Земле элементе, на долю которого приходится около 47% массы твёрдой земной коры. Морские и пресные воды на 89% состоят из кислорода, атмосфера — на 23%. Благодаря кислороду живые существа могут дышать, без него не был бы возможен огонь. Этот газ широко используется в медицине, металлургии, пищевой промышленности, энергетике.
А также изучим желтый минерал, имеющий самую прямую связь со здоровьем организма. Органогенный элемент (макроэлемент) сера составляет основу аминокислот, ферментов, белка, витаминов и является четвертым из жизненно важных элементов питания живых организмов после кислорода, воды и соли. Элементная сера является одним из важных и крупнотоннажных видов химического сырья. Сера находит широкое применение при синтезе многих продуктов (серная кислота, красители, сероуглерод и др.) и получении различных веществ и материалов (резина, целлюлоза, удобрения, присадки к маслам и др.)
3. Актуализация опорных знаний учащихся по теме
«СВОБОДНОЕ ПИСЬМО». Учащиеся выполняют задание: записывают в тетради все, что им известно о кислороде и сере (кратко).
2-3 учащихся озвучивают написанное (не повторяясь)
Учитель. В конце урока узнаем, получена ли новая информация об этих элементах и веществах.
4. Изучение нового материала и новых способов деятельности
Учитель. Сегодня на уроке мы работаем по плану, который записан на доске и дает возможность целостного восприятия изучаемого учебного материала.
ПЛАН
Положение элементов O и S в периодической системе химических элементов Д.И.Менделеева
Строение атома, возможные степени окисления. Прогноз окислительно-восстановительных свойств элементов
Нахождение в природе
Аллотропия. Характеристика аллотропных видоизменений кислорода и серы
Физические свойства серы
Химические свойства серы
Применение серы
Используя периодическую систему химических элементов Д.И.Менделеева, рассмотрим положение элементов O и S в периодической системе химических элементов Д.И.Менделеева и строение их атомов.
Ответы. Кислород и сера — это элементы VIA группы периодической системы. Элементы этой группы имеют общее название — халькогены, что означает «рождающие руды»


Учитель. Ребята, помните: собраться вместе – это начало
держаться вместе – это прогресс
работать вместе – это успех.
Учитель. Давайте спрогнозируем какие свойства: окислительные или восстановительные характерны для кислорода и для серы, какие степени окисления они проявляют в соединениях (РАБОТА В ПАРАХ).
После принятия ответов демонстрируются слайды №5 и №6.
Ознакомление с образцами серы и ее природных соединений (в презентации слайды №7-11)
Учитель. Кислород в природе встречается в виде двух простых веществ – газов кислорода (О2) и озона (О3). При сравнении физических свойств кислорода и озона целесообразно отметить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде.
Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким, но приятным запахом.
Есть отличия и в химических свойствах. Озон химически активнее кислорода, он мощный окислитель, намного более реакционноспособный по сравнению с двухатомным кислородом. Окисляет почти все металлы и многие неметаллы с образованием кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами (в презентации слайды №12-13)
ДИАГРАММА ЭЙЛЕРА – ВЕННА (заполняют учащиеся после информации, предоставленной учителем)
 Кислород Озон
Кислород Озон
Кислород и озон – аллотропные формы (видоизменения, модификации) химического элемента кислорода. Аллотропия – явление существования одного и того же химического элемента в виде двух и более простых веществ.
«КРИТИЧЕСКОЕ ЧТЕНИЕ ТЕКСТА». Учащиеся читают текст параграфа 17 (стр.63) об аллотропных видоизменениях химического элемента серы, оставляя карандашом отметки:
+ знаю
— не знал
? не понял
∆ интересно
Обсуждается прочитанное: соотношение + и —, анализируется ∆ и идет объяснение ? (в презентации слайды №15-18)
ДЕМОНСТРАЦИЯ. Превращение кристаллической серы в пластическую.
Учитель. Итак, следуя плану урока, мы начинаем изучение физических и химических свойств серы, а также ее применения.
«ОПЕРАТОР». СОСТАВЛЕНИЕ ТЕКСТА (устно) С УЧЕТОМ ПРОПУЩЕННЫХ СЛОВ. РАБОТА В ГРУППАХ (в презентации слайд №19)
Учащиеся прочитывают текст о физических свойствах серы слайда №19, получают листы с текстом, в котором пропущены ключевые слова, и пробуют подобрать слова в контексте. Учитель приходит на помощь, когда какое – либо из восьми слов не «угадано».

В обычных условиях сера — __1__ хрупкие кристаллы без вкуса и __2__ . Сера плохой проводник __3__ и __4__. В воде она практически __5__, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и других).
Сера — твердое __6__ вещество, устойчивое в виде двух аллотропических модификаций. Ромбическая S лимонно-желтого цвета, плотность 2,07 г/см3, tпл 112,8 °С, устойчива ниже 95,6 °С; моноклинная S медово-желтого цвета, плотность 1,96 г/см3, tпл119,3 °С, устойчива между 95,6 °С и температурой плавления. Обе эти формы образованы восьмичленными циклическими молекулами S8. При плавлении сера превращается в подвижную желтую __7__, которая выше 160 °С буреет, а около 190 °С становится вязкой темно-коричневой массой. Это обусловлено изменением строения молекул: при 160 °С кольца S8 начинают разрываться, переходя в открытые цепи.
Если расплавленную серу, нагретую до 250-300 °С, влить тонкой струей в холодную воду, то получается коричнево-желтая упругая масса
(__8__ сера).
Ответы. 1 – желтые 5 — нерастворима
2 – запаха 6 — кристаллическое
3 – тепла 7 – жидкость
4 – электричества 8 – пластическая
Химические свойства серы (в презентации слайды №21-22)
Свойства | Уравнения реакций |
Окислительные: 1) Сера реагирует со щелочными металлами и ртутью без нагревания: c остальными металлами (кроме Au, Pt) — при повышенной t: 2) С некоторыми неметаллами сера образует бинарные соединения: | 2Na + S Na2S Hg + S HgS 2Al + 3S –t Al2S3 Cu + S –t CuS H2 + S H2S C + 2S CS2 |
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
3) с кислотами — окислителями: | S + O2t SO2 2S + 3O2t;Рt 2SO3 S + Cl2 SCl2 S + 2H2SO4(конц) 3SO2 + 2H2O S + 6HNO3(конц) H2SO4+6NO2+2H2O |
Рассматривается вопрос о применении серы (в презентации слайды №23-33)
5. Рефлексия деятельности
Учитель. Теперь, ребята, вы сможете ответить на вопрос, поставленный в начале урока «Получена ли новая информация о сере и кислороде?»
6. Информация о домашнем задании
Прочитать параграфы 17 и 18, выполнить упражнение 2 (стр.67), тестовое задание 2 (стр.67)
ЛИТЕРАТУРНО – ХИМИЧЕСКОЕ ЗАДАНИЕ
В стихотворении Л.Щипахиной «Наш праздник» есть такие строки:
Есть праздник особый и древний,
Где пир на широких столах,
Где ели – лесные деревья –
Растут на паркетных полах.
Светло от хрустального звона…
Прозрачен снежинок накрап.
И падают капли озона
С широких игольчатых лап…
Как можно прокомментировать это выражение с химической точки зрения?
(Ответ. То, что воздух в хвойных лесах имеет повышенное содержание озона, является ошибочным утверждением. На самом деле его там нет совсем, потому что органические вещества, которые содержатся в смоле хвойных деревьев, легко окисляются озоном)
Методическая разработка урока «Общая характеристика подгруппы кислорода. Аллотропные модификации кислорода и серы. Физические и химические свойства серы. Нахождение в природе. Применение серы»
КИСЛОРОД И СЕРА
Урок изучения новых знаний
Чтобы совершенствовать ум, нужно
больше раздумывать, чем заучивать
Рене Декарт
Цель урока:
дать сведения о положении неметаллических элементов O и S в периодической системе Д.И.Менделеева и строении их атомов, спрогнозировать влияние строения атома на свойства вещества, познакомить с понятием аллотропии, выяснить местонахождение кислорода и серы в природе, физические и химические свойства образованных ими простых веществ;
формировать научное мировоззрение, развивать умение критически мыслить, анализировать, обобщать, делать выводы;
воспитывать чувство солидарности, стремление постичь сущность, способность высказывать свое мнение, слушать других.
1. Организационный этап урока
2. Мотивация учебно-познавательной деятельности учащихся
Сегодня на уроке мы будем говорить о кислороде — самом распространённом на Земле элементе, на долю которого приходится около 47% массы твёрдой земной коры. Морские и пресные воды на 89% состоят из кислорода, атмосфера — на 23%. Благодаря кислороду живые существа могут дышать, без него не был бы возможен огонь. Этот газ широко используется в медицине, металлургии, пищевой промышленности, энергетике.
А также изучим желтый минерал, имеющий самую прямую связь со здоровьем организма. Органогенный элемент (макроэлемент) сера составляет основу аминокислот, ферментов, белка, витаминов и является четвертым из жизненно важных элементов питания живых организмов после кислорода, воды и соли. Элементная сера является одним из важных и крупнотоннажных видов химического сырья. Сера находит широкое применение при синтезе многих продуктов (серная кислота, красители, сероуглерод и др.) и получении различных веществ и материалов (резина, целлюлоза, удобрения, присадки к маслам и др.)
3. Актуализация опорных знаний учащихся по теме
«СВОБОДНОЕ ПИСЬМО». Учащиеся выполняют задание: записывают в тетради все, что им известно о кислороде и сере (кратко).
2-3 учащихся озвучивают написанное (не повторяясь)
Учитель. В конце урока узнаем, получена ли новая информация об этих элементах и веществах.
4. Изучение нового материала и новых способов деятельности
Учитель. Сегодня на уроке мы работаем по плану, который записан на доске и дает возможность целостного восприятия изучаемого учебного материала.
ПЛАН
Положение элементов O и S в периодической системе химических элементов Д.И.Менделеева
Строение атома, возможные степени окисления. Прогноз окислительно-восстановительных свойств элементов
Нахождение в природе
Аллотропия. Характеристика аллотропных видоизменений кислорода и серы
Физические свойства серы
Химические свойства серы
Применение серы
Используя периодическую систему химических элементов Д.И.Менделеева, рассмотрим положение элементов O и S в периодической системе химических элементов Д.И.Менделеева и строение их атомов.
Ответы. Кислород и сера — это элементы VIA группы периодической системы. Элементы этой группы имеют общее название — халькогены, что означает «рождающие руды»


Учитель. Ребята, помните: собраться вместе – это начало
держаться вместе – это прогресс
работать вместе – это успех.
Учитель. Давайте спрогнозируем какие свойства: окислительные или восстановительные характерны для кислорода и для серы, какие степени окисления они проявляют в соединениях (РАБОТА В ПАРАХ).
После принятия ответов демонстрируются слайды №5 и №6.
Ознакомление с образцами серы и ее природных соединений (в презентации слайды №7-11)
Учитель. Кислород в природе встречается в виде двух простых веществ – газов кислорода (О2) и озона (О3). При сравнении физических свойств кислорода и озона целесообразно отметить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде.
Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким, но приятным запахом.
Есть отличия и в химических свойствах. Озон химически активнее кислорода, он мощный окислитель, намного более реакционноспособный по сравнению с двухатомным кислородом. Окисляет почти все металлы и многие неметаллы с образованием кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами (в презентации слайды №12-13)
ДИАГРАММА ЭЙЛЕРА – ВЕННА (заполняют учащиеся после информации, предоставленной учителем)
 Кислород Озон
Кислород Озон
Кислород и озон – аллотропные формы (видоизменения, модификации) химического элемента кислорода. Аллотропия – явление существования одного и того же химического элемента в виде двух и более простых веществ.
«КРИТИЧЕСКОЕ ЧТЕНИЕ ТЕКСТА». Учащиеся читают текст параграфа 17 (стр.63) об аллотропных видоизменениях химического элемента серы, оставляя карандашом отметки:
+ знаю
— не знал
? не понял
∆ интересно
Обсуждается прочитанное: соотношение + и —, анализируется ∆ и идет объяснение ? (в презентации слайды №15-18)
ДЕМОНСТРАЦИЯ. Превращение кристаллической серы в пластическую.
Учитель. Итак, следуя плану урока, мы начинаем изучение физических и химических свойств серы, а также ее применения.
«ОПЕРАТОР». СОСТАВЛЕНИЕ ТЕКСТА (устно) С УЧЕТОМ ПРОПУЩЕННЫХ СЛОВ. РАБОТА В ГРУППАХ (в презентации слайд №19)
Учащиеся прочитывают текст о физических свойствах серы слайда №19, получают листы с текстом, в котором пропущены ключевые слова, и пробуют подобрать слова в контексте. Учитель приходит на помощь, когда какое – либо из восьми слов не «угадано».

В обычных условиях сера — __1__ хрупкие кристаллы без вкуса и __2__ . Сера плохой проводник __3__ и __4__. В воде она практически __5__, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и других).
Сера — твердое __6__ вещество, устойчивое в виде двух аллотропических модификаций. Ромбическая S лимонно-желтого цвета, плотность 2,07 г/см3, tпл 112,8 °С, устойчива ниже 95,6 °С; моноклинная S медово-желтого цвета, плотность 1,96 г/см3, tпл119,3 °С, устойчива между 95,6 °С и температурой плавления. Обе эти формы образованы восьмичленными циклическими молекулами S8. При плавлении сера превращается в подвижную желтую __7__, которая выше 160 °С буреет, а около 190 °С становится вязкой темно-коричневой массой. Это обусловлено изменением строения молекул: при 160 °С кольца S8 начинают разрываться, переходя в открытые цепи.
Если расплавленную серу, нагретую до 250-300 °С, влить тонкой струей в холодную воду, то получается коричнево-желтая упругая масса
(__8__ сера).
Ответы. 1 – желтые 5 — нерастворима
2 – запаха 6 — кристаллическое
3 – тепла 7 – жидкость
4 – электричества 8 – пластическая
Химические свойства серы (в презентации слайды №21-22)
Свойства | Уравнения реакций |
Окислительные: 1) Сера реагирует со щелочными металлами и ртутью без нагревания: c остальными металлами (кроме Au, Pt) — при повышенной t: 2) С некоторыми неметаллами сера образует бинарные соединения: | 2Na + S Na2S Hg + S HgS 2Al + 3S –t Al2S3 Cu + S –t CuS H2 + S H2S C + 2S CS2 |
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
3) с кислотами — окислителями: | S + O2t SO2 2S + 3O2t;Рt 2SO3 S + Cl2 SCl2 S + 2H2SO4(конц) 3SO2 + 2H2O S + 6HNO3(конц) H2SO4+6NO2+2H2O |
Рассматривается вопрос о применении серы (в презентации слайды №23-33)
5. Рефлексия деятельности
Учитель. Теперь, ребята, вы сможете ответить на вопрос, поставленный в начале урока «Получена ли новая информация о сере и кислороде?»
6. Информация о домашнем задании
Прочитать параграфы 17 и 18, выполнить упражнение 2 (стр.67), тестовое задание 2 (стр.67)
ЛИТЕРАТУРНО – ХИМИЧЕСКОЕ ЗАДАНИЕ
В стихотворении Л.Щипахиной «Наш праздник» есть такие строки:
Есть праздник особый и древний,
Где пир на широких столах,
Где ели – лесные деревья –
Растут на паркетных полах.
Светло от хрустального звона…
Прозрачен снежинок накрап.
И падают капли озона
С широких игольчатых лап…
Как можно прокомментировать это выражение с химической точки зрения?
(Ответ. То, что воздух в хвойных лесах имеет повышенное содержание озона, является ошибочным утверждением. На самом деле его там нет совсем, потому что органические вещества, которые содержатся в смоле хвойных деревьев, легко окисляются озоном)
Презентация к уроку «Общая характеристика подгруппы кислорода. Аллотропные модификации кислорода и серы. Физические и химические свойства серы. Нахождение в природе. Применение серы.»

Кислород и сера

План изучения
- Положение в ПСХЭ
- Строение атома, возможные степени окисления
- Нахождение в природе
- Физические свойства
- Химические свойства

Положение кислорода и серы в периодической системе химических элементов Д.И. Менделеева

Положение в периодической системе
КИСЛОРОД и СЕРА
элементы VIA группы периодической системы
Элементы этой группы имеют общее название — ХАЛЬКОГЕНЫ, что означает «рождающие руды»

Строение атома кислорода
Электронные конфигурации атома:
Валентность кислорода равна двум
Степени окисления кислорода:
-2, 0, +2

Строение атома серы
Размещение электронов по уровням и подуровням
1s 2 2p 2 2p 6 3s 2 3p 4
Размещение электронов по орбиталям (последний уровень)
Степень окисления
+2, -2
Валентность
II
+4
+6
IV
VI

Нахождение серы в природе
Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде .

Сера также встречается в виде сульфатов — солей серной кислоты — мирабилит

Пирит – «огненный камень» (соединение серы в природе)

Сера в природе
Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.

Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца

Аллотропные модификации кислорода.
О 3
озон
(простое вещество)
«пахнущий»
Х. Ф. Шёнбейн 1839 г.
О 2
кислород
(простое вещество)
«рождающий кислоты»
К. В. Шееле 1772 г.
Дж. Пристли 1774 г.
А. Лавуазье 1777г.

Физические свойства аллотропных модификаций кислорода
название
веществ
агрегатное состояние при н. у.
кислород
раствори-мость в воде
O 2
газ,
цвет
озон
малораств. в воде,
O 3
бесцветный , в жидком состоянии — голубой
газ,
запах
М=32 г/моль
без запаха
хорошо растворим в воде,
нетоксичен
М=48 г/моль
голубой
РЕАКЦИОН.
резкий, но приятный запах (свежести)
токсичен
ВЫСОКАЯ
t 0 плавл
-218
и
СПОСОБНОСТЬ
ОЧЕНЬ
-183
кипен
ВЫСОКАЯ
-251
-112
0 C

ДИАГРАММА ЭЙЛЕРА – ВЕННА

Аллотропные модификации серы
Ромбическая
Моноклинная
Пластическая

Ромбическая сера
Ромбическая
( α-сера) – S 8 , желтого цвета,
t°пл.=113°C; Наиболее устойчивая модификация

Моноклинная сера
Моноклинная
( β –сера) — S 8 , темно-желтые иглы,
t°пл. = 119°C; устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую

Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу

Физические свойства серы
- Твёрдое кристаллическое вещество желтого цвета, без запаха
- Плохо проводит теплоту и не проводит электрический ток
- Сера в воде практически не растворяется
- Температура плавления 120 0 С

Ответы
- 1- желтые
- 2 – запаха
- 3 – тепла
- 4 – электричества
- 5 – нерастворима
- 6 – кристаллическое
- 7 – жидкость
- 8 — пластическая

Химические свойства серы (восстановительные)
Сера проявляет в реакциях с сильными окислителями:
S — 2ē S +2 ; S — 4ē S +4 ; S — 6ē S +6
1) C кислородом:
S + O 2 t S +4 O 2
2S + 3O 2 t ;Рt 2S +6 O 3
2) С галогенами (кроме йода)
S + Cl 2 S +2 Cl 2

Химические свойства серы (окислительные)
S 0 + 2ē S -2
3) Сера реагирует со щелочными металлами без нагревания:
2 Na + S Na 2 S
c остальными металлами (кроме Au, Pt) — при повышенной t :
2Al + 3S – t Al 2 S 3
Cu + S – t CuS
4) С некоторыми неметаллами сера образует бинарные соединения:
H 2 + S H 2 S
C + 2S CS 2

Применение серы
Производство спичек
Медицина
Производство резины
Сельское хозяйство
Производство взрывчатых
веществ
Производство
серной
кислоты
Красители

Сера используется для производства спичек

Процесс химического взаимодействия каучуков с серой в технике называется вулканизацией. При вулканизации изменяется молекулярная структура полимера, что влечет за собой изменение его физико-механических свойств: резко возрастает прочность при растяжении и эластичность каучука, а пластичность почти полностью исчезает Вулканизированный каучук называется резиной


Издавна было известно и важнейшее соединение серы — серная кислота. Один из создателей ятрохимии, монах Василий Валентин, в 15 веке подробно описал получение серной кислоты путем прокаливания железного купороса (старинное название серной кислоты — купоросное масло). Серная кислота-основа химической промышленности

Сера защищает растения от болезней. Для этого используется готовая «коллоидная сера» — тончайший порошок, который смешивают с мыльной водой и опрыскивают им растения. Сера как ядохимикат хороша тем, что практически безвредна для человека, не накапливается в организме и легко удаляется с листьев и плодов растений обычной водой

Применение серы в производстве удобрений имеет важное значение для получения полноценного минерального удобрения

Серу применяют в целлюлозно-бумажной промышленности и для производства красок, светящихся составов (люминисцентных и флюрисцентных).
15

В медицине для наружного употребления применяют: 1) раствор серы в льняном и терпентинном маслах , гарлемский бальзам — снаружи для втирания и для перевязок при подагрических страданиях, при паразитарных заболеваниях кожи, при ознобах. 2) Серное мыло — смесь 35 частей мыльного порошка, 5 частей серного цвета и соответствующего количества спирта (парфюмируется бергамотным маслом) — против чесотки.

Сера используется в косметологии. Наиболее известно «молочко Видаля» — болтушка, содержащая 5% серы осажденной. Готовые средства от прыщей также могут содержать серу очищенную (например, крем «Клерасил», гель «Делакс-Акне»). Хорошо себя зарекомендовала сера при использовании в мыле для лечения перхоти. Применяется при лечении заболеваний, вызванных повышенной секрецией сальных желез

Демеркуриза́ция — удаление ртути и её соединений физико-химическими или механическими способами с целью исключения отравления людей и животных. Металлическая ртуть высокотоксична и имеет высокое давление паров при комнатной температуре, поэтому при случайном проливе (а также в случае повреждения ртутных термометров, ламп, манометров и других содержащих ртуть приборов) подлежит удалению из помещений.
Ртуть вступает с серой в химическую реакцию и превращается в сульфид ртути HgS – нелетучий и, следовательно, неопасный. Обработку пола и других заражённых поверхностей необходимо проводить многократно, поэтому качественная демеркуризация занимаетнесколько дней

ПОЛУЧЕНА ЛИ НОВАЯ ИНФОРМАЦИЯ О КИСЛОРОДЕ И СЕРЕ?
Сера. Химические свойства серы. Соединения серы с водородом и кислородом. Нахождение серы в природе. Получение серы. Физические свойства серы. Аллотропные модификации серы.
Сера относится к элементу, находящемуся в VI-й группе главной подгруппы периодической системы Д.И.Менделеева. Его электронная конфигурация атома 1s22s22p63s23p4.
Химические свойства.
1. Свойства простого вещества.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислителем сера является в первую очередь по отношению к металлам:
S + 2Na = Na2S S + Ca = CaS 3S +2Al = Al2S3
В качестве окислителя сера проявляет свои свойства и при взаимодействии с неметаллами:
S + h3 = h3S 3S + 2P = P2S3 2S + C = CS2
Однако с неметаллами, имеющими электроотрицательность бóльшую, чем у серы, она реагирует в качестве восстановителя:
S +3F2 = SF6 S + Cl2 = SCl2
Сера реагирует со сложными веществами, как правило, окислителями. Причём азотная кислота окисляет её до серной кислоты:
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
Другие окислители окисляют серу до степени окисления (+4):
S + 2h3SO4 = 3SO2 + 2h3O 3S + 2KClO3 = 3SO2 + 2KCl
По механизму реакции ДИСПРОПОРЦИОНИРОВАНИЯ сера реагирует с щелочами. В процессе этой реакции образуются соединения серы (-2) и (+4):
3S + 6KOH = K2SO3 + 2K2S + 3h3O
Непосредственно с водой сера не реагирует, однако при нагревании подвергается дисмутации в атмосфере водяного пара.
Сера может быть получена в процессе реакций:
SO2 + 2CO = S + 2CO2 Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
Соединение серы (-2) с водородом называется сероводород – h3S. Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
FeS + 2HCl = FeCl2 + h3S
Для сероводорода и его солей характерны восстановительные свойства:
h3S + SO2 = 3S + 2h3O
В лаборатории сероводород получают:
FeS + 2HCl = FeCl2 + h3S
Cероводород легко окисляется галогенами, оксидом серы, хлоридом железа (III):
h3S + Cl2 = 2HCl + S 2h3S + SO2 = 2h3O + 3S h3S + 2FeCl3 = 2FeCl2 + S + 2HCl
На воздухе сероводород окисляет серебро, чем и объясняется почернение серебряных изделий со временем:
2h3S + 4Ag + O2 = 2Ag2S + 2h3O
Взаимодействие с кислородом
Оксид серы (IV)
Сернистый газ SO2 – бесцветный газ с удушливым резким запахом. При растворении его в воде (при 00С 1 объем воды растворяет более 70 объемовSO2) образуется сернистая кислотаh3SO3, которая известна только в растворах.
В лабораторных условиях для получения SO2действуют на твердый сульфит натрия концентрированной серной кислотой:
Na2SO3 + 2h3SO4 = 2NaHSO4 + SO2 + h3O
В промышленности SO2получают при обжиге сульфидных руд, например пирита:
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
S + O2 = SO2;
Оксид серы (VI)
Серный ангидрид SO3при комнатной температуре представляет собой бесцветную легко летучую жидкость (tкип=44,80С,tпл=16,80С), которая со временем переходит в асбестовидную модификацию, состоящую из блестящих шелковистых кристаллов. Волокна серного ангидрида устойчивы лишь в запаянном сосуде. Поглощая влагу воздуха, они превращаются в густую бесцветную жидкость – олеум (от лат.oleum– «масло»). Хотя формально олеум можно рассматривать как растворSO3 вh3SO4, на самом деле он представляет собой смесь различных пиросерных кислот:h3S2O7,h3S3O10и т.д. С водойSO3взаимодействует очень энергично: при этом выделяется так много теплоты, что образующиеся мельчайшие капельки серной кислоты создают туман. Работать с этим веществом нужно крайне осторожно.
2S + 3O2 = 2SO3.
Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:
SO3 + h3O = h3SO4
Нахождение серы в природе
Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (остров Сицилия) и США. Месторождения самородной серы имеются в Куйбышевской области (Поволжье), в государствах Средней Азии, в Крыму и других районах.
Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2– железный колчедан, или пирит;HgS – киноварь и др., а также соли серной кислоты (кристаллогидраты):CaSO4ּ2h3O – гипс,Na2SO4ּ10h3O– глауберова соль,MgSO4ּ7h3O– горькая соль и др.
Физические свойства серы
Природная сера состоит из смеси четырех устойчивых изотопов: ,,,.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая серапредставляет собой желтый порошок, плохо растворимый в воде, но хорошо растворимый в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. При кристаллизации из хлороформаCHCl3 или из сероуглеродаCS2 она выделяется в виде прозрачных кристаллов октаэдрической формы. Ромбическая сера состоит из циклических молекулS8, имеющих форму короны. При 1130Cона плавится, превращаясь в желтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нем образуются длинные полимерные цепочки. А если нагреть серу до 444,60С, она закипает. Выливая кипящую серу тонкой струйкой в холодную воду, можно получить пластическую серу –резиноподобную модификацию, состоящую из полимерных цепочек. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы. (tпл=1190C). Подобно ромбической сере, эта модификация состоит из молекулS8. При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.