Дисерная кислота Википедия
| Пиросерная кислота | |
|---|---|
| Систематическое наименование | Пиросерная кислота |
| Традиционные названия | Дисерная кислота |
| Хим. формула | H2S2O7 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 178,14 г/моль |
| Плотность | 1,9 г/см³ |
| Температура | |
| • плавления | 35 °C |
| Рег. номер CAS | 7783-05-3 |
| PubChem | 62682 |
| Рег. номер EINECS | 231-976-8 |
| SMILES | |
| InChI | |
| ChEBI | 29211 |
| ChemSpider | 56433 |
Пиросерная кислота — неорганическое соединение, двухосновная кислота с формулой H2S2O7, бесцветные кристаллы, разлагается в воде. На воздухе она дымит, так как разлагается на серную кислоту, выделяя летучий серный ангидрид, а потому называется дымящей серной кислотой.
В Энциклопедическом словаре Брокгауза и Эфрона описывается в составе нордгаузенской серной кислоты (то есть олеума) следующим образом:
О присутствии в нордгаузенской серной кислоте, по крайней мере, при низких температурах и отчасти при обыкновенной гидрата H2S2O7 надо заключить из того, что при охлаждении до 0° — 5° этот гидрат можно выделить из нее в кристаллическом виде. С другой стороны, пиросерная кислота непрочна, кристаллы ее, плавясь при 35°С, уже разлагаются при этом на H2SO4 и SO 3. В растворе в серной кислоте такое разложение, несомненно, наступает еще ранее, уже при обыкновенной температуре и сопровождается выделением паров легколетучего серного ангидрида, который, встречаясь с влагой воздуха и соединяясь с ней в труднолетучий гидрат H2SO4, и обусловливает появление тяжелого белого дыма, испускаемого нордгаузенской кислотой.[1].
Получение
- В 100% серной кислоте содержится 0,04% пиросерной кислоты.
- В серной кислоте, насыщенной триоксидом серы (олеум), имеет место равновесие [2]:
- SO3+h3SO4 ⇄h3S2O7{\displaystyle {\mathsf {SO_{3}+H_{2}SO_{4}\ \rightleftarrows H_{2}S_{2}O_{7}}}}
Физические свойства
Пиросерная кислота образует бесцветные кристаллы моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,2955 нм, b = 1,3705 нм, c = 1,3164 нм, β = 109,2°, Z = 16 [3].
Реагирует с водой и этанолом.
Химические свойства
- Разлагается водой:
- h3S2O7+h3O → 2h3SO4{\displaystyle {\mathsf {H_{2}S_{2}O_{7}+H_{2}O\ {\xrightarrow {}}\ 2H_{2}SO_{4}}}}
- Образует соли — дисульфаты или пиросульфаты, которые получаются нагреванием гидросульфатов, например дисульфат калия:
- 2KHSO4 →T K2S2O7+h3O{\displaystyle {\mathsf {2KHSO_{4}\ {\xrightarrow {T}}\ K_{2}S_{2}O_{7}+H_{2}O}}}
Применение
Применяется в производстве органических красителей, фармацевтических препаратов, очистки нефтепродуктов.
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-85270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Дисерная кислота Википедия
| Пиросерная кислота | |
|---|---|
| Систематическое наименование | Пиросерная кислота |
| Традиционные названия | Дисерная кислота |
| Хим. формула | H2S2O7 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 178,14 г/моль |
| Плотность | 1,9 г/см³ |
| Температура | |
| • плавления | 35 °C |
| Рег. номер CAS | 7783-05-3 |
| PubChem | 62682 |
| Рег. номер EINECS | 231-976-8 |
| SMILES | |
| InChI | |
| ChEBI | 29211 |
| ChemSpider | 56433 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пиросерная кислота — неорганическое соединение, двухосновная кислота с формулой H2S2O7, бесцветные кристаллы, разлагается в воде. На воздухе она дымит, так как разлагается на серную кислоту, выделяя летучий серный ангидрид, а потому называется дымящей серной кислотой.
В Энциклопедическом словаре Брокгауза и Эфрона описывается в составе нордгаузенской серной кислоты (то есть олеума) следующим образом:
О присутствии в нордгаузенской серной кислоте, по крайней мере, при низких температурах и отчасти при обыкновенной гидрата H2S2O7 надо заключить из того, что при охлаждении до 0° — 5° этот гидрат можно выделить из нее в кристаллическом виде. С другой стороны, пиросерная кислота непрочна, кристаллы ее, плавясь при 35°С, уже разлагаются при этом на H2SO4 и SO3. В растворе в серной кислоте такое разложение, несомненно, наступает еще ранее, уже при обыкновенной температуре и сопровождается выделением паров легколетучего серного ангидрида, который, встречаясь с влагой воздуха и соединяясь с ней в труднолетучий гидрат H 2SO4, и обусловливает появление тяжелого белого дыма, испускаемого нордгаузенской кислотой.[1].
Пиросерная кислота — Википедия
Материал из Википедии — свободной энциклопедии
| Пиросерная кислота | |
|---|---|
| Общие | |
| Систематическое наименование | Пиросерная кислота |
| Традиционные названия | Дисерная кислота |
| Хим. формула | H2S2O7 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 178,14 г/моль |
| Плотность | 1,9 г/см³ |
| Термические свойства | |
| Т. плав. | 35 °C |
| Классификация | |
| Рег. номер CAS | 7783-05-3 |
| PubChem | 62682 |
| Рег. номер EINECS | 231-976-8 |
| SMILES | |
| InChI | |
| ChEBI | 29211 |
| ChemSpider | 56433 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Пиросерная кислота — неорганическое соединение, двухосновная кислота с формулой H2S2O7, бесцветные кристаллы, разлагается в воде. На воздухе она дымит, так как разлагается на серную кислоту, выделяя летучий серный ангидрид, а потому называется дымящей серной кислотой.
В Энциклопедическом словаре Брокгауза и Эфрона описывается в составе нордгаузенской серной кислоты следующим образом:
О присутствии в нордгаузенской серной кислоте, по крайней мере, при низких температурах и отчасти при обыкновенной гидрата H2S2O7 надо заключить из того, что при охлаждении до 0° — 5° этот гидрат можно выделить из нее в кристаллическом виде. С другой стороны, пиросерная кислота непрочна, кристаллы ее, плавясь при 35°С, уже разлагаются при этом на H2SO4 и SO3. В растворе в серной кислоте такое разложение, несомненно, наступает еще ранее, уже при обыкновенной температуре и сопровождается выделением паров легколетучего серного ангидрида, который, встречаясь с влагой воздуха и соединяясь с ней в труднолетучий гидрат H2SO4, и обусловливает появление тяжелого белого дыма, испускаемого нордгаузенской кислотой.[1].
Получение
- В 100% серной кислоте содержится 0,04% пиросерной кислоты.
- SO3+h3SO4 ⇄h3S2O7{\displaystyle {\mathsf {SO_{3}+H_{2}SO_{4}\ \rightleftarrows H_{2}S_{2}O_{7}}}}
Физические свойства
Пиросерная кислота образует бесцветные кристаллы моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,2955 нм, b = 1,3705 нм, c = 1,3164 нм, β = 109,2°, Z = 16 [3].
Реагирует с водой и этанолом.
Химические свойства
- Разлагается водой:
- h3S2O7+h3O → 2h3SO4{\displaystyle {\mathsf {H_{2}S_{2}O_{7}+H_{2}O\ {\xrightarrow {}}\ 2H_{2}SO_{4}}}}
- Образует соли — дисульфаты или пиросульфаты, которые получаются нагреванием гидросульфатов, например дисульфат калия:
- 2KHSO4 →T 2K2S2O7+h3O{\displaystyle {\mathsf {2KHSO_{4}\ {\xrightarrow {T}}\ 2K_{2}S_{2}O_{7}+H_{2}O}}}
Применение
Применяется в производстве органических красителей, фармацевтических препаратов, очистки нефтепродуктов.Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-85270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Дитионовая кислота — Википедия
| Дитионовая кислота | |
|---|---|
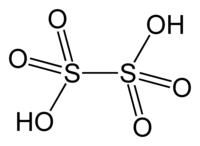 ( {{{картинка}}}) | |
| Общие | |
| Хим. формула | H2S2O6 |
| Физические свойства | |
| Молярная масса | 162,14 г/моль |
| Классификация | |
| Рег. номер CAS | 14970-71-9 |
| PubChem | 26985 |
| SMILES | |
| InChI | |
| ChEBI | 29208 |
| ChemSpider | 25128 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дитионовая кислота — неорганическое соединение, сильная двухосновная кислота, существует только в разбавленном растворе, образует соли. Является родоначальником гомологического ряда политионовых кислот H2SnO6.
- BaS2O6+h3SO4 → h3S2O6+BaSO4↓{\displaystyle {\mathsf {BaS_{2}O_{6}+H_{2}SO_{4}\ {\xrightarrow {}}\ H_{2}S_{2}O_{6}+BaSO_{4}\downarrow }}}
Дитионовая кислота существует только в разбавленном растворе, при концентрировании или нагревании разлагается.
- Разлагается при нагревании:
- h3S2O6 →50oC h3SO4+SO2↑{\displaystyle {\mathsf {H_{2}S_{2}O_{6}\ {\xrightarrow {50^{o}C}}\ H_{2}SO_{4}+SO_{2}\uparrow }}}
- h3S2O6+2NaOH → Na2S2O6+2h3O{\displaystyle {\mathsf {H_{2}S_{2}O_{6}+2NaOH\ {\xrightarrow {}}\ Na_{2}S_{2}O_{6}+2H_{2}O}}}
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.