Соли. Состав и название солей
Цель: повторить ранее изученные классы неорганических соединений «Оксиды», «Основания», «Кислоты»; познакомить с новым классом неорганических соединений «Соли».
Задачи:
- Обучающая – повторить состав, название и классификацию оксидов, оснований, кислот; познакомить с понятием «соль», названием и составом основных солей.
- Воспитательная – показать значение солей в жизни человека; воспитывать чувство взаимопомощи, бережное отношение к слуховой аппаратуре; напомнить учащимся о правилах охраны труда.
- Развивающая – развивать умение связно отвечать на вопросы, проводить сравнения, делать выводы, расширять словарь по теме: «Соли».
- Коррекционная – работать над развитием
слухового восприятия, следить за внятностью и
слитностью произношения, совершенствовать
фразовую речь.

Основные виды работы: фронтальный опрос в виде беседы, игра, демонстрация химических реактивов, работа с дидактическими карточками.
Оборудование: таблицы «Химические элементы», «Кислоты и соли», «Растворимость кислот, оснований и солей в воде»; химические реактивы «Соли», «Химическое лото», дидактические карточки с заданиями.
ХОД УРОКА
I. Организационный момент
1. Приветствие.
2. [Ты слышишь?]
3. – При работе на уроке следите за ударением,
правилами орфоэпии, произношением.
4. – Посмотрите на план урока. Мы будем:
(– Повторять пройденный материал.)
(– Изучать новую тему.)
(– Выполнять практическую работу.)
– Давайте вспомним [пройденный
материал].
[Какие классы неорганических соединений вы
знаете?] (Оксиды, основания, кислоты)
[Какой главный химический элемент в оксидах?]
(Кислород)
[Что входит в состав оснований?] (Атомы металла и
гидроксогруппы)
[Из чего состоят кислоты?] (Из атомов водорода и
кислотного остатка)
– Перед вами формулы неорганических соединений. Давайте определим, к какому классу относится
каждая из них.
Давайте определим, к какому классу относится
каждая из них.
NaOH H2SO4 P2O5
– Назовите класс соединений, название
вещества, прочитайте формулу, определите состав,
определите валентность.
(Основание, гидроксид натрия, натрий о аш, состоит
из атомов металла и гидроксогруппы, валентность
натрия – I, гидроксоруппы – I)
(Оксид, оксид фосфора, пэ два о пять, состоит из атомов неметалла и кислорода, валентность фосфора – V, кислорода – II)
III. Слуховой диктант
– Сейчас будет [слуховой диктант].
[Простое вещество, металл, кислород, водород,
неметалл, сложное вещество, основание, оксид
железа, кислота, гидроксид калия, оксид серы,
соляная кислота, кислотный остаток. ]
]
IV. Сообщение нового материала
– Сегодня мы познакомимся с еще одним
классом неорганических соединений – это соли.
– Понятие «соль» мы встречали недавно, при
изучении кислот. А с какими солями вы
встречаетесь каждый день? (У нас дома есть соль –
поваренная или пищевая).
– Давайте посмотрим на поваренную соль и мел.
[Какой цвет у поваренной соли, мела?] (Белый)
[Какое агрегатное состояние у поваренной соли, мела?] (Твердое)
– Растворимость этих веществ вы определите сами. Давайте вспомним [Правила техники безопасности. Как мы работаем со стеклянной посудой?] (Работать нужно осторожно, чтобы не разбить стекло и не порезаться).
(В двух стаканах вода. Добавим в один немного поваренной соли, а в другой – мел и перемешаем стеклянной палочкой.
– Посмотрите, как растворяется поваренная соль и мел? (Соль растворилась, а мел – нет)
– Значит, cоли бывают растворимые и нерастворимые.

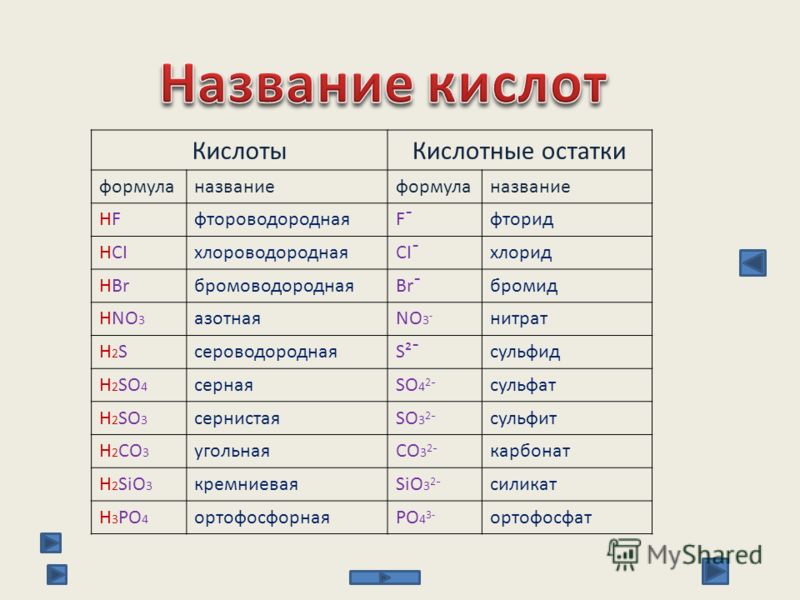
– Поваренная соль имеет химическую формулу NaCl и химическое название «хлорид натрия». Это соль соляной кислоты, потому что кислотный остаток у них одинаковый. Еще в составе есть атом металла. Определите валентность. По таблице растворимости подтвердите, что хлорид натрия – растворимая соль. (Ионы металла пересекаются с ионами кислотного остатка, и на пересечении стоит буква Р)
Названия солей
Химическая формула соли |
Название соли |
Солью какой кислоты является |
– Мел имеет химическую формулу CaCO3 и химическое
название «карбонат кальция». Это соль угольной
кислоты, потому что кислотный остаток у них
одинаковый. Также в составе атом металла.
Определите валентность. Определите
растворимость. В карточках запишите вторую соль.
Это соль угольной
кислоты, потому что кислотный остаток у них
одинаковый. Также в составе атом металла.
Определите валентность. Определите
растворимость. В карточках запишите вторую соль.
[Соль – это простое или сложное вещество?]
(Сложное, оно состоит из нескольких химических
элементов)
– Откройте тетрадь и запишите тему и
определение: «Соли – сложные вещества, состоящие
из атомов металла и кислотного остатка».
– Давайте повторим, какие соли мы узнали сегодня.
На одном кубике записаны атомы металлов, на
другом – атомы кислотного остатка. Соберите
формулы солей. Составьте формулу новой соли и
запишите данные в карточку.
(К + NO3 – нитрат калия, соль азотной
кислоты;
Сu + SO4 – cульфат меди, соль серной кислоты;
Fe + PO4 – фосфат железа, соль фосфорной
кислоты;
Zn + S – сульфид цинка, соль сероводородной
кислоты)
– С другими солями мы познакомимся на
следующем уроке.
V. Итог урока
– Мы с вами узнали последний,
четвертый класс неорганических соединений.
Давайте сделаем вывод.
Соли – твердые вещества с разной растворимостью
в воде. Какие соли мы узнали? Где они применяются?
(Хлориды, карбонаты; хлорид натрия применяется
как приправа к пище, при мариновании; карбонат
кальция применяется при строительстве, входит в
состав красок и шпатлевок в отделочных работах).
VI. Домашнее задание
– Выучите определение солей.
– Дайте название и определите растворимость
следующих солей:
KCl СuCO3
Список литературы:
1. Программа курса химии для 8-9 классов
общеобразовательных учреждений. Гара Н.Н.
Программы общеобразовательных учреждений.
Химия. – М.: Просвещение, 2008. – 56с.
2. Учебник. Рудзитис Г.Е Химия:
неорганическая химия: учебник для 8 класса
общеобразовательных учреждений/ Г.Е Рудзитис, Ф.Г
Фельдман. – 12-е изд., исправленное – М.:
Просвещение, 2008. – 176с.
Учебник. Рудзитис Г.Е Химия:
неорганическая химия: учебник для 8 класса
общеобразовательных учреждений/ Г.Е Рудзитис, Ф.Г
Фельдман. – 12-е изд., исправленное – М.:
Просвещение, 2008. – 176с.
Другие ресурсы:
СD-диск: Уроки химии Кирилла и Мефодия. 8-9 класс. –
М.: ООО Кирилл и Мефодий. – 2002.
Урок «Соли и их классификация»
Цель урока: сформировать понятие о солях и их классификации, научиться составлять химические формулы солей и давать им названия.
Задачи урока
Образовательные.
1. Познакомить с понятием солей.
2. Рассмотреть состав и название солей.
4. Научить составлять формулы солей.
Воспитательные.
Показать значимость солей; выработать умение работы с химическими реактивами, навыки индивидуальной работы.
Развивающие.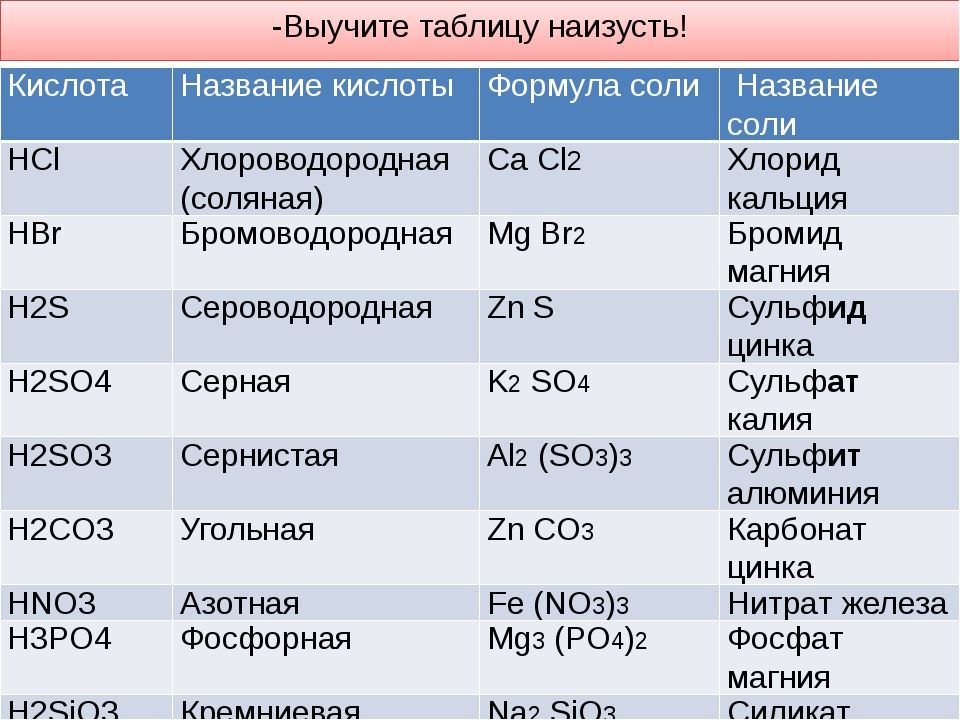
Умение анализировать и обобщать данные, классифицировать вещества, записывать и читать химические формулы, применять правила на практике. Приобретение навыков самостоятельной работы.
Методы :
1 Словесные (объяснение учителя, беседа с учащимися).
2 Наглядные (демонстрация веществ)
3 Практические
Оборудование и материалы: карточки, раковины моллюсков, образцы фосфоритов и апатитов, мела, мрамора, известняка, хлорида натрия, медного купороса (для наглядности).
Формы организации познавательной деятельности :
1. Индивидуальная (химический диктант).
2. Групповая
3. Обще классная (когда один учащийся работает у доски, а остальные учащиеся выполняют это же задание на своих местах в тетради)
Ход урока
I. Организационный момент
I I. Актуализация знаний учащихся
Проверка домашнего задания:
1 Индивидуальная работа учащихся: химический диктант ( 5-7 мин )
(Работа с карточками).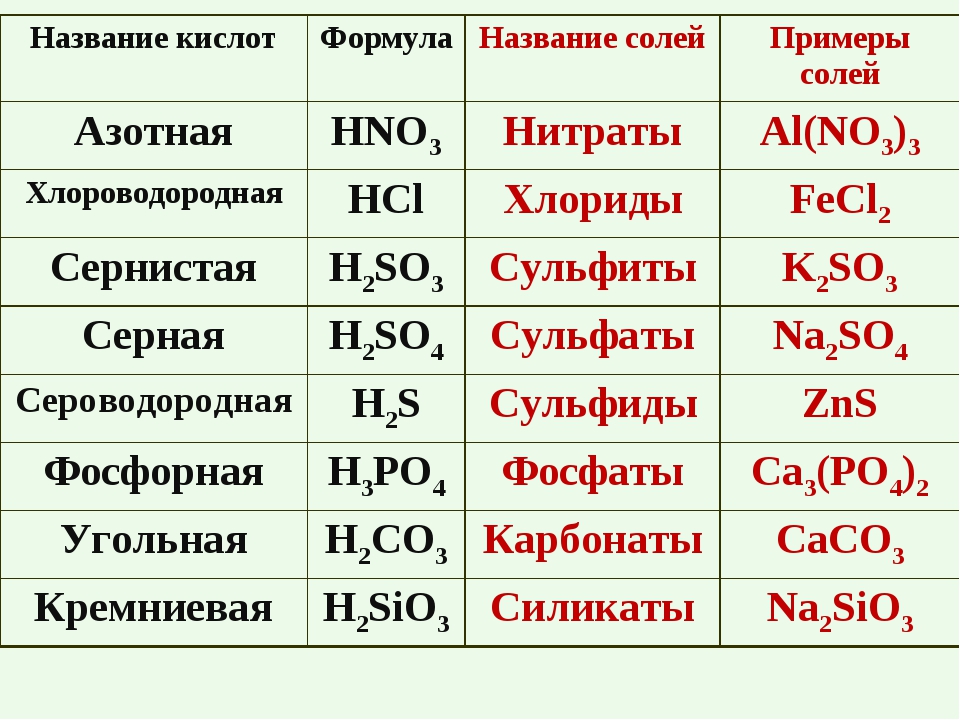
Вариант 1 Химический диктант Дать название веществу, формула которого h3 SO4 Написать формулу азотистой кислоты Дать название веществу, формула которого HNO3 Написать формулу соляной кислоты Дать название веществу, формула которого h3SiO3 | Вариант 2 Химический диктант Дать название веществу, формула которого h3CO3 Написать формулу сернистой кислоты Дать название веществу, формула которого h4PO4 Написать формулу сероводородной кислоты Дать название веществу, формула которого HCI |
Взаимопроверка. Ответы записаны на доске.
2. Этап обобщения и систематизации :
— Какие классы соединений вы знаете? Дайте определение каждому из них.
Название класса поочередно вывешивается на доске.
Оксиды Основания Кислоты
-На карточках обучающимся предложены формулы некоторых веществ.
Учитель предлагает соотнести химические формулы и название классов веществ. ( Учащиеся поочередно выходят к доске и записывают формулы веществ, данных в карточках, в соответствующий класс. Читают формулы и дают определение классу веществ. Предполагаемый ответ – Оксиды – сложные вещества, состоящие из атомов 2 элементов, один из которых кислород в степени окисления -2. Основания – это сложные вещества, состоящие из атомов металла и гидроксильной группы. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка).
До выполнения |
После выполнения |
Как Вы думаете, как можно назвать этот неизвестный нам класс? (дети предлагают разные варианты, если нет необходимого, то можно предложить им исторические названия NaCl-поваренная соль, MgSO4-входит в состав горькой соли или все можно попросить найти исторические названия этих солее в интернете, и т. д.). Учащиеся назвали – Соли, правильно! Этот класс соединений называется –соли.
д.). Учащиеся назвали – Соли, правильно! Этот класс соединений называется –соли.
Определение цели урока
III. Введение новых знаний.
(Слово учителя)
По мере того как учитель рассказывает о некоторых солях он записывает формулы их на доске: NaCl, MgSO4, CaCO3, Ca3(PO4)2
Соли широко распространены в природе. Огромная масса солей растворена в океанической и морской воде. Три четверти этой массы приходится на поваренную соль. А горький вкус ей придает сульфат магния.
В земной коре встречается мрамор, который образовался из известняка в далекие времена. Залежи известняка и мела находятся на дне океанов и морей. Частично они образовались из раковин морских простейших. Эта соль карбонат кальция.
Наземные животные строят свои скелеты из другой соли, в состав которой входят атомы кальция и кислотные остатки фосфорной кислоты. Эта же соль фосфат кальция – основа минералов фосфоритов и апатитов, из которых получают необходимые для сельского хозяйства фосфорные удобрения.
Эта же соль фосфат кальция – основа минералов фосфоритов и апатитов, из которых получают необходимые для сельского хозяйства фосфорные удобрения.
Ученые полагают, что миллионы лет назад жизнь зародилась в первичном Мировом океане. В нем живые организмы получали минеральные соли, необходимые для роста и жизни. При большой потери крови в организм пациента вводят физиологический раствор (временно замещающий кровь), представляющий собой раствор с массовой долей хлорида натрия 0,8 %.
Соли играют важную роль в процессах обмена веществ. Они содержатся в клеточном соке живых организмов, входят в состав нервной, мышечной и костной тканей. Поэтому без солей, и прежде всего поваренной соли, жизнь человека невозможна.
Вот какие удивительные и полезные вещества соли! Посмотрите на образцы солей и подумайте чем все соли похожи и в чем их различие? (предполагаемый ответ – все соли твердые вещества, имеющие различную окраску)
Правильно соли представляют собой твердые вещества, при растворении некоторых из них в воде, мы получаем растворы солей.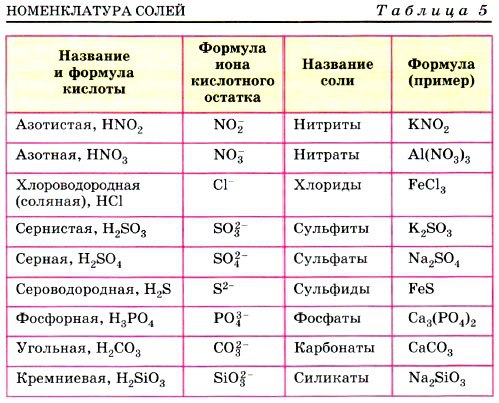 А окраска солей зависит от того какие элементы входят в их состав.
А окраска солей зависит от того какие элементы входят в их состав.
Но нас больше интересует состав солей: чем они образованы и какие свойства проявляют!
Все перечисленные выше вещества соли.
— Что общего в этих соединениях и чем они отличаются:
NaCl, MgSO4, CaCO3, Ca3(PO4)2
Все они состоят из металла и кислотного остатка.
— Давайте запишем определение солей.
Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков.
— А теперь давайте попробуем выбрать из перечня вещества только формулы солей:
Na2S LiCl K3PO4
Mg(OН)2 Fe(OH)2 Nh4
K2SO4 Ca(NO3)2 Na2O
(Один ученик выходит к доске и подчеркивает формулы солей)
— Правильно, Na2S, LiCl, K3PO4, K2SO4, Ca(NO3)2 – это все формулы солей.
А теперь, посмотрите на образцы солей и подумайте, чем все соли похожи и в чем их различие? (предполагаемый ответ – все соли твердые вещества, имеющие различную окраску)
Правильно соли представляют собой твердые вещества, при растворении некоторых из них в воде, мы получаем растворы солей. А окраска солей зависит от того какие элементы входят в их состав.
А окраска солей зависит от того какие элементы входят в их состав.
— По растворимости все соли можно разделить на 2 группы: растворимые в воде и нерастворимые. К первой группе относится: NaCl, K2SO4, ZnCl, а ко второй: BaSO4, CaCO3. Как можно узнать растворимая соль или нет? Попробовать растворить ее, что мы сейчас и сделаем (опыт). А если соли под рукой нет? Тогда необходимо воспользоваться таблицей растворимости: найти необходимый металл и кислотный остаток и посмотреть, растворима соль или нет.
— Как мы можем различить растворы кислоты и основания, оба прозрачные жидкости? Только с помощью специального индикатора – лакмусовой бумажки: в кислой среде – красный цвет, а в щелочной – синий.
— А какого цвета будет лакмусовая бумажка в растворе соли? В зависимости от того какой металл и какой кислотный остаток входит в состав соли: синяя, красная или может вообще не изменять окраску. (опыт) Истинную причину этого вы узнаете позже, когда мы будем подробно изучать свойства всех классов неорганических веществ.
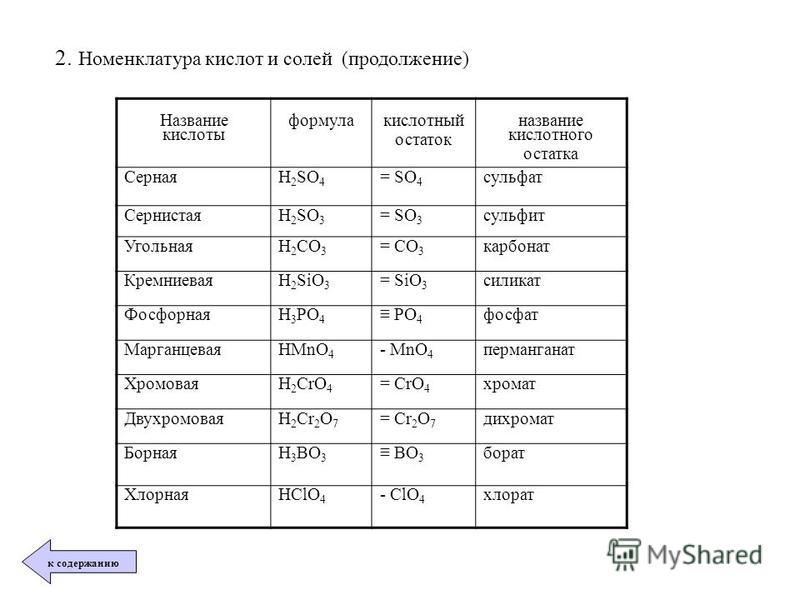
А теперь будем учиться составлять названия солей, с помощью алгоритма: (у каждого ученика на парте есть алгоритмы)
Алгоритм называния соли по формуле
Определить степени окисления каждого элемента (по формуле).
Определить по кислотному остатку, какой кислоте соответствует соль, каково название соли.
Названия солей образуются от латинских корней с добавление суффиксов:
-ид, если соль бескислородная;
-ит, если центральный атом находится не в высшей степени окисления ;
-ат , если центральный атом находится в высшей степени окисления, равной номеру группы.
К названию соли добавить русское название металла в родительном падеже, указать в скобках римской цифрой степень окисления металла (если она непостоянна).
Пользуясь таблицей на странице 109, составим названия следующих солей:
AlCl3 – хлорид алюминия
KNO2 — нитрит калия
BaSO4 – сульфат бария
— Теперь сделаем обратное задание по названию соли, составим ее формулу:
Алгоритм построения формул солей по названию
Слева записать металл, указанный в названии, над ним — степень окисления (из названия, из таблицы растворимости).
По названию соли определить, какой кислоте она соответствует, кислотный остаток записать справа от металла, над ним написать степень окисления (из таблицы растворимости).
3. Найти наименьшее общее кратное
4. Разделить полученное число на значение степени окисления металла и кислотного остатка.
нитрат магния
Для этого необходимо:
1. Записать химические знаки металла и кислотного остатка, указать заряды ионов.
2. Найти наименьшее общее кратное
3. Разделить полученное число на численное значение заряда каждого элемента
2
Mg+2(NO3)2-1
III. Закрепление.
А теперь давайте закрепим полученные знания, выполнив следующие задания:
Расставьте индексы и дайте названия следующим веществам:
Zn…Cl…
Ba…NO3…
Ca…PO4…
Al…S…
Na…SO4…
Составьте формулы следующих солей:
Нитрат меди (II)
Хлорид ртути (II)
Силикат магния
Нитрат натрия
Карбонат кальция
V. Итог урока.
Итак, подведем итог, сегодня на уроке мы познакомились с еще одним классом соединений — Соли, дали определение, научились отличать их от других соединений, классифицировать, составлять формулы солей и давать им названия.
Выставление оценок.
V. Домашнее задание. Запишите домашнее задание: §33, упр. 1-4.
Вариант 1 Химический диктант 1. Дать название веществу, формула которого h3 SO4 :________________________________ 2. Написать формулу азотистой кислоты: _________ 3. Дать название веществу, формула которого HNO3 :________________________________ 4. Написать формулу соляной кислоты: __________ 5.Дать название веществу, формула которого h3SiO3: ________________________________ | Вариант 2 Химический диктант 1. 2.Написать формулу сернистой кислоты: _____________ 3.Дать название веществу, формула которого h4PO4:______________________ 4.Написать формулу сероводородной кислоты:_______________ 5.Дать название веществу, формула которого HCI:_______________________ |
Вариант 1 Химический диктант Серная кислота. HNO2 Азотная кислота HCL Кремниевая кислота | Вариант 2 Химический диктант 1.Угольная кислота 2.h3SO3 3. Фосфорная кислота 4.h3S 5.Соляная кислота |
Алгоритм называния соли по формуле
Определить степени окисления металла и кислотного остатка
(по таблице растворимости, по формуле).
Определить по кислотному остатку, какой кислоте соответствует соль, каково название соли.
Названия солей образуются от латинских корней с добавление суффиксов:
-ид, если соль бескислородная;
-ит, если центральный атом находится не в высшей степени окисления ;
-ат , если центральный атом находится в высшей степени окисления, равной номеру группы.
К названию соли добавить русское название металла в родительном падеже, указать в скобках римской цифрой степень окисления металла (если она непостоянна).
Алгоритм построения формул солей по названию
Слева записать металл, указанный в названии, над ним -степень окисления (из названия, из таблицы растворимости).
По названию соли определить, какой кислоте она соответствует, кислотный остаток записать справа от металла, над ним написать степень окисления (из таблицы растворимости).
3. Найти наименьшее общее кратное
4. Разделить полученное число на значение степени окисления металла и кислотного остатка.
Конспект урока по химии на тему «Состав, названия солей, правила составления формул. » 8 класс
Дата № урока 34 Класс 8 Предмет химия
Тема урока: Состав, названия солей, правила составления формул.
ЦЕЛИ:
Образовательные:
1.Сформировать понятие о классе соли, научить составлять формулы солей и давать им название, продолжить систематизацию знаний об изучаемых классах веществ.
2.Повторить основные классы неорганических соединений, общие правила названия соединений.
3.Формирование практических умений: определять вещества разных классов с помощью индикаторов, работать с растворами кислот, щелочей, соблюдая правила техники безопасности.
Развивающие:
1.Культура речи и письма, познавательных и общеучебных умений и навыков, как самоконтроль, сотрудничество, формирование навыков самостоятельной работы с учебником.
2.Развитие у учащихся логических мыслительных операций: умение анализировать, сравнивать и делать выводы, исследовательских и практических навыков, развитие критического мышления.
Воспитательные:
1.Формировать добросовестное отношение к учебному труду, положительную мотивацию к учению.
2.Способствовать воспитанию гуманности, дисциплинированности, эстетического восприятия мира, умение работать в коллективе.
Химия. Планируемые результаты:
УУД :личностные — позволяют сделать учение осмысленным, увязывая их с реальными жизненными целями и ситуациями;
регулятивные — обеспечивают возможность управления познавательной и учебной деятельностью посредством постановки целей, планирования, контроля, коррекции своих действий, оценки успешности усвоения;
познавательные — включают действия исследования, поиска, отбора и структурирования необходимой информации, моделирование изучаемого содержания;
коммуникативные — обеспечивают возможности сотрудничества: умение слышать, слушать и понимать партнера, планировать и согласованно выполнять совместную деятельность, распределять роли, взаимно контролировать действия друг друга, уметь договариваться, вести дискуссию, правильно выражать свои мысли, оказывать поддержку друг другу и эффективно сотрудничать как с учителем, так и со сверстниками.
ТИП:
ОБОРУДОВАНИЕ: учебник, рабочие тетради, ПСХЭ, таблица растворимости, карточки, наглядные пособия.
ХОД УРОКА:
ОРГМОМЕНТ (ПРИВЕТСТВИЕ, ОТМЕТКА ОТСУТСТВУЮЩИХ, ПРОВЕРКА САМОЧУВСТВИЯ И ГОТОВНОСТИ К УРОКУ)
АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ – ПРОВЕРКА Д/З
У доски 2 учащихся выполняют задания
1.Установите соответствие между названием класса и его представителями:
СaО, CО2, BaSO4 , H2SО4 , HCl , H2CО3 ,Fe2О3 , CaCO3 , Сa(ОH)2 ,Сu(ОH)2 , Na2SO4 , CuО.
2. Установите соответствие между названием класса и его представителями:
CuО, Mg(NO3)2 , NaОH , H3PО4 , NaCl , Ba(ОH)2, P2О5, HNO3, KОH
Фронтальная беседа с классом
На какие группы делят все вещества
Какие классы сложных веществ вам известны?
Что такое оксиды? Что общего в их составе?
Какие вещества называют основаниями? Что общего в их составе?
Какие вещества называют кислотами? Что общего в составе кислот?
Выполняют дифференцированные задания
Задание №1 (средний уровень)
Дайте названия следующим веществам и распределите их по классам неорганических соединений:
HCl, Al2O3, Cu(OH)2, NO, HNO3, NaOH, HNO2, CO2, Mg(OH)2, H2CO3, H2SO3, H2SO4.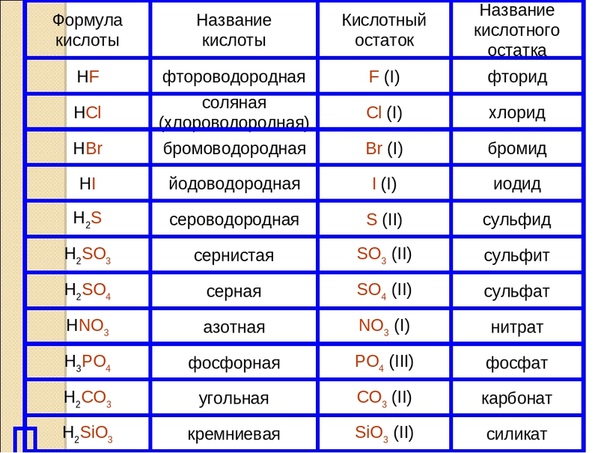
Задание №2 Химический диктант (средний уровень)
(проверка знаний формул учащимися)
а) Запишите формулы соляной кислоты, азотной, сероводородной, серной, угольной, фосфорной.
б) Назовите кислоты H2SiO3, HCI, H3PO4, HNO3, H2CO3, H2SO4, HCN.
1. Из предложенных ниже фрагментов соберите определение «кислот»
а) простые вещества б) сложные вещества в) содержат ионы металлов
г) имеют в составе атомы водорода д) содержат кислотные остатки
е) содержат гидроксид-ионы
2.Выберите бескислородные кислоты
а) H2S б) H3PO4 в) HBr г) H2SO3 д) НСl е) HNO2
3.Выберите двухосновные кислоты
а) HNO3 б) H2S в) HNO2 г) H2SO4 д) НСl е) H2CO3
4. Выберите формулу серностой кислоты
Выберите формулу серностой кислоты
а) H2S б) H2SiO3 в) H2SO4 д) H2SO3
5.Выберите название кислоты, формула которой H2SiO3
а) сернистая б) кремниевая в) угольная г) серная
6.Соотнесите названия кислот и формулы:
1) серная а) H2S
2) азотная в) H2SO4
3) сероводородная д) HCI
4) солянаяб) H2CO3
5) угольная е) HNO3
6) сернистая е) H2SO3
7.Выберите формулы одноосновных кислородосодержащих кислот:
а) H2SiO3 б) HNO3 в) НСl г) HNO2 д) H3PO4 е) HBr
8.Выберите формулы кислот, валентность кислотного остатка, которых равна 2:
а) H2S б) HNO3 в) H2CO3 г) НСl д) H3PO4 е) H2SO4
9. Метилоранжевый в кислой среде:
Метилоранжевый в кислой среде:
а) оранжевый б) желтый в) розовый (красный)
МОТИВАЦИЯ – Эпиграф к уроку:
«Не в количестве знаний заключается образование, а в полном понимании и искусном применении того, что знаешь» А. Дистервег (немецкий педагог)
ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Мы живем с вами в мире веществ и их превращений, поэтому должны знать не только состав и применение веществ, но и влияние их на организм человека и окружающий нас мир. С некоторыми классами веществ вы уже знакомы и сегодня приступим к изучению соединений нового класса.
Чтобы узнать, что это за класс, давайте попробуем отгадать вещество, о котором пойдет речь.
Творческое задание учащихся: «Угадайте вещество»
Вещество, без которого невозможна жизнь растений, животных и человека.
Это химическое соединение необходимо для существования в крови эритроцитов, сокращения мышц, переваривания пищи в желудке.
В год каждый человек потребляет от 3 до 5 кг этого вещества.
Это вещество — символ гостеприимства и радушия русской нации.
Говорят, чтобы узнать человека, надо с ним пуд этого вещества съесть.
Это -……(соль). Поваренная соль — представитель класса солей.
Сегодня мы начинаем знакомство с веществами этого класса.
Постановка проблемного вопроса
Даны формулы веществ AgCl, Na2SO4, KNO3
(учащиеся, сравнивая и анализируя формулы, находят общее: на первом месте в формулах стоит катион металла, на втором месте анион кислотного остатка).
Все эти вещества относятся к классу солей.
Дайте определение данному классу (учащиеся формулируют определение солей)
Cоли – это сложные вещества, состоящие из атомов металла и кислотного остатка.
Примеры солей: стр 156
BaSO4 – сульфат бария
AlCl3 – хлорид алюминия
Составление формул солей стр 156
Нитрат меди (II) —
Хлорид ртути (II) —
Силикат магния-
Нитрат натрия-
Карбонат кальция-
Классификация солей стр 157-158
По составу: средние, кислые, основные
По растворимости: растворимые в воде и нерастворимые ( работа с таблицей растворимости).
 Учащиеся приводят примеры растворимых и нерастворимых солей.
Учащиеся приводят примеры растворимых и нерастворимых солей.
Физминутка
Закройте глаза, расслабьте тело,
Представьте – вы птицы, вы вдруг полетели!
Теперь в океане дельфином плывете,
Теперь в саду яблоки спелые рвете.
Налево, направо, вокруг посмотрели,
Открыли глаза, и снова за дело!
«Интеллектуальная разминка»
Выбрать из предложенных формул веществ – формулы солей:
КCl; HNO3; FeSO4; H2S; CuCO3; NaOH; CaO. Определить растворимость всех солей.
Распространение солей в природе
Огромная масса солей растворена в океанической и морской воде. Три четверти этой массы приходится на поваренную соль. В океанической воде присутствует в виде растворимых солей большинство химических элементов.
В земной коре встречается мрамор, который образовался из известняка в далекие времена. Залежи известняка и мела находятся на дне океанов и морей. Частично они образовались из раковин морских простейших. Эта соль карбонат кальция.
Залежи известняка и мела находятся на дне океанов и морей. Частично они образовались из раковин морских простейших. Эта соль карбонат кальция.
Наземные животные строят свои скелеты из другой соли, в состав которой входят атомы кальция и кислотные остатки фосфорной кислоты. Эта же соль фосфат кальция – основа минералов фосфоритов и апатитов, из которых получают необходимые для сельского хозяйства фосфорные удобрения.
Ученые полагают, что миллионы лет назад жизнь зародилась в первичном Мировом океане. В нем живые организмы получали минеральные соли, необходимые для роста и жизни.
Применение солей
При большой потери крови в организм пациента вводят физиологический раствор (временно замещающий кровь), представляющий собой раствор с массовой долей хлорида натрия 0,8 %.
Соли играют важную роль в процессах обмена веществ.
Они содержатся в клеточном соке живых организмов, входят в состав нервной, мышечной и костной тканей.
Поваренная соль необходима при производстве мясных и рыбных консервов, в металлургической промышленности, при обработке мехов, сыромятных кож, при варке мыла, получении кальцинированной соды и в медицине.
Но главный потребитель поваренной соли – химическая промышленность. В ней используется не только сама соль, но и оба элемента, составляющие ее.
Итак, соль, используемая в прошлом главным образом в пищу, сейчас получила широкое применение.
Закрепление изученного материала
Работа в парах (взаимопроверка).
Сульфат железа (III)
Нитрат алюминия
Фосфат кальция
Сульфид натрия
Карбонат лития
Хлорид меди (II)
Перманганат калия
Фторид алюминия
Сульфит железа (II)
Нитрат хрома (III)
Силикат натрия
Из нижеперечисленных веществ определите оксиды, кислоты, соли, основания.
СaО, CО2, BaSO4 , h3SО4 , HCl , h3CО3 ,Fe2О3 , CaCO3 , Сa(ОH)2 , P2О5 , Сu(ОH)2 , KОH , Na2SO4 , CuО, Mg(NO3)2 , NaОH , h4PО4 , NaCl , Ba(ОH)2, HNO3.
Подведение итогов урока
Итак, подведем итог, сегодня на уроке мы познакомились с еще одним классом соединений Соли, дали определение, научились отличать их от других соединений, составлять формулы солей и давать им названия.
Рефлексия
мне было легко (нет ошибок)-
я затруднялся (1 ошибка)-
мне было трудно (2 и более)-
ИТОГИ УРОКА
ДОМАШНЕЕ ЗАДАНИЕ Прочитать §46 стр159-160 упр1.3 тесты учить правила, конспект.
ОГЭ по химии. Классификация веществ. Соли | Решаем химию: вопросы и ответы
Соли образованы металлом и кислотным остатком. Существует очень много веществ, которые относятся к классу солей, так что этой теме стоит уделить время. Поскольку в ЕГЭ по химии и ОГЭ по химии непременно встретятся вопросы про соли, нужно хорошо знать названия кислотных остатков и понимать, как правильно составлять формулы солей.
Фото: melscience.comФото: melscience.com
Прежде чем переходить к заданиям, давайте вспомним, что название соли составляется из кислотного остатка и металла. Примеры: BaSO4 – сульфат бария, NaNO3 – нитрат натрия. Если соль образована металлом с переменной валентностью, то нужно обязательно указать эту валентность. Примеры: FeCl2 – хлорид железа (II), FeCl3 – хлорид железа (III).
Если соль образована металлом с переменной валентностью, то нужно обязательно указать эту валентность. Примеры: FeCl2 – хлорид железа (II), FeCl3 – хлорид железа (III).
Также напомню, что соли бывают средними, кислыми и основными. Средние соли образуются, когда все атомы водорода в кислоте замещены атомами металла: CaCO3, K3PO4, Al2(SO4)3.
Кислые соли образуются при неполном замещении атомов водорода в кислоте атомами металла. Помните, что кислые соли не могут образовать одноосновные кислоты, а в названии к кислотному остатку добавляется часть гидро-. Примеры кислых солей: NaHCO3 – гидрокарбонат натрия, K2HPO4 – гидрофосфат калия. Обязательно учитывайте при составлении формул валентность кислотного остатка, иначе индексы будут расставлены неверно!
Основные соли образуются, когда в гидроксиде не все гидроксильные группы заместились на кислотный остаток. Основные соли не образуют гидроксиды металлов первой группы и других металлов с валентностью I. Чтобы название соли было правильным, нужно к кислотному остатку добавить часть гидрооксо-. Примеры основных солей: Mg(OH)Cl – гидроксохлорид магния, Fe(OH)(NO3)2 — гидроксонитрат железа (III). Здесь также нужно учитывать валентность кислотного остатка, чтобы не ошибиться с формулой.
Чтобы название соли было правильным, нужно к кислотному остатку добавить часть гидрооксо-. Примеры основных солей: Mg(OH)Cl – гидроксохлорид магния, Fe(OH)(NO3)2 — гидроксонитрат железа (III). Здесь также нужно учитывать валентность кислотного остатка, чтобы не ошибиться с формулой.
Теперь рассмотрим задания, похожие на которые могут встреться в выпускном экзамене по химии.
Задание 1.
Укажите формулу, соответствующую дигидроксонитрату железа (III).
1. Fe(NO3)2
2. Fe(OH)3
3. Fe(OH)2NO3
4. Fe(OH)2
Ответ: 3.
Объяснение: в задании следует обратить внимание на два момента: нам нужна основная соль (поскольку в названии соли фигурирует приставка «гидроксо-») и нам нужна соль железа (III). Варианты 1 и 4 можно отбросить, так как в них представлены не соли, а гидроксиды. В варианте 2 представлена средняя соль нитрат железа (III). А вот в варианте 3 мы видим основную соль (главный признак – присутствие в формуле гидроксильных групп –ОН), где железо имеет валентность III. Это и есть верный вариант.
А вот в варианте 3 мы видим основную соль (главный признак – присутствие в формуле гидроксильных групп –ОН), где железо имеет валентность III. Это и есть верный вариант.
Задание 2.
Укажите, как называется соль, формула которой NaHSO3.
1. сульфит натрия
2. сульфид натрия
3. сульфат натрия
4. гидросульфит натрия.
Ответ: 4.
Объяснение: в задании представлена кислая соль (поскольку в формуле имеется атом водорода), поэтому нам нужно название, где присутствует приставка «гидро-». Первые три варианта такую приставку не содержат, так что правильный ответ – вариант 4.
Задание 3.
Укажите кислоту, которая не образует кислых солей.
1. HNO3
2. h3SO4
3. Н2СО3
4. Н3РО4.
Ответ: 1.
Объяснение: кислые соли могут образовать только двух- и трёхосновные кислоты. Одноосновные кислоты, то есть содержащие всего один атом водорода, кислых солей не образуют. Из представленных вариантов только в варианте 1 показана одноосновная азотная кислота. Следовательно, это и есть верный ответ.
Задание 4.
В каком варианте представлены две средние соли?
1. Li2SO3 и KHCO3
2. CaCO3 и Al2(SO4)3
3. FeOHSO4 и Na2HPO4
4. Cu(NO3)2 и Zn(OH)Cl
Ответ: 2.
Объяснение: давайте подробно рассмотрим все варианты, что точно узнать ответ. Вариант 1: сульфит лития (средняя соль) и гидрокарбонат калия (кислая соль). Вариант 2: карбонат кальция (средняя соль) и сульфат алюминия (средняя соль). Вариант 3: гидроксосульфат железа (III) (основная соль) и гидрофосфат натрия (кислая соль). Вариант 4: нитрат меди (II) (средняя соль) и гидроксохлорид цинка (основная цель). Таким образом, лишь в варианте 2 представлены две средние соли.
Таким образом, лишь в варианте 2 представлены две средние соли.
Задание 5.
Какое основание не может образовать основную соль.
1. КОН
2. Zn(OH)2
3. Cu(OH)2
4. Al(OH)3
Ответ: 1.
Объяснение: основные соли могут образовать только те основания, в которых больше одной гидроксильной группы. Основания, в которых только одна группа –ОН, не дают основных солей. Такое основание представлено в варианте 1 (гидроксид калия).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Презентация по химии «Составление формул солей»
Презентация может быть использована на уроке химии в 8 классе по теме «Соли» для отработки навыков составления формул солей или первичного закрепления темы «Соли«, или для проверки умения составлять формулы и давать названия солям.
На первом слайде дается алгоритм составления формул солей.
На втором слайде в овальных фигурах записаны формулы кислот и оснований, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами кислот и оснований пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления.
На третьем слайде в прямоугольниках записаны формулы килотных и основных оксидов, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами оксидов пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления. Задания расположены в порядке усложнения.
На четвертом слайде дан алгоритм составления названий солей.
На пятом слайде даны формулы солей, которые ученик должен назвать.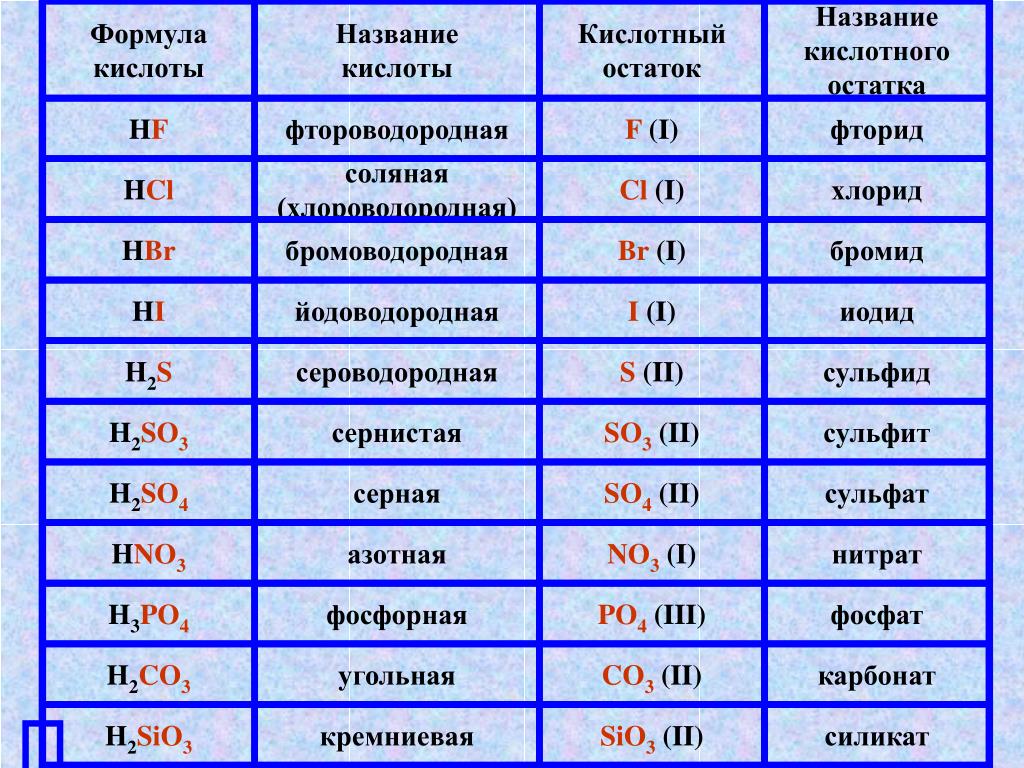 Правильность названия проверяется по клику мышки (в прямоугольнике справа появляется название соли).
Правильность названия проверяется по клику мышки (в прямоугольнике справа появляется название соли).
Соли – это сложные вещества, состоящие из атома металла и кислотного остатка.
Чтобы написать формулу соли по названию нужно:
1) написать на первом месте химический знак металла, на втором месте формулу кислотного остатка
2) проставить валентности металла и кислотного остатка
3) найти НОК, разделить НОК на валентности, получить индексы.
«Соли как производные кислот и оснований». Вариант 2
- Категория: Самостоятельные работы по химии. 8 класс
{module Адаптивный блок Адсенс в начале статьи}
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
СОЛИ КАК ПРОИЗВОДНЫЕ КИСЛОТ И ОСНОВАНИЙ
ВАРИАНТ 2
1. Впишите формулы солей, образованных соответствующими ионами:
Впишите формулы солей, образованных соответствующими ионами:
| Ионы, образующие соль | SO32− | NO3− | AsO43− |
| Ba2+ | BaSO3 | Ba(NO3)2 | Ba3(AsO4)2 |
| Ag+ | Ag2SO3 | AgNO3 | Ag3AsO4 |
| Fe2+ | FeSO3 | Fe(NO3)2 | Fe3(AsO4)2 |
2. Установите соответствие между названием соли, формулой соли, растворимостью соли:
| Название соли | Формула соли | Растворимость соли |
| 1) нитрат алюминия | А) K2SiO3 | а) растворимая |
| 2) сульфат калия | Б) K2SO3 | б) малорастворимая |
| 3) силикат калия | В) K2SO4 | в) нерастворимая |
| 4) хлорид алюминия | Г) Al(NO3)3 | |
| Д) Al(NO2)3 | ||
| Е) AlCl3 |
Ответ: 1) Г, а; 2) В, а; 3) А, а; 4) Е, а.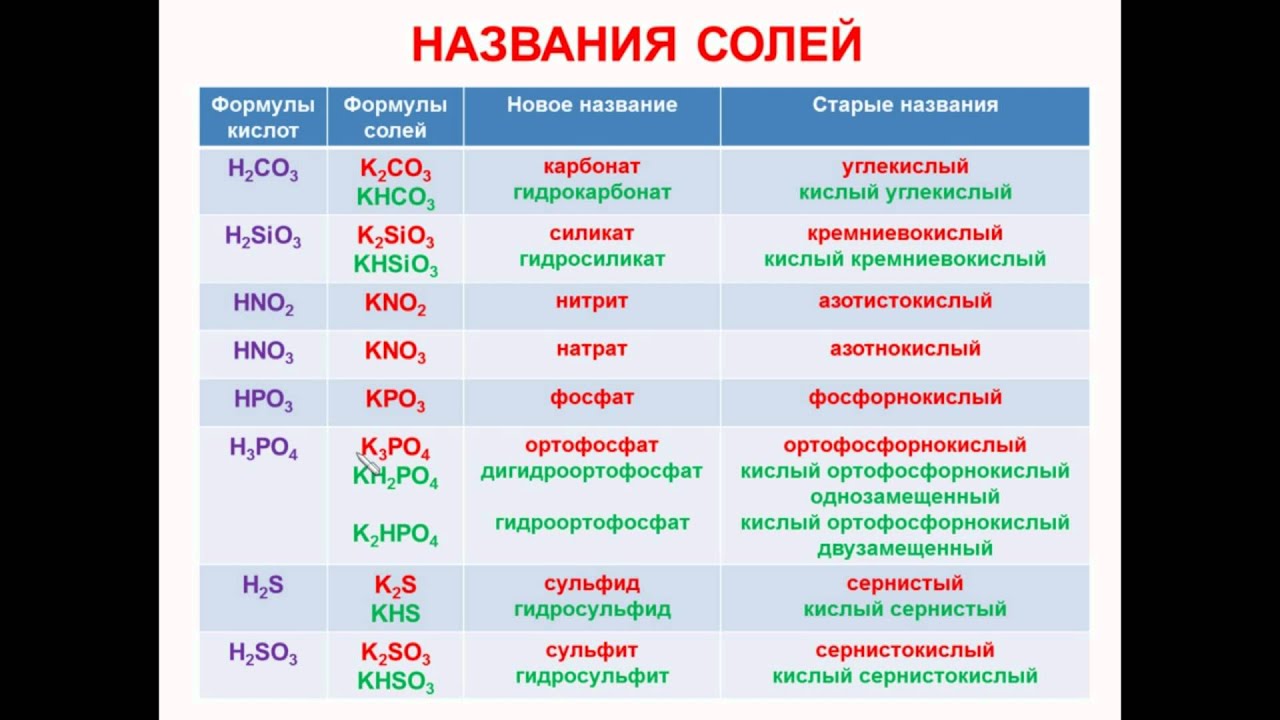
3. Определите степени окисления атомов элементов в солях: MgSO4, Ca3(PO4)2.
Ответ: Mg (+2), S (+6), O (−2), Ca (+2), P (+5), O (−2).
4*. Используя данные Интернета и книги, найдите отрывки из научно-популярных и художественных произведений, в которых упоминаются соли.
{module Адаптивный блок Адсенс в конце статьи}
кислота | соли | ||
Название | Формула | Кислотный остаток | Название аниона |
КИСЛОРОДСОДЕРЖАЩИЕ кислоты и их соли | |||
Азотная | HNO3 | NO3— | Нитрат |
Азотистая | HNO2 | NO2— | Нитрит |
Алюминиевая (орто) | H3AlO3 | AlO33- | Орто-алюминат |
Алюминиевая (мета) | HAlO2 | AlO2— | Мета-алюминат |
Бериллиевая | H2BeO2 | BeO22- | Бериллат |
Борная (орто) | H3BO3 | BO33- | Орто-борат |
Борная (мета) | HBO2 | BO2— | Мета-борат |
Борная (тетра) | H2B4O7 | B4O72- | Тетраборат |
Висмутовая | HBiO3 | BiO3— | Висмутат |
Вольфрамовая | H2WO4 | WO42- | Вольфрамат |
Железная | H2FeO4 | FeO42- | Феррат |
Железистая (мета) | HFeO2 | FeO2— | Феррит |
Кремниевая (орто) | H4SiO4 | SiO44- | Орто-силикат |
Кремниевая (мета) | H2SiO3 | SiO32- | Мета-силикат |
Марганцовая | HMnO4 | MnO4— | Перманганат |
Марганцовистая | H2MnO4 | MnO42- | Манганат |
Марганцоватистая | H2MnO3 | MnO32- | Манганит |
Молибденовая | H2MoO4 | MoO42- | Молибдат |
Мышьковая (орто) | H3AsO4 | AsO43- | Орто-арсенат |
Мышьяковая (мета) | HAsO3 | AsO3— | Мета-арсенат |
Димышьяковая | H4As2O7 | As2O74- | Диарсенат |
Оловянная (орто) | H4SnO4 | SnO44- | Орто-станнат |
Оловянная (мета) | H2SnO3 | SnO32- | Мета-станнат |
Оловянистая | H2SnO2 | SnO22- | Станнит |
Селеновая | H2SeO4 | SeO42- | Селенат |
Селенистая | H2SeO3 | SeO32- | Селенит |
Свинцовая (орто) | H4PbO4 | PbO44- | Орто-плюмбат |
Свинцовая (мета) | H2PbO3 | PbO32- | Мета-плюмбат |
Свинцовистая | H2PbO2 | PbO22- | Плюмбит |
Серная | H2SO4 | SO42- | Сульфат |
Дисерная | H2S2O7 | S2O72- | Дисульфат |
Надсерная | H2S2O8 | S2O82- | Пероксодисульфат |
Тиосерная | H2S2O3 | S2O32- | Тио-сульфат |
Дитионовая | H2S2O6 | S2O62- | Дитионат |
Тетратионовая | H2S4O6 | S4O62- | Тетратионат |
Сернистая | H2SO3 | SO32- | Сульфит |
Сурьмяная (орто) | H3SbO4 | SbO43- | Орто-антимонат |
Сурьмяная (мета) | HSbO3 | SbO3— | Мета-антимонат |
Теллуровая | H2TeO4 | TeO42- | Теллурат |
Угольная | H2CO3 | CO32- | Карбонат |
Муравьиная | HCOOH | HCOO— | Формиат |
Уксусная | CH3COOH | CH3COO— | Ацетат |
Фосфорная (орто) | H3PO4 | PO43- | Орто-фосфат |
Фосфорная (мета) | HPO3 | PO3— | Мета-фосфат |
Дифосфорная | H4P2O7 | P2O74- | Дифосфат |
Фосфористая (орто) | H3PO3 | Н2PO3—иHPO32- | Ди- и ГИДРО-фосфиты |
Фосфористая (мета) | HPO2 | PO2— | Мета-фосфит |
Фосфорноватистая | H3PO2 | H2PO2— | Дигидро-гипо-фосфит |
Хромовая | H2CrO4 | CrO42- | Хромат |
Дихромовая | H2Cr2O7 | Cr2O72- | Дихромат |
Хромистая (орто) | H3CrO3 | CrO33- | Орто-хромит |
Хромистая (мета) | HCrO2 | CrO2— | Мета-хромит |
ОКСО-кислоты и -соли элементов Cl,Br,I– ПОДОБНЫ. | |||
Хлорная | HClO4 | ClO4— | Пер-хлорат |
Хлорноватая | HClO3 | ClO3— | Хлорат |
Хлористая | HClO2 | ClO2— | Хлорит |
Хлорноватистая | HClO | ClO— | Гипо-хлорит |
Бромная | HBrO4 | BrO4— | Пер-бромат |
Бромноватая | HBrO3 | BrO3— | Бромат |
Бромристая | HBrO2 | BrO2— | Бромит |
Бромноватистая | HBrO | BrO— | Гипо-бромит |
Иодная | HIO4 | IO4— | Пер-иодат |
Иодноватая | HIO3 | IO3— | Иодат |
Иодистая | HIO2 | IO2— | Иодит |
Иодноватистая | HIO | IO— | Гипо-иодит |
БЕСКИСЛОРОДНЫЕ кислоты и их соли | |||
Фтороводородная | HF | F— | Фторид |
Хлороводородная | HCl | Cl— | Хлорид |
Бромоводородная | HBr | Br— | Бромид |
Иодоводородная | HI | I— | Иодид |
Циановодородная | HCN | CN— | Цианид |
Тиоциановодородная | HSCN | SCN— | Тио-цианид |
Селеноводородная | H2Se | Se2- | Селенид |
Сероводородная | H2S | S2- | Сульфид |
Теллуроводородная | H2Te | Te2- | Теллурид |
Формула солей Учебник по химии
Сноски: ссылка «Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 г. » (Красная книга)
» (Красная книга)
(1) «би» означает «два»; раз в два года — это событие, которое проводится два раза в год, раз в два года — это событие, которое происходит каждые два года, двухсотлетие — это событие, которое происходит каждые двести лет, велосипед имеет два колеса, биатлон — это спортивные соревнования, состоящие из двух соревнований (лыжный спорт и стрельба), бицепс это мышца с двумя головками или прикреплениями, двуязычный — это человек, который свободно говорит на двух языках и т. д.
(2) одноатомный или одноатомный или одноатомный? В процитированном выше документе IUPAC используется одноатомный атом, поэтому мы тоже будем его использовать!
(3) Формула соли такая же, как и ее эмпирическая формула.
Также см. Практическое исследование «Определение эмпирической формулы: оксид магния».
(4) Это место вокруг символа элемента на самом деле называется «правым нижним индексом».
| левый верхний индекс | символ | индекс правый верхний |
| левый нижний указатель | индекс нижний правый |
(5) Название элемента с символом Cs — цезий, но ИЮПАК также принимает альтернативное написание цезий.
(6) Систематическое название аммония в ИЮПАК — азан. Большинство людей до сих пор используют название аммоний для катиона NH 4 + , и это приемлемое название IUPAC.
(7) Чтобы соответствовать правилам построения формулы (порядок возрастания электроотрицательности, то есть символ для наименее электроотрицательного атома записывается первым, символ для наиболее электроотрицательного элемента записывается последним), гидроксиду следует дать формулу HO — НЕ ОН — .Однако формула гидроксида OH — хорошо известна и принята.
Систематические названия гидроксида ИЮПАК:
- оксиданид (замещающее название: вода, H 2 O, обозначается как оксидан, отрицательный ион, образующийся в результате дегидронации (депротонирования), обозначается HO —, следовательно, называется оксиданидом)
- гидридооксигенат (1-) (название добавки)
Именование солей Учебное пособие по химии
Сноски: ссылка «Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 г.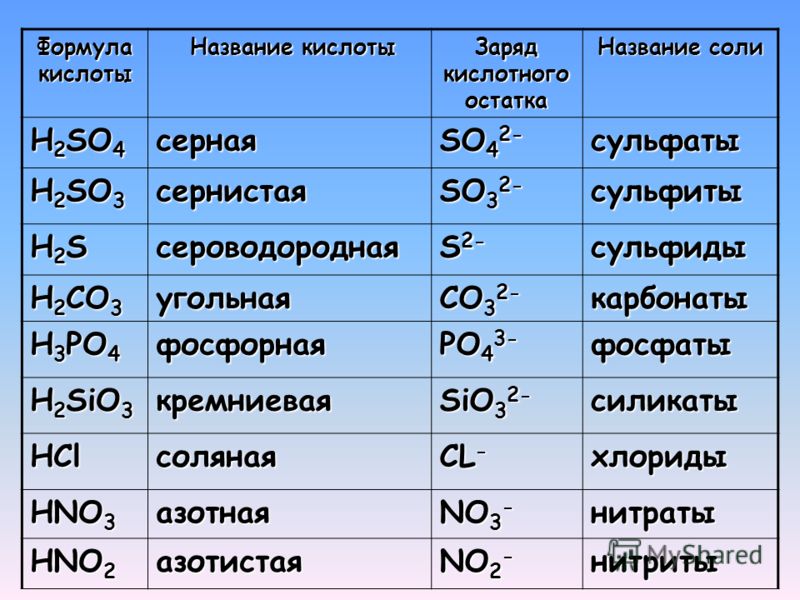 » (Красная книга)
» (Красная книга)
(1) одноатомный или одноатомный или одноатомный? В процитированном выше документе IUPAC используется одноатомный атом, поэтому мы тоже будем его использовать!
(2) Существует 3 основных системы ИЮПАК для наименования неорганических соединений:
Композиционная (стехиометрическая) номенклатура: не требует понимания структуры соединений внутри соединения и представляет собой систему номенклатуры, которую мы будем использовать здесь, во введении к названию неорганических солей ИЮПАК.
Заместительная номенклатура: требуется понимание соединений в структуре соединения.
Номенклатура добавок: требуется понимание соединений в структуре соединения, и это наиболее часто применяемая система для неорганических соединений.
(3) Степень окисления в виде римских цифр, помещенных в скобки после названия элемента, больше не рекомендуется IUPAC в качестве соглашения об именах.
(4) Первоначально использовалась латинская форма названий этих элементов с окончанием «ous» для более низкой степени окисления и окончанием «ic» для более высокой степени окисления.
(5) Название элемента с символом Cs — цезий, но ИЮПАК также принимает альтернативное написание цезий.
(6) Здесь мы обсуждаем только одноатомные анионы, O 2-, а не многоатомные анионы, такие как диоксид-анион и триоксид-анионы (аналогично для других неметаллов, которые образуют многоатомные ионы, такие как сера и йод, например)
Композиционные названия не рекомендуются для использования с многоатомными ионами элементов.
Названия составов и добавок оксидов Группы 1 соответствуют примеру калия, как показано ниже:
K 2 O оксид калия (оксид калия)
K 2 O 2 диоксид калия (2-) и название добавки: дикалий (диоксид)
KO 2 диоксид калия (1-) и название добавки монокалий (диоксид)
KO 3 триоксид калия (1-) и название добавки калий (триоксид)
(7) Чтобы соответствовать правилам построения формулы (порядок возрастания электроотрицательности, то есть символ для наименее электроотрицательного атома записывается первым, символ для наиболее электроотрицательного элемента записывается последним), гидроксиду следует дать формулу HO — НЕ ОН — . Однако формула гидроксида OH — хорошо известна и принята.
Однако формула гидроксида OH — хорошо известна и принята.
Систематические названия гидроксида ИЮПАК:
- оксиданид (замещающее название: вода, H 2 O, обозначается как оксидан, отрицательный ион, образующийся в результате дегидронации (депротонирования), обозначается HO —, следовательно, называется оксиданидом)
- гидридооксигенат (1-) (название добавки)
Обозначение солей — Кислоты, щелочи и соли — AQA — GCSE Combined Science Revision — AQA Trilogy
Кислоты нейтрализуются основаниями, включая щелочи, и карбонатами металлов.
Реакции с основаниями, в том числе с щелочами
Оксиды металлов являются основаниями. Обычно, когда кислота реагирует с оксидом металла, продукты представляют собой соль и воду.
0.0.0.1:0.1.0.$0.$2.$2″> Кислота + оксид металла → соль + водаНапример:
Серная кислота + оксид меди → сульфат меди + вода
H 2 SO 4 (водный) + CuO (s) → CuSO 4 (водн.) + H 2 O (l)
Щелочи — растворимые основания. Когда кислоты реагируют со щелочами, образуются соль и вода.Обычно:
Кислота + щелочь → соль + вода
Например:
$2.$9″> Азотная кислота + гидроксид натрия → нитрат натрия + водаHNO 3 (водн.) + NaOH (водн.) → NaNO 3 (водн. ) + H 2 O (l)
Реакции с карбонатами
При реакции кислоты с карбонатами образуются соль, вода и диоксид углерода. Обычно:
Кислота + карбонат → соль + вода + диоксид углерода
Например:
Соляная кислота + карбонат меди → хлорид меди + вода + диоксид углерода
2HCl (водный) + CuCO 2ffv5e2z4ew.0.0.0.1:0.1.0.$0.$3.$5.$1″> 3 (т) → CuCl 2 (водн.) + H 2 O (л) + CO 2 (г)
Обозначение солей
Название соли состоит из двух частей.Первая часть происходит из основания, карбоната щелочного металла или металла. Вторая часть происходит от кислоты:
- соляная кислота дает хлоридные соли
- азотная кислота дает нитратные соли
- серная кислота дает сульфатные соли
Предскажите название соли, образующейся, когда оксид меди вступает в реакцию с азотная кислота.
Образовавшаяся соль — нитрат меди.
Выведение формул солей
У соли нет общего заряда, так как сумма зарядов на их ионах равна нулю.Формулы некоторых общих ионов приведены ниже:
| Заряд на ионе | Примеры |
|---|---|
| +1 | K + , Na + , Li + |
| + 2 | 2ffv5e2z4ew.0.0.0.1:0.1.0.$0.$5.$2.$2.$1.$1″> Mg 2+ , Ca 2+ , Cu 2+ , Fe 2+ |
| +3 | Al 3+ , Fe 3+ |
| — 1 | 2ffv5e2z4ew.0.0.0.1:0.1.0.$0.$5.$2.$2.$3.$1″> Класс — , Br — , I — , NO 3 — |
| -2 | SO 4 2- |
| 0.0.0.1:0.1.0.$0.$5.$2.$2.$5.$0″>-3 | PO 4 3- |
Обратите внимание, что ионы элементов группы 1 имеют заряд +1, а ионы элементов группы 2 имеют заряд +2.Ионы элементов 7-й группы имеют заряд -1, а ионы элементов 6-й группы имеют заряд -2.
Пример
Какова формула сульфата алюминия?
Формулы ионов: Al 3+ и SO 4 $6.$4″> 2- .
Сумма зарядов ионов нейтральной соли должна быть равна нулю. Два иона Al 3+ имеют общий заряд +6, а три иона SO 4 2- имеют общий заряд -6.
Итак, формула Al 2 (SO 4 ) 3 .
- Вопрос
Какова формула хлорида магния?
2ffv5e2z4ew.0.0.0.1:0.1.0.$0.$5.$9.2″> Показать ответMgCl 2
Обозначение солей — Получение солей — GCSE Chemistry (Single Science) Revision — Другое
Соль — это любое соединение, образованное нейтрализацией кислоты основанием.
Название соли состоит из двух частей. Первая часть происходит из металла, оксида металла или карбоната металла. Вторая часть поступает из кислоты.
Вы всегда можете определить название соли, посмотрев на реагенты:
- азотная кислота всегда образует соли, оканчивающиеся на нитрат и содержащие ион нитрата 1sxi6ftix8k.0.0.0.1:0.1.0.$0.$1.$3.$0.$1″> , NO 3-
- соляная кислота всегда дает соли которые заканчиваются хлоридом и содержат ион хлорида , Cl —
- серная кислота всегда дает соли, которые заканчиваются сульфатом и содержат сульфат-ион, SO 4 2-
Например, если Оксид калия вступает в реакцию с серной кислотой, продуктами будут сульфат калия и вода.
1sxi6ftix8k.0.0.0.1:0.1.0.$0.$1.$5″> В таблице приведены еще несколько примеров:| Металл | Кислота | Соль | ||
|---|---|---|---|---|
| Натрий гидроксид | 1sxi6ftix8k.0.0.0.1:0.1.0.$0.$1.$6.$2.$0.$1″> вступает в реакцию с | 9034 с хлорной кислотой 9019 9039 до хлорной кислоты Хлорид натрия | ||
| Оксид меди | вступает в реакцию с | Hydro хлорной кислотой | 0.$0.$1.$6.$2.$1.$3″> с образованием | Хлорид меди |
| Сульфид натрия 9034 9034 с гидроксидом 9034 мочевая кислота | с образованием | Сульфат натрия | ||
| 1sxi6ftix8k.0.0.0.1:0.1.0.$0.$1.$6.$2.$3.$0.$0″> Оксид цинка | реагирует с | Сульфат мочевой кислоты | с образованием | Сульфат цинка |
| Общее название | Химическое название | Формула |
| Спирт, дерево | метанол, метиловый спирт | CH 3 OH |
| Спирт зерновой | Этанол или этиловый спирт | C 2 H 5 OH |
| Спирт, растирание | 2-пропанол, пропиловый спирт, изопропиловый спирт | |
| Спирт | Спирт этиловый | |
| Алка Зельцер | Бикарбонат натрия | |
| Квасцы | Калия сульфат алюминия додекагидрат | |
| Глинозем | оксид алюминия | Al 2 O 3 |
| Alundum | Плавленый оксид алюминия | |
| Антифриз | Этиленгликоль | |
| Антиперсперант | Хлоргидрат алюминия | |
| Царская водка | 1: 3 смесь азотной и соляная кислота | HNO 3 + HCl |
| Аспирин | Кислота ацетилсалициловая | |
| Пищевая сода | Натрия гидрокарбонат | NaHCO 3 |
| Разрыхлитель | Бикарбонат натрия | |
| Банановое масло | Амилацетат | |
| Барыта | Оксид бария | |
| Бариты | Сульфат бария | |
| Аккумуляторная кислота | Кислота серная | |
| бокситы | Гидратированный оксид алюминия | |
| Бензол | Бензол | |
| Отбеливатель (прачечный) | Гипохлорит натрия | NaClO |
| Обесцвечивающий порошок | Гипохлорит хлорида кальция | |
| Синий витрол | Сульфат меди (II) | CuSO 4 * 5H 2 O |
| Bluestone | Пентагидрат сульфата меди II | CuSO 3 * 5H 2 O |
| Борная кислота | Кислота борная | |
| Borax | Декагидрат тетрабората натрия | Na 2 B 4 O 7 * 10H 2 O |
| Латунь | Сплав меди и цинка | |
| Сера | Сера | S |
| Бронза | Сплав меди и олова | |
| Каламин | Карбонат цинка | |
| Кальцит | Карбонат кальция | |
| Калгон | Гексаметафосфат кальция | |
| Каломель | Хлорид ртути | |
| Карболовая кислота | Фенол | |
| Тетрахлорметан | Тетрахлорметан | CCl 4 |
| Карборунд | Карбид кремния | |
| Сода каустическая | Натрия гидроксид | |
| Мел | Карбонат кальция | |
| Селитра Чили | Нитрат натрия | |
| Хлороформ | Трихлорметан | CHCl 3 |
| Хлорокс | Гипохлористая кислота | |
| Желтый хром | Хромат свинца | |
| Киноварь | Сульфид ртути II | HgS |
| Клубная газировка | Угольная кислота | |
| Коппера | Гидратированный сульфат железа | |
| Коррозионный сублимат | Хлорид ртути | |
| Винный камень | Калий гидротартрат | KHC 4 H 4 O 6 |
| ДДТ | Дихлордифенилтрихлорэтан | |
| декстроза | Глюкоза | |
| Алмаз | Углерод | C |
| Доломит | Карбонат кальция и магния | CaCO 3 * MgCO 3 |
| Драно | Натрия гидроксид | |
| Средство для очистки духового шкафа | Натрия гидроксид | |
| Яичная скорлупа | Карбонат кальция | |
| Соль Эпсома | Гептагидрат сульфата магния | MgSO 4 * 7H 2 O |
| Эфир | Этиловый эфир | |
| Ex-lax | Фенолфталеин | |
| Компонент удобрения | Аммиачная селитра | |
| Флуростан | Фторид олова | |
| Золото дурака | Пирит железный | |
| Формалин | 40% раствор формальдегида | |
| Фреон (хладагент) | Дихлордифторметан | CCl 2 F 2 |
| Галена | Сульфид цинка | |
| Галена | Сульфид свинца II | PbS |
| Глауберова соль | Сульфат натрия гидратированный | |
| Глицерин | Глицерин | |
| Зерновой спирт | Этанол или этиловый спирт | C 2 H 5 OH |
| Графит | Углерод | C |
| Купорос зеленый | Гидратированный сульфат железа | |
| Гипс | Дигидрат сульфата кальция | CaSO 4 * 2H 2 O |
| Тяжелая вода | Оксид дейтерия | |
| Гипо | Пентагидрат тиосульфата натрия | Na 2 S 2 O 3 * 5H 2 O |
| Кусок льда | Хлорид кальция | |
| Инвертный сахар | Смесь глюкозы и фруктозы | |
| Веселящий газ | Оксид диазота | N 2 O |
| Левулоза | Фруктоза | |
| Лайм | Оксид кальция | CaO |
| Известняк | Карбонат кальция | CaCO 3 |
| Жидкая бумага | диоксид титана | |
| Соль Lite | Калия хлорид | |
| Горит | Окись свинца | |
| Литопон | Смесь сульфида цинка и сульфат бария | |
| Печень серы | Сульфид калия | |
| LOX | Кислород жидкий | |
| Лунный каустик | Нитрат серебра | |
| Щелок | Натрия гидроксид | NaOH |
| Магнезия | Оксид магния | |
| Мрамор | Карбонат кальция | CaCO 3 |
| Маргарин | Частично насыщенная жирная кислота | |
| Болотный газ | метан | |
| МЭК | Метилэтилкетон | CH 3 COC 2 H 5 |
| Микрокосмическая соль | Натрий-аммоний гидратированный гидрофосфат | |
| Сахар молочный | Лактоза | |
| Молоко магнезиальное | Гидроксид магния | Mg (OH) 2 |
| Лаймовое молоко | Гидроксид кальция | |
| Соль Мора | Аммоний железистый гидратированный сульфат | |
| Шарики от моли | Нафталин | |
| Сообщение | натрия гидроглутамат | |
| Кислота соляная | Кислота соляная | HCl |
| Nutrasweet | аспартам | |
| Масло горького миндаля | Бензальдегид | |
| Купоросное масло | Серная кислота (конц. ) ) | H 2 SO 4 |
| Масло мирбена | Нитробензол | |
| Купоросное масло | Кислота серная концентрированная | |
| Масло зимнее зеленое | метилсалицилат | |
| Олеум | Кислота дымящаяся серная | |
| Парижский зеленый | Двойная соль ацетата меди и арсенит меди | |
| Perier | Угольная кислота | |
| Олово | Сплав олова, сурьмы, меди, и свинец | |
| Фосген | Карбонилхлорид | |
| Фотографическая гипо | Тиосульфат натрия | |
| Пикриновая кислота | Тринитрофенол | |
| Гипс | Гидроксид кальция | |
| Штукатурка Парижская | Полугидрат сульфата кальция | CaSO 4 * (1/2) H 2 O |
| Калий | Карбонат калия | K 2 CO 3 |
| Прусский синий | Ферроцианид железа | |
| Пирит (золото дураков) | Дисульфид железа | FeS 2 |
| Кварцевый | Диоксид кремния | SiO 2 |
| Известь негашеная | Оксид кальция | |
| Ртуть | Меркурий | Hg |
| Рошельская соль | Тартрат калия натрия | |
| Ролаидс | дигидроксиалюминий натрия карбонат | |
| Руж | Оксид железа | |
| Медицинский спирт | 2-пропанол, пропиловый спирт, изопропиловый спирт | |
| Нашатырный спирт нашатырный | Хлорид аммония | NH 4 Cl |
| Сода содовая | Карбонат натрия гидратированный | |
| Нашатырный спирт нашатырный | Хлорид аммония | |
| Соль столовая | Натрия хлорид | NaCl |
| Соль легкая | Калия хлорид | |
| Селитра | Нитрат калия | KNO 3 |
| Песок | Диоксид кремния | SiO 2 |
| Sani-flush | Бисульфат натрия | |
| Обертка Saran | Поли-1,1-дихлорэтилен | |
| Кремнезем | Диоксид кремния | |
| Известь гашеная | Гидроксид кальция | Ca (OH) 2 |
| Нюхательные соли | Карбонат аммония | |
| Сода кальцинированная (сода стиральная) | Карбонат натрия | |
| Припой | Сплав олова и сурьмы | |
| Сахар | Сахароза | |
| Сахар столовый | Сахароза | C 12 H 22 O 11 |
| Сахар свинец | Ацетат свинца гидратированный | |
| Лосьон для загара | Парааминобензойная кислота | |
| тефлон | Полимер тетрафторэтилена | |
| TNT | Тринитротолуол | |
| Толуол | Толуол | |
| ТСП | (Tri) Фосфат натрия | Na 3 PO 4 |
| Tums | Карбонат кальция | |
| Синий Тернбулла | Феррицианид железа | |
| Тайленол | Ацетоминофен | |
| Уксус | Уксусная кислота, этановая кислота | |
| Витамин C | Кислота аскорбиновая | |
| Сода стиральная | Декагидрат карбоната натрия | NaCO 3 * 10H 2 O |
| Сода стиральная | Карбонат натрия гидратированный | |
| Устройство для смягчения воды | Гидроксид бария | |
| Белый свинец | Карбонат свинца основной | |
| Windex | Аммиак | |
| Древесный спирт | Метиловый спирт, метанол | CH 3 OH |
| Смесь цинка | Сульфид цинка |
В формуле: NaHCO 3 а) Отдельно от соли катион и анион Вычисляет заряд аниона (отрицательного иона) из заряд катиона (положительный ион) б) Вычисляет степень окисления
центральный атом, зная, что кислород имеет степень окисления -2
и водород +1. c) Напоминает степени окисления центральный элемент и записывает префиксы и суффиксы. Первое слово — это название металла, за которым следует сразу по степени окисления в скобках и римскими числами. Если Степень окисления металла неизменна, не указывается. Секунда слово — это название аниона с приставкой водород- или дигидроген-. | На имя: Гидросульфит натрия а) Напишите символ катион с его электрическим зарядом. На основе префиксов и суффиксы определяют номер центрального элемента окисления, участвующего в анионе: б) Образует оксикислоту S +4 c) Удаляет анион из кислоты. Анион имеет столько отрицательных электрических зарядов, сколько водород. теряет кислоту.Вычислите наименьшее количество ионов каждого типа, которое вам нужно, чтобы соединение было нейтральный. | Как и в оксикислотах, мы используем две
номенклатуры: это дополнительные названия и стехиометрические названия. Добавка называет для анионов: основаны на структуре анионов, по-разному называя кислород, который связаны с кислыми атомами водорода ( гидроксидо ), а кислород объединяет только центральные элемент ( оксид ).Эти имена содержат префиксы, соответствующие ди-, три-, тетра- и так далее. И названы в алфавитном порядке, за которыми следует имя центральный атом, заканчивающийся на , съел , за которым следует номер заряда с знак минус в скобках. (Система Ювенса-Бассетта) Стехиометрические названия для анионов: образованы словом « водород » с приставкой, обозначающей число атомов водорода и слово « оксидо » с префикс, который показывает нам количество атомов кислорода, за которым следует центральный атом закончился съел , за которым следует номер заряда с минусом знак в скобках.(Система Ювенса-Бассетта)
Названия присадок для солей : Напишите название катиона, а затем название
анион, с зарядом (система Ювенса-Бассетта) в кантионах, не имеющих фиксированной
степень окисления. Стехиометрические имена для солей : Напишите название катиона с префиксом ди-, три-, тетра- и т.д. мы предлагаем повторение катиона. Вслед за анионом без заряда, при необходимости с приставкой, трис, тетракис, пентаки, hexakis и др. говорят нам, что повторение аниона.
|
солей, используемых в повседневной жизни — StudiousGuy
Когда мы говорим о соли, первое, что может прийти в голову, — это белый гранулированный порошок, который мы используем для придания соленого вкуса нашим продуктам питания. Что ж. этот порошок, который мы называем поваренной солью, принадлежит к зонтичной группе химических соединений, называемых «солями». В химии соли определяются как соединения, содержащие совокупность катионов и анионов с чистым нейтральным зарядом. Хотя многие соли существуют в естественных условиях в нашем окружении, химический метод получения солей в лабораториях называется реакцией нейтрализации, в которой кислоты и основания реагируют с образованием ионных соединений (солей) и воды. Соли обычно твердые при комнатной температуре и плавятся только при воздействии высоких температур.Многие соли обладают значительной растворимостью в воде или других полярных растворителях. В отличие от молекулярных соединений, соли в растворе диссоциируют на анионные и катионные компоненты. Химические и физические свойства солей различаются в зависимости от составляющих анионов и катионов. Давайте взглянем на несколько солей, которые мы используем в повседневной жизни.
Что ж. этот порошок, который мы называем поваренной солью, принадлежит к зонтичной группе химических соединений, называемых «солями». В химии соли определяются как соединения, содержащие совокупность катионов и анионов с чистым нейтральным зарядом. Хотя многие соли существуют в естественных условиях в нашем окружении, химический метод получения солей в лабораториях называется реакцией нейтрализации, в которой кислоты и основания реагируют с образованием ионных соединений (солей) и воды. Соли обычно твердые при комнатной температуре и плавятся только при воздействии высоких температур.Многие соли обладают значительной растворимостью в воде или других полярных растворителях. В отличие от молекулярных соединений, соли в растворе диссоциируют на анионные и катионные компоненты. Химические и физические свойства солей различаются в зависимости от составляющих анионов и катионов. Давайте взглянем на несколько солей, которые мы используем в повседневной жизни.
Указатель статей (Нажмите, чтобы перейти)
1. Соль поваренная
Соль поваренная Хлорид натрия (NaCl), также известный как поваренная соль или поваренная соль, является одной из наиболее распространенных солей, с которыми мы сталкиваемся в повседневной жизни.Наиболее распространенными источниками хлорида натрия являются морская вода и минералы каменной соли. Он не только придает вкус простой пище, но и является одним из важнейших макроэлементов для нашего организма. Это основной источник ионов натрия и хлора в рационе человека. Хотя натрий сильно влияет на объем внеклеточной жидкости и позволяет нервным клеткам и мышцам взаимодействовать друг с другом, хлор помогает поддерживать осмотическое давление жидкости. Соль также является отличным антиобледенительным средством, поскольку снижает температуру замерзания воды.Зимой соль используется для удаления снега, покрывающего дороги.
2. Сода стиральная Стиральная сода — это общее название щелочной соли, называемой карбонатом натрия, содержащей десять молекул воды ({Na} _ {2} {CO} _ {3} . 10 {H} _ {2} {O}). Карбонат натрия естественным образом содержится в золе многих растений. Его часто находят в отложениях полезных ископаемых, оставшихся после сезонных озер. Промышленное производство стиральной соды осуществляется по технологии Solvay по следующей схеме:
10 {H} _ {2} {O}). Карбонат натрия естественным образом содержится в золе многих растений. Его часто находят в отложениях полезных ископаемых, оставшихся после сезонных озер. Промышленное производство стиральной соды осуществляется по технологии Solvay по следующей схеме:
В основном используется как очищающее средство для стирки одежды.Карбонат натрия «смягчает» воду, помогая другим чистящим ингредиентам поднимать грязь с тканей и удерживать ее в воде для стирки. Стиральная сода связывает минералы и позволяет воде правильно впитываться в волокна для чистки одежды.
3. Пищевая сода Пищевая сода — еще одно химическое вещество, которое чаще всего встречается в домашнем хозяйстве, особенно на кухне. Это один из наиболее часто используемых разрыхлителей, используемых в хлебобулочных изделиях для улучшения их текстуры и внешнего вида.В химии он известен под названием бикарбонат натрия (название IUPAC: гидрокарбонат натрия) и существует в природе в виде кристаллической структуры, нахколита, который позже измельчается с образованием мелкодисперсной пищевой соды. Это щелочное химическое соединение с формулой {NaHCO} _ {3}. Пищевая сода обладает антибактериальными и антимикробными свойствами, поэтому идеально подходит для гигиены полости рта. Пищевая сода также является нейтрализующим агентом, и ее можно эффективно использовать для лечения кислотного рефлюкса. Тем более, что нельзя путать пищевую соду с разрыхлителем.Хотя оба соединения могут выглядеть одинаково, разрыхлитель представляет собой смесь пищевой соды, зубного камня (сухой кислоты) и иногда кукурузного крахмала.
Это щелочное химическое соединение с формулой {NaHCO} _ {3}. Пищевая сода обладает антибактериальными и антимикробными свойствами, поэтому идеально подходит для гигиены полости рта. Пищевая сода также является нейтрализующим агентом, и ее можно эффективно использовать для лечения кислотного рефлюкса. Тем более, что нельзя путать пищевую соду с разрыхлителем.Хотя оба соединения могут выглядеть одинаково, разрыхлитель представляет собой смесь пищевой соды, зубного камня (сухой кислоты) и иногда кукурузного крахмала.
Каустическая сода, также известная как щелок, — это общее название гидроксида натрия, неорганической соли с химической формулой {Na} {OH}. Название каустик дано из-за агрессивной природы гидроксида натрия. Это сильно едкое основание и щелочь, которая разлагает белки при температуре окружающей среды и может вызвать серьезные химические ожоги открытых участков кожи.Его основные области применения включают очистку воды, пищу, текстиль, металлообработку, горнодобывающую промышленность, производство стекла и т. Д. В микромасштабе гидроксид натрия устраняет белки и нуклеиновые кислоты и выводит из строя большинство вирусов, с которыми он контактирует. Это химическое вещество также уничтожает дрожжи, грибки и эндотоксины. Из-за его эффективности в удалении микроорганизмов гидроксид натрия обычно используется в медицинской промышленности в качестве критически важного компонента санитарии. В небольших разведениях (5%) гидроксид натрия обычно содержится в некоторых продуктах личной гигиены, таких как лак для волос, краска для волос, шампунь, масла для загара, химические выпрямители для волос и т. Д.
Д. В микромасштабе гидроксид натрия устраняет белки и нуклеиновые кислоты и выводит из строя большинство вирусов, с которыми он контактирует. Это химическое вещество также уничтожает дрожжи, грибки и эндотоксины. Из-за его эффективности в удалении микроорганизмов гидроксид натрия обычно используется в медицинской промышленности в качестве критически важного компонента санитарии. В небольших разведениях (5%) гидроксид натрия обычно содержится в некоторых продуктах личной гигиены, таких как лак для волос, краска для волос, шампунь, масла для загара, химические выпрямители для волос и т. Д.
5. Обесцвечивающий порошок
Обесцвечивающий порошок — это название соединения гипохлорита кальция {Ca} ({OCl}) _ {2}, которое используется в основном как дезинфицирующее и бактерицидное средство, особенно при стерилизации питьевой воды. Когда обесцвечивающий порошок подвергается воздействию воды, он выделяет хлор, который убивает микробы и дезинфицирует область. Во время стирки белья хлор вступает в реакцию с водой и выделяет кислород, который превращает грязь в растворимые частицы, которые удаляются моющими средствами в процессе стирки.
Когда обесцвечивающий порошок подвергается воздействию воды, он выделяет хлор, который убивает микробы и дезинфицирует область. Во время стирки белья хлор вступает в реакцию с водой и выделяет кислород, который превращает грязь в растворимые частицы, которые удаляются моющими средствами в процессе стирки.
Парижская штукатурка, также известная как гипсовая штукатурка, — это общее название химического полугидрата сульфата кальция, химически гидратированной соли с химической формулой {CaSO} _ {4} • {1 / 2H} _ {2} {O}. Штукатурка «Париж» изготавливается под воздействием тепла на гипс. Гипс — еще одна гидратированная соль. Химическая формула гипса — дигидрат сульфата кальция, {CaSO} _ {4} • {2 h3O}. При нагревании часть воды улетучивается в процессе испарения, образуя гипс Парижа (ПОП).При смешивании с водой он образует полутвердое вещество, которое быстро затвердевает, что может использоваться в различных архитектурных, декоративных и ремонтных функциях. В медицинском секторе парный гипс используется для изготовления слепков, которые восстанавливают сломанные кости, удерживая их в одном месте. Кроме того, он также используется в стоматологии для изготовления коронок для замены зубов.
В медицинском секторе парный гипс используется для изготовления слепков, которые восстанавливают сломанные кости, удерживая их в одном месте. Кроме того, он также используется в стоматологии для изготовления коронок для замены зубов.
Английская соль — одна из наиболее распространенных гидратированных солей неорганического химического соединения сульфата магния, {MgSO} _ {4}.Это природная соль горького вкуса с химической формулой {MgSO} _ {4} • {7H} _ {2} {O}, получившая свое название от английского города Эпсом, где она была впервые обнаружена. Помимо того, что она является естественным источником магния и серы, английская соль широко используется в качестве соли для купания для снятия болей в теле, отшелушивания кожи и расслабления нежных мышц. Это также одобренное FDA слабительное, которое может помочь при запоре. Хотя английская соль не является универсальным удобрением, распыление раствора английской соли с низкой концентрацией в вашем саду может помочь вам избавиться от нежелательных сорняков и сделать ваши комнатные растения более здоровыми и зелеными.
Бура, также известная как борат натрия, тетраборат натрия или тетраборат динатрия, представляет собой природную минеральную соль с химической формулой {Na} _ {2} {B} _ {4} {O} _ {7} • {10H } _ {2} {O} Международный союз теоретической и прикладной химии (IUPAC) называет бура декагидратом тетрабората натрия. Бура встречается в естественных условиях в отложениях эвапоритов, образовавшихся в результате многократного испарения сезонных озер; хотя его также можно получить синтетическим путем из других соединений бора.Хотя бура находит широкое применение в нескольких промышленных и бытовых применениях, она наиболее известна своим превосходным очищающим действием. При смешивании с водой бура превращает воду в перекись водорода, сильные окислительные свойства которой делают ее мощным дезинфицирующим и чистящим раствором. Бура также используется в производстве косметики для защиты от грибка и плесени. Бура также является эффективным химическим веществом для борьбы с устойчивыми грибковыми инфекциями, такими как микоз.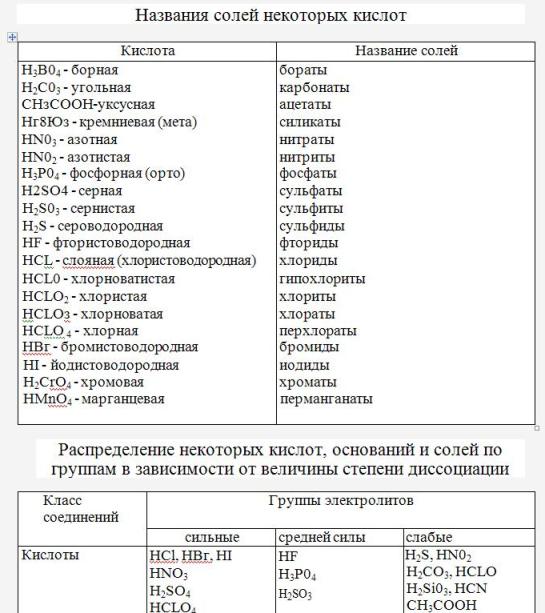
Нитрат калия, также известный как селитра, представляет собой ионную соль с химической формулой {KNO} _ {3}. Его обычно используют в качестве удобрения для выращивания ценных культур, которое обеспечивает растения азотом и калием, двумя наиболее важными питательными веществами. Из-за своей исключительной окислительной природы нитрат калия также используется в ракетном топливе, фейерверках и порохе. Хотя нитрат калия используется в порохе, сам по себе нитрат калия не является горючим или легковоспламеняющимся.Нитрат калия — распространенный активный ингредиент зубной пасты, обладающий действием против чувствительности. Он обеспечивает повышенную защиту от болезненной чувствительности зубов к холоду, теплу, кислотам, сладостям или контакту. Он также используется в пищевой промышленности для защиты мяса от микробов.
10. Калийные квасцы Сульфат калия и алюминия, широко известный как калийные квасцы, представляет собой двойную соль с химической формулой {K} {Al} ({SO} _ {4}) _ {2} · {12H} _ {2} {O}.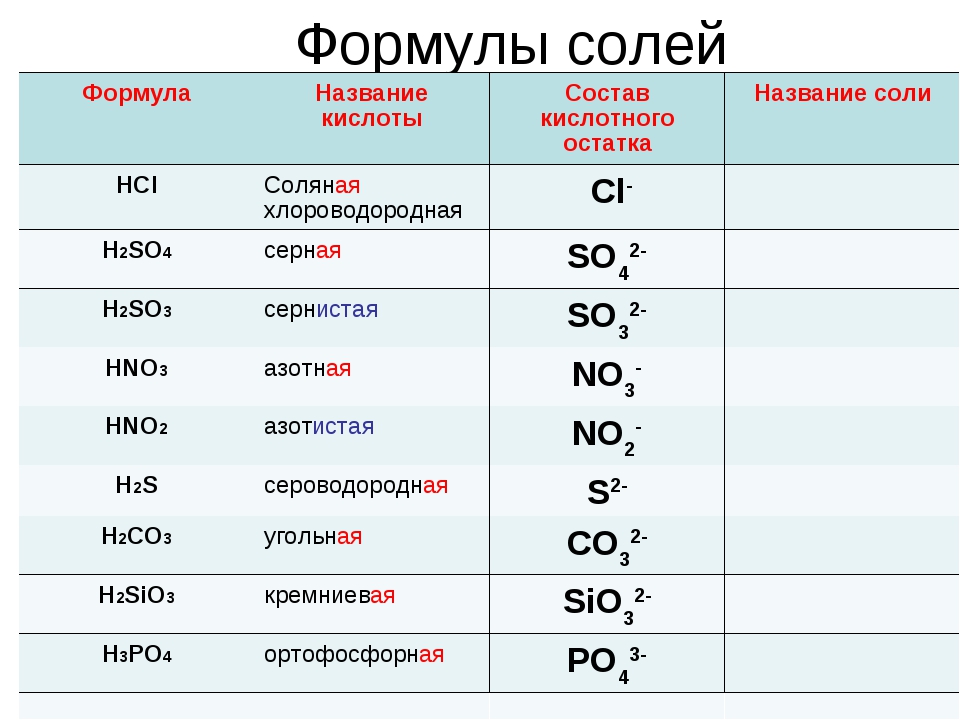

 Дать название веществу, формула которого h3CO3:______________________
Дать название веществу, формула которого h3CO3:______________________ Учащиеся приводят примеры растворимых и нерастворимых солей.
Учащиеся приводят примеры растворимых и нерастворимых солей.