«Состав и названия оксидов, кислот, оснований , солей» | План-конспект урока по химии (8 класс) по теме:
Состав и названия оксидов, кислот, оснований, солей
Цель урока: повторить и обобщить материал о составе веществ, относящихся к основным классам неорганических соединений, закрепить умения учащихся составлять формулы и давать названия веществам.
Задачи урока
Образовательные:
1. выявить прочность усвоения учащимися основных понятий темы: оксиды, кислоты, основания, соли;
2. закрепить умение учащихся составлять формулы веществ;
3. закрепить умение учащихся давать названия веществам;
4. закрепить умение учащихся классифицировать вещества по их формулам.
Развивающие:
1. развивать мышление;
2. развивать зрительную память учащихся.
Воспитательные:
1. воспитание самостоятельности;
2. показать практическое значение изучаемых веществ.
Оборудование:
Таблица «Классификация неорганических веществ»
Периодическая система химических элементов Д. И. Менделеева
И. Менделеева
Таблица растворимости
Карточки с общими формулами оксидов, кислот, оснований, солей
Магниты
Карточки для самостоятельной работы
Ход урока:
I. Организационная часть урока.
Сообщение темы, цели и задач урока.
На предыдущих уроках мы познакомились с основными классами неорганических соединений. Среди этих соединений встречается много знакомых нам веществ, например, соляная кислота, которая входит в состав желудочного сока, природные соединения оксида алюминия — драгоценные камни рубин и сапфир, гидроксид калия, используемый в элементах питания, карбонат кальция — мрамор и известняк. Сегодня на уроке мы повторим состав и названия этих соединений, Это понадобится нам в дальнейшем при изучении классификации и химических свойств этих соединений.
II. Основная часть урока.
Фронтальный опрос.
1. Перечислите классы неорганических соединений.
2. Дайте определение оксидам, основаниям, кислотам, солям.
Самостоятельная работа.
Задание 1. Из формул, приведенных ниже, выпишите отдельно оксиды, основания, кислоты, соли и дайте им названия:
НСl, СаО, NaOH, Ca(OH)2, K2CО3, HNО3, Fe(OH)2, СО2, h3SО4, Fе2О3, CuSО4, NaCl
(Учащимся выданы карточки с заданием 1. Во время работы класса 4-х учащихся вызывают для выполнения того же задания у доски: один выписывает формулы оксидов, второй — оснований, третий — кислот, четвертый – солей, записи нe видны классу. Когда работа заканчивается, эти записи открывают для проверки результатов, для исправления ошибок и самопроверки. Названия веществам даются устно.)
Затем проводится беседа по этому заданию:
1) Почему вещества СаО, СО2, Fe2О3 относят к оксидам?
2) Что общего в составе приведенных оснований, кислот, солей?
3) Что общего и чем различаются по составу кислоты и соли, основания и соли?
4) В каких случаях в названиях соединений в скобках приводится римская цифра?
Задание 2. Составьте формулы хлорида меди (II), гидроксида магния, сернистой кислоты, оксида серы (VI), сульфата натрия, фосфорной кислоты, гидроксида железа (III), оксида калия.
(Учащимся выданы карточки с заданием 2. Во время работы класса 1 ученика вызывают для выполнения того же задания у доски, записи нe видны классу. Когда работа заканчивается, эти записи открывают для самопроверки, взаимопроверки, для исправления ошибок).
Фронтальная работа
Задание 3. Задание «Третий лишний»
Среди каждой тройки веществ найдите вещество, отличающееся от двух других. Укажите признак отличия.
1. | НNО3 | НСl | Н2О |
2. | Na2SО4 | Н2SО4 | ВаСl2 |
3. | Са(ОН)2 | Al(ОН)3 | Al(NО3)3 |
4. | Cа(ОН)2 | NaОН | Cu(ОН)2 |
5. | P2О5 | SО2 | MgО |
6. | ВаО | СО2 | СаО |
Задание 4. Задание «Найди формулу»
На доску проецируется задание 4 на установление соответствия между формулой вещества и его названием.
Какая формула соответствует
1. гидроксиду натрия
NaН NaОН NaНСО3 Na2СО3
2. сероводородной кислоте
Н2S Н2SО3 Н2SО4 Н2S2О7
3. гидроксиду бария
Ва(ОН)2 Ве(ОН)2 НВrO BаОНCl
4. карбонату калия
СаСО3 К2SО3 К2СО3 КНСО3
5. соляной кислоте
соляной кислоте
НСl НСlО НСlО3 НСlО4
6. сульфиту калия
К2СО3 К2SО4 К2SО3 К2S
Задание 5.
Учащиеся отгадывают химические загадки.
1. Кислота, раствор которой используется в аккумуляторах в автомобиле.
2. Кислота тепла боится, быстро в воду превратится.
3. Расскажите в чем тут дело: гасили то, что не горело?
4. Только в воду соль попала, холодней в стакане стало.
5. Порознь каждый ядовит, вместе – будет аппетит.
6. Красив, наряден карбонат, ему строитель очень рад.
7. Поташ, селитру, сильвинит какой металл объединит?
8. Вещество, необходимое растениям для фотосинтеза.
Ответы:
1. Серная кислота.
2. Угольная кислота.
3. Гашение извести или питьевой соды.
4. Нитрат аммония.
5. Хлорид натрия.
6. Мрамор и известняк.
7. Калий.
8. Углекислый газ, вода.
Задание 6. Закрепление материала.
Самостоятельная работа.
Из формул, приведенных ниже, выпишите отдельно оксиды, основания, кислоты, соли и дайте им названия:
КОН, MgО, НСl , Cu(ОН)2 , Н2SО4, СаСО3, SО2, КСl.
Ва(ОН)2 , НNО3, SО3, CaСl2, К2СО3, CuО, КОН, Н2SО3.
АgNО3, Na2SО4, NН3, Al(ОН)3, P2О5, СаS, Fe(ОН)3, СS2, FeСl2, Н2S, Na2О, Н3РО4.
III. Подведение итогов урока.
Задание на дом. Напишите формулы веществ и расскажите, где используются эти вещества: речной песок, углекислый газ, карбонат кальция.
Решение упражнений по теме «Оксиды, основания, кислоты, соли. Их состав, и названия»
Сценарий урока
Решение упражнений по теме «Оксиды, основания, кислоты, соли. Их состав, и названия»
Цель: Повторить состав, названия оксидов, кислот, оснований, солей.
Развивать умение учащихся применять теоретические знания при решении упражнений.
Формировать научное мировоззрение у учащихся.
Ход урока
I Организационный этап
II Актуализация опорных знаний
Беседа
Назовите основные классы неорганических соединений.
Какие вещества называются а) оксидами б) кислотами в) основаниями г) солями
Сравните состав а) оснований и солей
б) кислот и солей
III Решение упражнений
Упражнение 1:
Н3РО4 Cu(OH)2 Na2O AlCl3 H2CO3 Mg(NO3)2 SO3 KOH
Беседа
В результате каких реакций образуется оксид
Упражнение 2: Закончите уравнения реакций. Назовите продукты реакций.
а) Ag + O2 в) Ca + O2
б) P + O2 г) Al + O2
Упражнение 3: Химический диктант
КОН Cu(OH)2 Ba(OH)2 Fe(OH)3 NaOH Al(OH)3
1. Укажите названия оснований (устно)
Укажите названия оснований (устно)
2.На какие группы делятся все основания?
3.Подчеркните щелочи, нерастворимые основания
4.Укажите валентность металлов в основаниях.
Упражнение 4: Химический диктант
Н3РО4 HCl HNO3 H2CO3 H2SO4
Беседа
1.Дайте название веществам
2.По каким признакам можно классифицировать кислоты
3.Охарактеризуйте каждую кислоту по составу и основаниям
Проверка д/з: тестовые задания с.152
4.Как распознавать растворы кислоты и щелочи?
5.Что такое индикатор?
Упражнение 5: (устно) Распознать с помощью индикатора растворы кислоты, щелочи и Н2О
Беседа
1.Что является продуктом взаимодействия основания и кислоты?
2.Что называется солью?
Проверка д/з №3 с.160
Упражнение 6: Дайте название солям:
MgSO4 MnCl2 Ca3(PO4)2 Zn(NO3)2 BaCO3
C помощью таблицы растворимости найдите растворимые соли и подчеркните их формулы.
Упражнение 7: Химический диктант
Na3PO4 BaSO4 FeCl3 Al(No3)3 K2CO3
Самостоятельная работа
Укажите класс соединений и назовите вещества
I HNO3 Al2O3 Mg(OH)2 BaCl2
II Ca(OH)2 Na2SO4 HCl MgOНаписать формулы соединений
I гидроксид бария II серная кислота
фосфат калия гидроксид железа (II)
угольная кислота карбонат натрия
оксид фосфата (V) оксид калия
Задача: Какое количество вещества составляет гидроксид меди(II) массой 4,9г?
Домашнее задание: повторить §40,41,44,46; письменно №2(с.159) (кроме NaH SO 4 Ca(HCO3)2)
Номенклатура солей, кислот и оснований
В разделе 2 вы уже познакомились с классификацией неорганических веществ, с номенклатурой оксидов, оснований, кислот, амфотерных гидроксидов и важнейших типов солей. Ниже рассматриваются общие химические свойства и способы получения этих важнейших классов неорганических веществ с позиций тех теоретических представлений, которые были получены вами при изучении предыдущих разделов, в частности, с позиции теории электролитической диссоциации. В заключение вскрывается генетическая связь между различными классами неорганических веществ. [c.225]
Ниже рассматриваются общие химические свойства и способы получения этих важнейших классов неорганических веществ с позиций тех теоретических представлений, которые были получены вами при изучении предыдущих разделов, в частности, с позиции теории электролитической диссоциации. В заключение вскрывается генетическая связь между различными классами неорганических веществ. [c.225] Аналитический материал, накопленный к тому времени, позволил Лавуазье создать одну из первых рациональных классификаций химических соединений, а на ее основе — их новую номенклатуру, часть принципов которой сохранилась до настоящего времени. Первое и самое важное место в классификации Лавуазье занимают кислородные соединения при этом кислоты и оксиды часто отождествляются, ибо основным нр1 зиаком кислот Лавуазье считал наличие в их составе кислорода. Классификация. Лавуазье основана, во-иервых, на различиях в элементном составе соединений и, во-вторых, на-характере их свойств (кислоты, основания, соле-образующие вещества, соли, органические вещества).

Номенклатура солей составлена так, что анион соли рассматривается как анион кислоты, а катион — как катион основания. Международный союз по чистой и прикладной химии в 1961 г. принял проект номенклатуры неорганических соединений, в том числе и солей. В соответствии с этим проектом номенклатурная комиссия при Химическом отделении АН СССР также разработала свой проект, который в ближайшем будущем получит официальное утверждение. Мы будем пользоваться прежней русской номенклатурой и номенклатурой, разработанной в последнее время. [c.180]
СОСТАВ, НОМЕНКЛАТУРА И ГРАФИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ, ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ [c.51]
В этом разделе рассматриваются важнейшие классы неорганических веществ, к которым относятся ок иды, основания, амфотерные гидроксиды, кислоты и соли. Подробно описаны состав и номенклатура представителей каждого из этих классов веществ, приводятся правила составления их графических формул. [c.28]
[c.28]
Ниже приведена номенклатура наиболее широко применяемых кислот, оснований и солей. [c.54]
Номенклатура кислот, оснований, солей и ионов [c.55]
Мы разберем некоторые правила построения названия соединения, предложенные Номенклатурной комиссией АН СССР. Для ряда соединений, например оксидов или галогенидов, используется одновременно международная и русская номенклатура. Русскую номенклатуру чаще используют в индивидуальных названиях веществ, международные названия — для обозначения групп соединений, сходных по свойствам элементов, или соединений одного и того же элемента. В технической литературе приняты названия, близкие к названиям международной номенклатуры. В первой части Вы узнаете об общих принципах конструирования названий кислот, оснований, солей, оксидов и других неорганических соединений.
Точка зрения Бренстеда существенно изменила наши взгля. ды на природу кислот, оснований и солей и на реакции вза-имодейстЕия между ними. На основании теории Бренстеда можно охватить с единой точки зрения все явления, наблюдающиеся в растворах кислот и оснований. Необходимо с новой точки зрения рассмотреть типичные кислотно-основные равновесия и создать новую номенклатуру. На необходимость такой номенклатуры указал Клагес. Он приводит ряд примеров, которые показывают, какие осложнения вызывает отсутствие такой номенклатуры. Например, ониевые соли, в частности гидроксониевые соли в воде, с одной стороны, мы рассматриваем как диссоциированные кислоты, с другой стороны, по аналогии с аммониевыми солями, как соли. Одно и то же вещество, например, уксусную кислоту в растворе хлорной кислоты следует рассматривать как основание, в воде — как кислоту. В связи с этим Клагес предлагает рассматривать соли, которые образуют катионы состава (р-ль + Н) как кислоты, а соли, которые образуют анионы состава (р-ль — -Н), — как основания. Старые и новые понятия — кислота и основание — не совпадают. Кислоты по терминологии Бренстеда являются по Клагесу свободными формами кислот .
На основании теории Бренстеда можно охватить с единой точки зрения все явления, наблюдающиеся в растворах кислот и оснований. Необходимо с новой точки зрения рассмотреть типичные кислотно-основные равновесия и создать новую номенклатуру. На необходимость такой номенклатуры указал Клагес. Он приводит ряд примеров, которые показывают, какие осложнения вызывает отсутствие такой номенклатуры. Например, ониевые соли, в частности гидроксониевые соли в воде, с одной стороны, мы рассматриваем как диссоциированные кислоты, с другой стороны, по аналогии с аммониевыми солями, как соли. Одно и то же вещество, например, уксусную кислоту в растворе хлорной кислоты следует рассматривать как основание, в воде — как кислоту. В связи с этим Клагес предлагает рассматривать соли, которые образуют катионы состава (р-ль + Н) как кислоты, а соли, которые образуют анионы состава (р-ль — -Н), — как основания. Старые и новые понятия — кислота и основание — не совпадают. Кислоты по терминологии Бренстеда являются по Клагесу свободными формами кислот .
Номенклатура кислых солей составляется так. Кислую соль рассматривают как продукт, получающийся из многоосновной кислоты, в которой не все атомы водорода, способные переходить в состояние ионов, нейтрализованы основанием . [c.181]
Необходимо заметить, что некоторые простые тела образуют окислы обоих главных родов, т.-е. основные и кислотные таков, напр., марганец, он образует основные закись и окись, и кислотные марганцовистый и марганцовый ангидриды. В промежутке будет та двуокись (или перекись), Мп02, о которой говорено выше она — слабое основание и слабый кислотный ангидрид. При этом всегда основные окислы заключают меньше кислорода, чем промежуточные, а они меньше, чем ангидриды кислот.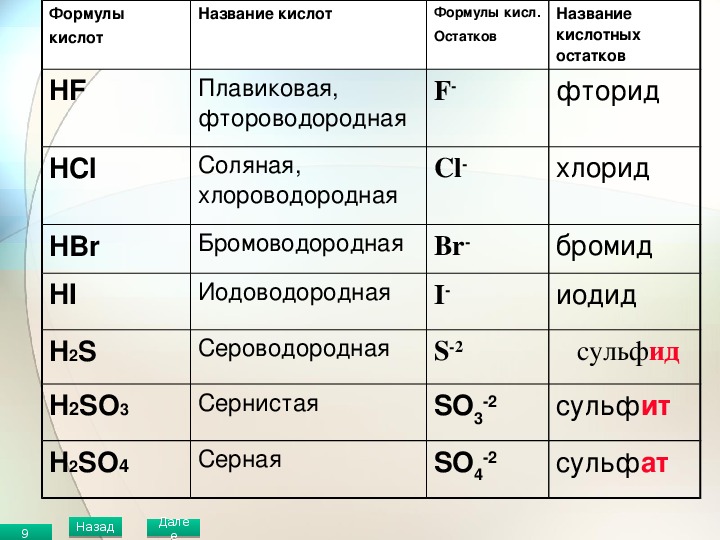
 [c.453]
[c.453] Кислые и основные соли. При рассмотрении классификации было указано, что кислые и основные соли можно рассматривать как продукты неполного превращения кислот и оснований. Название этим двум классам солей дается с использованием прилагательного кислый или основной , стоящего перед названием соли. По международной номенклатуре кислый атом водорода, входящий в состав кислой соли, отличается приставкой гид-ро , а гидроксид-ион в основных солях приставкой гы-дрокси (или гидроксид) [c.253]
Всякий, кто занимается химией, беспрестанно слышит и сам употребляет слова кислота, основание, соль. Все эти слова вошли в употребление у химиков в весьма отдаленные времена, и первоначально с тем же значением, какое они имеют в общежитии. Но мало по малу понятия, выражаемые этими словами, так изменились, так удалились от первоначального значения, что явилась необходимость объяснить их теперешнее значение, тем более, что они беспрестанно употребляются в химической номенклатуре. [c.196]
[c.196]
Укажем, что новая химическая номенклатура не только формально заменила старые названия веществ новыми, но и была принята с учетом классификации соединений и, прежде всего, классификации окислов, кислот и образуемых ими солей по степеням окисления элементов, образующих основания солей. Таким образом, новая номенклатура оказалась основой для создания систематического курса химии. К составлению этого курса Лавуазье приступил, по-видимому, в 1787 г. Рукопись сочинения была готова уже к началу 1789 г., а в марте курс вышел из печати. [c.367]
Конечная точка титрования может быть определена по кру- тому подъему кривой титрования. Следующие примеры покажут, fi каким путем выявляются конечные точки для кислот различной i силы. Термин кислота употреблен здесь согласно обобщенному определению, по которому кислотой является любое вещество, молекулы которого способны отщеплять протоны. По старой номенклатуре такие соединения назывались или свободными кислотами (1 ак соляная или уксусная кислота), или солями оснований (KaK, например, хлористый аммоний). [c.411]
[c.411]
Соли органических соединений. Названия солей, образующихся нейтрализацией органических кислот сильными основаниями, соответствуют номенклатуре неорганических соединений. Суффикс -ат заменяет окончание -вая в названии карбоновой кислоты или -овая в названии сульфоновых и фосфоновых кислот. [c.659]
Обычно пользуются буферными растворами, состоящими из смеси слабой кислоты или основания и соли этой кислоты, например смеси уксусной кислоты и ацетата натрия (по номенклатуре [c.19]
Классификация неорганических вещестЕ . Состав, номенклатура и графические форлъулы оксидов, оснований, кислот и солей [c.28]
Кислые и основные соли. Эти соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро-, а группа ОН — приставкой гидрокси- NaHS — гидросульфид натрия, NaHSOj — гидросульфит натрия, Mg(OH) l — гидроксихлорид магния, А1(0Н)2С1 — дигид-роксихлорид алюминия. [c.176]
[c.176]
Номенклатура кислот, оснований и солей. Кислоты с одним, двумя и тремя замещаемыми атомами водорода называются соответственно сдно-, двух- ц трехосновными кислотами, а основания с одним, двумя и тремя замещаемыми гидроксильными группами называются одно-, двух- и трехкислотными основаниями. Соли, такие, как N32804, образующиеся в результате полной нейтрализации кислоты основанием, называются нормальными солями соли, образованные при неиолной нейтрализации кислоты, называются кислыми солями, а образованные нри неполной нейтрализации основания — основными солями. [c.102]
В своей статье Гитон де Морво изложил принципы составления рациональной химической номенклатуры, которые через несколько лет, с некоторыми изменениями, легли в основу системы новых химических названий. Кроме того, он дал классификацию веществ на кислоты, соли и основания, причем среди последних флогистон занимал первое место. [c.73]
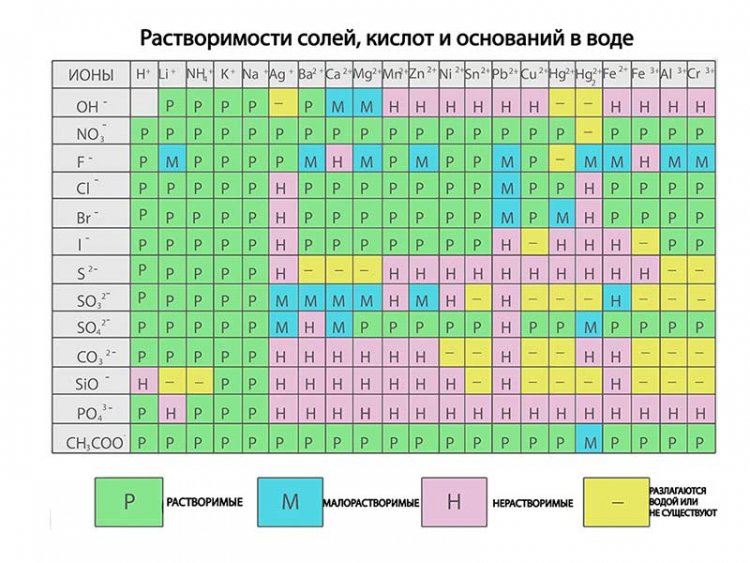
Таблица растворимости солей, кислот и оснований
Содержание:
Таблица растворимости вместе с
таблицей Менделеева
являются основным теоретическим материалом при изучении химии! Растворимость — способность вещества образовывать с другими веществами
однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Если при изучении материала на данной странице у Вас возникнут вопросы, Вы всегда можете задать их на нашем форуме. Также на Вам помогут решить задачи по химии, теории вероятности, математике, геометрии и многим другим предметам!
Полная таблица растворимости солей, кислот и оснований
Условные обозначения таблицы растворимости:
Р — вещество хорошо растворимо в воде;
М — вещество малорастворимо в воде;
Н — вещество практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах;
РК — вещество нерастворимо в воде и растворяется только в сильных неорганических кислотах;
НК — вещество нерастворимо ни в воде, ни в кислотах;
Г — вещество полностью гидролизуется при растворении и не существует в контакте с водой;
— — вещество не существует.
Стандартная (школьная) таблица растворимости
Таблица растворимости используют для проверки условий протекания реакции, так как одним из условий протекания
реакции является образование осадка (необратимость протекания реакции), то по таблице расворимости можно проверить образование осадка и тем самым определить,
протекает реакиция или нет.
Помимо таблицы растворимости на сайте Вы можете посмотреть тригонометрические формулы, таблицу производных и таблицу интегралов. Пользуйтесь на здоровье!
Слишком сложно?
Таблица растворимости солей, кислот и оснований не по зубам? Тебе ответит эксперт через 10 минут!
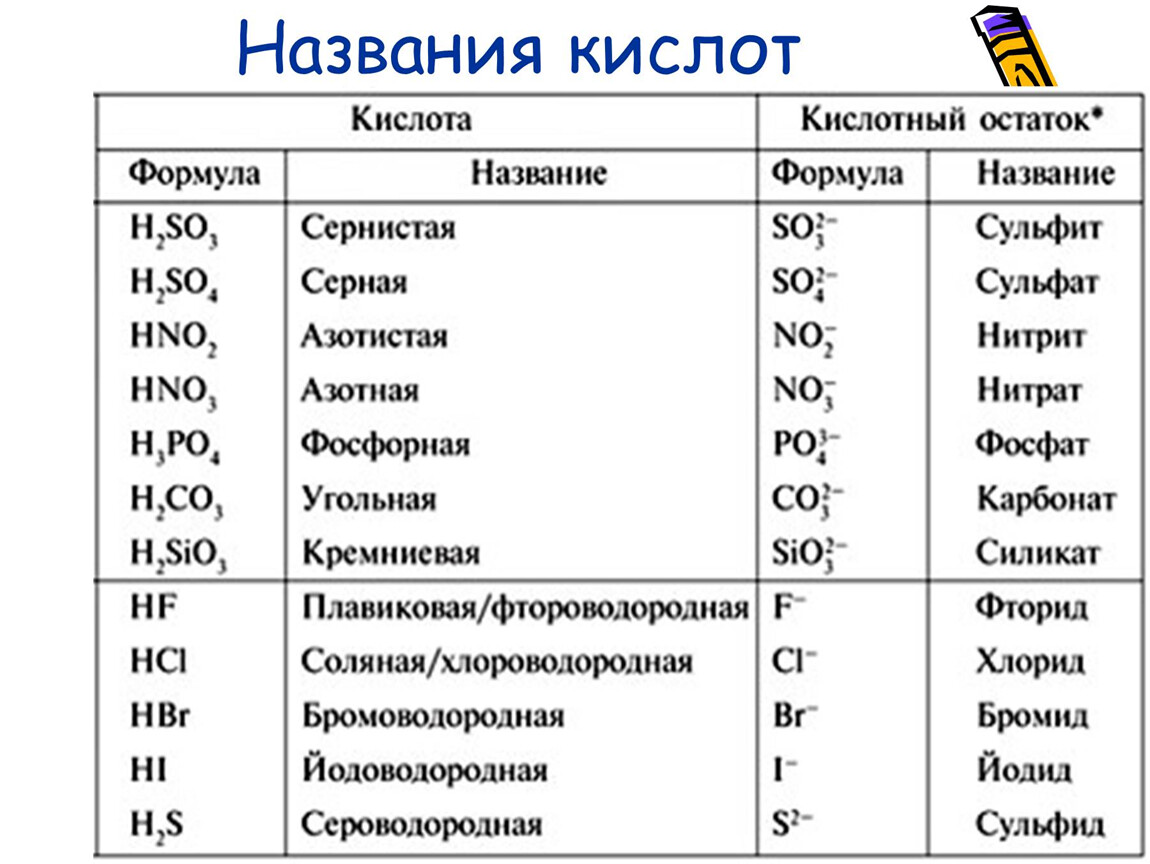
Таблица «Кислоты». Формулы, названия кислот, солей.
|
Молекулярная формула |
Название кислоты |
Сила |
Кислотный остаток и его заряд |
Название солей |
|
HCl |
соляная или хлороводородная |
сильная |
-Cl— |
хлориды |
|
H2 S |
сероводородная |
слабая |
-HS— =S2 — |
гидросульфиды сульфиды |
|
H2SO3 |
сернистая |
слабая |
-HSO3— =SO32 — |
гидросульфиты сульфиты |
|
HNO3 |
азотная |
сильная |
-NO3— |
нитраты |
|
H2SO4 |
серная |
сильная |
-H2SO4— =SO42 — |
гидросульфаты сульфаты |
|
H2SiO3 |
кремниевая |
слабая |
=SiO32 — |
силикаты |
|
H2CO3 |
угольная |
слабая |
-HCO3 — =CO3 2 — |
гидрокарбониты карбонаты |
|
H3PO4 |
фосфорная (ортофосфорная) |
слабая |
-H2PO4 — =HPO4 2 — =PO4 3 — |
дигидрофосфаты гидрофосфаты фосфаты
|
|
CH3COOH |
уксусная |
слабая |
CH3COOH— |
ацетаты |
|
HNO2 |
азотистая |
слабая |
-NO2 — |
нитриты |
Обратите внимание
Многоосновные кислоты образуют два вида солей: средние и кислые, причем трехосновная фосфорная образует кислые соли двух типов: дигидрофосфаты и гидрофосфаты. В порядке уменьшения силы наиболее распространенные кислоты располагаются так:
В порядке уменьшения силы наиболее распространенные кислоты располагаются так:
HNO3
H2SO4 H2SO3 H3PO4 CH3COOH
H2CO3 H2S
HClO
H2SiO3
HCl
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа № 12
Предмет: ХИМИЯ
Дата: 10.02.2016г
Пользуясь образцом выполнения варианта №1 таблицы 20 на стр.144 (приложение 1), выполнить вариант №2
Приложение 1.
|
Вариант 1 |
а) |
б) |
в) |
г) |
д) |
|
Формула вещества |
Принадлежит к классу |
Название вещества |
Валентность кислотного остатка (в кислоте, соли) |
Растворимость (по таблице растворимости на форзаце 2 учебника) |
Физические свойства знакомых (агрегатное состояние, цвет, запах, растворимость в воде) |
|
CaO |
Оксид основный |
Оксид кальция |
|
|
твёрд. |
|
H2S |
Кислота |
Сероводородная кислота |
II |
Р |
|
|
NaCl |
Соль |
Хлорид натрия (повареная соль) |
I |
Р |
твёрд., белый, растворим. |
|
Ca3(PO4)2 |
Соль |
Фосфат кальция |
III |
Н |
|
|
N2O5 |
Оксид кислотный |
Оксид азота (V) |
|
|
|
|
AgNO3 |
Соль |
Нитрат серебра |
I |
Р |
|
|
Mg |
Металл |
Магний |
|
|
твёрд. |
|
FeSO4 |
Соль |
Сульфат железа (II) |
II |
Р |
|
|
HNO3 |
Кислота |
Азотная кислота |
I |
Р |
|
Если тетрадь в школе, выполняете все задания в новой тетради!
Предмет: ХИМИЯ
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр.144
Дата: 03.02.2016г
Выучить наизусть формулы и название кислот, кислотных остатков, оксидов, соответствующих кислотам по таблице №1:
Таблица №1
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HCl |
Хлороводородная (соляная) |
Cl |
I |
Хлорид |
— |
|
HF |
Фтороводородная (плавиковая) |
F |
I |
Фторид |
— |
|
HBr |
Бромоводородная |
Br |
I |
Бромид |
— |
|
HI |
Иодоводородная |
I |
I |
Иодид |
— |
|
H2S |
Сероводородная |
S |
II |
Сульфид |
— |
|
H2SO3 |
Сернистая |
SO3 |
II |
Сульфит |
SO2 |
|
H2SO4 |
Серная |
SO4 |
II |
Сульфат |
SO3 |
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
|
HNO3 |
Азотная |
NO3 |
I |
Нитрат |
N2O5 |
|
H2CO3 |
Угольная |
CO3 |
II |
Карбонат |
CO2 |
|
H2SiO3 |
Кремниевая |
SiO3 |
II |
Силикат |
SiO2 |
|
H3PO4 |
Фосфорная (Ортофосфорная) |
PO4 |
III |
Фосфат (Ортофосфат) |
P2O5 |
Выполните следующее задание в тетради:
Начертите таблицу и заполните свободные клеточки (впишите формулу или название) в таблице №2 (по памяти, не пользуясь таблицей №1)
Таблица №2
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HNO3 |
|
|
|
Нитрат |
N2O5 |
|
|
Иодоводородная |
|
|
|
— |
|
H3PO4 |
|
|
|
|
|
|
|
Сернистая |
SO3 |
|
|
|
|
H2CO3 |
|
|
|
|
|
|
HCl |
|
|
|
Хлорид |
— |
|
|
Кремниевая |
|
|
|
|
|
HF |
|
|
|
|
— |
|
|
|
|
|
Сульфид |
— |
|
|
|
|
|
Бромид |
— |
|
|
Серная |
|
|
|
|
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
Все работы, выполненные в дни карантина, будут проверены и оценены. Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Дата: 28.01.2016г
Изучить §32, записать в тетради основные понятия:
- Кислотами называются сложные вещества ………..
- Валентность кислотного остатка находят ………..
- К бескислородным кислотам относят: ….., ……, ……, …..
- К кислородсодержащим кислотам относят: …, …,…..,….,….,….,…..
Выучить наизусть формулы и название кислот (таблица 19 на стр.141)
Выполните в тетради задания:
№1. Распределите химические формулы кислот из перечня формул веществ в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
|
Кислоты |
||||||
|
Бес-кисло- родные |
Кислород- содержащие |
растворимые
|
нераст-воримые |
одно- основные |
двух-основные |
трёх-основные |
Выполните задания №1, №2, №3 на стр. 142
142
При изучении нового материала можно воспользоваться дополнительным материалом:
Урок по теме: Кислоты: классификация, номенклатура, физические и химические свойства
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода,
способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
- По числу атомов водорода:число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
- По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих
кислотных оксидов:
|
Кислота (НnА) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
HClO4 хлорная |
ClO4 (I) перхлорат |
Cl2O7 оксид хлора (VII ) |
|
H2SO4 серная |
SO4 (II) сульфат |
SO3 оксид серы (VI ), серный ангидрид |
|
HNO3 азотная |
NO3 (I) нитрат |
N2O5 оксид азота ( V ) |
|
HMnO4 марганцевая |
MnO4 (I) перманганат |
Mn2O7 оксид марганца (VII ) |
|
H2SO3 сернистая |
SO3 (II) сульфит |
SO2 оксид серы (IV ) |
|
H3PO4 ортофосфорная |
PO4 (III) ортофосфат |
P2O5 оксид фосфора (V ) |
|
HNO2 азотистая |
NO2 (I) нитрит |
N2O3 оксид азота (III ) |
|
H2CO3 угольная |
CO3 (II) карбонат |
CO2 оксид углерода ( IV), углекислый газ |
|
H2SiO3 кремниевая |
SiO3 (II) силикат |
SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
|
Кислота (НnА) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I) хлорид |
|
H2S сероводородная |
S(II) сульфид |
|
HBr бромоводородная |
Br (I) бромид |
|
HI йодоводородная |
I(I) йодид |
|
HF фтороводородная,плавиковая |
F(I) фторид |
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны
известны
также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все
кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl |
1. SO3 + H2O = H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl |
|
Предмет: ХИМИЯ
Дата: 27.01.2016г
Изучить §31, записать в тетради основные понятия:
- Основаниями называются …………
- По характеру свойств различают ………
- К щелочам относят …………….
- Исторически сложившиеся названия щелочей:
KOH – едкое кали
NaOH – …..
Ca(OH)2 – ……..
Ba(OH)2– ……..
Ca(OH)2– ……..
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al 2 O 3, Zn(OH)2, CaO , SiO 2, CrO , NaOH , Mn 2 O 7, Fe(OH)2, Cr 2 O 3
|
Основный оксид |
Кислотный оксид |
Амфотерный оксид |
Безразличный оксид |
Щёлочь |
Нерастворимое основание |
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
При изучении нового материала можно использовать дополнительный материал:
Урок по теме: Основания: классификация, номенклатура, получение
|
ОСНОВАНИЯ Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Классификация оснований
Щёлочи – это основания растворимые в воде. Классификация оснований по числу групп ОН: n=1 однокислотное n=2 двухкислотное n=3 трехкислотное Физические свойства Большинство оснований – твёрдые вещества с различной растворимостью в воде. СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ ЩЁЛОЧЕЙ 1. Металл + H2O = ЩЁЛОЧЬ + Н2↑ 2Na + 2H2O = 2NaOH + H2 Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra) 2. Na2O + H2O = 2 NaOH Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra) НЕРАСТВОРИМЫХ ОСНОВАНИЙ СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
Кислоты и основания — Электронный учебник K-tree
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое
pH раствора, какими общими свойствами обладают кислоты и основания.
В статье описано, что такое
pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота — это всё что с H, а основание — c OH. НО! Не всегда. Что бы отличать кислоту от основания необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют
анионы OH—. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад HCl на H+ и Cl—.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион,
в водном растворе выделяют анион OH—.
Основания, содержащие гидроксид-ион,
в водном растворе выделяют анион OH—.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4, HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−, HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы. Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl—(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + h3O(ж) → h4O+(р-р) + F—(р-р) — в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F—] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов,
чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH—:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH—(р-р)
Большинство слабых оснований — это анионы:
F—(р-р) + H2O ↔ HF(р-р) + OH—(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и
основания, результирующий раствор будет нейтральным.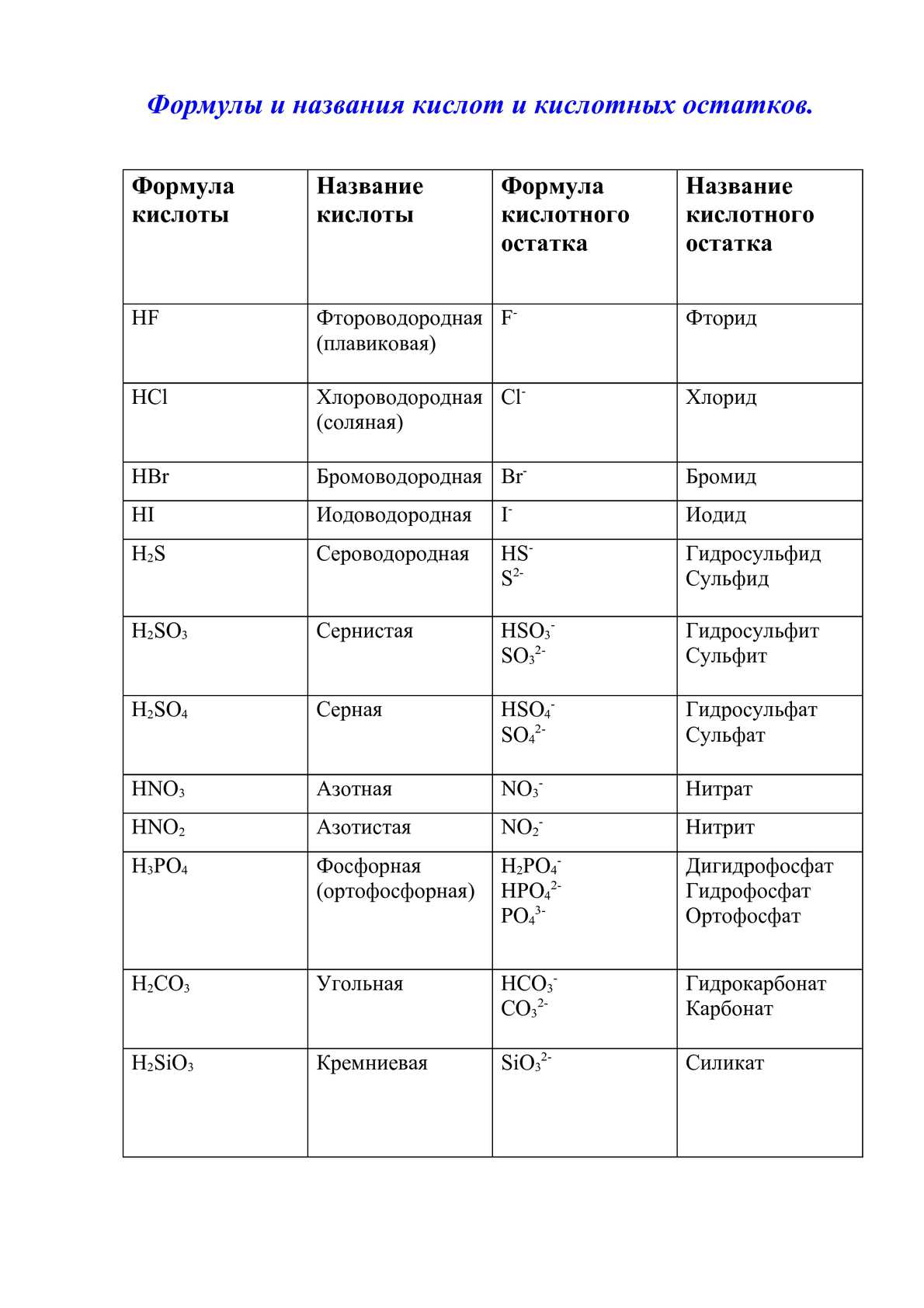
Пример:
H3O+ + OH— ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH—(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX(р-р) + OH—(р-р) ↔ H2O + X—(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH—(р-р)
Kc = [H3O+][OH—]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее равенство: [H3O+][OH—] = 10-14, что называется константой диссоциации воды. Для чистой воды [H3O+] = [OH—] = 10-7, откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический
сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-. В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H+, ни OH— в воде. Например, Cl—, NO—3, SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F—, CH3COO—,
CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Именование кислот и оснований | Введение в химию
Цель обучения
- Преобразование между структурой кислоты или основания и ее химическим названием
Ключевые моменты
- Кислоты названы на основе их аниона — иона, присоединенного к водороду.
 В простых бинарных кислотах один ион присоединен к водороду. Названия таких кислот состоят из приставки «гидро-», первого слога аниона и суффикса «-ic».
В простых бинарных кислотах один ион присоединен к водороду. Названия таких кислот состоят из приставки «гидро-», первого слога аниона и суффикса «-ic». - Сложные кислотные соединения содержат кислород. Для кислоты с многоатомным ионом суффикс «-ат» от иона заменяется на «-ic».
- Многоатомные ионы с одним дополнительным кислородом (по сравнению с типичным многоатомным ионом) имеют префикс «per-» и суффикс «-ic».
- Многоатомные ионы с на один кислород меньше имеют суффикс «-ous»; ионы с двумя меньшими числами имеют приставку «гипо-» и суффикс «-ous».
- Сильные основания с группами «-ОН» (гидроксид) называются как ионные соединения.Слабые основания называют молекулярными соединениями или органическими соединениями.
Срок
- многоатомный ион Заряженная разновидность (ион), состоящая из двух или более атомов, связанных ковалентной связью. Также известен как молекулярный ион.
Обозначение кислот
Кислоты названы по аниону, который они образуют при растворении в воде. В зависимости от того, к какому аниону присоединен водород, кислоты будут иметь разные названия.
В зависимости от того, к какому аниону присоединен водород, кислоты будут иметь разные названия.
Простые кислоты, известные как бинарные кислоты, содержат только один анион и один водород.Эти анионы обычно имеют окончание «-ид». Эти соединения называются кислотами, начиная с префикса «гидро-», затем добавляя первый слог аниона, а затем суффикс «-ic». Например, HCl, представляющий собой водород и хлор, называется соляной кислотой.
Номенклатура распространенных кислот В этой таблице представлена номенклатура некоторых распространенных анионов и кислотВ составе более сложных кислот есть кислород. Для этих кислот существует простой набор правил.
- Любой многоатомный ион с суффиксом «-ат» использует суффикс «-ic» как кислоту.Итак, HNO 3 будет азотной кислотой.
- Если у вас есть многоатомный ион, у которого на один кислород больше, чем у «-атного» иона, тогда ваша кислота будет иметь префикс «per-» и суффикс «-ic». Например, хлорат-ион — это ClO 3 —.
 Поэтому HClO 4 называется хлорной кислотой.
Поэтому HClO 4 называется хлорной кислотой. - Если у кислоты на один кислород меньше, чем у «-атного» иона, то у кислоты будет суффикс «-ous». Например, хлористая кислота — HClO 2 .
- Если у иона кислорода на два меньше, чем у иона «-ат», префикс будет «гипо-», а суффикс — «-ous».Например, вместо бромной кислоты HBrO 3 у нас есть бромистоводородная кислота HBrO.
Именование базы
Наиболее сильные основания содержат гидроксид, многоатомный ион. Поэтому сильные основания называют в соответствии с правилами наименования ионных соединений. Например, NaOH — гидроксид натрия, KOH — гидроксид калия, а Ca (OH) 2 — гидроксид кальция. Слабые основания, состоящие из ионных соединений, также называют с использованием ионной системы именования. Например, NH 4 OH — гидроксид аммония.
Слабые основания также иногда являются молекулярными соединениями или органическими соединениями, поскольку имеют ковалентные связи. Поэтому их называют в соответствии с правилами для молекулярных или органических соединений. Например, метиламин (CH 3 NH 2 ) является слабым основанием. Некоторые слабые базы имеют «общие» имена. Например, NH 3 называется аммиаком; его название не получено из какой-либо системы именования.
Поэтому их называют в соответствии с правилами для молекулярных или органических соединений. Например, метиламин (CH 3 NH 2 ) является слабым основанием. Некоторые слабые базы имеют «общие» имена. Например, NH 3 называется аммиаком; его название не получено из какой-либо системы именования.
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
3.6b: Присвоение названий кислотам и основаниям
Целью обучения этого модуля является определение и обозначение некоторых распространенных кислот и оснований.
Для наших целей в этом месте текста мы можем определить кислоту как вещество, по крайней мере, с одним атомом водорода, которое может диссоциировать с образованием аниона и иона H + (протона) в водном растворе, тем самым образуя кислый раствор. Мы можем определить основания как соединения, которые производят гидроксид-ионы (OH — ) и катион при растворении в воде, образуя, таким образом, щелочной раствор. Растворы, которые не являются ни щелочными, ни кислыми, являются нейтральными. Мы обсудим химию кислот и оснований более подробно позже, но в этом разделе мы опишем номенклатуру обычных кислот и определим некоторые важные основания, чтобы вы могли узнать их в будущих обсуждениях. Чистые кислоты и основания и их концентрированные водные растворы обычно встречаются в лаборатории. Обычно они очень едкие, поэтому с ними нужно обращаться осторожно.
Растворы, которые не являются ни щелочными, ни кислыми, являются нейтральными. Мы обсудим химию кислот и оснований более подробно позже, но в этом разделе мы опишем номенклатуру обычных кислот и определим некоторые важные основания, чтобы вы могли узнать их в будущих обсуждениях. Чистые кислоты и основания и их концентрированные водные растворы обычно встречаются в лаборатории. Обычно они очень едкие, поэтому с ними нужно обращаться осторожно.
Кислоты
Названия кислот различаются между (1) кислотами, в которых ион H + присоединен к атому кислорода многоатомного аниона (они называются оксокислотами, или иногда оксикислотами), и (2) кислотами, в которых ион H + Ион присоединен к какому-то другому элементу.В последнем случае название кислоты начинается с гидро- и заканчивается на -ic, с корнем названия другого элемента или иона между ними. Напомним, что название аниона, производного от этой кислоты, всегда оканчивается на -ид. Таким образом, газообразный хлористый водород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl —), газ цианистого водорода (HCN) образует синильную кислоту (которая содержит H + и CN —. ионы) и т. д. (Таблица 2.8). Примеры такого типа кислоты встречаются часто и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, который помогает переваривать пищу. Когда механизмы, препятствующие перевариванию желудка, срабатывают, кислота разрушает слизистую оболочку желудка и образуется язва.
ионы) и т. д. (Таблица 2.8). Примеры такого типа кислоты встречаются часто и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, который помогает переваривать пищу. Когда механизмы, препятствующие перевариванию желудка, срабатывают, кислота разрушает слизистую оболочку желудка и образуется язва.
| Обратите внимание на узор |
|---|
Кислоты различаются по тому, присоединен ли ион H + к атому кислорода многоатомного аниона или к какому-либо другому элементу. |
Таблица 2.8 Некоторые распространенные кислоты, не содержащие кислород
| Формула | Название в водном растворе | Название газообразных видов |
|---|---|---|
| HF | плавиковая кислота | фтороводород |
| HCl | соляная кислота | хлористый водород |
| HBr | бромистоводородная кислота | бромистый водород |
| HI | иодистоводородная кислота | йодистый водород |
| HCN | синильная кислота | цианистый водород |
| H 2 S | сероводородная кислота | сероводород |
Если кислота содержит один или несколько ионов H + , прикрепленных к кислороду, это производное одного из обычных оксоанионов, такого как сульфат (SO 4 2-) или нитрат (NO 3 — ). Эти кислоты содержат столько ионов H +, сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Эти кислоты содержат столько ионов H +, сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Названия кислот образованы от названий анионов в соответствии со следующими правилами:
- Если название аниона оканчивается на -ат, то название кислоты оканчивается на -ик. Например, поскольку NO 3 — — это нитрат-ион, HNO 3 — это азотная кислота.Точно так же ClO 4 — — это перхлорат-ион, поэтому HClO 4 — это хлорная кислота. Двумя важными кислотами являются серная кислота (H 2 SO 4 ) из сульфат-иона (SO 4 2-) и фосфорная кислота (H 3 PO 4 ) из фосфат-иона (PO ). 4 3−). Эти два названия используют небольшой вариант корня названия аниона: сульфат становится серным, а фосфат становится фосфорным.

- Если название аниона оканчивается на -ite, то название кислоты оканчивается на -ous.Например, OCl — — это ион гипохлорита, а HOCl — хлорноватистая кислота; NO 2 — — нитрит-ион, а HNO 2 — азотистая кислота; и SO 3 2- представляет собой сульфит-ион, а H 2 SO 3 представляет собой сернистую кислоту. Используются одни и те же корни независимо от того, заканчивается ли название кислоты на -ic или -ous; таким образом, сульфит становится сернистым.
Взаимосвязь между названиями оксокислот и исходных оксоанионов проиллюстрирована на рисунке 2.20, а некоторые распространенные оксокислоты представлены в таблице 2.9.
Рис. 2.20. Связь между названиями оксокислот и названиями родительских оксоанионов
Таблица 2.9 Некоторые распространенные оксокислоты
| Формула | Имя |
|---|---|
| \ (HNO_2 \) | азотистая кислота |
| \ (HNO_3 \) | азотная кислота |
| \ (H_2SO_3 \) | сернистая кислота |
| \ (H_2SO_4 \) | серная кислота |
| \ (H_3PO_4 \) | фосфорная кислота |
| \ (H_2CO_3 \) | угольная кислота |
| \ (HClO \) | хлорноватистая кислота |
| \ (HClO_2 \) | хлористая кислота |
| \ (HClO_3 \) | хлорная кислота |
| \ (HClO_4 \) | хлорная кислота |
Пример 11 |
|---|
Назовите и дайте формулу каждой кислоты. а. кислота, образующаяся при добавлении протона к иону гипобромита (OBr — ) г. кислота, образованная добавлением двух протонов к селенат-иону (SeO 4 2-) Дано : анион Запрошено : исходная кислота Стратегия : См. Таблицу 2.8 «Некоторые распространенные кислоты, не содержащие кислород» и Таблицу 2.9 «Некоторые распространенные оксокислоты», чтобы найти название кислоты.Если кислоты нет в списке, воспользуйтесь приведенными ранее рекомендациями. Решение : Ни один из видов не указан в таблице 2.8 «Некоторые распространенные кислоты, не содержащие кислород» или в таблице 2.9 «Некоторые распространенные оксокислоты», поэтому мы должны использовать информацию, приведенную ранее, чтобы получить название кислоты из названия многоатомного аниона. а. Название аниона, гипобромит, оканчивается на -ит, поэтому название исходной кислоты оканчивается на -ит. Таким образом, кислота представляет собой гипобромистую кислоту (HOBr). г. Селенат заканчивается на -ate, поэтому название исходной кислоты заканчивается на -ic. Следовательно, кислота представляет собой селеновую кислоту (H 2 SeO 4 ). Упражнение Назовите и дайте формулу каждой кислоты. а. кислота, образованная добавлением протона к пербромат-иону (BrO 4 —) г. кислота, образованная добавлением трех протонов к иону арсенита (AsO 3 3-) Ответ : а.надбромовая кислота; HBrO 4 г. мышьяковистая кислота; H 3 AsO 3 |
Многие органические соединения содержат карбонильную группу, в которой имеется двойная связь углерод-кислород. В карбоновых кислотах группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула — RCO 2 H, иногда обозначаемая как RCOOH:
., где R может быть алкильной группой, арильной группой или атомом водорода.Простейшим примером HCO 2 H является муравьиная кислота, названная так потому, что она содержится в выделениях жалящих муравьев (от латинского formica, что означает «муравей»). Другой пример — уксусная кислота (CH 3 CO 2 H), которая содержится в уксусе. Как и многие кислоты, карбоновые кислоты имеют резкий запах. Например, масляная кислота (CH 3 CH 2 CH 2 CO 2 H) отвечает за запах прогорклого масла, а характерный запах кислого молока и рвоты возникает из-за молочной кислоты [CH 3 CH (OH) CO 2 H].Некоторые распространенные карбоновые кислоты показаны на рис. 2.21.
Рисунок 2.21 Некоторые общие карбоновые кислоты
Хотя карбоновые кислоты являются ковалентными соединениями, когда они растворяются в воде, они диссоциируют с образованием ионов H + (как и любая другая кислота) и ионов RCO 2 —. Обратите внимание, что только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + . Напротив, атом водорода, присоединенный к атому кислорода спирта, не диссоциирует с образованием иона H + , когда спирт растворяется в воде.Причины разницы в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная связь в сравнении с ковалентной связью».
Обратите внимание на узор
Только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .
Базы
Мы представим более исчерпывающие определения оснований в следующих главах, но фактически каждое основание, с которым вы столкнетесь, будет ионным соединением, таким как гидроксид натрия (NaOH) и гидроксид бария [Ba (OH) 2 ], которые содержат гидроксид-ион и катион металла.Они имеют общую формулу M (OH) n. Важно понимать, что спирты с общей формулой ROH являются ковалентными соединениями, а не ионными соединениями; следовательно, они не диссоциируют в воде с образованием основного раствора (содержащего ионы OH — ). Когда основание вступает в реакцию с любой из рассмотренных кислот, оно принимает протон (H + ). Например, гидроксид-ион (OH —) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протонов.
Концентрированные водные растворы аммиака (NH 3 ) содержат значительные количества гидроксид-иона, хотя растворенное вещество не является в первую очередь гидроксидом аммония (NH 4 OH), как часто указывается на этикетке. Таким образом, водный раствор аммиака также является обычным основанием. Замена атома водорода Nh4 на алкильную группу приводит к амину (RNH 2 ), который также является основанием. Амины имеют резкий запах — например, метиламин (CH 3 NH 2 ) является одним из соединений, вызывающих неприятный запах, связанный с испорченной рыбой.На физиологическое значение аминов указывает слово «витамин», которое происходит от словосочетания «жизненно важные амины». Это слово было придумано для описания пищевых веществ, которые были эффективны при предотвращении цинги, рахита и других заболеваний, потому что эти вещества считались аминами. Впоследствии было подтверждено, что некоторые витамины являются аминами.
Обратите внимание на узор
Гидроксиды металлов (MOH) дают ионы OH — и являются основаниями, спирты (ROH) не образуют ионы OH — или H + и являются нейтральными, а карбоновые кислоты (RCO 2 H) дают H + ионов и кислоты.
Сводка
Обычные кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры. Номенклатура кислот различает оксикислоты, в которых ион H + присоединен к атому кислорода многоатомного иона, и кислоты, в которых ион H + присоединен к другому элементу. Карбоновые кислоты — важный класс органических кислот. Аммиак является важным основанием, как и его органические производные амины.
Ключевые вынос
Обычные кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры.
| Концептуальные проблемы |
|---|
1. Назовите каждую кислоту. а. HCl г. HBrO 3 г. HNO 3 г. H 2 SO 4 e. HIO 3 |
2. Назовите каждую кислоту.
а. HBr
г. H 2 SO 3
г.HClO 3
г. HCN
e. H 3 PO 4
3. Назовите водную кислоту, соответствующую каждому газу.
а. бромистый водород
г. цианистый водород
г. йодистый водород
4. Для каждой структурной формулы напишите сокращенную формулу и название соединения.
а.
г.
5.Для каждой структурной формулы напишите сокращенную формулу и название соединения.
а.
г.
6. Когда каждое соединение добавляется в воду, является ли полученный раствор кислотным, нейтральным или основным?
а. Канал 3 Канал 2 ОН
г. Мг (ОН) 2
г. C 6 H 5 CO 2 H
г. LiOH
e. C 3 H 7 CO 2 H
ф.H 2 SO 4
7. Изобразите структуру простейшего примера каждого типа соединения.
а. алкан
г. алкен
г. алкин
г. ароматический углеводород
e. алкоголь
ф. карбоновая кислота
г. амин
ч. циклоалкан
8. Определите класс органических соединений, представленных каждым соединением.
а.
г. Канал 3 Канал 2 ОН
г. HC≡CH
г.
e. C 3 H 7 NH 2
ф. CH 3 CH = CHCH 2 CH 3
г.
ч.
9. Определите класс органических соединений, представленных каждым соединением.
а.
г.
г.
г.
e.
ф. CH 3 CCH
г.
ч.
| Числовые задачи |
|---|
1. Напишите формулы для каждого соединения. а. хлорноватистая кислота г. пербромовая кислота г. бромистоводородная кислота г. сернистая кислота e. пербромат натрия |
2.Напишите формулу для каждого соединения.
а. йодистоводородная кислота
г. сероводород
с фосфорной кислотой
г. хлорная кислота
e. гипобромит кальция
3. Назовите каждое соединение.
а. HBr
г. H 2 SO 3
г. HCN
г. HClO 4
e. NaHSO 4
4.Назовите каждое соединение.
а. H 2 SO 4
г. HNO 2
г. К 2 HPO 4
г. H 3 PO 3
e. Ca (H 2 PO 4 ) 2 · H 2 O
Авторы и авторство
формул общих кислот и оснований
Кислоты и основания используются во многих химических реакциях.Они ответственны за большинство реакций изменения цвета и используются для регулирования pH химических растворов. Вот названия некоторых распространенных кислот и оснований и формулы, связанные с ними.
Формулы бинарных кислот
Бинарное соединение состоит из двух элементов. Бинарные кислоты имеют префикс hydro перед полным названием неметаллического элемента. У них окончание -ic . Примеры включают хлористоводородную кислоту, а фтористоводородная кислота включает:
Плавиковая кислота — HF
Соляная кислота — HCl
Бромистоводородная кислота — HBr
Водородная кислота — HI
Сероводородная кислота — H 2 S
Формулы тройных кислот
Трехкомпонентные кислоты обычно содержат водород, неметалл и кислород.Название наиболее распространенной формы кислоты состоит из неметаллического корня с окончанием -ic . Кислота, содержащая на один атом кислорода меньше, чем наиболее распространенная форма, обозначается окончанием -ous . Кислота, содержащая на один атом кислорода меньше, чем у кислоты , содержащей , имеет префикс гипо- и окончание , содержащее . Кислота, содержащая на один кислород больше, чем наиболее распространенная кислота, имеет префикс per- и окончание -ic .
Азотная кислота — HNO3
Азотистая кислота — HNO2
Хлорноватистая кислота — HClO
Хлорноватистая кислота — HClO2
Хлорная кислота — HClO3
Хлорная кислота — HClO4
Серная кислота — h3SO4 Кислота
hhosphorus Фосфорная
— Сера фосфорная
Сера фосфорная
hPO3 Угольная кислота — h3CO3
Уксусная кислота — HC2h4O2
Щавелевая кислота — h3C2O4
Борная кислота — h4BO3
Кремниевая кислота — h3SiO3
Формулы общих оснований
Вот формулы для 11 распространенных оснований:
Гидроксид натрия — NaOH
Гидроксид калия — KOH
Гидроксид аммония — Nh5OH
Гидроксид кальция — Ca (OH) 2
Гидроксид магния — Mg (OH) 2
Гидроксид бария — Ba (OH) 2
Гидроксид алюминия — Al (OH) 3
Гидроксид железа или гидроксид железа (II) — Fe (OH) 2
Гидроксид железа или гидроксид железа (III) — Fe (OH) 3
Гидроксид цинка — Zn (OH) 2
Гидроксид лития — LiOH
наименований 10 оснований с химическим строением и формулами
Вот список из десяти общих оснований с химическими структурами, химическими формулами и альтернативными названиями.
Обратите внимание, что сильное и слабое означает количество, которое основание будет диссоциировать в воде на составляющие ионы. Сильные основания полностью диссоциируют в воде на составляющие ионы. Слабые основания лишь частично диссоциируют в воде.
Основания Льюиса — это основания, которые могут отдавать электронную пару кислоте Льюиса.
Ацетон
Это химическая структура ацетона. МОЛЕКУУЛ / Getty Images Ацетон: C 3 H 6 O
Ацетон является слабым основанием Льюиса. Он также известен как диметилкетон, диметилцетон, азетон, β-кетопропан и пропан-2-он.Это простейшая молекула кетона. Ацетон — летучая, легковоспламеняющаяся бесцветная жидкость. Как и многие основы, имеет узнаваемый запах.
Аммиак
Это шарообразная модель молекулы аммиака. Дорлинг Киндерсли / Getty Images Аммиак: NH 3
Аммиак — слабое основание Льюиса. Это бесцветная жидкость или газ с характерным запахом.
Гидроксид кальция
Это химическая структура гидроксида кальция. Тодд Хелменстайн Гидроксид кальция: Ca (OH) 2
Гидроксид кальция считается основанием от сильного до среднего.Он полностью диссоциирует в растворах менее 0,01 М, но ослабевает с увеличением концентрации.
Гидроксид кальция также известен как дигидроксид кальция, гидрат кальция, гидралим, гашеная известь, каустическая известь, гашеная известь, гидрат извести, известковая вода и известковое молоко. Химическое вещество белое или бесцветное и может быть кристаллическим.
Гидроксид лития
Это химическая структура гидроксида лития. Тодд Хелменстайн Гидроксид лития: LiOH
Гидроксид лития — сильное основание.Он также известен как гидрат лития и гидроксид лития. Это белое кристаллическое твердое вещество, которое легко вступает в реакцию с водой и слабо растворяется в этаноле. Гидроксид лития — самое слабое основание гидроксидов щелочных металлов. Его основное применение — синтез консистентной смазки.
Метиламин
Это химическая структура метиламина. Бен Миллс / PD Метиламин: CH 5 N
Метиламин является слабым основанием Льюиса. Он также известен как метанамин, MeNh3, метиламмиак, метиламин и аминометан.Метиламин чаще всего встречается в чистом виде в виде бесцветного газа, хотя он также встречается в виде жидкости в растворе с этанолом, метанолом, водой или тетрагидрофураном (ТГФ). Метиламин — простейший первичный амин.
Гидроксид калия
Это химическая структура гидроксида калия. Тодд Хелменстайн Гидроксид калия: KOH
Гидроксид калия — сильное основание. Он также известен как щелок, гидрат натрия, едкий калий и калийный щелок. Гидроксид калия — белое или бесцветное твердое вещество, широко используемое в лабораториях и повседневных процессах.Это одна из наиболее часто встречающихся баз.
Пиридин
Это химическая структура пиридина. Тодд Хелменстайн Пиридин: C 5 H 5 N
Пиридин является слабым основанием Льюиса. Он также известен как азабензол. Пиридин — легковоспламеняющаяся бесцветная жидкость. Он растворим в воде и имеет характерный рыбный запах, который большинству людей кажется отвратительным и, возможно, тошнотворным. Один интересный факт о пиридине заключается в том, что это химическое вещество обычно добавляют в этанол в качестве денатурирующего агента, чтобы сделать его непригодным для питья.
Гидроксид рубидия
Это химическая структура гидроксида рубидия. Тодд Хелменстайн Гидроксид рубидия: RbOH
Гидроксид рубидия — сильное основание. Он также известен как гидрат рубидия. Гидроксид рубидия не встречается в природе. Эта база готовится в лаборатории. Это очень едкое химическое вещество, поэтому при работе с ним необходима защитная одежда. Контакт с кожей мгновенно вызывает химические ожоги.
Гидроксид натрия
Это химическая структура гидроксида натрия.Тодд Хелменстайн Гидроксид натрия: NaOH
Гидроксид натрия — сильное основание. Он также известен как щелок, каустическая сода, содовый щелок, белый каустик, натрий каустикум и гидрат натрия. Гидроксид натрия — чрезвычайно едкое белое твердое вещество. Он используется во многих процессах, в том числе в мыловарении, в качестве очистителя канализации, для производства других химикатов и для увеличения щелочности растворов.
Гидроксид цинка
Это химическая структура гидроксида цинка. Тодд Хелменстайн Гидроксид цинка: Zn (OH) 2
Гидроксид цинка является слабым основанием.Гидроксид цинка — белое твердое вещество. Это происходит естественным путем или готовится в лаборатории. Его легко приготовить, добавив гидроксид натрия в любой раствор соли цинка.
Обозначение солей — Кислоты, щелочи и соли — AQA — GCSE Chemistry (Single Science) Revision — AQA
Кислоты нейтрализуются основаниями, включая щелочи, и карбонатами металлов.
Реакции с основаниями, в том числе с щелочами
Оксиды металлов являются основаниями. Обычно, когда кислота реагирует с оксидом металла, продукты представляют собой соль и воду.
Кислота + оксид металла → соль + вода
Например:
Серная кислота + оксид меди → сульфат меди + вода
H 2 SO 4 (водный) + CuO (s) → CuSO 4 (водн.) + H 2 O (l)
Щелочи — растворимые основания. Когда кислоты реагируют со щелочами, образуются соль и вода. Обычно:
Кислота + щелочь → соль + вода
Например:
Азотная кислота + гидроксид натрия → нитрат натрия + вода
HNO 3 (водн.) + NaOH (водн.) → NaNO 3 (водн. ) + H 2 O (l)
Реакции с карбонатами
При реакции кислоты с карбонатами образуются соль, вода и углекислый газ.Обычно:
Кислота + карбонат → соль + вода + диоксид углерода
Например:
Соляная кислота + карбонат меди → хлорид меди + вода + диоксид углерода
2HCl (водн.) + CuCO 3 (с) → CuCl 2 (водн.) + H 2 O (л) + CO 2 (г)
Обозначение солей
Название соли состоит из двух частей. Первая часть происходит из основания, карбоната щелочного металла или металла. Вторая часть происходит от кислоты:
- соляная кислота дает хлоридные соли
- азотная кислота дает нитратные соли
- серная кислота дает сульфатные соли
- Вопрос
Предскажите название соли, образующейся при реакции оксида меди с азотная кислота.
- Показать ответ
Образовавшаяся соль — нитрат меди.
Выведение формул солей
У соли нет полного заряда, так как сумма зарядов на их ионах равна нулю. Формулы некоторых общих ионов приведены ниже:
| Заряд на ионе | Примеры |
|---|---|
| +1 | K + , Na + , Li + |
| Mg 2+ , Ca 2+ , Cu 2+ , Fe 2+ | |
| +3 | Al 3+ , Fe 3+ |
| — 1 | Класс — , Br — , I — , NO 3 — |
| -2 | SO 4 2- |
| -3 | PO 4 3- |
Обратите внимание, что ионы элементов группы 1 имеют заряд +1, а ионы элементов группы 2 имеют заряд +2.Ионы элементов 7-й группы имеют заряд -1, а ионы элементов 6-й группы имеют заряд -2.
Пример
Какова формула сульфата алюминия?
Формулы ионов: Al 3+ и SO 4 2-.
Сумма зарядов ионов нейтральной соли должна быть равна нулю. Два иона Al 3+ имеют общий заряд +6, а три иона SO 4 2- имеют общий заряд -6.
Итак, формула: Al 2 (SO 4 ) 3 .
- Вопрос
Какова формула хлорида магния?
- Открыть ответ
MgCl 2
Стандартный список сильных кислот и оснований
Изучение химии включает изучение кислот и оснований. Если вы посещаете урок химии, вам, вероятно, нужно будет запомнить сильные кислоты и основания. Используйте этот список сильных кислот и оснований как инструмент, который поможет вам узнать названия и химический состав каждой из них.
Список сильных кислот
Сильные кислоты не названы так, потому что они более сильные, чем другие кислоты. Сильная кислота растворяется в воде. Термин strong в названии относится к способности кислоты выделять молекулы водорода (H + ), что позволяет ей ионизироваться при помещении в раствор воды. Слабые кислоты не обладают этой способностью. Есть семь сильных кислот.
Сильная кислота | Химический состав | |
хлорноват. | соляная кислота | HCl |
иодоводородная кислота | HI | |
азотная кислота | HClO 4 | |
серная кислота | H 2 SO 4 |
Все эти высококоррозионные вещества могут выделять опасные пары и вызывать чрезвычайно болезненные ожоги.С этими веществами необходимо обращаться с особой осторожностью.
Как запомнить сильные кислоты
Запоминание списка веществ может быть сложной задачей. Попробуйте эту комбинацию мнемонического устройства в сочетании с фрагментированием, чтобы сохранить в памяти список из семи сильных кислот.
Мнемонический прибор сильных кислот
Используйте фразу «Химия иногда требует подготовки, помогите! ”, чтобы начать запоминать семь сильных кислот.
- c гемия — c хлорная кислота
- n eeds — n итриновая кислота
- p ремонт — p хлороводородная кислота
- s ometimes — s
- ульфуриновая кислота h elp — h ydro acid
Добавьте приведенный ниже совет по разделению на кусочки, чтобы завершить запоминание сильных кислот, поскольку некоторые элементы начинаются с одного и того же префикса.
Чанкинг и мнемоника
В списке сильных кислот три слова h , каждое из которых начинается с префикса hydro . Соедините эти три слова вместе и выучите фразу «раньше в классе » , чтобы лучше их запомнить. Эта фраза основана на букве, следующей сразу за гидро в остальных сильных кислотах.
Чтобы вспомнить кислоты, начинающиеся с буквы h, спросите себя: « Когда понадобится h elp?» Ответ:
- b efore — hydro b romic
- i n — hydro i odic
- c lass — hydro c hloric
Примеры использования для каждого Strong Кислота
Если вы хотите узнать больше о сильных кислотах, чем просто их название и их химический состав, вы можете найти эти примеры интересных и информативных способов использования каждой из них.
- хлорная кислота — производство хлоридных солей, производство спичек, производство взрывчатых веществ
- бромистоводородная кислота — промышленные чистящие средства, литографическая печать, гравировка
- соляная кислота — желудочная кислота (способствует пищеварению), производство фейерверков, аккумулятор производство
- йодистоводородная кислота — производство уксусной кислоты, дезинфекция медицинских инструментов, промышленный восстановитель
- азотная кислота — производство взрывчатых веществ, нитрат аммония (удобрения), производство полиуретана
- хлорная кислота — отделение натрия от калия, ракета производство топлива, производство взрывчатых веществ
- серная кислота — ингредиент для очистки канализации, очистка сточных вод, производство стали
Каждая из этих кислот может использоваться многими способами, помимо примеров, приведенных выше.Большинство их приложений используются для промышленных и научных лабораторий.
Список сильных оснований
Подобно сильным кислотам, сильные основания также полностью растворяются в воде, в отличие от слабых оснований, которые не растворяются. Сильные основания выделяют ионы гидроксида (OH-) и поглощают молекулы водорода (H +). Есть восемь сильных баз.
Strong Base | Химический состав | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Гидроксид бария | Ba (OH) 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ca OH) 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
гидроксид цезия | CsOH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
гидроксид лития | LiOH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3 | гидроксид калия гидроксид рубидия | RbOH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
гидроксид натрия | NaOH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
гидроксид стронция | 22 248 9116 | 22 248 9116 При работе с этими веществами следует соблюдать особую осторожность.Они очень едкие и могут вызвать чрезвычайно опасные химические ожоги. Как запоминать сильные основыЧтобы помочь запомнить и вспомнить восемь сильных оснований, попробуйте следующий мнемонический прием. Обратите внимание, что он включает в себя слова base, и strong , поэтому фразу должно быть легко связать с тем, что она представляет.
Обратите внимание, что где есть две сильные основы, которые начинаются с одной и той же буквы, соответствующее слово в мнемонике начинается с первых двух букв или соответствующего слова, чтобы сделать инструмент запоминания максимально полезным. Примеры использования каждой сильной базыВам интересно, как можно использовать сильные базы? Откройте для себя несколько примеров практического применения каждого из них.
Сильные основания имеют много применений помимо перечисленных примероввыше.Эти вещества находят множество применений в промышленных и научных целях. Развивайте свои знания в области химии Теперь, когда у вас есть списки сильных кислот и оснований, а также общая информация и устройства, которые помогут вам их запомнить, самое время узнать больше о химии. Начните с изучения распространенных примеров баз в повседневной жизни. Определения кислот и оснований и роль воды Определения
кислот и оснований Свойства кислот и Основания согласно Boyle В 1661 году Роберт Бойль резюмировал свойства кислот следующим образом: следует. 1. Кислоты имеют кислый вкус. 2. Кислоты едкие. 3. Кислоты изменяют цвет некоторых растительных красителей, например лакмус, от синего до красного. 4. Кислоты теряют кислотность при сочетании с щелочи. Название «кислота» происходит от латинского acidus , что означает «кислый» и относится к резкому запаху и кисловатый вкус многих кислот. Примеры: уксус кислый на вкус, потому что это разбавленный раствор. уксусной кислоты в воде.Лимонный сок кислый на вкус, потому что содержит лимонную кислоту. Молоко скисает, когда портится, потому что образуется молочная кислота, и неприятный кисловатый запах гнилого мясо или масло можно отнести к таким соединениям, как масляная кислоты, образующиеся при порче жира. В 1661 году Бойль резюмировал свойства щелочей следующим образом: следует.
По сути, Бойль определил щелочи как вещества, которые потребляют, или нейтрализовать кислоты. Кислоты теряют свойственный кислый вкус и способность растворять металлы при их смешивании со щелочами. Щелочи даже обращают вспять изменение цвета, которое происходит при лакмусовой бумажке. контактирует с кислотой. Со временем стали известны щелочи. как базы , потому что они служат «базой» для делая определенные соли. Аррениус Определение кислот и оснований В 1884 году Сванте Аррениус предположил, что соли, такие как NaCl диссоциируют, когда они растворяются в воде, давая частицы, которые он называется ион .
Три года спустя Аррениус расширил эту теорию, предложив что кислоты — нейтральные соединения, которые ионизируют , когда они растворяются в воде с образованием ионов H + и соответствующего отрицательный ион.Согласно его теории, хлористый водород — это кислоты, потому что она ионизируется, когда растворяется в воде, чтобы дать ионы водорода (H + ) и хлорида (Cl — ) как показано на рисунке ниже.
Аррениус утверждал, что основания — это нейтральные соединения, которые либо диссоциировать или ионизировать в воде с образованием ионов OH — и положительный ион.NaOH является основанием Аррениуса, потому что он диссоциирует в вода с образованием гидроксида (OH —) и натрия (Na + ) ионы.
Аррениусовая кислота — это любое вещество, которое ионизируется при растворении в воде с образованием H + , или водород, ион. Основание Аррениуса — это любое вещество, которое дает ОН — , или гидроксид, ион, когда он растворяется в воде. Кислоты Аррениуса включают такие соединения, как HCl, HCN и H 2 SO 4 которые ионизируются в воде с образованием иона H + . Аррениус основания включают ионные соединения, которые содержат OH — ион, такой как NaOH, KOH и Ca (OH) 2 . Эта теория объясняет, почему кислоты обладают схожими свойствами: характерные свойства кислот возникают из-за присутствия ион H + , образующийся при растворении кислоты в воде.Это также объясняет, почему кислоты нейтрализуют основания и наоборот. Кислоты предоставить ион H + ; базы обеспечивают OH — ион; и эти ионы объединяются, образуя воду. H + ( водн. ) + OH — ( водн. ) H 2 O ( л ) Теория Аррениуса имеет несколько недостатков.
Роль H + и ОН — Ионы в химии водных растворов КислородBecuase ( EN = 3,44) намного электроотрицательнее чем водород ( EN = 2,20), электроны в HO связи в воде неодинаково разделены между водородом и кислородом атомы.Эти электроны притягиваются к атому кислорода в центре молекулы и вдали от атомов водорода на любом конец. В результате молекула воды полярна . Кислород атом несет частичный отрицательный заряд (-), а атомы водорода несут частичный положительный заряд (+). Когда они диссоциируют с образованием ионов, молекулы воды образуют положительно заряженный ион H + и отрицательно заряженный ион OH — . Возможна и обратная реакция. Ионы H + могут объединяться с ионами OH — с образованием нейтральные молекулы воды. Тот факт, что молекулы воды диссоциируют с образованием H + и ионы OH — , которые затем могут рекомбинировать с образованием воды молекул, указывается следующим уравнением. До какой степени Вода диссоциирует с образованием ионов? При 25 ° C плотность воды составляет 0,9971 г / см 3 , или 0,9971 г / мл. Следовательно, концентрация воды составляет 55,35 моль. Концентрация ионов H + и OH — образованных диссоциацией нейтральных молекул H 2 O при эта температура всего 1.0 x 10 -7 моль / л. Соотношение концентрации иона H + (или OH — ) концентрации нейтральных молекул H 2 O составляет поэтому 1,8 x 10 -9 . Другими словами, только около 2 частей на миллиард (ppb) молекулы воды диссоциируют на ионы при комнатной температуре. В На рисунке ниже показана модель из 20 молекул воды, одна из которых диссоциировал с образованием пары H + и OH — ионы.Если бы эта иллюстрация была фотографией с очень высоким разрешением структуры воды мы бы встретили пару H + и OH — ионов в среднем только один раз на каждые 25 миллион таких фотографий. Оперативный Определение кислот и оснований Тот факт, что вода диссоциирует с образованием H + и OH — ионов в обратимой реакции является основой для оперативного определение кислот и оснований, более мощное, чем определения, предложенные Аррениусом.С практической точки зрения, кислота любое вещество, повышающее концентрацию H + ион, когда он растворяется в воде. База — любое вещество. что увеличивает концентрацию иона OH — при растворяется в воде. Эти определения связывают теорию кислот и оснований с простой лабораторный тест на кислоты и щелочи. Чтобы решить, будет ли соединение — кислота или основание, мы растворяем его в воде и тестируем решение, чтобы узнать, H + или OH — концентрация ионов увеличилась. Типичные кислоты и Основания Свойства кислот и оснований являются результатом различий между химией металлов и неметаллов, как видно из химии этих классов соединений: водород, оксиды и гидроксиды. Соединения, содержащие водород, связанный с неметаллом, называются гидриды неметаллов . Поскольку они содержат водород в +1 степень окисления, эти соединения могут действовать как источник H + ион в воде. Гидриды металлов , с другой стороны, содержат водород привязан к металлу. Поскольку эти соединения содержат водород в -1 степень окисления, они диссоциируют в воде с образованием H — (или гидридный) ион. Ион H — с его парой валентных электронов может абстрагировать ион H + из молекулы воды. Поскольку удаление ионов H + из молекул воды является одним способ увеличения концентрации ионов OH — в раствор, гидриды металлов являются основаниями. Аналогичный образец можно найти в химии оксидов. образованный металлами и неметаллами. Оксиды неметаллов растворяются в воде с образованием кислот. CO 2 растворяется в воде с образованием угольная кислота, SO 3 дает серную кислоту, а P 4 O 10 реагирует с водой с образованием фосфорной кислоты. Оксиды металлов , напротив, являются основаниями.Металл оксиды формально содержат ион O 2-, который реагирует с вода с образованием пары ионов OH — . Таким образом, оксиды металлов соответствуют рабочему определению база. Мы видим такую же закономерность в химии соединений, которые содержат ОН, или гидроксид, группа. Гидроксиды металлов , такие как LiOH, NaOH, KOH и Ca (OH) 2 , являются основаниями. Гидроксиды неметаллов , такие как хлорноватистая кислота (HOCl), кислоты. В таблице ниже обобщены тенденции, наблюдаемые в этих трех категории соединений. Гидриды металлов, оксиды металлов и металл гидроксиды — основания. Гидриды неметаллов, оксиды неметаллов и гидроксиды неметаллов — кислоты. Типичные кислоты и основания
Кислые атомы водорода в гидроксидах неметаллов в приведенной выше таблице не связаны с азотом, серой или атомы фосфора.В каждом из этих соединений кислый водород присоединен к атому кислорода. Таким образом, все эти соединения примеры оксикислот. Структуры скелета для восьми оксикислот представлены на рисунке. ниже. Как правило, кислоты, содержащие кислород, имеют скелет. структуры, в которых кислые водороды присоединены к кислороду атомы. Почему металл Гидроксидные основы и неметаллические гидроксиды кислоты? Чтобы понять, почему гидроксиды неметаллов являются кислотами и металлами гидроксиды являются основаниями, мы должны смотреть на электроотрицательность атомов в этих соединениях.Начнем с типичного металла гидроксид: гидроксид натрия Разница между электроотрицательностями натрия и кислород очень большой ( EN = 2,5). В результате электроны в NaO облигации не делятся поровну электроны тянутся к более электроотрицательному атому кислорода. Таким образом, NaOH диссоциирует с образованием Na + и OH —. ионы при растворении в воде. Мы получаем совсем другой узор, когда применяем тот же процедура для хлорноватистой кислоты, HOCl, типичного неметалла гидроксид. Здесь разница электроотрицательностей атомы хлора и кислорода малы ( EN = 0,28). В результате электроны в ClO связь распределяется между двумя атомами более или менее поровну. ОН связь, с другой стороны, является полярной ( EN = 1,24) электроны в этой связи тянутся к более электроотрицательным атом кислорода. Когда эта молекула ионизируется, электроны в OH связь остается с атомом кислорода, а OCl — и H + образуются ионы. Нет резкого перехода от металла к неметаллу в ряду или вниз по столбцу периодической таблицы. Поэтому мы должны ожидайте найти соединения, которые лежат между крайностями металла и оксиды неметаллов, или гидроксиды металлов и неметаллов. Эти соединения, такие как Al 2 O 3 и Al (OH) 3 , называются амфотерными (буквально «либо, либо оба «), потому что они могут действовать как кислоты или основания.Al (OH) 3 , например, действует как кислота, когда реагирует с основанием. И наоборот, он действует как основание, когда реагирует с кислотой. Br nsted Определение кислот и оснований Модель Брнстеда или Брнстеда-Лоури основана на простом предположение: Кислоты отдают ионы H + другой ион или молекула, которая действует как основание .В диссоциация воды, например, включает перенос H + ион от одной молекулы воды к другой с образованием H 3 O + и OH — ионов. Согласно этой модели, HCl не диссоциирует в воде до образуют ионы H + и Cl + . Вместо этого H + ион передается от HCl к молекуле воды с образованием H 3 O + и ионов Cl — , как показано на рисунке ниже. Поскольку это протон, ион H + составляет несколько порядков величины меньше самого маленького атома. В результате заряд изолированного иона H + распределяется по такой небольшое пространство, которое привлекает этот ион H + к любому источнику отрицательного заряда, который существует в растворе. Таким образом, момент образования иона H + в водный раствор, он связывается с молекулой воды.Брнстед модель, в которой ионы H + переносятся от одного иона или молекулы к другому, поэтому имеет больше смысла, чем Теория Аррениуса, которая предполагает, что ионы H + существуют в водный раствор. Даже модель Брнстеда наивна. Каждый ион H + , который Кислота, отданная воде, на самом деле связана с четырьмя соседними молекулы воды, как показано на рисунке ниже. Более реалистичная формула вещества, производимого при кислота теряет ион H + , следовательно, H (H 2 O) 4 + , или H 9 O 4 + .Для всех практических для целей, однако, это вещество может быть представлено как H 3 O + ион. Реакция между HCl и водой является основой для понимание определений кислоты Бренстеда и кислоты Бренстеда база. Согласно этой теории, ион H + является передается от молекулы HCl к молекуле воды, когда HCl диссоциирует в воде. HCl действует как донор ионов H + в этой реакции, а H 2 O действует как акцептор ионов H + .Кислота Брнстеда является поэтому любое вещество (такое как HCl), которое может отдавать H + ион к основанию. База Brnsted — это любое вещество (например, H 2 O), который может принимать ион H + из кислота. Существует два способа присвоения имени H + ion. Некоторый химики называют это ионом водорода; другие называют это протоном. Как В результате кислоты Бренстеда известны как ион водорода доноры или доноры протонов .Основания Бренстеда ионно-водородные. акцепторы или акцепторы протонов . С точки зрения модели Брнстеда, реакции между кислоты и основания всегда подразумевают перенос H + ион от донора протона до акцептора протона. Кислоты могут быть нейтральные молекулы. Они также могут быть положительными ионами или отрицательные ионы. Таким образом, теория Брнстеда расширяет число потенциальных кислоты.Это также позволяет нам решить, какие соединения являются кислотами из их химические формулы. Любое соединение, содержащее водород с степень окисления +1 может быть кислотой. Кислоты Бренстеда включают HCl, H 2 S, H 2 CO 3 , H 2 PtF 6 , NH 4 + , HSO 4 — и HMnO 4 . базы Брнстеда можно идентифицировать по их структурам Льюиса. Согласно модели Брнстеда, основанием является любой ион или молекула который может принимать протон.Чтобы понять последствия этого определения, посмотрите, как прототипная база, OH — ион, принимает протон. Единственный способ принять ион H + — это сформировать ковалентная связь с ним. Для образования ковалентной связи с H + иона, не имеющего валентных электронов, база должна обеспечивать оба электроны, необходимые для образования связи.Таким образом, только соединения, которые имеют пары несвязывающих валентных электронов, могут действовать как H + -ион акцепторы, или базы Бренстеда. Следующие ниже соединения, например, могут действовать как Brnsted оснований, потому что все они содержат несвязывающие пары электронов. Модель Брнстеда расширяет список потенциальных баз до включают любой ион или молекулу, которая содержит одну или несколько пар несвязывающие валентные электроны.Брнстедовское определение базы применимо к такому количеству ионов и молекул, что почти легче подсчитывать вещества, такие как следующие, которые нельзя Бренстед основания, потому что у них нет пар несвязывающей валентности электроны. Роль воды в Теория Брнстеда Теория Брнстеда объясняет роль воды в кислотно-щелочном реакции.
, а затем теряет эти ионы H + на основание.
Модель Брнстеда может быть расширена на кислотно-основные реакции в другие растворители.Например, в жидкости наблюдается небольшая тенденция аммиак для переноса иона H + из одного NH 3 молекулы к другой с образованием NH 4 + и NH 2 — ионы.
По аналогии с химией водных растворов делаем вывод что кислоты в жидком аммиаке включают любой источник NH 4 + ион и эти основания включают любой источник NH 2 — ион. Модель Брнстеда может быть расширена даже на реакции, которые не встречаются в растворе. Классический пример газовой фазы кислотно-щелочная реакция встречается, когда открытые емкости с затем проводится концентрированная соляная кислота и водный раствор аммиака. друг другу. Вскоре образуется белое облако хлорида аммония, газообразный HCl, выходящий из одного раствора, вступает в реакцию с NH 3 газ от другого. |
 , белый, растворим.
, белый, растворим. , серебристого цвета
, серебристого цвета Кислотный оксид + вода = кислота
Кислотный оксид + вода = кислота  К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ  В простых бинарных кислотах один ион присоединен к водороду. Названия таких кислот состоят из приставки «гидро-», первого слога аниона и суффикса «-ic».
В простых бинарных кислотах один ион присоединен к водороду. Названия таких кислот состоят из приставки «гидро-», первого слога аниона и суффикса «-ic». Поэтому HClO 4 называется хлорной кислотой.
Поэтому HClO 4 называется хлорной кислотой.