Органические и неорганические вещества в организме человека. Химический состав организма человека
Впервые химические вещества классифицировал в конце IX столетия арабский ученый Абу Бакр ар-Рази. Он, опираясь на происхождение веществ, распределили их по трем группам. В первой группе он отвел место минеральным, во второй — растительным и в третьей — животным веществам.
Этой классификации было суждено просуществовать почти целое тысячелетие. Лишь в XIX веке из тех групп сформировали две — органические и неорганические вещества. Химические вещества обоих типов строятся благодаря девяноста элементам, внесенным в таблицу Д. И. Менделеева.
Группа неорганических веществ
Среди неорганических соединений различают простые и сложные вещества. Группа простых веществ объединяет металлы, неметаллы и благородные газы. Сложные вещества представлены оксидами, гидроксидами, кислотами и солями. Все неорганические вещества могут строиться из любых химических элементов.
Группа органических веществ
В состав всех органических соединений в обязательном порядке входит углерод и водород (в этом их принципиальное отличие от минеральных веществ). Вещества, образованные C и H называются углеводородами — простейшими органическими соединениями. В составе производных углеводородов находится азот и кислород. Они, в свою очередь, классифицированы на кислород- и азотсодержащие соединения.

Группа кислородсодержащих веществ представлена спиртами и эфирами, альдегидами и кетонами, карбоновыми кислотами, жирами, восками и углеводами. К азотсодержащим соединениям причислены амины, аминокислоты, нитросоединения и белки. У гетероциклических веществ положение двояко — они, в зависимости от строения, могут относиться и к тому и к другому виду углеводородов.
Химические вещества клетки
Существование клеток возможно, если в их состав входят органические и неорганические вещества. Они погибают, когда в них отсутствует вода, минеральные соли. Клетки умирают, если сильно обеднены нуклеиновыми кислотами, жирами, углеводами и белками.
Они способны к нормальной жизнедеятельности, если в них находится несколько тысяч соединений органической и неорганической природы, способных вступать во множество различных химических реакций. Биохимические процессы, текущие в клетке — основа ее жизнедеятельности, нормального развития и функционирования.
Химические элементы, насыщающие клетку
Клетки живых систем содержат группы химических элементов. Они обогащены макро-, микро- и ультрамикроэлементами.
- Макроэлементы, прежде всего, представлены углеродом, водородом, кислородом и азотом. Эти неорганические вещества клетки образуют практически все ее органические соединения. А еще к ним причислены жизненно необходимые элементы. Клетка не способна жить и развиваться без кальция, фосфора, серы, калия, хлора, натрия, магния и железа.
- Группа микроэлементов образована цинком, хромом, кобальтом и медью.
- Ультрамикроэлементы — еще одна группа, представляющая важнейшие неорганические вещества клетки. Группа сформирована золотом и серебром, оказывающим бактерицидное действие, ртутью, препятствующей обратному всасыванию воды, заполняющей почечные канальцы, оказывающей влияние на ферменты. В нее же включена платина и цезий. Определенную роль в ней отводят селену, дефицит которого ведет к различным видам рака.
Вода в составе клетки
Важность воды, распространенного на земле вещества для жизни клетки, неоспорима. В ней растворяются многие органические и неорганические вещества. Вода — та благодатная среда, где протекает невероятное количество химических реакций. Она способна растворять продукты распада и обмена. Благодаря ей клетку покидают шлаки и токсины.

Эта жидкость наделена высокой теплопроводностью. Это позволяет теплу равномерно распространяться по тканям тела. У нее существенная теплоемкость (способность поглощать теплоту, когда собственная температура изменяется минимально). Такая способность не позволяет возникать в клетке резким перепадам температур.
Вода обладает исключительно высоким поверхностным натяжением. Благодаря ему растворенные неорганические вещества, как и органические, без труда передвигаются по тканям. Множество небольших организмов, используя особенность поверхностного натяжения, держатся на водной поверхности и свободно по ней скользят.
Тургор растительных клеток зависит от воды. С опорной функцией у определенных видов животных справляется именно вода, а не какие-нибудь другие неорганические вещества. Биология выявила и изучила животных с гидростатическими скелетами. К ним относятся представители иглокожих, круглых и кольчатых червей, медуз и актиний.
Насыщенность клеток водой
Работающие клетки заполнены водой на 80 % от их общего объема. Жидкость пребывает в них в свободной и связанной форме. Белковые молекулы прочно соединяются со связанной водой. Они, окруженные водной оболочкой, изолируются друг от дружки.
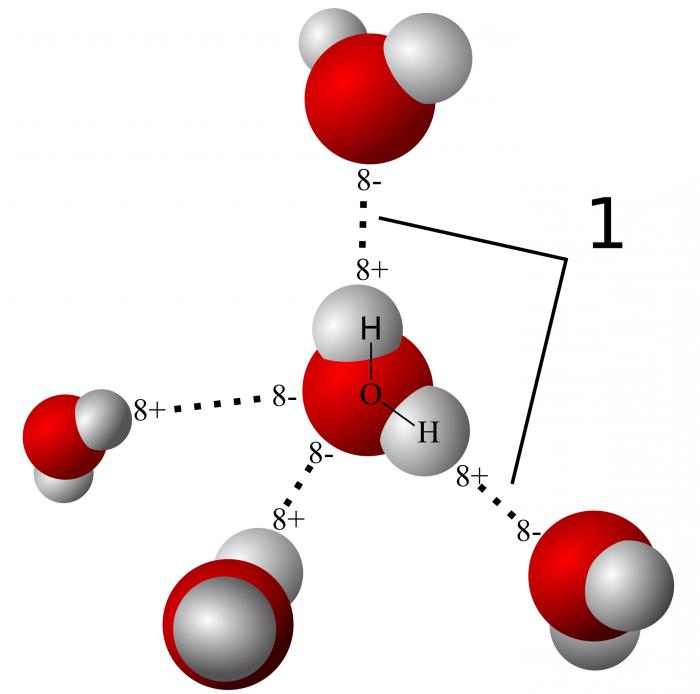
Молекулы воды полярны. Они образуют водородные связи. Благодаря водородным мостикам вода обладает высокой теплопроводностью. Связанная вода позволяет клеткам выдерживать пониженные температуры. На долю свободной воды приходится 95 %. Она способствует растворению веществ, вовлекаемых в клеточный обмен.
Высокоактивные клетки в тканях мозга содержат до 85 % воды. Мышечные клетки насыщены водой на 70 %. Менее активным клеткам, образующим жировую ткань, достаточно 40 % воды. Она в живых клетках не только растворяет неорганические химические вещества, она ключевой участник гидролиза органических соединений. Под ее воздействием органические вещества, расщепляясь, превращаются в промежуточные и конечные вещества.
Важность минеральных солей для клетки
Минеральные соли представлены в клетках катионами калия, натрия, кальция, магния и анионами HPO 4 2- , H 2 PO 4 — , Cl — , HCO 3 — . Правильные пропорции анионов и катионов создают необходимую для жизни клетки кислотность. Во многих клетках поддерживается слабощелочная среда, которая практически не меняется и обеспечивает их стабильное функционирование.
Концентрация катионов и анионов в клетках отлична от их соотношения в межклеточном пространстве. Причина тому — активная регуляция, направленная на транспортировку химических соединений. Такое течение процессов обуславливает постоянство химических составов в живых клетках. После гибели клеток концентрация химических соединений в межклеточном пространстве и цитоплазме обретает равновесие.
Неорганические вещества в химической организации клетки
В химическом составе живых клеток нет каких-либо особых элементов, характерных только для них. Это определяет единство хими
Значение неорганических веществ в организме, стадии минерального обмена
Очень большое значение имеет вода для жизни клетки. Обмен воды в организме многоклеточного существа рассмотрим на примере человека.
ОБМЕН ВОДЫ В ОРГАНИЗМЕ ЧЕЛОВЕКА:
• Поступление воды из внешней среды.
• Вода в кишечнике.
• Вода в крови и лимфе.
• Вода в клетках организма.
Некоторые функции воды:
1. Входит в состав внутриклеточной среды, участвует в образовании клеточных структур.
2. Участвует в выведении из клетки вредных и отработанных веществ.
3. Растворяет органические и неорганические соединения.
4. Обеспечивает транспорт веществ и взаимосвязь между органоидами клетки.
5. Участвует в терморегуляции.
6. Участвует в химических превращениях.
• Выведение воды из организма.
Осуществляется с участием кровеносной системы.
1. Через систему органов выделения (в составе мочи).
2. Через кожу в составе пота.
3. Через легкие (в составе выдыхаемого воздуха).
Кроме воды, в числе неорганических веществ, входящих в состав клетки, нужно назвать соли, представляющие собой ионные соединения. Клетка избирательно поглощает необходимые ей ионы из окружающей среды. Это приводит к тому, что концентрация ионов на внешней поверхности клетки отличается от их концентрации на внутренней поверхности.
Очевидно, что минеральные соли должны поступать в клетки организма из внешней среды и использоваться в них для обеспечения процессов жизнедеятельности. Избыток солей вместе с водой должен выводится из организма во внешнюю среду. Перечисленные процессы составляют сущность обмена минеральных солей в организме.
ОБМЕН МИНЕРАЛЬНЫХ СОЛЕЙ В ОРГАНИЗМЕ ЧЕЛОВЕКА:
• Мине
ральные соли в составе пищи.
• Поступают в кишечник.
• Всасываются в кровь (в растворенном виде).
• Поступают в различные органы, ткани, клетки.
Некоторые функции минеральных солей:
1. Регулируют обмен веществ, обеспечивают постоянство химического состава внутриклеточной среды.
2. Необходимы для синтеза гормонов (ионы цинка).
3. Входят в состав костной ткани (ионы кальция).
4. Обеспечивают процесс свертывания крови (ионы кальция).
5. Отвечают за проведение нервного импульса (ионы натрия, калия).
• Выведение минеральных солей из организма.
Осуществляется с участием кровеносной системы.
1. Через систему органов выделения.
2. Через пищеварительную систему.
3. Через систему покровных тканей.
Такова роль некоторых неорганических соединений в клетке и организме.
Минеральный обмен — совокупность процессов всасывания, усвоения, превращения и выведения веществ, находящихся в организме преимущественно в виде неорганических (минеральных) соединений. Функционально эти вещества в организме связаны с белками, углеводами, липидами, в том числе липидами биологических мембран и так далее. Минеральные вещества играют определяющую роль в поддержании кислотно-щелочного равновесия, осмотического давления клеточных и внеклеточных жидкостей, определяют состояние водно-солевого обмена, свёртывающей системы крови, участвуют в мышечном сокращении, многочисленных ферментативных реакциях так далее. Нарушения минерального обмена приводят к развитию тяжёлых патологических состояний — остеопорозу, остеомаляции, фосфат-диабету, рахиту, повышению нервно-мышечной возбудимости и так далее. Концентрация многих минеральных веществ в крови и моче является существенным диагностическим признаком ряда заболеваний.
Основную часть минеральных веществ в организме составляют хлориды, фосфаты и карбонаты калия, кальция, натрия, магния; существенную роль в минеральном обмене играют хлор и фосфор (Фосфорный обмен), а также микроэлементы. В водных средах организма минеральные соединения находятся в частично или полностью ионизированном состоянии, однако в организме присутствуют и нерастворимые минеральные вещества (например, минеральные компоненты костной, хрящевой и соединительной тканей, в которых сосредоточено около 99% всего кальция, 87% фосфора и 50% магния).
Всасываясь в желудочно-кишечном тракте, минеральные вещества попадают в кровь. Многие из них соединяются там с так называемыми транспортными белками (например, трансферринами, церулоплазмином, альбуминами и так далее) и в виде таких комплексов переносятся к местам активного обмена или депонирования. Из организма растворимые в воде минеральные вещества выводятся большей частью с мочой и потом, нерастворимые — с калом.
Функции каждого минерального вещества или группы минеральных веществ в организме специфичны, что обусловливает многообразие механизмов регуляции минерального обмена. Водно-солевой обмен, тесно связанный с обменом натрия, хлора и калия, регулируется гормонами минераглюкортикоидами (Кортикостероиды), вазопрессином, ренин-ангиотензинной системой и альдостероном (Гиперальдостеронизм). Фосфорно-кальциевый обмен регулируется паратгормоном (Паращитовидные железы), витамином D (см. Витамины) и кальцитонином (Щитовидная железа). Паратгормон и витамин D способствуют повышению концентрации ионов Са2+в крови и тканях. Так, паратгормон стимулирует резорбцию костной ткани с выходом освободившихся ионов Са2+ в кровь. В почках под его действием повышается обратное всасывание (реабсорбция) ионов Са2+, а реабсорбция фосфора понижается, таким образом под влиянием паратгормона выведение кальция с мочой уменьшается, а фосфора — увеличивается. В тонкой кишке под влиянием паратгормона усиливается всасывание кальция, поступающего с пищей. Скорость секреции и выброс в кровь паратгормона в свою очередь регулируются концентрацией ионов Са2+ в крови по принципу обратной связи. Витамин D участвует в регуляции переноса кальция и фосфора через клеточную мембрану эпителиальных клеток слизистой оболочки тонкой кишки в процессе их всасывания, а также в использовании кальция, поступившего в кровь в результате рассасывания предобразованной костной ткани. Витамин D регулирует также обратное всасывание фосфора и кальция в почечных канальцах.
Действие кальцитонина противоположно действию паратгормона и витамина D: он вызывает снижение содержания в крови кальция и фосфора. Секреция самого кальцитонина также регулируется концентрацией кальция в крови по принципу обратной связи. С мочой за сутки выводится от 100 до 300 мг кальция. Регуляция обмена других минеральных веществ изучена в меньшей степени.
В норме общая концентрация кальция в крови составляет 2,3-2,75 ммоль/л (9- 11 мг/100 мл), а концентрация ионизированного кальция равна в среднем 1,33 ммоль/л.
Содержание магния в сыворотке крови в норме составляет 0,7-1,2 ммоль/л; в эритроцитах оно равно 3,4-5,8 мг/100 мл эритроцитной массы. В суточном количестве мочи содержится магния (в миллиграммах): у детей грудного возраста — 20-40, у детей 1-5 лет — 40-60, у взрослых — 100-300. Повышение содержания магния в крови отмечают при уремии, гипотиреозе, метаболическом ацидозе, гипертонической болезни, артритах, рахите; снижение концентрации магния в крови наблюдается при закупорке желчевыводящих путей, тиреотоксикозе, гиперальдостеронизме. Её отмечают при хроническом алкоголизме, а также при нарушении процессов всасывания магния в кишечнике при панкреатите.
Одним из важнейших элементов, определяющих состояние минерального обмена, является калий — «антипод» натрия, основной внутриклеточный катион и потенциалообразующий ион биологических мембран. В норме содержание калия в сыворотке крови равно 3,4-5,3 ммоль/л, в эритроцитах — 77-96 ммоль/л эритроцитной массы. Концентрация калия в моче составляет 80-100 ммоль/л (2-4 г в суточном количестве). Повышение концентрации калия в крови является важным диагностическим признаком ацидоза, печёночной недостаточности, массивного гемолиза эритроцитов, аддисоновой болезни, гипокортицизма, шока. Снижение концентрации калия в крови отмечают при гиперальдостеронизме, поражениях почечных канальцев, обезвоживании организма, голодании, а также при бесконтрольном приёме мочегонных средств и так далее. Резкое возрастание выведения калия с мочой наблюдают при неправильно проводимой гипотензивной терапии.
Содержание хлора в сыворотке крови в норме составляет 97-108 ммоль/л, с мочой за сутки выводится от 150 до 2500 ммоль хлора; во внеклеточных жидкостях содержится в среднем 144 ммоль/л ионов С1-, а в мышечных клетках 2 ммоль/л. Повышенное содержание хлора в сыворотке крови может свидетельствовать об избыточном потреблении поваренной соли, а также быть существенным диагностическим признаком острого гломерулонефрита, непроходимости мочевых путей, хронической недостаточности кровообращения, гипоталамо-гипофизарной недостаточности и так далее. Возрастание выведения хлора с мочой отмечают при массивном схождении отеков, рассасывании транссудата, гиперпаратиреозе, в начальных стадиях острого гломерулонефрита. Уменьшение концентрации хлора в крови свидетельствует о метаболическом алкалозе, обезвоживании организма, его отмечают при полиурии, усиленном потоотделении, бессолевой диете.
Ионы хлора не только участвуют в регуляции водно-солевого обмена и поддержании кислотно-щелочного равновесия в организме, но и играют важную роль в процессе переноса ионов через биологические мембраны, образовании биоэлектрических потенциалов.
У детей в отличие от взрослых поступление в организм минеральных веществ и их выведение из организма не уравновешены между собой. Растущие ткани и формирующийся скелет ребёнка поглощают поступающие в организм минеральные вещества с высокой интенсивностью. Однако ионный состав плазмы крови и внеклеточной жидкости остается у ребенка постоянным во все возрастные периоды, за исключением периода новорождённости и раннего возраста.
8) Химический состав плазмы крови, нормальное содержание составных частей
Плазма крови (от греч. πλάσμα — нечто сформированное, образованное) — жидкая часть крови, которая содержит воду и взвешенные в ней вещества — белки и другие соединения. Основными белками плазмы являются альбумины, глобулины и фибриноген. Около 85 % плазмы составляет вода. Неорганические вещества составляют около 2-3 %; это катионы (Na+, K+, Mg2+, Ca2+) и анионы (HCO3-, Cl-, PO43-, SO42-). Органические вещества (около 9 %) в составе крови подразделяются на азотсодержащие (белки, аминокислоты, мочевина, креатинин, аммиак, продукты обмена пуриновых и пиримидиновых нуклеотидов) и безазотистые (глюкоза, жирные кислоты, пируват, лактат, фосфолипиды, триацилглицеролы, холестерин). Также в плазме крови содержатся газы (кислород, углекислый газ) и биологически активные вещества (гормоны, витамины, ферменты, медиаторы). Гистологически плазма является межклеточным веществом жидкой соединительной ткани (крови).
В состав плазмы крови входят вода (90 – 92%) и сухой остаток (8 – 10%). Сухой остаток состоит из органических и неорганических веществ. К органическим веществам плазмы крови относятся белки, которые составляют 7 – 8%. Белки представлены альбуминами (4,5%), глобулинами (2 – 3,5%) и фибриногеном (0,2 – 0,4%).
Белки плазмы крови выполняют разнообразные функции: 1) коллоидно-осмотический и водный гомеостаз; 2) обеспечение агрегатного состояния крови; 3) кислотно-основной гомеостаз; 4) иммунный гомеостаз; 5) транспортная функция; б) питательная функция; 7) участие в свертывании крови.
Альбумины составляют около 60% всех белков плазмы. Благодаря относительно небольшой молекулярной массе (70000) и высокой концентрации альбумины создают 80% онкотического давления. Альбумины осуществляют питательную функцию, являются резервом аминокислот для синтеза белков. Их транспортная функция заключается в переносе холестерина, жирных кислот, билирубина, солей желчных кислот, солей тяжелых металлов, лекарственных препаратов (антибиотиков, сульфаниламидов) . Альбумины синтезируются в печени.
Глобулины подразделяются на несколько фракций: a -, b — и g -глобулины.
a -Глобулины включают гликопротеины, т. е. белки, простетической группой которых являются углеводы. Около 60% всей глюкозы плазмы циркулирует в составе гликопротеинов. Эта группа белков транспортирует гормоны, витамины, микроэлементы, липиды. К a -глобулинам относятся эритропоэтин, плазминоген, протромбин.
b -Глобулины участвуют в транспорте фосфолипидов, холестерина, стероидных гормонов, катионов металлов. К этой фракции относится белок трансферрин, обеспечивающий транспорт железа, а также многие факторы свертывания крови.
g -Глобулины включают в себя различные антитела или иммуноглобулины 5 классов: Jg A, Jg G, Jg М, Jg D и Jg Е, защищающие организм от вирусов и бактерий. К g -глобулинам относятся также a и b – агглютинины крови, определяющие ее групповую принадлежность.
Глобулины образуются в печени, костном мозге, селезенке, лимфатических узлах.
Фцбриноген – первый фактор свертывания крови. Под воздействием тромбина переходит в нерастворимую форму – фибрин, обеспечивая образование сгустка крови. Фибриноген образуется в печени.
Белки и липопротеиды способны связывать поступающие в кровь лекарственные вещества. В связанном состоянии лекарства неактивны и образуют как бы депо. При уменьшении концентрации лекарственного препарата в сыворотке он отщепляется от белков и становится активным. Это надо иметь в виду, когда на фоне введения одних лекарственных веществ назначаются другие фармакологические средства. Введенные новые лекарственные вещества могут вытеснить из связанного состояния с белками ранее принятые лекарства, что приведет к повышению концентрации их активной формы.
К органическим веществам плазмы крови относятся также небелковые азотсодержащие соединения (аминокислоты, полипептиды, мочевина, мочевая кислота, креатинин, аммиак) . Общее количество небелкового азота в плазме, так называемого остаточного азота, составляет 11 – 15 ммоль/л (30 – 40 мг%). Содержание остаточного азота в крови резко возрастает при нарушении функции почек.
В плазме крови содержатся также безазотистые органические вещества: глюкоза 4,4 – 6,6 ммоль/л (80 – 120 мг%), нейтральные жиры, липиды, ферменты, расщепляющие гликоген, жиры и белки, проферменты и ферменты, участвующие в процессах свертывания крови и фибринолиза. Неорганические вещества плазмы крови составляют 0,9 – 1%. К этим веществам относятся в основном катионы Nа+, Са2+, К+, Mg2+ и анионы Сl-, НРО42-, НСО3-. Содержание катионов является более жесткой величиной, чем содержание анионов. Ионы обеспечивают нормальную функцию всех клеток организма, в том числе клеток возбудимых тканей, обусловливают осмотическое давление, регулируют рН.
В плазме постоянно присутствуют все витамины, микроэлементы, промежуточные продукты метаболизма (молочная и пировиноградная кислоты).
Плазма крови является раствором белков, электролитов,
моносахаридов, азотсодержащих соединений, липидов. При свертывании крови часть бел-
ков, отвечающих за этот процесс, теряет растворимость и вместе с форменными элементами
образует сгусток. Жидкая часть крови, лишенная свертывающих белков, называется сыво-
ротка.
Плазма крови состоит из
воды (около 90% массы),
низко молекулярных соединений органического и неорганического происхождения — солей или электролитов,
углеводов,
липидов,
органических кислот и оснований,
промежуточных продуктов обмена как содержащих азот, так и неазотистого происхождения,
витаминов (около 2% массы),
белков, на долю которых приходится до 8% массы плазмы.
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% всего
белка крови составляют альбумины, иммуноглобулины, липопротеины, фибриноген,
трансферрин; другие белки присутствуют в плазме в небольших количествах.
Из 9–10% сухого остатка плазмы крови на долю белков приходится
6,5–8,5%. Используя метод высаливания нейтральными солями, белки
плазмы крови можно разделить на три группы: альбумины, глобулины
и фибриноген. Нормальное содержание альбуминов в плазме крови состав-
ляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма кро-
ви, лишенная фибриногена, называется сывороткой.
Липопротеины плазмы крови
Липопротеины – это высокомолекулярные водорастворимые частицы, пред-
ставляющие собой комплекс белков и липидов. В этом комплексе белки
вместе с полярными липидами формируют поверхностный гидрофильный
слой, окружающий и защищающий внутреннюю гидрофобную липидную
сферу от водной среды и обеспечивающий транспорт липидов в кровяном
русле и их доставку в органы и ткани.
Ферменты, которые обнаруживаются в норме в плазме или сыворотке
крови, условно можно разделить на 3 группы: секреторные, индикаторные
и экскреторные.
Состав
• Белки — около 7,2 % (в плазме):
• сывороточный альбумин 4 %,
• сывороточный глобулин 2,8 %,
• фибриноген 0,4 %;
• Минеральные соли — 0,9—0,95 %;
• Глюкоза — 3,6—5,55 ммоль/л (венозная плазма натощак, IDF, 2011).
• Содержание гемоглобина:
• у мужчин 7,7— 8,1 ммоль/л 78—82 ед. по Сали,
• у женщин 7,0—7,4 ммоль/л 70—75 ед. по Сали;
• Число эритроцитов в 1 мм³ крови:
• у мужчин — 4 500 000—5 000 000,
• у женщин — 4 000 000—4 500 000;
• Число тромбоцитов в крови в 1 мм³ — около 300 000;
• Число лейкоцитов в крови в 1 мм³ — около 4000—9000;
• сегментоядерные 50—70 %,
• лимфоциты 20—40 %,
• моноциты 2—10 %,
• палочкоядерные 1—5 %,
• эозинофилы 2—4 %,
• базофилы 0—1 %,
• метамиелоциты 0—1 %.
Обмен веществ — Википедия
Метаболи́зм, или обме́н веще́ств — набор химических реакций, которые возникают в живом организме для поддержания жизни. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды.
Метаболизм обычно делят на 2 стадии: катаболизм и анаболизм. В ходе катаболизма сложные органические вещества деградируют до более простых, обычно выделяя энергию. А в процессах анаболизма — из более простых синтезируются более сложные вещества и это сопровождается затратами энергии.
Серии химических реакций обмена веществ называют метаболическими путями. В них, при участии ферментов, одни биологически значимые молекулы последовательно превращаются в другие.
Ферменты играют важную роль в метаболических процессах, потому что:
- действуют как биологические катализаторы и снижают энергию активации химической реакции;
- позволяют регулировать метаболические пути в ответ на изменения среды клетки или сигналы от других клеток.
Особенности метаболизма влияют на то, будет ли пригодна определённая молекула для использования организмом в качестве источника энергии. Так, например, некоторые прокариоты используют сероводород в качестве источника энергии, однако этот газ ядовит для животных[1]. Скорость обмена веществ также влияет на количество пищи, необходимой для организма.
Основные метаболические пути и их компоненты одинаковы для многих видов, что свидетельствует о единстве происхождения всех живых существ[2]. Например, некоторые карбоновые кислоты, являющиеся интермедиатами цикла трикарбоновых кислот, присутствуют во всех организмах, начиная от бактерий и заканчивая многоклеточными организмами эукариот[3]. Сходства в обмене веществ, вероятно, связаны с высокой эффективностью метаболических путей, а также с их ранним появлением в истории эволюции[4][5].
Органические вещества, входящие в состав всех живых существ (животных, растений, грибов и микроорганизмов), представлены в основном аминокислотами, углеводами, липидами (часто называемые жирами) и нуклеиновыми кислотами. Так как эти молекулы имеют важное значение для жизни, метаболические реакции сосредоточены на создании этих молекул при строительстве клеток и тканей или разрушении их с целью использования в качестве источника энергии. Многие важные биохимические реакции объединяются вместе для синтеза ДНК и белков.
Аминокислоты и белки[править | править код]
Белки являются биополимерами и состоят из остатков аминокислот, соединённых пептидными связями. Некоторые белки являются ферментами и катализируют химические реакции. Другие белки выполняют структурную или механическую функцию (например образуют цитоскелет).[6] Белки также играют важную роль в передаче сигнала в клетках, иммунных реакциях, агрегации клеток, активном транспорте через мембраны и регуляции клеточного цикла.[7]
Липиды[править | править код]
Липиды входят в состав биологических мембран, например плазматических мембран, являются компонентами коферментов и источниками энергии.[7] Липиды являются гидрофобными или амфифильными биологическими молекулами, растворимыми в органических растворителях, таких как бензол или хлороформ.[8]Жиры — большая группа соединений, в состав которых входят жирные кислоты и глицерин. Молекула трёхатомного спирта глицерина, образующая три сложные эфирные связи с тремя молекулами жирных кислот, называется триглицеридом.[9] Наряду с остатками жирных кислот, в состав сложных липидов может входить, например, сфингозин (сфинголипиды), гидрофильные группы фосфатов (в фосфолипидах). Стероиды, например холестерол, представляют собой ещё один большой класс липидов.[10]
Углеводы[править | править код]
Сахара могут существовать в кольцевой или линейной форме в виде альдегидов или кетонов, имеют несколько гидроксильных групп. Углеводы являются наиболее распространёнными биологическими молекулами. Углеводы выполняют следующие функции: хранение и транспортировка энергии (крахмал, гликоген), структурная (целлюлоза растений, хитин у грибов и животных).[7] Наиболее распространёнными мономерами сахаров являются гексозы — глюкоза, фруктоза и галактоза. Моносахариды входят в состав более сложных линейных или разветвлённых полисахаридов.[11]
Нуклеотиды[править | править код]
Полимерные молекулы ДНК и РНК представляют собой длинные неразветвлённые цепочки нуклеотидов. Нуклеиновые кислоты выполняют функцию хранения и реализации генетической информации, которые осуществляются в ходе процессов репликации, транскрипции, трансляции и биосинтеза белка.[7] Информация, закодированная в нуклеиновых кислотах, защищается от изменений системами репарации и мультиплицируется при помощи репликации ДНК.
Некоторые вирусы имеют РНК-содержащий геном. Например, вирус иммунодефицита человека использует обратную транскрипцию для создания матрицы ДНК из собственного РНК-содержащего генома.[12] Некоторые молекулы РНК обладают каталитическими свойствами (рибозимы) и входят в состав сплайсосом и рибосом.
Нуклеозиды — продукты присоединения азотистых оснований к сахару рибозе. Примерами азотистых оснований являются гетероциклические азотсодержащие соединения — производные пуринов и пиримидинов. Некоторые нуклеотиды также выступают в качестве коферментов в реакциях переноса функциональных групп.[13]
Коферменты[править | править код]
Метаболизм включает широкий спектр химических реакций, большинство из которых относится к нескольким основным типам реакций переноса функциональных групп.[14] Для переноса функциональных групп между ферментами, катализирующими химические реакции, используются коферменты.[13] Каждый класс химических реакций переноса функциональных групп катализируется отдельными ферментами и их кофакторами.[15]
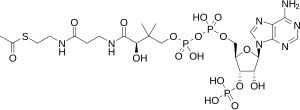
Аденозинтрифосфат (АТФ) — один из центральных коферментов, универсальный источник энергии клеток. Этот нуклеотид используется для передачи химической энергии, запасённой в макроэргических связях, между различными химическими реакциями. В клетках существует небольшое количество АТФ, который постоянно регенерируется из AДФ и AМФ. Организм человека за сутки расходует массу АТФ, равную массе собственного тела.[15] АТФ выступает в качестве связующего звена между катаболизмом и анаболизмом: при катаболических реакциях образуется АТФ, при анаболических — энергия потребляется. АТФ также выступает донором фосфатной группы в реакциях фосфорилирования.
Витамины — низкомолекулярные органические вещества, необходимые в небольших количествах, причём, например, у человека большинство витаминов не синтезируется, а получается с пищей или через микрофлору ЖКТ. В организме человека большинство витаминов являются кофакторами ферментов. Большинство витаминов приобретает биологическую активность в изменённом виде, например, все водорастворимые витамины в клетках фосфорилируются или соединяются с нуклеотидами.[16]Никотинамидадениндинуклеотид (NADH) является производным витамина B3 (ниацина) и представляет собой важный кофермент — акцептора водорода. Сотни различных ферментов дегидрогеназ отнимают электроны из молекул субстратов и переносят их на молекулы NAD+, восстанавливая его до NADH. Окисленная форма кофермента является субстратом для различных редуктаз в клетке.[17] NAD в клетке существует в двух связанных формах — NADH и NADPH. NAD+/NADH больше важен для протекания катаболических реакций, а NADP+/NADPH чаще используется в анаболических реакциях.
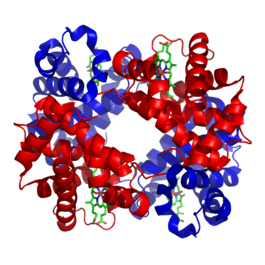 Структура гемоглобина. Белковые субъединицы окрашены красным и синим, а железосодержащий гем — зелёным. Из PDB 1GZX
Структура гемоглобина. Белковые субъединицы окрашены красным и синим, а железосодержащий гем — зелёным. Из PDB 1GZXНеорганические вещества и кофакторы[править | править код]
Неорганические элементы играют важнейшую роль в обмене веществ. Около 99 % массы млекопитающего состоит из углерода, азота, кальция, натрия, магния, хлора, калия, водорода, фосфора, кислорода и серы.[18] Биологически значимые органические соединения (белки, жиры, углеводы и нуклеиновые кислоты) содержат большое количество углерода, водорода, кислорода, азота и фосфора.[18]
Многие неорганические соединения являются ионными электролитами. Наиболее важны для организма ионы натрия, калия, кальция, магния, хлоридов, фосфатов и гидрокарбонатов. Баланс этих ионов внутри клетки и во внеклеточной среде определяет осмотическое давление и pH.[19] Концентрации ионов также играют важную роль для функционирования нервных и мышечных клеток. Потенциал действия в возбудимых тканях возникает при обмене ионами между внеклеточной жидкостью и цитоплазмой.[20] Электролиты входят и выходят из клетки через ионные каналы в плазматической мембране. Например, в ходе мышечного сокращения в плазматической мембране, цитоплазме и Т-трубочках перемещаются ионы кальция, натрия и калия.[21]
Переходные металлы в организме являются микроэлементами, наиболее распространены цинк и железо.[22][23] Эти металлы используются некоторыми белками (например ферментами в качестве кофакторов) и имеют важное значение для регуляции активности ферментов и транспортных белков.[24] Кофакторы ферментов обычно прочно связаны со специфическим белком, однако могут модифицироваться в процессе катализа, при этом после окончания катализа всегда возвращаются к своему первоначальному состоянию (не расходуются). Металлы-микроэлементы усваиваются организмом при помощи специальных транспортных белков и не встречаются в организме в свободном состоянии, так как связаны со специфическими белками-переносчиками (например ферритином или металлотионеинами).[25][26]
Классификация организмов по типу метаболизма[править | править код]
Все живые организмы можно разделить на восемь основных групп в зависимости от используемого: источника энергии, источника углерода и донора электронов (окисляемого субстрата)[27].
- В качестве источника энергии живые организмы могут использовать: энергию света (фото-) или энергию химических связей (хемо-). Дополнительно для описания паразитических организмов, использующих энергетические ресурсы хозяйской клетки, применяют термин паратроф.
- В качестве донора электронов (восстановителя) живые организмы могут использовать: неорганические вещества (лито-) или органические вещества (органо-).
- В качестве источника углерода живые организмы используют: углекислый газ (авто-) или органические вещества (гетеро-). Иногда термины авто- и гетеротроф используют в отношении других элементов, которые входят в состав биологических молекул в восстановленной форме (например азота, серы). В таком случае «автотрофными по азоту» организмами являются виды, использующие в качестве источника азота окисленные неорганические соединения (например растения; могут осуществлять восстановление нитратов). А «гетеротрофными по азоту» являются организмы, не способные осуществлять восстановление окисленных форм азота и использующие в качестве его источника органические соединения (например животные, для которых источником азота служат аминокислоты).
Название типа метаболизма формируется путём сложения соответствующих корней и добавлением в конце корня -троф-. В таблице представлены возможные типы метаболизма с примерами[28]:
| Источник энергии | Донор электронов | Источник углерода | Тип метаболизма | Примеры |
|---|---|---|---|---|
| Солнечный свет Фото- | Органические вещества -органо- | Органические вещества -гетеротроф | Фотоорганогетеротрофы | Пурпурные несерные бактерии, Галобактерии, Некоторые цианобактерии. |
| Неорганический углерод** -автотроф | Фотоорганоавтотрофы | Редкий тип метаболизма, связанный с окислением неусваиваемых веществ. Характерен для некоторых пурпурных бактерий. | ||
| Неорганические вещества -лито-* | Органические вещества -гетеротроф | Фотолитогетеротрофы | Некоторые цианобактерии, пурпурные и зелёные бактерии, также гелиобактерии. | |
| Неорганический углерод** -автотроф | Фотолитоавтотрофы | Высшие растения, Водоросли, Цианобактерии, Пурпурные серные бактерии, Зелёные бактерии. | ||
| Энергия химических связей Хемо- | Органические вещества -органо- | Органические вещества -гетеротроф | Хемоорганогетеротрофы | Животные, Грибы, Большинство микроорганизмов редуцентов. |
| Неорганический углерод** -автотроф | Хемоорганоавтотрофы | Окисление трудноусваиваемых веществ, например факультативные метилотрофы, окисляющие муравьиную кислоту. | ||
| Неорганические вещества -лито-* | Органические вещества -гетеротроф | Хемолитогетеротрофы | Метанобразующие археи, Водородные бактерии. | |
| Неорганический углерод** -автотроф | Хемолитоавтотрофы | Железобактерии, Водородные бактерии, Нитрифицирующие бактерии, Серобактерии. |
- Некоторые авторы используют -гидро-, когда в качестве донора электронов выступает вода.
- CO2, CO, HCHO, CH3OH, CH4 HCOO— и «неорганическая» метильная группа -СH3, присоединённая через атом кислорода, азота или серы к другим метильным группам (от одной до трёх) или к многоуглеродному скелету[29]
Классификация была разработана группой авторов (А. Львов, К. ван Ниль, F. J. Ryan, Э. Тейтем) и утверждена на 11-м симпозиуме в лаборатории Колд-Спринг-Харбор и изначально служила для описания типов питания микроорганизмов. Однако в настоящее время применяется и для описания метаболизма других организмов[30].
Из таблицы очевидно, что метаболические возможности прокариот значительно разнообразнее по сравнению с эукариотами, которые характеризуются фотолитоавтотрофным и хемоорганогетеротрофным типом метаболизма.
Следует отметить, что некоторые виды микроорганизмов могут в зависимости от условий среды (освещение, доступность органических веществ и т. д.) и физиологического состояния осуществлять метаболизм разного типа. Такое сочетание нескольких типов метаболизма описывается как миксотрофия.
При применении данной классификации к многоклеточным организмам важно понимать, что в рамках одного организма могут быть клетки, отличающиеся типом обмена веществ. Так клетки надземных, фотосинтезирующих органов многоклеточных растений характеризуются фотолитоавтотрофным типом метаболизма, в то время как клетки подземных органов описываются как хемоорганогетеротрофные. Так же как и в случае с микроорганизмами, при изменении условий среды, стадии развития и физиологического состояния тип метаболизма клеток многоклеточного организма может изменяться. Так, например, в темноте и на стадии прорастания семени клетки высших растений осуществляют метаболизм хемоорганогетеротрофного типа.
Катаболизмом называют метаболические процессы, при которых расщепляются относительно крупные органические молекулы сахаров, жиров, аминокислот. В ходе катаболизма образуются более простые органические молекулы, необходимые для реакций анаболизма (биосинтеза). Часто именно в ходе реакций катаболизма организм мобилизует энергию, переводя энергию химических связей органических молекул, полученных в процессе переваривания пищи, в доступные формы: в виде АТФ, восстановленных коферментов и трансмембранного электрохимического потенциала. Термин катаболизм не является синонимом «энергетического обмена»: у многих организмов (например у фототрофов) основные процессы запасания энергии не связаны напрямую с расщеплением органических молекул. Классификация организмов по типу метаболизма может быть основана на источнике получения энергии, что отражено в предыдущем разделе. Энергию химических связей используют хемотрофы, а фототрофы потребляют энергию солнечного света. Однако все эти различные формы обмена веществ зависят от окислительно-восстановительных реакций, которые связаны с передачей электронов от восстановленных доноров молекул, таких как органические молекулы, вода, аммиак, сероводород, на акцепторные молекулы, такие как кислород, нитраты или сульфат.[31] У животных эти реакции сопряжены с расщеплением сложных органических молекул до более простых, таких как двуокись углерода и воду. В фотосинтезирующих организмах — растениях и цианобактериях — реакции переноса электрона не высвобождают энергию, но они используются как способ запасания энергии, поглощаемой из солнечного света.[32]
Катаболизм у животных может быть разделён на три основных этапа. Во-первых, крупные органические молекулы, такие как белки, полисахариды и липиды, расщепляются до более мелких компонентов вне клеток. Далее эти небольшие молекулы попадают в клетки и превращается в ещё более мелкие молекулы, например ацетил-КоА. В свою очередь, ацетильная группа кофермента А окисляется до воды и углекислого газа в цикле Кребса и дыхательной цепи, высвобождая при этом энергию, которая запасается в форме АТР.
Пищеварение[править | править код]
Такие макромолекулы, как крахмал, целлюлоза или белки, должны расщепляться до более мелких единиц прежде, чем они могут быть использованы клетками. Несколько классов ферментов принимают участие в деградации: протеазы, которые расщепляют белки до пептидов и аминокислот, гликозидазы, которые расщепляют полисахариды до олиго- и моносахаридов.
Микроорганизмы выделяют гидролитические ферменты в пространство вокруг себя,[33][34] чем отличаются от животных, которые выделяют такие ферменты только из специализированных железистых клеток.[35] Аминокислоты и моносахариды, образующиеся в результате активности внеклеточных ферментов, затем поступают в клетки с помощью активного транспорта.[36][37]

Получение энергии[править | править код]
В ходе катаболизма углеводов сложные сахара расщепляются до моносахаридов, которые усваиваются клетками.[38] Попав внутрь, сахара (например глюкоза и фруктоза) в процессе гликолиза превращаются в пируват, при этом вырабатывается некоторое количество АТФ.[39] Пировиноградная кислота (пируват) является промежуточным продуктом в нескольких метаболических путях. Основной путь метаболизма пирувата — превращение в ацетил-КоА и далее поступление в цикл трикарбоновых кислот. При этом в цикле Кребса в форме АТР запасается часть энергии, а также восстанавливаются молекулы NADH и FAD. В процессе гликолиза и цикла трикарбоновых кислот образуется диоксид углерода, который является побочным продуктом жизнедеятельности. В анаэробных условиях в результате гликолиза из пирувата при участии фермента лактатдегидрогеназы образуется лактат и происходит окисление NADH до NAD+, который повторно используется в реакциях гликолиза. Существует также альтернативный путь метаболизма моносахаридов — пентозофосфатный путь, в ходе реакций которого энергия запасается в форме восстановленного кофермента NADPH и образуются пентозы, например рибоза, необходимая для синтеза нуклеиновых кислот.
Жиры на первом этапе катаболизма гидролизуются в свободные жирные кислоты и глицерин. Жирные кислоты расщепляются в процессе бета-окисления с образованием ацетил-КоА, который в свою очередь далее катаболизируется в цикле Кребса, либо идёт на синтез новых жирных кислот. Жирные кислоты выделяют больше энергии, чем углеводы, так как жиры содержат удельно больше атомов водорода в своей структуре.
Аминокислоты либо используются для синтеза белков и других биомолекул, либо окисляются до мочевины, диоксида углерода и служат источником энергии.[40] Окислительный путь катаболизма аминокислот начинается с удаления аминогруппы ферментами трансаминазами. Аминогруппы утилизируются в цикле мочевины; аминокислоты, лишённые аминогрупп, называют кетокислотами. Некоторые кетокислоты — промежуточные продукты цикла Кребса. Например, при дезаминировании глутамата образуется альфа-кетоглутаровая кислота.[41] Гликогенные аминокислоты также могут быть преобразованы в глюкозу в реакциях глюконеогенеза.[42]
Окислительное фосфорилирование[править | править код]
При окислительном фосфорилировании электроны, удалённые из пищевых молекул в метаболических путях (например в цикле Кребса), переносятся на кислород, а выделяющаяся энергия используется для синтеза АТФ. У эукариот данный процесс осуществляется при участии ряда белков, закреплённых в мембранах митохондрий, называемых дыхательной цепью переноса электронов. У прокариот эти белки присутствуют во внутренней мембране клеточной стенки.[43] Белки цепи переноса электронов используют энергию, полученную при передаче электронов от восстановленных молекул (например NADH) на кислород, для перекачки протонов через мембрану.[44]
При перекачке протонов создаётся разница концентраций ионов водорода и возникает электрохимический градиент.[45] Эта сила возвращает протоны обратно в митохондрии через основание АТФ-синтазы. Поток протонов заставляет вращаться кольцо из c-субъединиц фермента, в результате чего активный центр синтазы изменяет форму и фосфорилирует аденозиндифосфат, превращая его в АТФ.[15]
Энергия из неорганических соединений[править | править код]
Хемолитотрофами называют прокариот, имеющих особый тип обмена веществ, при котором энергия образуется в результате окисления неорганических соединений. Хемолитотрофы могут окислять молекулярный водород,[46] соединения серы (например сульфиды, сероводород и неорганические тиосульфаты),[1]оксид железа(II)[47] или аммиак.[48] При этом энергия от окисления этих соединений образуется с помощью акцепторов электронов, таких как кислород или нитриты.[49] Процессы получения энергии из неорганических веществ играют важную роль в таких биогеохимических циклах, как ацетогенез, нитрификация и денитрификация.[50][51]
Энергия из солнечного света[править | править код]
Энергия солнечного света поглощается растениями, цианобактериями, пурпурными бактериями, зелёными серными бактериями и некоторыми простейшими. Этот процесс часто сочетается с превращением диоксида углерода в органические соединения, как часть процесса фотосинтеза (см. ниже). Системы захвата энергии и фиксации углерода у некоторых прокариот могут работать раздельно (например у пурпурных и зелёных серных бактерий).[52][53]
У многих организмов поглощение солнечной энергии в принципе аналогично окислительному фосфорилированию, так как при этом энергия запасается в форме градиента концентрации протонов и движущая сила протонов приводит к синтезу АТФ.[15] Электроны, необходимые для этой цепи переноса, поступают от светособирающих белков, называемых центрами фотосинтетических реакций (примером являются родопсины). В зависимости от вида фотосинтетических пигментов классифицируют два типа центров реакций; в настоящее время большинство фотосинтезирующих бактерий имеют только один тип, в то время как растения и цианобактерии два.[54]
У растений, водорослей и цианобактерий фотосистема II использует энергию света для удаления электронов из воды, при этом молекулярный кислород выделяется как побочный продукт реакции. Электроны затем поступают в комплекс цитохрома b6f, который использует энергию для перекачки протонов через тилакоидную мембрану в хлоропластах.[7] Под действием электрохимического градиента протоны движутся обратно через мембрану и запускают АТР-синтазу. Электроны затем проходят через фотосистему I и могут быть использованы для восстановления кофермента NADP+, для использования в цикле Кальвина или рециркуляции для образования дополнительных молекул АТР.[55]
Анаболизм — совокупность метаболических процессов биосинтеза сложных молекул с затратой энергии. Сложные молекулы, входящие в состав клеточных структур, синтезируются последовательно из более простых предшественников. Анаболизм включает три основных этапа, каждый из которых катализируется специализированным ферментом. На первом этапе синтезируются молекулы-предшественники, например аминокислоты, моносахариды, терпеноиды и нуклеотиды. На втором этапе предшественники с затратой энергии АТФ преобразуются в активированные формы. На третьем этапе активированные мономеры объединяются в более сложные молекулы, например белки, полисахариды, липиды и нуклеиновые кислоты.
Не все живые организмы могут синтезировать все биологически активные молекулы. Автотрофы (например растения) могут синтезировать сложные органические молекулы из таких простых неорганических низкомолекулярных веществ, как углекислый газ и вода. Гетеротрофам необходим источник более сложных веществ, таких как моносахариды и аминокислоты, для создания более сложных молекул. Организмы классифицируют по их основным источникам энергии: фотоавтотрофы и фотогетеротрофы получают энергию из солнечного света, в то время как хемоавтотрофы и хемогетеротрофы получают энергию из неорганических реакций окисления.
Связывание углерода[править | править код]
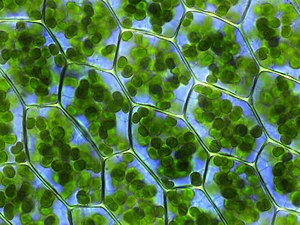 Растительные клетки содержат хлоропласты (зелёного цвета), в тилакоидах которых происходят процессы фотосинтеза. Plagiomnium affine из семейства Mniaceae отдела Настоящие мхи (Bryophyta)
Растительные клетки содержат хлоропласты (зелёного цвета), в тилакоидах которых происходят процессы фотосинтеза. Plagiomnium affine из семейства Mniaceae отдела Настоящие мхи (Bryophyta)Фотосинтезом называют процесс биосинтеза сахаров из углекислого газа, при котором необходимая энергия поглощается из солнечного света. У растений, цианобактерий и водорослей при кислородном фотосинтезе происходит фотолиз воды, при этом как побочный продукт выделяется кислород. Для преобразования CO2 в 3-фосфоглицерат используется энергия АТФ и НАДФ, запасённая в фотосистемах. Реакция связывания углерода осуществляется с помощью фермента рибулозобисфосфаткарбоксилазы и является частью цикла Кальвина.[56] У растений классифицируют три типа фотосинтеза — по пути трёхуглеродых молекул, по пути четырёхуглеродых молекул (С4), и CAM фотосинтез. Три типа фотосинтеза отличаются по пути связывания углекислого газа и его вхождения в цикл Кальвина; у C3 растений связывание CO2 происходит непосредственно в цикле Кальвина, а при С4 и CAM CO2 предварительно включается в состав других соединений. Разные формы фотосинтеза являются приспособлениями к интенсивному потоку солнечных лучей и к сухим условиям.[57]
У фотосинтезирующих прокариот механизмы связывания углерода более разнообразны. Углекислый газ может быть фиксирован в цикле Кальвина, в обратном цикле Кребса[58] или в реакциях карбоксилирования ацетил-КоА.[59][60] Прокариоты — хемоавтотрофы также связывают CO2 через цикл Кальвина, но для протекания реакции используют энергию из неорганических соединений.[61]
Углеводы и гликаны[править | править код]
В процессе анаболизма сахаров простые органические кислоты могут быть преобразованы в моносахариды, например в глюкозу, и затем использованы для синтеза полисахаридов, таких как крахмал. Образование глюкозы из соединений, таких как пируват, лактат, глицерин, 3-фосфоглицерат и аминокислот, называют глюконеогенезом. В процессе глюконеогенеза пируват превращается в глюкозо-6-фосфат через ряд промежуточных соединений, многие из которых образуются и при гликолизе.[39] Однако глюконеогенез не просто является гликолизом в обратном направлении, так как несколько химических реакций катализируют специальные ферменты, что даёт возможность независимо регулировать процессы образования и распада глюкозы.[62][63]
Многие организмы запасают питательные вещества в форме липидов и жиров, однако позвоночные не имеют ферментов, катализирующих превращение ацетил-КоА (продукта метаболизма жирных кислот) в пируват (субстрат глюконеогенеза).[64] После длительного голодания позвоночные начинают синтезировать кетоновые тела из жирных кислот, которые могут заменять глюкозу в таких тканях, как головной мозг.[65] У растений и бактерий данная метаболическая проблема решается использованием глиоксилатного цикла, который обходит этап декарбоксилирования в цикле лимонной кислоты и позволяет превращать ацетил-КоА в оксалоацетат и далее использовать для синтеза глюкозы.[64][66]
Полисахариды выполняют структурные и метаболические функции, а также могут быть соединены с липидами (гликолипиды) и белками (гликопротеиды) при помощи ферментов олигосахаридтрансфераз.[67][68]
Жирные кислоты, изопреноиды и стероиды[править | править код]
Жирные кислоты образуются синтазами жирных кислот из ацетил-КоА. Углеродный скелет жирных кислот удлиняется в цикле реакций, в которых сначала присоединяется ацетильная группа, далее карбонильная группа восстанавливается до гидроксильной, затем происходит дегидратация и последующее восстановление. Ферменты биосинтеза жирных кислот классифицируют на две группы: у животных и грибов все реакции синтеза жирных кислот осуществляются одним многофункциональным белком I типа,[69] в пластидах растений и у бактерий каждый этап катализируют отдельные ферменты II типа.[70][71]
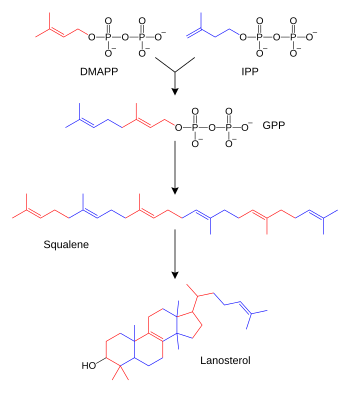
Терпены и терпеноиды являются представителями самого многочисленного класса растительных натуральных продуктов.[72] Представители данной группы веществ являются производными изопрена и образуются из активированных предшественников изопентилпирофосфата и диметилаллилпирофосфата, которые, в свою очередь, образуются в разных реакциях обмена веществ.[73] У животных и архей изопентилпирофосфат и диметилаллилпирофосфат синтезируются из ацетил-КоА в мевалонатном пути,[74] в то время как у растений и бактерий субстратами не-мевалонатного пути являются пируват и глицеральдегид-3-фосфат.[73][75] В реакциях биосинтеза стероидов молекулы изопрена объединяются и образуют сквалены, которые далее формируют циклические структуры с образованием ланостерола.[76] Ланостерол может быть преобразован в другие стероиды, например холестерин и эргостерин.[76][77]
Белки[править | править код]
Организмы различаются по способности к синтезу 20 общих аминокислот. Большинство бактерий и растений могут синтезировать все 20, но млекопитающие способны синтезировать лишь 10 заменимых аминокислот.[7] Таким образом, в случае млекопитающих 9 незаменимых аминокислот должны быть получены из пищи. Все аминокислоты синтезируются из промежуточных продуктов гликолиза, цикла лимонной кислоты или пентозомонофосфатного пути. Перенос аминогрупп с аминокислот на альфа-кетокислоты называется трансаминированием. Донорами аминогрупп являются глутамат и глутамин. [78]
Аминокислоты, соединёнными пептидными связями, образуют белки. Каждый белок имеет уникальную последовательность аминокислотных остатков (первичная структура белка). Подобно тому, как буквы алфавита могут комбинироваться с образованием почти бесконечных вариаций слов, аминокислоты могут связываться в той или иной последовательности и формировать разнообразные белки. Фермент Аминоацил-тРНК-синтетаза катализирует АТР-зависимое присоединение аминокислот к тРНК сложноэфирными связями, при этом образуются аминоацил-тРНК.[79] Аминоацил-тРНК являются субстратами для рибосом, которая объединяют аминокислоты в длинные полипептидные цепочки, используя матрицу мРНК.[80]
Нуклеотиды[править | править код]
Нуклеотиды образуются из аминокислот, углекислого газа и муравьиной кислоты в цепи реакций, для протекания которых требуется большое количество энергии.[81][82] Именно поэтому большинство организмов имеют эффективные системы сохранения ранее синтезированных нуклеотидов и азотистых оснований.[81][83]Пурины синтезируются как нуклеозиды (в основном связанные с рибозой). Аденин и гуанин образуются из инозин-монофосфата, который синтезируется из глицина, глутамина и аспартата при участии метенил-тетрагидрофолата. Пиримидины синтезируются из оротата, который образуется из глутамина и аспартата.[84]
Ксенобиотики и окислительный метаболизм[править | править код]
Все организмы постоянно подвергаются воздействию соединений, накопление которых может быть вредно для клеток. Такие потенциально опасные чужеродные соединения называются ксенобиотиками.[85] Ксенобиотики, например синтетические лекарства и яды природного происхождения, детоксифицируются специализированными ферментами. У человека такие ферменты представлены, например, цитохром-оксидазами,[86]глюкуронилтрансферазой,[87] и глутатион S-трансферазой.[88] Эта система ферментов действует в три этапа: на первой стадии ксенобиотики окисляются, затем происходит конъюгирование водорастворимых групп в молекулы, далее модифицированные водорастворимые ксенобиотики могут быть удалены из клеток и метаболизированы перед их экскрецией. Описанные реакции играют важную роль в разложении микробами загрязняющих веществ и биоремедиации загрязнённых земель и разливов нефти.[89] Многие подобные реакции протекают при участии многоклеточных организмов, однако, ввиду невероятного разнообразия, микроорганизмы справляются с гораздо более широким спектром ксенобиотиков, чем многоклеточные организмы, и способны даже разрушать стойкие органические загрязнители, например хлорорганические соединения.[90]
Связанной с этим проблемой для аэробных организмов является оксидативный стресс.[91] В процессе окислительного фосфорилирования и образования дисульфидных связей при
Неорганические вещества
Человеческий организм содержит в разных концентрациях практически все элементы таблицы Менделеева. Из неорганических соединений диагностическое значение имеют концентрация кислорода и углекислого газа, ионов солей, обеспечивающих осмотическое давление и кислотно-щелочной баланс, группы так называемых макро- и микроэлементов.
Кислород (О2(. Практически весь объем кислорода находится в организме в связанной с гемоглобином форме — в виде оксигемоглобина, и лишь 0,1-0,3% непосредственно растворено в плазме. В клинике используют несколько показателей, характеризующих кислородную обеспеченность организма:
Напряжение кислорода в крови (р02) — отражает содержание растворенного в крови кислорода.
Нормальная величина:
для артериальной крови — 83-108 мм рт. ст. (11,0-14,4 кПа),
для венозной крови — 40-45 мм рт. ст. (5,5-6,0 кПа).
Повышение напряжения кислорода происходит при его избытке во вдыхаемом воздухе, например, при гипербарической оксигенации. Эта лечебная процедура проводится в специальной камере, куда подается кислород под давлением 1-3 избыточных атмосферы. Повышенное количество растворенного кислорода обеспечивает хорошую оксигенацию всех клеток организма.
Снижение напряжения кислорода в крови (гипоксемия) возникает при пребывании на большой высоте, ингаляционном наркозе, различных заболеваниях легких и нарушениях дыхания.
Кислородная емкость крови. Зависит от содержания гемоглобина и от сродства гемоглобина к кислороду.
Нормальная величина —0,19 мл О2 В 1 мл крови.
Половинное насыщение гемоглобина кислородом (Р50) — является показателем сродства гемоглобина к кислороду.
Нормальная величина:
у взрослых — 25-29 мм рт. ст. (3,33-3,86 кПа)
у новорожденных — 18-24 мм рт. ст. (2,39-3,19 кПа).
Углекислый газ (двуокись углерода, СО2) — конечный продукт обмена веществ всех клеток. Транспортируется кровью, выводится легкими.
Напряжение углекислого газа в крови (рСО2).
Нормальная величина:
для артериальной крови — 35,8-46,6 мм рт. ст.,
для венозной крови — 46,0-58,0 мм рт. ст.
При значительных нарушениях дыхания (бронхиальная астма, отек легких, тяжелая пневмония, угнетение дыхательного центра наркотиками) и замедленном выведении углекислого газа его концентрация в крови повышается.
Снижение концентрации углекислого газа, возникающее при глубоком частом дыхании, приводит к спазму сосудов и бронхов. Сужение сосудов уменьшает кровообращение и доставку кислорода тканям, повышает артериальное давление, вызывает венозный застой. Все это, в свою очередь, приводит к нарушению обмена веществ и функций органов и тканей.
Во всех случаях повышения или снижения концентрации углекислого газа в крови и тканях происходит изменение одного из наиболее важных показателей внутренней среды организма — кислотно-щелочного состояния.
Водно-электролитный обмен
Вода является самым распространенным веществом организма. На ее долю приходится 60% массы тела у мужчин и 52% у женщин. Все биохимические реакции протекают в водных растворах внутри клеток и во внеклеточном пространстве. Водонерастворимые органические вещества, например, жиры, транспортируются в виде комплексов с водорастворимыми белками. Неорганические и многие органические вещества присутствуют в растворах в виде ионов.
Концентрация электролитов в жидкостях организма (мМоль/л) (Г.И. Козинец и др., 1996)
Внутриклеточная жидкость Внутриклеточная жидкость | |
Катионы {+) Калий — 160 Магний — 14 Натрий — 10 Кальций — 1 | Анионы (-) Фосфаты — 55 Бикарбонаты — 10 Сульфаты — 10 Хлориды — 3 |
Внеклеточная жидкость (плазмы крови) | |
Катионы (+) Натрий — 140 Калий — 5 Кальций — 2,5 Магний —1,5 | Анионы (-) Хлориды —100 Бикарбонаты — 27 Фосфаты — 1 Сульфаты —0,5 |
Концентрация ионов во внутри- и внеклеточных растворах (кровь, лимфа, желудочный сок, моча и др.) существенно отличается. Через полупроницаемые клеточные мембраны, разделяющие различные водные пространства, движение молекул происходит не только по концентрационному градиенту, но и против него, например, перенос ионов калия внутрь клетки и ионов натрия наружу, путем сложного механизма трансмембранного переноса. Вода свободно перемещается через мембраны в сторону того пространства, где концентрация органических и неорганических веществ выше, выравнивая осмотическое давление.
Благодаря различной концентрации катионов и анионов внутри и вне клеток на их мембране создается определенный электрический заряд, имеющий большое значение для функции клеток, особенно нервных. Нарушение концентрации ионов, в первую очередь, натрия, калия, кальция, хлоридов и бикарбонатов может быть причиной существенных расстройств различных систем и органов, а в тяжелых случаях приводить к смерти.
Натрий — основной катион внеклеточного пространства, играет главную роль в поддержании осмотического давления.
Нормальная концентрация: в цельной крови — 70-98 мМ/л, в плазме — 130-156 мМ/л, в слюне — 6,5-2),7мМ/л, в эритроцитах — 13-22 мМ/л.
Общее содержание в организме — 2700-3000 мМоль (1мМ — 23мг), запас в костных депо — 800-1000 мМоль.
Суточная потребность в виде NaCl — 29-87 мг на кг массы тела.
Суточное выведение: с мочой — 70-100 мМоль,
с потом — до 50 мМоль,
скалом — до 10 мМоль.
У здорового человека постоянство концентрации натрия в организме регулируется почками с участием определенных гормонов — при большом поступлении излишки натрия выводятся с мочой, при низком содержании в пище выведение уменьшается.
Снижение концентрации натрия в крови происходит при длительном применении мочегонных средств (диуретиков), частых поносах и рвоте, обширных ожогах, при заболеваниях почек, сопровождающихся потерей натрия, сахарном диабете, недостаточности коры надпочечников, избыточном введении воды.
Снижение концентрации натрия в моче отмечается при интенсивном потоотделении, низком содержании соли в пище, приеме стероидных препаратов, хроническом нефрите.
Увеличение концентрации натрия в крови наблюдается при ограничении приема воды, несахарном диабете, продолжительной рвоте и поносе без возмещения жидкости, недостатке калия, некоторых гормональных нарушениях.
Усиленное выведение натрия с мочой возникает при болезни Аддисона, нефритах с потерей солей, рассасывании отеков, сахарном диабете.
Калий— основной внутриклеточный катион, участвующий в поддержании осмотического давления, кислотно-щелочного баланса, некоторых функций клеток, особенно нервных и мышечных. Концентрация калия в организме существенно влияет на работу сердца.
Нормальная концентрация:
в крови — 38, 4-64,0 мМ/л,
в плазме — 3,4-5,3 мМ/л,
в эритроцитах — 79,8-99,3 мМ/л,
в моче — 80-100мМ/л.
Общее содержание в организме — 2300-3200 мМ.
Суточная потребность — 0,3-1 ,0 мМ на кг массы тела,
с пищей поступает около 50-200 мМ.
Суточное выведение:
с мочой — до 60 мМ,
с потом — до 10 мМ,
с калом — до 7 мМ.
Отсутствие «депо» калия в организме ведет к тому, что повышение его потерь сразу же сказывается на внутриклеточном содержании и функции клеток и проявляется, в первую очередь, нарушениями в работе сердца.
Снижение концентрации калия в крови (гипокалиемия) возникает при недостаточном поступлении с пищей, увеличении потерь с мочой и калом, при рвоте, поносе, применении калий истощающих мочегонных средств, применении стероидных препаратов, некоторых гормональных нарушениях, внутривенном введении больших объемов жидкости, не содержащей калия.
Повышение концентрации калия отмечается при выраженной почечной недостаточности, при ацидозе, неконтролируемом введении.
Увеличение выведения калия с мочой происходит при нарушениях кислотно-щелочного равновесия, приеме мочегонных средств.
Кальций — основной компонент костной ткани и зубов. Участвует в свертывании крови, сокращении мышц, деятельности некоторых эндокринных желез. Всасывание и выведение кальция находится под контролем гормонов (кальцитонин, паратиреоидный гормон) и активных метаболитов витамина Д. 99% кальция находится в костях, где он вместе с фосфором образует кристаллы гидроксиапатита) составляющего минеральную основу скелета. Несмотря на то, что лишь около 1% фиксированного кальция свободно обменивается с его растворенными фракциями, это существенно влияет на состояние костной ткани и ее механическую прочность.
Нормальная концентрация в крови — 2,3-2,75 мМ/л.
В крови кальций находится в трех формах:
— около 0,9 мМ/л связано с белками,
— около 0,25 мМ/л в комплексе с анионами (цитратом, лактатом, фосфатом, бикарбонатом),
— 1,25 мМ/л (около 50%) в свободной или ионизированной форме.
Наибольшей физиологической активностью обладает ионизированный кальций.
Одним из наиболее распространенных заболеваний, связанным с нарушением обмена кальция, является остеопороз. Это сисстемное заболевание скелета, характеризующееся снижением массы костей и нарушениями в их строении, которые приводят к значительному увеличению хрупкости костей и возможности их переломов. У здоровых людей старше 20-25 лет с возрастом происходит уменьшение костной массы со скоростью 0,5-1% в год. У женщин в постменопаузе, а также у мужчин и женщин старческого возраста среднее уменьшение массы костей может быть 3-5% и более в год. Риск развития остеопороза повышают такие факторы как дефицит эстрогенов (особенно в постменопаузе), недостаток кальция и витамина Д в пище, алкоголь, курение, гиподинамия. При первичном остеопорозе уровень кальция в крови остается, как правило, в норме. При вторичном остеопорозе, который (возникает в результате нарушения кальциевого обмена под действием лекарственных веществ и глюкокортикоидов, при нарушениях всасывания кальция в кишечнике, его выделения почками и др., концентрация кальция в крови снижена.
Увеличение концентрации кальция в крови наблюдается при гиперфункции или опухолях паращитовидных желез и повышенном образовании паратиреоидного гормона, а также при различных злокачественных опухолях с метастазами в кости и заболеванияхкрови (миеломная болезнь, лимфома, лимфосаркома). Уменьшение продукции паратиреоидного гормона (по разным причинам)! сопровождается снижением концентрации кальция в крови.
Фосфор — находится в организме в форме неорганических фосфатов, в комплексе с липидами {липидный фосфор) и нуклеотидами (кислоторастворимый фосфор). Входит в состав скелета, фосфолипидов мембран, 2,3-дифосфоглицерата (вещества, определяющего способность гемоглобина присоединять кислород). участвует в процессах накопления и освобождения энергии а клетках (в составе АТФ, АДФ, АМФ), в ферментативных реакциях (в составе НАДФ). Поступает с пищей; всасывание в тонком кишечнике фосфора и кальция тесно связано и регулируется кальциферолом. Выведение с мочой зависит от функционального состояния почек.
Нормальная концентрация в крови:
фосфор неорганический — 1-2мМ/л,
фосфор липидный — 2,0-3,5 мМ/л,
в эритроцитах — 3-5мМ/л,-
фосфор кислоторастворимый (эритроциты)— 7-14 мМ/л
в моче {неорганический фосфор) — 25,8-48,4 мМ/сут.
Определение концентрации фосфора в крови чаще всего назначается при нарушениях обмена кальция, так как наибольшее диагностическое значение имеет соотношение количества кальция и неорганического фосфора.
Увеличение концентрации отмечается при почечной недостаточности, передозировке витамина Д, недостаточности паращитовидных желез, в некоторых случаях при миеломной болезни, нарушениях липидного обмена (липидный фосфор). Количество кислоторастворимого фосфора увеличивается при всех заболеваниях, сопровождающихся кислородной недостаточностью.
Снижение концентрации происходит при дефиците витамина Д, нарушениях всасывания в кишечнике, рахите, гиперфункции паращитовидных желез.
Магний— второй по концентрации после калия внутриклеточный катион, входит в состав ряда ферментов. Наиболее необходим для функционирования сердца, нервной и мышечной ткани.
Нормальная концентрация;
в плазме — 0,7-1,2 мМ/л,
в моче — 3-5 мМ/сут,
Общее содержание в организме —около 1640мМоль, из них:
— в скелете около 50%,
— в мышцах около 30%.
Суточная потребность — 300-400 мг.
Снижение концентрации магния обнаруживается одновременно в крови и моче при больших потерях воды (продолжительные поносы, полиурия при заболеваниях почек, прием мочегонных средств), при нарушениях всасывания в кишечнике, хроническом алкоголизме, в период беременности. Недостаток магния проявляется нарушениями сердечной деятельности, а при значительном дефиците — судорогами.
Избыточное содержание магния отмечается при хронической-почечной недостаточности, гипофункции щитовидной железы и вызывает замедление проведения нервного импульса в проводящей системе сердца, блокаду нервно-мышечной передачи.
Хлориды — поступают в организм в виде солей натрия, кальция, магния, которые при растворении диссоциируют на катионы и анионы хлора. Ионизированный хлор играет большое значение в поддержании кислотно-щелочного равновесия и баланса воды в организме.
Нормальная концентрация;
в крови — 97-108мМ/л,
в моче — 150-250 мМ/сутки.
У здоровых людей, несмотря на избыточное или недостаточное поступление хлористого натрия (поваренной соли), в крови сохраняется нормальная концентрация ионов хлора благодаря регулированию их выведения с мочой. Клиническое значение определения хлоридов такое же, как и натрия. Увеличение концентрации хлоридов в крови — признак обезвоживания и может возникать при недостаточном поступлений жидкости, нарушении мочеотделения при заболеваниях почек или закупорке мочеточников, при несахарном диабете, респираторном алкалозе, недостаточности коры надпочечников.
Снижение концентрации хлоридов в крови возникает при избыточном потоотделении, рвоте, респираторном и метаболическом ацидозе, применении диуретиков, появлении отеков.
Повышенное выведение с мочой отмечается при недостаточности коры надпочечников, истощении запасов натрия, хроническом нефрите; уменьшенное выведение — при развитии отеков голодании, рвоте, усиленном потоотделении.
Концентрация хлоридов резко возрастает в поте и слюне при муковисцидозе.
Неорганические вещества в медицине
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА В МЕДИЦИНЕ.
Хлор в составе NaCI – один из основных компонентов плазмы крови. Раствор NaCI с массовой долей вещества, равной 0,9% (физиологический раствор), используют для инъекций.
Фтор в виде фторапатита Ca5(PO4)3F содержится в зубах, костях, а в виде соединений NaF, SnF2 входит в состав зубных паст.
Раствор хлороводородной кислоты применяют при лечении заболеваний желудочно- кишечного тракта (гастрит, панкреатит). Соляная кислота выполняет пищеварительную и бактерицидные функции в желудке, к тому же она участвует в реакциях восстановления ионов Fe3+ до Fe2+, после чего ионы железа, поступающие с пищей в организм, становятся доступными для усвоения, участвуют в образовании гемоглобина и других биологически активных соединений.
Бром необходим для производства лекарственных препаратов. Например, бромид натрия и бромид калия используют для приема внутрь с целью восстановления сбалансированного соотношения процессов возбуждения и торможения в головном мозге.
Иод применяют в медицине в виде так называемой иодной тинктуры (10%-ный раствор иода в этиловом спирте), превосходного антисептического и кровоостанавливающего средства. Иод участвует в образовании гормона щитовидной железы, влияющего на обмен веществ в организме, деятельность нервной системы.
Иодид натрия и иодид калия применяют для профилактики и лечения эндемического зоба, для профилактики атеросклероза.
Кислород широко используют в медицинской практике при лечении легочных и сердечных заболеваний, для поддерживания жизни больных с затрудненным дыханием ( кислородные подушки, барокамеры, «кислородный коктейль»). Кислород используют в кислородно-дыхательных аппаратах ( на военных подводных судах, при высотных полетах военных летчиков, при проведении подводных работ).
Озон – сильный окислитель, проявляющий дезинфицирующее и бактерицидные свойства. В малых дозах (в природных условиях концентрация озона в воздухе составляет 1.10-6 %) озон оказывает стимулирующее действие на организм человека: повышает устойчивость к действию токсичных веществ, уровень гемогло- бина в крови, иммунобиологическую защиту, улучшает работу легких, нормализует артериальное давление. Озоновый слой (90 % озона сосредоточено на высоте 10-50 км) спасает человека и животных, поглощая избыток ультрафиолетовых лучей, вредно влияющих на все живое. В высоких концентрациях озон токсичен, оказывает резко выраженное раздражающее действие на верхние дыхательные пути. Бронхи и легкие. Задерживает синтез витамина D, вызывает чувство усталости, головную боль, воспаление слизистых оболочек глаз, носа, кровотечение из носа.
Азот применяют в медицине как хладоагент в криотерапии.
Хлорид аммония NH4CI— диуретик и отхаркивающее средство.
Оксид азота(I) N2O –«веселящий газ»-в смеси с кислородом (80 % N2O и 20% O2 ) применяют как анестезирующее средство.
Сера участвует в образовании дисульфидных мостиков в белковых молекулах (вторичная структура белка), переносит некоторые группы атомов при обмене веществ, участвует в процессе образования запаса энергии. На кожу сера действует антипаразитарно – кератолитически и кератопластически, поэтому ее широко применяют в виде 30%-ных мазей при лечении кожных заболеваний ( экзема, лишай, чесотка). Сероводородную воду ( раствор сероводорода в воде) применяют в медицине для лечения ревматизма и кожных заболеваний.
Широко используют в медицине соли серной кислоты:Na2SO4 .10H2O(глауберова соль) и MgSO4. 7H2O ( горькая соль) – как слабительное; CaSO4. 2H2O ( гипс ) – гипсовые повязки; CuSO4. 5H2O( медный купорос) – вяжущее и антисептическое средство.
Нашатырный спирт ( 10%-ный водный раствор аммиака) используют в качестве лекарственного средства при обмороке: выделяющийся из раствора газообразный аммиак раздражает нервные окончания верхних дыхательных путей и рефлекторно возбуждает центральную нервную систему – человек приходит в сознание. Вдыхать аммиак рекомендуют также при отравлении некоторыми газообразными ядовитыми веществами.
Нитрат серебра ( ляпис) наряду с противомикробными свойствами в малых концентрациях ( до 2%) обладает вяжущим, а в больших ( 5% и более) – прижигающим действием. Его применяют при лечении кожных язв, а также при поражениях слизистых оболочек глаз ( конъюнктивит ) и гортани ( ларингит), используют для прижигания бородавок.
Фосфор ( элемент) входит в состав зубов, костей, мышц, нервных тканей и мозга. он участвует в передаче энергии в организме ( АТФ), наследственной информации (ДНК и РНК), в поддержании постоянства кислотности крови. Фосфор используют в фармации при изготовлении лекарств ( фосфакол – при глаукоме).
Активированный уголь назначают внутрь по 20-30 г в виде взвеси в воде при отравлении солями тяжелых металлов, пищевых интоксикациях. Адсорбируя токсичные вещества, он препятствует их всасыванию в желудочно-кишечном тракте и проявлению их токсического действия. Таблетки активированного угля назначают внутрь при метеоризме ( газах в кишечнике) и расстройствах пищеварения.
Смесь углекислого газа CO2(5%) с кислородом или воздухом (карбоген) – средство для возбуждения дыхательного центра – применяют в медицине в случаях резкого угнетения дыхания. Углекислый газ используют также как охлаждающий агент («сухой лед») .
Карбонат кальция CaCO3 используют в производстве зубных порошков, паст.
Гидрокарбонат натрия ( питьевая сода) NaHCO3 ( 1-2%-ные растворы) применяют для промывания глаз, полости рта и носа при поражении их отравляющими веществами. Раствор питьевой соды используют для устранения изжоги, вызванной повышением кислотности желудочного сока, а также при отравлении в химической лаборатории кислотами.
Полисилоксаны – силиконовые масла, резины HO — | SiR2— O-|n используют как медицинские материалы, обладающие хорошей совместимостью с кровью.
Тальк 3MgO. 4SiO2 . H2O применяют в медицине при изготовлении таблеток и паст.
Ионы натрия и калия играют важнейшую роль в жизнедеятельности организма человека. Натрий участвует а передаче нервных импульсов, способствует удержанию воды в тканях.
Сульфат натрия Na2SO4 применяют при отравлении солями бария и свинца.
Хлорид калия KCl применяют внутрь в виде 10 %-ного раствора в качестве противоаритмического средства, для регуляции сердечной деятельности.
Соли лития применяют при лечении психических заболеваний (карбонат лития Li2CO3), а также заболеваний, связанных с отложением солей, например подагры.
Кальций входит в состав костей. При его недостатке происходит нарушение оста, искривление костей скелета.
Хлорид кальция CaCl2 применяют при лечении неврозов, а также как противоаллергический, противоотечный, противовоспалительный препарат.
Сульфат магния MgSO4 уменьшает спазмы сосудов, применятся как слабительное и желчегонное средство.
Сульфат бария BaSO4 применяют в качестве рентгеноконтрастного средства при рентгенологическом исследовании желудочно-кишечного тракта.
Ацетат алюминия Al(CH3COO)3, алюмокалиевые квасцы KАl(SO4) .12H2O применяют для лечения кожных заболеваний
Гидроксид алюминия Al(OH)3 входит в состав адсорбирующего и обволакивающего средства, применяемого при язвенной болезни желудка, гастритах.
Марганец влияет на процессе кроветворения, ускоряет образование антител, нейтрализующих вредное влияние чужеродных белков. Например, внутривенная инъекция сульфата марганца MnSO4 спасает то укуса паука-каракурта.
Перманганат калия KMnO4 используют в качестве дезинфицирующего, антисептического и кровоостанавливающего средства.
Сульфат цинка ZnSO4 как антисептическое средство входит в состав глазных капель.
Оксид цинка применяют как вяжущее, подсушивающее и дезинфицирующее средство при кожных заболеваниях.
Неорганические вещества: вода, соли
- ГДЗ
- 1 Класс
- Окружающий мир
- 2 Класс
- Литература
- Окружающий мир
- 3 Класс
- Окружающий мир
- 4 Класс
- Окружающий мир
- 5 Класс
- Биология
- История
- География
- Литература
- Обществознание
- Человек и мир
- Технология
- Естествознание
- 6 Класс
- Биология
- История
- География
- Литература
- Обществознание
- Технология
- 7 Класс
- Биология
- История
- ОБЖ
- География
- Литература
- Обществознание
- 8 Класс
- Биология
- История
- География
- Литература
- Обществознание
- 9 Класс
- Биология
- История
- География
- Литература
- Обществознание
- 10 Класс
- Биология
- История