Соединения, содержащие атомы элементов в низшей степени окисления, будут восстановителями за счёт этих атомов. Соединения, включающие атомы элементов в высшей степени окисления, будут окислителями. Соединения, содержащие атомы в промежуточной степени окисления, в зависимости от типа реакции и условий её протекания, могут быть окислителями или восстановителями. Примеры типичных окислителей – $\ce {F2}$, $\ce {Cl2}$, $\ce {O2}$, $\ce {KClO3}$, $\ce {h3SO4}$, $\ce {HNO3}$, $\ce {KMnO4}$, $\ce {MnO2}$, $\ce {K2Cr2O7}$, $\ce {PbO2}$, типичных восстановителей – $\ce {h3}$, $\ce {C}$ (графит), $\ce {Zn}$, $\ce {Al}$, $\ce {Ca}$, $\ce {Kl}$, $\ce {h3S}$, $\ce {CO}$. Мн. вещества могут проявлять как окислительные, так и восстановит. свойства ($\ce {KNO2}$, $\ce {h3O2}$, $\ce {SO2}$, $\ce {Na2SO3}$ и др.).
Окислительно-восстановит. свойства веществ связаны с положением элементов в периодич. системе. Простые вещества – неметаллы обладают окислит. свойствами, металлы – восстановит. свойствами. В каждой группе периодич. системы элемент с более высоким порядковым номером обладает более ярко выраженными восстановит. свойствами в своей группе, а элемент с меньшим порядковым номером – более сильными окислит. свойствами. Так, кальций $\ce {Ca}$ – более сильный восстановитель, чем магний $\ce {Mg}$, а молекулярный хлор $\ce {Cl2}$ – более сильный окислитель, чем иод $\ce {I2}$.
По формальным признакам О.-в. р. подразделяют на межмолекулярные (напр., $\ce {3MnCO3 + KClO3 = 3MnO2 +KCl + 3CO2}$) и внутримолекулярные (напр., $\ce {2h3O2 = 2h3O +O2}$). Последняя реакция представляет собой самоокисление-самовосстановление (дисмутация, или диспропорционирование).
Критерием возможности протекания О.-в. р. в водном растворе при стандартных условиях может служить разность стандартных потенциалов окислителя и восстановителя Δφ0=φ0о-φ0в. Если Δφ0 больше 0, реакция в стандартных условиях протекает в прямом направлении самопроизвольно.
О.-в. р. часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрич. энергии (напр., в гальванич. элементе).
В случае О.-в. р. в органич. химии использование обобщённой концепции окисления-восстановления и понятия о степени окисления часто малоприменимо, особенно при незначит. полярности связей между атомами веществ, участвующими в реакции. В органич. химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органич. соединения к окислителю возрастает число (или кратность) кислородсодержащих связей ($\ce {C-O}$, $\ce {N-O}$, $\ce {S-O}$ и т. п.) либо уменьшается число водородсодержащих связей ($\ce {C-H}$, $\ce {N-H}$, $\ce {S-H}$ и т. п.), напр.: $\ce {RCHO -> RCOOH}$; $\ce {R2CHCHR2 -> R2C=CR2}$. При восстановлении органич. соединений в результате приобретения электронов происходят обратные процессы, напр.: $\ce {R2CO ->R2Ch3}$;$\ce {RSO2Cl->RSO2H}$.
Механизмы О.-в. р. весьма разнообразны; реакции могут протекать как по гетеролитическому, так и по гомолитическому механизму. Во многих случаях начальная стадия реакции – процесс одноэлектронного переноса. Окисление обычно протекает по положениям с наибольшей электронной плотностью, восстановление – по положениям, где электронная плотность минимальна.
В органич. химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т. е. способностью действовать избирательно на определённые функциональные группы), а также получать продукты в требуемой степени окисления. Напр., $\ce {Na[Bh5]}$ восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; $\ce {Li[Alh5]}$ восстанавливает все эти соединения до спиртов. Среди окислителей высокой селективностью обладает, напр., комплекс $\ce {CrO3}$ с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи $\ce {C-C}$. Селективность О.-в. р. может быть обеспечена и в каталитич. процессах; напр., в зависимости от катализатора и условий реакций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или до насыщенных углеводородов. Каталитич. О.-в. р. играют важную роль в пром-сти (напр., получение анилина из нитробензола).
О.-в. р. широко распространены в природе (фотосинтез, дыхание, транспорт электронов, брожение, гниение) и используются в технике (металлургия, топливная энергетика, химич. пром-сть и т. д.).
Окислительно-восстановительные реакции — Справочник химика 21
Вследствие разнообразия степеней окисления для химии -элементов очень характерны окислительно-восстановительные реакции. По этой же причине почти каждый из -элементов имеет соединения, резко отличающиеся по своим кислотно-основным свойствам, на- [c.503] Зная можно лишь предвидеть возможность или невозможность прохождения окислительно-восстановительной реакции данная система может быть окислена лишь такой системой, окисли-тельно-восстановительный потенциал которой выше. Следует учитывать также и скорость протекания реакции система может иметь очень высокий потенциал, но действовать как окислитель с очень малой скоростью, например для персульфата г-/ 2- = [c. 370]
370]
Типы окислительно-восстановительных реакций. Различают три типа реакций окисления — восстановления. [c.218]
О направлении окислительно-восстановительных реакций можно судить по изменению энергии Гиббса системы. Кроме того, для количественной характеристики окислительно-восстановительной активности веществ, находящихся в растворах или соприкасающихся с ними, используются так называемые электродные, или окислительно-восстановительные, потенциалы Е.
Очевидно, представить направление окислительно-восстановительной реакции можно, только зная количественную характеристику относительной силы окислительно-восстановительной системы . Такой характеристикой является величина окислительно-восстановительного потенциала. [c.344]
От каких факторов зависит скорость окислительно-восстановительных реакций Зависит ли она от разности окислительно-восстановительных потенциалов пар, участвующих в реакции [c.378]
Рассматриваемое правило дает возможность, пользуясь таблицей стандартных потенциалов, предвидеть направление течения различных окислительно-восстановительных реакций, выбирать подходящие окислители и восстановители и решать ряд других важных для аналитической практики вопросов. [c.350]
Окислительно-восстановительные реакции [c.214]
В общем случае, если в окислительно-восстановительной реакции на электроде участвуют наряду с двумя формами окислительно-восстановительной пары другие компоненты, которые при -этом не меняют свою степень окисления [c.352]
Окислительно-восстановительные реакции имеют ряд особенио-стей, затрудняющих их использование в титриметрическом ана-л зе. [c.370]
Следовательно, отклонения от закона действия масс, наблюдаемые в отношении скоростей окислительно-восстановительных реакций, являются лишь кажущимися и объясняются существовав нием обычно точно неизвестных промежуточных стадий окислительно-восстановительных процессов. [c.373]
[c.373]
Явление химической индукции известно более ста лет. Его изучали и изучают многие исследователи, так как возникновение индуцированных реакций слулСущность явления состоит в том, что некоторые окислительно-восстановительные реакции не протекают или протекают медленно. Предположим, что в растворе имеются вещества А и С, скорость реакции между которыми равна нулю.
Пример 5. Подсчитать нормальный потенциал окислительно-восстановительной реакции [c.260]
Какие соображения можно привести в доказательство того, что окислительно-восстановительные реакции проходят через ряд промежуточных стадий [c.378]
Как использовать обратимость окислительно-восстановительных реакций Поясните это на примере иодометрического определения мышьяка. [c.418]
Для многих окислительно-восстановительных реакций (особенно с участием сложных органических соединений) равновесный потенциал непосредственно измерить невозможно. В отличие от потенциала кислородного электрода его не всегда удается и рассчитать. Поэтому для характеристики кинетики окислительно-восстановительных реакций часто используют не величину поляризации, а непосредственное значение электродного потенциала под током. [c.429]
В кислотно-основных реакциях растворитель, например вода, может проявлять кислотные и основные свойства, т. ё. отщеплять или присоединять протон точно так же вода в окислительно-восстановительных реакциях может терять электрон (быть восстановителем) или присоединять его (быть окислителем). Подобным же свойством обладают и такие ионы, которые могут существовать в нескольких степенях, окисления. Так, известны соединения ванадия в степенях окисления два — три—четыре — пять—В Э1ИХ соединениях V и находящиеся в промежуточных степенях окисления, способны как терять электроны (быть восстановителями), превращаясь в ионы с более высокой [c.343]
Если пространственно разделить процесс окисления восстановителя II процесс восстановления окислителя, можно получить электрический ток.
За счет окислительно-восстановительной реакции по внешней цепи (металлический проводник) течет электрический ток от цинкового электрода к медному, а по внутренней цепи (трубка с электролитом) движутся ионы 504 Цинковый электрод постепенно растворяется, а на медном выделяется металлическая медь. [c.223]
Причина подобного несоответствия между предположением,, основанным на величинах стандартных потенциалов, и опытом объясняется, очевидно, тем, что здесь вследствие малой растворимости ul сильно понижается концентрация Си+, и поэтому значительно изменяется значение потенциала пары Си Си+. Таким образом, в расчете следует пользоваться стандартным потенциалом пары u V uI, равным -)-0,86 в, а не Е° пары uV u+. Согласно сказанному, окислительно-восстановительной реакцией иа электроде является u +-f 1 + е-> СиЦ, для которой уравнение Нернста записывается в следующем виде [c.354]
Для химии марганца очень характерны окислительно-восстановительные реакции. При этом кислая среда способствует образованию катионных комплексов Мп (И), а сильнощелочная среда — анионных комплексов Мп (VI). В нейтральной среде (а также слабокислой и слабощелочной) при окислительно восстановительных процессах, образуются производные Мп (IV) (чаи е всего МпО г). [c.569]
В качестве примеров окислительно-восстановительных реакций можно привести следующие [c.572]
I. Окислительно — восстановительные реакции, включающие стадии окисления катализатора окислителями (Н О, СО ) и восстановления поверхностного окисла восстановителями (СН , Н , СО) [c.158]
Процессы прямой конверсии, основанные на окислительно-восстановительных реакциях [c. 192]
192]
Часто исходный и конечный составы газовых выбросов и сточных вод неизвестны. Более того, при применении химических, электрохимических и биохимических методов очистки в результате окислительно-восстановительных реакций разрушаются одни и образуются другие, иногда даже более токсичные соединения. В этом случае необходима прямая санитарно-гигиеническая оценка способа очистки при оптимальных параметрах этого процесса. Всюду, где возможно, дана санитарно-гигиеническая оценка эффективности применяемых способов обезвреживания. [c.7]
Наконец, существует еще одна важная аналогия между кислотами и основаниями — с одной стороны, и окислителями и восста-иовителями —с другой. Так, в случае кислотно-основных реакций для того, чтобы какое-нибудь соединение проявляло кислотное свойство, необходимо присутствие в растворе основания, обладающего большим сродством к протону, чем основание, образуемое из кислоты, отдающей протон. Подобным же образом и в окислительно-восстановительных реакциях электроны не могут существовать растворе в свободном состоянии, для того чтобы какой-нибудь восстановитель проявлял свои свойства, необходимо присутствие окислителя, имеющего ббльщее сродство к электронам, чем окислитель,— продукт окисления данного восстановителя. Следовательно, точно так же, как в кислотно-основных системах, следует говорить не об отдельном окислителе или восстановителе, а об окислительно-вос-становительных системах, компонентами в которых являются окисленная и восстановленная формы одного и того же соединения. [c.344]
Учитывая, однако, что потенциал в растворе, содержащем две окислительно-восстановительные системы, удовлетворяет обоим уравнениям, для расчета можно пользоваться любым из них, смотря по тому, что удобнее. Пока оттитровано, еще не все железо (И), концентрации Ре + и для любого момента титрования вычислить очень легко. Концентрации оставщихся, не вошедших в реакцию МпОГ-ионов, вычислить гораздо труднее, так как приходится использовать константу равновесия данной окислительно-восстановительной реакции, которая должна быть известна, и учитывать концентрации РеЗ+, Ре и Мп2+ в каждый момент титрования. [c.360]
[c.360]
Природа электрода, так же как и сгепень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце — преимущественно гидроксиламин. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. В результате этого процесса получаются два основных конечных продукта — изопропиловый спирт СН3СНСН3 и пннакон (СНзСОНСНз)2. [c.432]
Ионы металлов переменной валентности как восстанавливающие и окисляющие агенты. Три )ассмотреиных варианта не исчерпывают всех во Можных иутсЙ нротекания окислительно-восстановительных реакций. В роди восстановительных (или окислительных) агентов могут выступать также находящиеся в растворе коны металлов. В этом с.лучае электродный процесс сводится к окислению (или восстановлению) ионов металлов переменной валентности, которые затем восстанавливают (или окисляют) органическое соединение. В качестве при у1сра можно указать на электроокисление суспензии антрацена. При проведении электролиза такой суспензии иочти весь ток на аноде расходуется на выделение кислорода. Если, однако, добавить к ней немного солен церия, хрома или марганца, то на аноде наряду с кислородом появится также антрахинон. Реакция идет, по-видимому, следующим образом ионы металла, наиример церия, окисляются на аноде [c.443]
Вследствие окислительного действия Fe(HI) неустойчивы Felg и Fe( N)3. При попытке их получения в растворах происходит окислительно-восстановительная реакция, например , [c.591]
Переходные металлы являются активными катализаторами в подавляющем большинстве окислительно — восстановительных реакций. Железо, например, является классическим ката/шзатором синтеза аммиака. Кобальт, никель, медь и металлы ш атиновой группы проявляют высокую активность в процессах гидрирования и дегидрирования, а также окисления. Серебро является практически единственным катализатором парциального окисления (например, этилена до его окиси). [c.93]
Кобальт, никель, медь и металлы ш атиновой группы проявляют высокую активность в процессах гидрирования и дегидрирования, а также окисления. Серебро является практически единственным катализатором парциального окисления (например, этилена до его окиси). [c.93]
Окислительно — восстановительные реакции. Из двух перечисленных выше типов реакций в гетерогенном катализе наиболее изучены окислительно — восстановительные. Они широко использовались как модельные реакции при разработке многих частных теорий катализа (промежуточных химических соединений Сабатье и В.Н. Ипатьева, мультиплетной теории A.A. Баландина, активных ансамблей Н.И. Кобозева, неоднородной поверхности Р.З. Рогин — ского, химической концепции катализа Г.К. Борескова и др.) и в особе нности при решении центральной проблемы в гетерогенном ката изе — проблемы предвидения каталитического действия. Успешное ее решение позволит создать научную основу подбора оптимальных катализаторов и разработать единую теорию катализа, обла/,,ающую главным достоинством — способностью предсказывать, а не только удовлетворительно объяснять наблюдаемые от — делььые факты. [c.159]
Подобно тому как во многих случаях возникают свободные радикалы, так для неорганических ионов должны существовать промежуточные валентные состояния. Многие результаты кинетических исследований окислительно-восстановительных реакций наталкивают на предиоложение о существовании таких нестабильных валентных состояний неорганических ионов. Один из классических примеров этого типа реакций дает медленная реакция ЗРе » + + 8п . Реакция идет очень медленно в растворе [c.508]
Промежуточные валентные состояния зачастую играют важную роль катализаторов в окислительно-восстановительных реакциях. Так, в разбавленных растворах кислот Fe » очень медленно окисляет 1 с образованием Fe и Ij [114в, 117]. Точно так же реакция между СггО (или НСгО ) и Г в кислых растворах идет чрезвычайно медленно [118]. Однако в смеси Fe » , Г и СгаО окисление Г в 1 идет очень быстро [119] и сопровождается окислением Fe » до Fe . Превращение Сг в этой системе, несомненно, идет через промежуточное четырех- или пятивалентное состояние имеющиеся по этому вопросу работы отдают предпочтение последнему. [c.509]
Однако в смеси Fe » , Г и СгаО окисление Г в 1 идет очень быстро [119] и сопровождается окислением Fe » до Fe . Превращение Сг в этой системе, несомненно, идет через промежуточное четырех- или пятивалентное состояние имеющиеся по этому вопросу работы отдают предпочтение последнему. [c.509]
Одной из наиболее валшых проблем в области нeopгaничe кoii химии является установление причин прочности связей, в комплексных попах. Так, и Со обычно очень медленно обменивают связанные с ними группы атомов (лиганды). С другой стороны, АР и Ре обменивают лиганды, такие, как Н2О и СГ, очень быстро. Как мы уже видели, такое поведение тесно связано с вопросом о скоростях окислительно-восстановительных реакций и с переносом заряда. Однако эта связь не одинакова во всех случаях, так как такие комплексы, как Ре (СХ)2 и Ре ( N) «, в которых лиганды очень инертны, легко вступают в реакции с передачей заряда. Таубе [163] дал решение этих вопросов на основании орбитальной модели валентно11 оболочки ионов. Недавно была сделана попытка более количественного решения этих проблем на основании рассмотрения влияния электрических полей лиганд на относительную энергию орбит центрального иона, которые в отсутствие этих электрических полей эквиваленты. (Эта теория получила название теории кристаллического ноля [164] в применении к неорганической химии эта теория была подробно исследована в монографии [165].) [c.524]
II в углах таких кристаллов могут быть химически неиасыш еиными и действовать как центры инициирования свободно-радикальных или окислительно-восстановительных реакции. [c.532]
Найдено, что скорость окислительно-восстановительной реакции Hg +T13+ — = 2Hg2+ + Tl+ описывается уравнением [c.587]
На одном из предприятий при проведении окисления изопропилбензола произощел взрыв в колонне окисления. Причины взрыва — присутствие в реакционной массе сажи и железа и локальная окислительно-восстановительная реакция соединений железа и гидроперекиси, что привело к местному разогреву и взрыву. Накопление сажи и железа произошло вследствие нарущения сроков промывки аппаратуры от солей железа и сажи (вместо 20 дней, указанных в регламенте, через 43 дня). [c.85]
Накопление сажи и железа произошло вследствие нарущения сроков промывки аппаратуры от солей железа и сажи (вместо 20 дней, указанных в регламенте, через 43 дня). [c.85]
Во многих случаях желательно проводить реакции свободно-радикальной полимеризации при комнатной или даже при еще более низких температурах. Ярким примером такого типа является производство синтетического каучука, где наиболее желательными физическими свойствами обладают полимеры, получаемые нри температурах ниже 0°. Обычным методом ипициирования полимеризации при подобных условиях является применение в качестве инициатора такой комбинации реагентов, которая реагирует с образованием свободных радикалов в результате какой-либо окислительно-восстановительной реакции. Исследовано большое количество таких восстановительно-окислительных систем особенно для эмульсионной полимеризации [8, 76]. Одна из таких систем, по-видимому, типичная и довольно подробно изученная, является комбинацией иона двухвалентного железа и перекиси водорода [18]. В разбавленном водном растворе кислоты они реагируют нормально, давая гидроксилы и ионы трехвалентного железа в двухстадипном процессе [c.135]
Общая химия (1984) — [ c.280 , c.285 ]
Химия (1986) — [ c.225 ]
Аналитическая химия. Т.1 (2001) — [ c.167 , c.170 ]
Аналитическая химия (1973) — [ c.151 , c.152 ]
Химия (1979) — [ c.255 ]
Общая химия в формулах, определениях, схемах (1996) — [ c.136 ]
Общая и неорганическая химия Изд.3 (1998) — [ c.234 ]
Химия (1978) — [
c.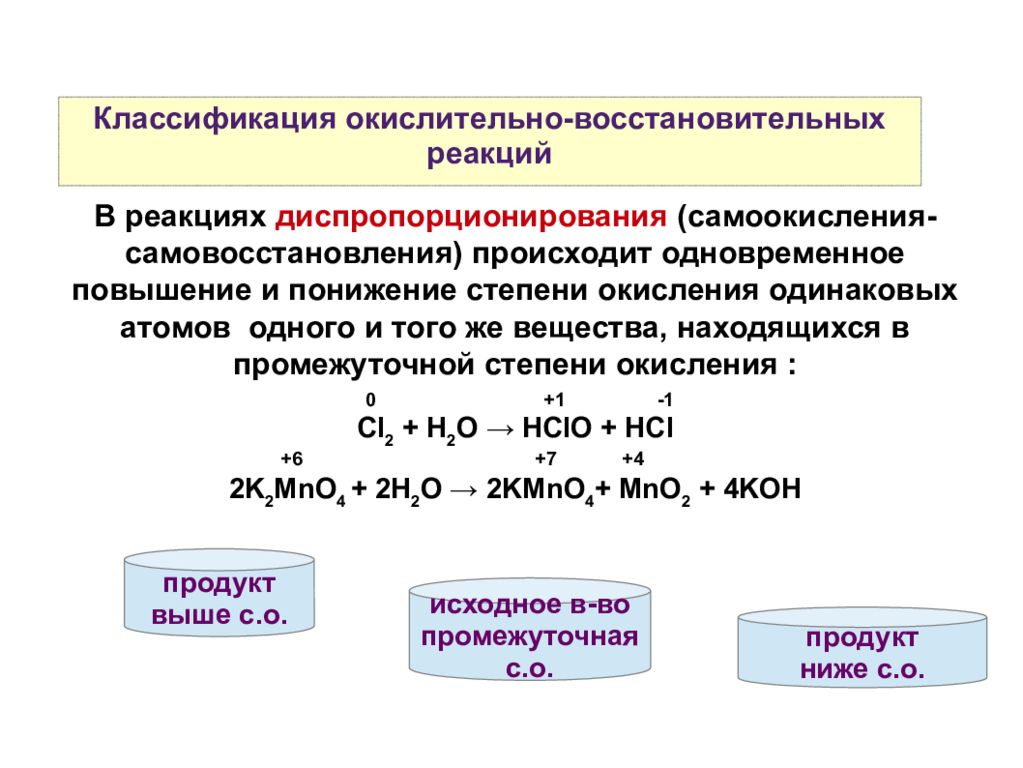 304
,
c.330
]
304
,
c.330
]
Общая химия в формулах, определениях, схемах (0) — [ c.136 ]
Введение в химию окружающей среды (1999) — [ c.83 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.136 ]
Общая химия в формулах, определениях, схемах (0) — [ c.136 ]
Методы измерения в электрохимии Том1 (1977) — [ c.11 ]
Химия координационных соединений (1966) — [ c.101 , c.171 , c.180 ]
Фотометрический анализ (1968) — [ c.13 , c.92 , c.368 , c.370 ]
Органическая химия (1964) — [ c.0 ]
Новые методы препаративной органической химии (1950) — [ c.296 , c.309 ]
Основы биохимии Т 1,2,3 (1985) — [ c.503 , c.504 , c.546 ]
Курс общей химии (1964) — [ c.148 , c.160 ]
Аналитическая химия (1965) — [ c.500 , c.503 ]
Общая химия 1982 (1982) — [ c.265 ]
Общая химия 1986 (1986) — [ c.256 ]
Аккумулятор знаний по химии (1977) — [
c. 75
]
75
]
Объёмный анализ Том 1 (1950) — [ c.97 ]
Учебник общей химии 1963 (0) — [ c.191 , c.199 ]
Руководство к практическим занятиям по радиохимии (1968) — [ c.409 , c.453 ]
Капельный анализ органических веществ (1962) — [ c.159 , c.793 ]
Общая и неорганическая химия (1959) — [ c.82 ]
Неорганическая химия (1978) — [ c.186 ]
Методы аналитической химии Часть 2 (0) — [ c.47 ]
Химия (1975) — [ c.235 ]
Лекционные опыты и демонстрации по общей и неорганической химии (1976) — [ c.290 , c.298 ]
Кинетические методы в биохимическихисследованиях (1982) — [ c.36 , c.49 ]
Общая химия Издание 18 (1976) — [ c.262 ]
Общая химия Издание 22 (1982) — [ c.265 ]
Справочник по общей и неорганической химии (1997) — [ c.61 ]
Неорганическая химия (1969) — [ c.198 ]
Общая и неорганическая химия (1981) — [ c.214 ]
Привитые и блок-сополимеры (1963) — [ c.86 ]
Курс химического качественного анализа (1960) — [
c. 168
]
168
]
Электроны в химических реакциях (1985) — [ c.269 , c.270 ]
Качественный химический полумикроанализ (1949) — [ c.103 , c.237 ]
Органическая химия (1964) — [ c.0 ]
Практикум по общей химии (1948) — [ c.138 ]
Практикум по общей химии Издание 2 1954 (1954) — [ c.123 , c.137 , c.326 ]
Практикум по общей химии Издание 3 (1957) — [ c.125 , c.139 , c.333 ]
Практикум по общей химии Издание 4 (1960) — [ c.125 , c.139 , c.333 ]
Практикум по общей химии Издание 5 (1964) — [ c.136 , c.152 , c.363 ]
Колориметрические методы определения следов металлов (1964) — [ c.120 ]
Методы аналитической химии — количественный анализ неорганических соединений (1965) — [ c.47 ]
Полимеры (1990) — [ c.30 ]
Биоэнергетика и линейная термодинамика необратимых процессов (1986) — [ c.311 ]
Новая процедура-ОЗОНОТЕРАПИЯ | ЕвроМедика
Озонотерапия имеет широкий спектр действия в медицине и косметологии. Чаще всего такая процедура назначается как составная комплексной терапии, однако в некоторых случаях озон и без других дополнительных средств может весьма хорошо справляться с поставленной перед ним задачей. Однако, озон — это мощный разрушитель всего, с чем вступают в реакцию отделившиеся от него свободные радикалы — атомы кислорода. И обращаться с ним нужно весьма осторожно. Однако, благодаря мощному обеззараживающему эффекту он практически незаменим в некоторых ситуациях.
Чаще всего такая процедура назначается как составная комплексной терапии, однако в некоторых случаях озон и без других дополнительных средств может весьма хорошо справляться с поставленной перед ним задачей. Однако, озон — это мощный разрушитель всего, с чем вступают в реакцию отделившиеся от него свободные радикалы — атомы кислорода. И обращаться с ним нужно весьма осторожно. Однако, благодаря мощному обеззараживающему эффекту он практически незаменим в некоторых ситуациях.
Показания к внутривенному введению озонотерапия внутривенно отзывы врачей
Озонотерапия внутривенно отзывы врачей вирусные заболевания грибковые поражения кожных покровов и внутренних органов хронические простуды слабый иммунитет бактериальные заболевания (хронический цистит, молочница) аллергии, астмы тяжелые кожные поражения (сильные угревые сыпи, псориазы, экземы, пролежни) токсикозы при беременности, в том числе тяжелые. Озон отлично очищает кровь от бактерий и вирусов, благодаря этому свойству он быстро снимает любые воспалительные процессы в организме, повышает иммунитет, улучшает общее самочувствие, что также отражается на внешности. Кожа выглядит более свежей и здоровой. Человек чувствует прилив сил, улучшается сон, повышается сопротивляемость организма инфекциям. Озон позволяет безмедикаментозно убрать симптомы цистита, боли в горле. И часто используется в тех случаях, когда нельзя применить антибиотики или противовирусные препараты для лечения больного.
Принцип действия
Принцип действия — прост. Попадая в кровь, молекула озона распадается на кислород (О2) и свободный атом озона — радикал (О). Атом активно вступает в химические реакции окисления со всем, что встретится на пути. В том числе с молекулами вирусов и бактерий. После окисления (присоединения атома кислорода), молекула вируса, бактерии, токсинов быстро распадается и выводится из организма. Таким образом наша кровь очищается от всего ненужного, в том числе от токсинов, болезнь уходит, иммунитет восстанавливается. Показания к подкожным инъекциям озона озонотерапия отзывы Озонотерапия показания и противопоказания отзывы угревая сыпь (при сильном поражении совместно с внутривенным введением) целлюлит выпадение волос лишние килограммы. Лишний вес и целлюлит Особенно эффективны такие уколы для борьбы с лишним весом. 7-10 таких сеансов позволяют сбросить до 5-7 килограммов без строгой диеты и изнуряющих спортивных тренировок. А самое главное, что они убирают жировые отложения в самых трудных местах, так называемых «жировых ловушках» — на животе, на галифе, в области «попиных ушек». Там, где не удается убрать жир ни голоданием, ни тренировками, ни массажем. Многие женщины сталкиваются с такой проблемой, что от диет худеют не в тех местах — щеки впали, грудь исчезла, а попа и ноги какими были, такими и остались. Уколы озона доставляют разрушитель жира непосредственно в проблемную зону — это основное преимущество таких уколов перед обще оздоровительными диетами и спортивными тренировками. Эффект обычно заметен уже после первого сеанса. Вы теряете в объеме примерно 2-3 сантиметра после каждой процедуры. Только нужно следить, чтобы врач обильно и часто обкалывал вам проблемные зоны. Озон должен буквально растекаться под кожей, кожа при постукивании в зоне уколов должна хрустеть. Вместе с жиром уходит и целлюлит, если он у вас был,так как целлюлит — ни что иное как разросшиеся «нездоровые» жировые клетки с нарушенной микроциркуляцией крови и лимфы.
Показания к подкожным инъекциям озона озонотерапия отзывы Озонотерапия показания и противопоказания отзывы угревая сыпь (при сильном поражении совместно с внутривенным введением) целлюлит выпадение волос лишние килограммы. Лишний вес и целлюлит Особенно эффективны такие уколы для борьбы с лишним весом. 7-10 таких сеансов позволяют сбросить до 5-7 килограммов без строгой диеты и изнуряющих спортивных тренировок. А самое главное, что они убирают жировые отложения в самых трудных местах, так называемых «жировых ловушках» — на животе, на галифе, в области «попиных ушек». Там, где не удается убрать жир ни голоданием, ни тренировками, ни массажем. Многие женщины сталкиваются с такой проблемой, что от диет худеют не в тех местах — щеки впали, грудь исчезла, а попа и ноги какими были, такими и остались. Уколы озона доставляют разрушитель жира непосредственно в проблемную зону — это основное преимущество таких уколов перед обще оздоровительными диетами и спортивными тренировками. Эффект обычно заметен уже после первого сеанса. Вы теряете в объеме примерно 2-3 сантиметра после каждой процедуры. Только нужно следить, чтобы врач обильно и часто обкалывал вам проблемные зоны. Озон должен буквально растекаться под кожей, кожа при постукивании в зоне уколов должна хрустеть. Вместе с жиром уходит и целлюлит, если он у вас был,так как целлюлит — ни что иное как разросшиеся «нездоровые» жировые клетки с нарушенной микроциркуляцией крови и лимфы.
Принцип действия очень прост — под кожей происходит все та же окислительная реакция. Только теперь свободный атом кислорода присоединяется к молекуле жира и разрушает ее. После этого молекулы жира выводятся из организма естественным образом. Если во время сеансов подкожных уколов вы придерживаетесь диеты, то их разрушение происходит быстрее — организм их активно использует в процессе метаболизма. Голодать не обязательно, достаточно уменьшить порции и есть легкую растительную пищу.
Угревая сыпь Уколы озона также прекрасно убирают различные высыпания и воспаления на лице или теле. Они обеззараживают глубокие слои кожи, улучшают микроциркуляцию в коже. Благодаря этому высыпания быстро проходят. Конечно, это не отменяет необходимости искать причину таких высыпаний, может быть они связаны с паразитозом, с гормональным сбоем. Однако уколы помогут поддерживать кожу в нормальном состоянии на протяжении всей противопаразитарной или гормональной терапии. Бывают случаи, когда природа высыпаний не может быть установлена — все анализы в порядке. В этом случае озонотерапия может на местном уровне убрать воспаления, и они могут больше не возобновиться. Нередко врачи и косметологи прибегают к озону в таких непонятных случаях.
Они обеззараживают глубокие слои кожи, улучшают микроциркуляцию в коже. Благодаря этому высыпания быстро проходят. Конечно, это не отменяет необходимости искать причину таких высыпаний, может быть они связаны с паразитозом, с гормональным сбоем. Однако уколы помогут поддерживать кожу в нормальном состоянии на протяжении всей противопаразитарной или гормональной терапии. Бывают случаи, когда природа высыпаний не может быть установлена — все анализы в порядке. В этом случае озонотерапия может на местном уровне убрать воспаления, и они могут больше не возобновиться. Нередко врачи и косметологи прибегают к озону в таких непонятных случаях.
Уколы озона активно используются для лечения выпадения волос. Они эффективны почти во всех случаях алопеции, за исключением андрогенной и и андрогенетической. Они помогут справиться с потерей волос из-за сильных стрессов, авитаминозов, помогут быстрее восстановить объем после лечения андрогенной алопеции, вызванной гормональным сбоев. Однако, такие уколы не помогут, если не устранить гормональный сбой до начала процедур, а могут только усугубить ситуацию. Приток крови к луковицам волос усилится, но кровь будет содержать в себе повышенное содержание губительных для волос гормонов, если начать терапию на фоне гормонального сбоя. При андрогенетической (наследственной) алопеции ничто, кроме миноксидила не поможет, здесь бессильна и озонотерапия.
Противопоказания: озон — разрушитель клеток .
Озон — мощный разрушитель клеток. Встречая на своем пути любые клетки — будь то вирусы, токсины, жиры — он вступает с ними в химические реакции и разрушает их. Если этот газ ввести в мышечную ткань, то он разрушит и ее. При вступлении в окислительную реакцию из газа высвобождается радикал — О. Этот свободный радикал разрушает клетки, в том числе и здоровые. Поэтому ни с капельницами, ни с подкожным введением озона нельзя переусердствовать, и применять их нужно только по показаниям. Озон — сильный окислитель — оксидант. А если вы помните, то все мы, наоборот, принимаем антиоксиданты, чтобы сохранить здоровье и молодость. Поэтому параллельно с сеансами озонотерапии необходимо принимать антиоксиданты, чтобы вовремя выводить оксиды из организма. Молекула О2, попадая в организм, стимулирует обменные процессы в клетках, органах и тканях. Поэтому при доброкачественных, а также при злокачественных опухолях озонотерапия противопоказана. Ее можно проводить только при фиброзно-кистозной мастопатии, так как кисты минимально снабжаются кровью. При миомах, доброкачественных новообразованиях щитовидной железы и т.д. озон противопоказан. В медицине есть такой афоризм «все — яд, и все — лекарство». Он употребим и в отношении к озону. Дозировано и строго по показаниям — он способен лечить, при бесконтрольном применении — он может калечить. Не зря существуют предельно допустимый уровень концентрации озона в воздухе.
Поэтому параллельно с сеансами озонотерапии необходимо принимать антиоксиданты, чтобы вовремя выводить оксиды из организма. Молекула О2, попадая в организм, стимулирует обменные процессы в клетках, органах и тканях. Поэтому при доброкачественных, а также при злокачественных опухолях озонотерапия противопоказана. Ее можно проводить только при фиброзно-кистозной мастопатии, так как кисты минимально снабжаются кровью. При миомах, доброкачественных новообразованиях щитовидной железы и т.д. озон противопоказан. В медицине есть такой афоризм «все — яд, и все — лекарство». Он употребим и в отношении к озону. Дозировано и строго по показаниям — он способен лечить, при бесконтрольном применении — он может калечить. Не зря существуют предельно допустимый уровень концентрации озона в воздухе.
В интернете много разных отзывов об озонотерапии. Однако, положительных откликов больше, чем отрицательных. Например, на сайте «отзовик» 85% женщин, оставивших комментарий об этой процедуре, остались довольны. Многие пишу, что внутривенная терапия помогла им справиться с хроническими болезнями (от бронхитов, астмы, цистита), когда ничего не помогало. Озон помог унять хронические аллергии, простудные заболевания. Есть четыре отзыва о положительном эффекте при болезнях суставов, процедуры облегчили боли при артритах.
Некоторые будущие мамочки пишут, что уже после первого сеанса уменьшились проявления токсикоза. В случае с тяжелым токсикозом стало легче после 10 процедуры. Про уколы одни пишут, что они помогли им уменьшить бугристость кожи при целлюлите, другие пишут, что целлюлит остался, но удалось сбросить 5 килограмм без особых усилий. Есть те, кто рекомендует озон для омоложения лица, но я бы посоветовала таким образом убирать вторые и третьи подбородки, а от мелких морщин по-моему озон не помогает.
Озонотерапия для лица .
Уколы озона в области лица благодаря свойству озона расщеплять подкожный жир позволяют быстро избавиться от второго подбородка, подтянуть овал лица. Благодаря тому, что озон улучшает обменные процессы в тканях, становятся менее заметными мешки под глазами, кожа приобретает свежий отдохнувший вид. Если нужно что-то рассосать под кожей — мешки, прыщи, жирок, то озон — лучшее средство. А вот в качестве средства от морщин я бы его не рекомендовала. Конечно, десяток сеансов и сделает морщины менее заметными, благодаря тому, что в коже улучшится микроциркуляция крови и она получит больше питательных веществ. Однако, такие уколы весьма болезненны, и в месте укола припухлость может сохраняться до двух дней. Если поставить уколы вблизи век, то можете двое суток выглядеть, так как будто вас в глаза искусали пчелы. Чтобы убрать мелкие морщинки лучше сходить, например, на лазерную биоревитализацию. Это безболезненно, более эффективно и без последствий — сразу же после нее вы можете отправиться хоть в театр. Но, как я уже писала, если вы заметили у себя на личике лишний жирок, тогда — на озонотерапию. Когда я делала озонотерапию от целлюлита, косметолог мне в подарок еще ставила несколько укольчиков в подбородок (от второго подбородка), в область глаз (от мелких морщинок под глазами) и под скулы — там у меня уже полгода держались многочисленные высыпания, почти как у подростка. Второй подбородок ушел после 3 сеанса, прыщи тоже усохли — прямо хороший эффект был. А вот эффекта под глазами от мелких морщин я не увидела, зато по два дня после каждой процедуры сидела с опухшими глазами и была похожа в это время на женщины, ведущую весьма нетрезвый образ жизни. Поэтому исходя из своего личного опыта в области глаз ставить не советую — сидение дома эдаким опухшим уродцем не оправдывает эффекта, который в моем случае был — никакой. А вот от второго подбородка и угрей озон — супер средство.
Благодаря тому, что озон улучшает обменные процессы в тканях, становятся менее заметными мешки под глазами, кожа приобретает свежий отдохнувший вид. Если нужно что-то рассосать под кожей — мешки, прыщи, жирок, то озон — лучшее средство. А вот в качестве средства от морщин я бы его не рекомендовала. Конечно, десяток сеансов и сделает морщины менее заметными, благодаря тому, что в коже улучшится микроциркуляция крови и она получит больше питательных веществ. Однако, такие уколы весьма болезненны, и в месте укола припухлость может сохраняться до двух дней. Если поставить уколы вблизи век, то можете двое суток выглядеть, так как будто вас в глаза искусали пчелы. Чтобы убрать мелкие морщинки лучше сходить, например, на лазерную биоревитализацию. Это безболезненно, более эффективно и без последствий — сразу же после нее вы можете отправиться хоть в театр. Но, как я уже писала, если вы заметили у себя на личике лишний жирок, тогда — на озонотерапию. Когда я делала озонотерапию от целлюлита, косметолог мне в подарок еще ставила несколько укольчиков в подбородок (от второго подбородка), в область глаз (от мелких морщинок под глазами) и под скулы — там у меня уже полгода держались многочисленные высыпания, почти как у подростка. Второй подбородок ушел после 3 сеанса, прыщи тоже усохли — прямо хороший эффект был. А вот эффекта под глазами от мелких морщин я не увидела, зато по два дня после каждой процедуры сидела с опухшими глазами и была похожа в это время на женщины, ведущую весьма нетрезвый образ жизни. Поэтому исходя из своего личного опыта в области глаз ставить не советую — сидение дома эдаким опухшим уродцем не оправдывает эффекта, который в моем случае был — никакой. А вот от второго подбородка и угрей озон — супер средство.
ХиМиК.ru — ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — Химическая энциклопедия
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ (р-ции
окисления-восстановления) происходят с изменением степени окисления атомов,
входящих в состав реагирующих в-в. При окислении в-в степень окисления элементов возрастает, при восстановлении
— понижается.
При окислении в-в степень окисления элементов возрастает, при восстановлении
— понижается.
Первоначально окислением
называли только р-ции в-в с кислородом, восстановлением — отнятие кислорода.
С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено
на р-ции, в к-рых кислород не участвует.
В неорг. химии окислительно-восстановительные реакции
формально могут рассматриваться как перемещение электронов от атома одного реагента
(восстановителя) к атому другого (окислителя), напр.:
При этом окислитель
восстанавливается, а восстановитель окисляется. При протекании р-ций
в гальванич. элементе переход электронов осуществляется по проводнику, соединяющему
электроды элемента, и изменение энергии Гиббса DG в данной р-ции м. б. превращено
в полезную работу. В отличие от р-ций ионного обмена окислительно-восстановительные реакции в водных р-рах
протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей
степени окисления являются только окислителями, в низшей — только восстановителями;
атомы в промежут. степени окисления в зависимости от типа р-ции и условий ее
протекания м.б. окислителями или восстановителями. Многие окислительно-восстановительные реакции-каталитические
(см. Окислительно-восстановительный катализ).
По формальным признакам
окислительно-восстановительные реакции разделяют на межмол. (напр., 2SO2 + O2
SO3) и внутримол., напр.:
Последняя р-ция представляет
собой самоокисление-самовосстановление (см. Диспропорционирование).
Окислительно-восстановительные реакции часто сопровождаются
высоким энерговыделением, поэтому их используют для получения теплоты или электрич.
энергии. Наиб. энергичные окислительно-восстановительные реакции протекают при взаимод. восстановителей с окислителями
в отсутствие р-рителя; в р-рах такие р-ции м.б. невозможны вследствие окислит.-восстановит.
взаимод. одного или обоих реагентов с р-рителем. Так, в водном р-ре нельзя непосредственно
провести р-цию 2Na + F22NaF,
поскольку натрий и фтор бурно взаимод. с водой. На окислит.-восстановит. св-ва
ионов сильно влияет комплексообразование, напр.: комплекс [Co2+(CN)6]4-,
в отличие от гидратир. иона Со2+, является сильным восстановителем.
Наиб. энергичные окислительно-восстановительные реакции протекают при взаимод. восстановителей с окислителями
в отсутствие р-рителя; в р-рах такие р-ции м.б. невозможны вследствие окислит.-восстановит.
взаимод. одного или обоих реагентов с р-рителем. Так, в водном р-ре нельзя непосредственно
провести р-цию 2Na + F22NaF,
поскольку натрий и фтор бурно взаимод. с водой. На окислит.-восстановит. св-ва
ионов сильно влияет комплексообразование, напр.: комплекс [Co2+(CN)6]4-,
в отличие от гидратир. иона Со2+, является сильным восстановителем.
В случае окислительно-восстановительных реакций в орг.
химии использование обобщенной концепции окисления-восстановления и понятия
о степени окисления часто малопродуктивно, особенно при нез-начит. полярности
связей между атомами, участвующими в р-ции. В орг. химии окисление рассматривают
обычно как процесс, при к-ром в результате перехода электронов от орг. соед.
к окислителю возрастает число (или кратность) кислородсодержащих связей (С —
О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С —
Н, N —Н, S —Н и т.п.), напр.: RCHO
RCOOH; R2CHCHR2
R2C=CR2. При восстановлении орг. соед. в результате приобретения
электронов происходят обратные процессы, напр.: R2CO
R2CH2; RSO2C1RSO2H.
Используют также подход,
при к-ром атомам С в молекуле приписывают разл. степени окисления в зависимости
от числа связей, образованных с элементом более электроотрицательным, чем водород.
В этом случае функцией, производные можно расположить в порядке возрастания
их степени окисления. Так, насыщ. углеводороды относят к нулевой группе (приблизит,
степень окисления — 4), R2C = = CR2, ROH, RCl и RNH2—
к первой (- 2), RCCR,
R2CO и R2CCl2 — ко второй (0), RCOOH, RCCC1,
RCONH2 и RССl3-к
третьей (+2), RCN, CCl4 и СО2-к четвертой (+ 4). Тогда
окисление-процесс, при к-ром соед. переходит в более высокую категорию, восстановление
— обратный процесс.
Тогда
окисление-процесс, при к-ром соед. переходит в более высокую категорию, восстановление
— обратный процесс.
Механизмы окислительно-восстановительных реакций весьма
разнообразны; р-ции могут протекать как по гетеролитическому, так и по гомолитич.
механизму. Во мн. случаях начальная стадия р-ции — процесс одноэлектронного
переноса. Окисление обычно протекает по положениям с наиб, электронной плотностью,
восстановление — по положениям, где электронная плотность минимальна.
В орг. химии используют
широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий
селективностью (т.е. способностью действовать избирательно на определенные функц.
группы), а также получать продукты в требуемой степени окисления. Напр., борогид-рид
Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и
сложными эфирами; LiAlH4 восстанавливает все эти соед. до спиртов.
Среди окислителей высокой селективностью обладают, напр., комплекс СгО3
с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные
связи С — С, а также SeO2, окисляющий кетоны и альдегиды до a-дикарбонильных
соединений.
Селективность окислительно-восстановительных реакций может
быть обеспечена и в катали-тич. процессах; напр., в зависимости от катализатора
и условий р-ций ацетиленовые углеводороды можно селективно гидрировать до этиленовых
или насыщ. углеводородов (см. Гидрирование). Электрохим. восстановление
СО2 до СО в водной среде в присут. никелевого комплекса 1, 4, 8,
11-тетраазациклотетрадекана позволяет проводить желаемый процесс при более низких
потенциалах и одновременно подавлять электролиз воды с образованием Н2.
Эта р-ция имеет ключевое значение для превращения СО2 через СО в
разнообразные орг. в-ва.
в-ва.
Каталитич. окислительно-восстановительные реакции играют
важную роль в пром-сти, напр.:
Окислительно-восстановительные реакции широко распространены
в природе и используются в технике. В основе жизни лежат окислительно-восстановительные реакции, происходящие
при фотосинтезе, дыхании, транспорте электронов; они же обеспечивают
осн. часть энергопотребления человечества за счет сжигания орг. топлива. Получение
металлов, извлечение энергии взрыва основано на окислительно-восстановительных реакциях.
Лит.: Хомченко Г.
П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М.,
1980; Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ.,
кн. 2, М., 1981, с. 119-41, 308-43; Марч Дж., Органическая химия, пер. с англ.,
т. 4, М., 1988, с. 259-341; ТурьяиЯ.И., Окислительно-восстановительные реакции
и потенциалы в аналитической химии, М., 1989; Тодрес 3. В., Электронный перенос
в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер.
Органическая химия, т. 12, М., 1989. С. И. Дракин, З.В. Тодрес.
Еще по теме:
Химическое отбеливание зубов: кабинетное и домашнее
Обратившись в стоматологическую клинику «Белый Кит» вы станете обладателем, белоснежной голливудской улыбки.
Одним из самых распространенных и эффективных способов отбеливания зубов является химический метод.
Что это такое химическое отбеливание зубов?
В основе данного способа улучшения цвета зубов лежит химическая окислительная реакция, активным компонентом которой выступает кислород. На зубы наносят специальный гель с отбеливающим агентом, которым обычно является перекись карбамида либо водорода. Последнее время используют также и перборат натрия, как более безопасное и эффективное соединение. Существует два вида химического отбеливания: домашний и кабинетный (профессиональный). Сразу оговоримся, что даже при отбеливании зубов дома, необходима консультация и контроль врача.
Сразу оговоримся, что даже при отбеливании зубов дома, необходима консультация и контроль врача.
Домашнему способу отдают предпочтение, когда налет не сильно выражен, в случаях же значительного изменения цвета зубов решить проблему можно только профессионально.
Как осуществляется домашняя процедура?
Для этого необходимо обзавестись каппой для зубов (лучше индивидуальной, сделанной по Вашему слепку) и отбеливающим гелем, концентрация агента в котором составляет 10%. Процедуру можно проводить один раз в день, надевая каппу на предварительно очищенные зубы на ночь (но не более 10 часов), либо два раза – утром и вечером по 2 часа.
- Плюс метода цена
- Минус – длительность процесса
Полное отбеливание произойдет лишь спустя 4-6 недель.
Как проводится процедура в кабинете стоматолога?
Гели, используемые в кабинетном методе, имеют более высокую концентрацию отбеливающего агента – 16%, 22% либо 38%. Поэтому предварительно врач защищает десны специальными пастами и коффердамом (латексной пластиной), а затем наносит гель на очищенные абразивными пластами зубы. Процедура длится порядка часа. Иногда для ускорения процесса используют тепловое, световое либо лазерное облучение.
Плюсы и минусы кабинетного способа прямо противоположны домашнему.
Конечно, выбирая между этими двумя методами химического отбеливания, стоит отдать предпочтение профессиональному. Поскольку квалифицированный врач лучше справится с данной задачей, да и результата долго ждать не придется.
Как надолго сохранить белоснежную улыбку?
Эффект отбеливания может длиться от 2 до 5 лет, все зависит от того, как вы будете ухаживать за своими зубами после процедуры. Достаточно чистить их два раза в день, всегда следить за гигиеной и здоровьем полости рта и регулярно (раз в полгода) посещать стоматолога с целью проведения профилактических сеансов.
После каждой процедуры в течение 3 часов воздерживайтесь от употребления напитков и продуктов с красящими веществами, а также курения. Дело в органической защитной пленке зубов, которая во время процесса отбеливания уничтожается, и образуется заново из слюны лишь спустя 3 и более часов.
Дело в органической защитной пленке зубов, которая во время процесса отбеливания уничтожается, и образуется заново из слюны лишь спустя 3 и более часов.
Бывает, что после процедуры на зубах остаются небольшие темные пятна. В этом случае необходимо обратиться к специалисту, который выявит причину и устранит неприятный дефект.
Какие существуют противопоказания к процедуре?
Химическое отбеливание зубов нельзя проводить:
- Несовершеннолетним лицам
- Беременным и кормящим женщинам
- При аллергии на активный компонент геля
- Заболевания пародонта, слизистой оболочки и кариесом, имеющим зубные отложения
- Проходящим курс ортодонтического лечения
- Не соблюдающим гигиену полости рта
- Если установлены коронки, полимеры, скайсы, некачественные пломбы
- Восстановленные зубы с помощью керамики, штифтов, фотополимеров
- Присутствие на зубах эрозии, трещин, клиновидные дефектов, обнаженные корни, кариозные полости
- Сильно стерта эмаль по возрастным или патологическим причинам
Помимо медицинских противопоказаний можно выделить еще один нюанс – природный цвет зубов. Когда их оттенок желтый, отбеливание будет эффективным. А когда коричневый и тем более серый, к сожалению, химическая процедура практически не даст результатов.
Смотрите цены и отзывы на услугу отбеливание зубов в Челябинске.
Доверяйте свои зубы только профессионалам!
Открыты причины разной реакции мужчин и женщин на стресс
* By submitting the completed data in the registration form, I confirm that I am a healthcare worker of the Russian Federation and give specific, informed and conscious consent to the processing of personal data to the Personal Data Operator Pfizer Innovations LLC (hereinafter referred to as the “Operator”) registered at the address: St. Moscow, Presnenskaya embankment, house 10, 22nd floor.
I grant the Operator the right to carry out the following actions with my personal data, as well as information about my hobbies and interests (including by analyzing my profiles on social networks): collecting, recording, systematizing, accumulating, storing, updating (updating, changing) , extraction, use, transfer (access, provision), deletion and destruction, by automated and (or) partially automated (mixed) processing of personal data.
Consent is granted with the right to transfer personal data to affiliated persons of Pfizer Innovations LLC, including Pfizer LLC (Moscow, Presnenskaya naberezhnaya, 10, 22nd floor), and with the right to order the processing of personal data, incl. h. LLC «Redox» (Moscow, Volgogradskiy prospect, house 42, building 42A, floor 3, room 3) and LLC «Supernova» (Moscow, Varshavskoe shosse, house 132), which processes and stores personal data.
The processing of my personal data is carried out for the purpose of registering on the Operator’s website www.pfizerprofi.ru to provide me with access to information resources of the Pfizer company, as well as to interact with me by providing information through any communication channels, including mail, SMS, e-mail, telephone and other communication channels.
This consent is valid for 10 (ten) years.
I have been informed about the right to receive information regarding the processing of my personal data, in accordance with the Federal Law of July 27, 2006 No. 152-FZ «On Personal Data».
This consent can be revoked by me at any time by contacting the address of the Operator-Pfizer Innovations LLC or by phone. 8 495 287 5000.
*Отправляя заполненные данные в регистрационной форме, я подтверждаю, что являюсь работником здравоохранения Российской Федерации и даю конкретное, информированное и сознательное согласие на обработку персональных данных Оператору персональных данных ООО «Пфайзер Инновации» (далее «Оператор»), зарегистрированному по адресу: г. Москва, Пресненская набережная, дом 10, 22 этаж.
Москва, Пресненская набережная, дом 10, 22 этаж.
Я предоставляю Оператору право осуществлять с моими персональными данными, а также сведениями о моих хобби и увлечениях (в том числе с помощью анализа моих профилей в социальных сетях) следующие действия: сбор, запись, систематизация, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передача (доступ, предоставление), удаление и уничтожение, путем автоматизированной и (или) частично автоматизированной (смешанной) обработки персональных данных.
Согласие предоставляется с правом передачи персональных данных аффилированным лицам ООО «Пфайзер Инновации», в т. ч. ООО «Пфайзер» (г. Москва, Пресненская набережная, дом 10, 22 этаж), и с правом поручения обработки персональных данных, в т.ч. ООО «Редокс», (г. Москва, Волгоградский проспект, дом 42, корпус 42А, этаж 3, ком. 3) и ООО «Супернова» (г. Москва, Варшавское шоссе, дом 132), осуществляющим обработку и хранение персональных данных.
Обработка моих персональных данных осуществляется с целью регистрации на сайте Оператора www.pfizerprofi.ru для предоставления мне доступа к информационным ресурсам компании Пфайзер, а также для взаимодействия со мной путем предоставления информации через любые каналы коммуникации, включая почту, SMS, электронную почту, телефон и иные каналы коммуникации.
Срок действия данного согласия — 10 (десять)лет.
Я проинформирован (-а) о праве на получение информации, касающейся обработки моих персональных данных, в соответствии с Федеральным законом от 27.07.2006 г. №152-ФЗ «О персональных данных».
Данное согласие может быть отозвано мною в любой момент посредством обращения по адресу нахождения Оператора-ООО «Пфайзер Инновации» или по тел. 8 495 287 5000.
Российские химики раскрыли механизм важнейшей для промышленности реакции
Механизм важнейшей окислительной реакции Байера-Виллигера,
известной больше ста лет, раскрыт международной группой ученых. Реакция
является универсальным путем получения эфиров органических кислот —
базовых соединений для химической промышленности. Результаты
исследования позволят предложить новые промышленные процессы окисления и
классы антипаразитарных органических пероксидов для лечения малярии и
гельминтозов. Работа выполнена при поддержке гранта Российского научного
фонда (РНФ) и опубликована в журнале Angewandte Chemie International Edition.
Реакция
является универсальным путем получения эфиров органических кислот —
базовых соединений для химической промышленности. Результаты
исследования позволят предложить новые промышленные процессы окисления и
классы антипаразитарных органических пероксидов для лечения малярии и
гельминтозов. Работа выполнена при поддержке гранта Российского научного
фонда (РНФ) и опубликована в журнале Angewandte Chemie International Edition.
Реакция Байера-Виллигера была открыта в 1899 году немецкими химиками Адольфом фон Байером и Виктором Виллигером. Ее суть заключается в окислении необходимых в промышленности веществ — кетонов и альдегидов — до сложных эфиров (производных органических кислот с замещением водорода СООН-группы на углеводородную цепь) под действием пероксокислот. Последние представляют собой кислоты с группировкой из двух связанных атомов кислорода. Реакция нашла применение, например, при производстве капролактона — предшественника многих полимеров. Несмотря на это, механизм процесса до недавнего времени оставался загадкой и существовал лишь «на бумаге»: ученым никак не удавалось зафиксировать или выделить промежуточное соединение (интермедиат).
«В середине прошлого столетия Рудольф Криге предложил вариант возможного промежуточного соединения. В нашем исследовании мы сконструировали ловушку для интермедиатов Криге, что позволило получить их в стабильном виде и охарактеризовать», — рассказывает Александр Терентьев, доктор химических наук, член-корреспондент РАН, заведующий лабораторией в Институте органической химии имени Н.Д. Зелинского РАН.
На первом
этапе реакции пероксидный фрагмент пероксокислоты атакует молекулу
кетона или альдегида. Целью становится углерод карбонильной (=С=O)
группы, и в результате он оказывается заключен между двумя кислородами.
Один является «его собственным», а другой приходит от пероксокислоты и
пока остается с ним связанным. По бокам от карбонильного углерода
находятся заместители кетона или альдегида, представленные
углеводородными цепями. Так устроен реакционный центр интермедиата
Криге, который впоследствии окажется в самой гуще событий и именно в нем
произойдут ключевые перестройки, приводящие к образованию эфира.
Так устроен реакционный центр интермедиата
Криге, который впоследствии окажется в самой гуще событий и именно в нем
произойдут ключевые перестройки, приводящие к образованию эфира.
Неустойчивость промежуточных соединений реакции Байера-Виллигера могут объяснить эффекты совместного влияния электронов, атомов и их пространственного расположения на реакционный центр. Например, в обычном промежуточном соединении создаются благоприятные условия для перехода одного из заместителей кетона или альдегида к атому кислорода пероксидного фрагмента пероксокислоты. Таким образом, происходит перестройка молекулы в конечный продукт: исходное соединение оказывается окислено. Авторам работы удалось стабилизировать промежуточное соединение Криге, нарушив эти эффекты взаимодействий благодаря созданию его замкнутой, циклической версии. Результаты исследования дают ключ к пониманию механизма реакции Байера-Виллигера, что позволит более результативно проводить ее оптимизацию и конструировать соединения, ускоряющие реакцию.
«Наши данные помогут увеличить избирательность и расширить номенклатуру в производстве мономеров — молекул-«кирпичиков» для построения полимера, а также позволят предложить новые промышленные процессы окисления и классы антипаразитарных органических пероксидов. Важно отметить, что в 2015 году за использование природного циклического пероксида Артемизинина для лечения малярии была вручена Нобелевская премия по физиологии и медицине. Полученные на основе недорогих и доступных полупродуктов стабильные интермедиаты Криге представляют собой новый класс циклических органических пероксидов и в перспективе смогут применяться для лечения малярии и гельминтозов», — заключает Александр Терентьев.
Работа выполнена главным образом сотрудниками
Института органической химии имени Н.Д. Зелинского РАН совместно с
коллегами из Университета штата Флорида.
Определения окисления и восстановления
На этой странице обсуждаются различные определения окисления и восстановления (окислительно-восстановительного потенциала) с точки зрения переноса кислорода, водорода и электронов. Здесь также объясняются термины «окислитель» и «восстановитель».
Здесь также объясняются термины «окислитель» и «восстановитель».
Окисление и восстановление с точки зрения переноса кислорода
Термины окисление и восстановление могут быть определены как добавление или удаление кислорода из соединения. Хотя это не самое надежное определение, как обсуждается ниже, его легче всего запомнить.
Окисление и восстановление в отношении переноса кислорода
- Окисление — увеличение кислорода.
- Редукция — это потеря кислорода на .
Например, при добыче железа из руды:
Поскольку восстановление и окисление происходят одновременно, это называется окислительно-восстановительной реакцией.
Окислитель — это вещество, которое окисляет что-то еще. В приведенном выше примере оксид железа (III) является окислителем.Восстановитель уменьшает что-то еще. В уравнении монооксид углерода является восстановителем.
- Окислители передают кислорода другому веществу.
- Восстановители удаляют кислорода из другого вещества.
Окисление и восстановление с точки зрения переноса водорода
Это старые определения, которые больше не используются, за исключением иногда в органической химии.
Окисление и восстановление в связи с переносом водорода
- Окисление — потеря водорода .
- Уменьшение — это , прирост водорода.
Обратите внимание, что это полная противоположность определениям кислорода (# 1).
Например, этанол можно окислить до этаналя:
Для удаления водорода из этанола требуется окислитель. Обычно используемым окислителем является раствор дихромата калия (VI), подкисленный разбавленной серной кислотой. Этаналь также можно восстановить до этанола, добавив водород. Возможный восстановитель — тетрагидридоборат натрия, NaBH 4 . Опять же, уравнение слишком сложно рассматривать на данном этапе.
Опять же, уравнение слишком сложно рассматривать на данном этапе.
Более точные определения окислителей и восстановителей:
- Окислители добавляют кислорода к другому веществу или удаляют из него водорода.
- Восстановители удаляют кислорода из другого вещества или добавляют к нему водорода.
Окисление и восстановление с точки зрения переноса электрона
Окисление и восстановление в отношении переноса электрона
- Окисление потеря электронов
- Снижение Прирост электронов
Очень важно помнить эти определения, и это легко сделать с помощью удобного сокращения:
Пример 1
Уравнение ниже показывает очевидный пример переноса кислорода в простой окислительно-восстановительной реакции:
\ [CuO + Mg \ вправо Cu + MgO \]
Оксид меди (II) и оксид магния являются ионными соединениями.Если описанное выше записать как ионное уравнение, становится очевидным, что ионы оксида являются ионами-наблюдателями. Если их пропустить, получится:
В указанной выше реакции магний восстанавливает ион меди (II), передавая электроны иону и нейтрализуя его заряд. Следовательно, магний является восстановителем. Другими словами, ион меди (II) удаляет электроны из магния, образуя ион магния. Ион меди (II) действует как окислитель.
Сводка
Путаница может возникнуть в результате попыток изучить определения окисления и восстановления в терминах переноса электронов и определения окислителей и восстановителей в одних и тех же терминах.
Может оказаться полезным следующий образ мышления:
- Окислитель окисляет что-то еще.
- Окисление — потеря электронов (OIL RIG).
- Следовательно, окислитель забирает электроны у другого вещества.
- Следовательно, окислитель должен получать электроны.

Вот еще одно умственное упражнение:
- Окислитель окисляет что-то еще.
- Следовательно, окислитель необходимо восстанавливать.
- Уменьшение прироста электронов (OIL RIG).
- Следовательно, окислитель должен получать электроны.
Реакции окисления-восстановления
Реакции окисления-восстановления
Процесс открытия: окисление и Редукция
Первый шаг к теории химических реакций был сделан Георгом Эрнстом Шталем в 1697, когда он предложил теорию флогистона , которая была основана на следующих наблюдения.
- Металлы имеют много общих свойств.
- Металлы при нагревании часто образуют «накипь». (Термин calx определяется как рассыпчатый осадок, оставшийся после обжига минерала или металла.)
- Эти окалины не такие плотные, как металлы, из которых они изготовлены.
- Некоторые из этих окалинов образуют металлы при нагревании древесным углем.
- За редким исключением, калькс встречается в природе, а не в металле.
Эти наблюдения привели Шталь к следующим выводам.
- Флогистон (от греч. phlogistos , «сжигать»). всякий раз, когда что-то горит.
- Древесина и древесный уголь особенно богаты флогистоном, так как оставляют очень мало золы. когда они горят. (Свечи должны быть почти из чистого флогистона, потому что они не оставляют золы.)
- Так как кальк встречается в природе, он должен быть проще металлов.
- Металлы образуют окалину, выделяя флогистон.
Калкс + флогистон
- Металлы можно получить, добавляя флогистон к известняку.
Calx + флогистон металл
- Поскольку древесный уголь богат флогистоном, нагревание окалины в присутствии древесного угля
иногда производит металлы.

Эта модель оказалась на удивление успешной. Это объяснило, почему металлы имеют схожие свойства: все они содержат флогистон.Это объяснили взаимосвязь между металлами и их кальцием: они связаны с увеличением или уменьшением флогистона. Это даже объяснил, почему свеча гаснет, когда в колпаке воздух со временем насыщается флогистоном.
С теорией флогистона была только одна проблема. Еще в 1630 году Жан Рей отмечал это олово набирает вес, когда образует окалину. (Кальк примерно на 25% тяжелее, чем металл.) С нашей точки зрения, это фатальный недостаток: если флогистон выделяется Когда металл образует окалину, почему окалина весит больше, чем металл? Это наблюдение не беспокоил сторонников теории флогистона.Шталь объяснил это, предположив, что вес увеличился, потому что воздух проник в металл, чтобы заполнить вакуум, оставшийся после флогистон уцелел.
Теория флогистона была основой химических исследований на протяжении большей части 18-го века. век. Лишь в 1772 году Антуан Лавуазье заметил, что неметаллы становятся все более популярными. количество веса при сжигании на воздухе. (Вес фосфора, например, увеличивается на примерно в 2,3 раза). Величина этого изменения привела Лавуазье к выводу, что фосфор должен соединиться с чем-то на воздухе при горении.Этот вывод был подкрепленный наблюдением, что объем воздуха уменьшается в 1/5 раза, когда фосфор горит в ограниченном количестве воздуха.
Лавуазье предложил название кислород (буквально «кислотообразующий») для вещество, абсорбируемое из воздуха при горении соединения. Он выбрал это имя, потому что продукты сгорания неметаллов, таких как фосфор, являются кислотами, когда они растворяются в вода.
| P 4 ( с ) + 5 O 2 ( г ) P 4 O 10 ( с ) |
P 4 O 10 ( с ) + 6 H 2 O ( л ) 4 H 3 PO 4 ( водн. |
Кислородная теория горения Лавуазье была в конечном итоге принята, и химики начали описывают любую реакцию между элементом или соединением и кислородом как окисление .Например, реакция между металлическим магнием и кислородом включает окисление магний.
2 мг ( с ) + O 2 ( г ) 2 MgO ( с )
На рубеже 20-го века казалось, что все реакции окисления имеют одно в обычном окислении всегда казалось, связано с потерей электронов. Поэтому химики разработали модель этих реакции, которые сосредоточены на переносе электронов. Металлический магний, например, был Считается, что он теряет электроны с образованием ионов Mg 2+ при взаимодействии с кислородом.От По соглашению, элемент или соединение, которое приобрело эти электроны, подвергалось уменьшению . В этом случае говорят, что молекулы O 2 восстанавливаются с образованием ионов O 2-.
Классическая демонстрация окислительно-восстановительных реакций включает размещение кусочка медную проволоку в водный раствор иона Ag + . Реакция включает чистый перенос электронов от металлической меди к ионам Ag + с образованием вискеров металлическое серебро, которое вырастает из медной проволоки, и ионы Cu 2+ .
Cu ( с ) + 2 Ag + ( водн. ) Cu 2+ ( водн. ) + 2 Ag ( с )
Ионы Cu 2+ , образующиеся в этой реакции, ответственны за голубой цвет раствора. Их наличие можно подтвердить добавлением к этому раствору аммиака. с образованием темно-синего комплексного иона Cu (NH 3 ) 4 2+ .
Химики в конце концов пришли к выводу, что окислительно-восстановительные реакции не всегда включают
перенос электронов. Нет изменений в количестве валентных электронов ни на одном из
атомы, когда CO 2 реагирует с H 2 , например,
Нет изменений в количестве валентных электронов ни на одном из
атомы, когда CO 2 реагирует с H 2 , например,
CO 2 ( г ) + H 2 ( г ) CO ( г ) + H 2 O ( г )
, как показано следующими структурами Льюиса:
Химики разработали концепцию числа окисления , чтобы расширить идея окисления и восстановления до реакций, в которых электроны на самом деле не приобретаются или потеряли.Наиболее мощная модель окислительно-восстановительных реакций основана на следующие определения.
Окисление включает увеличение степени окисления атома.
Восстановление происходит, когда степень окисления атома уменьшается на .
Согласно этой модели, CO 2 восстанавливается, когда он реагирует с водородом, потому что степень окисления углерода снижается с +4 до +2. При этом водород окисляется. реакция, потому что его степень окисления увеличивается от 0 до +1.
Реакции окисления-восстановления
Мы находим примеры окислительно-восстановительных или окислительно-восстановительных реакций почти каждый раз мы анализируем реакции, используемые как источники тепла или работы. Когда естественно газовые ожоги, например, происходит окислительно-восстановительная реакция, в результате которой выделяется более 800 кДж / моль энергии.
CH 4 ( г ) + 2 O 2 ( г ) CO 2 ( г ) + 2 H 2 O ( г )
В нашем организме последовательность окислительно-восстановительных реакций используется для сжигания сахаров,
такие как глюкоза (C 6 H 12 O 6 ) и жирные кислоты в жирах
мы едим.
| C 6 H 12 O 6 ( водн. ) + 6 O 2 ( г ) 6 CO 2 ( г ) + 6 H 2 O ( л ) |
| CH 3 (CH 2 ) 16 CO 2 H ( водн. ) + 26 O 2 ( г ) 18 CO 2 ( г ) + 18 H 2 O ( л ) |
Нам не нужно ограничиваться реакциями, которые могут быть использованы как источник энергии, однако, чтобы найти примеры окислительно-восстановительных реакций.Серебряный металл, для например, окисляется при контакте со следовыми количествами H 2 S или SO 2 в атмосфере или в продуктах, богатых серой, таких как яйца соединения.
4 Ag ( г ) + 2 H 2 S ( г ) + O 2 ( г ) 2 Ag 2 S ( с ) + 2 H 2 O ( г )
К счастью, пленка Ag 2 S, которая собирается на поверхности металла, образует защитное покрытие, замедляющее дальнейшее окисление металлического серебра.
Потускнение серебра — всего лишь один пример широкого класса окислительно-восстановительных реакции, которые подпадают под общую рубрику , коррозия . Другой Примером может служить серия реакций, которые происходят, когда железо или сталь ржавеют. При нагревании утюг реагирует с кислородом с образованием смеси оксидов железа (II) и железа (III).
| 2 Fe ( с ) + O 2 ( г ) 2 FeO ( с ) |
| 2 Fe ( с ) + 3 O 2 ( г ) 2 Fe 2 O 3 ( с ) |
Расплавленное железо реагирует даже с водой с образованием водного раствора ионов Fe 2+ и газ H 2 .
Fe ( л ) + 2 H 2 O ( л ) Fe 2+ ( водн. ) + 2 OH — ( водн. ) + H 2 ( г )
Однако при комнатной температуре все три реакции настолько медленны, что могут игнорируется.
Железо коррозирует только при комнатной температуре в присутствии кислорода и воды. в В ходе этой реакции железо окисляется с образованием гидратированной формы оксида железа (II).
2 Fe ( с ) + O 2 ( водн. ) + 2 H 2 O ( л ) 2 FeO H 2 O ( с )
Поскольку это соединение имеет ту же эмпирическую формулу, что и Fe (OH) 2 , оно часто ошибочно называют гидроксидом железа (II) или двухвалентного железа. FeO H 2 O, образовавшийся в эта реакция дополнительно окисляется O 2 , растворенным в воде, с образованием гидратированного форма железа (III) или оксида трехвалентного железа.
4 FeO H 2 O ( с ) + O 2 ( водн. ) + 2 H 2 O ( л ) 2 Fe 2 O 3 3 H 2 O ( с )
Чтобы еще больше усложнить ситуацию, на поверхности металла образовался FeO H 2 O объединяется с Fe 2 O 3 3 H 2 O с образованием гидратированной формы магнитный оксид железа (Fe 3 O 4 ).
FeO H 2 O ( s ) + Fe 2 O 3 3 H 2 O ( s ) Fe 3 O 4 n H 2 O ( s )
Поскольку эти реакции происходят только в присутствии воды и кислорода, автомобили имеют тенденцию
ржаветь в местах скопления воды.Кроме того, поскольку самый простой способ предотвратить железо
от ржавчины покрывать металл таким образом, чтобы он не контактировал с водой, автомобили были
изначально красили только по одной причине, чтобы замедлить образование ржавчины.
Присвоение номеров окисления
Ключом к идентификации окислительно-восстановительных реакций является определение того, когда химическое реакция приводит к изменению степени окисления одного или нескольких атомов.Следовательно, это Хорошая идея еще раз взглянуть на правила определения степеней окисления. От По определению, степень окисления атома равна заряду, который должен присутствовать на атом, если соединение состоит из ионов. Если предположить, что CH 4 содержит ионы C 4- и H + , например, степени окисления атомы углерода и водорода были бы -4 и +1.
Обратите внимание, что не имеет значения, действительно ли соединение содержит ионы.Окисление число — это заряд, который имел бы атом, если бы соединение было ионным. Концепция чего-либо степень окисления — это не что иное, как система бухгалтерского учета, используемая для отслеживания электронов в химических реакциях. Эта система основана на ряде правил, кратко изложенных в таблице. ниже.
| Правила присвоения номеров окисления |
|
Любой набор правил, каким бы хорошим он ни был, поможет вам только до определенного момента. Тогда вам придется полагаться на сочетании здравого смысла и предшествующих знаний. Вопросы, которые нужно иметь в виду, пока Присвоение степеней окисления включает следующее: Есть ли какие-либо распознаваемые ионы, скрытые в молекуле? Имеет ли смысл степень окисления в с точки зрения известной электронной конфигурации атома?
Распознавание окисления-восстановления Реакция
Химические реакции часто делятся на две категории: окислительно-восстановительные и
реакции метатезиса. Реакции метатезиса включают кислотно-основные реакции
которые включают перенос иона H + от кислоты Бренстеда к кислоте Бренстеда.
база.
Реакции метатезиса включают кислотно-основные реакции
которые включают перенос иона H + от кислоты Бренстеда к кислоте Бренстеда.
база.
| CH 3 CO 2 H ( водн. ) | + | ОН — ( водн. ) | CH 3 CO 2 — ( водн. ) | + | H 2 O ( л ) | |
| Кислота Бренстеда | База Брнстеда | База Брнстеда | Кислота Бренстеда |
Они также могут включать разделение пары электронов донором электронной пары. (Основание Льюиса) и акцептор электронной пары (кислота Льюиса).
| Co 3+ ( водн. ) | + | 6 НЕТ 2 — ( водн. ) | Co (NO 2 ) 6 3- ( водн. ) | ||
| Кислота Льюиса | База Льюиса |
Реакции окисления-восстановления или окислительно-восстановительные реакции банка включают перенос одного или нескольких электронов.
Cu ( с ) + 2 Ag + ( водн. ) Cu 2+ ( водн. ) + 2 Ag ( с )
Они также могут возникать при переносе атомов кислорода, водорода или галогена.
| CO 2 ( г ) + H 2 ( г ) CO ( г ) + H 2 O ( г ) |
| SF 4 ( г ) + F 2 ( г ) SF 6 ( г ) |
К счастью, существует почти надежный метод различения метатезиса. и окислительно-восстановительные реакции.Реакции, в которых ни один из атомов не претерпевает изменений в окислении
количество метатезиса реакций. Нет изменений в окислении
количество любого атома, например, в любой из реакций метатезиса.
и окислительно-восстановительные реакции.Реакции, в которых ни один из атомов не претерпевает изменений в окислении
количество метатезиса реакций. Нет изменений в окислении
количество любого атома, например, в любой из реакций метатезиса.
Слово метатезис буквально означает «обмен» или «транспозиция», и он используется для описания изменений, которые происходят в порядке буквы или звуки в слове по мере развития языка. Метатезис происходил, например, когда древнеанглийское слово brid превратилось в bird .В химии используется метатезис для описания реакций обмена атомами или группами атомов между молекулами.
Когда хотя бы один атом претерпевает изменение в степени окисления, реакция является окислительно-восстановительная реакция. Таким образом, каждая из реакций на рисунке ниже является пример окислительно-восстановительной реакции.
окислительно-восстановительных реакций | Безграничная химия
Окислительные состояния
Состояние окисления — это гипотетический заряд атома, если все его связи с другими атомами были полностью ионными.
Цели обучения
Предскажите степени окисления обычных элементов по номеру их группы.
Основные выводы
Ключевые моменты
- Степень окисления чистого элемента всегда равна нулю.
- Степень окисления чистого иона эквивалентна его ионному заряду.
- Обычно водород имеет степень окисления +1, а кислород — степень окисления -2.
- Сумма степеней окисления всех атомов нейтральной молекулы должна равняться нулю.
Ключевые термины
- восстановление : увеличение количества электронов, которое вызывает снижение степени окисления
- окисление : потеря электронов, которая вызывает повышение степени окисления
Степень окисления указывает степень окисления атома в химическом соединении; это гипотетический заряд, который имел бы атом, если бы все связи с атомами различных элементов были полностью ионными. Состояния окисления обычно представлены целыми числами, которые могут быть положительными, отрицательными или нулевыми.В некоторых случаях средняя степень окисления элемента является дробной, например 8/3 для железа в магнетите (Fe 3 O 4 ).
Состояния окисления обычно представлены целыми числами, которые могут быть положительными, отрицательными или нулевыми.В некоторых случаях средняя степень окисления элемента является дробной, например 8/3 для железа в магнетите (Fe 3 O 4 ).
Наивысшая известная степень окисления +8 у тетроксидов рутения, ксенона, осмия, иридия, хассия и некоторых комплексов с участием плутония; самая низкая известная степень окисления -4 для некоторых элементов углеродной группы.
Степени окисления плутония : Здесь плутоний различается по цвету в зависимости от степени окисления.
Повышение степени окисления атома в результате химической реакции называется окислением, и оно включает потерю электронов; Уменьшение степени окисления атома называется восстановлением и связано с увеличением количества электронов.
Общие правила, касающиеся состояний окисления
- Степень окисления свободного элемента (несоединенного элемента) равна нулю.
- Для простого (одноатомного) иона степень окисления равна чистому заряду иона. Например, Cl — имеет степень окисления -1.
- Если водород присутствует в большинстве соединений, он имеет степень окисления +1, а кислород — степень окисления −2. Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов (таких как LiH) и степень окисления -1 в пероксидах (таких как H 2 O 2 ) или -1 / 2 в супероксидах (например, KO).
- Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю. В ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду иона.
Прогнозирование состояний окисления
Как правило, степень окисления наиболее распространенных элементов может быть определена по номеру их группы в периодической таблице. Это показано на следующей диаграмме:
Типичные степени окисления наиболее распространенных элементов по группе : Переходные металлы не включены, поскольку они имеют тенденцию проявлять различные степени окисления.
Из приведенной выше таблицы можно сделать вывод, что бор (элемент III группы) обычно имеет степень окисления +3, а азот (элемент V группы) — степень окисления -3.Имейте в виду, что степени окисления могут измениться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо установленных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Как указано в правиле номер четыре выше, сумма степеней окисления для всех атомов в молекуле или многоатомном ионе равна заряду молекулы или иона. Это помогает определить степень окисления любого элемента в данной молекуле или ионе, предполагая, что мы знаем общие степени окисления всех других элементов.Например, в сульфит-ионе (SO 3 2- ) общий заряд иона равен 2-, и предполагается, что каждый кислород находится в своей обычной степени окисления -2. Поскольку в сульфите три атома кислорода, кислород вносит [латекс] 3 \ times-2 = -6 [/ latex] в общий заряд. Следовательно, сера должна иметь степень окисления +4, чтобы общий заряд сульфита составлял 2-: [латекс] (+ 4-6 = -2). [/ Latex]
Не путайте формальный заряд атома с его формальной степенью окисления, поскольку они могут быть разными (а часто и разными в многоатомных ионах).Например, заряд атома азота в ионе аммония NH 4 + равен 1+, но формальная степень окисления -3 — такая же, как у азота в аммиаке. В случае между аммиаком и аммиаком формальный заряд атома N изменяется, а его степень окисления — нет.
Типы окислительно-восстановительных реакций
Пять основных типов окислительно-восстановительных реакций — это комбинация, разложение, вытеснение, горение и диспропорционирование.
Цели обучения
Объясните процессы, участвующие в окислительно-восстановительной реакции, и опишите, что происходит с их различными компонентами.
Основные выводы
Ключевые моменты
- В комбинированных реакциях объединяются два элемента.
 [латекс] A + B \ rightarrow AB [/ латекс].
[латекс] A + B \ rightarrow AB [/ латекс]. - В реакциях разложения соединение распадается на составные части. [латекс] AB \ rightarrow A + B [/ латекс].
- В реакциях замещения один или несколько атомов заменяются другим. [латекс] AB + C \ rightarrow A + CB [/ латекс].
- В реакциях горения соединение реагирует с кислородом с образованием диоксида углерода, воды и тепла.
- В реакциях диспропорционирования молекула восстанавливается и окисляется; эти типы реакций редки.
Ключевые термины
- окислительно-восстановительный потенциал : сокращенное название «восстановление-окисление», два метода переноса электрона, которые всегда происходят вместе
- горение : процесс, в котором топливо соединяется с кислородом, обычно при высокой температуре, с выделением CO2, h3O и тепла
Редокс-реакции происходят повсюду.Фактически, большая часть наших технологий, от огня до аккумуляторов для ноутбуков, в значительной степени основана на окислительно-восстановительных реакциях. Окислительно-восстановительные реакции (восстановление — окисление) — это реакции, при которых изменяется степень окисления реагентов. Это происходит потому, что в таких реакциях электроны всегда передаются между частицами. Окислительно-восстановительные реакции протекают либо посредством простого процесса, такого как сжигание углерода в кислороде с образованием диоксида углерода (CO 2 ), либо посредством более сложного процесса, такого как окисление глюкозы (C 6 H 12 O 6 ) в человеческом теле через серию процессов переноса электронов.
Термин «окислительно-восстановительный потенциал» происходит от двух концепций, связанных с переносом электронов: восстановления и окисления. Эти процессы определены следующим образом:
- Окисление — это потеря электронов или увеличение степени окисления молекулой, атомом или ионом.

- Уменьшение — это увеличение количества электронов или уменьшение степени окисления молекулой, атомом или ионом.
Простая мнемоника для запоминания этих процессов — «НЕФТЯНАЯ ШКАФА» — окисление теряется (электроны), восстановление увеличивается (электроны).
Окислительно-восстановительные реакции — это согласованные наборы: если в ходе реакции окисляется один вид, другой должен быть восстановлен. Помните об этом, когда мы рассмотрим пять основных типов окислительно-восстановительных реакций: комбинация, разложение, смещение, горение и диспропорция.
Комбинация
Комбинированные реакции «объединяют» элементы в химическое соединение. Обычно окисление и восстановление происходят вместе.
Общее уравнение: [латекс] A + B \ rightarrow AB [/ латекс]
Образец 1.уравнение: 2 H 2 + O 2 → 2 H 2 O
Сумма степеней окисления реагентов равна сумме степеней окисления продуктов: 0 + 0 → (2) (+ 1) + (-2)
В этом уравнении и H 2 , и O 2 являются молекулярными формами своих соответствующих элементов и, следовательно, их степени окисления равны 0. Продукт представляет собой H 2 O: степень окисления составляет -2 для кислорода и + 1 для водорода.
Разложение
Реакции разложения противоположны реакциям комбинации, то есть они представляют собой разложение химического соединения на составляющие его элементы.
Общее уравнение: AB → A + B
Пример 2. Уравнение: 2 H 2 O → 2 H 2 + O 2
Расчет: (2) (+ 1) + (-2) = 0 → 0 + 0
В этом уравнении вода «разлагается» на водород и кислород, оба из которых нейтральны. Подобно предыдущему примеру, H 2 O имеет общую степень окисления 0, при этом каждый H принимает состояние +1, а O a -2; таким образом, разложение окисляет кислород от -2 до 0 и восстанавливает водород от +1 до 0.
Рабочий объем
Реакции замещения, также известные как реакции замещения, включают соединения и «замену» элементов. Они протекают как реакции одинарного и двойного замещения.
Они протекают как реакции одинарного и двойного замещения.
Общее уравнение (одинарное перемещение): A + BC → AB + CA
Однократная реакция замещения «заменяет» элемент в реагентах на другой элемент в продуктах.
Образец 3. Уравнение: Cl 2 + 2 NaBr → 2 NaCl + Br 2
Расчет: 0 + [(+1) + (-1) = 0] [латекс] \ rightarrow [/ latex] [(+1) + (-1) = 0] + 0
В этом уравнении Cl восстанавливается и замещает Br, в то время как Br окисляется.
Общее уравнение (двойное смещение): AB + CD → AD + CB
Реакция двойного замещения аналогична реакции одиночного замещения, но включает «замену» двух элементов в реагентах двумя элементами в продуктах.
Образец 4. Уравнение: Fe 2 O 3 + 6 HCl → 2 FeCl 3 + 3 H 2 O
В этом уравнении местами заменяются Fe и H, а также O и Cl.
Сгорание
В реакциях горения всегда участвует кислород и органическое топливо.На следующем изображении мы видим, как метан сжигается с выделением энергии.
Реакция горения метана : Это пример реакции горения, окислительно-восстановительного процесса. Метан ([латекс] \ text {CH} _4 [/ latex]) реагирует с кислородом ([латекс] \ text {O} _2 [/ latex]) с образованием диоксида углерода ([латекс] \ text {CO} _2 [ / latex]) и две молекулы воды ([латекс] 2 \ text {H} _2 \ text {O} [/ latex]).
Общее уравнение реакции горения:
[латекс] \ text {C} _x \ text {H} _y + \ left (x + \ dfrac {y} {4} \ right) \ text {O} _2 \ rightarrow x \ text {CO} _2 + \ dfrac {y} {2} \ text {H} _2 \ text {O} [/ latex]
Диспропорционирование
В некоторых окислительно-восстановительных реакциях вещества могут как окисляться, так и восстанавливаться.Они известны как реакции диспропорционирования. Одним из реальных примеров такого процесса является реакция перекиси водорода, H 2 O 2 , когда она заливается на рану. Сначала это может показаться простой реакцией разложения, потому что перекись водорода распадается с образованием кислорода и воды:
Сначала это может показаться простой реакцией разложения, потому что перекись водорода распадается с образованием кислорода и воды:
2 H 2 O 2 (водн.) → 2 H 2 O (л) + O 2 (г)
Однако ключ к этой реакции лежит в степени окисления кислорода.Обратите внимание, что кислород присутствует в реагенте, и оба продукта . В H 2 O 2 кислород имеет степень окисления -1. В H 2 O его степень окисления -2, и он был восстановлен. Однако в O 2 его степень окисления равна 0, и он был окислен. Кислород в реакции окисляется и восстанавливается, что делает ее реакцией диспропорционирования. Общая форма этой реакции следующая:
2A → A ’+ A”
Балансировка уравнений окислительно-восстановительного потенциала
Уравновешивание окислительно-восстановительных реакций включает разделение реакции на две половинные реакции.
Цели обучения
Сформулируйте сбалансированную окислительно-восстановительную реакцию на основе двух полуреакций.
Основные выводы
Ключевые моменты
- Восстановители окисляются и, следовательно, теряют электроны.
- Окислители восстанавливаются и, следовательно, приобретают электроны.
- Запомните мнемоническое устройство OIL RIG — «Окисление влечет за собой потери» и «Уменьшение предполагает выигрыш», чтобы различать окислители и восстановители.
Ключевые термины
- окисление : реакция, в которой атомы элемента теряют электроны и степень его окисления увеличивается
- восстановление : реакция, в которой приобретаются электроны и снижается степень окисления, часто за счет удаления кислорода или добавления водорода
- полуреакции : одна из двух составных частей любой окислительно-восстановительной реакции, в которой проявляется только окисление или восстановление
Каждая сбалансированная окислительно-восстановительная реакция состоит из двух полуреакций: полуреакции окисления и полуреакции восстановления. — (aq) [/ latex]
— (aq) [/ latex]
Во-первых, нам нужно разделить эту реакцию на две половинные реакции.- (водн.) [/ латекс]
Обратите внимание, что окончательное уравнение сбалансировано по массе, а также по заряду (каждая сторона уравнения имеет чистый заряд +3).
Хотя этот пример кажется пугающим, балансировка окислительно-восстановительных реакций в кислотном растворе становится намного проще при осторожной практике.
Пример: балансировка окислительно-восстановительных реакций в основном растворе
Если в щелочном растворе происходит окислительно-восстановительная реакция, мы действуем так же, как и выше, с одним незначительным отличием: после того, как мы добавили H + ( водн. ), чтобы уравновесить атомы водорода, мы просто добавляем одинаковое количество гидроксидов с обеих сторон. уравнения.- (aq) + \ text {H} _2 \ text {O} (l) [/ latex]
Эта полуреакция теперь уравновешена по массе в основном растворе. Отсюда мы действуем так же, как и выше в кислотном растворе: уравновешиваем заряд, добавляя соответствующее количество электронов.
Балансировка уравнений окислительно-восстановительного потенциала, безусловно, может быть сложной и трудоемкой, поэтому разумно применять их на практике.
Баланс окислительно-восстановительной реакции (КИСЛОТНЫЙ раствор) : отличное пошаговое руководство о том, как сбалансировать окислительно-восстановительную реакцию в кислотном растворе.
Баланс окислительно-восстановительной реакции (ОСНОВНОЙ раствор) : отличное пошаговое руководство о том, как сбалансировать окислительно-восстановительную реакцию в основном растворе.
Окислительно-восстановительное титрование
Редокс-титрование определяет концентрацию аналита, содержащего окислитель или восстановитель.
Цели обучения
Рассчитайте концентрацию неизвестного аналита путем окислительно-восстановительного титрования.
Основные выводы
Ключевые моменты
- Титрант — стандартизированный раствор; аналит — это анализируемое вещество.
- При окислительно-восстановительном титровании определяется концентрация неизвестного раствора (аналита), содержащего окислитель или восстановитель.
- Не для всех титров требуется внешний индикатор. Некоторые титранты могут служить собственными индикаторами, например, при титровании перманганата калия против бесцветного аналита.
Ключевые термины
- титрование : метод, в котором известные количества титранта добавляются к аналиту до тех пор, пока реакция не достигнет конечной точки
- аналит : любое вещество, подлежащее анализу
- титрант : стандартизованный раствор, используемый при титровании; раствор известной концентрации
Определение концентрации аналита
Как и в случае кислотно-основного титрования, окислительно-восстановительное титрование (также называемое окислительно-восстановительным титрованием) может точно определить концентрацию неизвестного аналита, измерив ее по стандартизованному титранту.{2 +} (водн.) +4 \ text {H} _2 \ text {O} (l) [/ latex]
В этом случае использование KMnO 4 в качестве титранта особенно полезно, поскольку он может действовать как собственный индикатор; это связано с тем, что раствор KMnO 4 имеет ярко-фиолетовый цвет, а раствор Fe 2+ бесцветен. Таким образом, можно увидеть, когда титрование достигнет своей конечной точки, поскольку раствор останется слегка пурпурным по сравнению с непрореагировавшим KMnO 4 .
Конечная точка титрования перманганатом : окислительно-восстановительное титрование с использованием перманганата калия в качестве титранта.Из-за своего ярко-фиолетового цвета KMnO4 служит отдельным индикатором. Обратите внимание, как достигается конечная точка, когда раствор остается слегка фиолетовым.
Пример: пример расчета на основе экспериментальных данных
Стандартизованный 4 М раствор KMnO4 титруют 100 мл образца неизвестного аналита, содержащего Fe 2+ . Студент проводит окислительно-восстановительное титрование и достигает конечной точки после добавления 25 мл титранта. Какая концентрация аналита?
Из приведенного выше сбалансированного уравнения мы знаем, что перманганат и железо реагируют в мольном соотношении 1: 5.{2 +} [/ латекс]
Теперь, когда мы знаем количество молей железа, присутствующего в образце, мы можем рассчитать концентрацию аналита:
[латекс] \ text {M} = \ frac {\ text {mol}} {\ text {L}} = \ frac {0.5 \ text {mol}} {0.100 \ text {L}} = 5 \ text { M} [/ латекс]
Другие типы окислительно-восстановительного титрования
Существуют различные другие типы окислительно-восстановительного титрования, которые могут быть очень полезными. Например, вина можно анализировать на диоксид серы, используя стандартизированный раствор йода в качестве титранта.В этом случае крахмал используется как индикатор; синий крахмал-йодный комплекс образуется в присутствии избытка йода, сигнализируя о конечной точке.
Другим примером является восстановление йода (I 2 ) до йодида (I — ) тиосульфатом (S 2 O 3 2-), снова с использованием крахмала в качестве индикатора. По сути, это обратное титрование того, что было только что описано; здесь, когда весь йод был уменьшен, синий цвет исчезает. Это называется йодометрическим титрованием.
Чаще всего восстановление йода до йодида является последней стадией в серии реакций, в которых начальные реакции используются для преобразования неизвестного количества аналита в эквивалентное количество йода, которое затем можно титровать. Иногда в промежуточных реакциях используются галогены (или органические соединения, содержащие галогены), отличные от йода, поскольку они доступны в виде стандартных растворов, которые лучше поддаются измерению, или они легче реагируют с аналитом. Хотя эти дополнительные этапы значительно усложняют иодометрическое титрование, они часто бывают полезными, потому что точка эквивалентности, включающая ярко-синий комплекс йод-крахмал, более точна, чем другие аналитические методы.
Определения окисления и восстановления (редокс)
Это, пожалуй, наиболее важное использование терминов окисление и восстановление на уровне A ‘.
Определения
Очень важно помнить эти определения. Есть очень простой способ сделать это. Если вы помните, что говорите о переносе электрона:
Простой пример
Уравнение показывает простую окислительно-восстановительную реакцию, которую, очевидно, можно описать в терминах переноса кислорода.
Оксид меди (II) и оксид магния являются ионными. Металлы явно нет. Если вы перепишете это как ионное уравнение, окажется, что ионы оксида являются ионами-наблюдателями, и у вас останется:
Последний комментарий по окислителям и восстановителям
Если вы посмотрите на уравнение выше, магний восстанавливает ионы меди (II), отдавая им электроны для нейтрализации заряда. Магний — восстановитель.
С другой стороны, ионы меди (II) удаляют электроны из магния, создавая ионы магния. Ионы меди (II) действуют как окислитель.
Внимание!
Это потенциально очень сбивает с толку, если вы попытаетесь узнать, что означают окисление и восстановление с точки зрения переноса электронов, а также выучить определения окислителей и восстановителей в одних и тех же терминах.
Лично я бы порекомендовал вам поработать, если вам это нужно.Аргумент (идущий в вашей голове) был бы таким, если бы вы хотели знать, например, что окислитель делает с точки зрения электронов:
Окислитель окисляет что-то еще.
Окисление — потеря электронов (OIL RIG).
Это означает, что окислитель забирает электроны у другого вещества.
Итак, окислитель должен получать электроны.
Или это можно было бы придумать так:
Окислитель окисляет что-то еще.
Это означает, что нужно восстанавливать окислитель.
Уменьшение прироста электронов (OIL RIG).
Итак, окислитель должен получать электроны.
Понимание намного безопаснее бездумного обучения!
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Что такое окисление? Определение и пример
Два основных типа химических реакций — это окисление и восстановление. Окисление не обязательно связано с кислородом. Вот что это означает и как это связано с сокращением.
Ключевые выводы: окисление в химии
- Окисление происходит, когда атом, молекула или ион теряют один или несколько электронов в химической реакции.
- Когда происходит окисление, степень окисления химического вещества увеличивается.
- Окисление не обязательно связано с кислородом! Первоначально этот термин использовался, когда кислород вызывал потерю электронов в реакции. Современное определение более общее.
Определение окисления
Окисление — это потеря электронов во время реакции молекулой, атомом или ионом.
Окисление происходит, когда степень окисления молекулы, атома или иона увеличивается. Противоположный процесс называется восстановлением, которое происходит, когда происходит увеличение количества электронов или уменьшается степень окисления атома, молекулы или иона.
Примером реакции является реакция между водородом и газообразным фтором с образованием плавиковой кислоты:
H 2 + F 2 → 2 HF
В этой реакции окисляется водород и восстанавливается фтор.Реакцию можно будет лучше понять, если записать ее в терминах двух полуреакций.
H 2 → 2 H + + 2 e —
F 2 + 2 e — → 2 F —
Обратите внимание, в этой реакции нет кислорода!
Историческое определение окисления, связанного с кислородом
Старое значение окисления означало, что к соединению добавляли кислород. Это произошло потому, что газообразный кислород (O 2 ) был первым известным окислителем.В то время как добавление кислорода к соединению обычно соответствует критериям потери электронов и увеличения степени окисления, определение окисления было расширено, чтобы включить другие типы химических реакций.
Классический пример старого определения окисления — это когда железо соединяется с кислородом с образованием оксида железа или ржавчины. Утверждают, что железо окислилось до ржавчины. Химическая реакция:
2 Fe + O 2 → Fe 2 O 3
Металлическое железо окисляется с образованием оксида железа, известного как ржавчина.
Электрохимические реакции — прекрасные примеры реакций окисления. Когда медную проволоку помещают в раствор, содержащий ионы серебра, электроны переходят от металлической меди к ионам серебра. Металлическая медь окисляется. Серебряные металлические усы растут на медной проволоке, а ионы меди выделяются в раствор.
Cu ( с ) + 2 Ag + ( водн. ) → Cu 2+ ( водн. ) + 2 Ag ( с )
Другой пример окисления, когда элемент соединяется с кислородом, — это реакция между металлическим магнием и кислородом с образованием оксида магния.Многие металлы окисляются, поэтому полезно распознать форму уравнения:
2 Mg (тв) + O 2 (г) → 2 MgO (тв)
Окисление и восстановление происходят вместе (окислительно-восстановительные реакции)
Как только электрон был открыт и химические реакции можно было объяснить, ученые поняли, что окисление и восстановление происходят вместе: один вид теряет электроны (окисляется), а другой получает электроны (восстанавливается). Тип химической реакции, в которой происходит окисление и восстановление, называется окислительно-восстановительной реакцией, что означает восстановление-окисление.
Окисление металла газообразным кислородом можно объяснить тем, что атом металла теряет электроны с образованием катиона (окисляется), а молекула кислорода приобретает электроны с образованием анионов кислорода. В случае магния, например, реакцию можно переписать так:
2 Mg + O 2 → 2 [Mg 2+ ] [O 2- ]
состоит из следующих полуреакций:
Mg → Mg 2+ + 2 e —
O 2 + 4 e — → 2 O 2-
Историческое определение окисления с участием водорода
Окисление, в котором участвует кислород, все еще является окислением согласно современному определению этого термина.Однако есть еще одно старое определение, связанное с водородом, которое можно встретить в текстах по органической химии. Это определение противоположно определению кислорода, поэтому может вызвать путаницу. Тем не менее, хорошо знать. Согласно этому определению окисление — это потеря водорода, а восстановление — это получение водорода.
Например, согласно этому определению, когда этанол окисляется до этаналя:
CH 3 CH 2 OH → CH 3 CHO
Этанол считается окисленным, потому что он теряет водород.Обращаясь к уравнению, этаналь можно восстановить, добавив к нему водород с образованием этанола.
Использование OIL RIG для запоминания окисления и восстановления
Итак, помните, что современное определение окисления и восстановления касается электронов (а не кислорода или водорода). Один из способов запомнить, какие виды окисляются, а какие восстанавливаются, — это использовать OIL RIG. OIL RIG расшифровывается как Oxidation Is Loss, Reduction Is Gain.
Источники
- Хаустейн, Кэтрин Хинга (2014).К. Ли Лернер и Бренда Уилмот Лернер (ред.). Реакция окисления – восстановления. Энциклопедия науки Гейла (5-е изд.). Фармингтон-Хиллз, Мичиган: Gale Group.
- Гудлицкий, Милош (1990). Окисления в органической химии . Вашингтон, округ Колумбия: Американское химическое общество. п. 456. ISBN 978-0-8412-1780-5.
Реакции восстановления и окисления — Викиверситет
Восстановление — это потеря атома кислорода из молекулы или получение одного или нескольких электронов.Реакция восстановления рассматривается с точки зрения восстанавливаемой молекулы, поскольку, когда одна молекула восстанавливается, другая окисляется. Полная реакция известна как окислительно-восстановительная реакция . Это хороший способ запомнить это.
Это можно вспомнить с помощью термина OIL RIG, говоря об электронах.
- Окисление — потеря электронов
- Уменьшение — это увеличение количества электронов
В случае органической химии это обычно происходит при получении / потере кислорода / водорода.
В неорганической химии термин относится к изменению степени окисления металлического центра.
- Окисление — это процесс, при котором вещество:
- теряет один или несколько электронов
- Получает атом кислорода или электроотрицательные атомы
- Теряет атом водорода или электроположительные атомы
- Увеличивает степень окисления
- Восстановление — это процесс, в котором вещество:
- получает один или несколько электронов
- Теряет атом кислорода или электроотрицательные атомы
- Получает атом водорода или электроположительные атомы
- Теряет увеличение степени окисления
Электрохимия играет важную роль в нашей повседневной жизни.Он отвечает за ржавление железа, он позволяет нам очищать многие металлы или покрывать обычные металлы серебром или золотом, он объясняет, как батареи питают iPod (а также как мы можем заряжать батареи), и используется в бесчисленном множестве других технологий.
Чтобы понять электрохимию, мы должны сначала изучить реакции восстановления / окисления (также известные как реакции РЕДОКС).
Некоторые элементы имеют большее сродство к электронам, чем другие. Когда материал входит в контакт с материалом с более низким сродством к электрону, он удаляет электроны из другого материала.Процесс, при котором вещество теряет электрон в химической реакции, называется окислением. Потерянный электрон не может существовать сам по себе и должен быть получен вторым веществом. Говорят, что вещество, которое приобретает электрон, восстанавливается (простой трюк, помогающий запомнить, что это акроним «LEO (потеря электронов — окисление) пошел GER (получение электронов — восстановлено)» или альтернативный способ вспомнить окисление и восстановление в Суть заключается в том, чтобы запомнить «OILRIG» — (OIL = окисление — потеря электронов и RIG = уменьшение — это усиление электронов).
Редокс и электрохимия
- Окисление представляет собой сочетание элементов с кислородом. Это также реакция потери электронов и получения положительного заряда. Говорят, что атомы, потерявшие электроны, окисляются. Атомы могут окисляться неметаллами.
- Уменьшение — это усиление электронов и, следовательно, получение отрицательного заряда. Говорят, что атом, который приобрел электроны, восстановился.
Когда электроны теряются одним атомом, они должны быть получены другим элементом.Следовательно, окисление и восстановление не могут происходить в одиночку. Если одно происходит, должно произойти и другое. Реакции, включающие окисление и восстановление, называются окислительно-восстановительными реакциями.
- Степень окисления (шаг) элемента — удобный способ отслеживать перенос электронов. Он определяет количество электронов, которые теряются или приобретаются элементом.
- Металлы группы 1 (1A) всегда имеют степень окисления +1.
- Металлы группы 2 (2A) всегда имеют степень окисления +2.
- Фтор всегда имеет степень окисления -1.
- Остальные галогены (Cl, Br, I) обычно имеют степень окисления -1, за исключением их соединений с фтором и кислородом, где они будут положительными.
- Кислород обычно имеет степень окисления -2, если не в паре с фтором (где она будет положительной).
- Водород имеет степень окисления +1 во всех своих соединениях, кроме гидридов активных металлов. Его степень окисления в гидридах металлов составляет -1.
2-Когда растительное масло восстанавливается, мы получаем гидрогенизированное масло.
Изменения степени окисления [править | править источник]
Окислительно-восстановительные реакции можно распознать по изменению степени окисления некоторых атомов. Если степень окисления элемента увеличивается, то элемент окисляется. Если он уменьшается, значит, элемент уменьшается.
- Степень окисления находится в диапазоне от -7 до +7. Он показывает количество электронов, потерянных относительно нейтрального атома.
- Восстановитель — это элемент или соединение, которое может терять электрон (подвергаться окислению).
- Окислитель — это элемент или соединение, которое может приобретать электрон (восстанавливаться).
Каждая окислительно-восстановительная реакция состоит из двух частей: окисления и восстановления. Каждую из них в отдельности называют полуреакцией .
- Во время окислительно-восстановительной реакции происходит перенос электронов от окисляемого вещества к восстанавливаемому.В гальваническом элементе эти реакции происходят в отдельных сосудах.
- Сосуды соединены солевым мостиком , который позволяет ионам переходить из одного раствора в другой. Соляной мостик НЕ переносит электроны. Электроны передаются по проводу, соединяющему два сосуда. Этот поток представляет собой электрический ток. Поток заряда продолжается из-за миграции ионов через солевой мостик. Полная система называется электрохимической ячейкой , или просто химической ячейкой. Каждый сосуд , в котором происходит половинная реакция, называется полуячейкой .
- Поток электронов через провод вызван разностью электрических потенциалов между электродами. Этот потенциал, измеряемый в вольтах, пропорционален изменению свободной энергии. Поток тока переносит электрическую энергию, которая используется для работы. Гальванический элемент или гальванический — это устройство, которое напрямую преобразует химическую энергию в электрическую.Ячейки, которые преобразуют электрическую энергию в химическую энергию, называются электролитическими ячейками . С помощью ecs мы можем предсказать, какой окислитель может окислять другой восстановитель. Отличный подход
Невозможно измерить потенциал полуреакции отдельно. Вместо этого необходимо измерить разность потенциалов между двумя половинными реакциями, когда они спарены в химической ячейке. Напряжение, возникающее между любой данной половиной реакции, называется стандартным электродным потенциалом (E 0) полуреакции.измерение (E 0), выполненное под давлением 1 атм с 1 молярными (M) растворами при 25 ° C.
Окислительный и редокс-потенциалы [править | править источник]
Для полуреакции с заданным окислительным потенциалом ее восстановительный потенциал будет противоположным по знаку. Общий потенциал окислительно-восстановительной реакции представляет собой сумму потенциалов полуреакции восстановления и окисления.
- Потенциал химической ячейки — это сумма потенциалов половинных реакций.
- При сложении потенциалов полуэлементов убедитесь, что происходит восстановление и окисление.
- Положительный электрод называется катодом , а отрицательный электрод называется анодом .



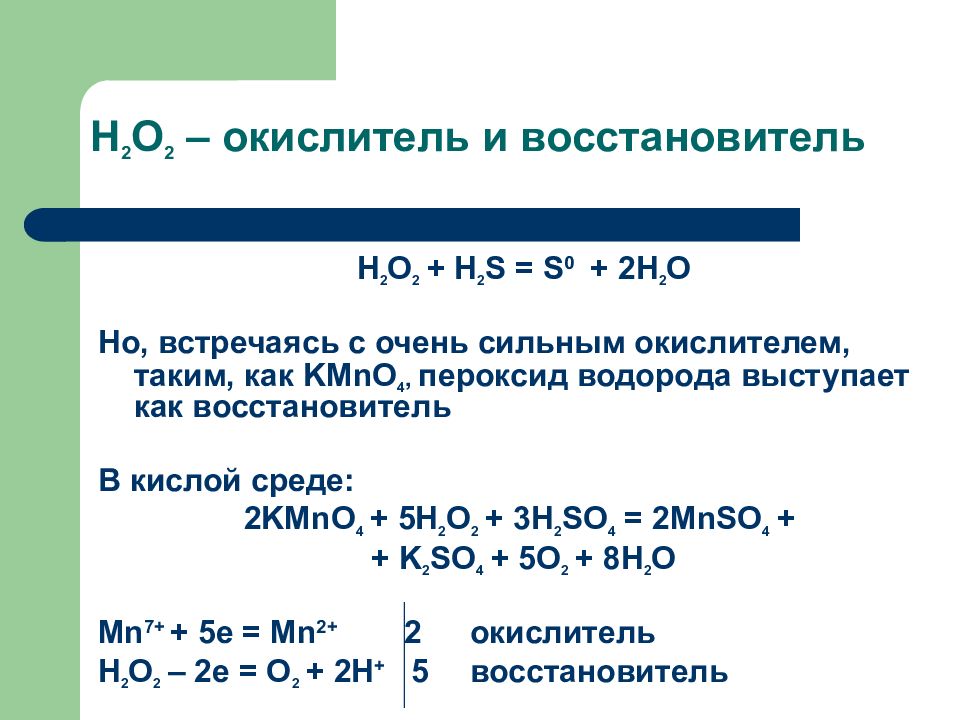 [латекс] A + B \ rightarrow AB [/ латекс].
[латекс] A + B \ rightarrow AB [/ латекс].