12 — Окислительно-восстановительные свойства нитритов
%PDF-1.5 % 1 0 obj >/OCGs[12 0 R 13 0 R 14 0 R 15 0 R]>>/Pages 3 0 R/Type/Catalog>> endobj 2 0 obj >stream application/pdf
childrenscience.ru
Опыт №5. Окислительно-восстановительные свойства нитрита натрия.
Для того чтобы, убедиться в окислительно-восстановительной двойственности нитрита натрия, нужно в одну пробирку поместить 3-4 капли раствора перманганата калия(KMnO4), затем подкислить несколькими каплями разбавленной серной кислоты и добавить нитрит натрия. В другую пробирку налить 3-4 капли йодида калия, опять подкислить раствор разбавленной серной кислотой и добавить несколько капель нитрита натрия до изменения окраски. Как объяснить наблюдаемы явления в обеих пробирках?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Напишите уравнения данных ОВР, используя метод электронно-ионных полуреакций:
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Сделайте выводы, в каком случае NO2— проявляет восстановительные, а в каком — окислительные свойства, и почему?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ОПЫТ №6. Окислительно-восстановительные свойства дихромата калия.
Для того чтобы, убедиться в окислительных свойствах дихромата калия (K2Cr2O7), нужно в одну пробирку поместить 3-4 капли раствора дихромата калия, затем подкислить несколькими каплями разбавленной серной кислоты и добавить нитрит натрия. В другую пробирку налить 3-4 капли дихромата калия, опять подкислить раствор разбавленной серной кислотой и добавить несколько капель йодида калия до появления устойчивой окраски. Как объяснить наблюдаемы явления в обеих пробирках?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Напишите уравнения данных ОВР, используя метод электронно-ионных полуреакций:
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Сделайте выводы, о возможности протекания данных реакций, рассчитав , ЭДС и энергию Гиббса каждой реакции.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вариант предлабораторного теста.
Определите степень окисления хлора в КСlО 1) +3 2) +5 3) +7 4) +1
Укажите процессы восстановления
l)S4+ = S6++2e—2) Вг7++ 2е— = Вг— 3)Ag = Ag++e—
III. Какие свойства в реакциях окисления-восстановления может проявлять S
1) окислитель 2) восстановитель 3) и окислитель и восстановитель
IV. Какая окислительно-восстановительная пара содержит наиболее сильный восстановитель
1) Н3РО3+ЗН+/Р+ЗН2О, Е°= -0,5В 2)Na+/Na, Е° =-2,71В 3) Zn2+/Zn, E°= -0,76В
V. Укажите реакции окисления-восстановления
l) AgNO3 + KOHAg2O+H2O+KNO3 2) Zn(OH)2+HCl ZnCl2+H2O
2) MnS+HNO3 S+NO+Mn(NO3)2+H2O 4) Fe(NO3)3+AI Fe + A1(NO3)3
VI. Определите тип процесса и сколько электронов (n) в нем участвует Вг7+ Вг —
1) n=6, окисление 2) n=6, восстановление 3) n=8, окисление 4) n=8, восстановление
VII. Определите X в процессе S4+ = Sx + 2e—
1) +4 2)+2 3)+6 4)-2
Определите nе— в процессе РbО2+4Н++nе—=Рb2++2Н2О 1) 4 2)3 3)2 4) 1
Определите nН+ в процессе Mn2++2H2O=MnO2+nH++2e— 1) 3 2)2 3) 1 4)4
Определите nОН— в процессе Si + nОН— = SiO32-+3H2O+4e—1) 6 2)3 3)4 4)2
Правильные ответы выделены жирным шрифтом.
Контрольные вопросы.
I. Определите, какую роль окислителя или/и восстановителя — могут играть в реакциях окисления-восстановления следующие частицы:
1)РО43-, РО33- 2)Сl—, СlO2— 3)NO, NO3— 4) S2-, SO2 5) Sn, SnO2
П. Составьте электронно-ионные уравнения взаимного превращения частиц (см. п. I) в кислой,
нейтральной и щелочной средах.
III. Методом электронно-ионных уравнений составьте уравнение реакции:
1) NO2+H2OHNO3+NO 2) Вr2+Н2ОНВr+НВrO3 3) MnO2+KOHKMnO4+Mn(OH)2
4) HClO3HCl+HClO4 5) Р+Н2ОН3РО3 + РН3
Определите возможность самопроизвольного протекания реакции.
Приложение.
studfile.net
Лекция по теме «окислительно-восстановительные реакции. Свойства металлов» Учебные вопросы:
Теория ОВР
Электрохимические свойства металлов.
1. Теория овр
К окислительно-восстановительным реакциям относятся такие, которые сопровождающиеся перемещением электронов от одних частиц к другим. При рассмотрении закономерностей протекания окислительно-восстановительных реакций используется понятие степени окисления.
Степень окисления
Понятие степени окисления введено для характеристики состояния элементов в соединениях. Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления обозначается арабской цифрой со знаком плюс при смещении электронов от данного атома к другому атому и цифрой со знаком минус при смещении электронов в обратном направлении. Цифру со знаком “+” или “-“ ставят над символом элемента. Степень окисления указывает состояние окисления атома и представляет собой всего лишь удобную форму для учета переноса электронов: ее не следует рассматривать ни как эффективный заряд атома в молекуле (например, в молекуле LiF эффективные заряды Li и F равны соответственно + 0,89 и -0,89, тогда как степени окисления +1 и -1), ни как валентность элемента (например, в соединениях CH4, CH3OH, HCOOH, CO2 валентность углерода равна 4, а степени окисления соответственно равны -4, -2, +2, +4). Численные значения валентности и степени окисления могут совпадать по абсолютной величине лишь при образовании соединений с ионной структурой.
При определении степени окисления используют следующие правила:
Атомы элементов, находящихся в свободном состоянии или в виде молекул простых веществ, имеют степень окисления, равную нулю, например Fe, Cu, H2, N2 и т.п.
Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона,
+1 -1 +2 -2 +3 -1
например, NaCl, Cu S, AlF3.
Водород в большинстве соединений имеет степень окисления +1, за исключением гидридов металлов (NaH, LiH), в которых степень окисления водорода равна -1.
Наиболее распространенная степень окисления кислорода в соединениях -2 , за исключением пероксидов (Na2O2, Н2О2), в которых степень окисления кислорода равна –1 и F2O, в котором степень окисления кислорода равна +2.
Для элементов с непостоянной степенью окисления ее значение можно рассчитать, зная формулу соединения и учитывая, что алгебраическая сумма степеней окисления всех элементов в нейтральной молекуле равна нулю. В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO4, вычисленная исходя из суммарного заряда молекулы [1 + x + 4(-2)] = 0, где х – степень окисления атома хлора), равна +7. Степень окисления атома серы в ионе (SO4)2- [х + 4(-2) = -2] равна +6.
Окислительно-восстановительные свойства веществ
Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление — это процесс отдачи электронов атомом, ионом или молекулой реагента. Вещества, которые отдают свои электроны в процессе реакции и при этом окисляются, называют восстановителями.
Восстановление – это процесс принятия электронов атомом, ионом или молекулой реагента.
Вещества, которые принимают электроны и при этом восстанавливаются, называют окислителями.
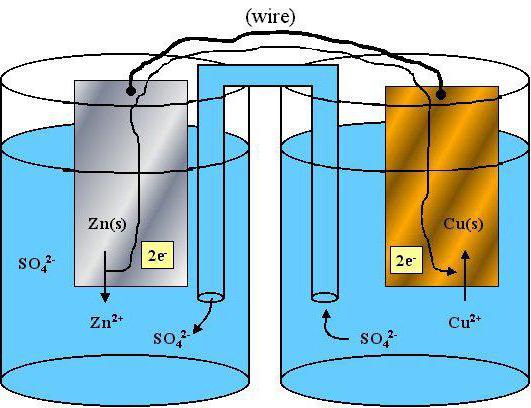
Реакции окисления-восстановления всегда протекают как единый процесс, называемый окислительно-восстановительной реакцией. Например, при взаимодействии металлического цинка с ионами меди восстановитель (Zn) отдает свои электроны окислителю – ионам меди (Cu2+):
Zn
+ Cu2+  Zn2+ + Cu
Zn2+ + Cu
Медь выделяется на поверхности цинка, а ионы цинка переходят в раствор.
Окислительно-восстановительные свойства элементов связаны со строением их атомов и определяются положением в периодической системе Д.И. Менделеева. Восстановительная способность элемента обусловлена слабой связью валентных электронов с ядром. Атомы металлов, содержащие на внешнем энергетическом уровне небольшое число электронов склонны к их отдаче, т.е. легко окисляются, играя роль восстановителей. Самые сильные восстановители – наиболее активные металлы.
Критерием окислительно-восстановительной активности элементов может служить величина их относительной электроотрицательности: чем она выше, тем сильнее выражена окислительная способность элемента, и чем ниже, тем ярче проявляется его восстановительная активность. Атомы неметаллов (например, F, O) обладают высоким значением сродства к электрону и относительной электроотрицательности, они легко принимают электроны, т.е. являются окислителями.
Окислительно-восстановительные свойства элемента зависят от степени его окисления. У одного и того же элемента различают низшую, высшую и промежуточные степени окисления.
В качестве примера рассмотрим серу S и ее соединения H2S, SO2 и SO3. Связь между электронной структурой атома серы и его окислительно-восстановительными свойствами в этих соединениях наглядно представлена в таблице 1.
В молекуле H2S атом серы имеет устойчивую октетную конфигурацию внешнего энергетического уровня 3s23p6 и поэтому не может больше присоединять электроны, но может их отдавать.
Состояние атома, в котором он не может больше принимать электроны, называется низшей степенью окисления.
В низшей степени окисления атом теряет окислительную способность и может быть только восстановителем.
Таблица.1.
В молекуле SO3 все внешние электроны атома серы смещены к атомам кислорода. Следовательно, в этом случае атом серы может только принимать электроны, проявляя окислительные свойства.
Состояние атома, в котором он отдал все валентные электроны, называется высшей степенью окисления. Атом, находящийся в высшей степени окисления, может быть только окислителем.
В молекуле SO2 и элементарной сере S атом серы находится в промежуточных степенях окисления, т.е., имея валентные электроны, атом может их отдавать, но, не имея завершенного р — подуровня, может и принимать электроны до его завершения.
Атом элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства, что определяется его ролью в конкретной реакции.
Так,
например роль сульфит — аниона SO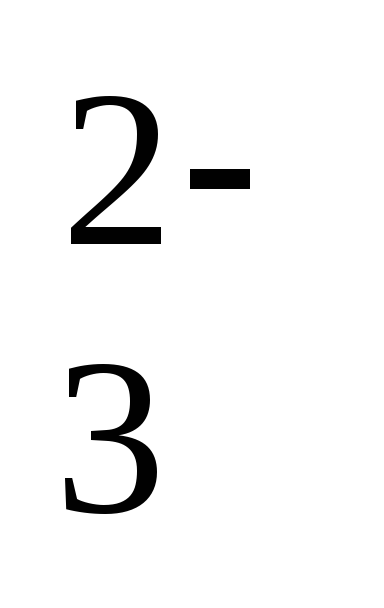 в следующих реакциях различна:
в следующих реакциях различна:
5Na2SO3 +2KMnO4 + 3H2SO4 2MnSO4 + 5Na2SO4 + K2SO4+ 3H2O (1)
H2SO3 + 2 H2S 3 S + 3 H2O (2)
В
реакции (1) сульфит-анион SO в присутствии сильного окислителяKMnO4 играет роль восстановителя; в реакции
(2) сульфит-анион SO
в присутствии сильного окислителяKMnO4 играет роль восстановителя; в реакции
(2) сульфит-анион SO —
окислитель, так как H2S
может проявлять только восстановительные
свойства.
—
окислитель, так как H2S
может проявлять только восстановительные
свойства.
Таким образом, среди сложных веществ восстановителями могут быть:
1. Простые вещества, атомы которых обладают низкими значениями энергии ионизации и электроотрицательности (в частности, металлы).
2. Сложные вещества, содержащие атомы в низших степенях окисления:
-1 -2 — 3
HCl,H2S,NH3
3. Сложные вещества, содержащие атомы в промежуточных степенях окисления:
+4 +2 +2
Na2SO3, FeCl2, Sn(NO3)2.
Окислителями могут быть:
1. Простые вещества, атомы которых обладают высокими значениями сродства к электрону и электроотрицательности — неметаллы.
2. Сложные вещества, содержащие атомы в высших степенях окисления: +7 +6 +7
KMnO4, K2Cr2O7, HClO4.
3. Сложные вещества, содержащие атомы в промежуточных степенях окисления:
+4 +4 +2
Na2SO3, MnO2, MnSO4.
studfile.net
Восстановительными свойствами обладают… Окислительно-восстановительные свойства
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
— Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
— S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4
Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl
Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
— Mn+7 принимает 5 e = Mn+2 2 является окислителем,
— 2I— отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
— серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
— Mn+7 принимает 5 e= Mn+2 2,
— S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
— нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
— Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
— Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
— 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
— Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции — фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла — алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
fb.ru
Окислительно-восстановительные свойства серы на примере тиосульфата натрия

Изучение свойств тиосульфата натрия
Работу приготовила: учитель химии ГБОУ Школы №1619 Галстян Мери Мисаковна
Г. Москва

Учебная тема: окислительно-восстановительные свойства серы на примере тиосульфата натрия
Цели учебного исследования: изучить окислительно-восстановительные свойства тиосульфата натрия и применение его в медицине.
Задачи учебного исследования: закрепить навыки составления уравнений ОВР в рамках подготовки к ЕГЭ, изучить практическое примените тиосульфата в медицине.

Методика занятия
Приготовить 5% раствор тиосульфата натрия и провести реакции:
- С раствором соляной кислоты
- С раствором йода
- С хлорной водой
- С раствором хлорида железа (III)
- С раствором нитрата серебра
Записать УХР и ответить на вопрос почему препарат используют при лечении чесотки, при отравлении галогенами, цианидами и другими ядами.

Отчет о работе
1. С раствором соляной кислоты
Na 2 S 2 O 3 + 2HCl = S+ SO 2 + 2 NaCl + H 2 O
S +2 + 2 e — → S 0
S +2 — 2 e — → S +4
Наблюдаем выделение сернистого газа с запахом жженых спичек и помутнение раствора за счет выделяемой серы.
При лечении чесотки применение этого лекарственного средства оправдано, так как оно способно распадаться на сернистый ангидрид и серу в кислой среде, оказывая повреждающее действие на клеща и на его яйца.


С раствором йода
Na 2 S 2 O 3+ I 2 = Na 2 S 4 O 6 + NaI
2S 2 O 3 2- -2e — =S 4 O 6 2- |1
I 2 0 +2e — =2I — |1
2S 2 O 3 2- +I 2 0 +=S 4 O 6 2- +2I —
Наблюдаем обесцвечивание раствора йода.


С хлорной водой
Na 2 S 2 O 3 + 4Cl 2 +5H 2 O = 2NaCl + 6HCl + 2H 2 SO 4 S2O3 2- -8e — + 5H 2 O = 2SO 4 2- + 10H + |1 Cl 2 0 +2e — = 2Cl – | 4
Данное вещество способно образовывать нетоксичные или малотоксичные соединения с галогенами, поэтому препарат используют при отравлении галогенами

![С раствором хлорида железа (III) Наблюдаем появление интенсивной фиолетовой окраски, обусловленной образованием комплексного соединения железа – дитиосульфатоферрат (III) натрия: FeCl 3 + 2Na 2 S 2 O 3 = Na[Fe(S 2 O 3 ) 2 ] + 3NaCl Полученный раствор медленно обесцвечивается вследствие окислительно-восстановительной реакции: Na[Fe(S 2 O 3 ) 2 ] + FeCl 3 = NaCl + FeS 4 O 6 + FeCl 2 (тетратионат железа) Итого: 2 FeCl 3 + 2 Na 2 S 2 O 3 → 2 FeCl 2 + Na 2 S 4 O 6 + 2 NaCl Fe +3 + e - → Fe 3](/800/600/https/fsd.videouroki.net/html/2019/01/09/v_5c35f9d66de34/img9.jpg)
С раствором хлорида железа (III)
Наблюдаем появление интенсивной фиолетовой окраски, обусловленной образованием комплексного соединения железа – дитиосульфатоферрат (III) натрия:
FeCl 3 + 2Na 2 S 2 O 3 = Na[Fe(S 2 O 3 ) 2 ] + 3NaCl
Полученный раствор медленно обесцвечивается вследствие окислительно-восстановительной реакции:
Na[Fe(S 2 O 3 ) 2 ] + FeCl 3 = NaCl + FeS 4 O 6 + FeCl 2
(тетратионат железа)
Итого:
2 FeCl 3 + 2 Na 2 S 2 O 3 → 2 FeCl 2 + Na 2 S 4 O 6 + 2 NaCl
Fe +3 + e — → Fe 3 |2
2S +4 — 2 e — → 2S +5 |1
2 Fe 3+ + 2 S 2 O 3 2- → 2 Fe +2 + S 4 O 6 2-
![С раствором хлорида железа (III) Наблюдаем появление интенсивной фиолетовой окраски, обусловленной образованием комплексного соединения железа – дитиосульфатоферрат (III) натрия: FeCl 3 + 2Na 2 S 2 O 3 = Na[Fe(S 2 O 3 ) 2 ] + 3NaCl Полученный раствор медленно обесцвечивается вследствие окислительно-восстановительной реакции: Na[Fe(S 2 O 3 ) 2 ] + FeCl 3 = NaCl + FeS 4 O 6 + FeCl 2 (тетратионат железа) Итого: 2 FeCl 3 + 2 Na 2 S 2 O 3 → 2 FeCl 2 + Na 2 S 4 O 6 + 2 NaCl Fe +3 + e - → Fe 3](/800/600/https/fsd.videouroki.net/html/2019/01/09/v_5c35f9d66de34/img10.jpg)
![С раствором хлорида железа (III) Наблюдаем появление интенсивной фиолетовой окраски, обусловленной образованием комплексного соединения железа – дитиосульфатоферрат (III) натрия: FeCl 3 + 2Na 2 S 2 O 3 = Na[Fe(S 2 O 3 ) 2 ] + 3NaCl Полученный раствор медленно обесцвечивается вследствие окислительно-восстановительной реакции: Na[Fe(S 2 O 3 ) 2 ] + FeCl 3 = NaCl + FeS 4 O 6 + FeCl 2 (тетратионат железа) Итого: 2 FeCl 3 + 2 Na 2 S 2 O 3 → 2 FeCl 2 + Na 2 S 4 O 6 + 2 NaCl Fe +3 + e - → Fe 3](/800/600/https/fsd.videouroki.net/html/2019/01/09/v_5c35f9d66de34/img11.jpg)
![С раствором нитрата серебра С серебра нитратом (в избытке AgNO 3 ) . Образуется белый осадок, быстро желтеет, ввиду разложения с выделением серы: Na 2 S 2 O 3 +2AgNO 3 →Ag 2 S 2 O 3 ↓+2NaNO 3 Ag 2 S 2 O 3 ↓→S↓+Ag 2 SO 3 Осадок постепенно буреет, затем чернеет, за счет образования сульфида серебра: S↓+Ag 2 SO 3 +H 2 O→Ag 2 S+H 2 SO 4 При избытке натрия тиосульфата образуется растворимое комплексное соединение: Na 2 S 2 O 3 +AgNO 3 →Na[Ag(S 2 O 3 )]+NaNO 3](/800/600/https/fsd.videouroki.net/html/2019/01/09/v_5c35f9d66de34/img12.jpg)
С раствором нитрата серебра
С серебра нитратом (в избытке AgNO 3 ) . Образуется белый осадок, быстро желтеет, ввиду разложения с выделением серы:
Na 2 S 2 O 3 +2AgNO 3 →Ag 2 S 2 O 3 ↓+2NaNO 3
Ag 2 S 2 O 3 ↓→S↓+Ag 2 SO 3
Осадок постепенно буреет, затем чернеет, за счет образования сульфида серебра:
S↓+Ag 2 SO 3 +H 2 O→Ag 2 S+H 2 SO 4
При избытке натрия тиосульфата образуется растворимое комплексное соединение:
Na 2 S 2 O 3 +AgNO 3 →Na[Ag(S 2 O 3 )]+NaNO 3
![С раствором нитрата серебра С серебра нитратом (в избытке AgNO 3 ) . Образуется белый осадок, быстро желтеет, ввиду разложения с выделением серы: Na 2 S 2 O 3 +2AgNO 3 →Ag 2 S 2 O 3 ↓+2NaNO 3 Ag 2 S 2 O 3 ↓→S↓+Ag 2 SO 3 Осадок постепенно буреет, затем чернеет, за счет образования сульфида серебра: S↓+Ag 2 SO 3 +H 2 O→Ag 2 S+H 2 SO 4 При избытке натрия тиосульфата образуется растворимое комплексное соединение: Na 2 S 2 O 3 +AgNO 3 →Na[Ag(S 2 O 3 )]+NaNO 3](/800/600/https/fsd.videouroki.net/html/2019/01/09/v_5c35f9d66de34/img13.jpg)

Заключение и выводы
- Свойства тиосульфата рекомендуем для изучения в медицинских классах, т. к. находит широкое применение в медицине
- Реакция взаимодействия тиосульфата с кислотами входит в материал ЕГЭ при изучении темы скорость химических реакций.
- Изучение восстановительных свойств тиосульфата и сравнение окислительных свойства галогенов входит в тему ОВР, является материалом для подготовки к практической части к олимпиадам.
- В реакции комплексообразования рекомендуется добавить реакции с хлоридом, бромидом и йодидом серебра.
videouroki.net
Натрий восстановительные свойств — Справочник химика 21
Опыт 29. Восстановительные свойства тиосульфатов. К раствору тиосульфата натрия приливаете по каплям хлорной воды. Наблюдайте исчезновение запаха хлора и появление в растворе сульфат (VI)-ионов. [c.58]Влияние рн на окислительно-восстановительные свойства. К 0,1 М КВг, подкисленному 0,1 М уксусной кислотой, прибавляют несколько капель 0,1 М ацетата натрия. Затем приливают несколько миллилитров 0,1 н. КМпО . При нагревании выделяется свободный бром (запах). Доказать присутствие брома можно с помощью полоски иодкрахмальной бумаги (синее Окрашивание). [c.510]
Восстановительные свойства арсенита натрия. 1. К 5— [c.188]
Окислительные или восстановительные свойства проявляли натрий, церий и железо в этих реакциях Почему железо не вытесняет цинк из его соли [c.95]
I б) Восстановительные свойства тиосульфата натрия [c.144]
Выполнение работы. В третью пробирку к раствору манганата добавить 1—2 микрошпателя кристаллического сульфита натрия. Наблюдать обесцвечивание раствора и появление бурого осадка диоксида марганца. Окислительные или восстановительные свойства проявляет в данном случае Mп В какое соединение переходит сульфит натрия. Написать уравнение реакции. [c.224]
Гипосульфит натрия находит широкое применение как антихлор вследствие ярко выраженных восстановительных свойств этой соли, легко окисляющейся под действием хлора до серной кислоты [c.146]
При сравнении металлов, занимающих то или иное положение в периодической системе, за меру их химической активности — восстановительной способности — принимается величина энергии ионизации свободных атомов. Действительно, при переходе, например, сверху вниз по главной подгруппе I группы периодической системы энергия ионизации атомов уменьшается, что связано с увеличением их радиусов (т. е. с большим удалением внешних электронов от ядра) и с возрастающим экранированием положительного заряда ядра промежуточными электронными оболочками. Поэтому атомы калия проявляют большую химическую активность — обладают более сильными восстановительными свойствами, чем атомы натрия, а атомы натрия — большую активность, чем атомы лития. [c.329]
Амиды натрия и калия являются типичными солями с анионом NH , проявляют сильные восстановительные свойства и применяются в органическом синтезе. При действии воды подвергаются разложению [c.308]
Так как окислительно-восстановительный потенциал зависит от соотношения активностей окисленной и восстановленной форм ионов, то, варьируя это соотношение, изучить характер изменения электродного потенциала, окислительные и восстановительные свойства раствора. Это осуществить, вводя в раствор вещества, связывающие ту или иную форму ионов. Уменьшение концентрации окисленной формы при постоянной концентрации восстановленной формы снижает потенциал исследуемой системы, и, наоборот, всякое уменьшение концентрации восстановленной формы при постоянной концентрации окисленной увеличивает окислительновосстановительный потенциал системы. При этом изменяются окислительные и восстановительные свойства раствора. Так, например, введение в раствор, содержащий ферро-ферри-ионы, ацетата натрия уменьшает окислительно-восстановительный потенциал, поскольку ионы Ре + связываются в комплекс. Это снижает окислительную способность раствора и повышает его восстановительное действие. Введение в эту же систему оксалата аммония, образующего комплекс с ионами Р +, увеличивает потенциал изучаемой системы при этом возрастает окислительное свойство раствора И снижается восстановительная способность его. Для установления характера изменения окислительно-восстановительного потенциала систем составить гальванический элемент типа [c.303]
Анион 50 Открывают реакцией с ионом Ва » . Кислота сильная, так как водный раствор ее соли с натрием показывает нейтральную реакцию. Ион S0 не обнаруживает резко выраженных окислительно-восстановительных свойств. Кислота устойчивая. Термический распад возможен только при очень высокой температуре. Концентрированная кислота заметно отличается от разбавленной по окислительным свойствам и более резко выраженной способности к гидратации — к обезвоживающему действию. [c.297]
Определите массу (г) гептагидрата сульфита натрия, необходимую для приготовления 500 мл 0,04 н. раствора, предназначенного для изучения восстановительных свойств сульфита натрия. [c.229]
В соответствии с занимаемым местом в периодической системе элементов атомы большинства металлов содержат на внешнем энергетическом уровне 1—2 электрона. В химических реакциях они будут отдавать валентные электроны, т. е. окисляться. Элементарные вещества — металлы обладают только восстановительными свойствами. В качестве восстановителей широко применяют алюминий, магний, натрий, калий, цинк и др. [c.89]
Восстановительные свойства амальгамы. В пробирку налить 4 мл разбавленного раствора серной кислоты и 2 капли раствора перманганата, взболтать и разлить в две пробирки. В одну из пробирок погрузить кусочек амальгамы натрия и, после того как реакция закончится, сравнить цвет раствора в этой пробирке с раствором в другой пробирке. Составить уравнение реакции. [c.216]
Нитриты, фосфиты и арсениты. Их получение. Соли азотистой кислоты как восстановители и окислители. Арсенит натрия его восстановительные свойства. [c.267]
Металлы чаще всего обладают восстановительными свойствами. В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Например, в третьем периоде натрий — самый активный восстановитель, а хлор — самый активный окислитель. У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные. Наиболее сильные восстановители — щелочные металлы, наиболее активные из них Fr и s. Лучшие окислители — галогены. [c.320]
ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СТАННИТА НАТРИЯ [c.153]
Опыт 10. Окислительные и восстановительные свойства пероксида натрия [c.116]
В
www.chem21.info
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) — это реакции, сопровождающиеся изменением степени окисления элементов вследствие смещения или полного перехода электронов от одних атомов или ионов к другим. Окисление – процесс отдачи электронов атомом, молекулой или ионом; восстановление — процесс присоединения электронов атомом, молекулой или ионом. Окисление и восстановление — это взаимосвязанные процессы, протекающие одновременно. Окислителями могут быть атомы и молекулы некоторых неметаллов; сложные ионы и молекулы, содержащие атомы элементов в высшей или в одной из высших степеней окисления MnO4—, NO3—, SO42-, Cr2O72-, ClO3—, PbO2 и др.; положительно заряженные ионы металлов (Fe3+, Au3+, Ag+, Sn4+, Hg2+ и др.). Типичными восстановителями являются почти все металлы и некоторые неметаллы (С, Н2 и др.) в свободном состоянии; отрицательно заряженные ионы неметаллов (S2-, I— и др.), катионы, степень окисления которых может возрасти (Sn2+, Fe2+, Cu+ и др.). Если вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем и восстановителем. Например, нитрит калия в присутствии сильного окислителя проявляет восстановительные свойства, окисляясь при этом до нитрата
3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
При взаимодействии с восстановителем, наоборот проявляет окислительные свойства
2KNO2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2H2O
Такая окислительно-восстановительная двойственность характерна также для Н2О2, H2SO3 (и ее солей) и т.д.
Составление уравнений ОВР.
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. В основе его лежит правило, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.
Рассмотрим данный метод на реакции взаимодействия сероводорода с перманганатом калия в кислой среде.
H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Затем определяем изменение степеней окисления атомов
H2S-2 + KMn+7O4 + H2SO4 = S0 + Mn+2SO4 + K2SO4 + H2O
Отсюда видно, что степень окисления изменяется у серы и марганца
Далее составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
S-2 – 2e = S5
Mn+7 + 5e = Mn+2 2
Находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 молекул H2S и 2 молекулы KMnO4, тогда получим 5 атомов S и 2 молекулы MnSO4. Кроме того, из сопоставления атомов в левой и правой частях уравнения найдем, что образуется также 1 молекула K2SO4 и 8 молекул воды.
Окончательное уравнение реакции будет иметь вид:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
Правильность написания уравнения проверяется путем подсчета атомов каждого элемента в левой и правой частях уравнения.
Лабораторная работа. Окислительно-восстановительные реакции Опыт 1. Окислительные свойства kMnO4 в различных средах.
В три конические колбы поместить по 3 капли раствора KMnO4. Затем в первую добавить 2 капли раствора 2 н. H2SO4, во вторую — 2 капли дистиллированной воды, в третью -2 капли раствора NaOH, после чего добавлять по каплям в каждую пробирку раствор Na2SO3 до изменения цвета раствора. Как ведет себя KMnO4 в кислой, нейтральной и щелочной среде ?
KMnO4 + Na2SO3 + H2SO4 MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na2SO3 + H2O MnO2 + Na2SO4 + KOH
KMnO4 + Na2SO3 + NaOH Na2MnO4 + К2SO4 + H2O
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 2. Окислительные свойства дихромата калия.
Налейте в две пробирки по 3-4 капли раствора K2Cr2O7, добавьте в одну из пробирок 3-4 капли 2 н. раствора H2SO4, в другую — 3-4 капли 2 н. раствора щелочи. Обратите внимание на изменение цвета раствора во второй пробирке. Добавьте во все пробирки сульфита натрия. Дайте объяснения наблюдаемым явлениям.
К2Cr2O7+ H2SO4 + Na2SO3Cr2 (SO4) 3 + К2SO4+ Na2SO4+ H2O
Определите степень окисления для всех элементов, расставьте коэффициенты в уравнениях реакций.
Опыт 3.Восстановление дихромата калия.
В пробирку налить 5-6 капель раствора дихромата калия, добавить 2-3капли серной кислоты и внести несколько кристалликов сульфида калия. Встряхнуть содержимое пробирки. Наблюдать изменение окраски.
Опыт 4. Окислительно–восстановительные свойства соединений железа (III)
В пробирку налить 4-5 капель раствора KMnO4 и 1-2 капли H2SO4 по каплям добавить раствор сульфата железа (II) до обесцвечивания раствора.
В пробирку налить 4-5 капель раствора хлорида железа и 1-2 капли раствора иодида калия. Отметить изменение окраски раствора. В пробирку с 7-8 каплями крахмала внести 1-2 капли полученного раствора. Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2 (SO4 ) 3 + K2SO4 + H2O
FeCl3 +KI FeCl2+KCl+I2
Опыт 5. Самоокисление и самовосстановление (диспропорционирование) сульфита натрия.
В две цилиндрические пробирки поместить по 2-3 кристаллика Na2SO3. Одну пробирку оставить в качестве контрольной. Вторую закрепить в штативе и нагревать в течение 5-6 мин. Дать пробирке остыть. В обе пробирки внести по 2-3 мл дистиллированной воды, размешать стеклянными палочками до растворения солей, находящихся в пробирках. Добавить в каждую пробирку по 2-3 мл раствора CuSO4. Отметить окраску осадков в пробирках. Как объяснить различие окраски? Черный осадок, полученный во второй пробирке, представляет собой сульфид меди. Какой продукт прокаливания сульфита натрия дал с сульфатом меди этот осадок? Написать уравнение реакции разложения сульфита натрия, учитывая, что вторым продуктом прокаливания является сульфит натрия.
Na2SO3 + H2O +CuSO4 H2SO4+ Cu2O + NaOH
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 6. Окислительные свойства пероксида водорода.
В пробирку с 5-6 каплями раствора KI прибавить 3-4 капли 2 н H2SO4 и затем по каплям прибавлять раствор H2O2 до появления желтой окраски. Для обнаружения в растворе йода внести в пробирку несколько капель хлороформа или бензола. Составьте уравнение реакции.
KI + H2O2 + H2SO4I2 + H2O + K2SO4
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 7. Восстановительные свойства пероксида водорода.
В пробирку с 5-6 каплями KMnO4 прибавить 3-4 капли 2 н H2SO4, 5-6 капель пероксида водорода и подогреть. Что происходит? Составить уравнение реакции, учитывая, что пероксид водорода окисляется до кислорода.
KMnO4 + H2O2 + H2SO4 MnSO4 + O2 + K2SO4 + H2O
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 8. Окисление меди азотной кислотой.
В пробирку поместить кусочек медной проволоки и прибавить 5-6 капель 0,2 н HNO3. Отметить выделение газа, растворение меди и изменение цвета раствора. Составить электронные уравнения реакции, указав окислитель и восстановитель. Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Cu + HNO3 Cu(NO3)2 + NO + H2O
Контрольные вопросы
1.Какие из следующих реакций являются окислительно-восстановительными:
a) Na2CO3 + SiO2 = Na2SiO3 + CO2 б) Fe2O3 + CO = 2FeO + CO2
в) K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
2. Определить окислитель и восстановитель и подобрать коэффициенты в следующих реакциях окисления-восстановления:
a) Na2SO3 + I2 + H2O = Na2SO4 + HI б) S + HNO3 = H2SO4 + NO
3.Степень окисления +2 в соединениях имеют металлы: Cu, Al, Zn, Sn, Pb, Cr, Fe, Mn
4.Степень окисления +3 в соединениях имеют металлы: Cu, Al, Zn, Sn, Pb, Cr, Fe, Mn
5.Степень окисления +1 в соединениях имеют металлы: Cu, Al, Zn, Sn, Pb, Cr, Fe, Mn, Na, Ca, Ag
studfile.net