#15 Наибольший радиус имеет атом:
А) олова. Б) кремния. В) свинца. Г) углерода
#16 Ион, в составе которого 16 протонов и 20 электронов, имеет заряд:
А) +4. Б) -2. В) +2. Г) -4
#17 В порядке возрастания неметаллических всойств элементы расположены в ряду:
А) O, N, C, B. Б) Cl, S, P, Si. B) C, Si, Ge, Sn. Г) B, C, O, F
#18 По периоду слева направо уменьшается(-ются)
А) атомный радиус элементов. Б) число валентных электронов в атомах. В) электроотрицательность элементов. Г) Кислотные свойства гидроксидов
#19 Наиболее сильное основание образует:
А) магний. Б) стронций. В) барий. Г) кадмий
#20 Электроотрицательность химических элементов с возрастанием зарзаряда ядра атома:
А) увеличивается и в периодах, и в группах. Б) уменьшается и в периодах, и в группах. В) увеличивается в периодах, а в группах уменьшается. Г) уменьшается в периодах, а в группах увеличивается
Всем спасибо за ваши ответы!!!
Контрольная работа по теме:»Химическая связь»

I.
1. Определите химический элемент по составу его атомной частицы — 38р, 50n, 38е :
а) F б) Ca в)Ar г) Sr
2. Максимальное число электронов на s-орбитали:
а) 1 б) 2 в) 6 г) 8
3. Число орбиталей на d-подуровне:
а) 3 б) 4 в) 5 г) 6
4. К р-элементам относится:
а) кремний б) магний в) водород г) хром
5. Элемент, атом которого имеет электронную конфигурацию 1s22s22p63s23p64s
а) К б) Са в) Ва г) Nа
6. Ряд элементов, образующих оксиды с общей формулой RО:
а) Ва, Са, Sr б) P, N, As в) C, Si, Ge г) B, Al, Ga
7. Из приведенных ниже элементов 3-го периода наиболее ярко выраженные
неметаллические свойства имеет:
а) Al б)S в)Si г)Cl
8. Элемент имеет электронную конфигурацию внешнего уровня … 3s23p2.
Выберите формулу его водородного соединения:
а) Ph4
б) h3
S в) Ch5
г) Sih5
9. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических
уровней:
а) S и Cl б) Be и B в) Kr и Xe г) Mo и Se
10. Номер периода в Периодической системе совпадает с:
Номер периода в Периодической системе совпадает с:
а) зарядом ядра атома б) числом электронов
в) числом энергетических уровней г) числом протонов
11. Выберите изотоп кальция в ядре которого содержится 22 нейтрона:
а) 40Са б) 42Са в) 44 Са г) 48Са
12. Оксиды BeO – MgO – CaO соответственно относятся:
а) основной –амфотерный – кислотный
б) кислотный – амфотерный – основной
в) амфотерный – основной – основной
г) все основные
13. Восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+
2) S2-
3) С15+
4) Fe2+
14. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Sn2+
2) S2-
3) Cr3+
4) Fe2
15. Наибольший радиус имеет атом
1) олова 2) кремния 3) свинца 4) углерода
16. Ион, в составе которого 16 протонов и 20 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
17. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B 2) Cl,S,P,Si
3) C,Si,Ge,Sn 4) B,C,O,F
18. По периоду слева направо уменьшается(-ются)
По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
19. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
20. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
II. 1. Составьте электронную формулу элемента с порядковым номером 15 в
ПСХЭ. Распределите электроны по атомным орбиталям.
Чему равна валентность этого атома в обычном и возбужденном состоянии?
Сделайте вывод о принадлежности этого элемента к металлам или неметаллам.
Запишите формулу его высшего оксида ( укажите его характер).
Составьте электронную формулу его иона.
2. Составьте электронную формулу элемента с порядковым номером 72
К какому семейству относится этот элемент.
3. Укажите типичный металл и типичный неметалл в 4-м периоде
ПСХЭ. Объясните свой ответ.
Контрольная работа по теме «Строение атома».
Вариант II
I.
1. Определите химический элемент по составу его атомной частицы — 15р, 16n, 15е :
а) F б) Ca в)Р г) Sr
2. Максимальное число электронов на d-орбитали:
а) 10 б) 2 в) 6 г) 8
3. Число орбиталей на р-подуровне:
а) 3 б) 4 в) 5 г) 6
4. К d-элементам относится:
а) кремний б) магний в) водород г) хром
5. Элемент, атом которого имеет электронную конфигурацию 1s22s22p63s23p64s23d2
а) К б) Са в) Тi г) Nа
6. Ряд элементов, образующих оксиды с общей формулой RО2:
а) Ва, Са, Sr б) P, N, As в) C, Si, Ge г) B, Al, Ga
7. Из приведенных ниже элементов 3-го периода наиболее ярко выраженные
Из приведенных ниже элементов 3-го периода наиболее ярко выраженные
металлические свойства имеет:
а) Al б)Nа в)Si г)Cl
8. Элемент имеет электронную конфигурацию внешнего уровня …3s23p4Выберите формулу его водородного соединения:
а) Ph4
б) h3
S в) Ch5
г) Sih5
9. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических
уровней:
а) Si и Cl б) Be и B в) K и Rb г) Mg и Al
10. Порядковый номер элемента в Периодической системе совпадает с:
а) зарядом ядра атома б) числом электронов
в) числом энергетических уровней г) числом нейтронов
11. Выберите изотоп марганца в ядре которого содержится 25 нейтронов:
а) 50Мn б) 52 Mn в) 54 Mn г) 55Mn 25
12. Оксиды SO2
– Al 2O3
– Na 2O
соответственно относятся:
а) основной –амфотерный – кислотный
б) кислотный – амфотерный – основной
в) амфотерный – основной – основной
г) все амфотерные
13.
1) S6+
2) S2-
3) Вг5+
4) Sn4+
14. Электронная конфигурация Is22s22p6
соответствует иону
1) А13+
2) Fe3+
3) Zn2+
4) Cr3+
15. Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
16. Ион, в составе которого 16 протонов и 14 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
17. У элементов главных подгрупп с увеличением атомного номера уменьшается
1) атомный радиус 3) число валентных электронов в атомах
2) заряд ядра атома 4) электроотрицательность
18. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
19. В ряду оксидов SiO2
— Р205
— SO2
— Cl2O7
кислотные свойства
1) возрастают 3) не изменяются
2) убывают 4) сначала уменьшаются, потом увеличиваются
20. По периоду слева направо увеличивается(-ются)
1) атомный радиус элементов 2) металлические свойства
3) электроотрицательность элементов 4) основные свойства
II. 1. Составьте электронную формулу элемента с порядковым номером 14 в
1. Составьте электронную формулу элемента с порядковым номером 14 в
ПСХЭ. Распределите электроны по атомным орбиталям.
Чему равна валентность этого атома в обычном и возбужденном состоянии?
Сделайте вывод о принадлежности этого элемента к металлам или неметаллам.
Запишите формулу его высшего оксида ( укажите его характер) .
Составьте электронную формулу его иона.
2. Составьте электронную формулу элемента с порядковым номером 82
К какому семейству относится этот элемент.
3. Укажите типичный металл и типичный неметалл в 3-м периоде
ПСХЭ. Объясните свой ответ.
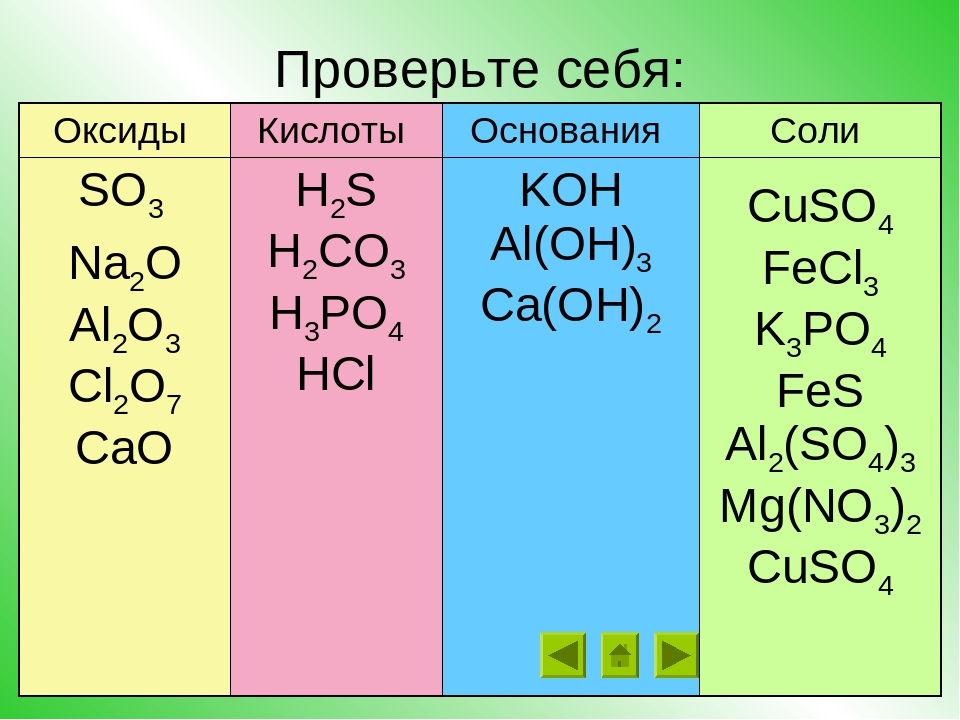
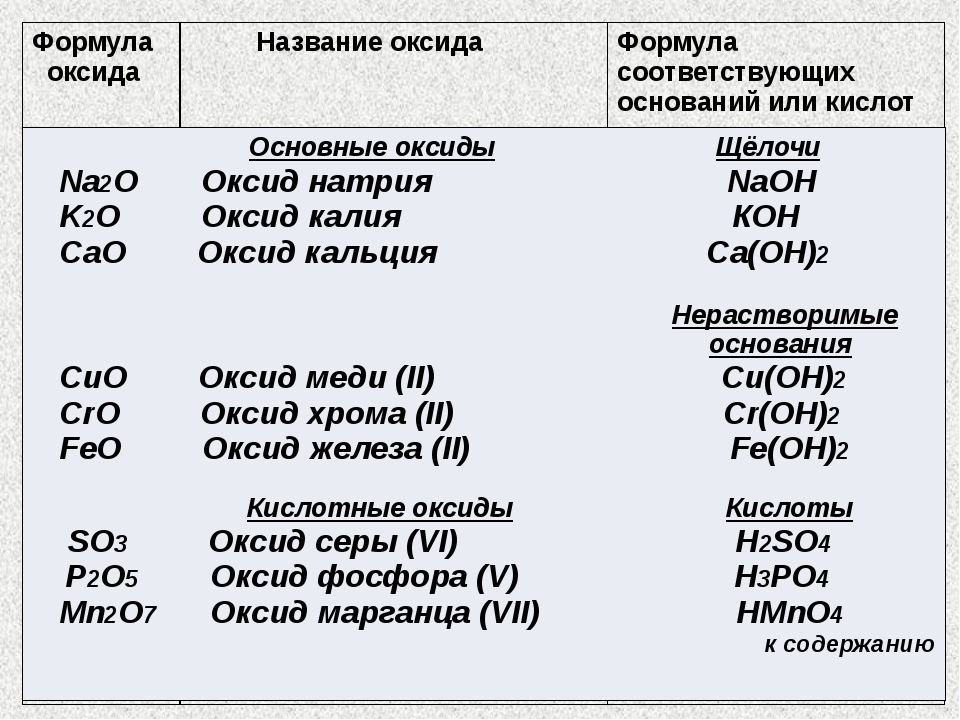
ЕГЭ по химии. А 6. Классификация веществ. Ответы.
Многообразие неорганических веществ. Классификация неорганических веществ. Классификация органических веществ. Систематическая номенклатура.
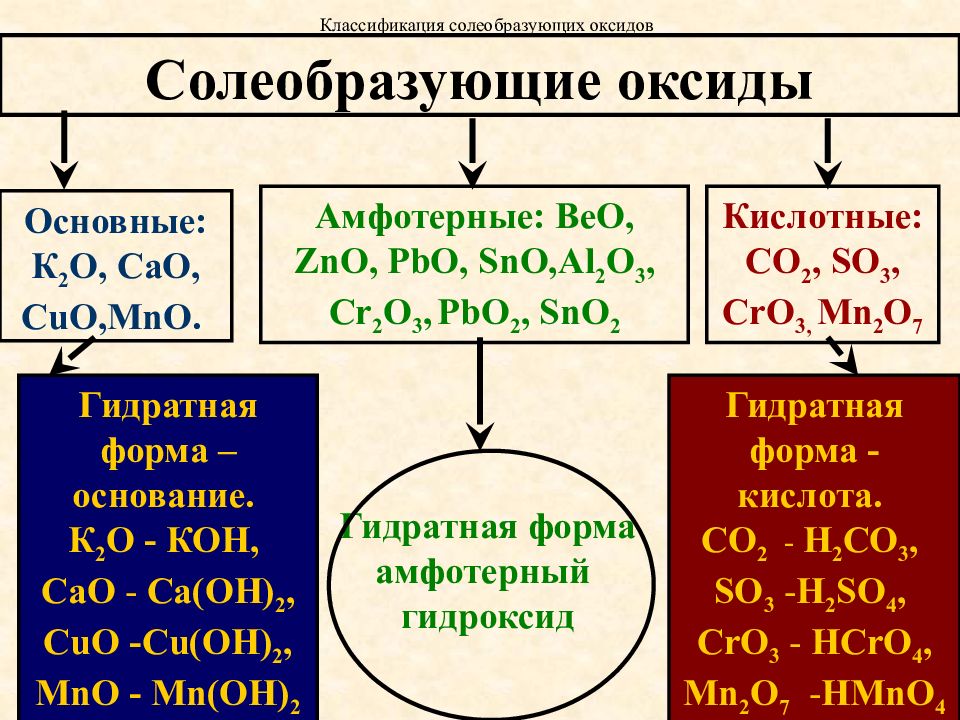
1. Амфотерным и основным оксидами соответственно являются:
1) FeO и CaO
2) А12Оз и К2О
3) CO2 и NO
4) Fe2O3 и CO
2. Какой из элементов может образовать кислотный оксид?
Какой из элементов может образовать кислотный оксид?
1) стронций 2) марганец 3) кальций 4) магний
3. Только кислотные оксиды расположены в ряду:
1) СО2, Mn2O7, SO2
2) Na2O, SiO2, Сг2Оз
3) CrO.SQ2, CaO
4) CuO, А12Оз, FeO
4. Какие из приведенных утверждений верны?
А. Основные оксиды — это оксиды, которым соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими
2) основными
3) амфотерными
4) кислотными
6. Формулы только кислотных оксидов записаны в ряду:
1) Na2O, MgO, AI2O3
2) ZnO, SnO РЬО2
3) CO2,SiO2,SO2
4) N2O,NO,CO
7. В каком ряду расположено вещество, которое не является кислотой?
В каком ряду расположено вещество, которое не является кислотой?
1) Н2С2О4, HCN, HSCN
2) H2S,H2SO3,H2SO4
3) HC1O2,HC1O3,HC1O4 .
4) HNO3.HNO2, H3N
8. Только солеобразующие оксиды находятся в ряду:
1) SeO3,SiO2,Cl2O7
2) N2O5,CO, SiO2
3) P2O5,NO,CO2
4) N2O3,Na2O,NO
9. В каком ряду приведены формулы только гидроксидов неметаллов?
1) H2SO4, HC1, HNO3
2) Н3РО4, H2SiO3, HCIO4
3) Н3ВО3, НАlO2, H2S
4) НСlO3, НВг, Н3РО3
10. В каком ряду приведены формулы только основных оксидов?
В каком ряду приведены формулы только основных оксидов?
1) А12О3, MgO, Na2O
2) N2O, CuO, ZnO
3) N2O5, CaO, K2O
4) FeO, Li2O, BaO
11. Кислотным является оксид, формула которого
1) СгО3
2) СаО
3) А12О3
4) NO
12. Только двухосновные кислоты расположены в ряду:
1) Н2СОз, Н3РО4, H3AsO3, HNO3
2) НС1O4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO,, H2SO4, H2Cr04
4) HMnO4, H3As04 H2BeO4, H2ZnO2
13. Только кислоты расположены в ряду
1) НNО3, Са(OH)2, NО2
2) КНСОз, Ba(HSO4)2, ZnOHCl
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
14. Несолеобразующим оксидом является
Несолеобразующим оксидом является
1} N2O5 2) NO2 3) N2O3 4) NO
15. Амфотерным оксидом является
1) оксид серы (IV)
2) оксид алюминия
3) оксид лития
4) оксид фосфора (V)
16. В перечне солей, формулы которых:
Mn(NO3)2, Mg(H2P04)2, A12(SO4)3, (NH4)2HP04, Na2SO3,
(NH4)2S, BaSiO3
число средних солей равно
1) 6 2) 5 3) 3 4) 4
17. Вещество СН3 — О — СН3 относится к
1) алканам
2) сложным эфирам
3) спиртам
4) простым эфирам
18. В перечне солей, формулы которых:
Ag2CO3, NaHS, Cu(NO3)2, Fe2(SO4)3, Ca(HCO3)2, KH2PO4, KMnO4, число кислых солей равно
1) 5 2) 2 3) 3 4) 4
19. Аминокислотой является
Аминокислотой является
1) анилин
2) стирол
3) глицин
4) валериановая кислота
20. К кислым солям относится
1) (NH4)2SO4 2) Fe(OH)SO4 3) KHSO4 4) HCOONa
21. К амфотерньм оксидам не относится
1) А12O3 2) ВеО 3) FeO 4) ZnO
22. Формулы кислотного оксида, кислоты и соли соответственно записаны в ряду:
1} CaO, HC1, СаСl2,
2) SO2, H2S, NaHSO4
3) SO2, A12(SO4)3, HNO3
4) ZnO, Zn(OH)2, H2S
23. Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
1) Na2SiO3, КОН, К2O
2} Са(ОН)2, H2S, СаО
3) HF, Mg(OH)2, ВаО
4) H2S04, Ва(ОН)г, SiO2
24. Амфотерными соединениями являются
Амфотерными соединениями являются
1) глюкоза и соляная кислота
2) бутанол-1 и гидроксид натрия
3) аминокислота и гидроксид цинка
4) муравьиная кислота и серная кислота
25. Амфотерным оксидом является
I) СаО 2) СгО3 3) FeO 4) Сr2О3
26. Какой из элементов может образовать кислотный оксид?
1)стронций
2)марганец
3)кальций
4)магний
| 27.Кислотой является |
1) NaH 2) Sih5 3) HI 4) NH3
28. Солью является
1) СаН2 2) РС1з 3) [CНзNНз]С1 4) СНзOH
29. Амфотерен оксид
Амфотерен оксид
1) бора 2) бериллия 3) цезия 4) кремния
30. Несолеобразующим является оксид
1) азота(I) 2) хрома(II) 3) хлора(III) 4) кремния(IV)
Ответы: 1-2, 2-2, 3-1, 4-3, 5-4, 6-3, 7-4, 8-1, 9-2, 10-4, 11-1, 12-3,
13-3, 14-4, 15-2, 16-2, 17-4, 18-3, 19-3, 20-3, 21-3, 22-2, 23-3, 24-3, 24-3, 25-4, 26-2, 27-3, 28-3, 29-2, 30-1.
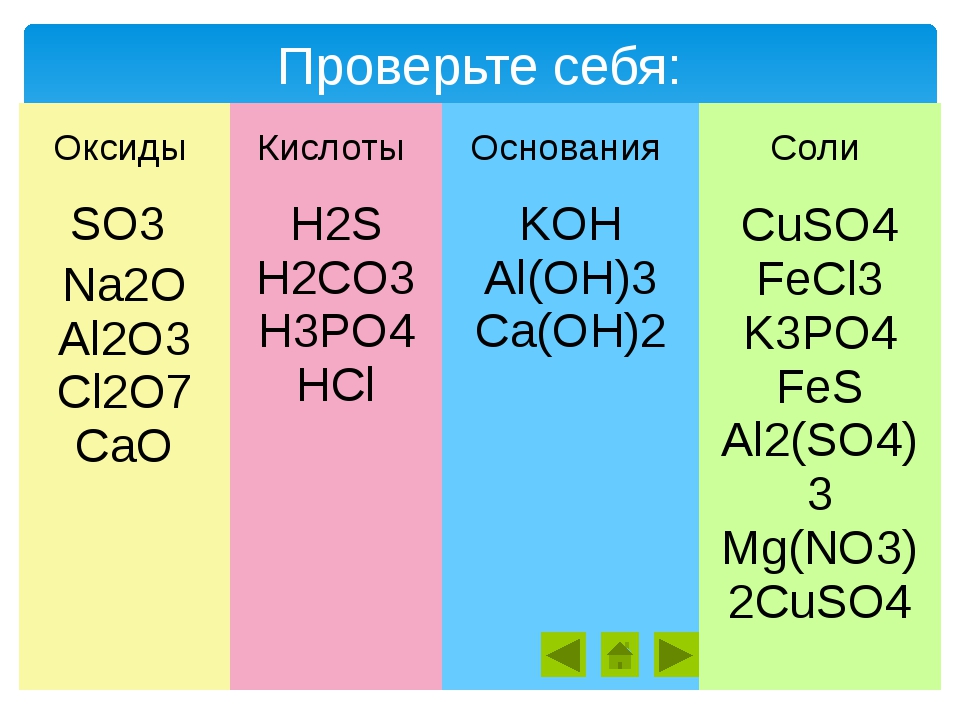
ЕГЭ по химии. А 6. Классификация веществ. Ответы. на Сёзнайке.ру
Многообразие неорганических веществ. Классификация неорганических веществ. Классификация органических веществ. Систематическая номенклатура.
1. Амфотерным и основным оксидами соответственно являются:
1) FeO и CaO
2) А12Оз и К2О
3) CO2 и NO
4) Fe2O3 и CO
2. Какой из элементов может образовать кислотный оксид?
1) стронций 2) марганец 3) кальций 4) магний
3. Только кислотные оксиды расположены в ряду:
Только кислотные оксиды расположены в ряду:
1) СО2, Mn2O7, SO2
2) Na2O, SiO2, Сг2Оз
3) CrO.SQ2, CaO
4) CuO, А12Оз, FeO
4. Какие из приведенных утверждений верны?
А. Основные оксиды — это оксиды, которым соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими
2) основными
3) амфотерными
4) кислотными
6. Формулы только кислотных оксидов записаны в ряду:
1) Na2O, MgO, AI2O3
2) ZnO, SnO РЬО2
3) CO2,SiO2,SO2
4) N2O,NO,CO
7. В каком ряду расположено вещество, которое не является кислотой?
1) Н2С2О4, HCN, HSCN
2) H2S,H2SO3,H2SO4
3) HC1O2,HC1O3,HC1O4 .
4) HNO3.HNO2, H3N
8. Только солеобразующие оксиды находятся в ряду:
1) SeO3,SiO2,Cl2O7
2) N2O5,CO, SiO2
3) P2O5,NO,CO2
4) N2O3,Na2O,NO
9. В каком ряду приведены формулы только гидроксидов неметаллов?
1) H2SO4, HC1, HNO3
2) Н3РО4, H2SiO3, HCIO4
3) Н3ВО3, НАlO2, H2S
4) НСlO3, НВг, Н3РО3
10. В каком ряду приведены формулы только основных оксидов?
1) А12О3, MgO, Na2O
2) N2O, CuO, ZnO
3) N2O5, CaO, K2O
4) FeO, Li2O, BaO
11. Кислотным является оксид, формула которого
1) СгО3
2) СаО
3) А12О3
4) NO
12. Только двухосновные кислоты расположены в ряду:
Только двухосновные кислоты расположены в ряду:
1) Н2СОз, Н3РО4, H3AsO3, HNO3
2) НС1O4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO,, H2SO4, H2Cr04
4) HMnO4, H3As04 H2BeO4, H2ZnO2
13. Только кислоты расположены в ряду
1) НNО3, Са(OH)2, NО2
2) КНСОз, Ba(HSO4)2, ZnOHCl
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
14. Несолеобразующим оксидом является
1} N2O5 2) NO2 3) N2O3 4) NO
15. Амфотерным оксидом является
1) оксид серы (IV)
2) оксид алюминия
3) оксид лития
4) оксид фосфора (V)
16. В перечне солей, формулы которых:
В перечне солей, формулы которых:
Mn(NO3)2, Mg(H2P04)2, A12(SO4)3, (NH4)2HP04, Na2SO3,
(NH4)2S, BaSiO3
число средних солей равно
1) 6 2) 5 3) 3 4) 4
17. Вещество СН3 — О — СН3 относится к
1) алканам
2) сложным эфирам
3) спиртам
4) простым эфирам
18. В перечне солей, формулы которых:
Ag2CO3, NaHS, Cu(NO3)2, Fe2(SO4)3, Ca(HCO3)2, KH2PO4, KMnO4, число кислых солей равно
1) 5 2) 2 3) 3 4) 4
19. Аминокислотой является
1) анилин
2) стирол
3) глицин
4) валериановая кислота
20. К кислым солям относится
К кислым солям относится
1) (NH4)2SO4 2) Fe(OH)SO4 3) KHSO4 4) HCOONa
21. К амфотерньм оксидам не относится
1) А12O3 2) ВеО 3) FeO 4) ZnO
22. Формулы кислотного оксида, кислоты и соли соответственно записаны в ряду:
1} CaO, HC1, СаСl2,
2) SO2, H2S, NaHSO4
3) SO2, A12(SO4)3, HNO3
4) ZnO, Zn(OH)2, H2S
23. Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
1) Na2SiO3, КОН, К2O
2} Са(ОН)2, H2S, СаО
3) HF, Mg(OH)2, ВаО
4) H2S04, Ва(ОН)г, SiO2
24. Амфотерными соединениями являются
1) глюкоза и соляная кислота
2) бутанол-1 и гидроксид натрия
3) аминокислота и гидроксид цинка
4) муравьиная кислота и серная кислота
25. Амфотерным оксидом является
Амфотерным оксидом является
I) СаО 2) СгО3 3) FeO 4) Сr2О3
26. Какой из элементов может образовать кислотный оксид?
1)стронций
2)марганец
3)кальций
4)магний
| 27.Кислотой является |
1) NaH 2) Sih5 3) HI 4) NH3
28. Солью является
1) СаН2 2) РС1з 3) [CНзNНз]С1 4) СНзOH
29. Амфотерен оксид
1) бора 2) бериллия 3) цезия 4) кремния
30. Несолеобразующим является оксид
1) азота(I) 2) хрома(II) 3) хлора(III) 4) кремния(IV)
Ответы: 1-2, 2-2, 3-1, 4-3, 5-4, 6-3, 7-4, 8-1, 9-2, 10-4, 11-1, 12-3,
13-3, 14-4, 15-2, 16-2, 17-4, 18-3, 19-3, 20-3, 21-3, 22-2, 23-3, 24-3, 24-3, 25-4, 26-2, 27-3, 28-3, 29-2, 30-1.
Оксид бериллия – обзор
26.6 Соединения металлов группы I и группы II
a. Оксиды и гидроксиды. За исключением амфотерного оксида бериллия BeO, все оксиды металлов групп I и II являются сильно основными. Все оксиды щелочных металлов энергично реагируют с водой с образованием гидроксидов.
M2O(s)+h3O(l)→2MOH(aq) (M=Li,Na,K,Rb,Cs)
Оксид бериллия практически не реагирует с водой. Оксид магния реагирует медленно и не очень энергично, но оксиды кальция, стронция и бария соединяются с водой все более энергично.
MO(s)+h3O(l)→M(OH)2(s) (M=Mg,Ca,Sr,Ba)
Гидроксиды щелочных металлов представляют собой белые водорастворимые твердые вещества. Все, кроме гидроксида лития, термически стабильны и могут плавиться и испаряться без разложения. При нагревании гидроксид лития разлагается до достижения температуры кипения с образованием оксида лития и воды. Гидроксиды щелочных металлов являются наиболее основными гидроксидами металлов. Их водные растворы поглощают углекислый газ из воздуха с образованием карбонатов.
Их водные растворы поглощают углекислый газ из воздуха с образованием карбонатов.
2MOH(aq) +CO2(g)→M2(CO3)+h3O(l) (M=Li,Na,K,Rb,Cs)
Гидроксиды элементов группы II гораздо менее растворимы, чем щелочные металлов, растворимость увеличивается от Be(OH) 2 до Ba(OH) 2 в соответствии с уменьшением притяжения между катионом и гидроксид-ионом в кристалле.Щелочность растворов этих гидроксидов лимитируется их растворимостью.
Многие соединения щелочных и щелочноземельных металлов важны из-за их коммерческого применения. В табл. 26.7 перечислены некоторые из этих соединений. Гидроксид натрия, NaOH, занимает шестое место в списке промышленных химикатов, производимых в самых больших количествах. Его получают в промышленных масштабах двумя способами. В одном процессе эквивалентные количества карбоната натрия и гидроксида кальция смешивают в виде суспензии.
ТАБЛИЦА 26.7. Некоторые коммерчески важные соединения щелочных и щелочноземельных металлов и их применение
CO 2 (CATASH) Общие названия приведены в скобках. | |||
|---|---|---|---|
| NaOH A (Lye, каустическая сода) (Lye, каустическая сода) (LIE, каустическая газировка) | мыла и моющие средства | ||
| NA 2 CO 3 A (SALA SALA) | STALL | ||
| Промышленные химические вещества | |||
| моющие средства и моющие средства | |||
| Nahco 3 (пищевая сода) | еды промышленности | ||
| домашнее использование | |||
| промышленного химиката | |||
| CAO A и Ca(OH) 2 (гашеная известь) | Раствор, штукатурка и цемент T | ||
| Pulp и бумажная промышленность | |||
| Отбеливающий порошок | |||
| KOH (каустическая калийная) | K 2 CO 3 | ||
| жидкостных мыла | |||
| тетрапотациальные пирофосфаты (моющие средства) | |||
| K 2 | |||
| стекло | |||
| KNO 3 | GUROPOWDER | ||
| KCL (MUBITE OF CATASH) | Удобрение Соли | ||
| MGO (Magnesia) | Огнеупорные изоляционные бумаги производства | ||
| MGSO 4 ⋅7H 2 o (EPSOM соль) | Дубление кожи | ||
| Морилка | |||
| Лекарства | |||
| Удобрения |
Na2CO3(водн. )+Ca(OH)2(водн.)→2NaOH(водн.)+CaCOa(s)
)+Ca(OH)2(водн.)→2NaOH(водн.)+CaCOa(s)
Гидроксид калия, КОН, можно получить способами, аналогичными тем, которые описаны для соединения натрия. Например, реакция между растворами гидроксида бария и сульфата калия дает сульфат бария в виде осадка и гидроксид калия в растворе.
Ba(OH)2(водн.)+K2SO4(водн.) → 2KOH(водн.)+BaSO4(S) в меньшей степени являются соединениями промышленного значения.Они являются сильными окислителями и отбеливателями и образуют перекись водорода при контакте с холодными растворами кислот или с избытком холодной воды.
Na2O2(т)+2h3O(ж)→h3O2(вод)+2NaOH(вод)2KO2(т)+2h3O(ж)→h3O2(вод)+O2(г)+2KOH(вод)
Супероксид калия используется в «дышащих» масках в качестве быстрого источника кислорода. Такие маски используются при спасательных работах в шахтах и в других местах, где воздух настолько беден кислородом, что приходится создавать искусственную атмосферу. Влага дыхания вступает в реакцию с оксидом, высвобождая кислород, и в то же время образующийся гидроксид калия удаляет углекислый газ при выдохе, позволяя атмосфере в маске непрерывно восстанавливаться.
Такие маски используются при спасательных работах в шахтах и в других местах, где воздух настолько беден кислородом, что приходится создавать искусственную атмосферу. Влага дыхания вступает в реакцию с оксидом, высвобождая кислород, и в то же время образующийся гидроксид калия удаляет углекислый газ при выдохе, позволяя атмосфере в маске непрерывно восстанавливаться.
С промышленной точки зрения наиболее важным среди оксидов металлов групп I и II является оксид кальция CaO, который широко известен как известь или негашеная известь. Это самый дешевый источник гидроксид-иона и среди промышленных химикатов уступает только серной кислоте по объему производства. Известь получают нагреванием известняка для отделения CO 2 .
CaCO3(s)известняк→ΔCaO(s)известь+CO2(g)
Некоторые товарные сорта извести представляют собой смеси оксида кальция и оксида магния.Такие смеси получают нагреванием доломитового известняка, содержащего карбонат магния вместе с карбонатом кальция.
Гидроксид кальция, Ca(OH) 2 , продукт реакции воды с оксидом кальция, известен как гашеная известь , а насыщенный раствор гидроксида кальция (который малорастворим) называется известковой водой. Оксид и гидроксид используются, иногда взаимозаменяемо, во многих отношениях (таблица 26.7).
Раствор представляет собой смесь Ca(OH) 2 , песка и воды.Он схватывается, потому что Ca(OH) 2 поглощает CO 2 из воздуха.
Ca(OH)2(водн.)+CO2(г)→CaCO3(т)+h3O(г)
Образующиеся кристаллы CaCO 3 склонны сцепляться и связывать массу вместе. Песок добавляется для придания объема и предотвращения чрезмерной усадки.
б. Карбонаты и гидрокарбонаты. Карбонаты щелочных металлов, за исключением карбоната лития, хорошо растворимы в воде, тогда как карбонаты элементов II группы (и большинство других карбонатов) практически нерастворимы в воде.Водные растворы растворимых карбонатов являются щелочными из-за гидролиза карбонат-иона,
CO32-карбонат ион+h3O(l)⇌HCO3- гидрокарбонат ион+OH-
Карбонаты металлов реагируют с сильнокислыми растворами с образованием диоксида углерода, для например,
MgCO3(т)+2H+→Mg2++CO2(г)+h3O(ж)
Нерастворимые карбонаты переводятся в раствор водой, содержащей растворенный диоксид углерода, по следующей реакции, обратной термическому разложению гидрокарбонатов твердых металлов:
MCO3(тв)+h3O(ж)+CO2(г)⇄M2++2HCO3−
Грунтовые воды всегда содержат углекислый газ, а известняк и доломит растворяются в такой воде,
CaCO3⋅MgCO3 (s)доломит+2h3O(l)+2CO2(aq)⇄Ca2++Mg2++4HCO3−
Кальций и магний, введенные таким образом в раствор, делают воду «жесткой» (раздел 13. 13).
13).
Растворение карбонатных минералов в подземных водах имеет еще один интересный эффект — если минерал находится ниже поверхности Земли и покрыт нерастворимыми породами, может образоваться пещера. Затем грунтовые воды могут просачиваться в пещеру через трещины в стенах или крыше. Вода содержит гидрокарбонаты кальция и магния, которые она растворила в другом месте, и когда она входит в пещеру, давление на нее заметно снижается, и углекислый газ выходит из нее в результате обратной реакции, показанной выше.Таким образом образуются нерастворимые карбонаты кальция и магния, которые откладываются вокруг отверстия, через которое вода просачивалась в пещеру, образуя сосулькообразные отложения, называемые сталактитами . Часть бикарбоната остается в растворе до тех пор, пока с кончика сталактита не начнут падать капли воды. Бикарбонат разлагается по мере падения капель и образует отложения на дне пещеры, образуя еще одну «сосульку», называемую сталагмитом . По прошествии многих столетий вершины сталактита и сталагмита встречаются, и две «сосульки» вырастают в колонну, которую, можно подумать, оставили там, чтобы поддерживать крышу пещеры.
Среди карбонатов и гидрокарбонатов групп I и II наиболее широко используемыми соединениями являются карбонат натрия и гидрокарбонат натрия. В 1938 году в Вайоминге были обнаружены очень крупные месторождения относительно редкого минерала trona , Na 2 CO 3 ⋅ NaHCO 3 ⋅ 2H 2 O , и большая часть карбоната натрия теперь производится из этого минерала. . Трону либо сначала очищают кристаллизацией, а затем нагревают для превращения гидрокарбоната натрия в нормальный карбонат, либо сначала проводят нагревание, а затем очищают нечистый карбонат натрия.
Гидрокарбонат натрия, также известный как бикарбонат натрия или бикарбонат соды, получают из чистого карбоната натрия
Na2CO3(aq)+h3O(l)+CO2(g)→2NaHCO3(s) в продаже как кальцинированная сода (табл. 26.7). Карбонат также существует в виде ряда гидратов, наиболее распространенным из которых является декагидрат Na 2 CO 3 ⋅ 10H 2 O ( стиральная сода ). Растворы соли являются эффективными чистящими средствами из-за щелочности, возникающей в результате гидролиза карбонат-иона.Ион гидроксида отвечает за очищающее действие.
Растворы соли являются эффективными чистящими средствами из-за щелочности, возникающей в результате гидролиза карбонат-иона.Ион гидроксида отвечает за очищающее действие.
Бикарбонат натрия используется в разрыхлителях в качестве разрыхлителя, вещества, которое образует пузырьки газа в тесте. Отсюда и его общее название: пищевая сода . Кислотное вещество должно присутствовать в тесте, чтобы высвободить углекислый газ в результате следующей реакции легкость и текстура.Кислое молоко часто является источником кислоты. Некоторые рецепты требуют использования разрыхлителя. Эти порошки представляют собой смеси гидрокарбоната натрия и кислого вещества, например, квасцов натрия (алюмосульфат натрия), NaAl(SO 4 ) 2 ⋅ 12H 2 O; дигидрофосфат кальция, Ca(H 2 PO 4 ) 2 ; или гидротартрат калия, K(HC 4 H 4 O 6 ). Разрыхлитель «двойного действия» стал возможен благодаря покрытым кристаллам Ca(H 2 PO 4 ) 2 ; они высвобождают около половины своего иона H + во время перемешивания и половину во время выпекания.
Структуры и стабильность нанокластеров оксидов щелочноземельных металлов: исследование ТФП используя функционал LDA-PWC. Было обнаружено, что среди структур-кандидатов изомеры на основе гексагонального кольца и пластинчатые формы демонстрируют аналогичную стабильность. Было обнаружено, что стопки гексагональных колец (MO)
3 являются слегка предпочтительной стратегией роста среди изомеров (MgO) 6 .Напротив, пластинчатые структуры несколько предпочтительнее для других кластеров оксида щелочного металла (МО) 6 . Было предложено объяснение, основанное на аргументах упаковки и ароматичности. Это исследование может иметь важные последствия для моделирования и понимания начальных моделей роста малых наноструктур щелочноземельных металлов.1. Введение
В последние несколько лет значительные усилия были направлены на понимание металлических и полупроводниковых кластеров.Кластеры представляют собой агрегаты атомов или молекул, промежуточные по размеру между отдельными атомами и объемным веществом, и их исследования предоставляют интересный способ разработки материалов с различными свойствами путем изменения размера и формы. Таким образом, исследования свойств кластеров в зависимости от размера в последние годы получили известность. Несмотря на значительный прогресс в изучении кластеров металлов и полупроводников, частицы оксидов металлов часто рассматриваются как объемные фрагменты. Однако в малых кластерах их структура и свойства могут быть совершенно иными [1–4].
Таким образом, исследования свойств кластеров в зависимости от размера в последние годы получили известность. Несмотря на значительный прогресс в изучении кластеров металлов и полупроводников, частицы оксидов металлов часто рассматриваются как объемные фрагменты. Однако в малых кластерах их структура и свойства могут быть совершенно иными [1–4].
В данной работе проведено сравнительное исследование структуры, стабильности и свойств некоторых оксидов щелочноземельных металлов (, , , и ). Оксид магния кристаллизуется в структуре каменной соли и обладает некоторыми типичными полупроводниковыми свойствами, такими как широкая валентная зона (~6 эВ), большая диэлектрическая проницаемость (9,8) и малая энергия связи экситона (<0,1 эВ). Для массивного MgO экспериментальное значение ширины запрещенной зоны составляет 7,8 эВ [5]. Он близок к идеальному изолирующему ионному твердому телу со структурой валентной зоны, в которой преобладает сильный потенциал ионных ядер.Исследования электронных свойств MgO мотивированы его технологическими применениями, такими как катализ, микроэлектроника и электрохимия. Объемный MgO относительно инертен, но его реакционная способность значительно увеличивается в наномасштабе. Большая площадь поверхности и присущая нанокристаллам MgO высокая поверхностная реакционная способность делают эти материалы особенно эффективными в качестве адсорбентов [6]. Фактически, они были названы «деструктивными адсорбентами» из-за их склонности адсорбировать и одновременно разрушать посредством процессов разрыва связи ряд токсичных химических веществ [6–9].
Объемный MgO относительно инертен, но его реакционная способность значительно увеличивается в наномасштабе. Большая площадь поверхности и присущая нанокристаллам MgO высокая поверхностная реакционная способность делают эти материалы особенно эффективными в качестве адсорбентов [6]. Фактически, они были названы «деструктивными адсорбентами» из-за их склонности адсорбировать и одновременно разрушать посредством процессов разрыва связи ряд токсичных химических веществ [6–9].
Интересно изучить подобную систему, такую как оксид кальция, чтобы оценить, являются ли эти тенденции общей чертой кластеров оксидов щелочноземельных металлов или нет. С теоретической точки зрения, Ca 2+ больше, чем Mg 2+ , поэтому можно ожидать, что эффекты размера ионов будут играть важную роль в определении структурных различий. Кроме того, Ca 2+ примерно в шесть раз поляризуемее, чем Mg 2+ , а поляризуемость анионов оксида также больше в CaO, поскольку связь слабее, чем в MgO. Оксид кальция также кристаллизуется в плотноупакованной структуре «каменная соль» и представляет собой преимущественно ионный материал с некоторой степенью ковалентности в его связях. С теоретической точки зрения он считается прототипом оксида с широкой запрещенной зоной (7,1 эВ) [10] и высокой диэлектрической проницаемостью (11,8). Кроме того, расчеты зонной структуры в приближении локальной плотности предсказали полуметаллическое ферромагнитное основное состояние CaO [11]. Нанокристаллический CaO используется в качестве абсорбента для удаления ХПК из сточных вод бумажной фабрики [12].
Оксид кальция также кристаллизуется в плотноупакованной структуре «каменная соль» и представляет собой преимущественно ионный материал с некоторой степенью ковалентности в его связях. С теоретической точки зрения он считается прототипом оксида с широкой запрещенной зоной (7,1 эВ) [10] и высокой диэлектрической проницаемостью (11,8). Кроме того, расчеты зонной структуры в приближении локальной плотности предсказали полуметаллическое ферромагнитное основное состояние CaO [11]. Нанокристаллический CaO используется в качестве абсорбента для удаления ХПК из сточных вод бумажной фабрики [12].
Оксид бария представляет собой оксид с интересными электронными и структурными свойствами. Он также является предшественником сегнетоэлектрического оксида перовскита BaTiO 3 и компонентом мантии Земли. Углеродные нанотрубки, покрытые оксидом бария-стронция, служат эмиттерами поля [13].
Теоретическая работа по ионным материалам была сосредоточена в основном на семействе галогенидов щелочных металлов, а исследования кластеров оксидов металлов были сравнительно немногочисленны, несмотря на их важность во многих областях физики поверхности, таких как гетерогенный катализ или коррозия. Сообщалось о масс-спектрах и данных о фрагментации, вызванной столкновениями, для стехиометрических и кластерных ионов [14, 15]. Также опубликованы масс-спектры кластерных ионов [16] и экспериментальные измерения нескольких однократно и дважды ионизированных кластерных ионов MgO и CaO методом времяпролетной масс-спектрометрии с лазерной ионизацией [17–20]. Простые ионные модели, основанные на феноменологических парных потенциалах, использовались для объяснения глобальных тенденций, обнаруженных в этих экспериментах [17–20]. Было представлено несколько ab initio расчетов стехиометрических кластеров MgO [21–32], но рост этих кластеров до сих пор недостаточно изучен.
Сообщалось о масс-спектрах и данных о фрагментации, вызванной столкновениями, для стехиометрических и кластерных ионов [14, 15]. Также опубликованы масс-спектры кластерных ионов [16] и экспериментальные измерения нескольких однократно и дважды ионизированных кластерных ионов MgO и CaO методом времяпролетной масс-спектрометрии с лазерной ионизацией [17–20]. Простые ионные модели, основанные на феноменологических парных потенциалах, использовались для объяснения глобальных тенденций, обнаруженных в этих экспериментах [17–20]. Было представлено несколько ab initio расчетов стехиометрических кластеров MgO [21–32], но рост этих кластеров до сих пор недостаточно изучен.
Мы стремимся изучить электронные свойства кластеров этих оксидов щелочноземельных металлов, используя подход функционала плотности.
2. Детали вычислений
В расчетах, представленных в статье, расчеты функционала плотности (DF) из первых принципов выполнялись с использованием кода DMol [5] [33–36], доступного в Accelrys Inc.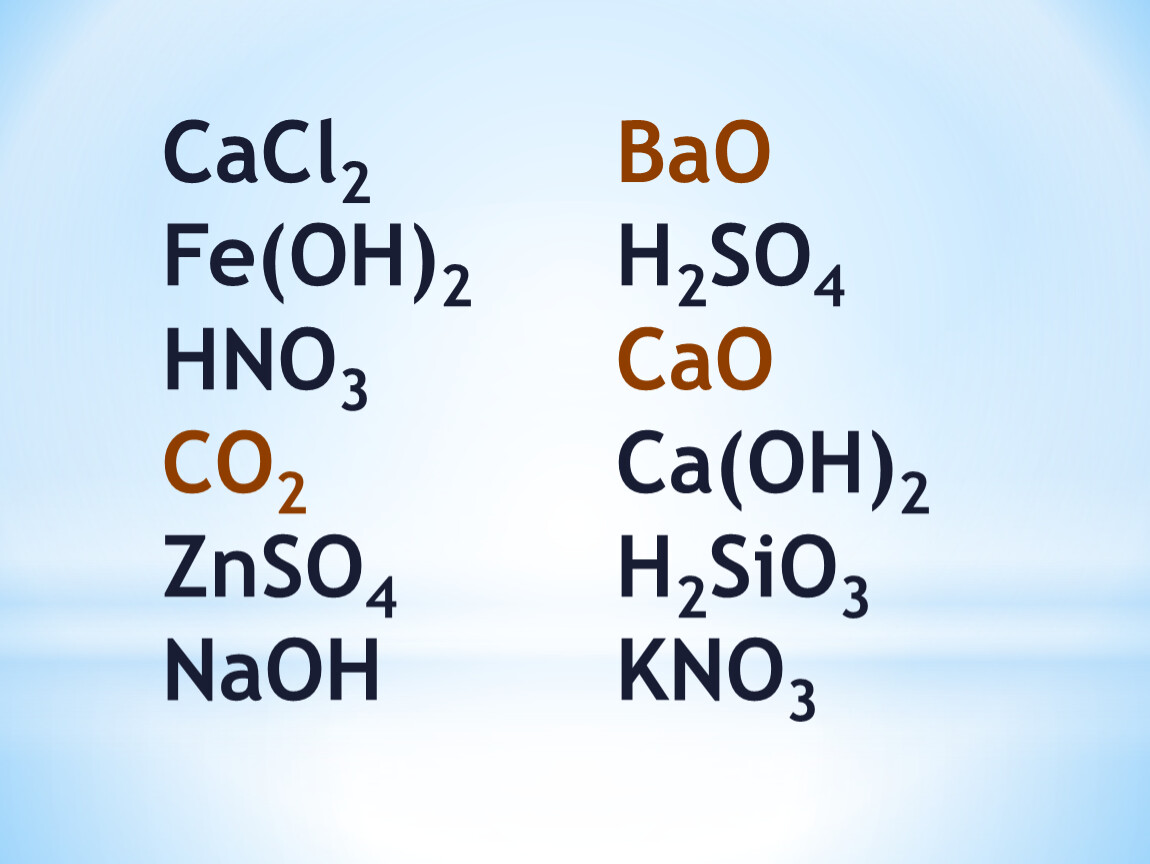 в Materials Studio 3.2. упаковка. Расчеты DFT проводились с использованием как приближения обобщенного градиента (GGA) с функционалом PW91 [37], так и приближения локальной плотности (LDA) с функционалом PWC (локальная корреляция Пердью-Ванга) [38].Гибридные функционалы, такие как B3LYP, хотя и более точны для энергий диссоциации оксидов металлов, не могут быть эффективно использованы с плоскими волнами и, следовательно, бесполезны для расчетов твердых материалов [39]. В наших расчетах для описания валентных орбиталей использовались числовые базисные наборы двойного качества ζ плюс поляризационные функции (DNP). Этот базисный набор является числовым эквивалентом базиса Гаусса, 6-31G**. Ядра Ba 2+ и Sr 2+ были обработаны полностью электронно.
в Materials Studio 3.2. упаковка. Расчеты DFT проводились с использованием как приближения обобщенного градиента (GGA) с функционалом PW91 [37], так и приближения локальной плотности (LDA) с функционалом PWC (локальная корреляция Пердью-Ванга) [38].Гибридные функционалы, такие как B3LYP, хотя и более точны для энергий диссоциации оксидов металлов, не могут быть эффективно использованы с плоскими волнами и, следовательно, бесполезны для расчетов твердых материалов [39]. В наших расчетах для описания валентных орбиталей использовались числовые базисные наборы двойного качества ζ плюс поляризационные функции (DNP). Этот базисный набор является числовым эквивалентом базиса Гаусса, 6-31G**. Ядра Ba 2+ и Sr 2+ были обработаны полностью электронно.
Выполнена полная оптимизация геометрии для всех конструкций. Положения атомов были релаксированы для достижения минимальной энергии, пока энергия системы не сошлась к 2 × 10 -5 Га, а градиент к 0,004Га Å -1 . Допуск SCF был установлен на уровне 1 × 10 -5 , а максимальное смещение — на уровне 0,005 Å. Также были рассчитаны энергии связи (BE), промежутки между высшей занятой молекулярной орбиталью (HOMO) и низшей незанятой молекулярной орбиталью (LUMO), энергии Ферми и плотность состояний.Приведенные значения энергии связи были скорректированы с учетом энергий нулевых колебаний.
Допуск SCF был установлен на уровне 1 × 10 -5 , а максимальное смещение — на уровне 0,005 Å. Также были рассчитаны энергии связи (BE), промежутки между высшей занятой молекулярной орбиталью (HOMO) и низшей незанятой молекулярной орбиталью (LUMO), энергии Ферми и плотность состояний.Приведенные значения энергии связи были скорректированы с учетом энергий нулевых колебаний.
3. Результаты
Различные структуры, включая пластинчатую, гексагональную, восьмиугольную, лестничную и другие типы, были изучены для различного количества формульных единиц четырех оксидов щелочноземельных металлов. В литературе сообщалось о различных теоретических исследованиях на разных уровнях расчетов [1, 2, 29, 32, 40–42], но нет четкого единого мнения относительно пригодности LDA, GGA или гибридных функционалов для расчетов на оксиде металла. нанокластеры.Поэтому мы сначала сравнили результаты для молекулярной формы MgO, полученные разными методами, с экспериментальными количествами.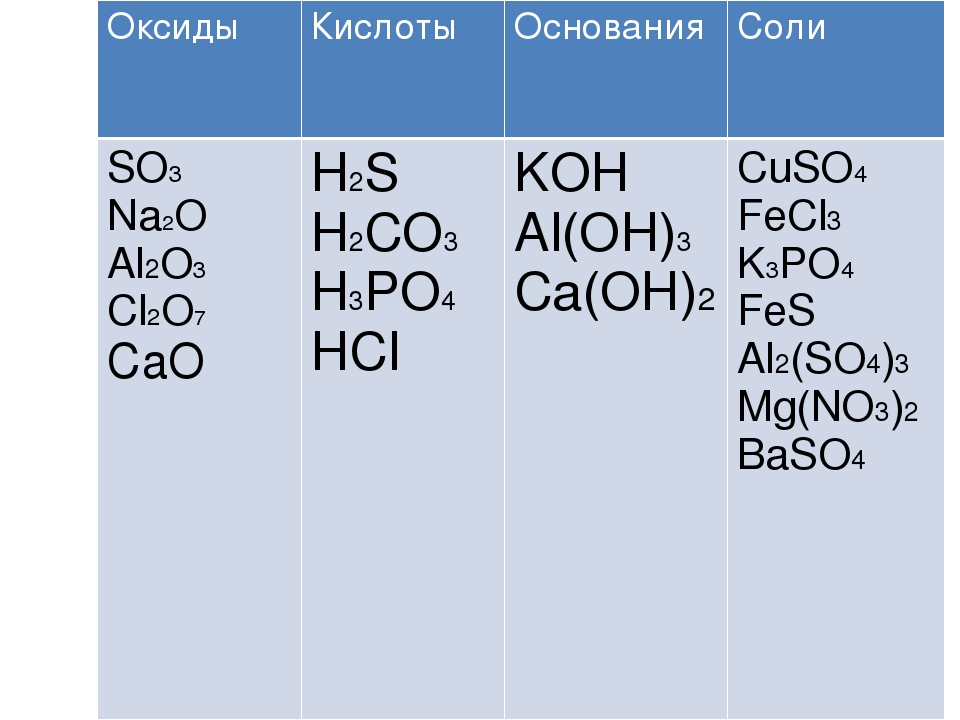 Расчетные значения LDA-PWC, GGA-PW91, B3LYP [40, 41] и MP4 [40, 41] для энергии связи составляют 3,69, 3,22, 2,03 и 3,22 эВ соответственно. Последние три не дотягивают до экспериментального значения [43] 3,57 эВ. Результат LDA намного превосходит другие расчеты, хотя его тенденция к избыточному связыванию очевидна из результата. Точно так же вычисленные длины связи Mg-O равны 1.743, 1,767 и 1,756 Å соответственно для расчетов LDA-PWC, GGA-PW91 и B3LYP [40, 41] по сравнению с экспериментальным [30, 31, 43] значением 1,749 Å. Здесь снова наш результат LDA показывает наилучшее соответствие с экспериментом. Расчетные частоты колебаний составляют 751 см −1 (LDA) и 719 см −1 (GGA) по сравнению с наблюдаемым [43] значением 785 см −1 .
Расчетные значения LDA-PWC, GGA-PW91, B3LYP [40, 41] и MP4 [40, 41] для энергии связи составляют 3,69, 3,22, 2,03 и 3,22 эВ соответственно. Последние три не дотягивают до экспериментального значения [43] 3,57 эВ. Результат LDA намного превосходит другие расчеты, хотя его тенденция к избыточному связыванию очевидна из результата. Точно так же вычисленные длины связи Mg-O равны 1.743, 1,767 и 1,756 Å соответственно для расчетов LDA-PWC, GGA-PW91 и B3LYP [40, 41] по сравнению с экспериментальным [30, 31, 43] значением 1,749 Å. Здесь снова наш результат LDA показывает наилучшее соответствие с экспериментом. Расчетные частоты колебаний составляют 751 см −1 (LDA) и 719 см −1 (GGA) по сравнению с наблюдаемым [43] значением 785 см −1 .
Для CaO также расчетная энергия связи LDA-PWC (5,08 эВ) лучше согласуется с экспериментальным [43] значением 4.76 эВ, чем значение B3LYP/6-311G(2d) [40, 41] (4,28 эВ). Хотя значение GGA-PW91 (4,55 эВ) немного лучше согласуется с экспериментом, расстояние связи LDA Ca–O (1,818 Å) прекрасно согласуется с экспериментальным [43] значением (1,822 Å), а значение GGA составляет значительно больше (1,843 Å), что отражает тенденцию GGA к недостаточному связыванию. Поэтому в остальной части статьи мы приводим результаты LDA, но мы также предлагаем сравнение с нашими расчетными результатами GGA.
Поэтому в остальной части статьи мы приводим результаты LDA, но мы также предлагаем сравнение с нашими расчетными результатами GGA.
3.1. Стабильность конструкций
(MO) 2 Где M = Mg, Ca, Sr, Ba. Оптимизированные структуры имеют форму ромба и плоские (рис. 1). Угол вокруг магния тупой (95,7 °) в (MgO) 2 , что указывает на перекрывающееся отталкивание между большими ионами кислорода в непосредственной близости, поскольку размер катиона мал. Однако для CaO валентные углы острые (∠OCaO = 86,4°). Валентный угол вокруг иона металла уменьшается с увеличением атомного номера иона металла (∠OSrO = 82,7°, ∠OBaO = 79,3°) параллельно с увеличением ионных радиусов ионов металлов.Металлические радиусы для Mg, Ca, Sr и Ba составляют 1,60, 1,97, 2,15 и 2,17 Å соответственно, тогда как радиусы соответствующих катионов M 2+ составляют 0,65, 0,97, 1,15 и 1,35 Å [44] . Атомный и ионный радиусы O и решетки O 2− составляют 0,66 и 1,40 Å соответственно. Оптимизированные расстояния связи M–O составляют 1,858, 2,005, 2,140 и 2,277 Å соответственно для M = Mg, Ca, Sr и Ba, которые меньше суммы ионных радиусов M 2+ и O 2− , что указывает на то, что эти связи не являются чисто ионными.Напротив, наблюдаемые расстояния связи M–O в ионных кристаллах оксидов металлов составляют 2,106, 2,405, 2,565 и 2,762 Å соответственно. Соответствующие значения газовой фазы [43] для двухатомных частиц составляют 1,749, 1,822, 1,920 и 1,940 Å соответственно. Оптимизированные расстояния связи M–O несколько ближе к значениям для газовой фазы, чем к значениям для ионов. Расчетные заряды Малликена на ионах металлов составляют 0,930, 1,253, 0,959 и 0,943 соответственно. Ввиду того факта, что заряды металла и кислорода близки к +1 и -1 соответственно, ожидается, что фактические ионные радиусы будут находиться между радиусами нейтрального состояния и двухвалентных ионов.Значения парциальных зарядов указывают на несколько более высокий ионный характер (CaO) 2 по сравнению с другими системами (MO) 2 .
Оптимизированные расстояния связи M–O составляют 1,858, 2,005, 2,140 и 2,277 Å соответственно для M = Mg, Ca, Sr и Ba, которые меньше суммы ионных радиусов M 2+ и O 2− , что указывает на то, что эти связи не являются чисто ионными.Напротив, наблюдаемые расстояния связи M–O в ионных кристаллах оксидов металлов составляют 2,106, 2,405, 2,565 и 2,762 Å соответственно. Соответствующие значения газовой фазы [43] для двухатомных частиц составляют 1,749, 1,822, 1,920 и 1,940 Å соответственно. Оптимизированные расстояния связи M–O несколько ближе к значениям для газовой фазы, чем к значениям для ионов. Расчетные заряды Малликена на ионах металлов составляют 0,930, 1,253, 0,959 и 0,943 соответственно. Ввиду того факта, что заряды металла и кислорода близки к +1 и -1 соответственно, ожидается, что фактические ионные радиусы будут находиться между радиусами нейтрального состояния и двухвалентных ионов.Значения парциальных зарядов указывают на несколько более высокий ионный характер (CaO) 2 по сравнению с другими системами (MO) 2 .
На рис. 1 представлены оптимизированные структуры для всех фрагментов (MO) 2 . На этом рисунке, как и на всех других рисунках, ионы металлов представлены зелеными шарами, а ионы оксидов — красными.
(MO) 3 Где M = Mg, Ca, Sr, Ba. В таблице 1 обобщены результаты для различных (MO) 3 исследованных систем.Здесь MO обозначает четыре оксида щелочных металлов: MgO, CaO, BaO и SrO. Для всех оксидов металлов исследованы две возможные структуры: лестничная и гексагональная.
-1,80 -1,70 -1,70
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3 (MgO) 3 . И лестничные, и гексагональные кольцевые исходные структуры оптимизированы до искаженной гексагональной формы с энергией связи −23,33 эВ (см. Таблицу 1 и Рисунок 2(a)). Хорошо известно, что кольцевые структуры (MgO) 3 являются конкурентными строительными блоками при росте очень малых кластеров MgO [29].Этот результат также согласуется с нашими более ранними расчетами [22, 23] для кластеров (MgO) 12 , которые оптимизировали для уложенных друг в друга колец из исходных кубических структур каменной соли.
В этой кольцевой структуре (рис. 2(a)) оптимизированный (LDA-PWC) валентный угол вокруг каждого кислорода составляет 103,9°, а вокруг каждого Mg — 136,1°. Расстояние связи Mg–O составляет 1,819 Å. Увеличение ∠OMgO означает отталкивание между атомами кислорода. Фактически расстояния O–O составляют 3,374 Å по сравнению с 2,866 Å для расстояния Mg–Mg.Порядки связи Mg–O составляют 0,872, что указывает на значительный ковалентный характер. Заряд Малликена для каждого кислорода равен -0,915. Это означает увеличение размера иона кислорода в системе по отношению к атому кислорода. Следовательно, энергия снижается за счет удержания ионов оксида друг от друга. Значения GGA-PW91 аналогичны, хотя расчетное расстояние связи Mg-O намного больше (1,843 Å), что отражает тенденцию GGA к недосвязыванию атомов. Эта структура имеет большую ширину запрещенной зоны (3,05 эВ), которая намного меньше, чем у массивного MgO [45–47].
(СаО) 3 . Однако для (CaO) 3 было обнаружено, что обе исходные структуры оптимизированы для разных геометрий. Расчеты LDA показывают, что лестничная структура несколько предпочтительнее, в то время как расчеты GGA предсказывают небольшой наклон в пользу гексагональной структуры (~ 0,1 эВ). Однако различия в энергии слишком малы, чтобы можно было сделать определенное заявление об относительной стабильности. В то время как ширина запрещенной зоны для гексагональной структуры равна 2.3 эВ, у лестничной структуры значительно меньше (1,8 эВ).
Расчеты LDA показывают, что лестничная структура несколько предпочтительнее, в то время как расчеты GGA предсказывают небольшой наклон в пользу гексагональной структуры (~ 0,1 эВ). Однако различия в энергии слишком малы, чтобы можно было сделать определенное заявление об относительной стабильности. В то время как ширина запрещенной зоны для гексагональной структуры равна 2.3 эВ, у лестничной структуры значительно меньше (1,8 эВ).
В лестничной структуре есть два типа атомов: центральные имеют координационное число 3, а внешние атомы имеют координацию только 2 и являются более ненасыщенными. В результате плотность заряда Малликена на внешних атомах Са составляет 1,249 по сравнению с 1,292 для центрального атома Са. Точно так же концевые двухкоординированные атомы кислорода имеют меньший отрицательный заряд (-1,240), а центральный имеет частичный заряд -1.311. Длина центральной связи также больше (2,294 Å) по сравнению с внешними (1,952 Å). Увеличение длины центральной связи можно объяснить усилением координации центральных ионов. Внешнее поле, создаваемое большим количеством окружающих ионов, увеличивает ионный характер центральной связи Ca–O, который напоминает предел решетки Ca–O (2,405 Å), в то время как концевые атомы ближе к молекулярному пределу (1,822 Å) . Ордера облигаций составляют 0,837 и 0,610 соответственно.Длины и порядки связи Ca–O составляют 2,059 Å и 0,566 соответственно на грани Ca–O–Ca и 2,108 Å и 0,662 на грани O–Ca–O. Опять же, это различие связано со значительным ионным радиусом O 2− , а на грани O–Ca–O есть два таких иона по сравнению с одним на противоположной грани.
Внешнее поле, создаваемое большим количеством окружающих ионов, увеличивает ионный характер центральной связи Ca–O, который напоминает предел решетки Ca–O (2,405 Å), в то время как концевые атомы ближе к молекулярному пределу (1,822 Å) . Ордера облигаций составляют 0,837 и 0,610 соответственно.Длины и порядки связи Ca–O составляют 2,059 Å и 0,566 соответственно на грани Ca–O–Ca и 2,108 Å и 0,662 на грани O–Ca–O. Опять же, это различие связано со значительным ионным радиусом O 2− , а на грани O–Ca–O есть два таких иона по сравнению с одним на противоположной грани.
На рис. 2(b) показаны оптимизированные структуры. Видно, что валентные углы у атомов кислорода в лестничной структуре тупые, а у кальция — острые.
(SrO) 3 . Для (SrO) 3 лестничная структура предпочтительнее на 0,16 эВ. В этой структуре (рис. 2(в)) внешний угол Sr–O–Sr тупой (101,0°), а валентный угол O–Sr–O острый (86,9°). Кратчайшими расстояниями связи Sr–O являются внешние, то есть между двумя 2-координатными узлами (2,107 Å), и соответствующий им порядок связи равен 1,128, а самой длинной связью является центральная связь (2,450 Å) с порядком связи всего 0,397. Заряды Малликена на атомах показывают поведение, подобное наблюдаемому для (CaO) 3 ; то есть заряды на , и равны 0.915, 1,055, -0,952 и -0,981 соответственно.
Заряды Малликена на атомах показывают поведение, подобное наблюдаемому для (CaO) 3 ; то есть заряды на , и равны 0.915, 1,055, -0,952 и -0,981 соответственно.
(BaO) 3 . Для (BaO) 3 снова получаются две разные структуры. Несколько предпочтительнее лестничная структура (на 0,12 эВ, см. табл. 1). Заряды Малликена на атомах показывают поведение, подобное наблюдаемому для (CaO) 3 и (SrO) 3 ; то есть заряды на , , и равны 0,880, 1,035, -0,915 и -0,965 соответственно. Наблюдается, что заряд центрального (3-координатного) иона металла уменьшается с увеличением атомного номера иона металла (-1.311, -0,981 и -0,965 для лестницы (CaO) 3 , (SrO) 3 и (BaO) 3 соответственно), что указывает на возрастающее участие d-орбиталей ионов металлов и, следовательно, увеличение ковалентность. Что касается SrO, внутренние связи Ba–O длиннее (2,512 Å) и имеют порядок связи всего 0,436, но внешние связи Ba–O короче (2,179 Å) и соответствующий порядок связи равен 1,160.
(MO) 4 Где M = Mg, Ca, Sr, Ba. В данном случае исследовались три конструкции: плитная, восьмиугольная и лестничная.В таблице 2 приведены рассчитанные энергии и щели HOMO-LUMO для различных структур. Установлено, что во всех случаях форма плиты предпочтительнее двух других. Энергетические различия в этом случае выше, и форма плиты более предпочтительна. Также проведено сравнение результатов расчетов с расчетами B3LYP [40, 41].
9004
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Из ссылки [40, 41 ]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(MgO) 4 . В пластинчатой структуре все атомы эквивалентны. Мы обнаружили, что, начиная с (MgO) 4 , предпочтение отдается трехмерным структурам. (MgO) 4 имеет кубическую структуру с ромбоэдрическим искажением (рис. 3(а)), каждый атом имеет три координации. Заряд Малликена на Mg равен 0,930, а все порядки связи Mg-O равны 0,570. Таким образом, связь в основном ионная.
(СаО) 4 . Для CaO снова предпочтительна пластинчатая структура. Хотя и LDA, и GGA указывают на это предпочтение, интересно видеть, что оптимизированные структуры для восьмиугольной исходной структуры различны для двух случаев (рис. 3(b)) и отличаются от исходной кольцевой структуры, в отличие от случая (MgO ) 4 (рис. 3(а)). В случае LDA оптимизированная структура состоит из трех слитых ромбов, тогда как оптимизированная структура GGA состоит из слитых шести- и четырехчленных колец.
(SrO) 4 и (BaO) 4 . (SrO) 4 и (BaO) 4 демонстрируют поведение, аналогичное (CaO) 4 , за исключением того, что и LDA, и GGA дают аналогичные оптимизированные структуры для восьмиугольной формы. По этой причине на рис. 3(с) показаны только оптимизированные структуры для (SrO) 4 .
Интересный результат состоит в том, что, хотя во всех случаях предпочтительна пластинчатая структура, следующей важной структурой является кольцо для (MgO) 4 , а для других оксидов металлов это лестничная структура.В отличие от (MgO) 4 исходная октагональная структура претерпевает значительные искажения во всех остальных случаях.
(MO) 5 Где M = Mg, Ca, Sr, Ba. В этом случае возможно наибольшее количество конструкций, а именно: лестничные, шестиугольные, десятиугольные, стул и многие другие (табл. 3). В случае MgO как LDA, так и GGA предсказывают, что наиболее стабильной структурой является форма стула. Аналогично обстоит дело с CaO, то есть форма стула является наиболее стабильной структурой, но в случае SrO и BaO форма лестницы оказывается немного предпочтительнее других форм.Однако можно отметить, что для этой стехиометрии энергетические различия не очень велики.
Аналогично обстоит дело с CaO, то есть форма стула является наиболее стабильной структурой, но в случае SrO и BaO форма лестницы оказывается немного предпочтительнее других форм.Однако можно отметить, что для этой стехиометрии энергетические различия не очень велики.
-3,34 -3,28 -3,34 -1,70 -1,71 -1,35 -1,70 + -1,63 -1,63 -1,66 декагональных
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(MgO) 5 Хотя MgO, по-видимому, предпочитает гексагональные структуры, интересно, что в этом случае гексагональное слитое кольцо оптимизируется до лестничной структуры (рис. 4(а)).Точно так же исходные структуры MgO-I и MgO-II оптимизируются до одной и той же геометрии, которая представляет собой гибрид одного гексагонального кольца, слитого с двумя четырехчленными кольцами. Структура с самой низкой энергией для (MgO) 5 получается из (MgO) 4 путем закрытия ребра таким образом, что закрывающие атомы являются двухкоординированными, а остальные атомы — трехкоординированными. Соответствующее ребро на (MgO) 4 открывается из-за увеличения координационного числа до трех и последующего усиления ионного характера.Аналогично обстоит дело со структурами (CaO) 5 , за исключением того, что LDA предсказывает две различные структуры, CaO-I и CaO-II (рис. 4(b)). Для (SrO) 5 (рис. 4(c)) и (BaO) 5 (рис. 4(d)) предпочтительнее использовать лестничные структуры, а конструкции кресла не могут быть оптимизированы.
Структура с самой низкой энергией для (MgO) 5 получается из (MgO) 4 путем закрытия ребра таким образом, что закрывающие атомы являются двухкоординированными, а остальные атомы — трехкоординированными. Соответствующее ребро на (MgO) 4 открывается из-за увеличения координационного числа до трех и последующего усиления ионного характера.Аналогично обстоит дело со структурами (CaO) 5 , за исключением того, что LDA предсказывает две различные структуры, CaO-I и CaO-II (рис. 4(b)). Для (SrO) 5 (рис. 4(c)) и (BaO) 5 (рис. 4(d)) предпочтительнее использовать лестничные структуры, а конструкции кресла не могут быть оптимизированы.
(MO) 6 Где M = Mg, Ca, Sr, Ba. При этом исследовались три конструкции: плитная, шестиугольная и лестничная (табл. 4).
0116/-/DCSupplemental.Ab initio молекулярно-динамическое исследование плавления оксида бериллия под высоким давлениемСорокин П.Б., Федоров А.С., Чернозатонский Л.А. Структура и свойства нанотрубок BeO. физ. Твердое тело 48, 398–401 (2006). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Баумейер, Б. ОБЪЯВЛЕНИЕ Статья Google Scholar Хазен, Р. М. и Фингер, Л. В. Кристаллохимия оксида бериллия при высоких давлениях и температурах. Дж. Заявл. физ. 59, 3728–3733 (1986). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Слэк, Г.А. и Аустерман С. Б. Теплопроводность монокристаллов BeO. Дж. Заявл. физ. 42, 4713–4717 (1971). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Ресслер Д.М., Уокер В.К. и Лох Э. Электронный спектр кристаллического оксида бериллия. Дж. Физ. хим. Твердые вещества 30, 157–167 (1969). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Главач, Й.Температуры плавления тугоплавких оксидов: Часть I. Артикул Google Scholar Думан С., Сютлю А., Багкл С., Тютюнджю Х. М. и Сривастава Г. П. Структурные, упругие, электронные и фононные свойства цинковой обманки и вюрцита BeO. Дж. Заявл. физ. 105, 033719 (2009). ОБЪЯВЛЕНИЕ Статья Google Scholar Ло, Э.Оптические фононы в кристаллах BeO. физ. 166, 673–678 (1968). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Phillips, JC Bonds and Bands in Semiconductors ( Academic , New York, 1973). Филлипс, Дж. К. Ионность химической связи в кристаллах. Преподобный Мод. физ. 42, 317–356 (1970). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Джефкоут, А.П., Хемли, Р.Дж., Мао, Х.К., Коэн, Р.Е. и Мел, М.Дж. Рамановская спектроскопия и теоретическое моделирование BeO при высоком давлении. ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Мори Ю., Икай Т. и Такарабе К. Отчет о работе фотонной фабрики. Часть B: Наука о высоком давлении . 20, 215 (2003). Ван Кэмп, П.Е. и Ван Дорен, В.Е. Свойства основного состояния и структурно-фазовое превращение оксида бериллия.Дж. Физ. Конденс. Вопрос 8, 3385–3390 (1996). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Беттгер, Дж. К. и Уиллс, Дж. М. Теоретическая структурно-фазовая стабильность BeO до 1 ТПа. физ. Ред. B 54, 8965–8968 (1996). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Парк, С.Дж., Ли, С.Г., Ко, Ю.Дж. и Чанг, К.Дж. Теоретическое исследование структурно-фазового превращения BeO под давлением.физ. Ред. B 59, 13501–13504 (1999). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Кай, Ю. ОБЪЯВЛЕНИЕ Статья Google Scholar Амрани, Б., Хассан, Ф. Э. Х. и Акбарзаде, Х. Исследование основных принципов свойств полиморфов BeO в основном и возбужденном состояниях.Дж. Физ. Конденс. Материя 19, 436216 (2007). Артикул Google Scholar Ю, Б. Р., Ян, Дж. В., Го, Х. З., Цзи, Г. Ф. и Чен, X. Р. Фазовый переход и упругие свойства BeO под давлением на основе расчетов из первых принципов. Physica B 404, 1940–1946 (2009). ОБЪЯВЛЕНИЕ КАС Статья Google Scholar Сахария, М. Б. и Гош, С.Динамическая устойчивость и фазовый переход BeO под давлением. Дж. Заявл. физ. 107, 083520 (2010). ОБЪЯВЛЕНИЕ Статья Google Scholar Сонг Х. Артикул Google Scholar Чжан, К.Л., Чжан П., Сонг Х.Ф. и Лю Х.Ф. Расчеты потенциала среднего поля уравнения состояния BeO при высоком давлении. Подбородок. физ. Б. 17, 1341–1348 (2008). КАС Статья Google Scholar Босак А., Шмальцль К., Криш М., ван Бик В. и Колобанов В. Динамика решетки оксида бериллия: неупругое рассеяние рентгеновских лучей и расчеты ab initio. физ. Ред. B 77, 224303 (2008). ОБЪЯВЛЕНИЕ Статья Google Scholar Сахария, М.Б. и Гош С. Неэмпирический расчет динамики решетки в BeO. Дж. Физ. Конденс. Материя 20, 395201 (2008). Артикул Google Scholar Вдовик У. ОБЪЯВЛЕНИЕ Статья Google Scholar Луо Ф., Ченг Ю., Cai, LC & Chen, XR. Структура и термодинамические свойства BeO: эмпирические поправки в квазигармоническом приближении. Дж. Заявл. физ. 113, 033517 (2013). ОБЪЯВЛЕНИЕ Статья Google Scholar Альфе, Д. Кривая плавления MgO на основе моделирования из первых принципов. физ. Преподобный Летт. 94, 235701 (2005). ОБЪЯВЛЕНИЕ Статья Google Scholar Белоношко А.Б., Арапан С., Мартонак Р. и Розенгрен А. Фазовая диаграмма MgO из первых принципов в широком диапазоне давления-температуры. физ. Ред. В 81, 054110 (2010). ОБЪЯВЛЕНИЕ Статья Google Scholar Боутс Б. ОБЪЯВЛЕНИЕ Статья Google Scholar Сирота, Н.Н., Кузьмина А. М., Орлова Н. С. Модули упругости оксида бериллия при 10–720 K по данным рентгенографии. Докл. акад. 1990. Т. 314. С. 856–862. КАС Google Scholar Белоношко А.Б., Скородумова Н.В., Розенгрен А., Йоханссон Б. Плавление и критический перегрев. физ. Ред. В 73, 012201 (2006 г.). ОБЪЯВЛЕНИЕ Статья Google Scholar Буше, Дж., Боттин Ф., Жомар Г. и Зерах Г. Кривая плавления алюминия до 300 ГПа, полученная с помощью моделирования молекулярной динамики ab initio. физ. Версия B 80, 094102 (2009 г.). ОБЪЯВЛЕНИЕ Статья Google Scholar Дэвис С. ОБЪЯВЛЕНИЕ Статья Google Scholar Белоношко А.Б. и Розенгрен А. Кривая плавления платины при высоком давлении, полученная методом ab initio Z. физ. Ред. B 85, 174104 (2012). ОБЪЯВЛЕНИЕ Статья Google Scholar Ли Д. Ф., Чжан П., Ян Дж. и Лю Х. Ю. Кривая плавления лития на основе моделирования квантовой молекулярной динамики. Еврофиз. лат. 95, 56004 (2011). ОБЪЯВЛЕНИЕ Статья Google Scholar Блёхль, П.Э., Джепсен О. и Андерсен О.К. Улучшенный метод тетраэдра для интегрирования зоны Бриллюэна. физ. Ред. В 49, 16223 (1994). ОБЪЯВЛЕНИЕ Статья Google Scholar Метфессель, М. и Пакстон, А. Т. ОБЪЯВЛЕНИЕ КАС Статья Google Scholar %PDF-1.4 5 0 объект > эндообъект 8 0 объект (Введение) эндообъект 9 0 объект > эндообъект 12 0 объект (Концепции теории твердого тела) эндообъект 13 0 объект > эндообъект 16 0 объект (Приближение Борна-Оппенгеймера) эндообъект 17 0 объект > эндообъект 20 0 объект (Теория функционала плотности: уравнения Кона-Шама) эндообъект 21 0 объект > эндообъект 24 0 объект (Приближение локальной плотности) эндообъект 25 0 объект > эндообъект 28 0 объект (Практическая реализация расчетов по теории функционала плотности) эндообъект 29 0 объект > эндообъект 32 0 объект (Решение уравнений Кона-Шама) эндообъект 33 0 объект > эндообъект 36 0 объект (псевдопотенциалы, сохраняющие норму) эндообъект 37 0 объект > эндообъект 40 0 объект (Самосогласованные расчеты электронной структуры) эндообъект 41 0 объект > эндообъект 44 0 объект (Расчеты общей энергии) эндообъект 45 0 объект > эндообъект 48 0 объект (Атомные силы и оптимизация атомной структуры) эндообъект 49 0 объект > эндообъект 52 0 объект (Поправки на самодействие к теории функционала плотности) эндообъект 53 0 объект > эндообъект 56 0 объект (Ошибка самодействия) эндообъект 57 0 объект > эндообъект 60 0 объект (Поправки на самодействие в атомах: подход Пердью-Цунгера) эндообъект 61 0 объект > эндообъект 64 0 объект (Поправки на самодействие для твердых тел: первые подходы) эндообъект 65 0 объект > эндообъект 68 0 объект (Псевдопотенциалы с поправкой на самодействие) эндообъект 69 0 объект > эндообъект 72 0 объект (Структурные свойства объемного карбида кремния кубической и гексагональной формы) эндообъект 73 0 объект > эндообъект 76 0 объект (Электронная структура 2H-, 4H- и 6H-SiC) эндообъект 77 0 объект > эндообъект 80 0 объект (Резюме) эндообъект 81 0 объект > эндообъект 84 0 объект (Свойства поверхностей \(110\) и \(001\) 3C-SiC) эндообъект 85 0 объект > эндообъект 88 0 объект (Неполярная поверхность 3C-SiC\(110\)-\(1×1\)) эндообъект 89 0 объект > эндообъект 92 0 объект (Полярная поверхность 3C-SiC\(001\)) эндообъект 93 0 объект > эндообъект 96 0 объект (Резюме) эндообъект 97 0 объект > эндообъект 100 0 объект (Свойства поверхностей \(1010\) и \(1102\)-c\(22\) 4H-SiC) эндообъект 101 0 объект > эндообъект 104 0 объект (Поверхность 4H-SiC\(1010\)) эндообъект 105 0 объект > эндообъект 108 0 объект (Поверхность 4H-SiC\(1102\)-c\(22\)) эндообъект 109 0 объект > эндообъект 112 0 объект (Резюме) эндообъект 113 0 объект > эндообъект 116 0 объект (Объемные и поверхностные свойства оксидов щелочноземельных металлов) эндообъект 117 0 объект > эндообъект 120 0 объект (Атомная и электронная структура BeO и поверхность BeO\(1010\)) эндообъект 121 0 объект > эндообъект 124 0 объект (Связанная поверхность и потенциальные состояния изображения оксидов щелочноземельных металлов) эндообъект 125 0 объект > эндообъект 128 0 объект (Структурные, упругие и электронные свойства нанотрубок SiC, BN и BeO) эндообъект 129 0 объект > эндообъект 132 0 объект (Графические монослои) эндообъект 133 0 объект > эндообъект 136 0 объект (нанотрубки) эндообъект 137 0 объект > эндообъект 140 0 объект (Резюме) эндообъект 141 0 объект > эндообъект 144 0 объект (Электронная структура фторидов, оксидов и нитридов щелочных металлов) эндообъект 145 0 объект > эндообъект 148 0 объект (Значения атомарных терминов) эндообъект 149 0 объект > эндообъект 152 0 объект (Общие электронные свойства) эндообъект 153 0 объект > эндообъект 156 0 объект (Объемные структурные свойства) эндообъект 157 0 объект > эндообъект 160 0 объект (Резюме) эндообъект 161 0 объект > эндообъект 164 0 объект (Выводы и перспективы) эндообъект 165 0 объект > эндообъект 168 0 объект (Резюме) эндообъект 169 0 объект > эндообъект 172 0 объект (Приложение) эндообъект 173 0 объект > эндообъект 175 0 объект (Явные формы сил Пулея, Хельмана-Фейнмана и Маделунга) эндообъект 176 0 объект > эндообъект 178 0 объект (Псевдопотенциалы, включая полуядерные состояния) эндообъект 179 0 объект > эндообъект 181 0 объект (Константы распада для гауссовых орбиталей) эндообъект 182 0 объект > эндообъект 185 0 объект (Библиография) эндообъект 186 0 объект > эндообъект 189 0 объект (Zusammenfassung) эндообъект 190 0 объект > эндообъект 193 0 объект > ручей xڝTM0WHx]»mԑhLlwiق! Открытые учебники | SiyavulaМатематикаНаука
Лицензирование нашей книгиЭти книги не только бесплатны, но и имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено: CC-BY-ND (фирменные версии) Вам разрешается и поощряется свободное копирование этих версий. Узнайте здесь больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников. CC-BY (версии без торговой марки) Эти небрендированные версии одного и того же контента доступны для совместного использования, адаптации, преобразования, изменения или дальнейшего развития любым способом, при единственном требовании — отдать должное Сиявуле.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 33
33 93
93 87
87 70
70 20
20 57
57 74
74 50
50 42
42 , Крюгер П. и Поллманн Дж. Структурные, упругие и электронные свойства нанотрубок SiC, BN и BeO. физ. Ред. В 76, 085407 (2007).
, Крюгер П. и Поллманн Дж. Структурные, упругие и электронные свойства нанотрубок SiC, BN и BeO. физ. Ред. В 76, 085407 (2007). Pure Appl. хим. 54, 682–688 (1982).
Pure Appl. хим. 54, 682–688 (1982).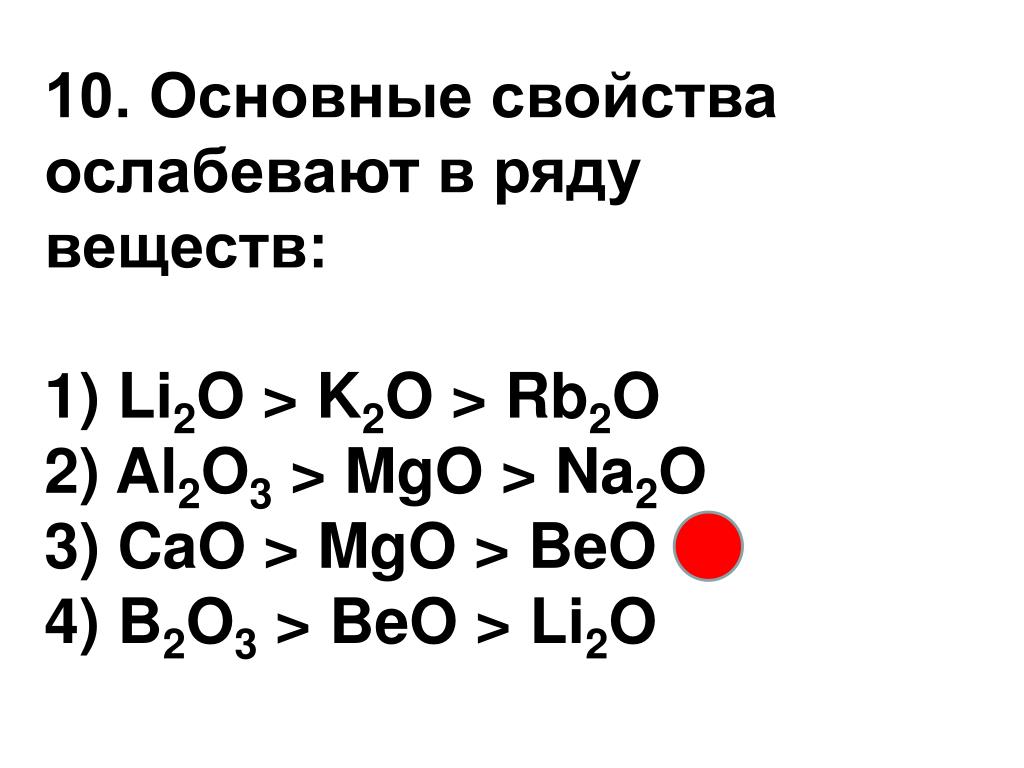 физ. Rev. B 37, 4727–4734 (1988).
физ. Rev. B 37, 4727–4734 (1988). , Ву, С., Сюй, Р. и Ю, Дж. Фазовый переход, индуцированный давлением, и его атомистический механизм в BeO: теоретический расчет. физ. Ред. B 73, 184104 (2006).
, Ву, С., Сюй, Р. и Ю, Дж. Фазовый переход, индуцированный давлением, и его атомистический механизм в BeO: теоретический расчет. физ. Ред. B 73, 184104 (2006). Ф., Лю Х.Ф. и Тиан Э. Структурные и термодинамические свойства гексагонального BeO при высоких давлениях и температурах. Дж. Физ. Конденс. Материя 19, 456209 (2007).
Ф., Лю Х.Ф. и Тиан Э. Структурные и термодинамические свойства гексагонального BeO при высоких давлениях и температурах. Дж. Физ. Конденс. Материя 19, 456209 (2007). Д. Структурная стабильность и термические свойства BeO в квазигармоническом приближении. Дж. Физ. Конденс. 2010. № 22. С. 045404.
Д. Структурная стабильность и термические свойства BeO в квазигармоническом приближении. Дж. Физ. Конденс. 2010. № 22. С. 045404. и Бонев С. А. Неустойчивость расслоения в плотном расплавленном MgSiO3 и фазовая диаграмма MgO. физ. Преподобный Летт. 110, 135504 (2013).
и Бонев С. А. Неустойчивость расслоения в плотном расплавленном MgSiO3 и фазовая диаграмма MgO. физ. Преподобный Летт. 110, 135504 (2013). М., Белоношко А.Б. и Йоханссон Б. Кривая плавления водорода при высоком давлении. Дж. Хим. физ. 129, 194508 (2008).
М., Белоношко А.Б. и Йоханссон Б. Кривая плавления водорода при высоком давлении. Дж. Хим. физ. 129, 194508 (2008). Высокоточный отбор проб для интегрирования зоны Бриллюэна в металлах. физ. Rev. B 40, 3616 (1989).
Высокоточный отбор проб для интегрирования зоны Бриллюэна в металлах. физ. Rev. B 40, 3616 (1989). Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
 46
46 48
48 75
75 Эта разность энергий возрастает до 0,57 эВ для кластера (MgO) 12 [22, 23]. Для других оксидов металлов предпочтительна пластинчатая структура. Система (MO) 6 является первой системой, для которой возможна как плитная, так и шестиугольная структура, и мы можем провести сравнение между ними. Мы наблюдаем, что расстояния связи Mg–O в терминальных кольцах (MgO) 6 уменьшаются при переходе от ромбической (плитной) к гексагональной структуре от 1.919 Å в первом случае до 1,891 Å во втором. Что касается лестничных структур, то валентное расстояние во внутреннем кольце трехкольцевого слэб-кластера (2,123 Å) заметно удлинено по сравнению с концевым валентным расстоянием. Как и ожидалось, внешнее расстояние Mg–O ближе к молекулярному 1,822 Å, а расстояние внутри кольца ближе к пределу решетки 2,106 Å. Также наблюдаются два отчетливо различающихся межплоскостных расстояния (1,936 Å и 1,898 Å), в зависимости от того, какой атом, Mg или O, находится на концевом кольце стопки из трех колец.
Эта разность энергий возрастает до 0,57 эВ для кластера (MgO) 12 [22, 23]. Для других оксидов металлов предпочтительна пластинчатая структура. Система (MO) 6 является первой системой, для которой возможна как плитная, так и шестиугольная структура, и мы можем провести сравнение между ними. Мы наблюдаем, что расстояния связи Mg–O в терминальных кольцах (MgO) 6 уменьшаются при переходе от ромбической (плитной) к гексагональной структуре от 1.919 Å в первом случае до 1,891 Å во втором. Что касается лестничных структур, то валентное расстояние во внутреннем кольце трехкольцевого слэб-кластера (2,123 Å) заметно удлинено по сравнению с концевым валентным расстоянием. Как и ожидалось, внешнее расстояние Mg–O ближе к молекулярному 1,822 Å, а расстояние внутри кольца ближе к пределу решетки 2,106 Å. Также наблюдаются два отчетливо различающихся межплоскостных расстояния (1,936 Å и 1,898 Å), в зависимости от того, какой атом, Mg или O, находится на концевом кольце стопки из трех колец. Он больше, когда O находится на концевом кольце, из-за большего радиуса O 2−. Межплоскостное расстояние в гексагональной стопочной структуре (1,980 Å) намного больше, чем расстояние связи Mg–O. Увеличенное разделение зарядов внутри оказывает лишь незначительное влияние на терминальные кольца, помимо того, что уже наблюдается для системы двойного кольца (MgO) 4 (1,943 Å).
Он больше, когда O находится на концевом кольце, из-за большего радиуса O 2−. Межплоскостное расстояние в гексагональной стопочной структуре (1,980 Å) намного больше, чем расстояние связи Mg–O. Увеличенное разделение зарядов внутри оказывает лишь незначительное влияние на терминальные кольца, помимо того, что уже наблюдается для системы двойного кольца (MgO) 4 (1,943 Å).

 , а для пластинчатой структуры эта полоса находится на 740 см −1 (интенсивность = 445 км моль −1 ).Для нанокластера (MgO) 12 соответствующие значения [22, 23] составляют 657 см −1 (интенсивность = 1132 км моль −1 ) (гексагональная) и 677 см −1 (интенсивность = 00042 км моль −1 ) (плита).
, а для пластинчатой структуры эта полоса находится на 740 см −1 (интенсивность = 445 км моль −1 ).Для нанокластера (MgO) 12 соответствующие значения [22, 23] составляют 657 см −1 (интенсивность = 1132 км моль −1 ) (гексагональная) и 677 см −1 (интенсивность = 00042 км моль −1 ) (плита).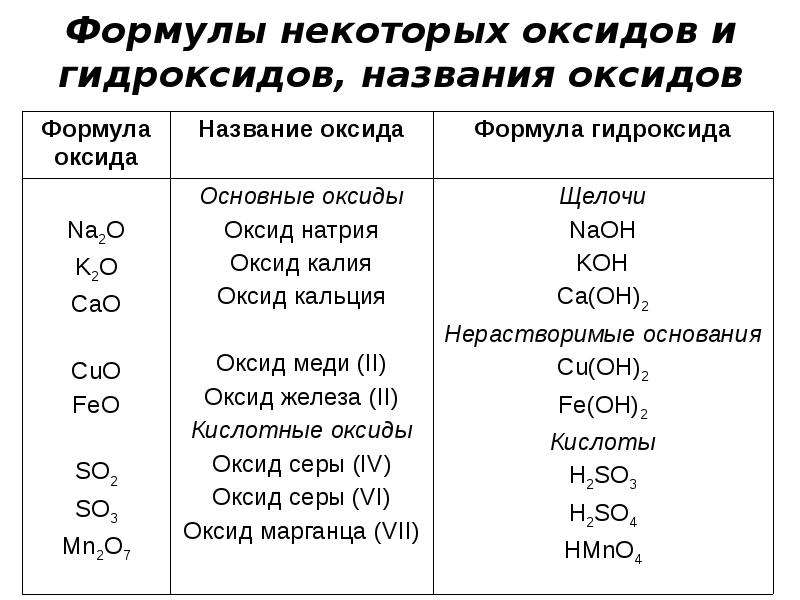 Меньшее анион-анионное отталкивание в нанотрубке стабилизирует ВЗМО, увеличивая зазор ВЗМО-НСМО.
Меньшее анион-анионное отталкивание в нанотрубке стабилизирует ВЗМО, увеличивая зазор ВЗМО-НСМО. Вычисленная электронная конфигурация иона магния отличается от ожидаемой 2p 6 . Орбитали 3s, 3p и 3d заняты, что приводит к формальному заряду Mg ближе к единице, чем ожидаемые два.
Вычисленная электронная конфигурация иона магния отличается от ожидаемой 2p 6 . Орбитали 3s, 3p и 3d заняты, что приводит к формальному заряду Mg ближе к единице, чем ожидаемые два. Фактически, CaO, по-видимому, демонстрирует некоторое аномальное поведение, поскольку заряд Малликена на Ca немного выше, чем рассчитанный для ионов металлов в других оксидах металлов.
Фактически, CaO, по-видимому, демонстрирует некоторое аномальное поведение, поскольку заряд Малликена на Ca немного выше, чем рассчитанный для ионов металлов в других оксидах металлов. Валентные углы вокруг ионов кислорода меньше, чем у ионов магния, но длины связей MgO остаются одинаковыми в обеих плоских структурах. В некоторых структурах, особенно в структурах кресла, из таблицы 5 видно большое изменение расстояний M-O внутри кластера.
Валентные углы вокруг ионов кислорода меньше, чем у ионов магния, но длины связей MgO остаются одинаковыми в обеих плоских структурах. В некоторых структурах, особенно в структурах кресла, из таблицы 5 видно большое изменение расстояний M-O внутри кластера. 238-2.422 2,031 2.189-2.512 2.413-2.417 2.205-2.532
238-2.422 2,031 2.189-2.512 2.413-2.417 2.205-2.532 78
78 940-2.204
940-2.204 , 41].Для наши результаты о том, что кольцевые структуры лежат выше по энергии, противоречат опубликованным результатам [17–20], в которых сообщалось, что и 5 имеют кольцевые структуры. Для всех (MO) 4 плитные конструкции предпочтительнее восьмиугольных кольцевых и лестничных конструкций. Однако в то время как для всех других систем (MO) 4 кольцевая структура является наименее предпочтительной, для (MgO) 4 она предпочтительнее лестничной структуры. Можно отметить, что кольцевая структура претерпевает значительные искажения во всех случаях, кроме MgO.
, 41].Для наши результаты о том, что кольцевые структуры лежат выше по энергии, противоречат опубликованным результатам [17–20], в которых сообщалось, что и 5 имеют кольцевые структуры. Для всех (MO) 4 плитные конструкции предпочтительнее восьмиугольных кольцевых и лестничных конструкций. Однако в то время как для всех других систем (MO) 4 кольцевая структура является наименее предпочтительной, для (MgO) 4 она предпочтительнее лестничной структуры. Можно отметить, что кольцевая структура претерпевает значительные искажения во всех случаях, кроме MgO. 8). Хотя в целом для MgO этим можно пренебречь, сокращение длин связей в кластерах может быть причиной усиления ковалентного характера.
8). Хотя в целом для MgO этим можно пренебречь, сокращение длин связей в кластерах может быть причиной усиления ковалентного характера.
 Для количественной оценки ароматичности мы использовали метод ядерно-независимого химического сдвига (NICS), предложенный Schleyer et al. [52]. Значения NICS рассчитывали в центре шестичленного кольца (NICS(0)) и в плоскости на 1 Å над ним (NICS(1)) и сравнивали с соответствующими значениями, рассчитанными для бензола.В этом методе отрицательные значения NICS указывают на ароматичность, а положительные значения — на антиароматичность. Ранее мы [53, 54] пришли к выводу, что значение NICS(1) является наилучшей мерой ароматичности бензола. Расчетное значение NICS(1) для бензола составляет -10,84, тогда как соответствующие значения для кольцевых структур (MgO) 3 и (CaO) 3 составляют -2,05 и 2,75 соответственно, что ясно указывает на то, что кольцо MgO составляет около 20 % ароматического, в то время как кольцо CaO является антиароматическим, что объясняет повышенную стабильность кольца MgO.
Для количественной оценки ароматичности мы использовали метод ядерно-независимого химического сдвига (NICS), предложенный Schleyer et al. [52]. Значения NICS рассчитывали в центре шестичленного кольца (NICS(0)) и в плоскости на 1 Å над ним (NICS(1)) и сравнивали с соответствующими значениями, рассчитанными для бензола.В этом методе отрицательные значения NICS указывают на ароматичность, а положительные значения — на антиароматичность. Ранее мы [53, 54] пришли к выводу, что значение NICS(1) является наилучшей мерой ароматичности бензола. Расчетное значение NICS(1) для бензола составляет -10,84, тогда как соответствующие значения для кольцевых структур (MgO) 3 и (CaO) 3 составляют -2,05 и 2,75 соответственно, что ясно указывает на то, что кольцо MgO составляет около 20 % ароматического, в то время как кольцо CaO является антиароматическим, что объясняет повышенную стабильность кольца MgO. В этой работе были предложены объяснения, основанные на эффектах размера ионов и ароматичности. Отрадно отметить, что экспериментальные наблюдения масс-спектров [14, 15, 48, 55] указывают на существование и устойчивость таких сложенных гексагональных колец, по крайней мере, для небольших газофазных кластеров MgO.Другие экспериментальные и теоретические исследования [22, 23, 56] также свидетельствуют о существовании и устойчивости нанотрубок MgO.
В этой работе были предложены объяснения, основанные на эффектах размера ионов и ароматичности. Отрадно отметить, что экспериментальные наблюдения масс-спектров [14, 15, 48, 55] указывают на существование и устойчивость таких сложенных гексагональных колец, по крайней мере, для небольших газофазных кластеров MgO.Другие экспериментальные и теоретические исследования [22, 23, 56] также свидетельствуют о существовании и устойчивости нанотрубок MgO. При переходе к ситуация обратная, преобладает плитная структура. При сохраняется тенденция к увеличению стабилизации плитных конструкций, причем плитная конструкция, очевидно, является более устойчивой. Для , плитная структура по-прежнему предпочтительна, но в меньшей степени. Для объяснения различий в относительной стабильности было предложено объяснение, основанное на простых аргументах упаковки.Ароматичность в кольце (MgO) 3 также объясняет его стабильность.
При переходе к ситуация обратная, преобладает плитная структура. При сохраняется тенденция к увеличению стабилизации плитных конструкций, причем плитная конструкция, очевидно, является более устойчивой. Для , плитная структура по-прежнему предпочтительна, но в меньшей степени. Для объяснения различий в относительной стабильности было предложено объяснение, основанное на простых аргументах упаковки.Ароматичность в кольце (MgO) 3 также объясняет его стабильность.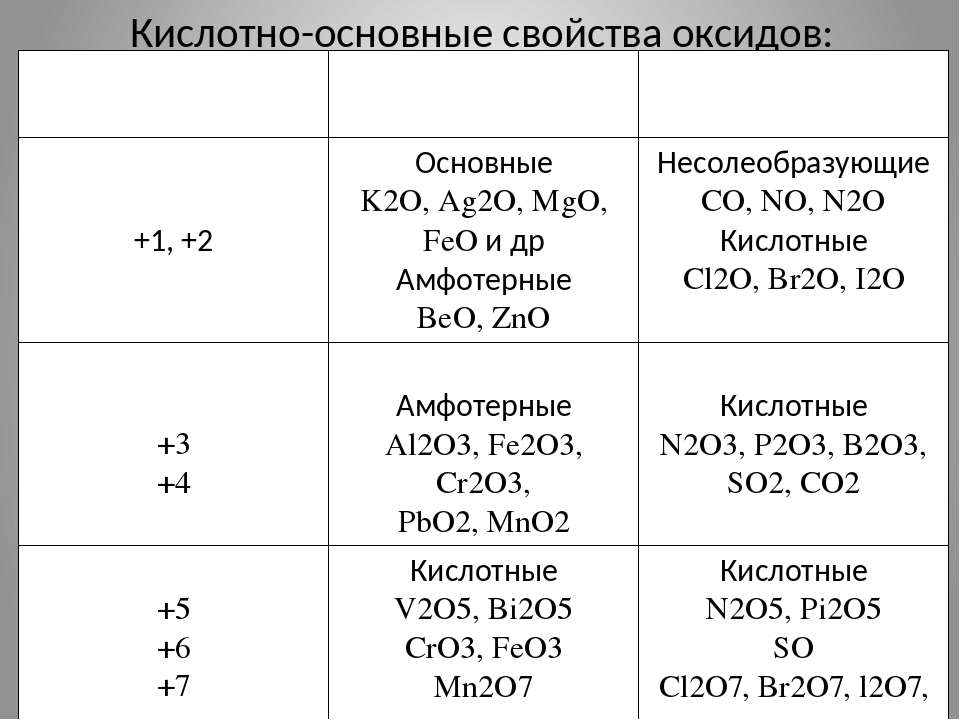 Во-вторых, кластеры фрагментации обнаруживаются как для четных значений, так и для случаев, кратных 3. Эти результаты предполагают, что основные блоки, образующие кластеры, различаются для двух материалов, как видно из настоящих расчетов. Результаты экспериментальных исследований и наши расчеты можно согласовать, если предположить, что нейтральная стехиометрия и кластеры имеют структурные различия: основным строительным блоком является гексагональный фрагмент (MgO) 3 в случае MgO и (CaO) 3 прямоугольный фрагмент 2 × 3 (или двухцепочечный) для CaO, такой же, как найденный в настоящих исследованиях.Эта разница является просто эффектом упаковки из-за большего перекрывающегося отталкивания между анионами в MgO, поскольку размер катиона очень мал, а также из-за ароматичности кольца (MgO) 3 .
Во-вторых, кластеры фрагментации обнаруживаются как для четных значений, так и для случаев, кратных 3. Эти результаты предполагают, что основные блоки, образующие кластеры, различаются для двух материалов, как видно из настоящих расчетов. Результаты экспериментальных исследований и наши расчеты можно согласовать, если предположить, что нейтральная стехиометрия и кластеры имеют структурные различия: основным строительным блоком является гексагональный фрагмент (MgO) 3 в случае MgO и (CaO) 3 прямоугольный фрагмент 2 × 3 (или двухцепочечный) для CaO, такой же, как найденный в настоящих исследованиях.Эта разница является просто эффектом упаковки из-за большего перекрывающегося отталкивания между анионами в MgO, поскольку размер катиона очень мал, а также из-за ароматичности кольца (MgO) 3 . Как отмечалось ранее, эта интенсивная мода колебаний для (MgO) 6 возникает при низком волновом числе (691 см -1 ).Таким образом, экспериментальное знание обилия масс само по себе не может различить две структуры, а сложные расчеты, такие как настоящие, могут только определить относительную стабильность. Наши более ранние исследования [22, 23] кластера (MgO) 12 показали, что нанотрубка (MgO) 12 , состоящая из четырех уложенных друг на друга гексагональных колец (MgO) 3 , более стабильна, чем объемноподобная кубической структуры на 0,48 эВ. Более того, расчетный энергетический барьер перестройки кубической структуры в трубку оказался равным всего 0.13 эВ, и, следовательно, эти две структуры легко конвертируются друг в друга.
Как отмечалось ранее, эта интенсивная мода колебаний для (MgO) 6 возникает при низком волновом числе (691 см -1 ).Таким образом, экспериментальное знание обилия масс само по себе не может различить две структуры, а сложные расчеты, такие как настоящие, могут только определить относительную стабильность. Наши более ранние исследования [22, 23] кластера (MgO) 12 показали, что нанотрубка (MgO) 12 , состоящая из четырех уложенных друг на друга гексагональных колец (MgO) 3 , более стабильна, чем объемноподобная кубической структуры на 0,48 эВ. Более того, расчетный энергетический барьер перестройки кубической структуры в трубку оказался равным всего 0.13 эВ, и, следовательно, эти две структуры легко конвертируются друг в друга. Риту Габа и Упасана Иссар благодарят CSIR и Комиссию по университетским грантам (UGC) соответственно за стипендии для старших исследователей.
Риту Габа и Упасана Иссар благодарят CSIR и Комиссию по университетским грантам (UGC) соответственно за стипендии для старших исследователей. в катализе, оптоэлектронных устройствах, хранении и преобразовании энергии.После экспериментальных и теоретических исследований, в основном сосредоточенных на атомарно тонких наноматериалах со слоистой структурой, все семейство 2D-материалов почти завершено, и недавно было сообщено о нескольких новых графеноподобных материалах. Здесь мы сообщаем об открытии графеноподобных мононитридов, монооксидов, монохлоридов и монослоев моноселенидов, которые показали высокую динамическую, термическую, кинетическую и механическую стабильность.
в катализе, оптоэлектронных устройствах, хранении и преобразовании энергии.После экспериментальных и теоретических исследований, в основном сосредоточенных на атомарно тонких наноматериалах со слоистой структурой, все семейство 2D-материалов почти завершено, и недавно было сообщено о нескольких новых графеноподобных материалах. Здесь мы сообщаем об открытии графеноподобных мононитридов, монооксидов, монохлоридов и монослоев моноселенидов, которые показали высокую динамическую, термическую, кинетическую и механическую стабильность. Предсказаны двумерные материалы, содержащие d -орбитальных атомов, такие как HfO, CdO и AgCl. Используя ту же стратегию, обнаружены 2D-графеноподобные монослои из мононитридов, таких как нитрид скандия (ScN), и моноселенидов, таких как селенид кадмия (CdSe).Обнаружено, что инженерия напряжений помогает стабилизировать двумерные монослои за счет отмены мнимой частоты закона дисперсии фононов. Эти двумерные монослои демонстрируют высокую динамическую, термическую, кинетическую и механическую стабильность благодаря атомной гибридизации и электронной делокализации.
Предсказаны двумерные материалы, содержащие d -орбитальных атомов, такие как HfO, CdO и AgCl. Используя ту же стратегию, обнаружены 2D-графеноподобные монослои из мононитридов, таких как нитрид скандия (ScN), и моноселенидов, таких как селенид кадмия (CdSe).Обнаружено, что инженерия напряжений помогает стабилизировать двумерные монослои за счет отмены мнимой частоты закона дисперсии фононов. Эти двумерные монослои демонстрируют высокую динамическую, термическую, кинетическую и механическую стабильность благодаря атомной гибридизации и электронной делокализации. Другие материалы на основе группы IV, такие как силицен, германен и станин, также продвинулись от теоретических предсказаний (5, 6) к экспериментальным наблюдениям (7⇓–9), демонстрируя электронные характеристики, подобные графену.Синтез фосфорена, монослоя фосфора, открыл новую область 2D-монослойных материалов на основе группы V (10). После сообщения (11) об устройствах на основе дисульфида молибдена (MoS 2 ) с коэффициентами включения/выключения >10 8 и однослойной подвижностью при комнатной температуре не менее 200 см 2 В −1 ⋅ s -1 исследования монослоев MoS 2 увеличились и вызвали большой интерес ко всему семейству двумерных халькогенидов (12).
Другие материалы на основе группы IV, такие как силицен, германен и станин, также продвинулись от теоретических предсказаний (5, 6) к экспериментальным наблюдениям (7⇓–9), демонстрируя электронные характеристики, подобные графену.Синтез фосфорена, монослоя фосфора, открыл новую область 2D-монослойных материалов на основе группы V (10). После сообщения (11) об устройствах на основе дисульфида молибдена (MoS 2 ) с коэффициентами включения/выключения >10 8 и однослойной подвижностью при комнатной температуре не менее 200 см 2 В −1 ⋅ s -1 исследования монослоев MoS 2 увеличились и вызвали большой интерес ко всему семейству двумерных халькогенидов (12).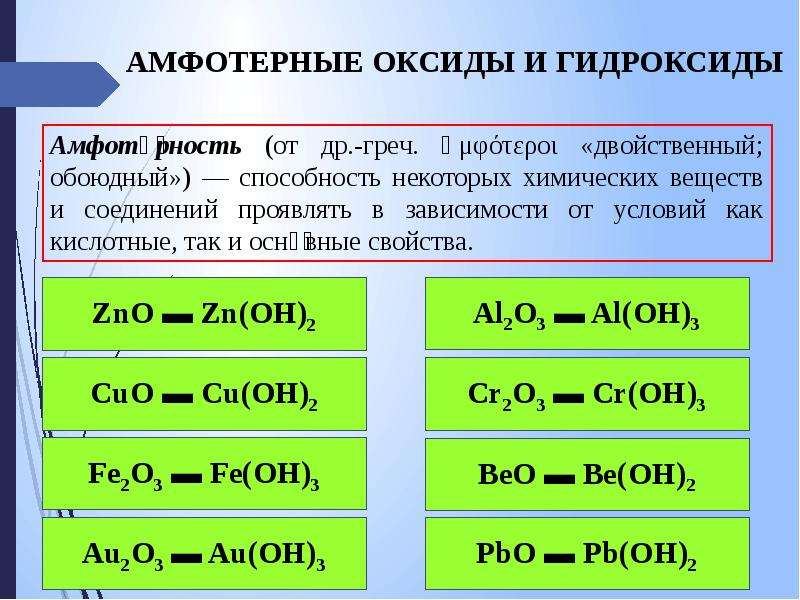 Николози и др. (14) рассмотрел жидкое расслоение слоистых материалов, включая графит, h-BN, дихалькогениды переходных металлов, трихалькогениды переходных металлов, слоистые галогениды металлов (MoCl 2 , CrCl 3 , PbCl 4 и т. д.), слоистые оксиды (Ti x O y , V 2 O 5 , MoO 3 , FeOCl и др.), слоистые полупроводники AIIIBVI (GaSe, InSe), слоистые фосфаты и фосфонаты циркония, глины, глины , а также тройные карбиды и нитриды переходных металлов.Однако с экспериментальной точки зрения изучение двумерных монослоев требует синтеза с использованием методов химического изготовления и методов детальной характеристики, таких как рентгеновская дифракция, просвечивающая электронная микроскопия высокого разрешения, атомно-силовая микроскопия, рамановская спектроскопия и сканирующая туннельная микроскопия. , что отнимает много времени на систематическое изучение большого количества материалов-кандидатов.
Николози и др. (14) рассмотрел жидкое расслоение слоистых материалов, включая графит, h-BN, дихалькогениды переходных металлов, трихалькогениды переходных металлов, слоистые галогениды металлов (MoCl 2 , CrCl 3 , PbCl 4 и т. д.), слоистые оксиды (Ti x O y , V 2 O 5 , MoO 3 , FeOCl и др.), слоистые полупроводники AIIIBVI (GaSe, InSe), слоистые фосфаты и фосфонаты циркония, глины, глины , а также тройные карбиды и нитриды переходных металлов.Однако с экспериментальной точки зрения изучение двумерных монослоев требует синтеза с использованием методов химического изготовления и методов детальной характеристики, таких как рентгеновская дифракция, просвечивающая электронная микроскопия высокого разрешения, атомно-силовая микроскопия, рамановская спектроскопия и сканирующая туннельная микроскопия. , что отнимает много времени на систематическое изучение большого количества материалов-кандидатов. Лебег и др. (15) использовали эффективность теории функционала плотности для выявления электронных и магнитных структур возможных новых двумерных материалов.В настоящее время был исследован почти каждый потенциальный слоистый материал, который существует в базе данных неорганической кристаллической структуры, включая каждую комбинацию двумерных дихалькогенидов, таких как ZrS 2 , WTe 2 , PdSe 2 , и другие недихалькогенидные слоистые соединения, такие как PbIF, Cu 2 S, FeS, FeBr 3 и KC 6 FeO 3 N 3 (15). Камаль и др. (16) изучали бинарные системы XY, состоящие из равного количества элементов группы IV и VI в складчатом, изогнутом и плоском расположении, используя расчеты электронной структуры, основанные на теории функционала плотности.
Лебег и др. (15) использовали эффективность теории функционала плотности для выявления электронных и магнитных структур возможных новых двумерных материалов.В настоящее время был исследован почти каждый потенциальный слоистый материал, который существует в базе данных неорганической кристаллической структуры, включая каждую комбинацию двумерных дихалькогенидов, таких как ZrS 2 , WTe 2 , PdSe 2 , и другие недихалькогенидные слоистые соединения, такие как PbIF, Cu 2 S, FeS, FeBr 3 и KC 6 FeO 3 N 3 (15). Камаль и др. (16) изучали бинарные системы XY, состоящие из равного количества элементов группы IV и VI в складчатом, изогнутом и плоском расположении, используя расчеты электронной структуры, основанные на теории функционала плотности. Тан и др. (17) обобщил современный прогресс в области ультратонких двумерных наноматериалов, уделив особое внимание их недавним достижениям. В этой работе мы сообщаем о графеноподобных однослойных монооксидах, таких как MgO, BaO, и монохлоридах, таких как NaCl. Эти материалы обычно имеют структуру, подобную каменной соли, с пространственной группой Fm3¯m в системе обозначений Германа–Могена.Как видно из структуры решетки NaCl на рис. 1 A , каждый из 2 атомов образует отдельную гранецентрированную кубическую решетку, при этом 2 решетки взаимопроникают друг в друга, образуя трехмерный шахматный узор. Однако существует несколько сообщений о двумерных монослоях NaCl и других материалов, подобных каменной соли. Здесь, используя расчеты из первых принципов, мы сообщаем о стабильных графеноподобных монооксидах и связанных с ними структурных и электронных свойствах.
Тан и др. (17) обобщил современный прогресс в области ультратонких двумерных наноматериалов, уделив особое внимание их недавним достижениям. В этой работе мы сообщаем о графеноподобных однослойных монооксидах, таких как MgO, BaO, и монохлоридах, таких как NaCl. Эти материалы обычно имеют структуру, подобную каменной соли, с пространственной группой Fm3¯m в системе обозначений Германа–Могена.Как видно из структуры решетки NaCl на рис. 1 A , каждый из 2 атомов образует отдельную гранецентрированную кубическую решетку, при этом 2 решетки взаимопроникают друг в друга, образуя трехмерный шахматный узор. Однако существует несколько сообщений о двумерных монослоях NaCl и других материалов, подобных каменной соли. Здесь, используя расчеты из первых принципов, мы сообщаем о стабильных графеноподобных монооксидах и связанных с ними структурных и электронных свойствах. ( C ) Вид сверху и сбоку двумерных монослоев MgO, BeO, SrO, CdO и AgCl. ( D ) Константы решетки и длины связей двумерных материалов по сравнению с графеном. ( E ) Смоделированные СТМ-изображения монослоев NaCl, MgO, LiCl и SrO 2D.
( C ) Вид сверху и сбоку двумерных монослоев MgO, BeO, SrO, CdO и AgCl. ( D ) Константы решетки и длины связей двумерных материалов по сравнению с графеном. ( E ) Смоделированные СТМ-изображения монослоев NaCl, MgO, LiCl и SrO 2D. На рис. 1 D показаны длина связи и параметры решетки этих двумерных материалов. Сравнение параметров решетки двумерных монослоев с трехмерными объемами приведено в SI Приложение , таблицы S1 и S2. Длина связи Na-Cl в двумерном монослое NaCl короче, чем (2,820 Å) в каменной соли NaCl. Длина связи Ba–O в монослое 2D BaO составляет 2,457 Å, а длина MgO – 1,908 Å. Затем на рис.1 E и SI Приложение , рис. S3, на основе аппроксимации Терсоффа и Хамана (18) в режиме постоянной высоты, используемой для имитации экспериментальной установки (19). Смоделированные СТМ-изображения двумерных монослоев NaCl, MgO, LiCl и SrO демонстрируют симметричную сотовую структуру, аналогичную структуре графена. Смоделированные СТМ-изображения обнаруженных двумерных монослоев BaO, AgCl, HfO, BeO и CdO показаны в SI, Приложение , рис. S3. Смоделированные СТМ-изображения 2D-листов BaO, 2D-листов AgCl и 2D-листов CdO показывают поверхности с гексагональным рисунком, в то время как смоделированные СТМ-изображения 2D-листов BeO и 2D-листов HfO показывают поверхности с треугольными узорами.
На рис. 1 D показаны длина связи и параметры решетки этих двумерных материалов. Сравнение параметров решетки двумерных монослоев с трехмерными объемами приведено в SI Приложение , таблицы S1 и S2. Длина связи Na-Cl в двумерном монослое NaCl короче, чем (2,820 Å) в каменной соли NaCl. Длина связи Ba–O в монослое 2D BaO составляет 2,457 Å, а длина MgO – 1,908 Å. Затем на рис.1 E и SI Приложение , рис. S3, на основе аппроксимации Терсоффа и Хамана (18) в режиме постоянной высоты, используемой для имитации экспериментальной установки (19). Смоделированные СТМ-изображения двумерных монослоев NaCl, MgO, LiCl и SrO демонстрируют симметричную сотовую структуру, аналогичную структуре графена. Смоделированные СТМ-изображения обнаруженных двумерных монослоев BaO, AgCl, HfO, BeO и CdO показаны в SI, Приложение , рис. S3. Смоделированные СТМ-изображения 2D-листов BaO, 2D-листов AgCl и 2D-листов CdO показывают поверхности с гексагональным рисунком, в то время как смоделированные СТМ-изображения 2D-листов BeO и 2D-листов HfO показывают поверхности с треугольными узорами.
 Механическую стабильность оценивали путем расчета константы упругости. Для этих двумерных материалов рассчитанные упругие константы удовлетворяют этому критерию устойчивости Борна для гексагональной системы (20). Подробную информацию о константе упругости можно найти в SI, Приложение , таблицы S4 и S5. Кинетическая стабильность представленных 2D-материалов может быть охарактеризована путем расчета фононной дисперсии методами DFPT вдоль линий высокой симметрии в зоне Бриллюэна, как показано на рис. 2. Подобно графену (21⇓–23), эти 2D-монослои имеют 6 фононных ветвей: внеплоскостные акустические (ZA) и внеплоскостные оптические (ZO) фононы, где Z означает, что вектор смещения направлен вдоль оси z ; поперечные акустические (TA), поперечные оптические (TO), продольные акустические (LA) и продольные оптические (LO) фононы, которые соответствуют колебаниям внутри 2D-плоскости.Все частоты положительные, без появления мнимых фононных мод, что указывает на термодинамическую стабильность графеноподобных монооксидов и монохлоридов.
Механическую стабильность оценивали путем расчета константы упругости. Для этих двумерных материалов рассчитанные упругие константы удовлетворяют этому критерию устойчивости Борна для гексагональной системы (20). Подробную информацию о константе упругости можно найти в SI, Приложение , таблицы S4 и S5. Кинетическая стабильность представленных 2D-материалов может быть охарактеризована путем расчета фононной дисперсии методами DFPT вдоль линий высокой симметрии в зоне Бриллюэна, как показано на рис. 2. Подобно графену (21⇓–23), эти 2D-монослои имеют 6 фононных ветвей: внеплоскостные акустические (ZA) и внеплоскостные оптические (ZO) фононы, где Z означает, что вектор смещения направлен вдоль оси z ; поперечные акустические (TA), поперечные оптические (TO), продольные акустические (LA) и продольные оптические (LO) фононы, которые соответствуют колебаниям внутри 2D-плоскости.Все частоты положительные, без появления мнимых фононных мод, что указывает на термодинамическую стабильность графеноподобных монооксидов и монохлоридов.
 Флуктуации полной потенциальной энергии для 2D монослоев MgO и NaCl при различных температурах во время AIMD моделирования показаны на рис. 3 и СИ Приложение , рис. С11–С13. Все атомы в двумерных монослоях лишь слегка колеблются вокруг своих положений равновесия после отжига при 300 К в течение 10 пс, что указывает на то, что все эти материалы стабильны при комнатной температуре.Для двумерного монослоя MgO средние значения полной потенциальной энергии остаются практически постоянными в течение всего моделирования в диапазоне температур от 300 до 3000 К, что подтверждает термостабильность этого монослоя при температуре 3000 К. Аналогично, двумерный монослой SrO термоустойчив. при 2000 К, а 2D-монослой NaCl термически стабилен при 500 К. Снимки структур, рассчитанных AIMD при разных температурах, показаны на рис. Плоские шестикоординатные мотивы хорошо сохранялись при комнатной температуре для 2D монослоев MgO, SrO и NaCl.При 3500 К некоторые связи в двумерном монослое MgO разорвались, но в целом система все еще держалась.
Флуктуации полной потенциальной энергии для 2D монослоев MgO и NaCl при различных температурах во время AIMD моделирования показаны на рис. 3 и СИ Приложение , рис. С11–С13. Все атомы в двумерных монослоях лишь слегка колеблются вокруг своих положений равновесия после отжига при 300 К в течение 10 пс, что указывает на то, что все эти материалы стабильны при комнатной температуре.Для двумерного монослоя MgO средние значения полной потенциальной энергии остаются практически постоянными в течение всего моделирования в диапазоне температур от 300 до 3000 К, что подтверждает термостабильность этого монослоя при температуре 3000 К. Аналогично, двумерный монослой SrO термоустойчив. при 2000 К, а 2D-монослой NaCl термически стабилен при 500 К. Снимки структур, рассчитанных AIMD при разных температурах, показаны на рис. Плоские шестикоординатные мотивы хорошо сохранялись при комнатной температуре для 2D монослоев MgO, SrO и NaCl.При 3500 К некоторые связи в двумерном монослое MgO разорвались, но в целом система все еще держалась. В случае SrO атомы значительно флуктуируют, и система показывает реконструкцию при 2500 К, что означает нарушение двумерных шестикоординатных мотивов. При 1000 К к 10 пс начинает плавиться 2D-монослой NaCl. Эти результаты свидетельствуют о том, что эти двумерные монослои обладают превосходной термической стабильностью и могут сохранять структурную целостность и плоскую геометрию.
В случае SrO атомы значительно флуктуируют, и система показывает реконструкцию при 2500 К, что означает нарушение двумерных шестикоординатных мотивов. При 1000 К к 10 пс начинает плавиться 2D-монослой NaCl. Эти результаты свидетельствуют о том, что эти двумерные монослои обладают превосходной термической стабильностью и могут сохранять структурную целостность и плоскую геометрию. 4. Для сравнения мы также рассчитали зонную структуру графена, используя аналогичные методы, как показано на рис.4 В . Графен демонстрирует типичный характер полосы Дирака, что согласуется с предыдущими исследованиями (24⇓–26). На рис. 4 C – E показана зонная структура монослоев MgO, NaCl и CdO 2D соответственно. Структуры полос для других двумерных монослоев можно найти в SI, Приложение , рис. S14, вместе со сравнением ширины запрещенной зоны с экспериментальными значениями в SI, Приложение , Таблица S3. Обратите внимание, что расчеты в приближении обобщенного градиента (GGA), как правило, недооценивают ширину запрещенной зоны полупроводниковых материалов.Таким образом, зонные структуры были рассчитаны с использованием GGA Perdew-Burke-Ernzerhof, пересмотренного для твердых тел (PBEsol), как с псевдопотенциалом волны с усилением проектора (PAW), так и с псевдопотенциалом, сохраняющим норму, со строго ограниченным надлежащим образом нормированным (SCAN) мета-GGA, Heyd- Функционал Скусерия-Эрнцергофа (HSE06) обменный функционал и сохраняющий норму псевдопотенциал.
4. Для сравнения мы также рассчитали зонную структуру графена, используя аналогичные методы, как показано на рис.4 В . Графен демонстрирует типичный характер полосы Дирака, что согласуется с предыдущими исследованиями (24⇓–26). На рис. 4 C – E показана зонная структура монослоев MgO, NaCl и CdO 2D соответственно. Структуры полос для других двумерных монослоев можно найти в SI, Приложение , рис. S14, вместе со сравнением ширины запрещенной зоны с экспериментальными значениями в SI, Приложение , Таблица S3. Обратите внимание, что расчеты в приближении обобщенного градиента (GGA), как правило, недооценивают ширину запрещенной зоны полупроводниковых материалов.Таким образом, зонные структуры были рассчитаны с использованием GGA Perdew-Burke-Ernzerhof, пересмотренного для твердых тел (PBEsol), как с псевдопотенциалом волны с усилением проектора (PAW), так и с псевдопотенциалом, сохраняющим норму, со строго ограниченным надлежащим образом нормированным (SCAN) мета-GGA, Heyd- Функционал Скусерия-Эрнцергофа (HSE06) обменный функционал и сохраняющий норму псевдопотенциал. Как видно на рис. 4 A , рассчитанные значения ширины запрещенной зоны с использованием GGA-PBEsol соответствуют значениям ширины запрещенной зоны с использованием SCAN. В функционале обмена SCAN meta-GGA структура полосы немного улучшена, но большее улучшение достигается с использованием гибридного функционала HSE06, как показано на рис.4 С – Е . Монослои MgO и NaCl 2D имеют непрямую ширину запрещенной зоны 4,8 и 6,3 эВ на уровне HSE06 соответственно. Двумерные монослои CdO представляют собой полупроводники с прямой запрещенной зоной с шириной запрещенной зоны 2,5 эВ на уровне HSE06 (0,85 эВ на уровне PBE) в точке Γ. Также была проанализирована вычисленная парциальная плотность состояний (PDOS) предсказанных двумерных материалов. Репрезентативные PDOS для 2D MgO и NaCl представлены на рис. 4. В случае 2D монослоя NaCl максимум валентной зоны (VBM) в основном определяется Cl-p-орбиталями вместе с небольшим вкладом Na-орбиталей. с орбитали.Минимум зоны проводимости (CBM) определяется орбиталями Na-s, Cl-s, Cl-p x и Cl-p y , при этом орбиталь Cl-p z вносит вклад в более высокую зону проводимости.
Как видно на рис. 4 A , рассчитанные значения ширины запрещенной зоны с использованием GGA-PBEsol соответствуют значениям ширины запрещенной зоны с использованием SCAN. В функционале обмена SCAN meta-GGA структура полосы немного улучшена, но большее улучшение достигается с использованием гибридного функционала HSE06, как показано на рис.4 С – Е . Монослои MgO и NaCl 2D имеют непрямую ширину запрещенной зоны 4,8 и 6,3 эВ на уровне HSE06 соответственно. Двумерные монослои CdO представляют собой полупроводники с прямой запрещенной зоной с шириной запрещенной зоны 2,5 эВ на уровне HSE06 (0,85 эВ на уровне PBE) в точке Γ. Также была проанализирована вычисленная парциальная плотность состояний (PDOS) предсказанных двумерных материалов. Репрезентативные PDOS для 2D MgO и NaCl представлены на рис. 4. В случае 2D монослоя NaCl максимум валентной зоны (VBM) в основном определяется Cl-p-орбиталями вместе с небольшим вкладом Na-орбиталей. с орбитали.Минимум зоны проводимости (CBM) определяется орбиталями Na-s, Cl-s, Cl-p x и Cl-p y , при этом орбиталь Cl-p z вносит вклад в более высокую зону проводимости. . Аналогично, в случае двумерного монослоя MgO ВБМ в основном определяется O-p-орбиталями вместе с небольшим вкладом Mg-s-орбиталей. CBM определяется орбиталями Mg-s, O-s, O-p x и O-p y , причем орбиталь O-p z вносит вклад в более высокую зону проводимости.Для случая CdO, показанного в Приложении SI , рис. S15, VBM в основном определяется орбиталями O-2p вместе с вкладами от орбиталей Cd-d и Cd-p. CBM около 2 эВ определяется орбиталями Cd-s и O-s. Они имеют решающее значение для стабилизации плоского гексагонально-скоординированного двумерного каркаса с точки зрения пассивации внеплоскостных связей. Чтобы глубже понять природу и стабильность связи в наших двумерных монослоях, мы дополнительно проанализировали распределение плотности электронов деформации.Графики изоповерхностей деформации электронной плотности монослоев 2D MgO, 2D NaCl и 2D CdO показаны в SI Приложение , рис. S4 H – J . Перенос заряда происходит в основном от атома металла к более электроотрицательным атомам кислорода или хлора.
. Аналогично, в случае двумерного монослоя MgO ВБМ в основном определяется O-p-орбиталями вместе с небольшим вкладом Mg-s-орбиталей. CBM определяется орбиталями Mg-s, O-s, O-p x и O-p y , причем орбиталь O-p z вносит вклад в более высокую зону проводимости.Для случая CdO, показанного в Приложении SI , рис. S15, VBM в основном определяется орбиталями O-2p вместе с вкладами от орбиталей Cd-d и Cd-p. CBM около 2 эВ определяется орбиталями Cd-s и O-s. Они имеют решающее значение для стабилизации плоского гексагонально-скоординированного двумерного каркаса с точки зрения пассивации внеплоскостных связей. Чтобы глубже понять природу и стабильность связи в наших двумерных монослоях, мы дополнительно проанализировали распределение плотности электронов деформации.Графики изоповерхностей деформации электронной плотности монослоев 2D MgO, 2D NaCl и 2D CdO показаны в SI Приложение , рис. S4 H – J . Перенос заряда происходит в основном от атома металла к более электроотрицательным атомам кислорода или хлора. На основе анализа заряда Бейдера мы обнаружили, что каждый атом Mg в двумерном листе MgO передает 1,618 e соседним атомам O, что указывает на значительную ионизацию атомов Mg и донорство электронов кислороду.Точно так же атомы Cl захватывают 0,853 e от каждого атома Na в 2D-листе NaCl, что предполагает донорство электронов атомам Cl. Этот перенос электрона приводит к стабилизации двумерных монослойных листов. Более подробную информацию об анализе заряда по Бейдеру можно найти в SI, Приложение , Таблица S6, вместе с анализом заселенности Малликена, показывающим аналогичный перенос электронов. Анализ общей плотности заряда монослоев 2D MgO (NaCl) показывает, что электроны распределены вокруг атомов кислорода (или хлора) и треугольных сфер Op x (Cl-p x ) и Op y ( Орбитали Cl-p y ) имеют наибольшую деформацию, распространяясь по связям Mg–O (Na–Cl).Для двумерного монослоя CdO заметная концентрация электронной плотности вдоль контактов Cd-O указывает на типичные характеристики ковалентных соединений.
На основе анализа заряда Бейдера мы обнаружили, что каждый атом Mg в двумерном листе MgO передает 1,618 e соседним атомам O, что указывает на значительную ионизацию атомов Mg и донорство электронов кислороду.Точно так же атомы Cl захватывают 0,853 e от каждого атома Na в 2D-листе NaCl, что предполагает донорство электронов атомам Cl. Этот перенос электрона приводит к стабилизации двумерных монослойных листов. Более подробную информацию об анализе заряда по Бейдеру можно найти в SI, Приложение , Таблица S6, вместе с анализом заселенности Малликена, показывающим аналогичный перенос электронов. Анализ общей плотности заряда монослоев 2D MgO (NaCl) показывает, что электроны распределены вокруг атомов кислорода (или хлора) и треугольных сфер Op x (Cl-p x ) и Op y ( Орбитали Cl-p y ) имеют наибольшую деформацию, распространяясь по связям Mg–O (Na–Cl).Для двумерного монослоя CdO заметная концентрация электронной плотности вдоль контактов Cd-O указывает на типичные характеристики ковалентных соединений. Затем мы дополнительно проанализировали функцию локализации электронов (ELF) (27). Значения ELF, которые могут варьироваться от 0 до 1, указывают на степень локализации электронов. Для вида сверху и сбоку в Приложение SI , рис. S16–S18, орбитали O-p и Cl-p, показанные зеленым цветом (ELF = 0,50), подразумевают сильно делокализованные особенности. Синие контуры вокруг атомов металла (ELF = 0.00) указывают на электронный дефицит атомов металла в двумерном монослое, что согласуется с деформационной электронной плотностью и зарядовым анализом Бейдера.
Затем мы дополнительно проанализировали функцию локализации электронов (ELF) (27). Значения ELF, которые могут варьироваться от 0 до 1, указывают на степень локализации электронов. Для вида сверху и сбоку в Приложение SI , рис. S16–S18, орбитали O-p и Cl-p, показанные зеленым цветом (ELF = 0,50), подразумевают сильно делокализованные особенности. Синие контуры вокруг атомов металла (ELF = 0.00) указывают на электронный дефицит атомов металла в двумерном монослое, что согласуется с деформационной электронной плотностью и зарядовым анализом Бейдера. Области накопления и истощения заряда показаны красным и синим цветом соответственно.
Области накопления и истощения заряда показаны красным и синим цветом соответственно. Эта отрицательная частота может быть преобразована в положительную с учетом воздействия внешнего стресса, как показано в SI Приложение , рис. S10, что указывает на то, что внешние стрессы могут помочь стабилизировать монослои 2D CdSe.
Эта отрицательная частота может быть преобразована в положительную с учетом воздействия внешнего стресса, как показано в SI Приложение , рис. S10, что указывает на то, что внешние стрессы могут помочь стабилизировать монослои 2D CdSe. Работа также поддерживалась Национальной лабораторией информационных наук и технологий Цинхуа.
Работа также поддерживалась Национальной лабораторией информационных наук и технологий Цинхуа.