Электронное строение атомов онлайн — сервис
Электрон — это носитель элементарного электрического заряда. Наличие и передача электрического заряда происходит в следствие передачи электронов телами.
Электронное строение атома.
Как известно, все вещества состоят из атомов, в центре каждого из них расположено положительно заряженное ядро, которое окружает электронная оболочка. Ядро атома состоит из протонов (p+) — положительно заряженных частиц и нейтронов (n0) — частицы, которые не имеют заряда, по массе они примерно равны с протонами. Число протонов N (p+) равняется заряду ядра Z, а также порядковому номеру химического элемента в периодической системе элементов, что можно записать как:
N (p+) = Z
А число протонов N (n0) можно просто записать как N.
Если сложить сумму числа протонов (Z) и нейтронов N, получим массовое число (А):
A = Z + N
Электронная оболочка атома состоит из отрицательно заряженных электронов (е-), которые движутся вокруг ядра.
s-подуровень — из одной s-орбитали
p-подуровень — из трех p-орбиталей
d-подуровень — из пяти d-орбиталей
Для обозначения подуровня к его буквенному обозначению добавляется номер слоя (уровня).
Общее количество электронов в электронном слое (уровне) равняется 2n2.
Чтобы решить поставленную задачу, воспользуйтесь онлайн калькулятором, вам нужно ввести исходные данные и в считанные секунды получить требуемый результат.
Электронное строение атомов онлайн
Электронное строение атома, схема и примеры
Понятие «атом»
Понятие «атом» знакомо человечеству ещё со времен Древней Греции. Согласно высказыванию древних философов, атом представляет собой мельчайшую частицу, входящую в состав вещества.
Электронное строение атома
Атом состоит из положительно заряженного ядра внутри которого находятся протоны и нейтроны. Вокруг ядра по орбитам движутся электроны, каждый из которых можно охарактеризовать набором из четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml) и спинового (ms или s).
Главное квантовое число определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия. Другими словами, главное квантовое число определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до бесконечности.
Орбитальное квантовое число характеризует форму электронного облака. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т.е. расщепление её на энергетические подуровне. Орбитальное квантовое число может имеет значения от нуля до (n-1), всего n значений. Энергетические подуровни обозначают буквами:
|
Значение l |
1 |
2 |
3 |
4 |
5 |
|
Обозначение |
s |
p |
d |
f |
h |
|
Форма |
шар |
объемная восьмерка |
более сложная форма |
||
Магнитное квантовое число показывает ориентацию орбитали в пространстве. Оно принимает любое целое числовое значение от (+l) до (-l), включая нуль. Число возможных значений магнитного квантового числа равна (2l+1).
Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментам импульса, характеризующим его веретенообразное вращение вокруг собственной оси. Это свойства электрона получило название спина. Величину и ориентацию спина характеризует спиновое квантовое число, которое может принимать значения (+1/2) и (-1/2). Положительное и отрицательное значения спина связаны с его направлением.
До того, как все вышеописанное стало известно и подтверждено экспериментально существовало несколько моделей строения атома. Одна из первых моделей строения атома была предложена Э. Резерфордом, который в опытах по рассеянию α-частиц показал, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре. Согласно его модели, вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален.
Развивать модель строения атома Резерфорда стал Н. Бор, который в своем исследовании также объединил учения Эйнштейна о световых квантах и квантовую теорию излучения Планка. Завершили начатое и представили миру современную модель строения атома химического элемента Луи де Бройль и Шредингер.
Примеры решения задач
1.1.1. Строение электронных оболочек атомов химических элементов.
Химия — наука о веществах, их свойствах и превращениях.
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
— образование осадка при кипячении воды, называемого в быту накипью;
— выделение тепла и света при горении костра;
— изменение цвета среза свежего яблока на воздухе;
— образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p+, no и e−. Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. mp ≈ mn , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. mp/me ≈ mn/me ≈ 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
| атом1 | атом2 | атом3 | атом4 | |
| ядро | 1p+ | 1p+, 1n0 | 4p+, 3n0 | 4p+, 4n0 |
| оболочка | 1e− | 1e− | 4e− | 4e− |
Вид атомов с одинаковым зарядом ядер, т.е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Каждый химический элемент имеет свое название и индивидуальный символ, который читается определенным образом. Так, например, самый простой химический элемент, атомы которого содержат в ядре только один протон, имеет название «водород» и обозначается символом «Н», что читается как «аш», а химический элемент с зарядом ядра +7 (т.е. содержащий 7 протонов) — «азот», имеет символ «N» , который читается как «эн».
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1Н, 2Н и 3Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1Н вообще нет нейтронов (1-1=0), в изотопе 2Н – 1 нейтрон (2-1=1) и в изотопе 3Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2Н практически в два раза тяжелее изотопа 1Н, а изотоп 3Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2Н и 3Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2Н дали название дейтерий и присвоили символ D, а изотопу 3Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:

Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:

Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.
Орбитали с l = 0 называют s-орбиталями. s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
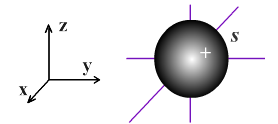
Орбитали с l = 1 называются p-орбиталями. Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:

Орбитали с l = 2 называются d-орбиталями, а с l = 3 – f-орбиталями. Их строение намного более сложное.
3) Магнитное квантовое число – ml – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число ml соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1). Так, например, при l = 0 ml = 0 (одно значение), при l = 1 ml = -1, 0, +1 (три значения), при l = 2 ml = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
4) Спиновое квантовое число (или просто спин) — ms — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения . Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ↓ и ↑.
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:

Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и ml.
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
- Принцип минимума энергии: электроны заполняют орбитали, начиная с подуровня с наименьшей энергией. Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Для того чтобы проще запомнить данную последовательность заполнения электронных подуровней, весьма удобна следующая графическая иллюстрация:
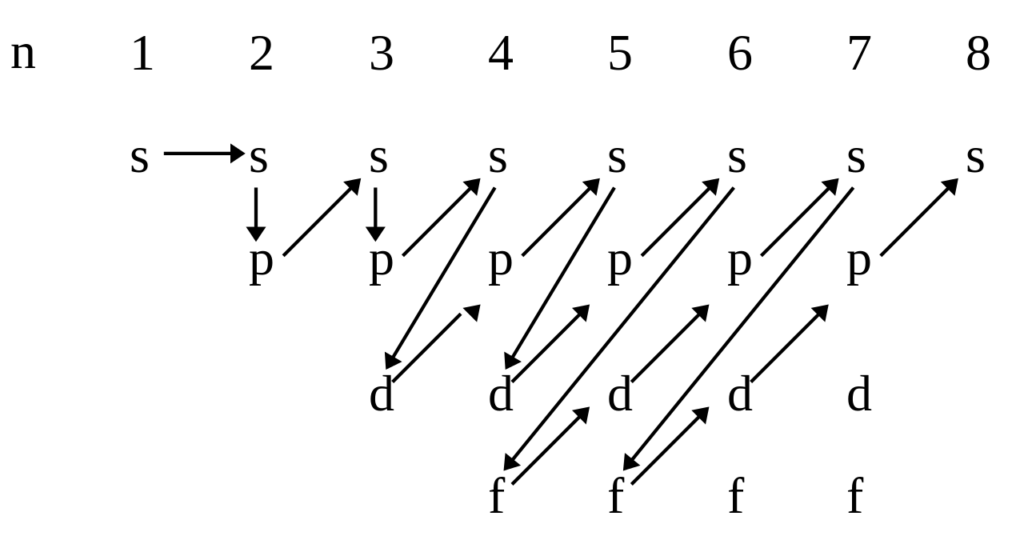
- Принцип Паули: на каждой орбитали может находиться не более двух электронов.
Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой.
- Правило Хунда: наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.
Фактически вышесказанное означает то, что, например, размещение 1-го, 2-х, 3-х и 4-х электронов на трех орбиталях p-подуровня будет осуществляться следующим образом:

Заполнение атомных орбиталей от водорода, имеющего зарядовое число равное 1, до криптона (Kr) с зарядовым числом 36 будет осуществляться следующим образом:

Подобное изображение порядка заполнения атомных орбиталей называется энергетической диаграммой. Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т.е. фосфор (P), будет иметь следующий вид энергетической диаграммы:

При переводе в электронную формулу атома фосфора примет вид:
15P = 1s22s22p63s23p3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s1 |
| 2 | He | гелий | 1s2 | |
| II | 3 | Li | литий | 1s22s1 |
| 4 | Be | бериллий | 1s22s2 | |
| 5 | B | бор | 1s22s22p1 | |
| 6 | C | углерод | 1s22s22p2 | |
| 7 | N | азот | 1s22s22p3 | |
| 8 | O | кислород | 1s22s22p4 | |
| 9 | F | фтор | 1s22s22p5 | |
| 10 | Ne | неон | 1s22s22p6 | |
| III | 11 | Na | натрий | 1s22s22p63s1 |
| 12 | Mg | магний | 1s22s22p63s2 | |
| 13 | Al | алюминий | 1s22s22p63s23p1 | |
| 14 | Si | кремний | 1s22s22p63s23p2 | |
| 15 | P | фосфор | 1s22s22p63s23p3 | |
| 16 | S | сера | 1s22s22p63s23p4 | |
| 17 | Cl | хлор | 1s22s22p63s23p5 | |
| 18 | Ar | аргон | 1s22s22p63s23p6 | |
| IV | 19 | K | калий | 1s22s22p63s23p64s1 |
| 20 | Ca | кальций | 1s22s22p63s23p64s2 | |
| 21 | Sc | скандий | 1s22s22p63s23p64s23d1 | |
| 22 | Ti | титан | 1s22s22p63s23p64s23d2 | |
| 23 | V | ванадий | 1s22s22p63s23p64s23d3 | |
| 24 | Cr | хром | 1s22s22p63s23p64s13d5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s22s22p63s23p64s23d5 | |
| 26 | Fe | железо | 1s22s22p63s23p64s23d6 | |
| 27 | Co | кобальт | 1s22s22p63s23p64s23d7 | |
| 28 | Ni | никель | 1s22s22p63s23p64s23d8 | |
| 29 | Cu | медь | 1s22s22p63s23p64s13d10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s22s22p63s23p64s23d10 | |
| 31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 | |
| 32 | Ge | германий | 1s22s22p63s23p64s23d104p2 | |
| 33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 | |
| 34 | Se | селен | 1s22s22p63s23p64s23d104p4 | |
| 35 | Br | бром | 1s22s22p63s23p64s23d104p5 | |
| 36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5B = 1s22s22p1

А в возбужденном состоянии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5B* = 1s22s12p2

В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень. К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
- d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
Онлайн урок: Строение атома по предмету Химия 8 класс
В ходе изучения химии вы уже познакомились со многими веществами и их свойствами. В нескольких уроках вам встречалось строение атома. Настало время познакомиться с ним более подробно.
Это нужно для того, чтобы лучше понимать понятия «валентность» и «степень окисления», уметь составлять формулы химических соединений и понимать формулы веществ, изображаенных схемами.
Здесь вы видите, из чего устроены молекулы веществ:
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
С одним из интересных свойств атома связана радиоактивность.
Радиоактивность – свойство атома самопроизвольно излучать невидимые глазом частицы; оно обусловлено распадом их атомных ядер, превращением в другие элементы.
Радиоактивными являются не все атомы.
Как правило, в среднем чем больше масса ядра, тем больше его нестабильность.
Распад радиоактивного атомного ядра сопровождается выбросом трех видов излучений (атом может излучать какой-либо один вид частиц или их комбинацию):- альфа излучение α
- бета излучение β
- гамма излучение γ
α-лучи представляют собой ядра атомов гелия – частицы, состоящей из двух протонов и двух нейтронов
β-лучи – электроны
γ-лучи – электромагнитное излучение с очень большой частотой: на шкале электромагнитых волн оно находится левее рентгеновского излучения, а значит, является более энергетичным
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Используя α-излучение и испытывая его действие на тонкую металлическую фольгу, Эрнест Резерфорд обнаружил, что α-частицы, проходя через нее, отклоняются от первоначального направления движения.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Это открытие послужило экспериментальным доказательством существования положительно заряженного ядра атома. На его основе в 1911 г. ученый создал планетарную модель атома.
Согласно планетарной модели, атом состоит из несущего положительный заряд ядра и движущихся вокруг него отрицательно заряженных электронов.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Сейчас эту модель называют модель Резерфорда-Бора. Датский физик Нильс Бор внёс уточнение в схему Резерфорда: он сказал, что электроны движутся вокруг ядра не хаотично, а по строго определенным орбитам, а также рассчитал радиусы этих орбит.
Радиус первой орбиты в атоме водорода 5,2917720859 х 10−11 м в физики сейчас называют боровским радиусом.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Позже были открыты составные части атомного ядра: протон и нейтрон, а еще позднее было выявлено огромное число разнообразных микрочастиц.
Таким образом, по современным представлениям, атом состоит из ядра и электронов. В свою очередь, ядро состоит из протонов и нейтронов.
По своей массе протоны и нейтроны почти одинаковы, их массы равны 1 дальтону (атомная единица массы). Протон имеет положительный заряд, условно принятый равным +1, а нейтрон заряда не имеет.
Электрон имеет заряд, по модулю равный заряду протона, но отрицательный, то есть –1. Масса электрона примерно в 1800 раз меньше массы протона, поэтому ей пренебрегают. Протоны обозначают символом р, нейтроны – n, электроны – е.
Согласно современной теории ядра, протоны и нейтроны связаны между собой сильным взаимодействием.
Всего физики выделяют 4 вида взаимодействий: сильные (ядерные), слабые, гравитационные, электромагнитные.
Составляющие атом частицы обусловливают его важнейшие характеристики.
Заряд ядра – важнейшая характеристика атома и соответствующего ему химического элемента.
Положительный заряд ядра обусловлен протонами: заряд ядра равен числу протонов в нем.
Порядковый номер элемента в периодической системе Менделеева как раз и равен заряду ядра его атомов и обозначается буквой Z.
Таким образом, химический элемент – это вид атомов с одинаковым зарядом ядра.
Другой характеристикой атома, зависимой от частиц ядра, является масса ядра.
Масса ядра складывается из числа протонов и нейтронов в ядре атома.
От количества и расположения электронов в атоме зависят его качественные характеристики: способность объединяться с другими атомами и химические свойства.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов
Билет № 3
1. Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | 1 |
| нейтрон | n | 0 | 1 |
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле:
N = 2n2, где N — максимальное число электронов на уровне,
n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень
важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:
1
8
2
следует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e−,
на 2-м — 8 e−,
на внешнем уровне — 8 e−; - числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
- Третий, наружный уровень содержит 1 e− (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
2. Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Пример:
Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г?
Решение:
- Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑
- Находим молярную массу соляной кислоты: M (HCl) = 1 + 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых, кроме хлора, который берется 35,5) - Находим количество вещества соляной кислоты: n (HCl) = m / M = 146 г / 36,5 г/моль = 4 моль
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль - Составляем пропорцию:
4 моль — x моль
2 моль — 1 моль
(или с пояснением:
из 4 моль соляной кислоты получится x моль водорода,
а из 2 моль — 1 моль) - Находим x:
x = 4 моль • 1 моль / 2 моль = 2 моль
Ответ: 2 моль.
автор: Владимир Соколов
Строение электронных оболочек атомов » HimEge.ru
Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы.
•Атом состоит из ядра и электронной оболочки
•Электронная оболочка – совокупность движущихся вокруг ядра электронов
•Ядра атомов заряжены положительно, они состоят из протонов (положительно заряженных частиц) p+ и нейтронов (не имеющих заряда) no
•Атом в целом электронейтрален, число электронов е– равно числу протонов p+, равно порядковому номеру элемента в таблице Менделеева.
На рисунке изображена планетарная модель атома, согласно которой электроны движутся по стационарным круговым орбитам. Она очень наглядна, но не отражает сути, т.к в действительности законы микромира подчиняются на классической механике, а квантовой, которая учитывает волновые свойства электрона.
Согласно квантовой механике электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью (не путать с орбитой!) или электронным облаком.
Т.е у электрона отсутствует понятие «траектория», электроны не движутся ни по круговым орбитам, ни по каким-либо другим. Самая большая сложность квантовой механики заключается в том, что это невозможно представить, мы все привыкли к явлениям макромира, подчиняющегося классической механике, где любая движущаяся частица имеет свою траекторию.
Итак, электрон имеет сложное движение, может находится в любом месте пространства около ядра, но с разной вероятностью. Давайте теперь рассмотрим те части пространства, где вероятность нахождения электрона достаточно высока — орбитали — их формы и последовательность заполнения орбиталей электронами.
Представим себе трехмерную систему координат, в центре которой находится ядро атома.
Вначале идет заполнение 1s орбитали, она располагается ближе всего к ядру и имеет форму сферы.
Обозначение любой орбитали складывается из цифры и латинской буквы. Цифра показывает уровень энергии, а буква — форму орбитали.
1s орбиталь имеет наименьшую энергию и электроны находящиеся на этой орбитали имеют наименьшую энергию.
На этой орбитали могут находиться не более двух электронов. Электроны атомов водорода и гелия (первых двух элементов) находятся именно на этой орбитали.
Электронная конфигурация водорода: 1s1
Электронная конфигурация гелия: 1s2
Верхний индекс показывает количество электронов на этой орбитали.
Следующий элемент — литий, у него 3 электрона, два из которых располагаются на 1s орбитали, а где же располагается третий электрон?
Он занимает следующую по энергии орбиталь — 2s орбиталь . Она также имеет форму сферы, но большего радиуса (1s орбиталь находится внутри 2s орбитали).
Электроны, находящиеся на этой орбитали имеют большую энергию, по сравнению с 1s орбиталью, т.к они расположены дальше от ядра. Максимум на этой орбитали может находится также 2 электрона.
Электронная конфигурация лития: 1s2 2s1
Электронная конфигурация бериллия: 1s2 2s2
У следующего элемента — бора — уже 5 электронов, и пятый электрон будет заполнять орбиталь, обладающую ещё большей энергией- 2р орбиталь. Р-орбитали имеют форму гантели или восьмерки и располагаются вдоль координатных осей перпендикулярно друг другу.
На каждой р-орбитали может находится не более двух электронов, таким образом на трех р-орбиталях — не более шести. Валентные электроны следующих шести элементов заполняют р-орбитали, поэтому их относят к р-элементам.
Электронная конфигурация атома бора: 1s2 2s2 2р1
Электронная конфигурация атома углерода: 1s2 2s2 2р2
Электронная конфигурация атома азота: 1s2 2s2 2р3
Электронная конфигурация атома кислорода: 1s2 2s2 2р4
Электронная конфигурация атома фтора: 1s2 2s2 2р5
Электронная конфигурация атома неона: 1s2 2s2 2р6
Графически электронные формулы этих атомов изображены ниже:
Квадратик — это орбиталь или квантовая ячейка, стрелочкой обозначается электрон, направление стрелочки — это особая характеристика движения электрона — спин (упрощенно можно представить как вращение электрона вокруг своей оси по часовой и против часовой стрелки). Нужно знать то, что на одной орбитали не может быть двух электронов с одинаковыми спинами (в одном квадратике нельзя рисовать две стрелочки в одном направлении!). Это и есть принцип запрета В.Паули: «В атоме не может быть даже двух электронов, у которых все четыре квантовых числа были бы одинаковыми»
Существует ещё одно правило (правило Гунда), по которому электроны расселяются на одинаковых по энергии орбиталях сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами, такие электроны называют спаренными.
Атом неона имеет завершенный внешний уровень из восьми электронов (2 s-электрона+6 p-электронов =8 электронов на втором энергетическом уровне), такая конфигурация является энергетически выгодной, и её стремятся приобрести все другие атомы. Именно поэтому элементы 8 А группы — благородные газы — столь инертны в химическом отношении.
Следующий элемент — натрий, порядковый номер 11, первый элемент третьего периода, у него появляется ещё один энергетический уровень — третий. Одиннадцатый электрон будет заселять следующую по энергии орбиталь -3s орбиталь.
Электронная конфигурация атома натрия: 1s2 2s2 2р6 3s1
Далее происходит заполнение орбиталей элементов третьего периода, сначала заполняется 3s подуровень с двумя электронами, а потом 3р подуровень с шестью электронами (аналогично второму периоду) до благородного газа аргона, имеющего, подобно неону, завершенный восьмиэлектронный внешний уровень. Электронная конфигурация атома аргона (18 электронов): 1s2 2s2 2р6 3s2 3р6
Четвертый период начинается с элемента калия (порядковый номер 19), последний внешний электрон которого располагается на 4s орбитали. Двадцатый электрон кальция также заполняет 4s орбиталь.
За кальцием идет ряд из 10 d-элементов, начиная со скандия (порядковый номер 21) и заканчивая цинком (порядковый номер 30). Электроны этих атомов заполняют 3d орбитали, внешний вид которых представлен на рисунке ниже.
Далее идут шесть р-элементов (происходит заполнение 4р орбиталей). Заканчивается четвертый период инертным газом криптоном, электронная конфигурация которого 1s2 2s2 2р6 3s2 3p6 4s2 3d10 4р6
Итак, подведем итоги:
- Энергетические уровни соответствуют номеру периода. Энергетические уровни делятся на подуровни (первый уровень состоит из одного подуровня, второй уровень из двух подуровней, третий — из трех и т.д).
- s подуровень состоит из одной s орбитали, p подуровень — из трех р орбиталей, d подуровень из 5 d орбиталей.
- На каждой орбитали может находится не более двух электронов.
Смотрите также Атомная теория
и явление «проскока» электрона.