Ковалентная неполярная связь определение. Типы химической связи
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» — совместно и «vales» — имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
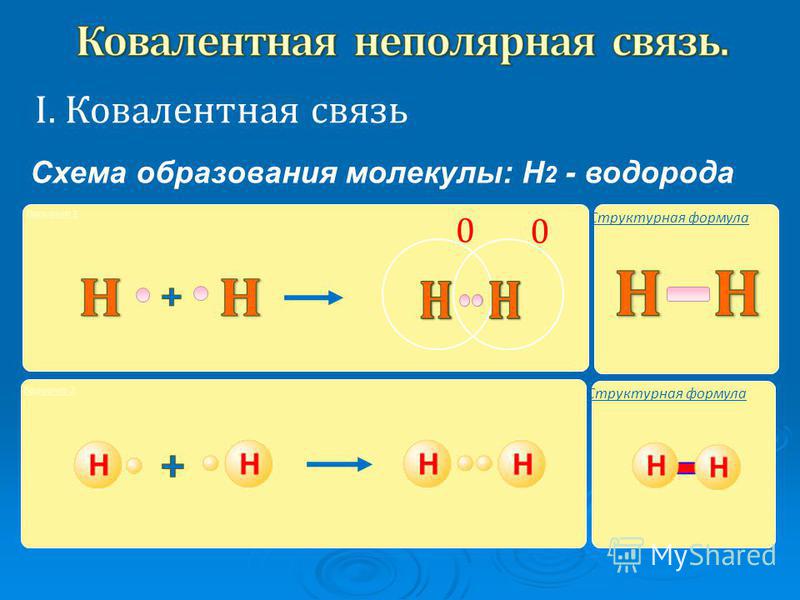
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор — свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и общественные электроны не принадлежат в равной степени двум атомам. Большую часть времени общественные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там общественные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Большую часть времени общественные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там общественные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Химическим элементарным частицам свойственно соединяться друг с другом посредством формирования специальных взаимосвязей. Они бывают полярными и неполярными. Каждая из них имеет определенный механизм формирования и условия возникновения.
Вконтакте
Что это
Ковалентная связь — это образование, возникающее у элементов с неметаллическими свойствами . Наличие приставки «ко» свидетельствует о совместном участии атомных электронов разных элементов.
Понятие «валенты» означает наличие определенной силы. Возникновение такой взаимосвязи происходит посредством обобществления атомных электронов, не имеющих «пары».
Указанные химические связи возникают за счет появления «копилки» электронов, являющейся общей для обеих взаимодействующих частиц. Появление пар электронов осуществляется вследствие накладывания друг на друга электронных орбиталей. Указанные виды взаимодействия возникают между электронными облаками обоих элементов .
Важно! Ковалентная взаимосвязь появляется в случае объединения пары орбиталей.
Веществами с описанной структурой являются:
- многочисленные газы;
- спирты;
- углеводы;
- белки;
- органические кислоты.
Ковалентная химическая связь образуется за счет формирования общественных пар электронов у простых веществ либо сложных соединений. Она бывает полярная и неполярная.
Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц , присутствующих в формуле.
Химические связи описанного вида формируются только между элементами, где преобладают неметаллические свойства.
Если в соединении присутствуют атомы одинаковых либо разных неметаллов, значит возникающие между ними взаимосвязи – «ковалентные».
Когда в соединении одновременно присутствуют металл и неметалл говорят об образовании взаимосвязи.
Структура с «полюсами»
Ковалентная полярная связь соединяет друг с другом атомы разных по природе неметаллов. Это могут быть атомы:
Это могут быть атомы:
- фосфора и ;
- хлора и ;
- аммиака.
Есть и другое определение для указанных веществ. Оно говорит о том, что данная «цепочка» формируется между неметаллами
Формула вещества с ковалентной полярной связью – это:
- NO и многие другие.
Представленные соединения в нормальных условиях могут иметь жидкие либо газообразные агрегатные состояния. Формула Льюиса помогает точнее понять механизм связывания атомных ядер.
Как появляется
Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Обычно она смещается к элементу, имеющему наибольший показатель электроотрицательности. Его можно определить по специальной таблице.
Из-за смещения общей пары «электрончиков» в сторону элемента с большим значением электроотрицательности, на нем частично формируется отрицательный заряд.
Соответственно другой элемент получит частичный положительный заряд. Вследствие этого образуется соединение с двумя разнозаряженными полюсами.
Нередко при образовании полярной взаимосвязи используется акцепторный механизм или донорно-акцепторный механизм. Примером вещества, образованного по данному механизму, служит молекула аммиака. В нем азот наделен свободной орбиталью, а водород – свободным электроном. Образующая общая электронная пара занимает данную орбиталь азота, в результате чего один элемент становится донором, а другой акцептором.
Описанный механизм образования ковалентной связи , как вид взаимодействия, характерен не для всех соединений с полярным связыванием. Примерами могут служить вещества органического, а также неорганического происхождения.
О неполярной структуре
Ковалентная неполярная связь связывает между собой элементы с неметаллическими свойствами, имеющими одинаковые значения электроотрицательности.
Формула вещества с ковалентной неполярной взаимосвязью:
Примеры соединений, относящиеся к указанной категории являются веществами простого строения . В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В некоторой литературе их именуют валентными. Под подразумевают количество электронов, необходимых для завершения внешней оболочки. Атом может отдавать или принимать отрицательно заряженные частицы.
Описанная взаимосвязь относится к категории двухэлектронных либо двухцентровых цепочек. При этом пара электронов занимает общее положение между двумя орбиталями элементов. В структурных формулах электронную пару записывают в виде горизонтальной черты или «-». Каждая такая черточка показывает количество общих электронных пар в молекуле.
Для разрыва веществ с указанным видом взаимосвязи требуется затратить максимальное количество энергии, поэтому эти вещества являются одними из прочных по шкале прочности.
Внимание! В данную категорию относят алмаз – одно из самых прочных соединений в природе.
Как появляется
По донорно-акцепторному механизму неполярные взаимосвязи практически не соединяются. Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Сходством ковалентной полярной и неполярной связи является появление общей электронной плотности. Только во втором случае образующиеся электронные «копилки» в одинаковой мере принадлежат обоим атомам, занимая центральное положение. В результате не образуются частичные положительные и отрицательные заряды, а значит образующиеся «цепи» являются неполярными.
Важно! Неполярная взаимосвязь приводит к образованию общей электронной пары, за счет чего последний электронный уровень атома становится завершенным.
Свойства веществ с описанными структурами существенно различаются от свойств веществ с металлической либо ионной взаимосвязью.
Что такое ковалентная полярная связь
Какие бывают виды химической связи
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь .
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
В образовании химических связей принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными . Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s- орбитали и 1 на 2p -орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl 4 , H 2 S, CO 2 , NH 3 , SiO 2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH 4 + :
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом , а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом .
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:
Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F − , Cl − , S 2-), а также между простыми катионами и сложными анионами (NO 3 − , SO 4 2- , PO 4 3- , OH −). Поэтому к ионным соединениям относят соли и основания (Na 2 SO 4 , Cu(NO 3) 2 , (NH 4) 2 SO 4), Ca(OH) 2 , NaOH)
Поэтому к ионным соединениям относят соли и основания (Na 2 SO 4 , Cu(NO 3) 2 , (NH 4) 2 SO 4), Ca(OH) 2 , NaOH)
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М 0 — ne − = M n + ,
где М 0 – нейтральный атом металла, а M n + катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Определение
Ковалентной связью называется химическая связь, образующаяся за счёт обобществления атомами своих валентных электронов. Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых расположены валентные электроны. В простейшем случае перекрывание двух АО приводит к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО:
Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых расположены валентные электроны. В простейшем случае перекрывание двух АО приводит к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО:
Образование связи
Ковалентная связь (атомная связь, гомеополярная связь) — связь между двумя атомами за счёт обобществления (electron sharing) двух электронов — по одному от каждого атома:
A. + В. -> А: В
По этой причине гомеополярная связь имеет направленный характер. Пара электронов, осуществляющая связь, принадлежит одновременно обоим связываемым атомам, например:
| .. | .. | .. | |||||||||
| : | Cl | : | Cl | : | H | : | O | : | H | ||
. . . | .. | .. |
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом ее образования:
1. Простая ковалентная связь . Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными. Если атомы, образующие простую ковалентную связь одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующиеся связь в равной степени владеют обобществленной электронной парой, такая связь называется неполярной ковалентной связью. Если атомы различны, тогда степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов, атом с большей электроотрицательностью в большей степени обладает парой электронов связи, и поэтому его истинный заряд имеет отрицательный знак, атом с меньшей электроотрицательностью приобретает соответственно такой же по величине заряд, но с положительным знаком.
Сигма (σ)-, пи (π )-связи — приближенное описание видов ковалентных связей в молекулах органических соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен , ацетилен и бензол .
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода.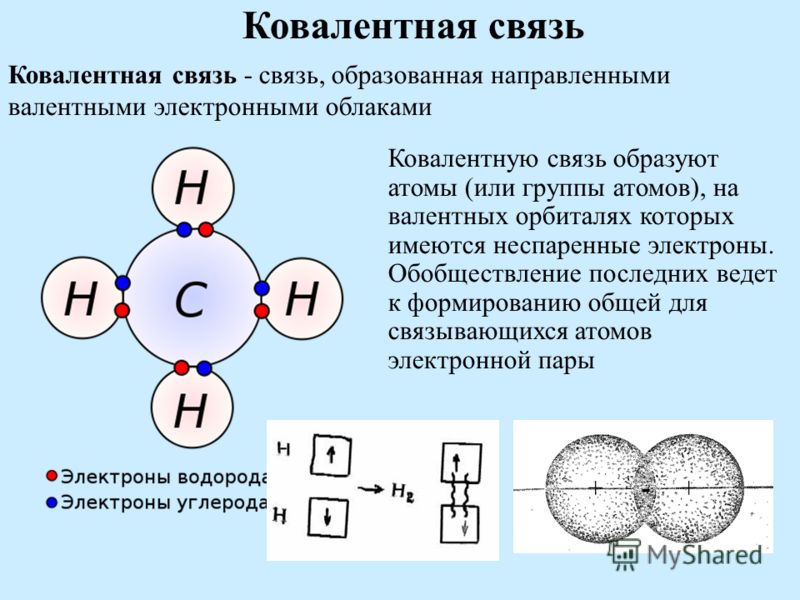 Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π
-связью.
Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π
-связью.
В линейной молекуле ацетилена
Н-С≡С-Н (Н: С::: С: Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π -связи между этими же атомами углерода. Две π -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С 6 H 6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π
-связи, а единая π
-электронная система из шести электронов, общая для всех атомов углерода.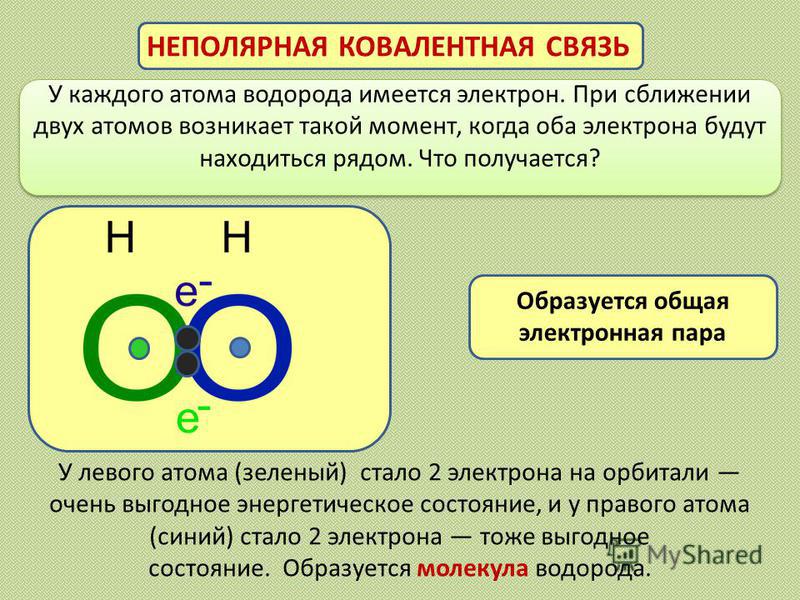 Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов. Различают две основные разновидности ковалентной связи:
- Ковалентная неполярная связь образуется между атомами неметалла одного и того же химического элемента. Такую связь имеют простые вещества , например О 2 ; N 2 ; C 12 .
- Ковалентная полярная связь образуется между атомами различных неметаллов.
См. также
Литература
- «Химический энциклопедический словарь», М., «Советская энциклопедия», 1983, с.264.
| Органическая химия |
|---|
| Список органических соединений |
| Структурная химия | |
|---|---|
| Химическая связь : | Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия |
| Отображение структуры: | Функциональная группа | Структурная формула | Химическая формула | Лиганд |
| Электронные свойства: | Электроотрицательность | Сродство к электрону | Энергия ионизации | Диполь | Правило октета |
| Стереохимия : | Асимметрический атом | Изомерия | Конфигурация | Хиральность | Конформация |
Wikimedia Foundation
. 2010
.
2010
.
- Большая политехническая энциклопедия
ХИМИЧЕСКАЯ СВЯЗЬ, механизм, за счет которого атомы соединяются и образуют молекулы. Имеется несколько типов такой связи, основанных либо на притяжении противоположных зарядов, либо на образовании устойчивых конфигураций путем обмена электронами.… … Научно-технический энциклопедический словарь
Химическая связь — ХИМИЧЕСКАЯ СВЯЗЬ, взаимодействие атомов, обусловливающее их соединение в молекулы и кристаллы. Действующие при образовании химической связи силы имеют в основном электрическую природу. Образование химической связи сопровождается перестройкой… … Иллюстрированный энциклопедический словарь
Взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют Х. с. Валентность атома (о чём подробнее сказано ниже) показывает число связей … Большая советская энциклопедия
химическая связь — взаимное притяжение атомов, приводящее к образованию молекул и кристаллов.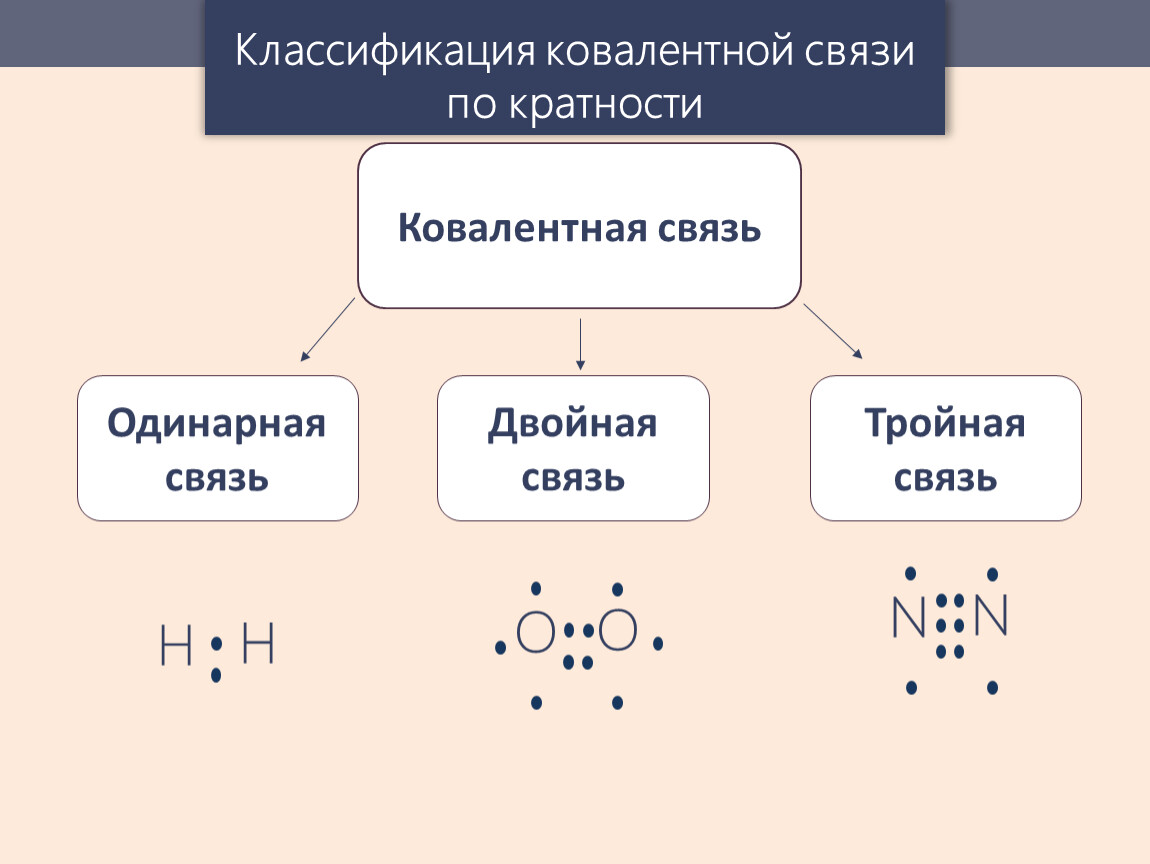 Валентность атома показывает число связей, образованных данным атомом с соседними. Термин «химическое строение» ввел академик А. М. Бутлеров в… … Энциклопедический словарь по металлургии
Валентность атома показывает число связей, образованных данным атомом с соседними. Термин «химическое строение» ввел академик А. М. Бутлеров в… … Энциклопедический словарь по металлургии
Ионная связь прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Примером может служить соединение CsF … Википедия
Химическая связь явление взаимодействия атомов, обусловленное перекрыванием электронных облаков, связывающихся частиц, которое сопровождается уменьшением полной энергии системы. Термин «химическое строение» впервые ввёл А. М. Бутлеров в 1861… … Википедия
Рис.
2.1. Образование
молекул из атомов сопровождается перераспределением
электронов валентных орбиталей и приводит к выигрышу
в энергии, так как энергия молекул оказывается
меньше энергии невзаимодействующих
атомов. На рисунке представлена схема
образования неполярной ковалентной
химической связи между атомами водорода.
В обычных условиях молекулярное состояние устойчивее, чем атомное (рис.2.1).Образование молекул из атомов сопровождается перераспределением электронов валентных орбиталей и приводит к выигрышу в энергии, так как энергия молекул оказывается меньше энергии невзаимодействующих атомов (приложение 3). Силы, удерживающие атомы в молекулах, получили обобщенное названиехимической связи .
Химическая связь между атомами осуществляется валентными электронами и имеет электрическую природу . При этом различают четыре основных типа химической связи:ковалентную ,ионную, металлическую иводородную .
1 Ковалентная связь
Химическая связь, осуществляемая электронными парами, называется атомной, или ковалентной . Соединения с ковалентными связями называются атомными, или ковалентными .
При возникновении
ковалентной связи происходит
сопровождающееся выделением энергии
перекрытие электронных облаков
взаимодействующих атомов (рис. 2.1). При
этом между положительно заряженными
атомными ядрами возникает облако с
повышенной плотностью отрицательного
заряда. Благодаря действию кулоновских
сил притяжения между разноименными
зарядами увеличение плотности
отрицательного заряда благоприятствует
сближению ядер.
2.1). При
этом между положительно заряженными
атомными ядрами возникает облако с
повышенной плотностью отрицательного
заряда. Благодаря действию кулоновских
сил притяжения между разноименными
зарядами увеличение плотности
отрицательного заряда благоприятствует
сближению ядер.
Ковалентная связь образуется за счет непарных электронов внешних оболочек атомов . При этом электроны с противоположными спинами образуютэлектронную пару (рис.2.2), общую для взаимодействующих атомов. Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной, две- двойной и т.д.
Мерой прочности химической связи служит энергия E св, затрачиваемая на разрушение связи (выигрыш в энергии при образовании соединения из отдельных атомов). Обычно эту энергию измеряют в расчете на 1 мольвещества и выражают в килоджоулях на моль (кДж∙моль –1). Энергия одинарной ковалентной связи лежит в пределах 200–2000 кДжмоль –1 .
Рис. 2.2. Ковалентная
связь – наиболее общий вид химической
связи, возникающей за счет обобществления
электронной пары посредством обменного
механизма (а) ,
когда каждый из взаимодействующих
атомов поставляет по одному электрону,
или посредством донорно-акцепторного
механизма (б) ,
когда электронная пара передается в
общее пользование одним атомом (донором)
другому атому (акцептору).
2.2. Ковалентная
связь – наиболее общий вид химической
связи, возникающей за счет обобществления
электронной пары посредством обменного
механизма (а) ,
когда каждый из взаимодействующих
атомов поставляет по одному электрону,
или посредством донорно-акцепторного
механизма (б) ,
когда электронная пара передается в
общее пользование одним атомом (донором)
другому атому (акцептору).
Ковалентная связь обладает свойствами насыщаемости и направленности . Под насыщаемостью ковалентной связи понимается способность атомов образовывать с соседями ограниченное число связей, определяемое числом их неспаренных валентных электронов. Направленность ковалентной связи отражает тот факт, что силы,удерживающие атомы друг возле друга, направлены вдоль прямой, соединяющей атомные ядра. Кроме того, ковалентная связь может быть полярной или неполярной .
В случае неполярной ковалентной связи электронное облако,
образованное общей парой электронов,
распределяется в пространстве симметрично
относительно ядер обоих атомов. Неполярная
ковалентная связь образуется между
атомами простых веществ, например, между
одинаковыми атомами газов, образующих
двухатомные молекулы (О 2 , Н 2 ,
N 2 ,Cl 2 и т.д.).
Неполярная
ковалентная связь образуется между
атомами простых веществ, например, между
одинаковыми атомами газов, образующих
двухатомные молекулы (О 2 , Н 2 ,
N 2 ,Cl 2 и т.д.).
В случае полярной ковалентной связи электронное облако связи смещено к одному из атомов. Образование полярной ковалентной связи между атомами характерно для сложных веществ. Примером могут служить молекулы летучих неорганических соединений: HCl, H 2 O, NH 3 и др.
Степень смещения общего электронного облака к одному из атомов при образовании ковалентной связи (степень полярности связи ) определяется, главным образом, зарядом атомных ядер и радиусом взаимодействующих атомов .
Чем больше заряд
атомного ядра, тем сильнее оно притягивает
к себе облако электронов. В то же время
чем больше радиус атома, тем слабее
внешние электроны удерживаются вблизи
атомного ядра. Совокупное действие двух
этих факторов и выражается в различной
способности разных атомов «оттягивать»
к себе облако ковалентной связи.
Способность атома в молекуле притягивать к себе электроны получила название электроотрицательности . Таким образом, электроотрицательность характеризует способность атома к поляризации ковалентной связи:чем больше электроотрицательность атома, тем сильнее смещено к нему электронное облако ковалентной связи .
Для количественной оценки электроотрицательности предложен ряд методов. При этом наиболее ясный физический смысл имеет метод, предложенный американским химиком Робертом С. Малликеном, который определил электроотрицательность атома как полусумму его энергииE e сродства к электрону и энергииE i ионизации атома:
. (2.1)
Энергией ионизации атома называется та энергия, которую
нужно затратить, чтобы «оторвать» от
него электрон и удалить его на бесконечное
расстояние. Энергию ионизации определяют
при помощи фотоионизации атомов или
путем бомбардировки атомов электронами,
ускоренными в электрическом поле.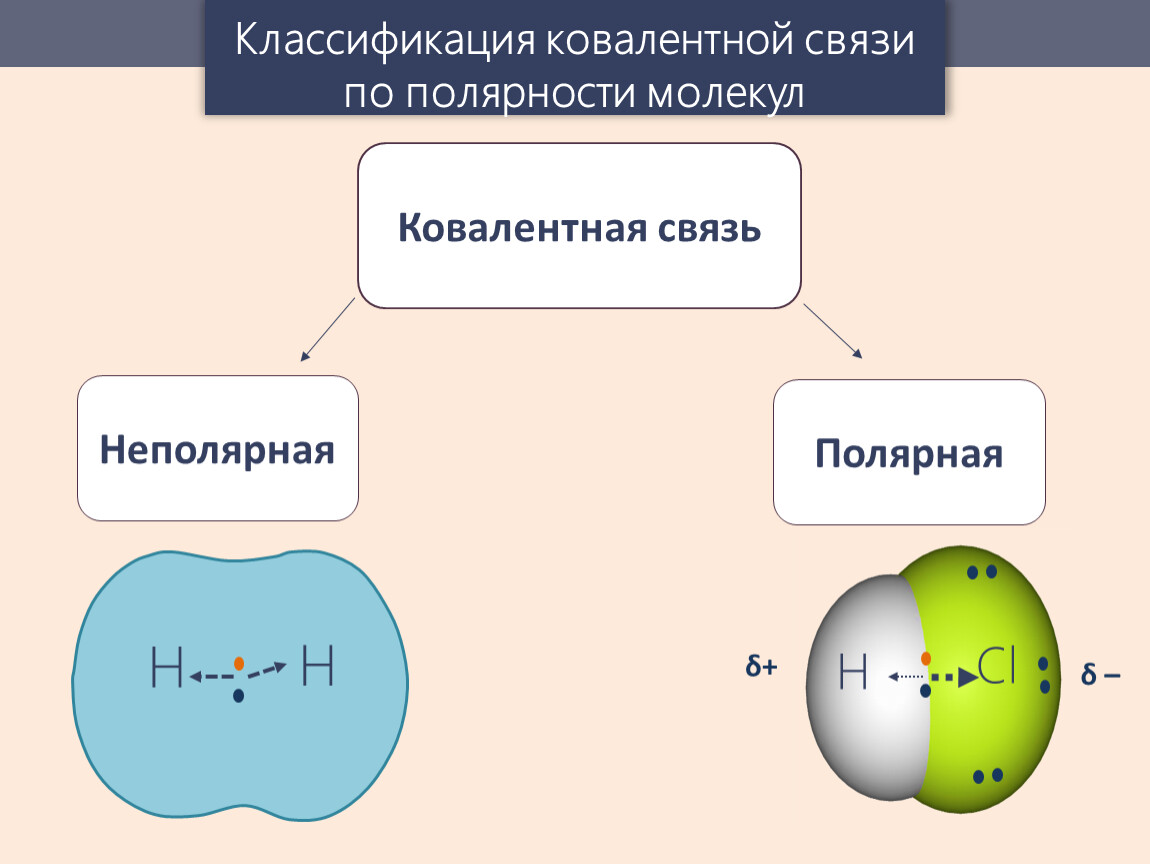 То
наименьшее значение энергии фотонов
или электронов, которое становится
достаточным для ионизации атомов, и
называют их энергией ионизацииE i .
Обычно эта энергия выражается в
электрон-вольтах (эВ): 1 эВ = 1,610 –19 Дж.
То
наименьшее значение энергии фотонов
или электронов, которое становится
достаточным для ионизации атомов, и
называют их энергией ионизацииE i .
Обычно эта энергия выражается в
электрон-вольтах (эВ): 1 эВ = 1,610 –19 Дж.
Охотнее всего отдают внешние электроны атомы металлов , которые содержат на внешней оболочке небольшое число непарных электронов (1, 2 или 3). Эти атомы обладают наименьшей энергией ионизации. Таким образом, величина энергии ионизации может служить мерой большей или меньшей «металличности» элемента: чем меньше энергия ионизации, тем сильнее должны быть выраженыметаллические свойства элемента.
В одной и той же
подгруппе периодической системы
элементов Д.И.Менделеева с увеличением
порядкового номера элемента его энергия
ионизации уменьшается (табл.2.1), что
связано с увеличением атомного радиуса
(табл.1.2), а, следовательно, с ослаблением
связи внешних электронов с ядром. У
элементов одного периода энергия
ионизации возрастает с увеличением
порядкового номера. Это
связано с уменьшением атомного радиуса
и увеличением заряда ядра.
Это
связано с уменьшением атомного радиуса
и увеличением заряда ядра.
Энергия E e ,
которая выделяется при присоединении
электрона к свободному атому, называетсясродством к электрону (выражается
также в эВ). Выделение (а не поглощение)
энергии при присоединении заряженного
электрона к некоторым нейтральным
атомам объясняется тем, что наиболее
устойчивыми в природе являются атомы
с заполненными внешними оболочками.
Поэтому тем атомам, у которых эти оболочки
«немного не заполнены» (т.е. до заполнения
не хватает 1, 2 или 3 электронов),
энергетически выгодно присоединять к
себе электроны, превращаясь в отрицательно
заряженные ионы 1 .
К таким атомам относятся, например,
атомы галогенов (табл.2.1) – элементов
седьмой группы (главной подгруппы)
периодической системы Д.И.Менделеева.
Сродство к электрону атомов металла,
как правило, равно нулю или отрицательно,
т.е. им энергетически невыгодно
присоединение дополнительных электронов,
требуется дополнительная энергия, чтобы
удержать их внутри атомов. Сродство к
электрону атомов неметаллов всегда
положительно и тем больше, чем ближе к
благородному (инертному) газу расположен
неметалл в периодической системе. Это
свидетельствует об усилениинеметаллических
свойств по мере приближения к концу
периода.
Сродство к
электрону атомов неметаллов всегда
положительно и тем больше, чем ближе к
благородному (инертному) газу расположен
неметалл в периодической системе. Это
свидетельствует об усилениинеметаллических
свойств по мере приближения к концу
периода.
Из всего сказанного ясно, что электроотрицательность (2.1) атомов возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы периодической системы Менделеева. Нетрудно, однако, понять, что для характеристики степени полярности ковалентной связи между атомами важным является не абсолютное значение электроотрицательности, а отношение электроотрицательностей атомов, образующих связь. Поэтому на практике пользуются относительными значениями электроотрицательности (табл.2.1),принимая за единицу электроотрицательность лития.
Для характеристики
полярности ковалентной химической
связи используют разность относительных
электроотрицательностей атомов . Обычно связь между атомами А и В считается
чисто ковалентной, если | A – B |0.5.
Обычно связь между атомами А и В считается
чисто ковалентной, если | A – B |0.5.
Конспект урока химии «Ковалентная полярная и неполярная связь»
Ковалентная полярная и неполярная связь. Электроотрицательность.
СОДЕРЖАНИЕПолярная и неполярная ковалентные связи. Электроотрицательность атома химического элемента. Характеристики ковалентной связи.
ПЛАН УРОКА.
I. Проверка знаний и умений.
· Дайте определения понятиям: «химическая связь», «валентность».
· Какие электроны принимают участие в образовании химической связи?
· Что представляет собой ковалентная химическая связь?
· Какие электроны принимают участие в образовании ковалентной химической связи?
· Как определить количество неспаренных электронов у данного химического элемента?
· Что представляет собой электронная формула химического соединения? Какую информацию она несет?
· Что представляет собой структурная формула химического соединения? Какую информацию она несет?
II. Актуализация знаний.
Актуализация знаний.
Ковалентная связь существует как в простых веществах (приведите примеры веществ), так и в сложных соединениях (приведите пример).
III. Изучение нового материала.
В случае взаимодействия одинаковых атомов и образования простого вещества общие электронные пары в равной степени принадлежат обоим взаимодействующим атомам.
В случае взаимодействия различных атомов, обладающих неметаллическими свойствами общие электронные пары также являются общими, но смещены в сторону атома, обладающего более выраженными неметаллическими свойствами. (Вспомните схему образования ковалентной связи в молекуле HCl).
В молекуле образуются своеобразные полюса, что обусловлено смещением общих электронных пар к атому, обладающему более выраженными неметаллическими свойствами.
Электроотрицательность (ЭО) — это способность атомов химического элемента притягивать к себе общие электронные пары в соединении.
Электроотрицательность – своеобразная мера неметалличности химических элементов.
Электроотрицательность – это безразмерная условная величина, характерная для данного химического элемента. Численные значения ЭО приведены в ПСХЭ.
Как изменяется ЭО химических элементов в группах и периодах ПСХЭ? (Вспомните закономерности изменения в группах и периодах неметаллических свойств) Обоснуйте свой ответ с позиции строения атома.
Какой химический элемент имеет наибольшую ЭО, какой – наименьшую?
Общие электронные пары смещаются в сторону более электроотрицательного элемента. Чем больше разность величин ЭО взаимодействующих атомов, тем больше полярность образующейся химической связи.
IY. Закрепление изученного.
Докажите, что связь в молекулах Вr2 и HCl является ковалентной.
Каковы виды ковалентной связи в данных молекулах?
Сформулируйте определение ковалентной неполярной и ковалентной полярной связи.
Y. Углубление знаний.
Ковалентная неполярная связь – связь между атомами с одинаковой ЭО, когда общие электронные пары находятся на одинаковом расстоянии от обоих взаимодействующих атомов и в равной степени принадлежат им обоим.
Ковалентная полярная связь – связь между атомами с незначительно различающейся ЗО, когда общие электронные пары смещены в сторону более ЭО химического элемента (разность ЭО < 1,7).
Характеристики ковалентной связи:
Длина связи
Энергия связи
Самостоятельная работа с учебником
YI. Закрепление изученного.
Закрепление изученного.
· Что представляет собой ковалентная связь?
· Дайте определение ЭО.
· В чем разница между полярной и неполярной ковалентной химической связью?
· Алгоритм составления схемы образования ковалентной связи:
ВЫВОД:
Ковалентная связь – связь посредством общих электронных пар. Ковалентная связь между атомами, обладающими равной ЭО – неполярная, так как общие электронные пары в равной степени принадлежат обоим взаимодействующим атомам. Ковалентная полярная связь – связь между атомами с разной ЭО, при этом общие электронные пары смещены в сторону более электроотрицательного элемента.
Ковалентная химическая связь характеризуется длиной и энергией. С увеличением числа связей между атомами в в молекуле энергия связи увеличивается, а ее длина уменьшается.
Y. Домашнее задание (инструктаж)
Домашнее задание (инструктаж)
Механизм образования ковалентной неполярной связи. Пример неполярной ковалентной связи. Ковалентная связь полярная и неполярная
Определение
Ковалентной связью называется химическая связь, образующаяся за счёт обобществления атомами своих валентных электронов. Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых расположены валентные электроны. В простейшем случае перекрывание двух АО приводит к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО:
Образование связи
Ковалентная связь (атомная связь, гомеополярная связь) — связь между двумя атомами за счёт обобществления (electron sharing) двух электронов — по одному от каждого атома:
A. + В. -> А: В
+ В. -> А: В
По этой причине гомеополярная связь имеет направленный характер. Пара электронов, осуществляющая связь, принадлежит одновременно обоим связываемым атомам, например:
| .. | .. | .. | |||||||||
| : | Cl | : | Cl | : | H | : | O | : | H | ||
| .. | .. | .. |
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом ее образования:
1. Простая ковалентная связь . Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными. Если атомы, образующие простую ковалентную связь одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующиеся связь в равной степени владеют обобществленной электронной парой, такая связь называется неполярной ковалентной связью. Если атомы различны, тогда степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов, атом с большей электроотрицательностью в большей степени обладает парой электронов связи, и поэтому его истинный заряд имеет отрицательный знак, атом с меньшей электроотрицательностью приобретает соответственно такой же по величине заряд, но с положительным знаком.
Если атомы различны, тогда степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов, атом с большей электроотрицательностью в большей степени обладает парой электронов связи, и поэтому его истинный заряд имеет отрицательный знак, атом с меньшей электроотрицательностью приобретает соответственно такой же по величине заряд, но с положительным знаком.
Сигма (σ)-, пи (π )-связи — приближенное описание видов ковалентных связей в молекулах органических соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен , ацетилен и бензол .
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π
-связью.
Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π
-связью.
В линейной молекуле ацетилена
Н-С≡С-Н (Н: С::: С: Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π -связи между этими же атомами углерода. Две π -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С 6 H 6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода.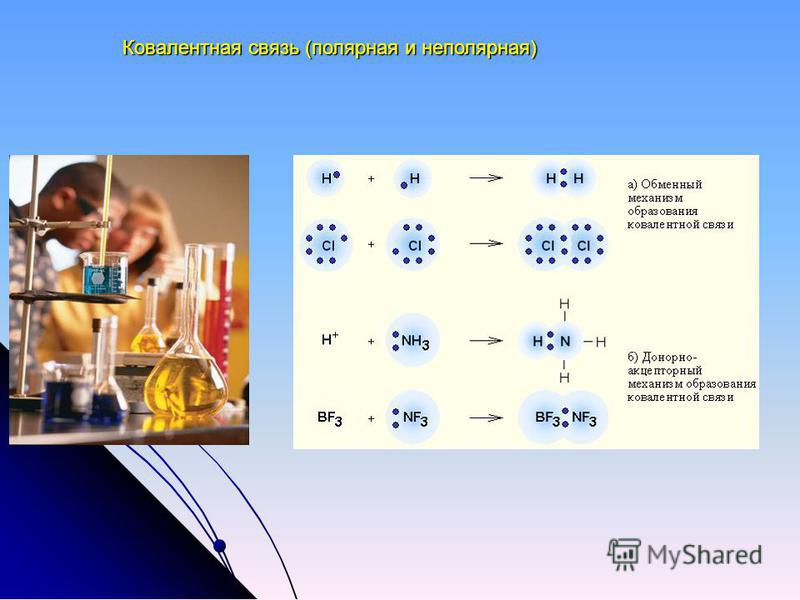 На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π
-связи, а единая π
-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π
-связи, а единая π
-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов. Различают две основные разновидности ковалентной связи:
- Ковалентная неполярная связь образуется между атомами неметалла одного и того же химического элемента. Такую связь имеют простые вещества , например О 2 ; N 2 ; C 12 .

- Ковалентная полярная связь образуется между атомами различных неметаллов.
См. также
Литература
- «Химический энциклопедический словарь», М., «Советская энциклопедия», 1983, с.264.
| Органическая химия |
|---|
| Список органических соединений |
| Структурная химия | |
|---|---|
| Химическая связь : | Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия |
| Отображение структуры: | Функциональная группа | Структурная формула | Химическая формула | Лиганд |
| Электронные свойства: | Электроотрицательность | Сродство к электрону | Энергия ионизации | Диполь | Правило октета |
| Стереохимия : | Асимметрический атом | Изомерия | Конфигурация | Хиральность | Конформация |
Wikimedia Foundation
. 2010
.
2010
.
Ни для кого не секрет, что химия — наука довольно сложная и к тому же разнообразная. Множество различных реакций, реагентов, химикатов и прочих сложных и непонятных терминов — все они взаимодействуют друг с другом. Но главное, что с химией мы имеем дело каждый день, неважно, слушаем ли мы учителя на уроке и усваиваем новый материал или же завариваем чай, который в целом тоже представляет собой химический процесс.
Можно сделать вывод, что химию знать просто необходимо , разбираться в ней и знать, как устроен наш мир или какие-то отдельные его части — интересно, и, более того, полезно.
Сейчас нам предстоит разобраться с таким термином, как ковалентная связь, которая, кстати говоря, может быть как полярной, так и неполярной. Кстати говоря, само слово «ковалентная», образуется от латинского «co» — совместно и «vales» — имеющий силу.
Появления термина
Начнём с того, что сам термин «ковалентная» впервые ввёл в 1919 году Ирвинг Ленгмюр — лауреат Нобелевской премии.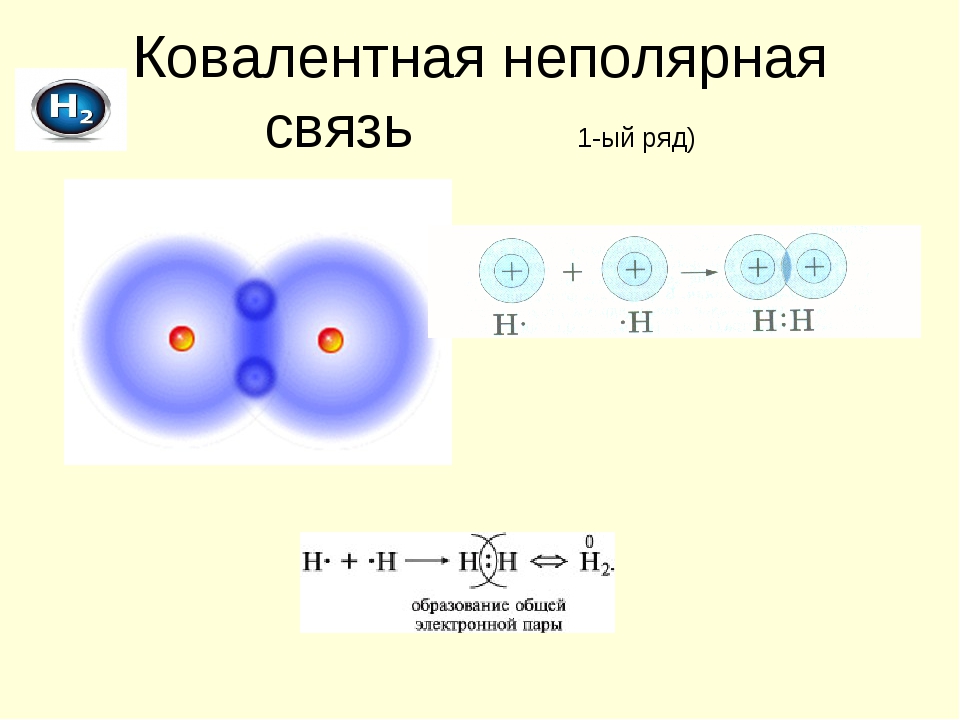 Понятие «ковалентной» предполагает химическую связь, при которой оба атома обладают электронами, что называется совместным обладанием. Таким образом, она, к примеру, отличается от металлической, в которой электроны свободны, или же от ионной, где и вовсе один отдаёт электроны другому. Нужно заметить, что образуется она между неметаллами.
Понятие «ковалентной» предполагает химическую связь, при которой оба атома обладают электронами, что называется совместным обладанием. Таким образом, она, к примеру, отличается от металлической, в которой электроны свободны, или же от ионной, где и вовсе один отдаёт электроны другому. Нужно заметить, что образуется она между неметаллами.
Исходя из вышесказанного, можно сделать небольшой вывод о том, что из себя представляет этот процесс. Она возникает между атомами за счёт образования общих электронных пар, причём пары эти возникают на внешних и предвнешних подуровнях электронов.
Примеры, вещества с полярной:
Виды ковалентной связи
Также различаются два вида — это полярная, и, соответственно, неполярная связи. Особенности каждой из них мы разберём отдельно.
Ковалентная полярная — образование
Что из себя представляет термин «полярная»?
Обычно происходит так, что два атома имеют разную электроотрицательность, следовательно, общие электроны не принадлежат им в равной степени, а находятся они всегда ближе к одному, чем к другому. К примеру, молекула хлороводорода, в ней электроны ковалентной связи располагаются ближе к атому хлора, так как его электроотрицательность выше чем у водорода. Однако, на самом деле, разница в притяжении электронов невелика настолько, чтобы произошёл полный перенос электрона от водорода к хлору.
К примеру, молекула хлороводорода, в ней электроны ковалентной связи располагаются ближе к атому хлора, так как его электроотрицательность выше чем у водорода. Однако, на самом деле, разница в притяжении электронов невелика настолько, чтобы произошёл полный перенос электрона от водорода к хлору.
В итоге при полярной электронная плотность смещается к более электроотрицательному, на нём же возникает частичный отрицательный заряд. В свою очередь, у того ядра, чья электроотрицательность ниже, возникает, соответственно, частичный положительный заряд.
Делаем вывод: полярная возникает между различными неметаллами, которые отличаются по значению электроотрицательности, а электроны располагаются ближе к ядру с большей электроотрицательностью.
Электроотрицательность – способность одних атомов притягивать к себе электроны других, тем самым образуя химическую реакцию.
Примеры ковалентной полярной , вещества с ковалентной полярной связью:
Формула вещества с ковалентной полярной связью
Ковалентная неполярная, разница между полярной и неполярной
И наконец, неполярная, скоро мы узнаем что же она из себя представляет.
Основное отличие неполярной от полярной — это симметрия. Если в случае с полярной электроны располагались ближе к одному атому, то при неполярной связи, электроны располагаются симметрично, то есть в равной степени по отношению к обоим.
Примечательно, что неполярная возникает между атомами неметалла одного химического элемента.
К примеру, вещества с неполярной ковалентной связью:
Также совокупность электронов зачастую называют просто электронным облаком, исходя из этого делаем вывод, что электронное облако связи, которое образует общая пара электронов, распределяется в пространстве симметрично, или же равномерно по отношению к ядрам обоих.
Примеры ковалентной неполярной связи и схема образования ковалентной неполярной связи
Но Также полезно знать, как же различать ковалентную полярную и неполярную.
Ковалентная неполярная — это всегда атомы одного и того же вещества. h3. CL2.
На этом статья подошла к концу, теперь мы знаем, что из себя представляет этот химический процесс, умеем определять его и его разновидности, знаем формулы образования веществ, и в целом чуточку больше о нашем сложном мире, успехов в химии и образовании новых формул.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) парывалентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой .
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Образование связи
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома.
A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H 2 . Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО . Обобществленные электроны располагаются на более низкой по энергии связывающей МО.
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь . Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
· Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью . Такую связь имеют простые вещества, например: О 2 , N 2 , Cl 2 . Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH 3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH 3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
· Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называетсяковалентной полярной связью .
2. Донорно-акцепторная связь . Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор . Второй из атомов, участвующий в образовании связи, называется акцептором . В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь . Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
σ-связь и π-связь
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода.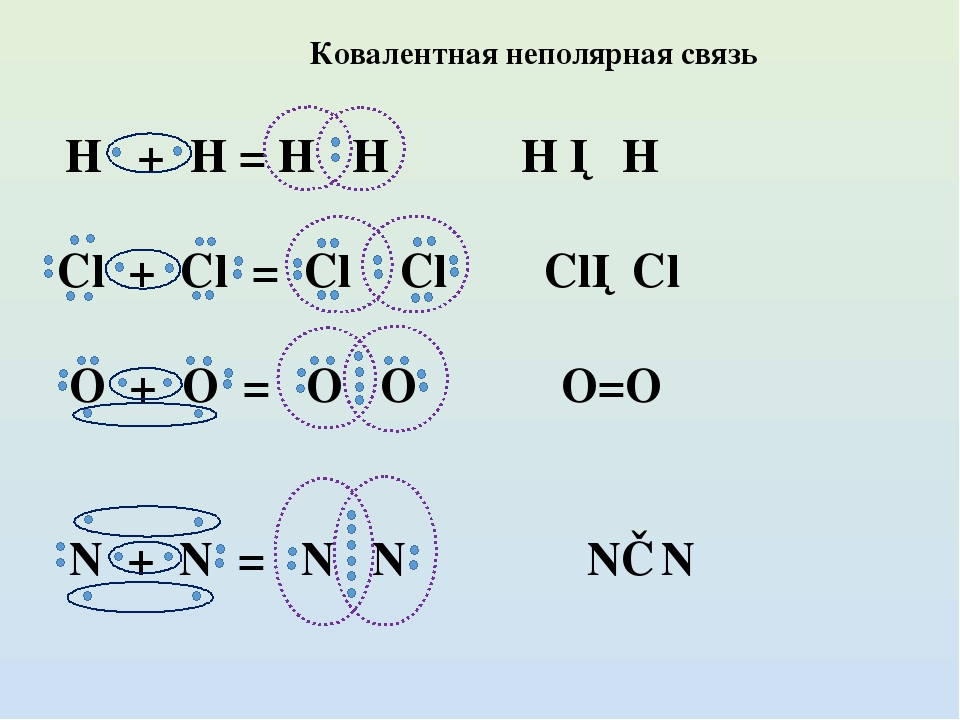 Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют -связью.
Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют -связью.
В линейной молекуле ацетилена
Н-С≡С-Н (Н: С::: С: Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две -связи между этими же атомами углерода. Две -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С 6 H 6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвёртых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные -связи, а единая -электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Примеры веществ с ковалентной связью
Простой ковалентной связью соединены атомы в молекулах простых газов (Н 2 , Cl 2 и др.) и соединений (Н 2 О, NH 3 , CH 4 , СО 2 , HCl и др.). Соединения с донорно-акцепторной связью -аммония NH 4 + , тетрафторборат анион BF 4 − и др. Соединения с семиполярной связью — закись азота N 2 O, O − -PCl 3 + .
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями могут служить алмаз, германий и кремний.
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общаяэлектронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е -> Na+ ион натрия, устойчивая восьми электронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е —> .Cl — ион хлора, устойчивая восьми электронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е -> Na+ ион натрия, устойчивая восьми электронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е —> .Cl — ион хлора, устойчивая восьми электронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
Химическим элементарным частицам свойственно соединяться друг с другом посредством формирования специальных взаимосвязей. Они бывают полярными и неполярными. Каждая из них имеет определенный механизм формирования и условия возникновения.
Вконтакте
Что это
Ковалентная связь — это образование, возникающее у элементов с неметаллическими свойствами . Наличие приставки «ко» свидетельствует о совместном участии атомных электронов разных элементов.
Понятие «валенты» означает наличие определенной силы. Возникновение такой взаимосвязи происходит посредством обобществления атомных электронов, не имеющих «пары».
Указанные химические связи возникают за счет появления «копилки» электронов, являющейся общей для обеих взаимодействующих частиц. Появление пар электронов осуществляется вследствие накладывания друг на друга электронных орбиталей. Указанные виды взаимодействия возникают между электронными облаками обоих элементов .
Важно! Ковалентная взаимосвязь появляется в случае объединения пары орбиталей.
Веществами с описанной структурой являются:
- многочисленные газы;
- спирты;
- углеводы;
- белки;
- органические кислоты.

Ковалентная химическая связь образуется за счет формирования общественных пар электронов у простых веществ либо сложных соединений. Она бывает полярная и неполярная.
Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц , присутствующих в формуле.
Химические связи описанного вида формируются только между элементами, где преобладают неметаллические свойства.
Если в соединении присутствуют атомы одинаковых либо разных неметаллов, значит возникающие между ними взаимосвязи – «ковалентные».
Когда в соединении одновременно присутствуют металл и неметалл говорят об образовании взаимосвязи.
Структура с «полюсами»
Ковалентная полярная связь соединяет друг с другом атомы разных по природе неметаллов. Это могут быть атомы:
- фосфора и ;
- хлора и ;
- аммиака.
Есть и другое определение для указанных веществ. Оно говорит о том, что данная «цепочка» формируется между неметаллами с разными показателями электроотрицательности.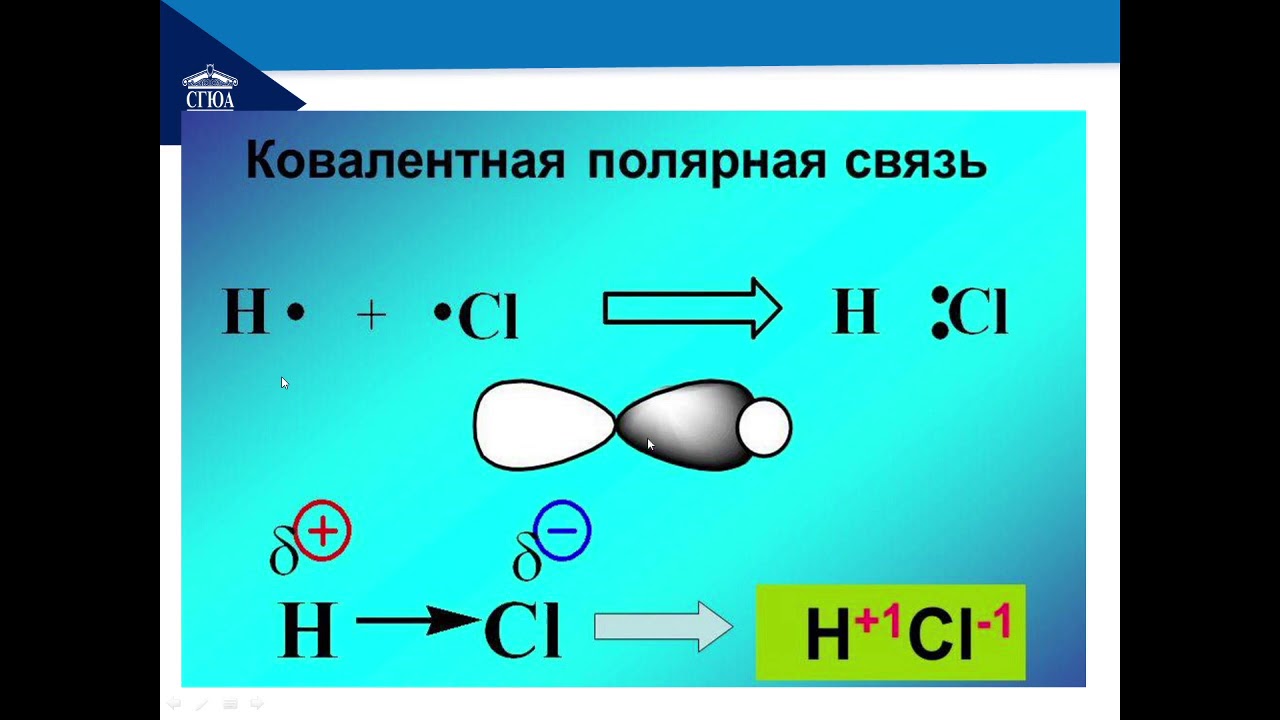 В обоих случаях «подчеркивается» разновидность химических элементов-атомов, где возникла эта взаимосвязь.
В обоих случаях «подчеркивается» разновидность химических элементов-атомов, где возникла эта взаимосвязь.
Формула вещества с ковалентной полярной связью – это:
- NO и многие другие.
Представленные соединения в нормальных условиях могут иметь жидкие либо газообразные агрегатные состояния. Формула Льюиса помогает точнее понять механизм связывания атомных ядер.
Как появляется
Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Обычно она смещается к элементу, имеющему наибольший показатель электроотрицательности. Его можно определить по специальной таблице.
Из-за смещения общей пары «электрончиков» в сторону элемента с большим значением электроотрицательности, на нем частично формируется отрицательный заряд.
Соответственно другой элемент получит частичный положительный заряд. Вследствие этого образуется соединение с двумя разнозаряженными полюсами.
Нередко при образовании полярной взаимосвязи используется акцепторный механизм или донорно-акцепторный механизм. Примером вещества, образованного по данному механизму, служит молекула аммиака. В нем азот наделен свободной орбиталью, а водород – свободным электроном. Образующая общая электронная пара занимает данную орбиталь азота, в результате чего один элемент становится донором, а другой акцептором.
Описанный механизм образования ковалентной связи , как вид взаимодействия, характерен не для всех соединений с полярным связыванием. Примерами могут служить вещества органического, а также неорганического происхождения.
О неполярной структуре
Ковалентная неполярная связь связывает между собой элементы с неметаллическими свойствами, имеющими одинаковые значения электроотрицательности. Другими словами, вещества с ковалентной неполярной связью — это соединения, состоящие из разного количества идентичных неметаллов.
Формула вещества с ковалентной неполярной взаимосвязью:
Примеры соединений, относящиеся к указанной категории являются веществами простого строения . В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В некоторой литературе их именуют валентными. Под подразумевают количество электронов, необходимых для завершения внешней оболочки. Атом может отдавать или принимать отрицательно заряженные частицы.
Описанная взаимосвязь относится к категории двухэлектронных либо двухцентровых цепочек. При этом пара электронов занимает общее положение между двумя орбиталями элементов. В структурных формулах электронную пару записывают в виде горизонтальной черты или «-». Каждая такая черточка показывает количество общих электронных пар в молекуле.
Для разрыва веществ с указанным видом взаимосвязи требуется затратить максимальное количество энергии, поэтому эти вещества являются одними из прочных по шкале прочности.
Внимание! В данную категорию относят алмаз – одно из самых прочных соединений в природе.
Как появляется
По донорно-акцепторному механизму неполярные взаимосвязи практически не соединяются. Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Сходством ковалентной полярной и неполярной связи является появление общей электронной плотности. Только во втором случае образующиеся электронные «копилки» в одинаковой мере принадлежат обоим атомам, занимая центральное положение. В результате не образуются частичные положительные и отрицательные заряды, а значит образующиеся «цепи» являются неполярными.
Важно! Неполярная взаимосвязь приводит к образованию общей электронной пары, за счет чего последний электронный уровень атома становится завершенным.
Свойства веществ с описанными структурами существенно различаются от свойств веществ с металлической либо ионной взаимосвязью.
Что такое ковалентная полярная связь
Какие бывают виды химической связи
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» — совместно и «vales» — имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор — свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами.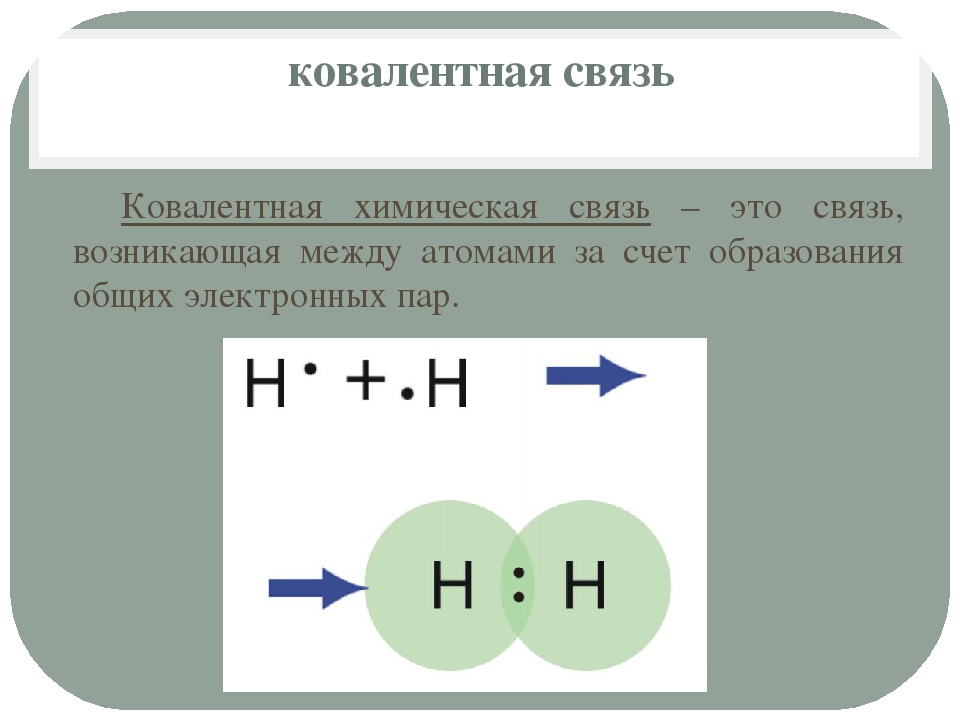 Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и общественные электроны не принадлежат в равной степени двум атомам. Большую часть времени общественные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там общественные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Ковалентная связь определение. §2 Химическая связь
1 / 5
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома .
A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО . Обобществлённые электроны располагаются на более низкой по энергии связывающей МО.
Образование связи при рекомбинации атомов
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф. Лондон ввёл понятие дисперсионное притяжение — взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы ».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени .
Образование связи по донорно-акцепторному механизму
Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи, существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H + и отрицательного иона водорода H — , называемого гидрид-ионом :
H + + H — → H 2
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным .
H + + H 2 O → H 3 O +
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот .
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония :
NH 3 + H + → NH 4 +
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений , в состав которого входят аммониевые , оксониевые, фосфониевые, сульфониевые и другие соединения .
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H 3 + :
H 2 + H + → H 3 +
Связывающая электронная пара молекулярного иона водорода H 3 + принадлежит одновременно трём протонам.
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь . Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
- Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью . Такую связь имеют простые вещества , например: 2 , 2 , 2 . Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH 3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
- Если атомы различны, то степень владения обобществлённой парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд.
 Если соединение образуется между двумя различными неметаллами , то такое соединение называется ковалентной полярной связью .
Если соединение образуется между двумя различными неметаллами , то такое соединение называется ковалентной полярной связью .
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π {\displaystyle \pi } -связью.
В линейной молекуле ацетилена
Н-С≡С-Н (Н: С::: С: Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две
π
{\displaystyle \pi } -связи между этими же атомами углерода. Две
π
{\displaystyle \pi } -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Две
π
{\displaystyle \pi } -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С 6 H 6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвёртых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π {\displaystyle \pi } -связи, а единая π {\displaystyle \pi } диэлектрики или полупроводники . Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями) могут служить
Химическим элементарным частицам свойственно соединяться друг с другом посредством формирования специальных взаимосвязей. Они бывают полярными и неполярными. Каждая из них имеет определенный механизм формирования и условия возникновения.
Они бывают полярными и неполярными. Каждая из них имеет определенный механизм формирования и условия возникновения.
Вконтакте
Что это
Ковалентная связь — это образование, возникающее у элементов с неметаллическими свойствами . Наличие приставки «ко» свидетельствует о совместном участии атомных электронов разных элементов.
Понятие «валенты» означает наличие определенной силы. Возникновение такой взаимосвязи происходит посредством обобществления атомных электронов, не имеющих «пары».
Указанные химические связи возникают за счет появления «копилки» электронов, являющейся общей для обеих взаимодействующих частиц. Появление пар электронов осуществляется вследствие накладывания друг на друга электронных орбиталей. Указанные виды взаимодействия возникают между электронными облаками обоих элементов .
Важно! Ковалентная взаимосвязь появляется в случае объединения пары орбиталей.
Веществами с описанной структурой являются:
- многочисленные газы;
- спирты;
- углеводы;
- белки;
- органические кислоты.

Ковалентная химическая связь образуется за счет формирования общественных пар электронов у простых веществ либо сложных соединений. Она бывает полярная и неполярная.
Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц , присутствующих в формуле.
Химические связи описанного вида формируются только между элементами, где преобладают неметаллические свойства.
Если в соединении присутствуют атомы одинаковых либо разных неметаллов, значит возникающие между ними взаимосвязи – «ковалентные».
Когда в соединении одновременно присутствуют металл и неметалл говорят об образовании взаимосвязи.
Структура с «полюсами»
Ковалентная полярная связь соединяет друг с другом атомы разных по природе неметаллов. Это могут быть атомы:
- фосфора и ;
- хлора и ;
- аммиака.
Есть и другое определение для указанных веществ. Оно говорит о том, что данная «цепочка» формируется между неметаллами с разными показателями электроотрицательности. В обоих случаях «подчеркивается» разновидность химических элементов-атомов, где возникла эта взаимосвязь.
В обоих случаях «подчеркивается» разновидность химических элементов-атомов, где возникла эта взаимосвязь.
Формула вещества с ковалентной полярной связью – это:
- NO и многие другие.
Представленные соединения в нормальных условиях могут иметь жидкие либо газообразные агрегатные состояния. Формула Льюиса помогает точнее понять механизм связывания атомных ядер.
Как появляется
Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Обычно она смещается к элементу, имеющему наибольший показатель электроотрицательности. Его можно определить по специальной таблице.
Из-за смещения общей пары «электрончиков» в сторону элемента с большим значением электроотрицательности, на нем частично формируется отрицательный заряд.
Соответственно другой элемент получит частичный положительный заряд. Вследствие этого образуется соединение с двумя разнозаряженными полюсами.
Нередко при образовании полярной взаимосвязи используется акцепторный механизм или донорно-акцепторный механизм. Примером вещества, образованного по данному механизму, служит молекула аммиака. В нем азот наделен свободной орбиталью, а водород – свободным электроном. Образующая общая электронная пара занимает данную орбиталь азота, в результате чего один элемент становится донором, а другой акцептором.
Описанный механизм образования ковалентной связи , как вид взаимодействия, характерен не для всех соединений с полярным связыванием. Примерами могут служить вещества органического, а также неорганического происхождения.
О неполярной структуре
Ковалентная неполярная связь связывает между собой элементы с неметаллическими свойствами, имеющими одинаковые значения электроотрицательности. Другими словами, вещества с ковалентной неполярной связью — это соединения, состоящие из разного количества идентичных неметаллов.
Формула вещества с ковалентной неполярной взаимосвязью:
Примеры соединений, относящиеся к указанной категории являются веществами простого строения .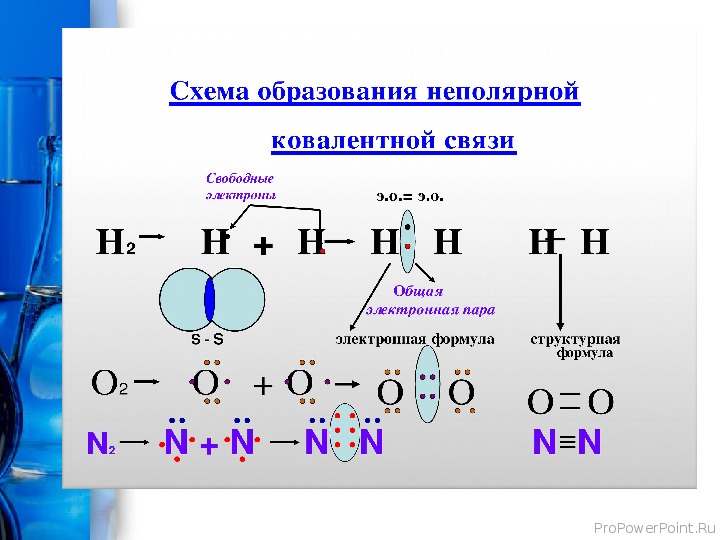 В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В некоторой литературе их именуют валентными. Под подразумевают количество электронов, необходимых для завершения внешней оболочки. Атом может отдавать или принимать отрицательно заряженные частицы.
Описанная взаимосвязь относится к категории двухэлектронных либо двухцентровых цепочек. При этом пара электронов занимает общее положение между двумя орбиталями элементов. В структурных формулах электронную пару записывают в виде горизонтальной черты или «-». Каждая такая черточка показывает количество общих электронных пар в молекуле.
Для разрыва веществ с указанным видом взаимосвязи требуется затратить максимальное количество энергии, поэтому эти вещества являются одними из прочных по шкале прочности.
Внимание! В данную категорию относят алмаз – одно из самых прочных соединений в природе.
Как появляется
По донорно-акцепторному механизму неполярные взаимосвязи практически не соединяются. Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Сходством ковалентной полярной и неполярной связи является появление общей электронной плотности. Только во втором случае образующиеся электронные «копилки» в одинаковой мере принадлежат обоим атомам, занимая центральное положение. В результате не образуются частичные положительные и отрицательные заряды, а значит образующиеся «цепи» являются неполярными.
Важно! Неполярная взаимосвязь приводит к образованию общей электронной пары, за счет чего последний электронный уровень атома становится завершенным.
Свойства веществ с описанными структурами существенно различаются от свойств веществ с металлической либо ионной взаимосвязью.
Что такое ковалентная полярная связь
Какие бывают виды химической связи
Благодаря которой образуются молекулы неорганических и органических веществ. Химическая связь появляется при взаимодействии электрических полей, которые создаются ядрами и электронами атомов. Следовательно, образование ковалентной химической связи связано с электрической природой.
Химическая связь появляется при взаимодействии электрических полей, которые создаются ядрами и электронами атомов. Следовательно, образование ковалентной химической связи связано с электрической природой.
Что такое связь
Под этим термином подразумевают результат действия двух либо более атомов, которые приводят к формированию прочной многоатомной системы. Основные виды химической связи образуются при уменьшении энергии реагирующих атомов. В процессе формирования связи атомы стараются завершить свою электронную оболочку.
Виды связи
В химии выделяют несколько видов связи: ионной, ковалентной, металлической. Ковалентная химическая связь имеет две разновидности: полярная, неполярная.
Каков механизм ее создания? Ковалентная неполярная химическая связь образуется между атомами одинаковых неметаллов, имеющих одну электроотрицательность. При этом образуются общие электронные пары.
Неполярная связь
Среди примеров молекул, у которых ковалентная химическая связь неполярного вида, можно назвать галогены, водород, азот, кислород.
Впервые эта связь была обнаружена в 1916 году американским химиком Льюисом. Сначала им была выдвинута гипотеза, а подтверждена она была только после экспериментального подтверждения.
Ковалентная химическая связь связана с электроотрицательностью. У неметаллов она имеет высокое значение. В ходе химического взаимодействия атомов не всегда возможен перенос электронов от одного атома к другому, в результате осуществляется их объединение. Между атомами появляется подлинная ковалентная химическая связь. 8 класс обычной школьной программы предполагает детальное рассмотрение нескольких видов связи.
Вещества, имеющие данный вид связи, при нормальных условиях — жидкости, газы, а также твердые вещества, имеющие невысокую температуру плавления.
Типы ковалентной связи
Подробнее остановимся на данном вопросе. Какие выделяют типы химической связи? Ковалентная связь существует в обменном, донорно-акцепторном вариантах.
Первый тип характеризуется отдачей каждым атомом одного неспаренного электрона на образование общей электронной связи.
Электроны, объединяемые в общую связь, должны обладать противоположными спинами. В качестве примера подобного вида ковалентной связи можно рассмотреть водород. При сближении его атомов наблюдается проникновение их электронных облаков друг в друга, именуемое в науке перекрыванием электронных облаков. В результате увеличивается электронная плотность между ядрами, а энергия системы понижается.
При минимальном расстоянии ядра водорода отталкиваются, в итоге образуется некое оптимальное расстояние.
В случае донорно-акцепторного типа ковалентной связи у одной частицы есть электроны, ее называют донором. Вторая частица имеет свободную ячейку, в которой будет размещаться пара электронов.
Полярные молекулы
Как образуются ковалентные полярные химические связи? Они возникают в тех ситуациях, когда у связываемых атомов неметаллов различная электроотрицательность. В подобных случаях обобществленные электроны размещаются ближе к тому атому, у которого значение электроотрицательности выше.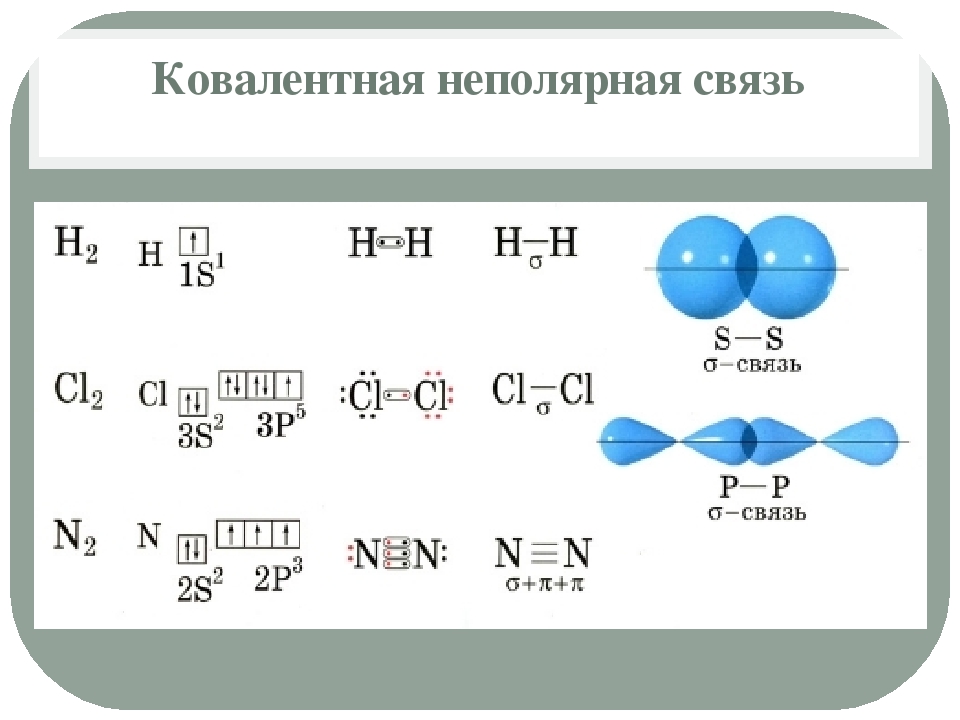 В качестве примера ковалентной полярной связи могут рассматриваться связи, которые возникают в молекуле бромоводорода. Здесь общественные электроны, которые отвечают за формирование ковалентной связи, ближе находятся к брому, чем к водороду. Причина подобного явления в том, что у брома электроотрицательность выше, чем у водорода.
В качестве примера ковалентной полярной связи могут рассматриваться связи, которые возникают в молекуле бромоводорода. Здесь общественные электроны, которые отвечают за формирование ковалентной связи, ближе находятся к брому, чем к водороду. Причина подобного явления в том, что у брома электроотрицательность выше, чем у водорода.
Способы определения ковалентной связи
Как определить ковалентные полярные химические связи? Для этого необходимо знать состав молекул. Если в ней присутствуют атомы разных элементов, в молекуле существует ковалентная полярная связь. В неполярных молекулах присутствуют атомы одного химического элемента. Среди тех заданий, которые предлагаются в рамках школьного курса химии, есть и такие, которые предполагают выявление вида связи. Задания подобного типа включены в задания итоговой аттестации по химии в 9 классе, а также в тесты единого государственного экзамена по химии в 11 классе.
Ионная связь
Чем отличается ковалентная и ионная химическая связь? Если ковалентная связь характерна для неметаллов, то ионная связь образуется между атомами, имеющими существенные отличия по электроотрицательности.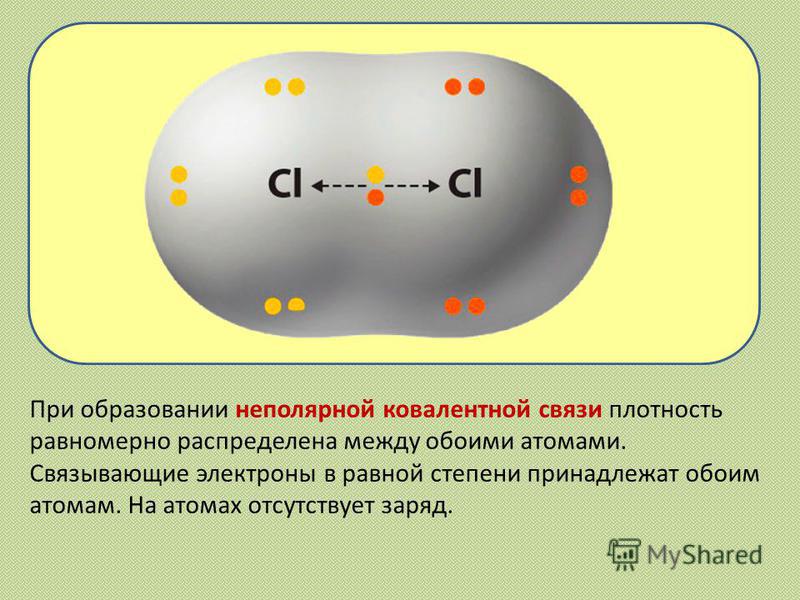 К примеру, это характерно для соединений элементов первой и второй групп главных подгрупп ПС (щелочных и щелочноземельных металлов) и элементов 6 и 7 групп главных подгрупп таблицы Менделеева (халькогенов и галогенов).
К примеру, это характерно для соединений элементов первой и второй групп главных подгрупп ПС (щелочных и щелочноземельных металлов) и элементов 6 и 7 групп главных подгрупп таблицы Менделеева (халькогенов и галогенов).
Она формируется в результате электростатического притяжения ионов, обладающих противоположными зарядами.
Особенности ионной связи
Так как силовые поля противоположно заряженных ионов распределяются равномерно во всех направлениях, каждый из них способен притягивать к себе противоположные по знаку частицы. Это и характеризует ненаправленность ионной связи.
Взаимодействие двух ионов, обладающих противоположными знаками, не предполагает полной взаимной компенсации индивидуальных силовых полей. Это способствует сохранению способности притягивать по остальным направлениям ионы, следовательно, наблюдается ненасыщенность ионной связи.
В ионном соединении у каждого иона есть возможность притягивать к себе некое число других, обладающих противоположных знаком, чтобы сформировать кристаллическую решетку ионного характера. В таком кристалле не существует молекул. Каждый ион окружается в веществе неким конкретным числом ионов иного знака.
В таком кристалле не существует молекул. Каждый ион окружается в веществе неким конкретным числом ионов иного знака.
Металлическая связь
Данный вид химической связи обладает определенными индивидуальными особенностями. Металлы имеют избыточное количество валентных орбиталей при недостатке электронов.
При сближении отдельных атомов происходит перекрывание их валентных орбиталей, что способствует свободному перемещению электронов из одной орбитали в другую, осуществляя между всеми атомами металла связь. Эти свободные электроны и являются основным признаком металлической связи. Она не обладает насыщенностью и направленностью, поскольку валентные электроны распределяются по кристаллу равномерно. Присутствие в металлах свободных электронов объясняет их некоторые физические свойства: металлический блеск, пластичность, ковкость, теплопроводность, непрозрачность.
Разновидность ковалентной связи
Она образуется между атомом водорода и элементом, который имеет высокую электроотрицательность. Существуют внутри- и межмолекулярные водородные связи. Эта разновидность ковалентной связи является самой непрочной, она появляется благодаря действию электростатических сил. У атома водорода небольшой радиус, и при смещении либо отдаче этого одного электрона водород становится положительным ионом, действующим на атом с большой электроотрицательностью.
Существуют внутри- и межмолекулярные водородные связи. Эта разновидность ковалентной связи является самой непрочной, она появляется благодаря действию электростатических сил. У атома водорода небольшой радиус, и при смещении либо отдаче этого одного электрона водород становится положительным ионом, действующим на атом с большой электроотрицательностью.
Среди характерных свойств ковалентной связи выделяют: насыщаемость, направленность, поляризуемость, полярность. Каждый из этих показателей имеет определенное значение для образуемого соединения. К примеру, направленность обуславливается геометрической формой молекулы.
Урок-семинар по теме «Виды ковалентной связи для учащихся 8-го класса по химии»
Цель:
- Закрепить понятие электроотрицательности химических элементов, видов ковалентной связи: полярной и неполярной;
- Упражнять в умении составлять электронные, структурные формулы соединений, объяснять механизм образования ковалентных связей; использовать приобретенные знания и умения в практической деятельности;
- Способствовать развитию коммуникативных умений;
- Развивать логическое мышление.

Методы и приемы:
Эвристическая беседа, фронтальный опрос, тестовая работа, с/р
Оборудование: презентация в PowerPoint Приложение 1, Приложение 2, таблицы, карточки с заданиями, опорный конспект, алгоритм составления образования ковалентной связи, электронных, структурных формул.
Ход урока
Слайд 1. Приложение2
Вступительное слово учителя:
Сегодня на уроке мы проведем семинар по теме “Виды ковалентной связи”.
Слайд 2. Приложение 2
Девиз урока:
“В твоих знаниях, твоя сила. На нашем семинаре, друзья, инертным газом быть нельзя!”
На уроке мы обобщим и закрепим имеющиеся знания по теме “Ковалентная связь”.
Слайд 3. Приложение 2 Слово учителя:
Сегодня на уроке:
- Вы вспомните: что такое электроотрицательность химических элементов, какую связь называют ковалентной, какие виды ковалентной связи существуют.

В ходе урока:
- Вы составите электронные и структурные формулы соединений, определите виды химической связи в соединениях.
- Вы закрепите полученные знания на практике
- Вы получите много полезной научной информации !
- Вы приятно удивитесь: оказывается вы многое знаете!
Слайд 4. Приложение 2 Учитель: Разрешите представить Программу семинара:
I часть “Поделись знаниями”
II часть “Обсуждение главных вопросов семинара”:
1. Электроотрицательность химических элементов
2. Виды ковалентной связи. Механизм образования:
— ковалентная неполярная связь
— ковалентная полярная связь
3. Характеристики ковалентной связи.
Часть III.
Тренинг “А как обстоят дела на практике?”:
— определение видов связей в соединениях
— решение задач
Часть IV.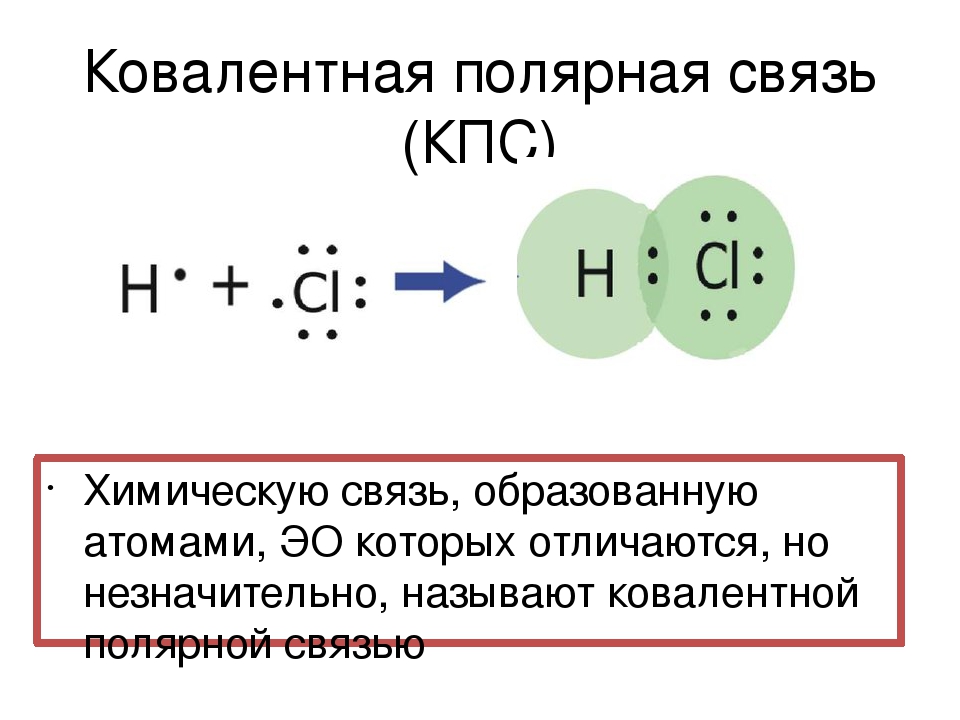 “Для любознательных”
“Для любознательных”
Часть V. “Подведем итоги!”
Учитель: Сегодня предоставится возможность участникам семинара высказать свои взгляды, мнения, суждения по главным обсуждаемым вопросам, закрепить полученные знания в ходе выполнения различных заданий. В семинаре принимают участие 2 команды: 1 команда – “Аргон”, 2 команда — “Неон”.В команде свой капитан. Каждая команда должна заработать как можно больше баллов и победить. Также среди учеников будут разыграны номинации “Лучший химик”, “отличник”, “хорошист”, “участник семинара”.
Слайд 5. Приложение 2 Учитель: Переходим к первой части “Поделись знаниями!”. Каждый поучаствует в обсуждении вопросов, выполнив тест. Вам предложен тестовая работа уровня А и Б. Необходимо правильные ответы внести в таблицу. Проверить тест можно по ключу. (Учащиеся выполняют тест). Из массива данных выбрать соответствующий правильный ответ. Приложение1. После выполнения теста учащиеся обмениваются работами друг с другом, проверяют правильность по ключу. (Переход по управляющей кнопке к слайду “Ключ”). Выставляют оценки, сдают работу. (Далее возврат по управляющей кнопке к слайду 5 “Поделись знаниями”.
После выполнения теста учащиеся обмениваются работами друг с другом, проверяют правильность по ключу. (Переход по управляющей кнопке к слайду “Ключ”). Выставляют оценки, сдают работу. (Далее возврат по управляющей кнопке к слайду 5 “Поделись знаниями”.
Учитель: Следующее задание. Письменно у доски, выполнить задания по карточкам.
1 задание: Написать схему строения электронной оболочки атома С. Подчеркнуть валентные электроны. Изобразить графически переход атома в возбужденное состояние.
2 задание: Написать схему электронного строения атома Ве. Подчеркнуть валентные электроны. Изобразить графически переход атома в возбужденное состояние.
3 задание: Решить задачу. Мr вещества, формула которого ХСО3, равна 100. Определите, какой элемент обозначен через Х. укажите какую информацию о веществе несет выведенная формула. Определите W (O) в веществе.
Учитель: Все участники семинара примут участие в викторине “Проверь себя”.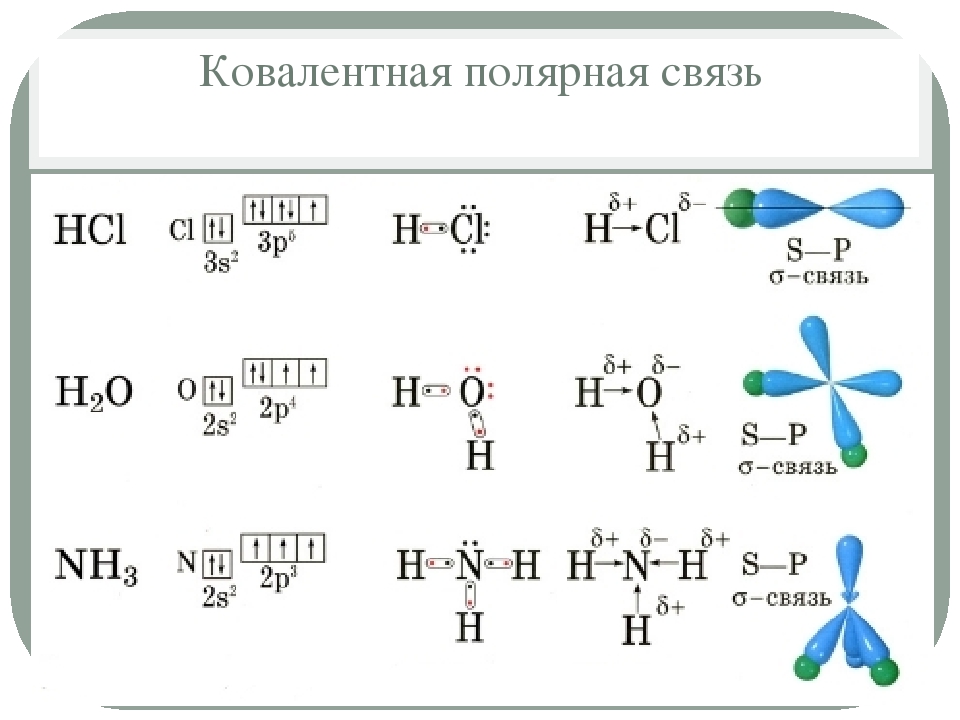 Кто быстрее и правильно ответит на вопросы, тот заработает больше баллов. За каждый правильный ответ участник получает жетоны. Приложение 2 (Переход со слайда 5. по управляющей кнопке на слайд Тест “Выбери правильный ответ”. Затем, после проведения теста, возврат на слайд “Поделись знаниями )
Кто быстрее и правильно ответит на вопросы, тот заработает больше баллов. За каждый правильный ответ участник получает жетоны. Приложение 2 (Переход со слайда 5. по управляющей кнопке на слайд Тест “Выбери правильный ответ”. Затем, после проведения теста, возврат на слайд “Поделись знаниями )
Вопросы теста “Выбери правильный ответ” (выполняют устно):
6. Радиус атома в ряду увеличивается:
А) Se – S – O
Б) Na – Mg — Al
7. “Третий лишний”.
Выбери лишний элемент, объясни:
а) Na, K, Li, С в) H2O, O2, F2, Сl2
б) Mg, С, N, F г) NaCl, HBr, HI, N2
Устно:
Конкурс “Разминка”
1. Электроны, за счет которых атомы вступают в химические связи называются ……. (валентными).
2. Способность атомов образовывать химические связи называют … (валентностью).
3. Валентные электроны расположены на …. (последнем энергетическом уровне)
(последнем энергетическом уровне)
4. Что показывает номер группы?
5. В чем физический смысл номера периода?
6. Сколько валентных электронов в атоме Са, N?
7. Сила, соединяющая два или несколько взаимодействующих атомов в молекулы называется… (химической связью).
8. Химическая связь, образуемая за счет общих электронных пар называется …. (ковалентной).
9. Неметаллические свойства в периоде с возрастанием заряда ядра ….(увеличиваются)?
10. Металлические свойства в группе сверху вниз ….. (возрастают)?
11. Энергия ионизации — это …
12. Наименьшей энергией ионизации обладают…(металлы). Как изменяется значение энергии ионизации по периоду с возрастанием заряда ядра? (возрастает).
13. Энергия, выделяемая при присоединении одного е к атому, называется … (сродством к электрону).
14. Наибольшим сродством к электрону обладают … (неметаллы).
15. Самый активный неметалл?
16. Самый активный металл?
Самый активный металл?
17. Какими квантовыми числами характеризуется состояние электрона в атоме?
18. В чем физический смысл порядкового номера?
Слайд.6 ЧастьII “Обсуждение главных вопросов”.
Учитель: Мы обобщили имеющиеся знания. Теперь приступим к обсуждению главных вопросов конференции.
Периодическую систему Д.И. Менделеева заполняют более 107 элементов. Они образуют 7 миллионов простых и сложных веществ. Причина этого явления заключена в том, что, взаимодействуя между собой, атомы элементов вступают в химические связи между собой, образуют тем самым соединения. Какова же причина соединения атомов в молекулы?
Учащиеся: Причиной образования химической связи является стремление атомов металлов и неметаллов путем взаимодействия с другими атомами достичь более устойчивой электронной структуры, подобной структуре инертных элементов.
Учитель: Какие виды химической связи вы знаете? (Слайд. 7 “Виды химической связи.”) Используя представленную на слайде информацию , перечислите.
7 “Виды химической связи.”) Используя представленную на слайде информацию , перечислите.
Учащиеся, используя материал слайда, перечисляют виды химической связи.
Учитель: С механизмом образования какой связи вы уже знакомы?
Учащиеся: Ковалентной.
Учитель: По ходу конференции каждый участник должен составить отчет, отразить важные вопросы в тетради. Учащиеся записывают по ходу уроку задания. Запишите тему урока.
Учитель: Дайте определение ковалентной связи.
Учащиеся: Дают определение.
Учитель: Используя информацию предложенную вам, охарактеризуйте основные моменты отражающие образование ковалентной связи.
Учащиеся дают ответ. (Переход при помощи управляющей кнопки со слайда 7 на слайд 8. Затем на слайд 7 по управляющей кнопке).
Учитель: На прошлом уроке мы рассмотрели механизм образования ковалентной связи. Выяснили, что связь образуется за счет общих электронных пар. На каком расстоянии от ядер атомов находится общая электронная пара в молекуле Н2 , Сl2 ?
На каком расстоянии от ядер атомов находится общая электронная пара в молекуле Н2 , Сl2 ?
Учащиеся: На одинаковом расстоянии.
Учитель: А в соединениях HCl, HF?
Учащиеся: Смещаются в сторону Сl, F.
Учитель: Верно. Как называется способность атомов притягивать к себе общие электронные пары в соединениях. Слайд 9.(Электроотрицательность).
Следовательно в молекуле Н2 два атома с одинаковой ЭО, в результате этого общая пара электронов находится на одинаковом расстоянии от ядер.А в молекуле НСl два атома с разной ЭО, при чем у Сl она больше, чем у Н, вследствие этого общая пара е смещается в сторону Сl.
Численные значения электроотрицательности химических элементов представлены в таблице, (ЭОН= 2.1) под порядковым номером. Обратим внимание на значение ЭО. Как она изменяется по периоду с возрастанием зарядов ядер химических элементов.
Учащиеся. В периодах Э.О. элементов возрастает с увеличением заряда ядра, а в главных подгруппах снизу вверх.
В периодах Э.О. элементов возрастает с увеличением заряда ядра, а в главных подгруппах снизу вверх.
Учитель: У металлов значения ЭО < 1,8 – 2, неметаллов > 2. Самый электроотрицательный элемент – F, менее электроотрицательный Fr. В какую сторону смещаются общие электронные пары?
Учащиеся: В сторону более электроотрицательного химического элемента.
Учитель: У более электроотрицательного элемента скапливается избыток отрицательного заряда, у менее электроотрицательного избыток положительного заряда. Чем больше различается разность величин ЭО взаимодействующих атомов, тем больше полярность связи. В формулах соединений химический знак менее электроотрицательного элемента пишется на первом месте. (Переход к слайду 10 “Задания”. Учащиеся выполняют представленные задания на слайде). Приложение 2
Следовательно, на основании сказанного различают два вида ковалентной связи: полярная ковалентная связь и неполярная ковалентная связь. (Слайд 11.) Приложение 2. Основываясь на имеющиеся знания, дайте определение полярной и неполярной ковалентной связи.
(Слайд 11.) Приложение 2. Основываясь на имеющиеся знания, дайте определение полярной и неполярной ковалентной связи.
Учащиеся: Связь между атомами с одинаковой электроотрицательностью называют ковалентной неполярной связью. Общие электронные пары в равной степени принадлежат обоим атомам.
Связь между атомами, с незначительно отличающимися значениями электроотрицательности называют ковалентной полярной связью. Общие электронные пары смещаются в сторону наиболее электроотрицательного элемента.
Учитель: Необходимо также отметить, что ЭО в неполярной связи = 0, а в полярной связи < 1.7
Учитель. Слайд 12. Приложение 2. На примере образования молекулы N2 поясните механизм образования ковалентной неполярной связи. (Переход со слайда 11 по управляющей кнопке на слайд13 “Механизм образования молекулы N2 Далее переход на слайд 11 “Виды ковалентной связи”.) Приложение 2
Учащиеся. Поясняют механизм образования.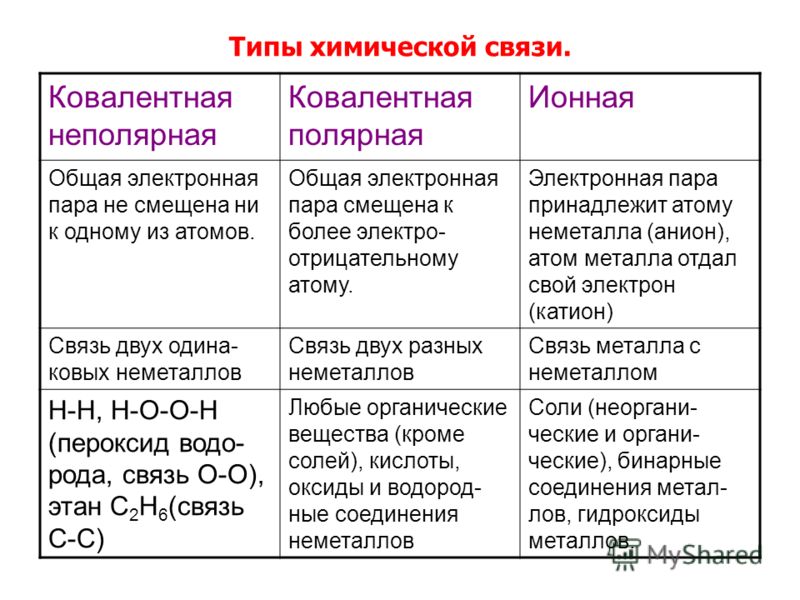
Учитель Слайд. 13. Приложение 2. На примере образования молекулы НF поясняют механизм образования ковалентной полярной связи. (Переход со слайда 11 “Виды ковалентной связи” на слайд14 “Механизм образования ковалентной полярной связи в молекуле HF”. Зтем переход на слайд 11)
(Все учащиеся записывают в тетрадь).
Учитель: Слайд 15. Приложение 2.Закрепим умение составлять электронные, структурные формулы веществ, объяснять механизм образования ковалентной связи, определять ее вид. В этом нам поможет алгоритм, который представленный перед вами. “Выполни упражнение ”: (Переход со слайда 15 по управляющей кнопке на слайд 16.
Задание “Выполни упражнение”.
Из приведенного ряда веществ:
О2, НCl, Ch5, N2, h3S, F2, OF2, NaCl, h3, ССl4, СO2, KBr
выпишите соединения с :
а) ковалентной неполярной связью
б) ковалентной полярной связью
Составьте электронные и структурные формулы веществ.
(Затем возврат по управляющей кнопке к слайду 15)
Учитель: Проведем физминутку. Работа по карточкам: если соединение с ковалентной полярной связью, поднимаем левую руку, если соединение с ковалентной неполярной связью поднимаем правую руку. Если неметалл поднимаем две руки вверх, если металл – дотрагиваемся до кончика носа (карточки с соединениями заранее подготовлены учителем). 1- 2 мин.
Учитель: Слайд 15. Приложение 2
Проведем “Химический диктант”. Составь формулу и определи вид химической связи:
А) молекула состоит из трех атомов кислорода – О3
Б) молекула состоит из двух атомов водорода и одного атома кислорода. – h3O
В) три атома водорода один атом фосфора четыре атома кислорода. – h4PO4
Г) шесть атомов кислорода двенадцать атомов водорода шесть атомов кислорода. – С6Н12О6
Учитель: (Переход к слайду 17. Приложение 2. “Характеристики ковалентной связи”
Какими свойствами обладает ковалентная связь?
Учащиеся, используя материал слайда перечисляют. (Далее переход к слайду 18. Приложение 2 “Выполни задание”:
(Далее переход к слайду 18. Приложение 2 “Выполни задание”:
Расположите молекулы в порядке увеличения прочности связи и укажите молекулу с наибольшей длиной связи: F2, N2, S2
(Переход на слайд 20. Часть III.“Тренинг “А как обстоят дела на практике?”.Приложение 2)
Учитель: А теперь переходим к III части Тренингу “Выполни задания”. (По управляющей кнопке 1. переход на слайд 21 “Какие утверждения верны” По мере выполнения, со слайда 21 по управляющей кнопке возврат к слайду 20)
Задание 1. Проверь свои знания. Какие утверждения верны.
“Проверь себя! Верны ли утверждения”:
- В молекулах соединений: НСl, Nh4 связь ковалентная полярная.
- В молекулах соединений: Сl2, h3связь ковалентная неполярная.
- В молекулах соединений Br2, O2 связь ковалентная полярная.
- В молекулах соединений СO2, N2O связь ковалентная неполярная
- Наиболее электроотрицательный элемент O.

- В ходе образования химической связи общая электронная пара смещается в сторону наиболее электроотрицательного элемента.
- У металлов электроотрицательность > 2.
- Наименьшей электроотрицательностью обладает атом Fr.
- В молекуле азота тройная связь
- Длина связи – это расстояние между ядрами атомов в молекуле.
- Электроотрицательность элементов возрастает по периоду с увеличением заряда ядра.
(Работает весь класс, поднимает карточки “+” — верно, “- ” — неверно)
Слайд 22. Приложение 2
Учитель: Далее выполним задания:
Опишите качественный и количественный состав:
а)СO и СO2 б) SO2 и SO3
Определите вид химической связи, вычислите W(O) в соединениях.
2. Вычислите Мr и W(O) в веществах: а,б,в – 10 баллов, г,д,е – 15 баллов. Выпишите вещества с ковалентной связью.
а) в горном хрустале – SiO2
б) корунде – Al2O3
в) кальците – CaCO3
г) малахите — (CuOH)2 CO3
д) глюкозе – C6h22O6
е) сахаре – C12h32O11
Каждый может выбрать свой темп выполнения заданий.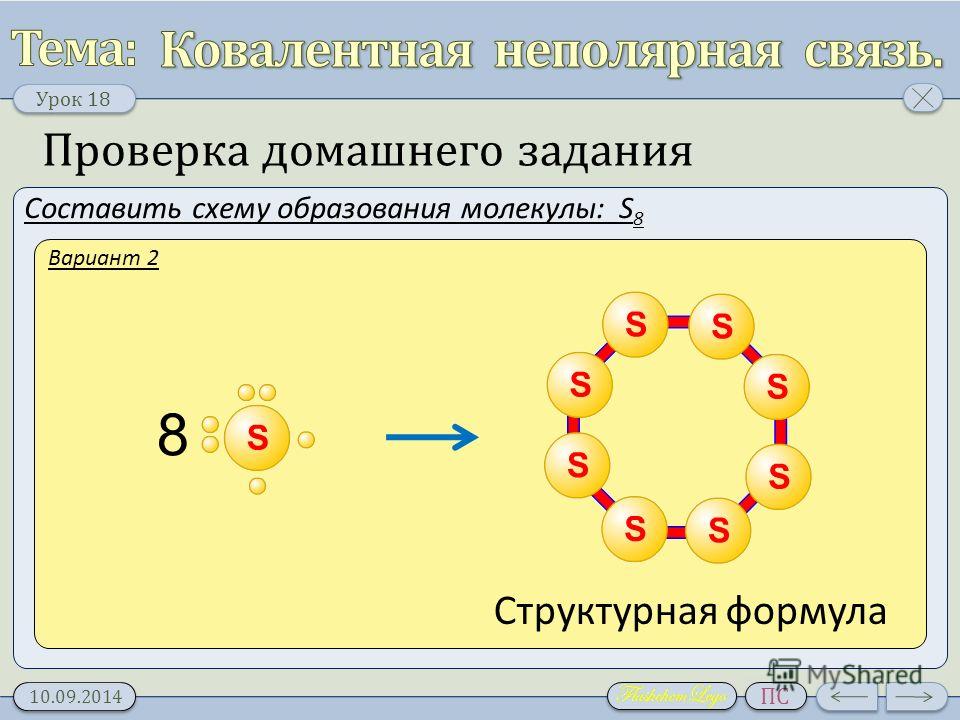 Чем больше заданий выполнено. Тем больше баллов заработает каждый.
Чем больше заданий выполнено. Тем больше баллов заработает каждый.
(По мере выполнения возврат к слайду 20. Приложение 2)
Слайд.23.Приложение 2. Учитель: Рассмотрим где же встречаются в повседневной жизни вещества с ковалентной связью. (Переход со слайда 23 на слайды по управляющим кнопкам по очереди)
Учитель: Подведем итоги подсчитаем баллы. Выставим оценки. Определим победителей. Слайд. 30. Приложение 2
Запишите Д/з.п.17,18 ( I в – упр. 3,4; II в – упр.6 – 8 учебник Химия 8 класс. Автор: Н.С. Новошинская, Н.И. Новошинский).
Всем спасибо.
|
№ |
Деятельность учителя |
Деятельность учащихся |
|
Стадия вызова |
||
|
Урок начинается с показа рисунка атома (слайд 1) |
Атом. |
|
|
Что за частицу вы видите на рисунке? |
Атомы–частницы вещества, химически неделимые. |
|
|
Что вы знаете о составе атома? Каково строение атома? |
ядро (протоны, нейтроны), электронная оболочка. |
|
|
В природе не существуют одиночные атомы. Все они находятся в составе простых или сложных соединений. Еще в начале года мы узнали, что атомы принято изображать на бумаге сферами, а если мы говорим о моделях атомов, то это- шарики. У вас на столах лежат шарики разных цветов. Они символизируют атомы разных элементов. Сделайте из этих шариков молекулу. Конечно, шарики скрепить можно чем-нибудь. Но ведь для нас эти шарики — атомы. |
Ребята объединяются в группы по четыре человека. (Сидящие впереди ребята поворачиваются к тем, кто сидит за ними).
Задание дается в расчете на то, что ребята с ним не справятся, так как кроме шариков не дается больше ничего, ребята соединить шарики не могут, они просят дать веревочки, или палочки, или клей, чтобы скрепить шарики. Ребята рассуждают, приходят к выводу ( или учитель подводит их к выводу), что если бы атомы не соединялись друг с другом, то молекул бы не было. |
|
|
Как же соединяются атомы в молекулах? Давайте попробуем ответить на этот вопрос в течение урока. Итак, тема урока — связи между атомами, эти связи называют — химические. На доске записывается тема урока. — Химическая связь |
Мы не знаем, как атомы соединяются. |
|
|
Стадия содержания |
||
|
1 |
Итак, перед вами два одинаковых атома водорода. |
Неметаллические. |
|
Что заставляет атомы соединяться — стремление приобрести устойчивый внешний энергетический уровень, т.е. завершить свой внешний энергетический уровень. Как этого добиться –обзавестись еще одним электроном. |
Электростатические силы. |
|
|
Давайте попробуем объяснить, что произойдет с атомами водорода в момент столкновения? |
Ребята выдвигают гипотезы, принимаются все без исключения, затем предлагается правильный ответ. |
|
|
Если упростить объяснение процесса образования химической связи, то можно сказать, что образовалась общая электронная пара, которая принадлежат обоим атомам (показано скобками) (ам. Если общую электронную пару заменить черточкой- получится структурная формула. Структурная формула показывает порядок связи атомов и количество связей. В шаро-стержневых моделях черточку символизирует палочка. |
Ответ: ядро первого атома тянет к себе электронную оболочку второго атома, а ядро второго атома — тянет электронную оболочку первого атома. Электронные облака перекрываются, что создает область с избыточным отрицательным зарядом, что препятствует отталкиванию атомов друг от друга | |
|
Составьте модель молекулы H2 с помощью шариков- символов атомов и палочек-символов химической связи- теперь атомы держаться в молекуле |
Строят модели молекул |
|
|
2 |
Рассмотрим случай, когда молекула образована разными атомами неметаллами –Н и Сl и еще раз составим схему образования ковалентной связи: -записываем химические знаки элементов, -изображаем внешние электроны (в образовании связи участвуют внешние электроны-сколько-7!!!, но не все, а неспаренные. -показываем общую электронную пару (за счет перекрывания эл. облаков (s и p), -но так как элементы разные то обычно общая электронная пара смещена в сторону того атома, у которого более выражены немеет. свойства. Значит куда ? (к хлору). |
Электронная пара будет смещаться в сторону атома с большей электроотрицательностью (к хлору). |
|
Для качественной характеристики полярности связи ввели понятие электроотрицательность- ЭО- (прочитайте определение на с. 63 – ЭО- способность атомов оттягивать к себе общие электронные пары). ЭО- условная безразмерная характеристика. В числах ЭО приведена в таблице Полинга (на столах). Посмотрите, какова ЭО у водорода, хлора? Общая электронная пара сместиться к атому хлора. |
Читают, дают определение |
|
|
При этом благодаря смещению общей электронной пары на атомах возникнут частичные заряды-полюса, и связь будет называться ковалентной полярной. |
ЭО атома водорода -2, атома хлора-3, 16 |
|
|
Составьте модель молекулы HCL. |
Составляют модель |
|
|
Стадия первичного закрепления |
||
|
1 |
Обучающимся предлагаются задания для выполнения а выбор: «Дело по душе»: |
Ребята выбирают задание, в т.ч. с помощью конструктора анимаций «Механизм образования ковалентной химической связи» (http://fcior.edu.ru/) |
|
-составьте шаро- стержневые модели молекул веществ по формулам H2O, N2, O2 или -составьте схему образования ковалентной связи молекул H2O; N2, O2 с помощью конструктора анимаций или в тетрадях или составьте алгоритм определения вида химической связи по формуле вещества |
Составление алгоритма определения химической связи необходимо предложить обучающимся с высоким уровнем познавательной активности |
|
|
2 |
Проверка выполнения задания по составлению алгоритма определения вида химической связи по формуле вещества (остальные задания можно проверить, используя приемы «тихий ответ», «идеальный ответ»): |
|
|
Стадия подачи домашнего задания |
||
|
1 |
Параграфы 11,12; упражнения в зависимости от степени усвоения учебного материала |
|
Какую химическую связь называют ковалентной?.
 .. — Химия
.. — ХимияВопросы:
1. Какую химическую связь называют ковалентной? Какие признаки лежат в основе классификации ковалентной химической связи?
2. Что такое электроотрицательность? ковалентная полярная и ковалентная неполярная связи?
3. Может ли связь в молекуле вещества быть полярной, а молекула — неполярной? От чего зависит полярность молекулы? Приведите примеры из органической и неорганической химии.
4. Каковы механизмы образования ковалентной связи? Что такое донор? акцептор? Приведите примеры.
5. Приведите примеры органических и неорганических веществ с одинарной, двойной и тройной химическими связями.
7. Что такое молекулярная кристаллическая решетка? Чем она отличается от ионной? Приведите примеры веществ с молекулярной кристаллической решеткой.
8. Что такое атомная кристаллическая решетка? Чем она отличается от ионной и молекулярной кристаллической решеток? Приведите примеры веществ с молекулярной кристаллической решеткой.
9. Приготовьте сообщение на тему «История семи великих камней Алмазного фонда России*. При подготовке его используйте материалы по истории и мировой художественной культуре.
10. Откуда пошла поговорка «Тяжела ты, шапка Мономаха»?
11. Сравните императорские короны Британской империи и Российской империи по истории создания, авторству, составу этих государственных символов. Используйте материалы энциклопедий и справочников.
12. Какие знаки государственного отличия в царской, советской и современной России изготовлены с применением бриллиантов?
13. В чем измеряется масса драгоценных камней? Почему эту меру так называют? Для ответа воспользуйтесь дополнительной литературой.
Ответы:
Неполярные ковалентные связи – определение, пример и ответы на часто задаваемые вопросы
[Изображение будет загружено в ближайшее время]
Молекулярная связь, которую также называют ковалентной связью, представляет собой химическую связь, которая включает совместное использование электронных пар атомов. Эти электронные пары атомов известны как связывающие пары или общие пары, а стабильный баланс сил отталкивания и притяжения между атомами, когда они имеют общие электроны, называется ковалентной связью. Для многих молекул, имеющих общие электроны, совместное использование электронов позволяет каждому атому достичь эквивалента полной внешней оболочки, что соответствует стабильной электронной конфигурации.В потоке органической химии ковалентные связи встречаются гораздо чаще, чем ионные связи, а ионные связи встречаются гораздо реже.
Эти электронные пары атомов известны как связывающие пары или общие пары, а стабильный баланс сил отталкивания и притяжения между атомами, когда они имеют общие электроны, называется ковалентной связью. Для многих молекул, имеющих общие электроны, совместное использование электронов позволяет каждому атому достичь эквивалента полной внешней оболочки, что соответствует стабильной электронной конфигурации.В потоке органической химии ковалентные связи встречаются гораздо чаще, чем ионные связи, а ионные связи встречаются гораздо реже.
В ковалентной связи существует множество видов взаимодействий, включая σ-связь, связь металл-металл, π-связь, агостические взаимодействия, изогнутые связи и трехцентровые двухэлектронные связи. Термин ковалентная связь был введен в 1939 году. Изучение значения префикса со- означает совместное, связанное в действии, партнерство в меньшей степени и т. д. Таким образом, «ковалентная связь» означает, что атомы имеют общую «валентность», например обсуждается в теории валентных связей ковалентных связей.
История
[Изображение будет загружено в ближайшее время]
Ковалентный термин в отношении связи был впервые использован в 1919 году ученым Ирвингом Ленгмюром в статье журнала Американского химического общества, которая была озаглавлена «Расположение электронов в атомах и атомах». Молекулы». Ученый Ленгмюр писал, что «мы будем обозначать термин ковалентный как количество пар электронов, которое данный атом разделяет с соседними атомами.
Идея ковалентной связи восходит к Гилберту Н.В 1916 году Льюис, описавший обмен электронными парами между атомами. Он ввел электрон Льюиса, или точечную нотацию, или точечную структуру Льюиса, в которой валентные электроны (находящиеся во внешней оболочке) представлены в виде точечных структур вокруг атомных символов. Электронные пары, расположенные между атомами, представляют собой ковалентные связи. Несколько пар представляют несколько связей, таких как тройная и двойная. В альтернативной форме представления, которая здесь не показана, электронные пары, образующие связи, представлены сплошными линиями.
Льюис заявил, что атом образует достаточно ковалентных связей, чтобы сформировать полную внешнюю электронную оболочку или замкнутую оболочку. На показанной диаграмме метана атом углерода имеет валентность четыре и, следовательно, окружен восемью электронами по правилу октетов: четыре от самого углерода и четыре от связанных атомов водорода. Каждый водород имеет валентность, равную единице, и по правилу дуэта окружен двумя электронами: один собственный электрон плюс один от углерода. Количество электронов, соответствующее полным оболочкам в квантовой теории атома; внешняя оболочка атома углерода — это оболочка с n = 2, которая может содержать восемь электронов, тогда как единственная и внешняя оболочка атома водорода — это оболочка с n = 1, которая может содержать только два.
Неполярные ковалентные связи
Когда электроны распределяются поровну между двумя атомами, образуется неполярная ковалентная связь. В атоме количество электронов, общих для соседних атомов, будет одинаковым.
A Неполярная связь называется ковалентной, потому что разница в электроотрицательности в основном незначительна. Это означает, что между двумя атомами нет разделения зарядов или оба атома имеют одинаковую электроотрицательность. Когда атомы, имеющие общую полярную связь, располагаются таким образом, что электрические заряды имеют тенденцию компенсировать друг друга, тогда также формируется этот тип связи.
Между двумя одинаковыми атомами неметаллов или между разными атомами может возникнуть неполярная ковалентная связь.
Ковалентные соединения
Неполярные ковалентные соединения – это соединения, в которых нет разницы в электроотрицательности. Поскольку между атомами молекулы нет связи или дипольного момента и нет дальнейшего развития зарядов на атомах, поэтому нет движения пары электронов связи к связанным атомам и нет изменения электроотрицательности.
Краткое описание ковалентных связей
Форма многих крупных биологических молекул определяется нековалентными связями и стабилизирует комплексы, состоящие из двух или более различных молекул.

В биологических системах существует четыре основных типа нековалентных связей: ионные связи, водородные связи, гидрофобные связи и ван-дер-ваальсовы взаимодействия. Энергии связи для этих взаимодействий находятся в диапазоне примерно от 1 до 5 ккал/моль.
Атом водорода, ковалентно связанный с электроотрицательным атомом донора, связывается с атомом-акцептором, несвязывающие электроны которого притягивают водород в водородной связи.Среди молекул воды водородные связи в значительной степени определяют свойства как жидкой воды, так и кристаллической твердой формы (льда).
Электростатическое притяжение между положительными и отрицательными зарядами ионов приводит к образованию ионных связей. Все катионы и анионы окружены прочно связанной оболочкой из молекул воды в водном растворе.
Всякий раз, когда любые два атома близко подходят друг к другу, возникают слабые и относительно неспецифические взаимодействия Ван-дер-Ваальса, возникающие в результате притяжения между переходными диполями, связанными со всеми молекулами.

Что такое неполярная ковалентная связь? [Видео]
Привет и добро пожаловать в это видео о полярности ковалентных связей . Мы начнем с краткого обзора ковалентных связей, затем перейдем к определению полярности, рассмотрим, как определить, является ли связь полярной или неполярной, и закончим кратким обсуждением важности полярности с молекулярной точки зрения. Давайте начнем!
Помните, что существует несколько различных типов химических связей. Ионные, металлические и ковалентные являются основными категориями. Ковалентные связи образуются, когда атомы разделяют свои валентные электроны. Например, когда два атома хлора соединяются вместе, каждый из них отдает связи по одному электрону.
Каждый хлор имеет «доступ» к обоим связывающим электронам, таким образом, каждый хлор имеет 8 валентных электронов, что удовлетворяет правилу октетов.
Как правило, атомы, образующие ковалентные связи, представляют собой неметаллы в верхней правой части таблицы Менделеева, такие как углерод, кислород, азот, сера, фосфор и галогены. Водород также включен, хотя он не в правом верхнем углу.Это атомы, которые мы видим в органической химии.
Водород также включен, хотя он не в правом верхнем углу.Это атомы, которые мы видим в органической химии.
Несмотря на то, что мы имеем дело с небольшим подмножеством периодической таблицы, ковалентные связи резко различаются по своим свойствам, особенно по своей полярности.
Давайте определим этот термин, так как он находится в центре внимания этого видео. Полярность ковалентной связи описывает распределение общих электронов в этой связи. Чем более неравномерно распределение, тем полярнее связь.
Возможно, когда вы узнали о ковалентных связях, у вас в голове по умолчанию возникло представление об электронах, разделенных поровну.Это имеет место в случае неполярных связей, где электроны действительно более или менее поровну распределены между двумя атомами. Но это не всегда так.
В полярных ковалентных связях электроны распределяются между двумя атомами неравномерно. Один атом в связи притягивает электроны больше, чем другой, в результате чего электроны проводят больше времени вокруг этого атома.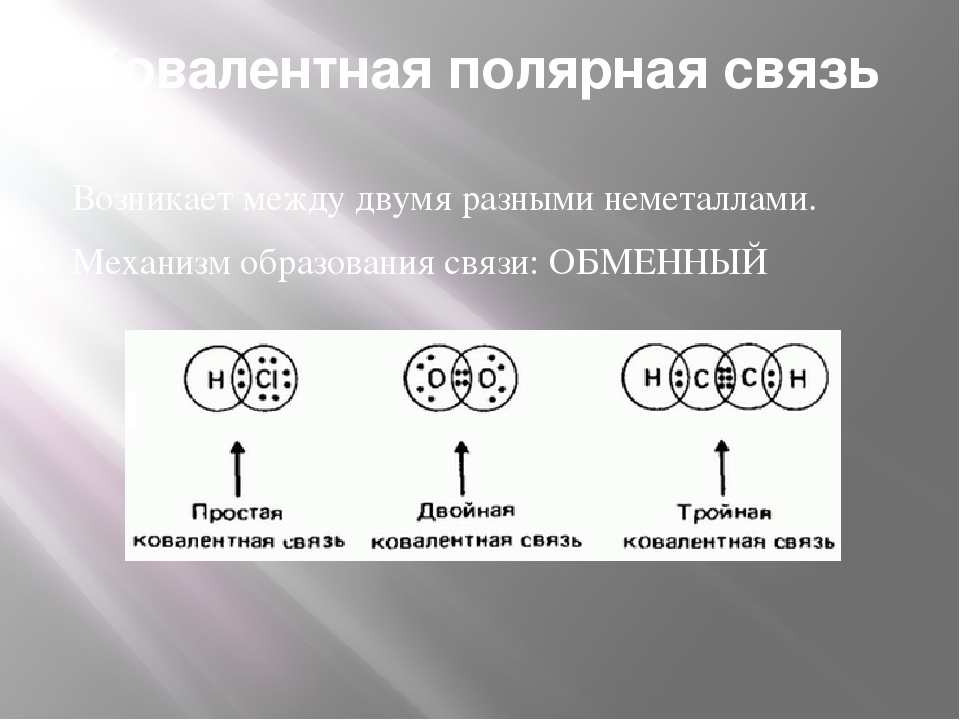 Это создает области частичного положительного заряда и частичного отрицательного заряда — или частично заряженные «полюса», таким образом, слово полярность .
Это создает области частичного положительного заряда и частичного отрицательного заряда — или частично заряженные «полюса», таким образом, слово полярность .
Частичный заряд обозначается строчной сигмой, а полярные связи часто обозначаются штриховкой или полярной стрелкой. Заштрихованным красным цветом обозначены области с частичным отрицательным зарядом, а синим — области с частичным положительным зарядом. Наконечник полярной стрелки указывает на отрицательный конец связи, а знак плюс, по логике вещей, находится на положительном конце связи.
Возможно, у вас сразу же возникла пара вопросов, когда мы просматривали этот материал. Почему одни атомы притягивают связывающие электроны больше, чем другие? Можем ли мы оценить полярность только по химической формуле? Как полярность влияет на химические и физические свойства молекулы? Это отличные вопросы.
Во-первых, склонность одних атомов притягивать связывающие электроны сильнее, чем у других, описывается их электроотрицательностью. Атомы имеют тенденцию быть более электроотрицательными, когда они меньше и имеют большие ядерные заряды, что приводит к более сильному притяжению связывающих электронов ядром атома. Это свойство очень похоже на сродство атома к электрону, которое описывает притяжение свободного атома к электрону. Таким образом, подобно тенденциям сродства к электрону, по мере продвижения слева направо и вверх по периодической таблице элементы становятся более электроотрицательными, за исключением благородных газов.Это означает, что фтор является наиболее электроотрицательным элементом. Элементам были присвоены относительные значения электроотрицательностей по шкале Полинга, где фтор имеет наивысшее значение 4. Не волнуйтесь, вряд ли вам когда-нибудь придется запоминать эти числа. В большинстве случаев вы сможете ссылаться на них, и после некоторой практики вы начнете запоминать относительные значения, и они вам больше не понадобятся.
Атомы имеют тенденцию быть более электроотрицательными, когда они меньше и имеют большие ядерные заряды, что приводит к более сильному притяжению связывающих электронов ядром атома. Это свойство очень похоже на сродство атома к электрону, которое описывает притяжение свободного атома к электрону. Таким образом, подобно тенденциям сродства к электрону, по мере продвижения слева направо и вверх по периодической таблице элементы становятся более электроотрицательными, за исключением благородных газов.Это означает, что фтор является наиболее электроотрицательным элементом. Элементам были присвоены относительные значения электроотрицательностей по шкале Полинга, где фтор имеет наивысшее значение 4. Не волнуйтесь, вряд ли вам когда-нибудь придется запоминать эти числа. В большинстве случаев вы сможете ссылаться на них, и после некоторой практики вы начнете запоминать относительные значения, и они вам больше не понадобятся.
Количественное эмпирическое правило состоит в том, что когда разница между электроотрицательностями атома находится в пределах 0. 4 и 1,8 связь считается полярной, а все, что меньше 0,4, — неполярной.
4 и 1,8 связь считается полярной, а все, что меньше 0,4, — неполярной.
Возьмем, к примеру, фтористый водород . Фтор гораздо более электроотрицательный, чем водород; по шкале Полинга их разница составляет 1,8, так что это очень полярная связь. Таким образом, связывающие электроны проводят гораздо больше времени вокруг атома фтора, чем у атома водорода. Это оставляет фтористый конец связи с частичным отрицательным зарядом, а водородный конец связи с частичным положительным зарядом.
И наоборот, в углерод-водородных связях их соответствующие электроотрицательности относительно схожи, разница составляет всего 0,35 по шкале Полинга. Таким образом, связывающие электроны проводят примерно одинаковое время вокруг двух атомов и отсутствуют области частичного заряда. Опять же, эти связи называются неполярными.
Помните, что при оценке полярности связи недостаточно просто увидеть электроотрицательный атом, чтобы понять, что это полярная связь. Если другой атом также электроотрицательный, то электроны будут разделены поровну, и связь будет неполярной.Итак, возвращаясь к нашему примеру с хлором, хотя хлор является третьим наиболее электроотрицательным элементом, связь хлор-хлор неполярна, потому что хлоры одинаково притягивают электроны. Однако свяжите этот хлор с углеродом, и вы получите полярную связь.
Если другой атом также электроотрицательный, то электроны будут разделены поровну, и связь будет неполярной.Итак, возвращаясь к нашему примеру с хлором, хотя хлор является третьим наиболее электроотрицательным элементом, связь хлор-хлор неполярна, потому что хлоры одинаково притягивают электроны. Однако свяжите этот хлор с углеродом, и вы получите полярную связь.
Наконец, давайте ответим на третий вопрос о влиянии полярности.
Помните, что в полярных связях есть участки частичного положительного и отрицательного заряда. Это создает возможность для привлекательных взаимодействий.Полярные связи могут совпадать с другими полярными связями; они называются диполь-дипольными взаимодействиями.
Они слабы по сравнению с ионными, металлическими или ковалентными связями, но в совокупности они объясняют многие химические и физические свойства молекулярных соединений. Напротив, поскольку неполярные связи более или менее нейтральны, их межмолекулярные взаимодействия намного слабее.
Это всего лишь один пример того, как полярность влияет на свойства молекулярных соединений.Полярность также играет важную роль в реакционной способности и растворимости соединений. Например, вы могли слышать фразу «подобное растворяется в подобном». Что ж, «подобное» во фразе обычно относится к полярным и неполярным, что означает, что полярные соединения растворяются в других полярных соединениях, а неполярные соединения растворяются в других неполярных соединениях.
Давайте завершим сегодняшнее видео небольшой практикой. До сих пор мы рассматривали только двухатомные молекулы, но мы также можем определить полярность связей внутри более крупных молекул.Вот быстрый пример с хлорметаном. Хлор значительно более электроотрицателен, чем атом углерода, что делает эту связь хлор-углерод полярной. Итак, мы отметим его полярной стрелкой, указывающей на хлор. С другой стороны, все связи углерод-водород неполярны, поэтому мы можем оставить их без стрелки.
Теперь скопируйте структуру уксусной кислоты и сделайте то же самое, нарисовав полярные стрелки для любой полярной связи. Обратитесь к шкале Полинга здесь, если вам это нужно.
Обратитесь к шкале Полинга здесь, если вам это нужно.
Хорошо, кислород более электроотрицательный, чем оба углерода (разница 0.89) и водород (разница 1,24), поэтому мы можем нарисовать полярные стрелки, показывающие частичные отрицательные заряды на обоих атомах кислорода. Это оставляет центральный углерод и водород, который присоединен к кислороду, частично положительными, в то время как группа связей углерод-водород неполярна.
В завершение давайте быстро подытожим то, что мы только что обсудили. Полярные ковалентные связи возникают, когда электроны распределяются между атомами неравномерно, тогда как неполярные ковалентные связи возникают, когда электроны более равномерно распределяются между атомами.Неравное распределение электронов происходит из-за различий в электроотрицательности двух атомов, разделяющих электроны. Это неравное распределение электронов приводит к возникновению частичных зарядов. Чем больше разница в электроотрицательности между двумя атомами, тем сильнее диполь. Например, ковалентные связи, образованные между атомом углерода и двумя атомами кислорода в двуокиси углерода, являются полярными ковалентными связями, поскольку электроотрицательность углерода и кислорода различаются. Если электроотрицательности близки к равным, то ковалентные связи неполярны.
Например, ковалентные связи, образованные между атомом углерода и двумя атомами кислорода в двуокиси углерода, являются полярными ковалентными связями, поскольку электроотрицательность углерода и кислорода различаются. Если электроотрицательности близки к равным, то ковалентные связи неполярны.
Хорошо, это все для этого обзора! Спасибо за просмотр и удачной учебы!
Что такое неполярная ковалентная связь?
Фото: Public Domain, https://commons.wikimedia.org/w/index.php?curid=1264890Неполярные ковалентные связи — это связи, в которых оба атома обладают одинаковой электроотрицательностью, и, следовательно, электроны в электронной связи делится между ними поровну. Обратите внимание, что это должно происходить между двумя атомами неметалла, чтобы это была правильная неполярная ковалентная связь.
Это краткое определение неполярных ковалентных связей, но более внимательное изучение того, что означает ковалентность связи и неполярность вещества, поможет вам понять неполярные ковалентные связи более подробно.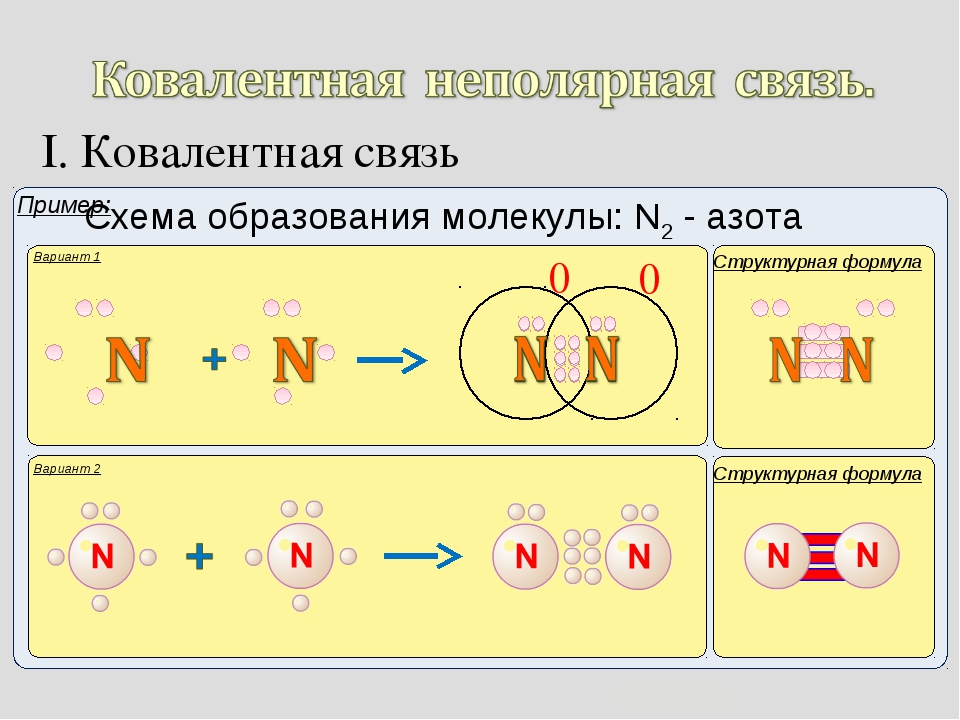
Что такое ковалентная связь?
В химии ковалентная связь представляет собой химическую структуру, которая соединяет вместе два иона или атома, состоящую из электронов, которые являются общими для этих атомов. Ковалентные связи также иногда называют молекулярными связями.Ковалентные связи обычно возникают между двумя атомами, которые довольно близки по электроотрицательности и являются неметаллическими по своей природе. Тем не менее, другие химические вещества также могут образовывать ковалентные связи, такие как макромолекулы и радикалы. Пары электронов, которые устанавливают ковалентную связь, часто называют общими парами, иногда называемыми связывающими парами. Эффект общих пар заключается в том, что оба атома, участвующие в связи, обычно имеют стабильную внешнюю электронную оболочку, стабильность аналогична той, что наблюдается в атомах элементов благородных газов.
Фото: CNX OpenStax через Wikimedia Commons, CC 4.0 Химическое соединение, содержащее атомы, образующие ковалентные связи, называется ковалентным соединением. Ковалентные соединения являются одной из двух категорий, в которые обычно группируются соединения. Другой тип соединения — это ионное соединение, а ионные соединения состоят из электрически заряженных молекул или атомов благодаря электрическому дисбалансу, вызванному потерей или приобретением электронов. Обычно это происходит в результате взаимодействия металлических элементов с неметаллическим элементом.Примеры ковалентных соединений включают ДНК, воду и сахарозу.
Ковалентные соединения являются одной из двух категорий, в которые обычно группируются соединения. Другой тип соединения — это ионное соединение, а ионные соединения состоят из электрически заряженных молекул или атомов благодаря электрическому дисбалансу, вызванному потерей или приобретением электронов. Обычно это происходит в результате взаимодействия металлических элементов с неметаллическим элементом.Примеры ковалентных соединений включают ДНК, воду и сахарозу.
Двумя наиболее известными типами ковалентных связей являются полярные ковалентные связи и чистые/неполярные ковалентные связи. Что отличает неполярные ковалентные связи, так это то, что их электроны разделены поровну. Идентичные атомы, атомы, которые имеют одинаковые значения электроотрицательности, имеют одинаковое распределение электронов, но определение иногда растягивается, чтобы охватить любые атомы, которые имеют приблизительно одинаковое распределение электронов, атомы с разницей электроотрицательности меньше 0. 4. Молекулы с такими неполярными связями включают Ch5, N2 и h3.
4. Молекулы с такими неполярными связями включают Ch5, N2 и h3.
Электроотрицательность двух атомов влияет на то, как электроны, образующие связь, распределяются между атомами. По мере увеличения разницы в электроотрицательности связь между электронными парами становится более связанной с одним атомом, чем с другим атомом. Существуют различные пороговые значения, которые отличают характеристики облигации. Связи, имеющие разность электроотрицательностей от 0 до 0,3, считаются неполярными связями, а те, которые имеют разности в пределах от 0.4-1,7 классифицируются как полярные связи. Наконец, ионные связи — это те, где разница электроотрицательностей превышает 1,7.
Давайте рассмотрим несколько примеров ковалентных связей. Ковалентные связи встречаются в молекулах воды, которые имеют химическую формулу h3O. Каждый атом водорода в молекуле имеет ковалентную связь с кислородом. В каждой из ковалентных связей есть два электрона, один из которых исходит от атома водорода, а другой — от атома кислорода.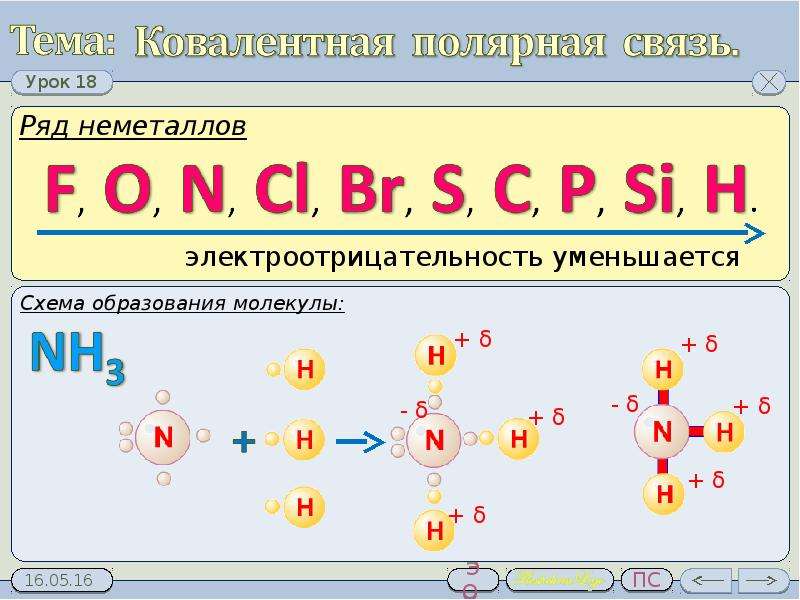 Поскольку электроотрицательность двух атомов относительно одинакова, электроны распределяются между двумя атомами более или менее поровну.
Поскольку электроотрицательность двух атомов относительно одинакова, электроны распределяются между двумя атомами более или менее поровну.
Молекула водорода в h3O состоит из двух атомов водорода, связанных ковалентной связью. Атом водорода поддерживает стабильную внешнюю электронную оболочку, имея два электрона в этой оболочке, а положительный заряд ядер атомов водорода притягивает к себе электроны, что удерживает отдельные составляющие молекул вместе. Фосфор способен образовывать две разные молекулы в сочетании с хлором. Фосфор и хлор могут создавать либо PCl3, либо PCl5.
Обе эти молекулы имеют ковалентные связи, соединяющие атомы фосфора и хлора вместе, а в случае PCl3 молекула принимает традиционные структуры инертных газов, где внешняя электронная оболочка полностью заполнена.В то время как PCl3 является стабильной молекулой, PCl5 также оказывается стабильной молекулой, поэтому, хотя правило октета является удобной эвристикой для определения стабильности молекулы, следует помнить, что ковалентные связи не всегда следуют этому правилу.
Что такое полярность?
В повседневной жизни вы чаще всего слышите термин «полярный» по отношению к крайним полюсам Земли, Северному и Южному полюсам. Расположение этих полюсов находится в противоположных точках на поверхности планеты.Подобно полюсам, найденным на крайнем севере и юге Земли, у батареи также есть полюса, отрицательный и положительный полюса. В контексте батарей один конец батареи имеет положительный заряд, а противоположный — отрицательный. Подобно батареям, атомы также могут иметь полюса и полярность, даже связи между атомами могут иметь полярность. Молекулы классифицируются как полярные, когда атомы, составляющие молекулу, выстраиваются таким образом, что один конец молекулы имеет суммарный отрицательный заряд, а противоположный конец имеет суммарный положительный заряд.
Молекула воды. Синий представляет области положительного заряда, красный — области отрицательного заряда. Фото: Риккардо Ровинетти через Wikimedia Commons, CC 3.0 Атомы со слабой электроотрицательностью могут связываться с атомами с более высоким значением электроотрицательности, и когда это происходит, создается полярная молекула. Электрические полюса образуются, когда соединяются атомы с различными уровнями электроотрицательности, а полярная природа молекул, созданных таким образом, означает, что они могут связываться со многими другими видами молекул.Тот факт, что полярные молекулы имеют как отрицательную, так и положительную области, позволяет им связываться с широким спектром других химических структур. Вода — полярная молекула, и благодаря своей полярной природе она способна присоединяться ко многим другим молекулам и служить основой жизни на Земле.
Электрические полюса образуются, когда соединяются атомы с различными уровнями электроотрицательности, а полярная природа молекул, созданных таким образом, означает, что они могут связываться со многими другими видами молекул.Тот факт, что полярные молекулы имеют как отрицательную, так и положительную области, позволяет им связываться с широким спектром других химических структур. Вода — полярная молекула, и благодаря своей полярной природе она способна присоединяться ко многим другим молекулам и служить основой жизни на Земле.
Если полярные молекулы имеют электрические полюса, вы можете догадаться, что неполярные молекулы не имеют электрических полюсов. Неполярные молекулы не имеют заметного заряда ни на одной половине структуры, имея более или менее равномерное распределение электронов по всей молекуле.Подводя итог, можно сказать, что у неполярных молекул нет различий в зарядах на обоих концах молекулы, а заряды атомов нейтрализуют друг друга. Между тем полярные молекулы примечательны тем, что их диполи имеют как суммарный отрицательный заряд, так и суммарный положительный заряд.
Примеры полярных и неполярных молекул
Давайте рассмотрим некоторые конкретные примеры полярных и неполярных молекул.
Как уже упоминалось, вода является полярной молекулой, и связи, соединяющие атомы кислорода и водорода, распределены таким образом, что на обеих половинах кислородно-водородной связи имеется равное количество места, и такое расположение означает, что одна половина молекула имеет чистый отрицательный заряд, а другая половина сохраняет положительный заряд.Другой полярной молекулой является этанол, который получает свою полярную природу из-за того, что атомы кислорода, находящиеся внутри молекулы, имеют большую электроотрицательность, чем окружающие атомы. Более высокий потенциал электроотрицательности означает, что эти атомы кислорода притягивают больше электронов, чем атомы водорода, что дает связи –ОН и общий отрицательный заряд. Другие полярные молекулы включают диоксид серы и сероводород.
К неполярным молекулам относятся такие молекулы, как озон, кислород и азот. В случае этих неполярных молекул они состоят из одного элемента и называются гомоядерными молекулами. Есть гомоядерные молекулы, в том числе двуокись углерода, четыреххлористый углерод и метан. Такие вещества, как бензин, толуол и уксусная кислота, также имеют тенденцию быть неполярными.
В случае этих неполярных молекул они состоят из одного элемента и называются гомоядерными молекулами. Есть гомоядерные молекулы, в том числе двуокись углерода, четыреххлористый углерод и метан. Такие вещества, как бензин, толуол и уксусная кислота, также имеют тенденцию быть неполярными.
Хотя монооксид углерода является полярной молекулой, большинство углеродных соединений неполярны, а уникальная структура монооксида углерода делает его полярной молекулой и является исключением из этого правила.У монооксида углерода разница электроотрицательностей между молекулами кислорода и углерода достаточно велика, поэтому молекула имеет разность зарядов и является полярной. Еще одна особенность монооксида углерода заключается в том, что, хотя большинство линейных молекул неполярны, монооксид углерода полярен. Другие неполярные молекулы включают благородные газы и алкины. Благородные газы, иногда называемые инертными газами, неполярны, поскольку состоят только из атомов одного и того же элемента, тогда как алкины могут растворяться в воде. Гелий, криптон, аргон и неон — все это примеры благородных газов.
Гелий, криптон, аргон и неон — все это примеры благородных газов.
Значения электроотрицательности атома молекулы определяют, является ли молекула неполярной или полярной. В конце концов, электроны распределяются поровну между атомами, если существуют большие различия в значениях электроотрицательности, и если значения распределяются неравномерно, молекула будет иметь суммарный отрицательный заряд в одной области и суммарный положительный заряд в другой, что делает ее полярной. Помните, что необходимо учитывать общую электроотрицательность, электроотрицательность всех связей.Одним из основных факторов, влияющих на полярность молекулы, является структура/геометрия молекулы. Если все заряды молекулы вращаются вокруг центрального атома, по всей вероятности, они распределены равномерно, и в результате молекула будет неполярной. При прогнозировании полярности молекулы необходимо учитывать как общую электроотрицательность, так и структуру молекулы.
Была ли эта статья полезной?
😊 ☹️ Приятно слышать! Хотите узнать больше о научных тенденциях? Подпишитесь на нашу научную рассылку! Нам жаль это слышать! Мы любим отзывы 🙂 и хотим, чтобы вы внесли свой вклад в то, как сделать Science Trends еще лучше.
Сравните ионные и ковалентные соединения
Сравните ионные и ковалентные соединенияСравнение ионных, полярных и неполярных Облигации
Определения: Ионная связь : Образование Ионной связи является результатом перенос одного или нескольких электронов с металла на неметалл. Ковалентная связь: Связь между неметаллами состоит из двух общих электронов между двумя атомами.При ковалентной связи два электрона делят атомы притягиваются к ядрам обоих атомов. Ни один атом полностью теряет или приобретает электроны, как при ионной связи. Существует два типа ковалентной связи: 1. Неполярный связывание с равным разделением электронов. 2. Полярный
связывание с неравным распределением электронов. | |
Сравнение ионной, полярной и неполярной связи: Принимая во внимание, что неполярная связь предполагает равное распределение электронов между одинаковыми атомами неметаллов ПОЛЯРНАЯ СВЯЗЬ является неравной обмен электронами между двумя различными атомами неметаллов. А правильное понимание полярной связи достигается при просмотре типы связи на континууме. Ионная связь включена одна крайность с полным переносом электронов, образующих заряженные ионы.Неполярная ковалентная связь с равным распределением электронов находится в другой крайности. Где-то посередине, но в пользу ковалентная сторона представляет собой полярную связь с неравным распределением электронов частичный, но неполный перенос электронов. | |
Сравнение диаграмм Льюиса ионных, полярных и неполярных Склеивание: Лучший способ показать и представить неравное распределение
электроны были бы по сравнению с NaCl и HCl, а h3 с использованием
Диаграммы Льюиса. Подписи ниже соответствуют рисунку справа. IONIC: Полный перенос электронов, поэтому Na становится положительным (потеря e-), а Cl становится отрицательным (приобретается e-). ПОЛЯРНЫЙ: Неравное распределение. Хлор имеет большую склонность сохранить свой собственный электрон, а также отобрать электрон водорода. Это НЕ полностью успешно. В результате только частичные заряды установлены.Водород становится частично положительным, так как он потерял контроль над своим электроном некоторое время (H +). хлор становится частично отрицательным, так как он получает электрон водорода иногда (Cl-).
НЕПОЛЯРНЫЙ: Равное разделение. Ни один атом не может доминировать другой, поэтому электроны делятся поровну между их. |
Полярные и неполярные молекулы — определение, 7 ключевых отличий, примеры
Определение полярных молекулПолярная молекула представляет собой химическое вещество, в котором электроны распределяются между участвующими атомами неравномерно, что приводит к дипольному моменту.
- Термин полярность используется для описания разницы электрических полюсов молекулы, которая затем определяет, насколько полярна молекула.

- Определение того, является ли молекула полярной, основывается на сумме всех связей, присутствующих в молекуле.
- Полярность возникает при образовании связи с атомами, имеющими разную электроотрицательность. Когда один из атомов имеет более высокое сродство к электрону, он притягивает к себе общую пару электронов, что изменяет распределение электронов.
- Если разница в электроотрицательности значительна, полярная связь с формой. Если разница велика, один из атомов полностью оттягивает к себе электроны, что приводит к образованию ионной связи.
- Полярность часто выражается в случае ковалентных связей, поскольку эти связи образуются за счет совместного использования электронов.
- Полярные молекулы ориентируются в определенном направлении в присутствии электрического поля. Положительный конец молекулы направлен к отрицательному полюсу поля, тогда как отрицательный конец направлен к положительному полюсу.

- В случае молекул с более чем двумя атомами следует учитывать геометрию молекул, чтобы определить их полярность.
- В многоатомных соединениях полярность зависит от суммарного дипольного момента всех ковалентных связей, присутствующих в молекуле.
- Полярные молекулы обычно имеют более высокие температуры кипения и плавления, а также высокое поверхностное натяжение, поскольку полярные связи значительно прочнее неполярных.
- Некоторые примеры полярных молекул: H 2 O, CHF 3 , NH 3 и т. д.
Источник изображения: Гавайский университет в Маноа.
Определение неполярных молекулНеполярные молекулы — это молекулы, в которых электроны поровну распределены между вовлеченными атомами и имеют нулевой дипольный момент.
- Неполярные молекулы образуются, когда два атома, участвующие в химической связи, имеют одинаковое сродство к электронам, что обеспечивает равное распределение электронов между ними.

- Истинные неполярные связи существуют только между двухатомными молекулами одного и того же элемента, такого как N2 и O2.
- Однако неполярные молекулы проявляют лондоновские дисперсионные силы, вызванные симметричным распределением электронов.
- Взаимодействие часто носит спонтанный и временный характер и является самой слабой из всех межмолекулярных сил.
- В случае многоатомных или сложных молекул отсутствие полярности может быть результатом симметричного расположения полярных связей.
- Если две равнополярные связи расположены таким образом, что диполь одной связи уравновешивает диполь другой, может образоваться нулевой суммарный диполь, что приведет к образованию неполярной молекулы.
- Большинство углеводородов неполярны по своей природе, так как разница в электроотрицательности между атомами углерода и водорода очень мала.
- Неполярные взаимодействия обычно менее сильны, чем полярные, так как в них не участвует электростатическая ассоциация.

- Неполярные молекулы не имеют никакой ориентации в электрическом поле, поскольку между неполярными молекулами и электрическим полем не происходит электростатического взаимодействия.
- Некоторыми примерами неполярных молекул являются CO 2 , H 2 , бензол и т. д.
| Характеристики | Полярные молекулы | Неполярный молекул | Определение | Определение | Полярная молекула — это химическое вещество, в котором распределение электронов между атомами являются неровным, что приводит к дипольный момент. | Неполярные молекулы — это молекулы, в которых электроны поровну распределены между вовлеченными атомами и имеют нулевой дипольный момент. | |
| Дипольный момент | Суммарный дипольный момент присутствует в полярных молекулах. | Суммарный диполь неполярных молекул равен нулю. | |||||
| Электроотрицательности | Разница в электроотрицательности между атомами больше 0,4. | Разница в электроотрицательности между атомами менее 0,4. | |||||
| Физические свойства | Полярные молекулы имеют высокие температуры кипения и плавления. | Неполярные молекулы имеют низкие температуры кипения и плавления. | |||||
| Разделение зарядов | Полярные молекулы имеют частичный положительный и частичный отрицательный заряд внутри молекулы. | В случае неполярных молекул разделения зарядов не наблюдается. | |||||
| Межмолекулярные силы | Полярные молекулы могут участвовать в водородных связях между заряженными полюсами связи. | Неполярные молекулы обычно имеют более слабые межмолекулярные силы, такие как силы Ван-дер-Ваальса. | |||||
| Примеры | Некоторые примеры полярных молекул являются H 2 o, CHF 3 , NH 3 , NH 3 , и др. 3 и др. 3 и др. | Некоторые примеры неполярных молекул CO 2 , H 2 , бензол и т. д. |
Источник изображения: Гавайский университет в Маноа.
Вода (H 2 O)- Вода представляет собой полярную молекулу, состоящую из двух связей O-H, где дипольный момент каждой из этих связей равен 1.5Д.
- Вода не имеет линейной структуры, так как неподеленная пара электронов на атоме кислорода отталкивает общую пару электронов между водородом и кислородом.
- Атом кислорода более электроотрицателен, чем водород, поэтому он притягивает к себе общую пару электронов.
- Неравное распределение электронов приводит к частичному отрицательному заряду атомов кислорода и частичному положительному заряду водорода. Полярность связей O-H отвечает за изогнутую структуру молекулы.

- Полярная природа молекул водорода также приводит к образованию водородных связей с другой молекулой воды или другими полярными молекулами.
- Воду называют универсальным растворителем, так как она способна растворять большинство полярных веществ в результате взаимодействия слабо заряженных атомов.
Источник изображения: Гавайский университет в Маноа.
Углекислый газ (CO 2 )- Углекислый газ состоит из двух полярных связей C-O; однако молекула неполярна, поскольку связи расположены таким образом, что чистый диполь равен нулю.
- Каждая из связей C-O имеет дипольный момент 2,3D, но диполи действуют в противоположных направлениях, что приводит к нулевому диполю.
- Связи C-O расположены под углом 180° друг к другу, что приводит к линейной молекулярной структуре.
- Полярность C-O обусловлена тем, что атом кислорода более электроотрицателен, чем атом углерода.

- Углекислый газ является примером молекул, которые являются неполярными, несмотря на то, что связи, присутствующие в молекуле, являются полярными.
CO 2 (Двуокись углерода) представляет собой неполярную молекулу.
Является ли H 2 O полярным или неполярным?H 2 O (вода) представляет собой полярную молекулу.
Является ли NH 3 полярным или неполярным?NH 3 представляет собой полярную молекулу.
Является ли SO 2 полярным или неполярным?SO 2 (диоксид серы) представляет собой полярную молекулу.
Является ли BF 3 полярным или неполярным?BF 3 (трифторид бора) представляет собой неполярную молекулу.
Является ли CCl 4 полярным или неполярным? CCl 4 (четыреххлористый углерод) представляет собой неполярную молекулу.
CH 4 (Метан) представляет собой неполярную молекулу.
Является ли CH 2 Cl 2 полярным или неполярным?CH 2 Cl 2 (Дихлорметан) представляет собой полярную молекулу.
Является ли CH 3 Cl полярным или неполярным?CH 3 Cl (хлорметан) представляет собой полярную молекулу.
Является ли XeF 2 полярным или неполярным?XeF 2 (дифторид ксенона) представляет собой неполярную молекулу.
Является ли NOCl полярным или неполярным?NOCl (нитрозилхлорид) представляет собой полярную молекулу.
Является ли SF 4 полярным или неполярным?SF 4 (тетрафторид серы) представляет собой полярную молекулу.
Является ли BH 3 полярным или неполярным? BH 3 (Боран) представляет собой неполярную молекулу.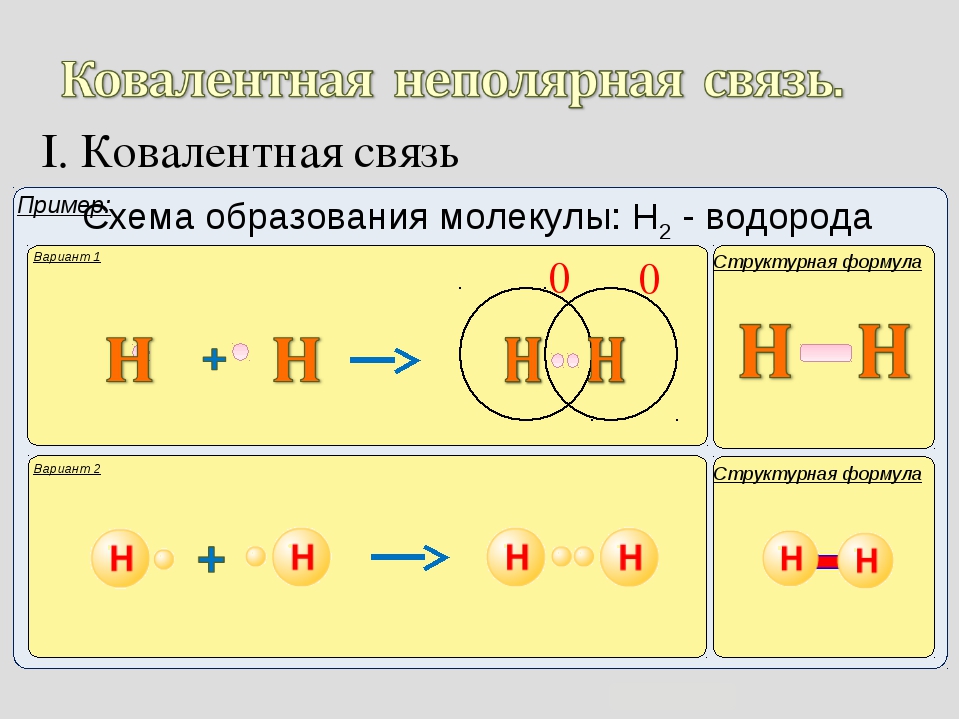
- Gautum SD, Pant M и Adhikari NR (2016). Всесторонняя химия, часть 2. Шестое издание. Издатели и дистрибьюторы наследия Pvt. Ltd. ://pediaa.com/difference-between-polar-and-nonpolar-molecules/ — 6%
- https://techiescientist.com/is-pf5-polar-or-nonpolar/ – 3%
- https://www.thoughtco.com/definition-of-polar-molecule-605531 – 2%
- https://courses.lumenlearning.com /cheminter/chapter/полярные молекулы/ – 2%
Разница между ковалентной и полярной ковалентной
Основное отличие — ковалентный против полярно-ковалентного
В соединениях существуют различные типы химических связей.Ковалентные связи являются такими химическими связями. Ковалентная связь образуется, когда два атома делят друг с другом свои неспаренные электроны. Сохранение неспаренных электронов не является стабильным состоянием для атома. Следовательно, они образуют ковалентные связи, чтобы подчиняться электронной конфигурации вокруг атома. Ковалентные связи могут быть как полярными, так и неполярными. Основное различие между ковалентной и полярной ковалентной связью заключается в том, что ковалентная связь может быть как полярной, так и неполярной, тогда как полярная ковалентная связь по существу полярна.
Следовательно, они образуют ковалентные связи, чтобы подчиняться электронной конфигурации вокруг атома. Ковалентные связи могут быть как полярными, так и неполярными. Основное различие между ковалентной и полярной ковалентной связью заключается в том, что ковалентная связь может быть как полярной, так и неполярной, тогда как полярная ковалентная связь по существу полярна.
Ключевые области охвата
1. Что такое Coverent
— определение, правило октета, разные типы
2. Что такое полярное ковалентное
— определение, электроотрицательность
3. В чем разница между ковалентным и полярным ковалентным
– Сравнение ключевых различий
Ключевые термины: химическая связь, ковалентная связь, ковалентное соединение, электроотрицательность, неполярность, правило октетов, пи-связь, полярная ковалентная связь, сигма-связь
Что такое ковалентный
Термин ковалентный используется для обозначения химических связей, образованных путем обмена неспаренными электронами между атомами, или для обозначения соединений, состоящих из атомов, связанных друг с другом ковалентными связями. Ковалентные связи образуются, когда два атома делят друг с другом свои неспаренные электроны, чтобы получить стабильную электронную конфигурацию.
Ковалентные связи образуются, когда два атома делят друг с другом свои неспаренные электроны, чтобы получить стабильную электронную конфигурацию.
В соответствии с правилом октета электронной конфигурации атом, отличный от водорода, имеет тенденцию образовывать связи до тех пор, пока он не будет окружен восемью валентными электронами. Следовательно, атомы образуют либо ионные связи, либо ковалентные связи, чтобы подчиняться правилу октета.
Когда образуется ковалентная связь, два электрона являются общими для обоих атомов. Например, атом углерода в основном состоянии имеет четыре валентных электрона (валентные электроны — это электроны, расположенные на самой внешней орбитали атома).Чтобы завершить электронную конфигурацию, атом углерода делит свои четыре электрона с другими четырьмя электронами (неспаренными). Самый простой пример – метан. В метане четыре атома водорода делят свои неспаренные электроны с одним атомом углерода, образуя четыре ковалентные связи.
Рисунок 1: Четыре ковалентные связи в молекуле метана
Ковалентное соединение представляет собой химическое соединение, состоящее из атомов, связанных друг с другом ковалентными связями.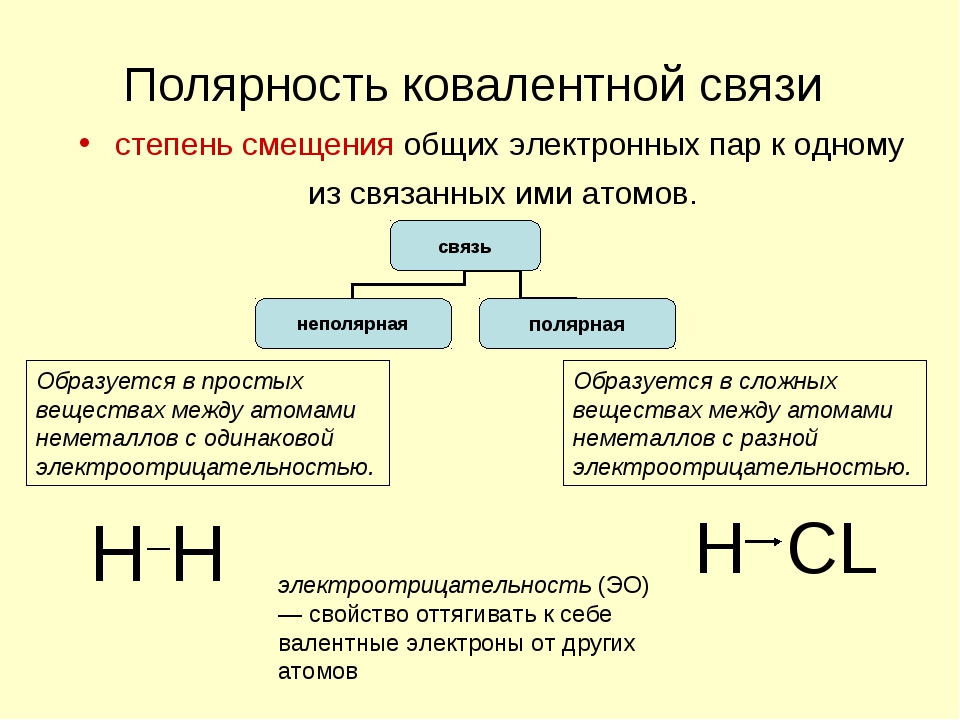 Эти соединения могут быть молекулами или ионами.Ковалентная связь может быть как полярной, так и неполярной. Ковалентные связи также могут быть одинарными, двойными или тройными связями. Одинарная связь представляет собой сигма-связь. Двойные и тройные связи состоят из пи-связей и сигма-связи.
Эти соединения могут быть молекулами или ионами.Ковалентная связь может быть как полярной, так и неполярной. Ковалентные связи также могут быть одинарными, двойными или тройными связями. Одинарная связь представляет собой сигма-связь. Двойные и тройные связи состоят из пи-связей и сигма-связи.
Что такое полярная ковалентная
Термин полярная ковалентная используется для обозначения ковалентной связи, которая является полярной. Существует два типа ковалентных связей: полярные ковалентные связи и неполярные ковалентные связи. Неполярные ковалентные связи образуются, когда два атома имеют одинаковые электронные пары.Полярная ковалентная связь образуется, когда два атома имеют неравное распределение электронов.
Неравное распределение электронов приводит к тому, что ковалентная связь имеет небольшое разделение электрических зарядов. Тогда один конец ковалентной связи будет иметь дельта-положительный электрический заряд, а другой конец будет иметь дельта-отрицательный заряд. Это известно как дипольный момент.
Это известно как дипольный момент.
Рисунок 2: Ковалентные полярные связи в молекуле воды
Причиной этого неравного распределения электронов между двумя атомами является различие между значениями электроотрицательности атомов.Когда два атома с разной электроотрицательностью находятся в ковалентной связи, электроны связи больше притягиваются к более электроотрицательному атому, чем к другому атому. Например, ковалентная связь между C и O будет иметь дельта-положительный заряд на атоме углерода и дельта-отрицательный заряд на атоме кислорода. Это связано с тем, что электроотрицательность О составляет 3,44, а для углерода — 2,55.
Разница между ковалентной и полярной ковалентной
Определение
Ковалентный: Термин ковалентный относится к химическим связям, образованным путем обмена неспаренными электронами между атомами, или к соединениям, состоящим из атомов, связанных друг с другом ковалентными связями.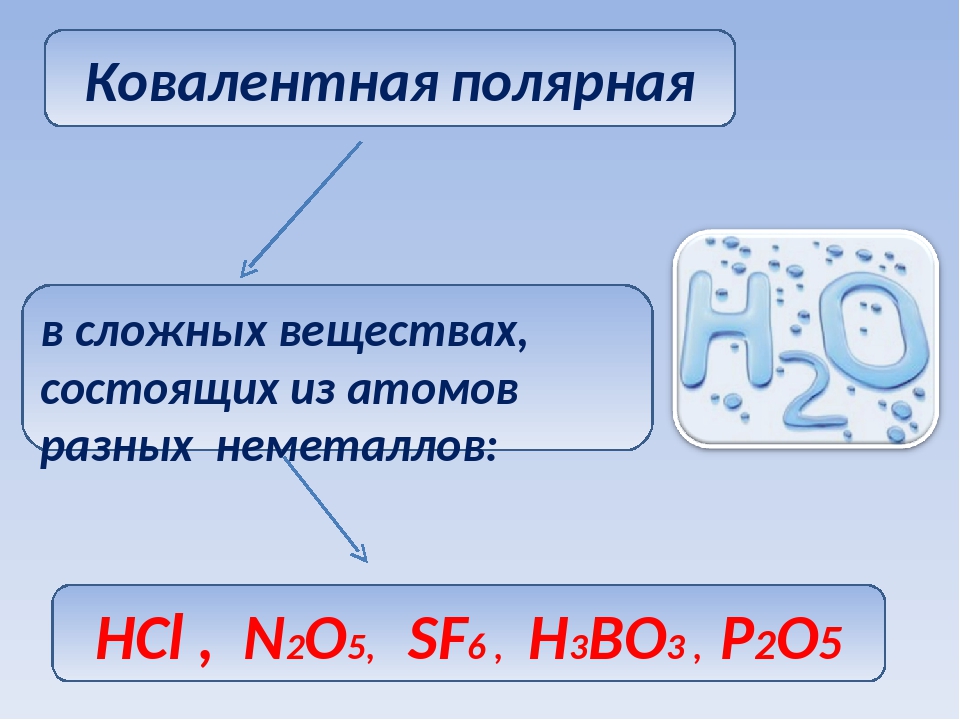
Полярная ковалентная связь: Термин «полярная ковалентная связь» используется для обозначения ковалентной связи, которая является полярной.
Полярность
Ковалентная: Ковалентные связи могут быть как полярными, так и неполярными.
Полярная ковалентная: Полярные ковалентные связи являются полярными.
Разделение электрического заряда
Ковалентная: Ковалентные связи могут иметь или не иметь электронного разделения зарядов.
Полярная ковалентная: Полярные ковалентные связи демонстрируют небольшое разделение электрических зарядов.
Дипольный момент
Ковалентный: Ковалентный может иметь или не иметь дипольный момент.
Полярная ковалентная: Полярные ковалентные связи имеют дипольный момент.
Заключение
Ковалентная связь образуется, когда два атома делят друг с другом свои неспаренные электроны. Ковалентные связи могут быть как полярными, так и неполярными. Основное различие между ковалентной и полярной ковалентной связью заключается в том, что ковалентная связь может быть как полярной, так и неполярной, тогда как полярная ковалентная связь по существу полярна.
Ковалентные связи могут быть как полярными, так и неполярными. Основное различие между ковалентной и полярной ковалентной связью заключается в том, что ковалентная связь может быть как полярной, так и неполярной, тогда как полярная ковалентная связь по существу полярна.
Каталожные номера:
1. Хельменстин, Энн Мари. «Понять, что такое ковалентная связь в химии». ThoughtCo, доступно здесь.
2. Хельменстин, Энн Мари. «Что такое полярная связь в химии? Определение и примеры». ThoughtCo, доступно здесь.
Изображение предоставлено:
1. «Ковалентный» DynaBlast — создано с помощью Inkscape (CC BY-SA 2.5) через Commons Wikimedia
2. «209 полярных ковалентных связей в молекуле воды» Колледж OpenStax — анатомия и физиология, веб-сайт Connexions, 19 июня, 2013.(CC BY 3.0) через Commons Wikimedia
Полярные и неполярные ковалентные связи: определения, молекулы и примеры
Полярные и неполярные ковалентные связи: Две основные группы молекул — это полярные и неполярные молекулы. Некоторые молекулы определенно полярны или неполярны, в то время как многие имеют некоторую полярность и находятся где-то посередине. Вот беглый взгляд на то, что означают полярность и неполярность, как предсказать, будет ли молекула той или иной, и примеры характерных соединений.
Некоторые молекулы определенно полярны или неполярны, в то время как многие имеют некоторую полярность и находятся где-то посередине. Вот беглый взгляд на то, что означают полярность и неполярность, как предсказать, будет ли молекула той или иной, и примеры характерных соединений.
- В химии полярность означает распределение электрических зарядов вокруг атомов, химических групп или молекул.
- Полярные молекулы возникают, когда между связанными атомами существует разница в электроотрицательности.
- Неполярные молекулы возникают, когда электроны равномерно распределены между атомами двухатомной молекулы или когда полярные связи в более крупной молекуле компенсируют друг друга.
Полярные молекулы возникают, когда два атома не участвуют в электронах в равной степени в ковалентной связи.Образуется диполь, часть молекулы несет небольшой положительный заряд, а другая часть несет небольшой отрицательный заряд. Это происходит, когда существует различие между электроотрицательностью каждого атома. Абсолютная разница образует ионную связь, а незначительная разница образует полярную ковалентную связь.
Это происходит, когда существует различие между электроотрицательностью каждого атома. Абсолютная разница образует ионную связь, а незначительная разница образует полярную ковалентную связь.
К счастью, вы можете посмотреть электроотрицательность в таблице, чтобы предсказать, могут ли атомы образовывать полярные ковалентные связи. Если изменение электроотрицательности между двумя атомами находится в пределах 0.5 и 2.0 атомы образуют полярную ковалентную связь. Если разница электроотрицательностей между атомами больше 2,0, связь ионная. Ионные соединения представляют собой удивительно полярные молекулы.
Примеры полярных молекул включают:
- Вода – h3O
- Аммиак – Nh4
- Диоксид серы – SO2
- Сероводород – h3S
- Этанол – C2H6O
Примечание: Ионные соединения, такие как хлорид натрия (NaCl), являются полярными.Однако в большинстве случаев, когда люди говорят о «полярных молекулах», они имеют в виду «полярные ковалентные молекулы», а не все примеры соединений с полярностью!
Неполярные молекулы Когда молекулы равномерно делят электроны в ковалентной связи, суммарный электрический заряд молекулы отсутствует. В неполярной ковалентной связи электроны распределены равномерно. Вы можете предсказать неполярные молекулы, которые образуются, когда атомы имеют одинаковую или сравнимую электроотрицательность.
В неполярной ковалентной связи электроны распределены равномерно. Вы можете предсказать неполярные молекулы, которые образуются, когда атомы имеют одинаковую или сравнимую электроотрицательность.
Обычно, если разница электроотрицательности между двумя атомами меньше 0,5, связь считается неполярной, даже если единственные действительно неполярные молекулы состоят из идентичных атомов.
Неполярные молекулы также образуются, когда атомы, имеющие общую полярную связь, располагаются таким образом, что электрические заряды компенсируют друг друга.
Примеры неполярных молекул включают:
- Любой благородный газ: He, Ne, Ar, Kr, Xe (это атомы, технически не молекулы.)
- Любой из гомоядерных двухатомных элементов: h3, N2, O2, Cl2 (Это действительно неполярные молекулы.)
- Углекислый газ – CO2
- Бензол – C6H6
- Четыреххлористый углерод – CCl4
- Метан – Глава 5
- Этилен – C2h5
- Жидкие углеводороды, такие как бензин и толуол
- Большинство органических молекул
Если вы знаете двойственность молекул, вы можете предсказать, будут ли они соединяться вместе, образуя химические растворы. Общий закон заключается в том, что «подобное растворяется в подобном», что указывает на то, что полярные молекулы растворяются в других полярных жидкостях, а неполярные молекулы растворяются в неполярных жидкостях. Вот почему нефть и вода не связаны: нефть неполярна, а вода полярна.
Общий закон заключается в том, что «подобное растворяется в подобном», что указывает на то, что полярные молекулы растворяются в других полярных жидкостях, а неполярные молекулы растворяются в неполярных жидкостях. Вот почему нефть и вода не связаны: нефть неполярна, а вода полярна.
Очень важно знать, какие соединения находятся на полпути между полярными и неполярными, потому что вы можете использовать их в качестве промежуточного звена для растворения химического вещества в соединение, с которым оно иначе не ассоциировалось бы. Например, если вы хотите смешать ионное соединение или полярное соединение в органическом растворителе, вы можете растворить его в этаноле (полярном, но не сильно).Затем раствор этанола можно растворить в органическом растворителе, таком как ксилол.
Химическая связь: полярные и неполярные ковалентные связи Связь — это химическое сродство между двумя атомами, при котором электроны, остающиеся в атоме, образуют связь между двумя атомами. Химическая связь, возникающая между молекулами, может быть двух типов: ионная и ковалентная.
Химическая связь, возникающая между молекулами, может быть двух типов: ионная и ковалентная.
Ионная связь: Один из видов химической связи. В этой разновидности связи электроны в атомах молекул передаются между собой.Здесь один атом отдает электрон, а другой атом принимает электрон для создания связи. Поэтому атом образует ионы, т. е. катион, и анион. Ион с положительной энергией называется катионом, ион с отрицательной энергией называется анионом.
Ковалентная связь: Одна из разновидностей химической связи. В этой разновидности связи электроны в атомах молекул делятся друг с другом. Здесь оба атома принимают электрон для образования связи.Ковалентная связь может быть двух видов, в частности, полярные ковалентные связи и неполярные ковалентные связи.
Неполярные ковалентные связи При неполярной ковалентной связи атомы поровну делят электроны друг с другом. Вы когда-нибудь видели малышей, играющих вместе с игрушкой? Иногда они одинаково делятся игрушками, а иногда один ребенок забирает игрушку у другого ребенка. Некоторые типы химической связи очень похожи на то, как дети играют с игрушками.
Некоторые типы химической связи очень похожи на то, как дети играют с игрушками.
Неполярные ковалентные связи — это разновидность связи, которая возникает, когда два атома делят пару электронов друг с другом.Эти общие электроны склеивают два или более атома вместе, образуя молекулу. Подобно детям, которые делят игрушки, атомы, включенные в неполярную ковалентную связь, равномерно делят электроны.
HH Неполярные ковалентные связиПримером неполярной ковалентной связи является связь между двумя атомами водорода, поскольку они равномерно делят электроны. Другим примером неполярной ковалентной связи является связь между двумя атомами хлора, поскольку они также равномерно делят электроны. Неполярные ковалентные связи — это очень прочные связи, требующие большого количества энергии для разрыва связи.
Неполярные ковалентные связи чрезвычайно важны в биологии. Они образуют кислород, которым мы дышим, и помогают создавать наши живые клетки. Один вид неполярной ковалентной связи, который очень важен в биологии, называется пептидной связью. Пептидная связь связывает вместе цепи аминокислот, которые необходимы для создания нашей ДНК. Аминокислоты состоят из нескольких атомов, таких как углерод, кислород, азот и водород.
Пептидная связь связывает вместе цепи аминокислот, которые необходимы для создания нашей ДНК. Аминокислоты состоят из нескольких атомов, таких как углерод, кислород, азот и водород.
- Физическое состояние: В основном это газы и меньше жидкости
- Природа: Они очень гибкие по своей природе.
- Растворимость: Нерастворимы в воде или слабо растворимы в воде. Но они более растворимы в неполярных растворителях, таких как CCl 4 , CHCl 3 , и т. д.
- Проводимость: Это непроводники, поскольку они не содержат заряжаемых частиц.
- Точки кипения и плавления : поскольку они не имеют никакого взаимодействия или полярности, у них очень низкие температуры кипения и плавления,
- Дипольный момент: Поскольку связь больше не является полярной, они имеют нулевой дипольный момент.

Полярные ковалентные связи
Вы когда-нибудь видели, как двое детей играют, и один ребенок ведет себя жестко по отношению к другому ребенку? Ребенок-хулиган, кажется, проводит больше времени, играя с игрушкой, чем другой ребенок. Они не едины для обмена игрушками.
Это неравномерное распределение также происходит с типом связи, называемым полярной ковалентной связью. Полярная ковалентная связь — это разновидность химической связи, при которой пара электронов распределяется между двумя атомами неравномерно. В полярной ковалентной связи электроны распределяются неравномерно, потому что один атом использует больше времени с электронами, чем другой атом.В полярных ковалентных связях один атом обладает более сильным притяжением, чем другой атом, и притягивает электроны.
h3O Полярные ковалентные связи Помните, как электроны принимают отрицательный заряд? Ну, когда электроны проводят больше времени с одним атомом, это заставляет этот атом нести частичный отрицательный заряд.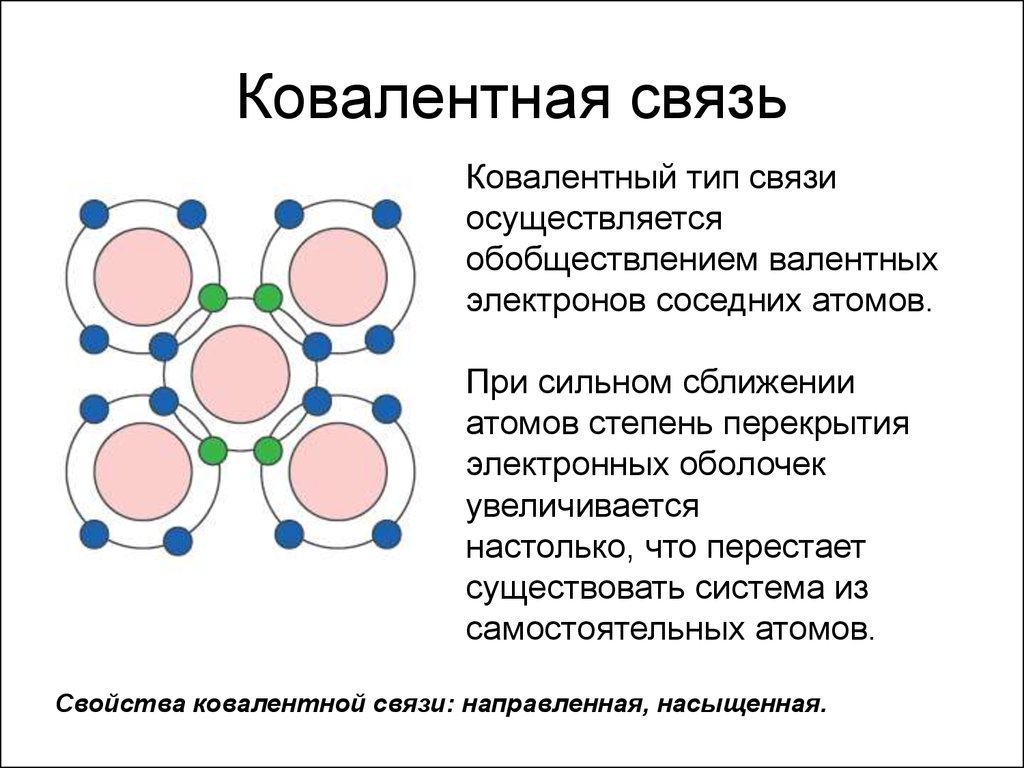 Атом, который не использует столько времени с электронами, несет частичный положительный заряд. Чтобы узнать полярную ковалентную связь, вместо этого скажите «ковалентная тяга» и поймите, что один атом сильнее «тянет» электроны, чем другой атом.
Атом, который не использует столько времени с электронами, несет частичный положительный заряд. Чтобы узнать полярную ковалентную связь, вместо этого скажите «ковалентная тяга» и поймите, что один атом сильнее «тянет» электроны, чем другой атом.
В полярной ковалентной связи один атом использует больше времени с электронами, чем другой. Ваша жизнь на самом деле зависит от полярной ковалентной связи. Ты пьешь воду, да? Молекула воды, сконденсировавшаяся в виде h3O, является примером полярной ковалентной связи. Электроны распределены неравномерно, атом кислорода использует больше времени с электронами, чем атомы водорода. Так как электроны потребляют больше времени с атомом кислорода, он несет частичный отрицательный заряд.
Другим примером полярной ковалентной связи является водород и атом хлора.В этой связи атом хлора проводит больше времени с электронами, чем атом водорода. Из-за этого неравного распределения электронов атом хлора несет частичный отрицательный заряд, а атом водорода несет частичный положительный заряд.
- Физическое состояние: Эти соединения могут жить в твердом состоянии из-за большей силы взаимодействий.
- Точки плавления и кипения: Они имеют более высокие температуры плавления и кипения, чем неполярные соединения.
- Проводимость: Они проводят электричество в фазе раствора благодаря подвижности ионов.
- Растворимость: Они хорошо растворяются в полярных растворителях, таких как вода.
Вы можете предсказать, какой тип связи сформируется, посмотрев на электроотрицательность каждого атома, участвующего в связи. Электроотрицательность показывает, насколько сильно атом будет оттягивать электроны от другого атома в химической связи.Некоторые атомы имеют более высокую электроотрицательность, а другие — более слабую электроотрицательность.
Электроотрицательность подобна игре в перетягивание каната между двумя атомами. Если у вас есть один человек на стороне нити, который сильнее, чем другой человек, то этот более сильный человек будет тянуть сильнее, привлекая другого человека в свою сторону. С другой стороны, если бы у вас было два человека одинаковой силы, то веревка не сдвинулась бы ни в одну сторону, а осталась бы на одном и том же месте.
Когда два атома имеют разные уровни электроотрицательности, один атом будет тянуть электроны от другого. Подобно перетягиванию каната, если у вас есть более сильный атом с более высокой электроотрицательностью, то он сможет перетягивать электроны в своем направлении. Поскольку атомы имеют разную электроотрицательность, электроны распределяются неравномерно.
С другой стороны, если у вас есть два атома с одинаковой силой или одинаковой электроотрицательностью, то электроны не будут тянуться ни в одном направлении, а останутся в середине двух атомов.Поскольку рывка нет, электроны поровну распределяются между двумя атомами.
Какая молекула имеет неполярную ковалентную связь?
Примеры молекул газа, которые имеют неполярную ковалентную связь: атом газообразного водорода, атомы газообразного азота и т. д. Как видно из рисунка выше, газообразный водород имеет в общей сложности 2 атома водорода. Каждый атом водорода имеет 1 валентный электрон.
Является ли HCL неполярной ковалентной связью?
Рассмотрим молекулу хлороводорода (HCl).Каждому атому в Hcl требуется еще один электрон, чтобы сформировать электронную конфигурацию инертного газа. Одиночные или множественные связи между атомами углерода неполярны. Водород и углерод имеют одинаковые значения электроотрицательности, поэтому связь C—H обычно не считается полярной ковалентной связью.
Является ли O2 неполярной ковалентной связью?
Двухатомный кислород состоит из двух одинаковых элементов, и они в равной степени делят 4 электрона, образующих двойную связь между ними. Они одинаково электроотрицательны, что означает, что у каждого элемента нет частичных зарядов.Поскольку ни один из атомов не тянет сильнее, это неполярная ковалентная связь.
Они одинаково электроотрицательны, что означает, что у каждого элемента нет частичных зарядов.Поскольку ни один из атомов не тянет сильнее, это неполярная ковалентная связь.
Какие 3 типа ковалентных связей?
Три типа, упомянутые в других ответах, — это полярно-ковалентные, неполярно-ковалентные и координатно-ковалентные. Первый, полярный ковалентный, образуется между двумя неметаллами, имеющими разную электроотрицательность.
Является ли ОО полярной ковалентной связью?
Этот атом C связан с двумя наиболее электроотрицательными атомами в молекуле (O), оба из которых оттягивают электроны от C.Доктор Хэкстон говорит, что связь О-О полярна, а связь С-С неполярна. Когда два атома одного и того же вида образуют ковалентную связь, они делят электроны поровну, потому что их электроотрицательность одинакова.
Является ли Br2 полярным или неполярным?
Br2 является неполярной молекулой, поскольку полярность молекулы зависит от наличия конечного дипольного момента. Разделение зарядов в основном происходит из-за изменения электроотрицательности различных атомов в молекуле. Для Br2, поскольку два атома равны, они имеют одинаковую электроотрицательность, поэтому он неполярен.
Разделение зарядов в основном происходит из-за изменения электроотрицательности различных атомов в молекуле. Для Br2, поскольку два атома равны, они имеют одинаковую электроотрицательность, поэтому он неполярен.
Является ли HH полярным или неполярным?
Таким образом, молекулы имеют определенную форму, подобную той, что наблюдается в изогнутой структуре молекулы воды. Электроны в связях между идентичными атомами (H-H) распределяются равномерно, поэтому электроны проводят одинаковое количество времени вокруг каждого атомного центра. Эти ковалентные связи неполярны.
Почему молекула HCL полярна, а молекула Cl2 неполярна?
H и Cl имеют разную электроотрицательность; Следовательно, они образуют полярную связь.Cl и Cl имеют одинаковую электроотрицательность; Поэтому они образуют неполярную связь.
Является ли HCL ковалентной связью?
HCL, также известная как соляная кислота, имеет ковалентную связь. Атом водорода (H) делит электрон с хлором (Cl), образуя связь.
Является ли HCN полярной или неполярной ковалентной связью?
Структура Льюиса и геометрический эскиз для HCN одинаковы: электроотрицательности водорода, углерода и азота равны 2,20, 2,55 и 3,04.Разница в 0,35 в электроотрицательности связи H-c показывает, что она существенно неполярна.
Ch4Cl полярный или неполярный?
Поскольку H находится между B и C с точки зрения значений электроотрицательности, их разница в значениях электроотрицательности настолько мала, что связь C-H считается неполярной; Таким образом, для связей C-H не нарисована дипольная стрелка. Поскольку связь C-CL полярна, Ch4Cl имеет чистый диполь, поэтому Ch4Cl полярен.
Почтовая навигация
.
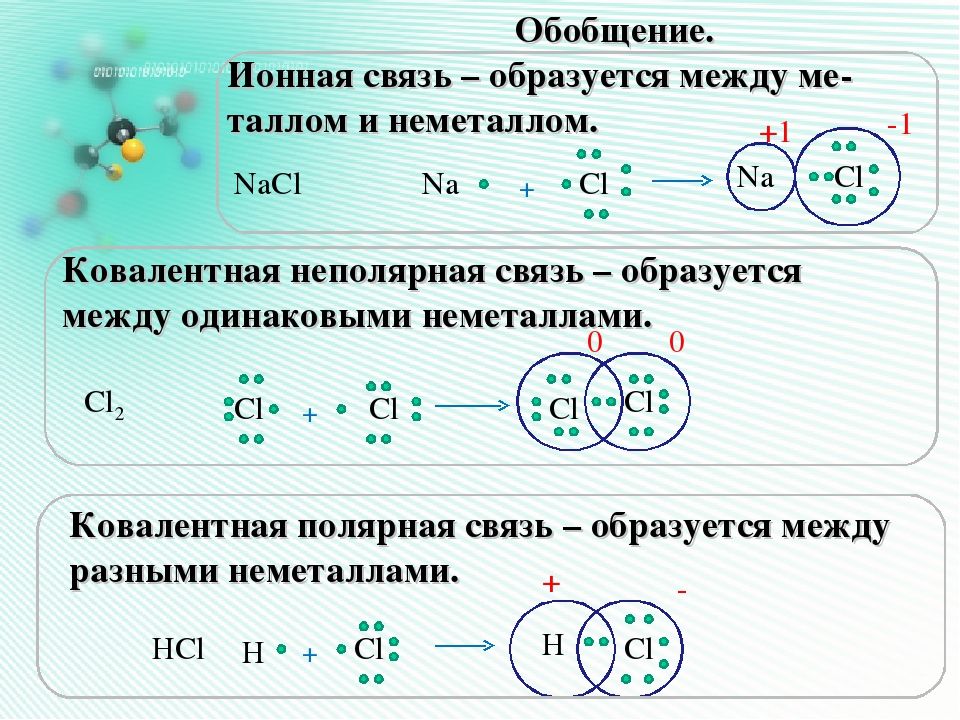

 Если соединение образуется между двумя различными неметаллами , то такое соединение называется ковалентной полярной связью .
Если соединение образуется между двумя различными неметаллами , то такое соединение называется ковалентной полярной связью .




 Какие свойства проявляет водород- металлические или неметаллические? В центре каждого атома положительное ядро, вокруг ядра — электронная оболочка, состоящая из 1 электрона.
Какие свойства проявляет водород- металлические или неметаллические? В центре каждого атома положительное ядро, вокруг ядра — электронная оболочка, состоящая из 1 электрона. химик Жд.Льюис). Такую связь, образованную с помощью общей электронной пары или пар называется ковалентной.
химик Жд.Льюис). Такую связь, образованную с помощью общей электронной пары или пар называется ковалентной.  Сколько неспаренных элеетронов– затрудняются – (8 –номер группы),
Сколько неспаренных элеетронов– затрудняются – (8 –номер группы), Такая же связь в молекулах CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, Тогда в молекуле водорода –ковалентная неполярная. Такая же связь в молекулах O2, N2, Cl2, Br2, S8, P4
Такая же связь в молекулах CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, Тогда в молекуле водорода –ковалентная неполярная. Такая же связь в молекулах O2, N2, Cl2, Br2, S8, P4 

 Номер
общих электронов зависит от количества необходимых электронов
для завершения октета.
Номер
общих электронов зависит от количества необходимых электронов
для завершения октета.
 Это оставляет другой
атом с долей менее половины и делает электронное распределение
несимметричный.В среднем по времени электроны расходуют
больше времени с одним атомом приводит к тому, что он имеет частичный отрицательный заряд.
Другой атом, лишенный электронов, приобретает частичный положительный
обвинение.
Это оставляет другой
атом с долей менее половины и делает электронное распределение
несимметричный.В среднем по времени электроны расходуют
больше времени с одним атомом приводит к тому, что он имеет частичный отрицательный заряд.
Другой атом, лишенный электронов, приобретает частичный положительный
обвинение.