Органические вещества, их строение и функции.
Органические вещества живых систем
Органические соединения составляют в среднем 20—30% массы клетки живого организма. К ним относятся биологические полимеры — белки, нуклеиновые кислоты и углеводы, а также жиры и ряд небольших молекул — гормонов, пигментов, АТФ и многие другие.
В различные типы клеток входит неодинаковое количество органических соединений. В растительных клетках преобладают сложные углеводы — полисахариды, в животных — больше белков и жиров. Тем не менее, каждая из групп органических веществ в любом типе клеток выполняет сходные функции.
Аминокислоты, азотистые основания, липиды, углеводы и т. д. поступают в клетку вместе с пищей или образуются внутри ее из предшественников. Они служат исходными продуктами для синтеза ряда полимеров, необходимых клетке.
Белки, как правило, являются мощными высокоспецифическими ферментами и регулируют обмен веществ клетки.
Нуклеиновые кислоты служат хранителями наследственной информации. Кроме того, нуклеиновые кислоты контролируют образование соответствующих белков-ферментов в нужном количестве и в нужное время.
Липиды
Липиды — так называют жиры и жироподобные вещества (липоиды). Относящиеся сюда вещества характеризуются растворимостью в органических растворителях и нерастворимостью (относительной) в воде.
Различают растительные жиры, имеющие при комнатной температуре жидкую консистенцию, и животные — твердую.
Липиды входят в состав всех плазматических мембран. Они выполняют в клетке энергетическую роль, активно участвуют в процессах метаболизма и размножения клетки.
Углеводы
В состав углеводов входят углерод, водород и кислород. Различают следующие углеводы.
Моносахариды, или простые углеводы, которые в зависимости от содержания атомов углерода имеют названия триозы, пентозы, гексозы и т. д. Пентозы — рибоза и дезоксирибоза — входят в состав ДНК и РНК. Гексоза – глюкоза — служит основным источником энергии в клетке. Их эмпирическую формулу можно представить в виде Cn (h3O) n.Полисахариды — полимеры, мономерами которых служат моносахариды гексозы. Наиболее известными из дисахаридов (два мономера) являются сахароза и лактоза. Важнейшими полисахаридами являются крахмал и гликоген, служащие запасными веществами клеток растений и животных, а также целлюлоза — важнейший структурный компонент растительных клеток.
Растения обладают большим разнообразием углеводов, чем животные, так как способны синтезировать их на свету в процессе фотосинтеза. Важнейшие функции углеводов в клетке: энергетическая, структурная и запасающая.
Энергетическая роль состоит в том, что углеводы служат источником энергии в растительных и животных клетках; структурная — клеточная стенка у растений почти полностью состоит из полисахарида целлюлозы; запасающая — крахмал служит запасным продуктом растений. Он накапливается в процессе фотосинтеза в вегетационный период и у ряда растений откладывается в клубнях, луковицах и т. д. В животных клетках эту роль выполняет гликоген, откладывающийся преимущественно в печени.
Белки
Среди органических веществ клетки белки занимают первое место, как по количеству, так и по значению. У животных на них приходится около 50% сухой массы клетки. В организме человека встречается около 5 млн. типов белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения, белки построены всего из 20 различных аминокислот.
Более детально остановимся на свойствах белков. Важнейшие из них денатурация и ренатурация.
Денатурация — это утрата белковой молекулой своей структурной организации. Денатурация может быть вызвана изменением температуры, обезвоживанием, облучением рентгеновскими лучами и другими воздействиями. В начале разрушается самая слабая структура — четвертичная, затем — третичная, вторичная и при наиболее жестких условиях — первичная.
Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается и структура белка. Такой процесс называется ренатурацией. Это свойство белков полностью восстанавливать утраченную структуру широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например, антибиотиков, для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные вещества. У некоторых живых организмов обычная частичная обратная денатурация белков связана с их функциями (двигательной, сигнальной, каталитической и др.). Процесс разрушения первичной структуры белка всегда необратим
Конспект «Химический состав клетки» — УчительPRO
«Химический состав клетки»
Раздел ЕГЭ: 2.3. Химический состав клетки. Макро- и микроэлементы. Взаимосвязь строения и функций неорганических и органических веществ (белков, нуклеиновых кислот, углеводов, липидов, АТФ), входящих в состав клетки. Роль химических веществ в клетке и организме человека.
Химические элементы клетки образуют неорганические и органические вещества. Несмотря на то что в живых организмах преобладают неорганические вещества, именно органические вещества определяют уникальность их химического состава и феномена жизни в целом, поскольку они синтезируются преимущественно организмами в процессе жизнедеятельности и играют в реакциях важнейшую роль.
 Следует отметить, что содержание химических веществ в различных клетках и тканях может существенно различаться. Например, если в животных клетках среди органических соединений преобладают белки, то в клетках растений — углеводы.
Следует отметить, что содержание химических веществ в различных клетках и тканях может существенно различаться. Например, если в животных клетках среди органических соединений преобладают белки, то в клетках растений — углеводы.
Макро- и микроэлементы
В живых организмах встречается около 80 химических элементов, однако только для 27 из этих элементов установлены их функции в клетке и организме. Остальные элементы присутствуют в незначительных количествах, и, по-видимому, попадают в организм с пищей, водой и воздухом. В зависимости от концентрации их делят на макроэлементы и микроэлементы.
Концентрация каждого из макроэлементов в организме превышает 0,01 % , а их суммарное содержание — 99 %. К макроэлементам относят кислород, углерод, водород, азот, фосфор, серу, калий, кальций, натрий, хлор, магний и железо. Первые четыре из перечисленных элементов (кислород, углерод, водород и азот) называют также органогенными, поскольку они входят в состав основных органических соединений. Фосфор и сера также являются компонентами ряда органических веществ, например белков и нуклеиновых кислот. Фосфор необходим для формирования костей и зубов.
Без оставшихся макроэлементов невозможно нормальное функционирование организма.
Так, калий, натрий и хлор участвуют в процессах возбуждения клеток. Кальций входит в состав клеточных стенок растений, костей, зубов и раковин моллюсков, требуется для сокращения мышечных клеток и свертывания крови. Магний является компонентом хлорофилла — пигмента, обеспечивающего протекание фотосинтеза. Он также принимает участие в биосинтезе белка и нуклеиновых кислот. Железо входит в состав гемоглобина, и необходимо для функционирования многих ферментов.
Микроэлементы содержатся в организме в концентрациях менее 0,01 % , а их суммарная концентрация в клетке не достигает и 0,1 %. К микроэлементам относятся цинк, медь, марганец, кобальт, йод, фтор и др.
Цинк входит в состав молекулы гормона поджелудочной железы — инсулина, медь требуется для процессов фотосинтеза и дыхания. Кобальт является компонентом витамина В12, отсутствие которого приводит к анемии. Йод необходим для синтеза гормонов щитовидной железы, обеспечивающих нормальное протекание обмена веществ, а фтор связан с формированием эмали зубов.
Как недостаток, так и избыток или нарушение обмена макро- и микроэлементов приводят к развитию различных заболеваний.
В частности, недостаток кальция и фосфора вызывают рахит, нехватка азота — тяжелую белковую недостаточность, дефицит железа — анемию, отсутствие йода — нарушение образования гормонов щитовидной железы и снижение интенсивности обмена веществ, уменьшение поступления фтора — кариес. Свинец токсичен почти для всех организмов.
Недостаток макро- и микроэлементов можно компенсировать путем увеличения их содержания в пище и питьевой воде, а также за счет приема лекарственных препаратов.
Химические элементы клетки образуют различные соединения — неорганические и органические.
Неорганические вещества
К неорганическим веществам клетки относятся вода, минеральные соли, кислоты и др.
Вода (Н2О) — наиболее распространенное неорганическое вещество клетки, обладающее уникальными физико-химическими свойствами. В теле взрослого человека ее в среднем 66 %, однако кости содержат около 20 % воды, печени — 70 %, а мозг — 86 %.
В клетке вода является растворителем, средой для протекания реакций, исходным веществом и продуктом химических реакций, выполняет транспортную и терморегуляторную функции, придает клетке упругость, обеспечивает тургор растительной клетки. Все вещества делятся на растворимые в воде (гидрофильные) и нерастворимые в ней (гидрофобные).
Минеральные соли могут находиться в растворенном или нерастворенном состояниях. Растворимые соли диссоциируют на ионы — катионы и анионы. Наиболее важными катионами являются ионы калия и натрия, облегчающие перенос веществ через мембрану и участвующие в возникновении и проведении нервного импульса, а также ионы кальция, которые принимают участие в процессах сокращения мышечных волокон и свертывании крови; магния, входящего в состав хлорофилла; железа, входящего в состав ряда белков, в том числе гемоглобина. Важнейшими анионами являются фосфат-анион, входящий в состав АТФ и нуклеиновых кислот, и остаток угольной кислоты, смягчающий колебания рН среды. Ионы минеральных солей обеспечивают проникновение самой воды в клетку и ее удержание в ней. Если в среде концентрация солей ниже, чем в клетке, то вода проникает в клетку. Также ионы определяют буферные свойства цитоплазмы, т. е. ее способность поддерживать постоянство слабощелочной рН цитоплазмы, несмотря на постоянное образование в клетке кислотных и щелочных продуктов.
Нерастворимые соли (CaCO3, Ca3(PO4)2 и др.) входят в состав костей, зубов, раковин и панцирей одноклеточных и многоклеточных животных.
Кроме того, в организмах могут вырабатываться и другие неорганические соединения, например кислоты и оксиды. Так, обкладочные клетки желудка человека вырабатывают соляную кислоту, которая активирует пищеварительный фермент пепсин, а оксид кремния пропитывает клеточные стенки хвощей и образует панцири диатомовых водорослей.
Органические вещества
К органическим веществам клетки относят углеводы, липиды, белки, нуклеиновые кислоты, АТФ, витамины и др. они могут быть представлены как относительно простыми молекулами, так и более сложными. В тех случаях, когда сложная молекула (макромолекула) образована значительным числом повторяющихся более простых молекул, ее называют полимером, а ее структурные единицы — мономерами. В зависимости от того, повторяются или нет звенья полимеров, их относят к регулярным или нерегулярным.
Углеводы
Углеводы — это органические соединения, в состав которых входят в основном три химических элемента — углерод, водород и кислород, хотя целый ряд углеводов содержит также азот или серу.
Общая формула углеводов — Cm(H2O)n. Их делят на моно-, олиго- и полисахариды.
1) Моносахариды содержат единственную молекулу сахара, которую невозможно расщепить на более простые. Это кристаллические вещества, сладкие на вкус и хорошо растворимые в воде. Моносахариды принимают активное участие в обмене веществ в клетке и входят в состав сложных углеводов — олигосахаридов и полисахаридов.
Моносахариды классифицируют по количеству углеродных атомов (C3 — C9), например пентозы (C5) и гексозы (C6). К пентозам относятся рибоза и дезоксирибоза. Рибоза входит в состав РНК и АТФ. Дезоксирибоза является компонентом ДНК. Гексозы (С6Н12О6) — это глюкоза, фруктоза, галактоза и др. Глюкоза (виноградный сахар) встречается во всех организмах, в том числе в крови человека, поскольку является энергетическим резервом. Она входит в состав сахарозы, лактозы, мальтозы, крахмала, целлюлозы и др. Фруктоза (плодовый сахар) в наибольших концентрациях содержится в плодах, меде, корнеплодах сахарной свеклы. Она не только принимает активное участие в процессах обмена веществ, но и входит в состав сахарозы и некоторых полисахаридов, например инсулина.
2) К олигосахаридам относят углеводы, образованные несколькими остатками моносахаридов. Они в основном также хорошо растворимы в воде и сладки на вкус. В зависимости от количества этих остатков различают дисахариды (два остатка), трисахариды (три) и др.
К дисахаридам относятся сахароза, лактоза, мальтоза и др. Сахароза (свекловичный или тростниковый сахар) состоит из остатков глюкозы и фруктозы, она встречается в запасающих органах некоторых растений. Особенно много сахарозы в корнеплодах сахарной свеклы и сахарного тростника, откуда их получают промышленным способом. Она служит эталоном сладости углеводов. Лактоза (молочный сахар), образована остатками глюкозы и галактозы, содержится в материнском и коровьем молоке. Мальтоза (солодовый сахар) состоит из двух остатков глюкозы. Она образуется в процессе расщепления полисахаридов в семенах растений и в пищеварительной системе человека, используется при производстве пива.
3) Полисахариды — это биополимеры, мономерами которых являются остатки моно- или дисахаридов. Большинство полисахаридов нерастворимы в воде и несладкие на вкус. К ним относятся крахмал, гликоген, целлюлоза и хитин. Крахмал — это белое порошкообразное вещество, не смачиваемое водой, но образующее при заваривании горячей водой взвесь — клейстер. Мономером крахмала является глюкоза (рис. 3). Крахмал — основное запасное вещество растений, которое накапливается в запасающих органах растений. Качественной реакцией на крахмал является реакция с йодом, при которой он окрашивается в сине-фиолетовый цвет.
Гликоген (животный крахмал) — это запасной полисахарид животных и грибов, который у человека в наибольших количествах накапливается в мышцах и печени. Мономером гликогена является глюкоза. По сравнению с молекулами крахмала молекулы гликогена более разветвлены.
Целлюлоза, или клетчатка, — основной опорный полисахарид растений. Мономером целлюлозы является глюкоза. Целлюлоза входит в состав клеточных стенок растений. Целлюлоза является основой древесины, она используется в строительстве, при производстве тканей, бумаги, спирта и многих органических веществ.
Хитин — это полисахарид, мономером которого является азотсодержащий моносахарид на основе глюкозы. Он входит в состав клеточных стенок грибов и панцирей членистоногих.
Функции углеводов. Углеводы выполняют в клетке пластическую (строительную), энергетическую, запасающую и опорную функции. Энергетическая ценность расщепления 1 г углеводов составляет 17,2 кДж. Углеводы могут также входить в состав сложных липидов и белков, образуя гликолипиды и гликопротеины, в частности в клеточных мембранах.
Липиды
Липиды — это разнородная в химическом отношении группа низкомолекулярных веществ с гидрофобными свойствами. Данные вещества нерастворимы в воде, образуют в ней эмульсии, но при этом хорошо растворяются в органических растворителях. Липиды маслянисты на ощупь, многие из них оставляют на бумаге характерные невысыхающие следы.
В зависимости от строения молекулы липиды делят на простые и сложные. К простым липидам относятся нейтральные липиды (жиры), воски, стерины и стероиды. Сложные липиды содержат и другой, нелипидный компонент. Наиболее важными из них являются фосфолипиды и гликолипиды.
Жиры являются производными трехатомного спирта глицерина и высших жирных кислот. Среди жирных кислот есть как насыщенные, так и ненасыщенные, то есть содержащие двойные связи.
Из насыщенных жирных кислот чаще всего встречаются пальмитиновая и стеариновая, а из ненасыщенных — олеиновая. Некоторые ненасыщенные жирные кислоты не синтезируются в организме человека или синтезируются в недостаточном количестве, и поэтому являются незаменимыми. Остатки глицерина образуют гидрофильные «головки», а остатки жирных кислот — «хвосты». Жиры растений большей частью содержат ненасыщенные жирные кислоты, вследствие чего они являются жидкими и называются маслами. Масла содержатся в семенах многих растений, таких как подсолнечник, соя, рапс и др.
Воски — это сложные смеси жирных кислот и жирных спиртов. У растений они образуют пленку на поверхности листа, которая защищает от испарения, проникновения возбудителей заболеваний и т. п. У ряда животных они также покрывают тело или служат для построения сот.
К стеринам относятся такой липид, как витамин D, и холестерол — обязательный компонент клеточных мембран, а к стероидам — половые гормоны: эстрадиол, тестостерон и др.
Фосфолипиды, помимо остатков глицерина и жирных кислот, содержат остаток ортофосфорной кислоты. Они входят в состав клеточных мембран и обеспечивают их барьерные свойства.
Гликолипиды также являются компонентами мембран, но их содержание там невелико. Нелипидной частью гликолипидов являются углеводы.
Функции липидов. Липиды выполняют в клетке пластическую (строительную), энергетическую, запасающую, защитную и регуляторную функции. При расщеплении 1 г липидов выделяется 38,9 кДж энергии. Они откладываются в запас в различных органах растений и животных. Подкожная жировая клетчатка защищает внутренние органы животных от переохлаждения или перегревания, от ударов, а у водных животных — еще и повышает плавучесть. Регуляторная функция липидов связана с тем, что некоторые из них являются гормонами.
Белки
Белки — это высокомолекулярные соединения, биополимеры, мономерами которых являются аминокислоты, связанные пептидными связями. Аминокислотой называют органическое соединение, имеющее аминогруппу, карбоксильную группу и радикал. В состав белка могут входить 20 аминокислот, которые различаются радикалами. Аминокислоты делят на заменимые и незаменимые.
Заменимые аминокислоты, образуются в организме человека в необходимом количестве, а незаменимые должны поступать с пищей, но могут частично синтезироваться микроорганизмами кишечника. Полностью незаменимых аминокислот насчитывается 8: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин.
Последовательность из двух аминокислот, связанных пептидными связями, называется дипептидом, из трех — трипептидом и т. д. Среди пептидов встречаются такие важные соединения, как гормоны (окситоцин, вазопрессин), антибиотики и др. Цепочка из более чем двадцати аминокислот называется полипептидом, а полипептиды, содержащие более 60 аминокислотных остатков, — это белки.
Уровни структурной организации белка. Белки могут иметь первичную, вторичную, третичную и четвертичную структуры. Третичная структура характерна для большинства белков организма, например миоглобина мышц.
По форме молекулы различают фибриллярные и глобулярные белки. Первые из них вытянуты, как, например, коллаген соединительной ткани или кератины волос и ногтей. Глобулярные же белки имеют форму клубка (глобулы), как миоглобин мышц.
Простые и сложные белки. Простые белки состоят только из аминокислот, тогда как сложные белки (липопротеины, хромопротеины, гликопротеины, нуклеопротеины и др.) содержат белковую и небелковую части. Хромопротеины содержат окрашенную небелковую часть. К ним относятся гемоглобин, миоглобин, хлорофилл, цитохромы и др. Небелковой частью липопротеинов является липид, а гликопротеинов — углевод. Как липопротеины, так и гликопротеины входят в состав клеточных мембран. Нуклеопротеины представляют собой комплексы белков и нуклеиновых кислот (ДНК и РНК). Они выполняют важнейшие функции в процессах хранения и передачи наследственной информации.
Свойства белков. Многие белки хорошо растворимы в воде, однако есть среди них и такие, которые растворяются только в растворах солей, щелочей, кислот или органических растворителях. Структура молекулы белка и его функциональная активность зависят от условий окружающей среды. Утрата белковой молекулой своей структуры, вплоть до первичной, называется денатурацией. Она происходит вследствие изменения температуры, рН, атмосферного давления, под действием кислот, щелочей, солей тяжелых металлов, органических растворителей и т. п. Обратный процесс восстановления вторичной и более высоких структур называется ренатурацией, однако он не всегда возможен. Полное разрушение белковой молекулы называется деструкцией.
Функции белков. Белки выполняют в клетке ряд функций: пластическую (строительную), каталитическую (ферментативную), энергетическую, сигнальную (рецепторную), сократительную (двигательную), транспортную, защитную, регуляторную и запасающую.
Энергетическая ценность 1 г белка составляет 17,2 кДж. Белки-рецепторы мембран принимают активное участие в восприятии сигналов окружающей среды и их передаче по клетке. Без белков невозможно движение клеток и организмов в целом, так как они составляют основу жгутиков и ресничек, а также обеспечивают сокращение мышц и перемещение внутриклеточных компонентов. В крови человека и многих животных белок гемоглобин переносит кислород и часть углекислого газа, другие белки транспортируют ионы и электроны. Защитная роль белков связана, в первую очередь, с иммунитетом, поскольку белок интерферон способен уничтожать многие вирусы, а белки-антитела подавляют развитие бактерий и иных чужеродных агентов. Среди белков и пептидов немало гормонов, например, гормон поджелудочной железы инсулин, регулирующий концентрацию глюкозы в крови. У некоторых организмов белки могут откладываться в запас, как в семенах бобовых, или белки куриного яйца.
Нуклеиновые кислоты
Нуклеиновые кислоты — это биополимеры, мономерами которых являются нуклеотиды. В настоящее время известно два типа нуклеиновых кислот: рибонуклеиновая (РНК) и дезоксирибонуклеиновая (ДНК).
Нуклеотид образован азотистым основанием, остатком сахара-пентозы и остатком ортофосфорной кислоты. Особенности нуклеотидов в основном определяются азотистыми основаниями, входящими в их состав, поэтому даже условно нуклеотиды обозначаются по первым буквам их названий. В состав нуклеотидов могут входить пять азотистых оснований: аденин (А), гуанин (Г), тимин (Т), урацил (У) и цитозин (Ц). Пентозы нуклеотидов — рибоза и дезоксирибоза — определяют, какой нуклеотид будет образован — рибонуклеотид или дезоксирибонуклеотид. Рибонуклеотиды являются мономерами РНК, могут выступать в качестве сигнальных молекул (цАМФ) и входить в состав макроэргических соединений, например АТФ, и коферментов, таких как НАДФН + Н+, НАДН + Н+, ФАДН2 и др., а дезоксирибонуклеотиды входят в состав ДНК.
Дезоксирибонуклеиновая кислота (ДНК) — двухцепочечный биополимер, мономерами которого являются дезоксирибонуклеотиды. В состав дезоксирибонуклеотидов входят только четыре азотистых основания из пяти возможных — аде-нин (А), тимин (Т), гуанин (Г) и цитозин (Ц), а также остатки дезоксирибозы и ортофосфорной кислоты. Нуклеотиды в цепи ДНК соединяются между собой через остатки ортофосфорной кислоты, образуя фосфодиэфирную связь. При образовании двухцепочечной молекулы азотистые основания направлены вовнутрь молекулы. Однако соединение цепей ДНК происходит не случайным образом — азотистые основания разных цепей соединяются между собой водородными связями по принципу комплементарности: аденин соединяется с тимином двумя водородными связями (А=Т), а гуанин с цитозином — тремя (Г^Ц) (рис. 14). Для нее были установлены правила Чаргаффа.
Структура ДНК была расшифрована Ф. Криком и Д. Уотсоном. Согласно их модели третичная структура молекулы ДНК представляет собой правозакрученную двойную спираль. Расстояние между нуклеотидами в цепи ДНК равно 0,34 нм.
Основной функцией ДНК является хранение и передача наследственной информации, которая записана в виде последовательностей нуклеотидов.
ДНК эукариотических клеток сосредоточена в ядре, митохондриях и пластидах, а прокариотических — находится прямо в цитоплазме. Ядерная ДНК является основой хромосом, она представлена незамкнутыми молекулами. ДНК митохондрий, пластид и прокариот имеет кольцевую форму.
Рибонуклеиновая кислота (РНК) — биополимер, мономерами которого являются рибонуклеотиды. Они содержат также четыре азотистых основания — аденин (А), урацил (У), гуанин (Г) и цитозин (Ц), отличаясь тем самым от ДНК по одному из оснований (вместо тимина в РНК встречается урацил). Остаток сахара-пентозы в рибонуклеотидах представлен рибозой. РНК — в основном одноцепочечные молекулы, за исключением некоторых вирусных. Выделяют три основных типа РНК: информационные, или матричные (иРНК, мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все они образуются в процессе транскрипции — переписывания с молекул ДНК.
иРНК составляют наименьшую фракцию РНК в клетке (2—4 %). Они являются матрицами для синтеза полипептидных цепей. Информация о структуре белка записана в них в виде последовательностей нуклеотидов, причем каждую аминокислоту кодирует триплет нуклеотидов — кодон.
рРНК представляют собой наиболее многочисленный тип РНК в клетке (до 80 °%). Они образуются в ядрышках и входят в состав клеточных органоидов — рибосом.
тРНК — наименьшие из молекул РНК, так как содержат всего 73—85 нуклеотидов. Их доля от общего количества РНК клетки составляет около 16 °%. Функция тРНК — транспорт аминокислот к месту синтеза белка (на рибосомы). Вторичная структура молекулы тРНК напоминает листок клевера. На одном из концов молекулы находится участок для прикрепления аминокислоты, а в одной из петель — триплет нуклеотидов, комплементарный кодону иРНК и определяющий, какую именно аминокислоту будет переносить тРНК — антикодон (рис. 16).
Все типы РНК принимают активное участие в процессе реализации наследственной информации, которая с ДНК переписывается на иРНК, а на последней осуществляется синтез белка. тРНК в процессе синтеза белка доставляет аминокислоты к рибосомам, а рРНК входит в состав непосредственно рибосом.
Аденозинтрифосфорная кислота (АТФ) — это нуклеотид, содержащий, помимо азотистого основания аденина и остатка рибозы, три остатка фосфорной кислоты. Связи между остатками фосфорной кислоты — макроэргические (при расщеплении выделяется 42 кДж/ моль энергии, тогда как стандартная химическая связь при расщеплении дает 12 кДж/моль).
При необходимости макроэргическая связь АТФ расщепляется с образованием аденозиндифосфорной кислоты (АДФ), фосфорного остатка и выделением энергии:
АТФ + Н2О → АДФ + H3PO4 + 42 кДж.
АДФ также может расщепляться с образованием АМФ (аденозинмонофосфорной кислоты) и остатка фосфорной кислоты:
АДФ + Н2О → АМФ + H3PO4 + 42 кДж.
В процессе энергетического обмена (при дыхании, брожении), а также в процессе фотосинтеза АДФ присоединяет фосфорный остаток и превращается в АТФ. Реакция восстановления АТФ называется фосфорилированием. АТФ является универсальным источником энергии для всех процессов жизнедеятельности живых организмов.
Это конспект по теме «Химический состав клетки». Выберите дальнейшие действия:
Органические вещества клетки
Существует 4 класса органических веществ, входящих в состав клеток: белки, жиры, углеводы и нуклеиновые кислоты.
Биополимеры
Биологические полимеры – высокомолекулярные органические соединения, молекулы которых состоят из большого числа повторяющихся звеньев – мономеров. К биополимерам относятся белки (состоят из аминокислот), нуклеиновые кислоты (состоят из нуклеотидов), полисахариды и их производные (состоят из моносахаридов).
По форме биополимеров могут быть линейными (белки, нуклеиновые кислоты, целлюлоза) или ветвящимися (гликоген, крахмал).
Свойства биополимеров 1. Кооперативность
Тесная взаимосвязь всех функциональных групп, то есть взаимодействие одних групп полимера изменяет характер взаимодействия других его групп. Например, связывание кислорода белком эритроцитов крови – гемоглобином.
2. Способность образовывать интерполимерные комплексы
Такие комплексы могут возникать как между отдельными частями молекулы, так и между разными молекулами. Благодаря образованию комплексов осуществляются биосинтез белков, нуклеиновых кислот, регуляция обмена веществ и другие биологические процессы.
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Углеводы
Углеводы — органические вещества, в состав которых входят углерод, кислород и водород. Образуются в процессе фотосинтеза из воды и углекислого газа. Различают — моносахариды (состоят из одной молекулы) (глюкоза, рибоза и т.д.), дисахариды — соединение двух молекул (сахароза, мальтоза) и полисахариды — в их состав входит много молекул сахара (крахмал, гликоген, клетчатка, пектин, инулин, хитин).
Функции углеводов
1. Входят в состав многих органических веществ (рибоза — в состав РНК, АТФ, ФАД, НАД, НАДФ, дезоксирибоза — в состав ДНК)
2. Глюкоза — является источником энергии (окисляется при дыхании)
3. Многие углеводы являются запасными веществами — крахмал у растений, гликоген — у грибов и животных
4. Входят в состав многих компонентов клеток и тканей (гликокаликс, гепарин, кликопротеины, пектины, полисахариды, гемицеллюлоза, хитин, муреин, тейхоевые кислоты)
5. Защитная — в составе гликокаликса участвует в процессе клеточного распознавания, входят в состав иммуноглобулинов, входят в состав камеди (выделяется при повреждении стволов) и в состав клеточной стенки многих организмов
Белки
Белки — это органические вещества-полимеры, мономерами которых являются аминокислоты (гемоглобин, альбумин, коллаген, эластин и многие другие).
Белки имеют 4 структуры
Первичная — линейная последовательность аминокислот, соединенная в полипептиднуй цепь
Вторичная — спираль, состоящая из двух цепей, соединенных водородными связями
Третичная — глобула или фибриллярная структура (уложенные слои или суперскрученная спираль). Ионные, водородные, ковалентные (дисульфидные мостики), гидрофобные взаимодействия между составными частями
Четвертичная — несколько глобул или микрофибриллы, соединенные силами межмолекулярного притяжения
Бывают: собственно белки и ферменты.
Ферменты — биологические катализаторы, не только ускоряют, но и осуществляют большиснтво реакций в живых организмах.
Ферменты – это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при умеренной температуре, нормальном давлении и нейтральной среде. В таких условиях реакции синтеза или распада веществ протекали бы очень медленно, если бы не подвергались воздействию ферментов. Ферменты ускоряют реакцию без изменения ее общего результата за счет снижения энергии активации. Это означает, что в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулами, которые вступают в реакцию. Ферменты отличаются от химических катализаторов высокой степенью специфичности, то есть фермент катализирует только одну реакцию или действует только на один тип связи. Скорость ферментативных реакций зависит от многих факторов – природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т.д.
Классификация ферментов 1. Оксидоредуктазы
Окислительно-восстановительные реакции: перенос атомов водорода (Н) и кислорода (О) или электронов от одного вещества к другому, при этом окисляется первый и восстанавливается второй. Участвуют во всех процессах биологического окисления.
2. Трансферазы
Перенос группы атомов (метильной, ацильной, фосфатной или аминогруппы) от одного вещества к другому. Например, перенос остатков фосфорной кислоты от АТФ на глюкозу или фруктозу под действием фототрансфераз.
3. Гидролазы
Реакции расщепления сложных органических соединений на более простые путем присоединения молекул воды в месте разрыва химической связи (гидролиз). Например, амилаза (гидролизует крахмал), липаза (расщепляет жиры), трипсин (расщепляет белки) и др.
4. Лиазы
Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, C-O, C-S. Например, декарбоксилаза отщепляет карбоксильную группу.
5. Изомеразы
Внутримолекулярные перестройки, превращение одного изомера в другой (изомеризация).
6. Лигазы (синтетазы)
Реакции соединения двух молекул с образованием новых связей с использованием энергии АТФ. Например, фермент валин-т-РНК-синтеза, под действием которого образуется комплекс валин-т-РНК.
На рисунке представлен механизм действия фермента. В молекуле каждого фермента имеется активный центр – это один или более участков, в которых происходит катализ за счет тесного контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа), или отдельная аминокислота. Активный центр может формироваться связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы – коферментами или кофакторами. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (комплементарности) друг другу.
Молекула фермента изменяет глобулярную форму молекулы субстрата. Молекула субстрата, присоединяясь к ферменту, тоже в определенных пределах изменяет свою конфигурацию для увеличения реакционности функциональных групп центра.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Функции белков
1. Ферментативная — ускоряют, а в большинстве случаев осуществляют биохимические реакции в организме
2. Структурная — входят в состав всех мембран, являются компонентом соединительной ткани (костей, хрящей, сухожилий, кожи, волос, ногтей), входят в состав слизистых секретов (мукопротеины). Из белков состоят капсиды вирусов. Входят в состав каружного скелета насекомых.
3. Двигательная — из белков состоят микротрубочки (тубулин), двигательный аппарат жгутиков, актин и миозин — сократительные белки мышц.
4. Транспортная — транспорт через мембрану и внутри клетки, а также белки крови (гемоглобин переносит кислород, гемоцианин переносит кислород в крови беспозвоночных, сывороточный альбумин переносит жирные кислоты, глобулины переносят ионы металлов и гормоны)
5. Защитная — белки иммунитета (интерфероны), белки крови (предотвращают кровопотерю), антиоксиданты (гасят активные формы кислорода)
6. Рецепторная — белки гликокаликса (отвечают за клеточную совместимость), светочувствительные ферменты сетчатки глаза, фитохром у растений (реагирует на изменение длины светового дня)
7. Запасающая — белок-ферритин запасает железо в печени, селезенке, миоглобин запасает кислород в мышцах позвоночных
8. Питательная — белки — источники аминокислот
9. Регуляторная — многие гормоны являются белками (инсулин, соматотропин, пролактин, глюкагон)
10. Антибиотическая — многие антибиотики (противомикробные препараты) являются белками (грамицидин S, актиномицин)
11. Токсическая — многие токсины (опасные для живых организмов вещества) являются белками — ботулинический токсин, столбнячный, холерный, токсины грибов и пчел
Нуклеиновые кислоты: ДНК и РНК
В 1953 г. английские ученые Дж. Уотсон и Ф. Крик предложили модель пространственной струк- туры ДНК. Они показали, что ДНК состоит из двух полинуклеотидных цепей, спирально закрученных одна вокруг другой. Двойная спираль стабилизирована водородными свя- зями между азотистыми основаниями разных цепей так, что против аденина одной цепи всегда стоит ти- мин другой, а гуанина — цитозин. Многократное повторение этих связей придает большую устойчивость двойной спирали ДНК. При опреде- ленных условиях (действие кислот, щелочей, нагревание и т. п.) происходит денатурация ДНК — разрыв водородных связей между компле- ментарными азотистыми основани- ями. Денатурированная ДНК может восстановить двуспиральное строение благодаря установлению водородных связей между комплементарными нуклеотидами — этот процесс называется ренатурацией.
Строение ДНК:
ДНК составляют 4 типа азотистых оснований : А (аденин), Т (тимин), Г (гуанин) и Ц (цитозин).
Нуклеотиды соединяются по принципу комплементарности: А=Т, ГΞЦ
Функции ДНК:
1. Хранение генетической информации
2. Репликация ДНК
3. Синтез РНК
Строение РНК:
РНК бывает:
1. Рибосомальной (входит в состав рибосом)
2. Транспортной (приносит аминокислоты к рибосомам во время синтеза белка)
3. Информационной (передает информацию о первичной структуре белка на рибосомы)
Принцип комплементарности – избирательное соединение нуклеотидов; свойство, которое лежит в основе образования новых молекул ДНК на базе исходной. Против аденина одной цепи всегда располагается тимин другой цепи, против гуанина – цитозин и наоборот. Таким образом, пары нуклеотидов аденин и тимин, а также гуанин и цитозин строго соответствуют друг другу и являются дополнительными (пространственное взаимное соответствие), или комплементарными.
Образование полимера РНК происходит так же, как и у ДНК. Молекула РНК синтезируется на одной из цепочек ДНК-матрицы по принципу комплементарности. Например, против Г молекулы ДНК становится Ц молекулы РНК, против Ц молекулы ДНК – Г молекулы РНК, против Т молекулы ДНК – А молекулы РНК, а против А молекулы ДНК – У молекулы РНК (вместо тимина РНК несет урацил).
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Правило Чаргаффа: у всякого организма число адениловых нуклеотидов равно числу тимидиловых, а число гауниловых – числу цитидиловых.
Первое правило: А/Т = Г/Ц = 1.
Второе правило: А + Г = Ц + Т.
Третье правило: А + Ц = Г + Т.
Чаргафф не смог полностью объяснить свои правила, основанные на результатах тщательной аналитической работы с различными образцами ДНК. Однако уже в 1953 г. Это сделали молодые ученые Д. Уотсон и Ф. Крик. Они создали структурную модель молекулы ДНК.
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Липиды
Липиды — жироподобные органические вещества, нерастворимые в воде, но растворимые в неполярных органических растворителях (бензоле, бензине и т.д.).
Состоят из глицерина и жирных кислот, при этом глицериновые головки являются гидрофильными, а углеводородные хвосты — гидрофобными. Таким образом, образуется в мембране билипидный слой, через который диффундирует вода и другие вещества.
Строение липидов:
Функции липидов:
1. Энергетическая — при окислении липидов выделяется много энергии
2. Резервная — жиры являются запасным веществом и в ходе окисления жиров выделяется вода, которая очень важны, например, для жителей пустыни
3. Структурная — из фосфолипидов состоят мембраны всех живых организмов, гликолипиды участвуют в межклеточных контактах в тканях животных, сфинголипиды обеспечивают электрическую изоляцию аксона, создавая условия для быстрого прохождения импульса, пчелы из воска строят соты
4. Защитная — термоизоляция и амортизация, воски являются водоотталкивающими веществами у растений, гликолипиды участвуют в распознавании токсинов
5. Регуляторная — некоторые гормоны — липиды (тестостерон, прогестерон, кортизон), существуют жирорастворимые витамины (A, D, E, K), гибберелины — регуляторы роста растений
Разнообразие липидов
Фосфолипиды — содержат остаток фосфорной кислоты, входят в состав клеточных мембран.
Гликолипиды — соединения липидов с углеводами. Являются составной частью тканей мозга и нервных волокон.
Липопротеиды — комплексные соединения разнообразных белков с жирами.
Стероиды — важные компоненты половых гормонов, витамина Д.
Воска — выполняют защитную функцию: у млекопитающих — смазывают кожу и волосы, у птиц — придают перьям водоотталкивающие свойства, у растений — предотвращают чрезмерное испарение воды.
АТФ
Аденозинтрифосфорная кислота (АТФ) — нуклеотид, в состав которого входит азотистое основание аденин, углевод рибоза и три остатка фосфорной кислоты. Молекула АТФ является универсальным химическим аккумулятором энергии в клетках. Остатки фосфорной кислоты связаны макроэргичными связями. Когда от АТФ отщепляется один остаток фосфорной кислоты, образуется АДФ — аденозиндифосфорная кислота и выделяется 40 кДж энергии
2.3.2. Органические вещества клетки. Углеводы, липиды.
Органические вещества
Общая характеристика органических веществ клетки
Органические вещества клетки могут быть представлены как относительно простыми молекулами, так и более сложными. В тех случаях, когда сложная молекула (макромолекула) образована значительным числом повторяющихся более простых молекул, ее называют полимером,
а структурные единицы — мономерами. В зависимости от того, повторяются или нет звенья полимеров, их относят к регулярным или нерегулярным (рис. 2.6). Полимеры составляют до 90% массы сухого вещества клетки. Они относятся к трем основным классам органических соединений — углеводам (полисахариды), белкам и нуклеиновым кислотам. Регулярными полимерами являются полисахариды, а белки и нуклеиновые кислоты — нерегулярными. В белках и нуклеиновых кислотах последовательность мономеров крайне важна, так как они выполняют информационную функцию.
Углеводы
Углеводы — это органические соединения, в состав которых входят в основном три химических элемента — углерод, водород и кислород, хотя целый ряд углеводов содержит также азот или серу. Общая формула углеводов — Сm(Н20)n. Их делят на простые и сложные углеводы.
Простые углеводы (моносахариды) содержат единственную молекулу сахара, которую невозможно расщепить на более простые. Это кристаллические вещества, сладкие на вкус и хорошо растворимые в воде. Моносахариды принимают активное участие в обмене веществ в клетке и входят в состав сложных углеводов — олигосахаридов и полисахаридов.
Моносахариды классифицируют по количеству углеродных атомов (С3-С9), например, пентозы (С5) и гексозы (С6). К пентозам относятся рибоза и дезоксирибоза. Рибоза входит в состав РНК и АТФ. Дезоксирибоза является компонентом ДНК. Гексозы (С6Н1206) — это глюкоза, фруктоза, галактоза и др.
Глюкоза (виноградный сахар) (рис. 2.7) встречается во всех организмах, в том числе в крови человека, поскольку является энергетическим резервом. Она входит в состав многих сложных Сахаров: сахарозы, лактозы, мальтозы, крахмала, целлюлозы и др.
Фруктоза (плодовый сахар) в наибольших концентрациях содержится в плодах, меде, корнеплодах сахарной свеклы. Она не только принимает активное участие в процессах обмена веществ, но и входит в состав сахарозы и некоторых полисахаридов, например инсулина.
Большинство моносахаридов способно давать реакцию «серебряного зеркала» и восстанавливать медь при добавлении фелинговой жидкости (смесь растворов сульфата меди (II) и калий-натрий виннокислого) и кипячении.

К олигосахаридам относят углеводы, образованные несколькими остатками моносахаридов. Они в основном также хорошо растворимы в воде и сладки на вкус. В зависимости от количества этих остатков различают дисахариды (два остатка),

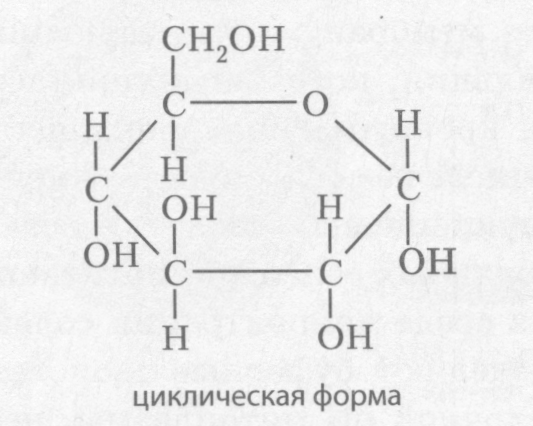
Рис. 2.7. Строение молекулы глюкозы
трисахариды (три) и др. К дисахаридам относятся сахароза, лактоза, мальтоза и др.
Сахароза (свекловичный или тростниковый сахар) состоит из остатков глюкозы и фруктозы (рис. 2.8), она встречается в запасающих органах некоторых растений. Особенно много сахарозы в корнеплодах сахарной свеклы и сахарного тростника, откуда их получают промышленным способом. Она служит эталоном сладости углеводов.
Лактоза, или молочный сахар, образована остатками глюкозы и галактозы, содержится в материнском и коровьем молоке.
Мальтоза (солодовый сахар) состоит из двух остатков глюкозы. Она образуется в процессе расщепления полисахаридов в семенах растений и в пищеварительной системе человека, используется при производстве пива.

Полисахариды — это биополимеры, мономерами которых являются остатки моно- или ди- сахаридов. Большинство полисахаридов нерастворимы в воде и несладкие на вкус. К ним относятся крахмал, гликоген, целлюлоза и хитин.
Крахмал — это белое порошкообразное вещество, не смачиваемое водой, но образующее при заваривании горячей водой взвесь — клейстер. В действительности крахмал состоит из двух полимеров — менее разветвленной амилозы и более разветвленного амилопектина (рис. 2.9). Мономером как амилозы, так и амилопектина является глюкоза. Крахмал — основное запасное вещество растений, которое в огромных количествах накапливается в семенах, плодах, клубнях, корневищах и других запасающих органах растений. Качественной реакцией на крахмал является реакция с йодом, при которой крахмал окрашивается в сине-фиолетовый цвет.
Гликоген (животный крахмал) — это запасной полисахарид животных и грибов, который у человека в наибольших количествах накапливается в мышцах и печени. Он также нерастворим в воде и несладок на вкус. Мономером гликогена является глюкоза. По сравнению с молекулами крахмала, молекулы гликогена еще более разветвлены.
Целлюлоза, или клетчатка, — основной опорный полисахарид растений. Мономером целлюлозы является глюкоза (рис. 2.10). Неразветвленные молекулы целлюлозы образуют пучки, которые входят в состав клеточных стенок растений и некоторых грибов. Целлюлоза является основой древесины, она используется в строительстве, при производстве тканей, бумаги, спирта и многих органических веществ. Целлюлоза химически инертна и не растворяется ни в кислотах, ни в щелочах. Она также не расщепляется ферментами пищеварительной системы человека, однако ее перевариванию способствуют бактерии толстого кишечника. Кроме того, клетчатка стимулирует сокращения стенок желудочно-кишечного тракта, способствуя улучшению его работы.

Хитин — это полисахарид, мономером которого является азотсодержащий моносахарид. Он входит в состав клеточных стенок грибов и панцирей членистоногих. В пищеварительной системе человека также отсутствует фермент переваривания хитина, его имеют лишь некоторые бактерии.
Функции углеводов. Углеводы выполняют в клетке пластическую (строительную), энергетическую, запасающую и опорную функции. Они образуют клеточные стенки растений и грибов. Энергетическая ценность расщепления 1 г углеводов составляет 17,2 кДж. Глюкоза, фруктоза, сахароза, крахмал и гликоген являются запасными веществами. Углеводы могут также входить в состав сложных липидов и белков, образуя гликолипиды и гликопротеины, в частности в клеточных мембранах. Не менее важной представляется роль углеводов в межклеточном узнавании и восприятии сигналов внешней среды, поскольку они в составе гликопротеинов выполняют функции рецепторов.
Липиды — это разнородная в химическом отношении группа низкомолекулярных веществ с гидрофобными свойствами. Данные вещества нерастворимы в воде, образуют в ней эмульсии, но при этом хорошо растворяются в органических растворителях. Липиды маслянисты на ощупь, многие из них оставляют на бумаге характерные невысыхающие следы. Вместе с белками и углеводами они являются одними из основных компонентов клеток. Содержание липидов в различных клетках неодинаково, особенно много их в семенах и плодах некоторых растений, в печени, сердце, крови.
В зависимости от строения молекулы липиды делят на простые и сложные. К простым липидам относятся нейтральные липиды (жиры), воски, стерины и стероиды. Сложные липиды содержат и другой, нелипидный компонент. Наиболее важными из них являются фосфолипиды, гликолипиды и др.
Жиры являются производными трехатомного спирта глицерина и высших жирных кислот (рис. 2.11). Большинство жирных кислот содержит 14-22 углеродных атома. Среди них есть как насыщенные, так и ненасыщенные, то есть содержащие двойные связи. Из насыщенных жирных кислот чаще всего встречаются пальмитиновая и стеариновая, а из ненасыщенных — олеиновая. Некоторые ненасыщенные жирные кислоты не синтезируются в организме человека или синтезируются в недостаточном количестве, и поэтому являются незаменимыми. Остатки глицерина образуют гидрофильные «головки», а остатки жирных кислот — «хвосты».
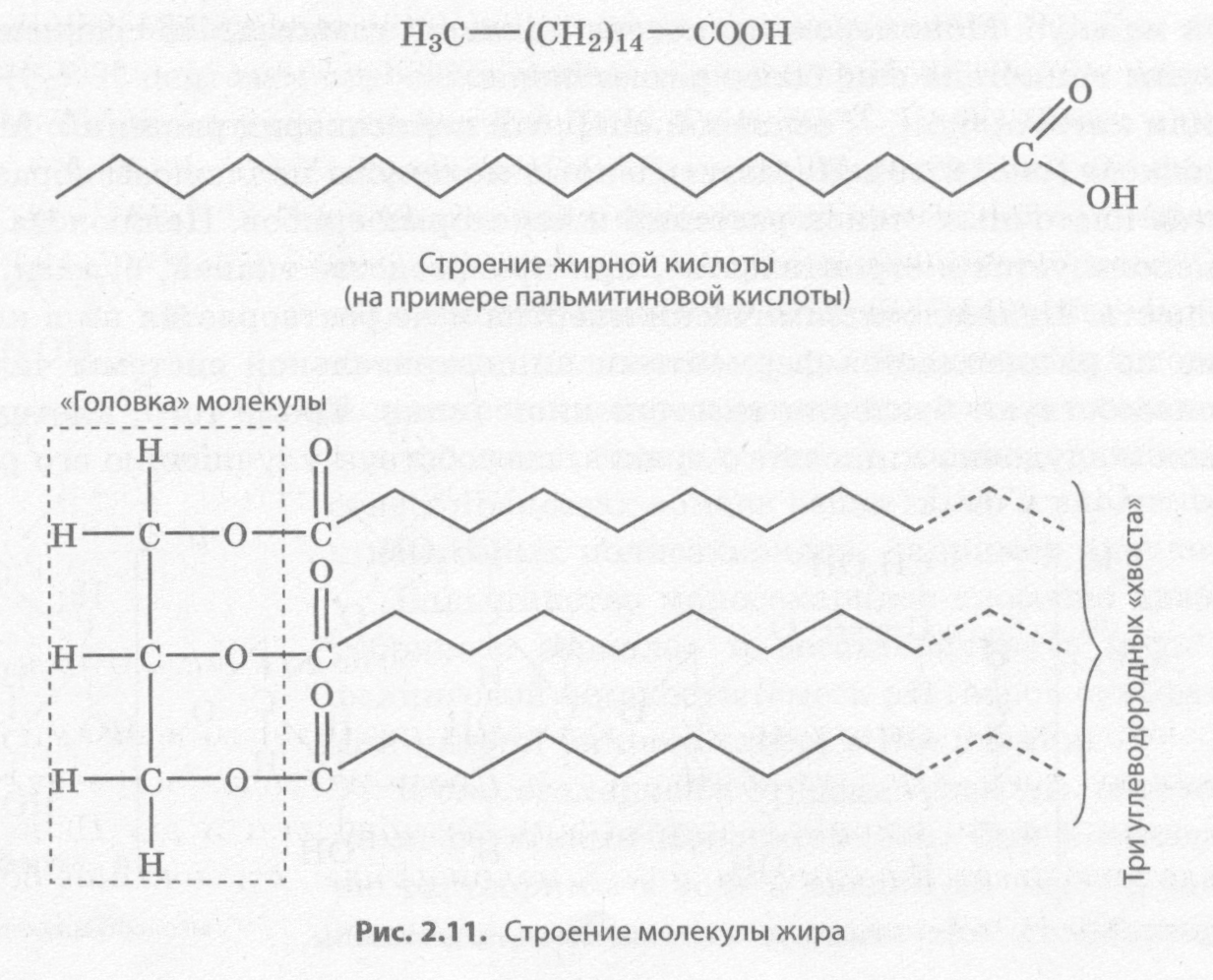
Жиры выполняют в клетках в основном запасающую функцию и служат источником энергии. Ими богата подкожная жировая клетчатка, выполняющая амортизационную и термоизоляционную функции, а у водных животных — еще и повышающая плавучесть. Жиры растений большей частью содержат ненасыщенные жирные кислоты, вследствие чего они являются жидкими и называются маслами. Масла содержатся в семенах многих растений, таких как подсолнечник, соя, рапс и др.
Воски — это сложные смеси жирных кислот и жирных спиртов. У растений они образуют пленку на поверхности листа, которая защищает от испарения, проникновения патогенов и т. п. У ряда животных они покрывают тело или служат для построения сот.
К стеринам относится такой липид, как холестерол — обязательный компонент клеточных мембран, а к стероидам — половые гормоны эстрадиол, тестостерон и др.
Фосфолипиды, помимо остатков глицерина и жирных кислот, содержат остаток ортофосфор- ной кислоты. Они входят в состав клеточных мембран и обеспечивают их барьерные свойства.
Гликолипиды также являются компонентами мембран, но их содержание там невелико. Не- липидной частью гликолипидов являются углеводы.
Функции липидов. Липиды выполняют в клетке пластическую (строительную), энергетическую, запасающую, защитную и регуляторную функции, кроме того, они являются растворителями для ряда витаминов. Это обязательный компонент клеточных мембран. При расщеплении 1 г липидов выделяется 38,9 кДж энергии. Они откладываются в запас в различных органах растений и животных. К тому же подкожная жировая клетчатка защищает внутренние органы от переохлаждения или перегревания, а также ударов. Регуляторная функция липидов связана с тем, что некоторые из них являются гормонами.
Урок на тему «Органические вещества клетки. Белки, их строение и функции»
Урок биологии в 10 классе
Тема урока «Белки, особенности их строения, структурной организации, свойства и биологические функции».
Образовательные задачи урока: создание условий для полного усвоения знаний учащихся о строении аминокислот и полипептидов, о пространственной структуре белков; сформировать понятия денатурация и ренатурация; научить характеризовать основные биологические функции белков.
Развивающие задачи урока: развитие навыков самостоятельной работы с информацией при её отборе и анализе; развитие учебно-интеллектуальных умений внимательно воспринимать информацию и запоминать её; совершенствование навыков работы на компьютере.
Воспитательные задачи урока: содействовать формированию научного мировоззрения; воспитывать чувство ответственности за результаты учебного труда.
Тип урока – урок изучения новых знаний.
Методический приём – учебная лекция-дискуссия.
Ход урока
- I. Организационно-мотивационный этап.
- Сегодня на уроке мы попробуем рассмотреть со всех сторон органические вещества белки, а также попытаемся связать воедино факты и сведения об этих удивительных веществах.
- «Открытия приходят лишь к тем, кто подготовлен к их пониманию» — говорил Луи Пастер. Надеюсь, что вы готовы познавать и действовать, активно мыслить и делать выводы.
Демонстрация слайда №1
- II. Постановка познавательной задачи.
Проблемный вопрос. С какими, на ваш взгляд, материальными объектами связаны свойства жизни?
— ответы учащихся
Уже довольно давно ученые поняли, что важную, а может быть, и главную роль во всех жизненных процессах играют белки.
Сформулируйте задачи сегодняшнего урока.
— ответы учащихся.
Демонстрация слайда № 2.
Изучение темы подчиним следующему плану.
Демонстрация слайда № 3.
- III. Решение познавательной задачи
Изложение теоретического материала по плану учебной лекции.
1.Белки – непериодические полимеры. Строение и свойства аминокислот.
Демонстрация слайда № 4
Схема строения аминокислоты |
По своей химической природе белки являются непериодическими полимерами. Мономерами белковых молекул являются аминокислоты. Вообще аминокислотой можно назвать любое соединение, содержащее одновременно аминогруппу (– NH2) и группировку органических кислот – карбоксильную группу (– СООН). Аминокислоты отличаются своими радикалами (R), в роли которых могут быть самые разные соединения. Это обусловливает большое разнообразие аминокислот.
В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления пищеварительными ферментами белков пищи или распада собственных запасных белков. В зависимости от аминокислотного состава белки бывают полноценными, содержащими весь набор аминокислот, и неполноценными, в составе которых отсутствуют какие-то аминокислоты.
Примеры формул аминокислот изображены на слайде № 5.
Демонстрация слайда № 5
Группа –NH2 имеет основные свойства, группа – СООН – кислотные свойства. Таким образом, аминокислоты – амфотерные соединения, совмещающие свойства кислоты и основания.
Амфотерными свойствами аминокислот обусловлена их способность взаимодействовать другс другом. Две аминокислоты соединяются за счет реакции конденсации в одну молекулу путем установления связи между углеродом кислотной и азотом основной групп с выделением молекулы воды.
Демонстрация слайда № 6.
Образование пептидной связи
Связь, изображенная на слайде, называется пептидной (от греч. пепсис – пищеварение). Этот термин напоминает нам о том, что эта связь гидролизуется пищеварительным ферментом желудочного сока пепсином. По природе пептидная связь является ковалентной.
Число возможных аминокислот очень велико, но белки образуют только 20 так называемых золотых, или стандартных, аминокислот (8 из них являются незаменимыми, т.к. не синтезируются в организмах животных и человека). Именно сочетание этих 20 аминокислот и дает все многообразие белков. После того как молекула белка собрана, некоторые аминокислотные остатки в ее составе могут подвергаться химическим изменениям, так что в «зрелых» белках можно обнаружить до 30 различных аминокислотных остатков (но строятся все белки исходно все равно только из 20!).
Демонстрация слайда № 7
Проблемный вопрос. В этом кроется источник бесконечного разнообразия белковых молекул, что является важной предпосылкой эволюционного процесса?
Пептиды различаются числом (n), природой, порядком или последовательностью своих аминокислотных остатков. Их можно сравнить со словами разной длины, в написании которых использован алфавит, состоящий из 20 букв. Из 20 аминокислот можно теоретически получить 1020 возможных вариантов цепей, длиной каждая не менее чем 10 аминокислотных остатков. Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислотных остатков.
2.Первичная, вторичная, третичная и четвертичная структуры белка.
Демонстрация слайда № 8.
Демонстрация слайда № 9.
Первичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи.
Она определяется генотипом, т.е. генами организма. В первичной структуре все связи между аминокислотными остатками являются ковалентными и, следовательно, прочными. Разные белки отличаются друг от друга по первичной структуре: кератин имеет одну последовательность аминокислот, пепсин – другую, соматотропин (гормон роста) – третью и т.д. В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером в 1944–1954 гг. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (из 21 и 30 аминокислотных остатков), удерживаемых друг около друга дисульфидными мостиками.
Однако молекула белка в виде цепи аминокислот, последовательно соединенных пептидными связями, еще не способна выполнять специфические функции. Для этого необходим более высокий уровень структурной организации, выражающийся в усложнении пространственного расположения мономеров.
Демонстрация слайда № 10.
Вторичная структура белка представлена спиралью, в которую закручивается полипептидная цепь. Группы N–H и С=О, входящие в пептидную связь, заметно поляризованы: азот обладает большей электроотрицательностью, чем водород, а кислород – большей, чем углерод.
Кислород группы С=О может образовывать водородные связи с водородом группы N–H (разумеется, расположенной в другой пептидной связи).
Одной из разновидностей вторичной структуры является —спираль, где каждый атом кислорода связан с атомом водорода четвертой по ходу спирали NH-группы.
— спираль
Любопытно, что эта сложная красивая структура сперва была предсказана известным биохимиком Л. Полингом теоретически и лишь потом обнаружена экспериментально.
Демонстрация слайда № 11.
Третичная структура белка представляет собой сложную трехмерную пространственную упаковку
-спиралей и -слоев. Эта трехмерная структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи несколько типов:
1) ионные, возникающие за счет электростатического взаимодействия между отрицательно и положительно заряженными боковыми группами;
2) гидрофобные («не любящие воду»), устанавливающиеся за счет стремления неполярных радикалов объединяться друг с другом, а не смешиваться с окружающей их водной средой;
3) дисульфидные, которые образуются между атомами серы SH-групп двух остатков аминокислоты цистеина. Эти S–S связи по своей природе являются ковалентными;
4) водородные, которые также возникают за счет взаимодействия между атомами радикалов.
Третичная структура белка не является конечной. Для некоторых белков, чаще всего регуляторных, характерна четвертичная структура, необходимая им для эффективного выполнения функции.
Демонстрация слайда № 12
Четвертичная структура представлена ассоциантом, состоящим из нескольких полипептидных цепей. Например, сложная молекула гемоглобина состоит из двух -субъединиц (141 аминокислотный остаток) и двух -субъединиц (146 аминокислотных остатков). Каждая субъединица связана с молекулой железосодержащего гема. В результате их объединения образуется функционирующая молекула гемоглобина. Только в такой упаковке гемоглобин работает полноценно, то есть способен переносить кислород. Четвертичная структура стабилизируется теми же связями, что и третичная.
Пространственная конфигурация белка, т.е. третичная и четвертичная структуры, называется конформацией. Конформация белка определяется его первичной структурой: белковая цепочка с определенной последовательностью аминокислот самопроизвольно укладывается с образованием природной пространственной конфигурации. Это получило название «самосборка белковой молекулы». Если полипептидную цепь взять за концы, растянуть ее и затем отпустить, то она всякий раз будет свертываться в одну и ту же структуру, характерную для этого вида полипептида.
Проблемный вопрос.Что произойдет, если изменить всего лишь одну аминокислоту в каком-либо полипептиде? (Мы получим молекулу с совершенно иной структурой, а значит и с иными свойствами).
3. Свойства белков.
Белки чрезвычайно разнообразны по своим физическим и химическим свойствам. Чем это обусловлено? (Ответы учащихся)
Приведем примеры разнообразия свойств белков.
1. Есть белки растворимые (например, фибриноген) и нерастворимые (например, фибрин) в воде.
2. Есть белки очень устойчивые (например, кератин) и неустойчивые (например, фермент каталаза с легко изменяющейся структурой).
3. У белков встречается разнообразная форма молекул – от нитей (миозин – белок мышечных волокон) до шариков (гемоглобин) и т.д.
Но всегда структура и свойства белка соответствуют выполняемой им функции.
Демонстрация слайда № 13.
В основе важнейшего свойства всех живых систем – раздражимости, лежит способность белков к обратимому изменению структуры в ответ на действие физических и химических факторов. Поскольку вторичная, третичная и четвертичная структуры белка создаются, в общем, более слабыми связями, чем первичная, то они оказываются менее стабильными. Например, при нагревании они легко разрушаются. При этом хотя у белка и сохраняется в целости первичная структура, он не может выполнять свои биологические функции, становится неактивным. Процесс разрушения природной конформации белка, сопровождающийся потерей активности, называется денатурацией. Разрыв части слабых связей, изменения конформации и свойств происходят и под действием физиологических факторов (например, под действием гормонов). Таким образом регулируются свойства белков – ферментов, рецепторов, транспортеров.
Эти изменения структуры обычно легко обратимы. Обратный денатурации процесс называется ренатурацией. Это свойство белков широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например, антибиотиков, вакцин, сывороток, ферментов; для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства.
Если восстановление пространственной конфигурации белка невозможно, то денатурация считается необратимой. Обычно это происходит при разрыве большого количества связей, например, при варке яиц.
3.Классификация белков по составу.
Демонстрация слайда №14.
Простые белки (протеины) – состоят только из аминокислот (альбумины, глобулины, гистоны, склеропротеины).
Сложные белки (протеиды) – состоят из глобулярных белков и небелкового материала.
Демонстрация слайда № 15.
Небелковую часть называют простетической группой (фосфопротеиды, гликопротеиды, нуклеопротеиды, хромопротеиды, липопротеиды, металлопротеиды, флавопротеиды).
4.Биологические функции белков.
Демонстрация слайда № 16.
Структурные – входят в различные структуры клетки и организма.
Демонстрация слайда№ 17.
Запасные – служат резервными веществами клетки и организма.
Демонстрация слайда№ 18.
Сигнальные – являются рецепторами.
Демонстрация слайда№ 1 9.
Токсины – являются ядами, используемыми живыми существами в целях защиты или нападения.
Демонстрация слайда№ 20.
Защитные – обеспечивают иммунные реакции организма.
Демонстрация слайда№ 21.
Транспортные – переносят различные вещества.
Демонстрация слайда№ 22.
Сократительные – участвуют в сокращении мышечных волокон.
Демонстрация слайда№ 23.
Ферменты – являются биологическими катализаторами.
Гормоны – являются регуляторами биологических функций.
IV. Закрепление материала.
1. Юный биохимик, определяя содержание азота в чистом препарате белка, получил величину 39,9%. Как вы можете прокомментировать этот результат?
2. Как по молекулярной массе определить число возможных аминокислот в белке? От чего зависит возможная погрешность этой оценки?
3. Сколько может существовать вариантов полипептидных цепей, включающих 20 аминокислот и состоящих из 50 аминокислотных остатков? Из 200 остатков?
4. Заполните пропуски в тексте: «В результате взаимодействия различных … и образования … связей спирализованная молекула белка образует … структуру, которая, в свою очередь, зависит от … структуры белка, то есть от … аминокислот в молекуле полипептида. Субъединицы некоторых белков образуют … структуру. Примером такого белка является …».
5. Ионы тяжелых металлов (ртути, свинца) и мышьяка, легко связываются с сульфидными группировками белков. Зная свойства сульфидов этих металлов, объясните, что произойдет с белком при соединении с этими металлами. Почему тяжелые металла являются ядами для организма?
6. Установлено, что при достаточной калорийности пищи, но при отсутствии в ней белка у животных наблюдаются патологические явления: останавливается рост, изменяется состав крови и т.д. С чем это связано?
7. Почему белки называют «носителями и организаторами жизни»?
8. Какие особенности строения белковой молекулы обеспечивают ей выполнение многих функций, например, транспортной, защитной, энергетической?
9. Заполните пропуски в тексте: «Защитные белки называются … Они связываются с …, попадающими в организм и называемыми … Среди тысяч разнообразных белков … узнают только один … и с ним реагируют. Такой механизм сопротивления возбудителям заболеваний называется …».
V. Домашнее задание.
Демонстрация слайда № 24
VI.Подведение итогов. Рефлексия.
Демонстрация слайда № 25.
Конспект -лекция.
БЕЛКИ – сложные органические соединения (полимеры), состоящие из мономеров аминокислот.
Аминокислоты в химическом отношении представляют собой производные органических кислот, в которых водород в α-положении (при углероде, ближайшем к СООН-группе) замещен на аминогруппу (-NH2):
Все известные аминокислоты различаются между собой только радикалами. В природных белках содержится 20 аминокислот.№ п/п | Аминокислоты | Сокращенное обозначение | Примечание |
1 | Аланин | Ала | |
2 | Аргинин | Арг | Основная аминокислота; для детей незаменимая |
3 | Аспарагин | Асн | R содержит амидогруппу |
4 | Аспарагиновая кислота | Асп | Кислая аминокислота |
5 | Цистеин | Цис | R cодержит серу |
6 | Глутамин | Глн | R содержит амидогруппу |
7 | Глутаминовая кислота | Глу | Кислая аминокислота |
8 | Глицин | Гли | |
9 | Гистидин | Гис | Основная аминокислота; для детей незаменимая |
10 | Изолейцин | Иле | Незаменимая аминокислота |
11 | Лейцин | Лей | Незаменимая аминокислота |
12 | Лизин | Лиз | Основная аминокислота; незаменимая |
13 | Метионин | Мет | Незаменимая аминокислота; R содержит серу |
14 | Фенилаланин | Фен | Незаменимая аминокислота; R содержит ароматическое кольцо |
15 | Пролин | Про | Иминокислота (=NH вместо -Nh3). |
16 | Серин | Сер | |
17 | Треонин | Тре | Незаменимая аминокислота |
18 | Триптофан | Три | R содержит ароматическое кольцо; незаменимая аминокислота |
19 | Тирозин | Тир | R содержит ароматическое кольцо |
20 | Валин | Вал | Незаменимая аминокислота |
Большинство аминокислот имеет одну кислотную (карбоксильную) группу и одну основную (аминогруппу), т. е. одновременно являются и кислотами, и основаниями (нейтральные аминокислоты). Существуют основные аминокислоты (имеют 2 и более аминогрупп) и кислые аминокислоты (имеют 2 и более карбоксильных групп).
При взаимодействии двух аминокислот возникает пептидная связь:
Образование дипептида
Огромное разнообразие белков определяется последовательностью расположения и количеством входящих в них аминокислотных остатков. Хотя четкого разграничения не существует, короткие цепи принято называть пептидами или олигопептидами, а под полипептидами (белками) понимают обычно цепи, состоящие из 50 и более аминокислот. Наиболее часто встречаются белки, включающие 100-400 аминокислотных остатков, но известны и такие, молекула которых образована 1000 и более остатками. Белки могут состоять из нескольких полипептидных цепей. В таких белках каждая полипептидная цепь носит название субъединицы.
Белки имеют четыре уровня организации.
Таблица «Уровни пространственной организации белков».
Структура | Морфологические особенности структуры | Связи и силы, участвующие в образовании структуры |
Первичная | Линейная последовательность аминокислот в полипептидной цепи | Ковалентные пептидные связи. |
Вторичная | 1. α- спираль 2. β-структура | 1. Водородные связи между остатками карбоксильной группы одной аминокислоты и остатком аминогруппы другой аминокислоты, удаленной от первой на 4 аминокислотных остатка; 2. водородные связи между остатками карбоксильных и аминогрупп одной цепи и остатками одноименных групп другой цепи. |
Третичная | 1. Глобула, образующаяся в результате компактной укладки α- спирали. 2. Фибрулла — β-структуры, уложенные параллельными слоями, либо суперспираль – несколько спиралей скрученных вместе (наподобие каната). | 1. ионные, водородные, ковалентные (дисульфидные мостики –S-S-), гидрофобные взаимодействия; 2. между β-структурами – в основном водородные. В суперспиралях – водородные и ковалентные (дисульфидные мостики). |
Четвертичная | Агрегат из нескольких глобул или фибрулл. | В основном силы межмолекулярного взаимодействия (в меньшей степени – водородные и ионные). |
Сравнительно слабые связи, ответственные за стабилизацию вторичной, третичной и четвертичной структур белка, легко разрушаются, что сопровождается потерей его биологической активности. Разрушение исходной (нативной) структуры белка, называемое денатурацией, происходит в присутствии кислот и оснований, при нагревании, изменении ионной силы и других воздействиях. Как правило, денатурированные белки плохо или совсем не растворяются в воде. Денатурация может быть обратимая, при условии сохранения первичной структуры белка. Необратимая денатурация сопровождается разрушением первичной структуры, т. е. разрушаются пептидные связи.
При непродолжительном действии и быстром устранении денатурирующих факторов возможна ренатурация белка с полным или частичным восстановлением исходной структурыи биологических свойств.
СОСТАВ БЕЛКОВ.
І. Простые белки – состоят только из аминокислот (альбумины, глобулины, гистоны и др.)
ІІ. Сложные белки – состоят из глобулярных белков и небелкового материала (простетической группы).
Таблица 7 «Сложные белки».
№ п/п | Название сложных белков | Простетическая группа | Примеры |
1. 2. 3. 4. 5. | Фосфопротеиды Гликопротеиды Нуклеопротеиды Хромопротеиды Липопротеиды | Фосфорная кислота Углевод Нуклеиновая кислота Пигмент Липид | Казеин молока Гепарин, тиреотропин Белки хроматина ядра Гемоглобин, цитохром, фитохром Белки компоненты клеточных мембран |
ФУНКЦИИ БЕЛКОВ.
1. Структурная: коллаген – компонент соединительной ткани, склеротин – входит в состав наружного скелета насекомых.
2. Запасающая:яичный альбумин — белок яйца, казеин – белок молока.
3. Ферментативная: трипсин – катализирует гидролиз белков, рибулозодифосфаткарбоксилаза – катализирует карбоксилирование (присоединение СО2) рибулозодифосфата при фотосинтезе.
4. Гормональная: инсулин, глюкагон – гормоны, регулирующие уровень глюкозы в крови.
5. Транспортная: гемоглобин – переносит О2 в крови позвоночных, сывороточный альбумин – обеспечивает транспорт жирных кислот, липидов.
6. Защитная: тромбин – участвует в процессе свертывания крови, антитела (γ-глобулины) – образуют комплексы с инородными телами, обеспечивая иммунный ответ.
7. Сократительная: миозин и актин – обеспечивают сократимость мышечных волокон.
8. Токсическая: змеиный яд – участвует в составе ферментов, бактериальные токсины – синтезируются бактериями.
9. Энергетическая: 1г белка дает 17,6 Кдж энергии.
10. Рецепторная: опсин палочек и колбочек сетчатки глаза является фоторецептором.
Органический состав клеток
Существует 4 класса органических веществ, входящих в состав клеток: белки, жиры, углеводы и нуклеиновые кислоты.
Углеводы
Углеводы — органические вещества, в состав которых входят углерод, кислород и водород. Образуются в процессе фотосинтеза из воды и углекислого газа. Различают — моносахариды (состоят из одной молекулы) (глюкоза, рибоза и т.д.), дисахариды — соединение двух молекул (сахароза, мальтоза) и полисахариды — в их состав входит много молекул сахара (крахмал, гликоген, клетчатка, пектин, инулин, хитин).
Функции углеводов
1. Входят в состав многих органических веществ (рибоза — в состав РНК, АТФ, ФАД, НАД, НАДФ, дезоксирибоза — в состав ДНК)
2. Глюкоза — является источником энергии (окисляется при дыхании)
3. Многие углеводы являются запасными веществами — крахмал у растений, гликоген — у грибов и животных
4. Входят в состав многих компонентов клеток и тканей (гликокаликс, гепарин, кликопротеины, пектины, полисахариды, гемицеллюлоза, хитин, муреин, тейхоевые кислоты)
5. Защитная — в составе гликокаликса участвует в процессе клеточного распознавания, входят в состав иммуноглобулинов, входят в состав камеди (выделяется при повреждении стволов) и в состав клеточной стенки многих организмов
Белки
Белки — это органические вещества-полимеры, мономерами которых являются аминокислоты (гемоглобин, альбумин, коллаген, эластин и многие другие).
Белки имеют 4 структуры
Первичная — линейная последовательность аминокислот, соединенная в полипептиднуй цепь
Вторичная — спираль, состоящая из двух цепей, соединенных водородными связями
Третичная — глобула или фибриллярная структура (уложенные слои или суперскрученная спираль). Ионные, водородные, ковалентные (дисульфидные мостики), гидрофобные взаимодействия между составными частями
Четвертичная — несколько глобул или микрофибриллы, соединенные силами межмолекулярного притяжения
Бывают: собственно белки и ферменты.
Ферменты — биологические катализаторы, не только ускоряют, но и осуществляют большиснтво реакций в живых организмах.
Функции белков
1. Ферментативная — ускоряют, а в большинстве случаев осуществляют биохимические реакции в организме
2. Структурная — входят в состав всех мембран, являются компонентом соединительной ткани (костей, хрящей, сухожилий, кожи, волос, ногтей), входят в состав слизистых секретов (мукопротеины). Из белков состоят капсиды вирусов. Входят в состав каружного скелета насекомых.
3. Двигательная — из белков состоят микротрубочки (тубулин), двигательный аппарат жгутиков, актин и миозин — сократительные белки мышц.
4. Транспортная — транспорт через мембрану и внутри клетки, а также белки крови (гемоглобин переносит кислород, гемоцианин переносит кислород в крови беспозвоночных, сывороточный альбумин переносит жирные кислоты, глобулины переносят ионы металлов и гормоны)
5. Защитная — белки иммунитета (интерфероны), белки крови (предотвращают кровопотерю), антиоксиданты (гасят активные формы кислорода)
6. Рецепторная — белки гликокаликса (отвечают за клеточную совместимость), светочувствительные ферменты сетчатки глаза, фитохром у растений (реагирует на изменение длины светового дня)
7. Запасающая — белок-ферритин запасает железо в печени, селезенке, миоглобин запасает кислород в мышцах позвоночных
8. Питательная — белки — источники аминокислот
9. Регуляторная — многие гормоны являются белками (инсулин, соматотропин, пролактин, глюкагон)
10. Антибиотическая — многие антибиотики (противомикробные препараты) являются белками (грамицидин S, актиномицин)
11. Токсическая — многие токсины (опасные для живых организмов вещества) являются белками — ботулинический токсин, столбнячный, холерный, токсины грибов и пчел
Нуклеиновые кислоты: ДНК и РНК
В 1953 г. английские ученые Дж. Уотсон и Ф. Крик предложили модель пространственной струк- туры ДНК. Они показали, что ДНК состоит из двух полинуклеотидных цепей, спирально закрученных одна вокруг другой. Двойная спираль стабилизирована водородными свя- зями между азотистыми основаниями разных цепей так, что против аденина одной цепи всегда стоит ти- мин другой, а гуанина — цитозин. Многократное повторение этих связей придает большую устойчивость двойной спирали ДНК. При опреде- ленных условиях (действие кислот, щелочей, нагревание и т. п.) происходит денатурация ДНК — разрыв водородных связей между компле- ментарными азотистыми основани- ями. Денатурированная ДНК может восстановить двуспиральное строение благодаря установлению водородных связей между комплементарными нуклеотидами — этот процесс называется ренатурацией.
Строение ДНК:
ДНК составляют 4 типа азотистых оснований : А (аденин), Т (тимин), Г (гуанин) и Ц (цитозин).
Нуклеотиды соединяются по принципу комплементарности: А=Т, ГΞЦ
Функции ДНК:
1. Хранение генетической информации
2. Репликация ДНК
3. Синтез РНК
Строение РНК:
РНК бывает:
1. Рибосомальной (входит в состав рибосом)
2. Транспортной (приносит аминокислоты к рибосомам во время синтеза белка)
3. Информационной (передает информацию о первичной структуре белка на рибосомы)
Липиды
Липиды — жироподобные органические вещества, нерастворимые в воде, но растворимые в неполярных органических растворителях (бензоле, бензине и т.д.).
Состоят из глицерина и жирных кислот, при этом глицериновые головки являются гидрофильными, а углеводородные хвосты — гидрофобными. Таким образом, образуется в мембране билипидный слой, через который диффундирует вода и другие вещества.
Строение липидов:
Функции липидов:
1. Энергетическая — при окислении липидов выделяется много энергии
2. Резервная — жиры являются запасным веществом и в ходе окисления жиров выделяется вода, которая очень важны, например, для жителей пустыни
3. Структурная — из фосфолипидов состоят мембраны всех живых организмов, гликолипиды участвуют в межклеточных контактах в тканях животных, сфинголипиды обеспечивают электрическую изоляцию аксона, создавая условия для быстрого прохождения импульса, пчелы из воска строят соты
4. Защитная — термоизоляция и амортизация, воски являются водоотталкивающими веществами у растений, гликолипиды участвуют в распознавании токсинов
5. Регуляторная — некоторые гормоны — липиды (тестостерон, прогестерон, кортизон), существуют жирорастворимые витамины (A, D, E, K), гибберелины — регуляторы роста растений
Разнообразие липидов
Фосфолипиды — содержат остаток фосфорной кислоты, входят в состав клеточных мембран.
Гликолипиды — соединения липидов с углеводами. Являются составной частью тканей мозга и нервных волокон.
Липопротеиды — комплексные соединения разнообразных белков с жирами.
Стероиды — важные компоненты половых гормонов, витамина Д.
Воска — выполняют защитную функцию: у млекопитающих — смазывают кожу и волосы, у птиц — придают перьям водоотталкивающие свойства, у растений — предотвращают чрезмерное испарение воды.
АТФ
Аденозинтрифосфорная кислота (АТФ) — нуклеотид, в состав которого входит азотистое основание аденин, углевод рибоза и три остатка фосфорной кислоты. Молекула АТФ является универсальным химическим аккумулятором энергии в клетках. Остатки фосфорной кислоты связаны макроэргичными связями. Когда от АТФ отщепляется один остаток фосфорной кислоты, образуется АДФ — аденозиндифосфорная кислота и выделяется 40 кДж энергии
8. АТФ и другие органические соединения клетки
Аденозинтрифосфорная кислота — АТФ
Нуклеотиды являются структурной основой для целого ряда важных для жизнедеятельности органических веществ, например макроэргических соединений.Универсальным источником энергии во всех клетках служит АТФ — аденозинтрифосфорная кислота, или аденозинтрифосфат.
АТФ содержится в цитоплазме, митохондриях, пластидах и ядрах клеток и является наиболее распространённым и универсальным источником энергии для большинства биохимических реакций, протекающих в клетке.
АТФ обеспечивает энергией все функции клетки: механическую работу, биосинтез веществ, деление и т. д. В среднем содержание АТФ в клетке составляет около \(0,05\) % её массы, но в тех клетках, где затраты АТФ велики (например, в клетках печени, поперечнополосатых мышц), её содержание может доходить до \(0,5\) %.
Строение АТФ
АТФ представляет собой нуклеотид, состоящий из азотистого основания — аденина, углевода рибозы и трёх остатков фосфорной кислоты, в двух из которых запасается большое количество энергии.
Связь между остатками фосфорной кислоты называют макроэргической (она обозначается символом ~), так как при её разрыве выделяется почти в \(4\) раза больше энергии, чем при расщеплении других химических связей.
АТФ — неустойчивая структура, и при отделении одного остатка фосфорной кислоты АТФ переходит в аденозиндифосфат (АДФ), высвобождая \(40\) кДж энергии.
Другие производные нуклеотидов
Особую группу производных нуклеотидов составляют переносчики водорода. Молекулярный и атомарный водород обладает большой химической активностью и выделяется или поглощается в ходе различных биохимических процессов. Одним из наиболее широко распространённых переносчиков водорода является никотинамиддинуклеотидфосфат (НАДФ).
Молекула НАДФ способна присоединять два атома или одну молекулу свободного водорода, переходя в восстановленную форму НАДФ·h3. В таком виде водород может быть использован в различных биохимических реакциях.
Нуклеотиды могут также принимать участие в регуляции окислительных процессов в клетке.
Витамины
Витамины (от лат. vita — «жизнь») — сложные биоорганические соединения, совершенно необходимые в малых количествах для нормальной жизнедеятельности живых организмов. От других органических веществ витамины отличаются тем, что не используются в качестве источника энергии или строительного материала. Некоторые витамины организмы могут синтезировать сами (например, бактерии способны синтезировать практически все витамины), другие витамины поступают в организм с пищей.
Витамины принято обозначать буквами латинского алфавита. В основу современной классификации витаминов положена их способность растворяться в воде и жирах (они делятся на две группы: водорастворимые (B1, B2, B5, B6, B12, PP, C) и жирорастворимые (A, D, E, K)).
Витамины участвуют практически во всех биохимических и физиологических процессах, составляющих в совокупности обмен веществ. Как недостаток, так и избыток витаминов может привести к серьёзным нарушениям многих физиологических функций в организме.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
http://biouroki.ru/test/114.html
http://dic.academic.ru/dic.nsf/%20ruwiki/208102