Основание (химия) — Циклопедия
Основания. Неорганическая химия, 8 класс, по учебнику О. С. Габриелян Химия 8 класс. Основания // SovaFilmProductionОснование — сложное вещество, которое состоит из атома металла или иона аммония и гидроксогруппы (−OH).
Имеются различные определения основания. С точки зрения теории раствора, основание — это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя.
При взаимодействии кислот и оснований друг с другом образуются молекулы растворителя, то есть происходит нейтрализация.
[править] Основания по теории Аррениуса
Согласно теории Аррениуса, основаниями называют электролиты, которые в водном растворе диссоциируют с образованием катионов металла (или неметаллических катионов, как NH4+) и анионов только одного типа — гидроксида ОН−.
Например:
- NaOH = Na+ + OH−
- NH4OH = NH4+ + OH−
- Ba(OH)2 = Ba2+ + 2OH−
Основания Аррениуса можно рассматривать как гидроксиды основных оксидов, то есть как продукты соединения воды с основными оксидами:
- Na2 O + H2O = 2NaOH
- CaO + H2O = Ca(OH)2
- BaO + H2O = Ba(OH)2
Основания Аррениуса, как и основные оксиды, при взаимодействии с кислотами и ангидридами, а также с амфотерными оксидами образуют соли, а между собой не взаимодействуют.
Например: Cu(OH)2 + 2HCl = CuCl2 + 2H2O Ca(OH)2 + CO2 = CaCO3 + H2О
Основные гидроксиды, или основания, изображают по следующей общей формуле: Ме(ОН)x, где Ме — атом металла, или металлоподобная группа (как NH4), а x — число гидроксидных групп, равное валентности металла. Например: NaOH, Ba(OH)2, Fe(OH)3.
Основания называют обычно гидроксидами соответствующих металлов. Если металл имеет постоянную валентность и образует только один гидроксид, то его называют просто гидроксидом этого металла. Так, NaOH — гидроксид натрия, Ba(OH)
Основания Аррениуса являются твердыми веществами. Некоторые из них, в частности NaOH и KOH, в термическом отношении достаточно устойчивы: их можно нагревать до температуры плавления и даже кипения, и они не разлагаются. Однако большинство оснований неустойчивы и при нагревании легко разлагаются с образованием оксидов и выделением воды.
Например:
- Ca(OH)2 = CaO + H2O
- 2Fe(OH)3 = Fe2O3 + 3H2O
Большинство оснований Аррениуса нерастворимы в воде. Хорошо растворимыми являются только основания щелочных и щелочноземельных металлов, то есть щелочи. Среди щелочей практически наиболее применяемыми являются NaOH, KOH, Ca(OH)2 и Ba(OH)2. Водные растворы едких щелочей имеют едкий мыльный вкус. Они легко разрушают растительные и животные ткани. Поэтому их называют еще едкими щелочами. Растворы едких щелочей обладают способностью изменять окраску индикаторов. Так, в щелочной среде фиолетовый цвет лакмуса меняется на синий, оранжевый цвет метилоранжа — на светло-желтый, а бесцветный раствор фенолфталеина становится фиолетовым. Щелочные свойства растворов оснований обусловливаются наличием в растворе гидроксильных ионов.
Химические свойства оснований Аррениуса определяются их отношением к кислотам, ангидридам, амфотерным оксидам и солям. Наиболее характерным свойством оснований является их способность вступать в химические реакции с кислотами. Причем с кислотами взаимодействуют как растворимые, так и нерастворимые основания.
Реакции взаимодействия оснований с кислотами называют реакциями нейтрализации. Суть реакций нейтрализации заключается в том, что кислотный водород и гидроксильная группа в основании образуют воду, а катионы металла основания и кислотные остатки образуют соль:
- Ba(OH)2 + 2HCl = BaCl2 + 2H2O
- Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Основания вступают в химические реакции также с ангидридами и амфотерными оксидами:
- 2NaOH + CO2 = Na2CO3 + H2O
- 2KOH + SO2 = K2SO3 + H2O
- 2KOH + PbO = K2PbO2 + H2O
Растворы едких щелочей взаимодействуют и с растворами солей, образуя нерастворимые основания:
- CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
- Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Основания Аррениуса можно получить разными способами.
- Непосредственным сообщением основных оксидов с водой. Этим способом можно пользоваться в тех случаях, когда основной оксид непосредственно взаимодействует с водой. Например:
- Na2O + H2O = 2NaOH
- CaO + H2O = Ca(OH)2
- Взаимодействием едких щелочей, с растворами солей. Этим способом пользуются в лабораториях, когда соответствующий оксид с водой непосредственно не взаимодействует, а гидроксид нерастворим. Например:
- CuSO4 + 2KOH = Cu(OH)2
- FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
- CuSO4 + 2KOH = Cu(OH)2
- Взаимодействием активных металлов (K, Na, Ca, Ba) с водой. Например:
- 2Na + 2H2O = 2NaOH + H2↑
- Ca + 2H2O = Ca(OH)2 + H2↑
Для технического получения NaOH и KOH широко используют способ электролиза водных растворов NaCl и KCl.
[править] Основания как катализаторы
Основания могут использоваться как нерастворимые гетерогенные катализаторы для химических реакций. Например, катализаторами являются оксиды магния, кальция, бария, некоторые цеолиты. Многие переходные металлы входят в состав катализаторов, и многие из них входят в состав оснований. Катализаторы на базе оснований используются для гидрогенизации, при миграции двойных связей, реакции Меервейна-Пондорфа-Верлея, реакции Майкла и многих других реакций.
- Ф. А. Деркач «Химия» Л.: 1968
- Ю. О. Ластухин, С. А. Воронов. Органическая химия. Учебник для высших учебных заведений. Издание четвертое. — Львов: Центр Европы, 2009—868 с. (Страница 164)
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008—758 с.
cyclowiki.org
Основание (химия) — Википедия. Что такое Основание (химия)
Основание — химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда ) либо с вакантной орбиталью другого химического соединения (основание Льюиса
) либо с вакантной орбиталью другого химического соединения (основание Льюиса )[1]
)[1]
Частным случаем оснований являются щёлочи — гидроксиды щелочных, щелочноземельных металлов, а также некоторых других элементов, например, таллия. Реакции оснований с кислотами называют реакциями нейтрализации.
История
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что эти вещества служат «основаниями» для образования солей в твёрдой форме[3].
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны H +, а основание — как вещество, дающее при диссоциации гидроксид-ионы OH−[4]. Теория Аррениуса, однако, имела свои недостатки — например, она не учитывала влияние растворителя на кислотно-основное равновесие, а также была неприменима к неводным растворам[5].
В 1924 году Э. Франклином была создана сольвентная теория, согласно которой основание определялось как соединение, которое при диссоциации увеличивает число тех же анионов, которые образуются при диссоциации растворителя[4].
Современное определение
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и в настоящее время.
Основание в теории Брёнстеда — Лоури
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Брёнстедом и английским учёным Т. Лоури, основанием Брёнстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты
B+h3O⇌BH++OH−.{\displaystyle {\mathsf {B+H_{2}O}}\rightleftharpoons {\mathsf {BH^{+}+OH^{-}}}.}
Основание в теории Льюиса
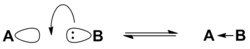
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Льюисом, основание — это вещество, способное отдавать электронную пару на образование связи с кислотой Льюиса[7]. Основаниями Льюиса могут быть амины R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения с π-связями[8]. В зависимости от орбитали, на которой расположена участвующая в реакции пара электронов, основания Льюиса подразделяют на n-, σ- и π-типы — электронные пары для этих типов расположены соответственно на несвязывающих, σ- и π-орбиталях[4].
Понятия основания в теориях Льюиса и Брёнстеда — Лоури совпадают: согласно обеим теориям основания отдают пару электронов на образование связи. Разница заключается лишь в том, куда расходуется эта электронная пара. Основания Брёнстеда за её счёт образуют связь с протоном, а основания Льюиса — с любыми частицами, имеющими вакантную орбиталь. Таким образом, существенные различия этих теорий касаются понятия кислоты, а не основания[8][4].
AlCl3+Cl−⇌AlCl4−{\displaystyle {\mathsf {AlCl_{3}+Cl^{-}}}\rightleftharpoons {\mathsf {AlCl_{4}^{-}}}}
BF3+(C2H5)2O⇌BF3⋅(C2H5)2O{\displaystyle {\mathsf {BF_{3}+(C_{2}H_{5})_{2}O}}\rightleftharpoons {\mathsf {BF_{3}\cdot (C_{2}H_{5})_{2}O}}}
Теория Льюиса не предусматривает количественной оценки способности оснований реагировать с кислотами Льюиса. Однако, для качественной оценки широко применяется принцип жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО), согласно которому жёсткие кислоты предпочтительно реагируют с жёсткими основаниями, а мягкие кислоты — с мягкими основаниями. По Пирсону, жёсткими основаниями являются основания, донорный центр которых обладает низкой поляризуемостью и высокой электроотрицательностью[9][10]. Напротив, мягкими основаниями являются донорные частицы с высокой поляризуемостью и низкой электроотрицательностью[10]. Жёсткие и мягкие кислоты обладают такими же свойствами как жёсткие и мягкие основания соответственно с той разницей, что они являются акцепторными частицами[11].
| Жёсткие основания | Промежуточные основания | Мягкие основания |
|---|---|---|
| OH−, RO−, F−, Cl−, RCOO−, NO3−, NH3, RNH2, H2O, ROH, SO42−, CO32−, R2O, NR2−, NH2− | Br−, C6H5NH2, NO2−, C5H5N | RS−, RSH, I−, H−, R3C−, алкены, C6H6, R3P, (RO)3P |
| Жёсткие кислоты | Промежуточные кислоты | Мягкие кислоты |
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
Критерий ЖМКО не имеет количественных параметров, однако основания Льюиса можно приблизительно расположить в ряды по их льюисовской основности. Например, мягкость оснований убывает в следующих рядах[8]:
I−>Br−>Cl−>F−,{\displaystyle {\mathsf {I^{-}>Br^{-}>Cl^{-}>F^{-}}},}
Ch4−>Nh3−>OH−>F−.{\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-}}}.}
Основание в общей теории Усановича
В общей теории кислот и оснований, созданной М. И. Усановичем в 1939 году, основание определено как вещество, отдающее анионы (или электроны) и принимающие катионы. Таким образом, в рамках теории Усановича в понятие основания входят как основания Брёнстеда, так и основания Льюиса, а также восстановители[5]. Кроме того, само понятие основности, как и кислотности, в общей теории Усановича рассматривается как функция вещества, проявление которой зависит не от самого вещества, а от его партнёра по реакции[13].
Сила оснований
Количественное описание силы оснований
Теория Брёнстеда — Лоури позволяет количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb — константы равновесия реакции основания с кислотой сравнения, в качестве которой выбрана вода. Чем выше константа основности, тем выше сила основания и тем больше его способность отщеплять протон[8]. Часто константу основности выражают в виде показателя константы основности pKb. Например, для аммиака как основания Брёнстеда можно записать[4][14]:
Nh4+h3O⇌Nh5++OH−{\displaystyle {\mathsf {NH_{3}+H_{2}O}}\rightleftharpoons {\mathsf {NH_{4}^{+}+OH^{-}}}}
Kb=[Nh5+]⋅[OH−][Nh4]=1,79⋅10−5;{\displaystyle K_{b}={\frac {[{\mathsf {NH_{4}^{+}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {NH_{3}}}]}}=1{,}79\cdot 10^{-5};}
pKb=−logKa=4,75.{\displaystyle \ \mathrm {p} K_{b}=-\log K_{a}=4{,}75.}
Для многоосновных оснований используют несколько значений констант диссоциации Kb1, Kb2 и т. д. Например, фосфат-ион может протонироваться трижды:
PO43−+h3O⇌HPO42−+OH−;Kb1=[HPO42−]⋅[OH−][PO43−]=2,10⋅10−2;{\displaystyle {\mathsf {PO_{4}^{3-}+H_{2}O}}\rightleftharpoons {\mathsf {HPO_{4}^{2-}+OH^{-}}};K_{\mathrm {b1} }={\frac {[{\mathsf {HPO_{4}^{2-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {PO_{4}^{3-}}}]}}=2{,}10\cdot 10^{-2};}
HPO42−+h3O⇌h3PO4−+OH−;Kb2=[h3PO4−]⋅[OH−][HPO42−]=1,58⋅10−7;{\displaystyle {\mathsf {HPO_{4}^{2-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{2}PO_{4}^{-}+OH^{-}}};K_{\mathrm {b2} }={\frac {[{\mathsf {H_{2}PO_{4}^{-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {HPO_{4}^{2-}}}]}}=1{,}58\cdot 10^{-7};}
h3PO4−+h3O⇌h4PO4+OH−;Kb3=[h4PO4]⋅[OH−][h3PO4−]=1,32⋅10−12.{\displaystyle {\mathsf {H_{2}PO_{4}^{-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{3}PO_{4}+OH^{-}}};K_{\mathrm {b3} }={\frac {[{\mathsf {H_{3}PO_{4}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {H_{2}PO_{4}^{-}}}]}}=1{,}32\cdot 10^{-12}.}
Силу основания можно также охарактеризовать константой кислотности его сопряжённой кислоты Ka (BH+), причём произведение константы основности Kb на константу Ka (BH+) равно ионному произведению воды для водных растворов[14] и константе автопротолиза растворителя в общем случае[8].
Ka(Nh5+)=[Nh4]⋅[H+][Nh5+]=5,62⋅10−10;{\displaystyle K_{a}\mathrm {(NH_{4}^{+})} ={\frac {[{\mathsf {NH_{3}}}]\cdot [{\mathsf {H^{+}}}]}{[{\mathsf {NH_{4}^{+}}}]}}=5{,}62\cdot 10^{-10};}
Ka(Nh5+)⋅Kb(Nh4)=Kw=1⋅10−14;{\displaystyle {K_{a}\mathrm {(NH_{4}^{+})} }\cdot {K_{b}\mathrm {(NH_{3})} }=K_{w}=1\cdot 10^{-14};}
pKa(Nh5+)+pKb(Nh4)=pKw=14{\displaystyle {\mathrm {p} K_{a}\mathrm {(NH_{4}^{+})} }+{\mathrm {p} K_{b}\mathrm {(NH_{3})} }=\mathrm {p} K_{w}=14}
Из последнего уравнения также следует, что сила основания тем выше, чем ниже кислотность сопряжённой ему кислоты. Например, вода является слабой кислотой и при отщеплении протона превращается в сильное основание — гидроксид-ион OH−[8].
Значения pKb некоторых оснований и pKa их сопряжённых кислот в разбавленных водных растворах[4]| Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) | Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) |
|---|---|---|---|---|---|---|---|
| ClO4− | HClO4 | 19 ± 0,5 | −5 ± 0,5 | HPO42− | H2PO4− | 6,80 | 7,20 |
| HSO4− | H2SO4 | 16,8 ± 0,5 | −2,8 ± 0,5 | ClO− | HClO | 6,75 | 7,25 |
| H2O | H3O+ | 15,74 | −1,74 | H2BO3− | H3BO3 | 4,76 | 9,24 |
| NO3− | HNO3 | 15,32 | −1,32 | NH3 | NH4+ | 4,75 | 9,25 |
| HOOC-COO− | (COOH)2 | 12,74 | 1,26 | CN− | HCN | 4,78 | 9,22 |
| HSO3− | H2SO3 | 12,08 | 1,92 | CO32− | HCO3− | 3,67 | 10,33 |
| SO42− | HSO4− | 12,04 | 1,96 | HOO− | H2O2 | 11,62 | 3,38 |
| H2PO4− | H3PO4 | 11,88 | 2,12 | PO43− | HPO42− | 1,68 | 12,32 |
| F− | HF | 10,86 | 3,14 | OH− | H2O | −1,74 | 15,74 |
| NO2− | HNO2 | 10,65 | 3,35 | NH2− | NH3 (ж.) | −19 | 33 |
| CH3COO− | CH3COOH | 9,24 | 4,76 | H− | H2 | −24,6 | 38,6 |
| SH− | H2S | 6,95 | 7,05 | СH3− | СH4 | ~−44 | ~58 |
Влияние растворителя
На кислотно-основное равновесие значительное влияние оказывает растворитель. В частности, для водных растворов было обнаружено, что все основания с константами основности pKb < 0 имеют одинаковые свойства (например, pH растворов). Объясняется это тем, что такие основания в воде практически нацело превращаются в гидроксид-ион OH−, который является единственным основанием в растворе. Так, все основания с pKb < 0 (амид натрия NaNH2, гидрид натрия NaH и др.) дают эквивалентное количество гидроксид-ионов в водных растворах, выравниваясь между собой по силе. Данное явление получило название нивелирующего эффекта растворителя. Аналогичным образом, в водных растворах выравниваются по силе и очень слабые основания с pKb > 14[15][16].
Основания с pKb от 0 до 14 в воде частично протонированы и находятся в равновесии с сопряжённой кислотой, а их свойства в растворе зависят от значения pKb. В этом случае говорят о дифференцирующем эффекте растворителя. Интервал pKb, в котором основания дифференцированы по силе, равен показателю константы автопротолиза растворителя. Для разных растворителей этот интервал различен (14 для воды, 19 для этанола, 33 для аммиака и т. д.), соответственно, и набор дифференцированных и нивелированных оснований для них разный[17].
В растворителях, обладающих выраженными кислотными свойствами, все основания становятся более сильными и большее число оснований нивелируется по силе. Например, уксусная кислота уравнивает большинство известных оснований по силе, со своим сопряжённым основанием — ацетат-ионом CH3COO−. Напротив, основные растворители (аммиак) служат дифференцирующими растворителями для оснований[18].
Влияние строения основания
Существует несколько факторов, которые определяют относительную силу органических и неорганических оснований и которые связаны с их строением. Часто несколько факторов действуют одновременно, поэтому трудно предсказать их суммарное влияние. Среди наиболее значимых можно выделить следующие факторы.
- Индуктивный эффект (эффект поля). При повышении доступности электронной пары основания его сила возрастает. По этой причине введение электронодонорных заместителей в основание способствует проявлению им основных свойств. Например, введение алкильных заместителей в молекулу аммиака приводит к более сильным основаниям, чем сам аммиак[19]. Напротив, введение акцепторных заместителей в молекулу понижает силу основания[8].
- Мезомерный эффект (резонансный эффект). Электронодонорные и электроноакцепторные заместители оказывают положительное и отрицательное влияние на силу основания соответственно также через систему сопряжения. В таком случае говорят о мезомерном эффекте. Данный эффект приводит к тем же последствиям, что и индуктивный: различается лишь механизм их действия. Так, пара-нитроанилин является более слабым основанием, чем анилин (pKb равны 12,89 и 9,40 соответственно) из-за акцепторного влияния нитрогруппы, которая снижает доступность электронной пары азота аминогруппы[20].
- Эффект сопряжения проявляется также в том случае, если электронная пара основания находится в системе сопряжения, например, с ароматической системой или двойной связью. В таком случае основания имеют более низкую силу. Например, амиды и анилины являются гораздо более слабыми основаниями, чем амины[19].
- Корреляция с расположением атомов в периодической системе. Чем выше электроотрицательность основного элемента, тем ниже основная сила основания. Так, сила основания понижается при движении по периоду периодической системы слева направо. Также основность понижается при переходе по группе сверху вниз, что связано с увеличением радиуса основного атома и, следовательно, меньшей плотностью отрицательного заряда на нём, что в итоге снижает силу связывания положительно заряженного протона[20].
Ch4−>Nh3−>OH−>F−;{\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-};}}}
Nh4>Ph4>Ash4{\displaystyle {\mathsf {NH_{3}>PH_{3}>AsH_{3}}}}
- Гибридизация. Сила органических оснований понижается, если основный атом связан с другим атомом кратными связями. Так, при переходе от аминов к иминам и нитрилам основность уменьшается. Это объясняется тем, что электронная пара в этих соединениях располагается на sp3-, sp2— и sp-гибридных орбиталях атома азота соответственно, то есть в данном ряду электронная пара приближается по характеру к s-электронам, приближаясь к атомному ядру и становясь менее доступной[19].
RCh3Nh3>RCH=NH>RC≡N{\displaystyle {\mathsf {RCH_{2}NH_{2}>RCH{=}NH>{RC}{\equiv }{N}}}}
Супероснования
Основания в органической химии
См. также
Комментарии
- ↑ 1 2 С одной стороны, наличие третьей алкильной группы в триметиламине и триэтиламине должно увеличивать их основность. С другой стороны, с добавлением третьего заместителя резко уменьшается способность сопряжённых кислот (CH3)3NH+ и (C2H5)3NH+ к гидратации, что уменьшает их устойчивость и суммарно понижает основность аминов.
Примечания
- ↑ IUPAC Gold Book — base. Проверено 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. Органическая химия. 9 класс. — 13-е изд. — М.: Просвещение, 2009. — С. 10. — ISBN 978-5-09-021-625-8.
- ↑ William B. Jensen, The Origin of the Term Base, Journal of Chemical Éducation • 1130 Vol. 83 No. 8 août 2006
- ↑ 1 2 3 4 5 6 7 Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М: Большая Российская энциклопедия, 1992. — Т. 2. — С. 393—395. — ISBN 5-85270-039-8.
- ↑ 1 2 Золотов Ю. А., Дорохова Е. Н., Фадеева В. И. и др. Основы аналитической химии. Книга 1. Общие вопросы. Методы разделения / Под ред. Ю. А. Золотова. — 2-е изд., перераб. и доп. — М: Высшая школа, 1999. — С. 118. — ISBN 5-06-003558-1.
- ↑ IUPAC Gold Book — Brønsted base. Проверено 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ IUPAC Gold Book — Lewis base. Проверено 18 апреля 2013. Архивировано 1 мая 2013 года.
- ↑ 1 2 3 4 5 6 7 8 Москва В. В. Понятие кислоты и основания в органической химии // Соросовский образовательный журнал. — 1996. — № 12. — С. 33—40.
- ↑ IUPAC Gold Book — hard base. Проверено 18 апреля 2013. Архивировано 1 мая 2013 года.
- ↑ 1 2 Химическая энциклопедия, 1992, т. 2, с. 145.
- ↑ IUPAC Gold Book — hard acid. Проверено 18 апреля 2013. Архивировано 1 мая 2013 года.
- ↑ Золотов и др., 1999, с. 152.
- ↑ Кусаинова К. М. Нет ни кислот, ни оснований! Об одной полузабытой теории и её творце // Химия и жизнь. — 2004. — № 6. — С. 40—44.
- ↑ 1 2 Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е, испр. и доп. — Ленинград: Химия, 1978. — С. 232—236.
- ↑ Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд. — М: Бином. Лаборатория знаний, 2010. — Т. 1. — С. 40. — ISBN 978-5-94774-614-9.
- ↑ Неорганическая химия / Под ред. Ю. Д. Третьякова. — М: Академия, 2004. — Т. 1. — С. 89—94. — ISBN 5-7695-1446-9.
- ↑ Золотов и др., 1999, с. 123—125.
- ↑ Танганов Б. Б. Химические методы анализа. — Улан-Удэ: Издательство ВСГТУ, 2005. — С. 8—14. — ISBN 5-89230-037-4.
- ↑ 1 2 3 4 Сайкс П. Механизмы реакций в органической химии = A Guidebook to Mechanism in Organic Chemistry / Под ред. Я. М. Варшавского. — 3-е изд.. — М: Химия, 1977. — С. 82—91.
- ↑ 1 2 Марч Дж. Органическая химия. Реакции, механизмы и структура. Т. 1 / Пер. с англ. З. Е. Самойловой, под ред. И. П. Белецкой. — М: Мир, 1987. — С. 340—346.
wiki.sc
ОСНОВАНИЕ — это… Что такое ОСНОВАНИЕ?
ОСНОВАНИЕ — достаточное условие для чего либо: бытия, познания, мысли, деятельности. Напр., О. материальных явлений это их причины; О. поступков их мотивы; О. суждений др. суждения (посылки) или опыт. Разыскание О. наз. обоснованием; обосновать… … Философская энциклопедия
Основание — Основание: В науке: Основание в химии. Основание степени в алгебре. Основание в геометрии. Основание здания в строительстве массивы грунтов, принимающие нагрузку от зданий и сооружений. Другое: Основание (англ. Foundation) цикл из семи… … Википедия
ОСНОВАНИЕ — ОСНОВАНИЕ, основания, ср. 1. чаще ед. Начало существования, момент возникновения чего нибудь. Год основания университета. Основание Петербурга относится к 1703 году. 2. Нижняя опорная часть предмета или сооружения, фундамент. Дом на каменном… … Толковый словарь Ушакова
основание — База, базис, бык, столп, устой, фундамент, пьедестал, краеугольный камень, точка опоры. Гуманность… может послужить, так сказать, краеугольным камнем предстоящих реформ . Дост. Камень, который отвергли строители, соделался главою угла . Пс. 117 … Словарь синонимов
ОСНОВАНИЕ — здания (сооружения) массив грунта (горной породы), непосредственно воспринимающий нагрузку от здания (сооружения). Различают основание естественное, когда грунты находятся в условиях природного залегания, и искусственное, когда грунты… … Большой Энциклопедический словарь
основание — ОСНОВАНИЕ, базирование, базировка, обоснование, построение ОСНОВАТЕЛЬНОСТЬ, обоснованность ОСНОВАТЕЛЬНЫЙ, обоснованный ОСНОВЫВАТЬ/ОСНОВАТЬ, базировать, обосновывать/обосновать, строить/построить ОСНОВЫВАТЬСЯ, базироваться,… … Словарь-тезаурус синонимов русской речи
ОСНОВАНИЕ — ОСНОВАНИЕ, я, ср. 1. см. основать, ся. 2. Опорная часть предмета, сооружения, основа (в 1 знач.). Дом на каменном основании. 3. В математике: сторона геометрической фигуры или грань геометрического тела, перпендикулярная высоте. О. треугольника,… … Толковый словарь Ожегова
Основание — (хим.). Под именем О. (Bases salifiables) понимаютсявещества, обладающие известной химической функцией: вещества, дающие скислотами соли, таким образом вопрос, что такое О., связывается свопросом, что такое кислота и что такое соль. В истории… … Энциклопедия Брокгауза и Ефрона
ОСНОВАНИЕ — хим. соединение, диссоциирующее в водных растворах на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила(ОН)–. Напр., Са(ОН)2 гидроокись Са, NaOH гидроокись Na, или едкий натр. Сила О. определяется степенью его… … Геологическая энциклопедия
ОСНОВАНИЕ — англ. foundation/ premise; нем. Grundlage. 1. Базисная часть ч. л., главный принцип, достаточное условие для ч. л.: бытия, познания, мышления, деятельности. 2. В логике часть условного суждения, выражающая условие, от к рого зависит истинность… … Энциклопедия социологии
dic.academic.ru
Основания — это… Что такое Основания?
Основа́ния — класс химических соединений.
- Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН—. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
- Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
- В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
- В статье смысл термина основание раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Способы получения оснований
- Получение щелочи при реакции сильноосновного оксида с водой
Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей.
CaO(т) + H2O(ж) → Ca(OH)2(p)Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Косвенное получение основания (гидроксида) при реакции соли со щелочью
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p)- Получение щелочи при реакции замещения типичного металла с водой.
Ca+2H2O=Ca(OH)2+H2
Классификация оснований
- Растворимые в воде основания (щёлочи)
LiOH, NaOH, KOH, Ca(OH)2 , Ba(OH)2 , Sr(OH)2 , Ra(OH)2, CsOH, RbOH, FrOH
- Практически нерастворимые в воде гидрооксиды
Mg(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3 , Be(OH)2
- Другие основания
NH3 × H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые, или гидроксиды типичных металлов и не типичных.
Химические свойства
1. Действие на индикаторы: лакмус — синий, метилоранж — жёлтый, фенолфталеин — малиновый,
2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода 2NaOH + SiO2 = Na2SiO3 + H2O
4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O
См. также
Гидроксид
Wikimedia Foundation. 2010.
partners.academic.ru
ОСНОВАНИЕ — это… Что такое ОСНОВАНИЕ?
исходное условие, предпосылка существования нек-рого явления или системы явлений. В сфере познания поиски О. нек-рой теории осуществляются через процесс обоснования. Поисками «последних О. бытия» (к-рые часто называют принципами) отмечена вся история философии. У древних греков такие О. отыскивались как в материи (Фалес, Гераклит, Демокрит), так и в мире нематериальных сущностей (Платон). Во многих филос. системах Древнего Востока в качестве О. нередко выступали этич. категории – добро, зло и т.п. Аристотель расширяет круг проблем и говорит уже не об одном начале, а о четырех причинах всех вещей. В мистич. ср.-век. философии (Экхарт, Бёме) поиски О. всего сущего связывались с разработкой содержания категории ничто. Лейбниц впервые различил О. (ratio) и причину (causa). Он установил принцип достаточного О. для понимания истин факта, к-рые в эмпирич. философии объяснялись действующими причинами. У X. Вольфа О. есть то, через что можно понять, почему нечто существует. Крузиус первый различил О. бытия и О. познания. Кант логическим называет О., к-рое тождественно со следствием (аналитич. суждение), а реальным – О., в к-ром есть некое иное содержание, чем в следствии (синтетич. суждение). Детальную разработку категории О. дал Гегель, к-рый рассматривал его как момент в диалектич. развитии понятия, когда противоречия сущности разрешены в единстве положительного и отрицательного. Сущность, по Гегелю, определяет себя как О.: «основание есть внутри себя сущая сущность…» (Соч., т. 1, М. –Л., 1929, с. 207). После Гегеля категория О. рассматривалась гл. обр. в логич. аспекте (Шопенгауэр, Вундт, Зигварт, Иерузалем, Витгенштейн и др.), причем обычно указывалось, что принципу «все имеет свою причину» в реальности соответствует логич. принцип «все имеет свое О.». У Шопенгауэра, напр., закон достаточного О. дает необходимую связь различным представлениям, но сам как логич. закон обоснованию не подлежит. В диалектич. материализме категория О. приобрела особое значение в связи с материалистич. пониманием истории и раскрытием объективных О. развития общества.Содержание категории О. раскрывается через категории материи (как О. всех вещей), отражения (как О. познания) и его законов, а также практики.
В формальной логике под О. понимают: 1) антецедент (см. Консеквент и антецедент) условного суждения; 2) аргумент; 3) одну из составных частей доказательства (см. Доказательство в формальной логике, Достаточного основания принцип и лит. при этих статьях).Лит.: Маркс К., Капитал, т. 1, М., 1955, с. 66, 88, 143, 193, 223, 341, 387, 492, 515; Ленин В. И., Философские тетради, Соч., 4 изд., т. 38, с. 117–36; Шопенгауэр А., О четверояком корне закона достаточного основания …, пер. с нем., M., 1902; Шпет Г. Г., Проблема причинности у Юма и Kантa, К., 1907; Церетели с. Б., О природе связи основания и следствия, «ВФ», 1957, No 1; Эмдин М. В., О категориях основания и обоснованного, «Вестн. ЛГУ. Сер. экон., филос. и права», 1959, No 23, вып. 4; Бунге М., Причинность, пер с англ., М., 1962, § 9; Асмус В. Ф., Проблема интуиции в философии и математике, М., 1963, Кант И., Новое освещение первых принципов метафизич. познания, Соч., т. 1, М., 1963.
Философская Энциклопедия. В 5-х т. — М.: Советская энциклопедия. Под редакцией Ф. В. Константинова. 1960—1970.
dic.academic.ru
Ответы@Mail.Ru: Что такое основание? Основания- это…
Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН-. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами.
OH группа с Ме по-моему
соединение элемента с группой OH
Основания — это сложные вещества, в расворах которых нет других анионов, кроме гидроксид-ионов.
Это соединения в которые входят гидроксо группы ОН
Ха я такое сейчас прохожу по естествознанию
мяу тут надо писать что такое основание
основания — это сложные в-ва состоящие из нескольких атомов один из которых водород . кажись так
Это щелочи! Основание — сложное вещество, которое состоит из атома металла или иона аммония и гидроксогруппы (-OH). Имеются различные определения основания. С точки зрения теории раствора, основание — это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя.
основания-это сложные вещества состоящие из ионов металлов связанных с ними гидроксид ионов)
химия от А до Я. <a rel=»nofollow» href=»http://ximiy.pw/8/8bobr» target=»_blank»>http://ximiy.pw/8/8bobr</a> зайди и сразу найдешь все ответы химия 8 класс и гдз
А нас это естествознание 6 класс, а вы это в 8 проходите. лол
Основания — это сложные вещества, состоящие из ионов металлов и связанные с ними гидроксид-ионами.
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)
touch.otvet.mail.ru
Основание — это… Что такое Основание?
ОСНОВАНИЕ — достаточное условие для чего либо: бытия, познания, мысли, деятельности. Напр., О. материальных явлений это их причины; О. поступков их мотивы; О. суждений др. суждения (посылки) или опыт. Разыскание О. наз. обоснованием; обосновать… … Философская энциклопедия
ОСНОВАНИЕ — ОСНОВАНИЕ, основания, ср. 1. чаще ед. Начало существования, момент возникновения чего нибудь. Год основания университета. Основание Петербурга относится к 1703 году. 2. Нижняя опорная часть предмета или сооружения, фундамент. Дом на каменном… … Толковый словарь Ушакова
основание — База, базис, бык, столп, устой, фундамент, пьедестал, краеугольный камень, точка опоры. Гуманность… может послужить, так сказать, краеугольным камнем предстоящих реформ . Дост. Камень, который отвергли строители, соделался главою угла . Пс. 117 … Словарь синонимов
ОСНОВАНИЕ — • ОСНОВАНИЕ, в геометрии сторона треугольника, противолежащая углу, от вершины которого проводится высота. • ОСНОВАНИЕ, в математике число единиц в системе счисления, равное одной единице следующего, более высокого, разряда этой системы.… … Научно-технический энциклопедический словарь
ОСНОВАНИЕ — здания (сооружения) массив грунта (горной породы), непосредственно воспринимающий нагрузку от здания (сооружения). Различают основание естественное, когда грунты находятся в условиях природного залегания, и искусственное, когда грунты… … Большой Энциклопедический словарь
основание — ОСНОВАНИЕ, базирование, базировка, обоснование, построение ОСНОВАТЕЛЬНОСТЬ, обоснованность ОСНОВАТЕЛЬНЫЙ, обоснованный ОСНОВЫВАТЬ/ОСНОВАТЬ, базировать, обосновывать/обосновать, строить/построить ОСНОВЫВАТЬСЯ, базироваться,… … Словарь-тезаурус синонимов русской речи
ОСНОВАНИЕ — ОСНОВАНИЕ, я, ср. 1. см. основать, ся. 2. Опорная часть предмета, сооружения, основа (в 1 знач.). Дом на каменном основании. 3. В математике: сторона геометрической фигуры или грань геометрического тела, перпендикулярная высоте. О. треугольника,… … Толковый словарь Ожегова
Основание — (хим.). Под именем О. (Bases salifiables) понимаютсявещества, обладающие известной химической функцией: вещества, дающие скислотами соли, таким образом вопрос, что такое О., связывается свопросом, что такое кислота и что такое соль. В истории… … Энциклопедия Брокгауза и Ефрона
ОСНОВАНИЕ — хим. соединение, диссоциирующее в водных растворах на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила(ОН)–. Напр., Са(ОН)2 гидроокись Са, NaOH гидроокись Na, или едкий натр. Сила О. определяется степенью его… … Геологическая энциклопедия
ОСНОВАНИЕ — англ. foundation/ premise; нем. Grundlage. 1. Базисная часть ч. л., главный принцип, достаточное условие для ч. л.: бытия, познания, мышления, деятельности. 2. В логике часть условного суждения, выражающая условие, от к рого зависит истинность… … Энциклопедия социологии
dic.academic.ru