Щелочь. Основания. Свойства оснований
2.jpg)
Нерастворимое основание: гидроксид меди
Основания — называют электролиты, в растворах которых отсутствуют анионы, кроме гидроксид-ионов (анионы — это ионы, которые имеют отрицательный заряд, в данном случае — это ионы OH — ). Названия оснований состоят из трёх частей: слова гидроксид, к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH)2). Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) — натриевая щелочь.
Едкий натр, гидроксид натрия, натриевая щелочь, каустическая сода
В основу классификации оснований положена их способность растворяться в воде. От растворимости в воде зависят некоторые свойства оснований. Так, основания, растворимые в воде, называют щелочью. К ним относятся гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH)2)), хотя на самом деле — это малорастворимое вещество белого цвета (гашенная известь).
Получение оснований
Получение оснований и щелочей может производиться различными способами. Для получения щелочи можно использовать химическое взаимодействие металла с водой.
Такие реакции протекают с очень большим выделением тепла, вплоть до воспламенения (воспламенение происходит по причине выделения водорода в процессе реакции).
2Na + 2H2O → 2NaOH + H2
 Негашенная известь — CaO
Негашенная известь — CaO
CaO + H2O → Ca(OH)2
Но в промышленности эти методы не нашли практического значения, конечно кроме получения гидроксида кальция Ca(OH)2.
Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока. При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде — хлор, при этом в растворе, где происходит электролиз, накапливается
KCl + 2H2O →2KOH + H2 + Cl2 (эта реакция проходит при пропускании электрического тока через раствор).
Нерастворимые основания осаждают щелочами из растворов соответствующих солей.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Свойства оснований
Щелочи устойчивы к нагреванию. Гидроксид натрия можно расплавить и расплав довести до кипения, при этом он разлагаться не будет. Щелочи легко вступают в реакцию с кислотами, в результате которого образуется соль и вода. Эта реакция ещё носит название — реакция нейтрализации
KOH + HCl → KCl + H2O
Щёлочи взаимодействуют с кислотными оксидами, в результате которой образуется соль и вода.
2NaOH + CO2 → Na2CO3 + H2O
Нерастворимые основания, в отличии от щелочей, термически не стойкие вещества. Некоторые из них, например, гидроксид меди, разлагаются при нагревании,
Cu(OH)2 + CuO → H2O
другие — даже при комнатной температуре (например, гидроксид серебра — AgOH).
Нерастворимые основания взаимодействуют с кислотами, реакция происходит лишь в том случае, если соль, которая образуется при реакции, растворяется в воде.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Щелочные металлы — такие металлы, которые при взаимодействии с водой образуют щелочь. К типичному представителю щелочных металлов относится натрий Na. Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности. Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH. Реакция протекает следующим образом:
2Na + 2H2O → 2NaOH + H2
Подобным образом ведут себя все щелочные металлы. Если перед началом реакцией в воду добавить индикатор фенолфталеин, а затем опустить в воду кусочек натрия, то натрий будет скользить по воде, оставляя за собой ярко розовый след образовавшейся щелочи (щелочь окрашивает фенолфталеин в розовый цвет)
Гидроксид железа
Гидроксид железа является основанием. Железо, в зависимости от степени его окисления, образует два разных основания: гидроксид железа, где железо может иметь валентности (II) — Fe(OH)2 и (III) — Fe(OH)3. Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.

Гидроксид железа 3-х валентного
Гидроксид железа (II) — белое студенистое вещество (осадок в растворе), которое обладает сильными восстановительными свойствами. К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
Гидроксид железа (III) имеет амфотерные свойства, но кислотные свойства у него выражены значительно слабее. Получить гидроксид железа (III) можно в результате химической реакции обмена между солью железа и щёлочью. Например
Fe2(SO4)3 + 6 NaOH → 3 Na2SO4 +2 Fe(OH)3
www.kristallikov.net
Щелочи: понятие, свойства и применение
Щелочи — это водорастворимые сильные основания. В настоящее время в химии принята  теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH −. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH −. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов.
Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
 Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
В магазине «ПраймКемикалсГрупп» вы найдете самые востребованные щелочи по выгодным ценам.
Едкий натр
Самая популярная и востребованная в мире щелочь.
Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали
Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия
Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция
Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития
Востребованное соединение в химпроме как сырье; в стекольной, керамической,  радиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
радиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария
Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
В аналитической химии применяются фиксаналы щелочей, которые можно купить у нас:
— стандарт-титр Калий гидроокись (Калий гидроксид) 0,1 Н
pcgroup.ru
Кислоты, щелочи и основания с точки зрения химии
Что же представляют собой кислоты, щелочи и основания с химической точки зрения? Читай внимательно и запоминай. Смотри не запутайся!
Что такое кислота?
Кислоты представляют собой молекулы, которые при растворении в воде высвобождают ион водорода. Ионы — это положительно и отрицательно заряженные частички, которые придают кислотам их свойства.
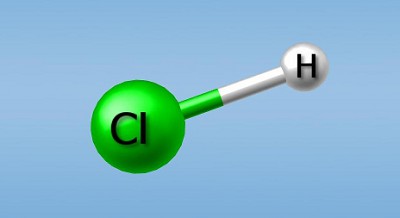
Молекула соляной кислоты
Давай рассмотрим этот процесс на примере соляной кислоты — HCI. Если соляную кислоту соединить с водой, она распадется на ион водорода (Н+) и ион хлора (CI ). Так как в составе молекулы воды также есть водород, то при распаде соляной кислоты общее количество ионов водорода в растворе увеличится.
А что происходит со щелочами при попадании в воду? В воде щелочи высвобождают гидроксид-ионы. Например, гидроксид натрия (NaOH) — щелочь. При соединении с водой он распадается на ионы натрия (Na+) и гидроксид-ионы (ОН ). Когда гидроксид-ионы встречаются с ионами водорода воды, общее количество ионов водорода в растворе сокращается.
Что такое основание?
Основание — это соединение, химически противоположное кислоте. В состав основания входят ионы металлов и связанные с ними гидроксид-ионы. Эти вещества способны присоединять ионы водорода (Н+) из кислоты. Когда основание смешивается с кислотой, оно полностью нейтрализует его свойства, а в результате реакции образуется соль.
Например, с точки зрения химии хорошо знакомая тебе зубная паста — это основание, которое нейтрализует кислоту, оставшуюся во рту после приема пищи.
ЗАПОМНИ! В связи с тем, что ионы существуют только в растворах, свои свойства кислоты проявляют также лишь в растворах.
Что такое щелочь?
Щелочи — это соединения, в состав которых входят ион металла и гидроксид-ион (ОН-). К щелочам химики относят гидроксиды щелочных и щелочноземельных металлов. Щелочи представляют собой вещества белого цвета, которые хорошо растворяются в воде. Более того, растворение всегда сопровождается очень активным выделением тепла. Щелочи вступают в реакцию с кислотами, образуя соль и воду.

Такая щелочь, как гидроксид натрия, используется для производства твердого мыла
Щелочи очень активны! Они способны поглощать из воздуха не только водяные пары, но и молекулы углекислого газа, сероводорода и т.д. Поэтому хранят щелочи в очень герметичной таре. Концентрированные щелочи разрушают стекло, а иногда даже фарфор. Если сравнивать щелочи с кислотами, то щелочи могут вызвать более сильные ожоги, так как они очень быстро проникают в ткань, и их практически невозможно смыть водой.

В кислотном растворе лакмусовая бумажка становится красной, в щелочном — синей
Шкала pH
Почему одни жидкости — кислоты, а другие — щелочи? Оказывается, все дело в типе ионов. Если в жидкости больше концентрация ионов водорода, такая жидкость является кислотой, а если гидроксид-ионов, то щелочью.
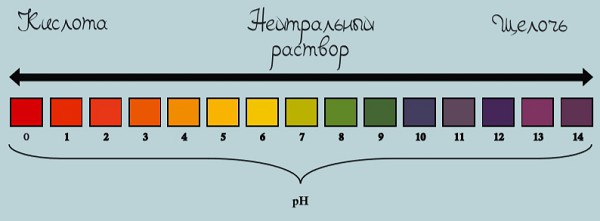
Шкала pH используется для измерения кислотности или щелочности раствора от 0 до 14.
Если pH раствора находится в пределах 0—7, то такой раствор считается кислотным, при этом раствор с pH = 0 — самый кислый. Растворы с pH в пределах 7—14 являются щелочами, при этом раствор с pH = 14 считается самым едким и опасным.
Если pH раствора равен 7, то такой раствор является нейтральным, так как концентрация ионов водорода равна концентрации гидроксид-ионов. Пример нейтрального раствора — чистая вода.
Что такое показатель pH?
В переводе с латинского pH (potentia hydrogeny) означает «сила водорода», т.е. активность ионов водорода в водном растворе.
Как химики определяют наличие воды в веществе?
Они берут бесцветный сульфат меди (CuSO4) и добавляют его в вещество. Если воды нет, то порошок остается бесцветным, однако даже при минимальном количестве воды он становится синим.
Концентрированные кислоты и щелочи
Ядовитые жидкости находятся не только в школьных лабораториях, они и вокруг нас. Это различные средства бытовой химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизельное топливо, аккумуляторные, тормозные и прочие технические жидкости, а на кухне — уксус и уксусная кислота.
Совершенно очевидно, что все вышеупомянутые вещества должны использоваться строго по назначению и в соответствии с определенными правилами, указанными на этикетке каждого средства. К сожалению, несоблюдение мер безопасности при работе с ядовитыми средствами может привести к серьезным проблемам со здоровьем: отравлению, различным повреждениям кожи и слизистых оболочек.
ВНИМАНИЕ! Обязательно запомни следующую информацию: кислоты с очень низким показателем pH (менее 2) и щелочи, pH которых выше 13, являются чрезвычайно опасными!
Кислоты и щелочи в природе
Ты уже успел убедиться в том, что вокруг нас — огромное количество кислот и щелочей. Молочные продукты, овощи и фрукты содержат лимонную, яблочную, щавелевую, уксусную, молочную, аскорбиновую и другие кислоты. Трудно поверить, но в косточках вишен и миндаля содержится (хоть и в минимальных количествах) такой сильный яд, как синильная кислота! Известно, что многие насекомые предпочитают защищаться разными кислотами. Никогда не задумывался, почему укусы обыкновенного крошечного муравья бывают такими болезненными? А все потому, что он вспрыскивает в ранку капельки муравьиной кислоты. Эту же кислоту выделяют и кое-какие виды гусениц, а тропические пауки и некоторые жуки защищаются от врагов при помощи уксусной и серной кислот.
ОСТОРОЖНО! Как правило, концентрированные кислоты и щелочи есть во всех школьных каби нетаххимии, и пользоваться ими можно только под руководством учителя.
Применение щелочей
Щелочи широко применяются в различных отраслях промышленности, медицине и быту. Например, каустическая сода используется для растворения жиров и входит в состав многих моющих средств, применяется при производстве целлюлозы, масел, дизельного топлива. Также щелочи используют для изготовления мыла, искусственных волокон, различных красителей и т.д.
Кислоты в почве
Оказывается, кислоты есть и в почвах, а способность почвы проявлять свойства кислот называется кислотностью. Этот показатель зависит от наличия в земле ионов водорода. От кислотности почвы зависят рост и развитие растений. Большинство из них предпочитает нейтральные или близкие к ним почвы. Однако есть ряд растений, которые отлично себя чувствуют именно на кислотных почвах, например рододендроны, гортензии, азалии. Некоторые сорта гортензии могут менять цвет бутонов в зависимости от условий выращивания и кислотности почвы. Ученые выяснили, что на цвет бутонов влияет наличие алюминия!

Большинство садовых почв характеризуется достаточным содержанием этого элемента. В кислой среде соединения алюминия превращаются в растворимые и становятся доступными для растений, поэтому и вырастают бутоны голубого цвета. В нейтральной или щелочной среде алюминий находится в виде нерастворимых соединений, поэтому он и не поступает в растения. В результате на таких почвах растут бутоны розового цвета.
Кислоты и щелочи в нашем организме
Для переваривания пищи организм использует желудочный сок, в состав которого входят соляная кислота и различные ферменты. Иногда, особенно после переедания, мы можем почувствовать боль в желудке. Чаще всего для снятия неприятных ощущений достаточно принять антацидный, или противокислотный, препарат, основное действие которого направлено на нейтрализацию соляной кислоты в желудке. Как правило, все антациды — щелочи, и именно они нейтрализуют повышенную активность кислот.
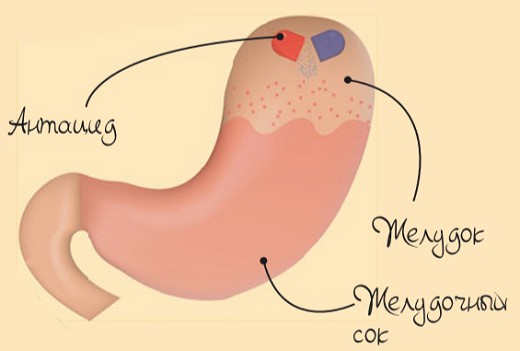
Действие антацидных препаратов
Поделиться ссылкой
sitekid.ru
Кислоты, основания и щелочи

 Слово «кислота» происходит от латинского слова «кислый». Некоторые продукты с нашего стола, к примеру, уксус или лимонный сок, — кислоты. Основание — соединение, химически противоположное кислоте, и при реакции с кислотой дает нейтральное соединение — соль. Растворимые в воде основания называются щелочами. В цитрусовых плодах — грейпфрутах, апельсинах лимонах — содержатся лимонная и аскорбиновая кислоты. Пчелиный яд – кислота. Нейтрализовать её можно основанием. В цитрусовых плодах – грейпфрутах, апельсинах, лимонах – содержится лимонная и аскорбиновая кислоты.
Слово «кислота» происходит от латинского слова «кислый». Некоторые продукты с нашего стола, к примеру, уксус или лимонный сок, — кислоты. Основание — соединение, химически противоположное кислоте, и при реакции с кислотой дает нейтральное соединение — соль. Растворимые в воде основания называются щелочами. В цитрусовых плодах — грейпфрутах, апельсинах лимонах — содержатся лимонная и аскорбиновая кислоты. Пчелиный яд – кислота. Нейтрализовать её можно основанием. В цитрусовых плодах – грейпфрутах, апельсинах, лимонах – содержится лимонная и аскорбиновая кислоты.Кислоты
Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в воде. Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»). Именно ионы придают кислотам их свойства, но существовать они могут только в растворе. Следовательно, свойства кислот проявляются исключительно в растворах. Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор. Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным.
 Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».
Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
Основания и щелочи
Основание — это соединение, химически противоположное кислоте. Щелочью называется основание, растворимое в воде. Смешиваясь с кислотой, основание нейтрализует её свойства, и продуктом реакции является соль. Зубная паста — основание, нейтрализующее кислоту, оставшуюся во рту после приема пищи. Бытовые жидкие очистители содержат щелочи растворяющие грязь. Желудочные таблетки содержат щелочи, нейтрализующие обращающуюся при несварении желудка кислоту. С точки зрения химии основания — это вещества, способные присоединять ионы водорода (Н+) из кислоты. Ион оксида (О2-) и ион гидроксида (ОН—) могут соединяться с ионами водорода в кислоте. Значит, оксиды металлов, например оксид магния, и гидроксиды металлов, например гидроксид натрия (едкий натр), являются основаниями. Гидроксид натрия (NаОН) состоит из натрия, кислорода и водорода. Гидроксид магния (Мg(ОН)2) состоит из магния, кислорода и водорода.
Многие основания и щёлочи — очень едкие вещества и потому опасны: они разъедают живые ткани. Жидкие очистители содержат щелочи, растворяющие грязь. В бумажной промышленности гидроксид натрия растворяет древесную смолу и освобождает волокна целлюлозы, из которых производится бумага. Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.
Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
 Кислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
Кислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.www.polnaja-jenciklopedija.ru
Основания (щелочи)
Основания (щелочи):
Снова обратимся к крайне полезной табличке с рядом активности металлов
Металлы левее магния (Mg), вытесняют водород из воды даже при комнатной температуре.
Например, реакция с натрием:
2Na + 2H2O = 2NaOH + H2↑
Попадая в воду, натрий быстро уменьшается в размерах, выделяется много теплоты, вдобавок вполне можно ожидать взрыв и пламя!
Получаем NaOH (гидроксид натрия) и водород.
Гидроксид переводится, как «оксид, присоединивший воду».
В ходе реакции вода выступила в роли кислоты для металла, так как один атома водорода заместился на металл. Металл соединился с водным остатком OH — гидроксильной группой (гидроксогруппой или просто гидроксилом). Т.к. H — одновалентен, то и OH- одновалентен и ему было достаточно одного атома натрия.
Раствор гидроксида натрия стал мылким на ощупь.
Используем индикатор фенолфталеин, который станет малинового цвета, в полученной жидкости. Метилоранж станет желтым, а лакмус — синим.
Таким образом, делаем вывод, что у нас получилась щелочь — едкий, мылкий раствор. Слово произошло от старинного «щёлок» — мылкий раствор из золы для стирки и мытья.
В чистом виде щелочи твердые, но очень хорошо поглощают воду (гидроскопичны), поэтому быстро расплываются прямо на глазах. Кроме гидроксида кальция (гашеной извести), используется в строительстве и малорастворимом в воде.
Щелочи разъедают живое (кожу, дерево,…). Поэтому вместо гидроксида натрия, можно сказать едкий натрий и вас поймут.
При попадании на кожу, необходимо быстро смыть большим количеством воды из-под крана, иначе на коже появиться болезненный химический ожог в виде язвы. После промывания кожу можно протереть раствором уксусной или борной кислоты, так как кислота и щелочь взаимно нейтрализуются.
Читайте продолжение о щелочах в химии
Редактировать этот урок и/или добавить задание и получать деньги постоянно* Добавить свой урок и/или задания и получать деньги постоянноДобавить новость и получить деньги
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
uchilegko.info
Ответы@Mail.Ru: что такое щелочь?
Щёлочи — гидроксиды щелочных и щёлочноземельных металлов. Все щелочи являются основаниями и потому иногда не совсем правильно щелочью или щелочным веществом называются любые основания. Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и расворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Кроме того, едкие щёлочи растворимы в этаноле и метаноле. К щелочам относятся гидроксиды металлов подгрупп Iа и IIа периодической системы, например NaOH(едкий натр) , KOH (едкое кали) , Ba(OH)2 (едкий барит) . Едкие щелочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH. Поглощают h3O и CO2 из воздуха. Щёлочи широко применяются в промышленности. Важное химическое свойство щелочей — способность образовывать соли в реакции с кислотами. Получают путём электролиза хлоридов щелочных металлов или действием воды на оксиды щелочных металлов. Примеры реакций: NaOH + HCl = NaCl +h3O
Щёлочь — вещестово, состоящее из металла и группы OH (гидроксогруппы) . Щёлочь нейтрализет кистолу с получением воды и соли.
едкое вещество потипу кислоты
Иди на х*й св*н*я тупая!
Гидроксид натрия (лат. Natrii hydroxidum; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь) — самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется около 1860 миллионов тонн едкого натра. Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разъедать кожу, бумагу, и другие органические вещества, вызывая сильные ожоги. До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 г. французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda из рода Солянка, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
щелочью называется гидроксид, образованный ЩЕЛОЧНЫМ металлом и остатком -OH. ЩМе + OH. щелочные металлы находятся в первой группе главной подруппы ПСХЭ ( просто все вещества, стоящие в ряд ниже римской цифры 1 в периодической системе химических элементов Д. Менделеева)
Вот что это: <a rel=»nofollow» href=»https://youtu.be/TcwvbllpHgk» target=»_blank»>https://youtu.be/TcwvbllpHgk</a>
щелочь это не растворимые в воде основание
Щёлочи — гидроксиды щелочных и щёлочноземельных металлов. Все щелочи являются основаниями и потому иногда не совсем правильно щелочью или щелочным веществом называются любые основания. Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и расворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Кроме того, едкие щёлочи растворимы в этаноле и метаноле. К щелочам относятся гидроксиды металлов подгрупп Iа и IIа периодической системы, например NaOH(едкий натр) , KOH (едкое кали) , Ba(OH)2 (едкий барит) . Едкие щелочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH. Поглощают h3O и CO2 из воздуха. Щёлочи широко применяются в промышленности. Важное химическое свойство щелочей — способность образовывать соли в реакции с кислотами. Получают путём электролиза хлоридов щелочных металлов или действием воды на оксиды щелочных металлов. Примеры реакций: NaOH + HCl = NaCl +h3O
Щёлочи — гидроксиды щелочных и щёлочноземельных металлов. Все щелочи являются основаниями и потому иногда не совсем правильно щелочью или щелочным веществом называются любые основания. Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и расворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Кроме того, едкие щёлочи растворимы в этаноле и метаноле. К щелочам относятся гидроксиды металлов подгрупп Iа и IIа периодической системы, например NaOH(едкий натр) , KOH (едкое кали) , Ba(OH)2 (едкий барит) . Едкие щелочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH. Поглощают h3O и CO2 из воздуха. Щёлочи широко применяются в промышленности. Важное химическое свойство щелочей — способность образовывать соли в реакции с кислотами. Получают путём электролиза хлоридов щелочных металлов или действием воды на оксиды щелочных металлов. Примеры реакций: NaOH + HCl = NaCl +h3O
если щелочь попадет на кожу то надо промыть под струёй воды пару минут и нейтрализовать кислотой
Короче это сода? И из соды и лимонной кислоты можно сделать батарейку?
Щёлочи — гидроксиды щелочных, щёлочноземельных металлов. К щелочам относят хорошо растворимые в воде основания. При диссоциации щёлочи образуют анионы OH− и катион металла.
Щёлочи (в русском языке происходит от слова «щёлок», возможно, производное от того же корня, что и др. -исл. «skola» — «стирать») — гидроксиды щелочных, щёлочноземельных металлов и некоторых других элементов, например, таллия
Щёлочь-вещество состоящее из оснований и гидроксогрупп, они хорошо растворяются в воде
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)
touch.otvet.mail.ru
Основания — классификация, получение и свойства » HimEge.ru
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
Взаимодействие активных металлов с водой (только щелочи)
2Na + 2H2O = 2NaOH + H2,
Ba + 2H2O = Ba(OH)2 + H2,
Взаимодействие основных оксидов с водой (только щелочи)
Na2O + H2O = 2NaOH,
Взаимодействие солей со щелочами (малорастворимые основания)
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,
Cu2+ + 2OH— = Cu(OH)2,
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl,
Al3+ + 3OH— = Al(OH)3.
Электролиз водных растворов солей (промышленный способ)
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
NaOH = Na+ + OH—.
Многоосновные основания диссоциируют ступенчато:
Ba(OH)2 = BaOH+ + OH—,
BaOH+ = Ba2+ + OH—,
суммарное уравнение:
Ba(OH)2 = Ba2+ + 2OH—.
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
OH— + H+ = H2O.
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
Ba(OH)2 + HCl = BaOHCl + H2O,
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
3) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O,
4) Взаимодействие с солями
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4,
2Fe3+ + 6OH— = 2Fe(OH)3.
5) Термическое разложение
Cu(OH)2 = CuO + H2O,
2Fe(OH)3 = Fe2O3 + 3H2O .
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
2LiOH = Li2O + H2O.
6)Взаимодействие с неметаллами
6KOH + 3S = K2SO3 + 2K2S + 3H2O,
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
himege.ru