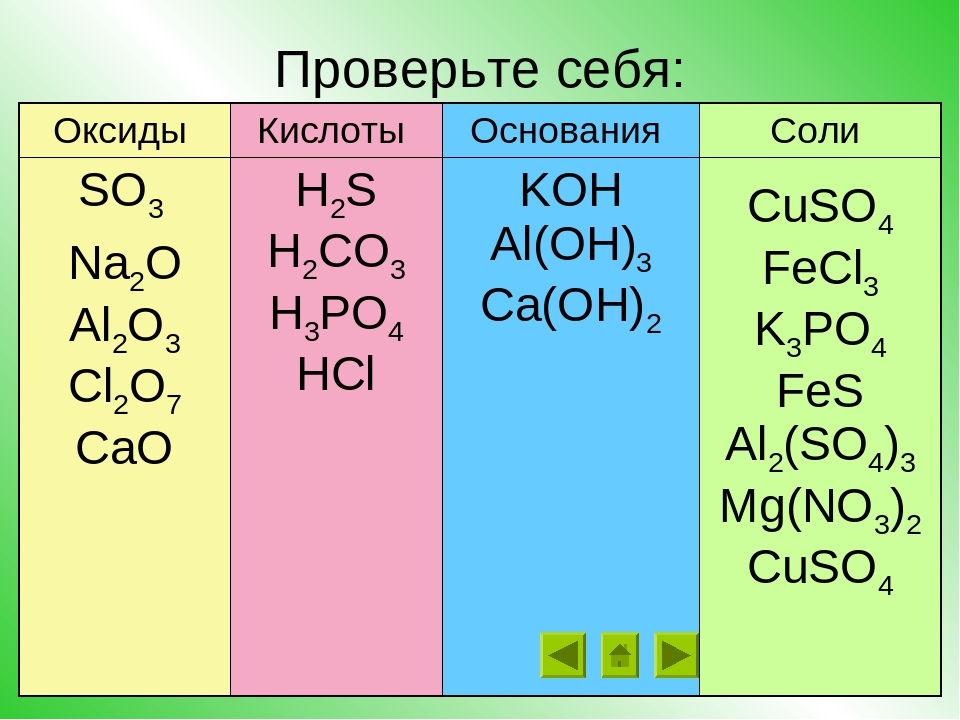
Основания, кислоты и соли в теории электролитической диссоциации
КИСЛОТЫ, ОСНОВАНИЯ и соли с ТОЧКИ ЗРЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ [c.173]Кислоты, основания и соли с точки зрения теории электролитической диссоциации (ТЭД) [c.123]
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима. В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства оснований.
Кислотами с позиций теории электролитической диссоциации называются вещества, диссоциирующие в растворах с образованием ионов водорода, С точки зрения протонной теории кислот и оснований к кислотам относятся вещества, способные отдавать ион водорода, т, е. быть донорами прогонов,, Наиболее характерное химическое свойство кислот — их способность реагировать с основаниями (а также с основными и амфотерными оксидами) с образованием солей, например [c.31]
Соли рассматривают обычно как продукты замены атома водорода,в кислотах на атомы металлов или гидроксильных групп в основаниях на кислотные остатки. С точки зрения теории электролитической диссоциации солями называются сложные вещества, которые при растворении в воде (или при плавлении) дают в растворе катионы металлов и анионы кислот.
После Аррениуса было показано, что определение кислот, солей и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ. [c.116]
Теория электролитической диссоциации позволила дать научное определение понятиям кислота , основание , буферная емкость раствора , создать теорию индикаторов, объяснить процессы ступенчатой диссоциации, гидролиза солей и т. д. Ниже рассмотрены некоторые примеры приложения это[«1 теории к химическому равновесию в растворах. [c.38]
Электролитическая диссоциация. Мы отметили две особенности кислот, солей и оснований 1) своеобразие их химических реакций в водном растворе и 2) способность этих растворов подвергаться электролизу. Эти особенности кислот, солей и оснований хорошо объясняются теорией электролитической диссоциации. Основное положение этой теории заключается в том, что
Дальнейшее развитие химии и использование неводных растворителей привело к необходимости объяснить процессы, протекающие в этих растворителях. Например, хлорид аммония, ведущий себя как соль в водном растворе, при растворении в жидком аммиаке проявляет свойства кислоты, растворяя металлы с выделением водорода. Мочевина С0(КНг)2, растворяясь в безводной уксусной кислоте, проявляет свойства основания, в жидком аммиаке — свойства кислоты, а ее водные растворы нейтральны. Все эти факты нельзя было объяснить на основании теории электролитической диссоциации Аррениуса. В связи с этим определение кислот и оснований были пересмотрены. [c.75]
Например, хлорид аммония, ведущий себя как соль в водном растворе, при растворении в жидком аммиаке проявляет свойства кислоты, растворяя металлы с выделением водорода. Мочевина С0(КНг)2, растворяясь в безводной уксусной кислоте, проявляет свойства основания, в жидком аммиаке — свойства кислоты, а ее водные растворы нейтральны. Все эти факты нельзя было объяснить на основании теории электролитической диссоциации Аррениуса. В связи с этим определение кислот и оснований были пересмотрены. [c.75]
Сванте Аррениус (1859—1927), профессор университета в Стокгольме и директор Нобелевского института. Предложил теорию, объясняющую свойства растворов солей, кислот и оснований и получившую название теории электролитической диссоциации. Аррениусу принадлежит также ряд исследований по астрономии, космической физике и в области приложения физико-химических законов к биологическим процессам. [c.233]
На основе теории электролитической диссоциации дайте определения понятиям кислота, основание, соль. [c.77]
[c.77]
В качестве растворителя чаще всего применяют воду, поэтому рассмотрение кислот, оснований и солей ограничим только водными растворами, для которых целиком сохраняют справедливость определения кислот и оснований, вытекающего из теории электролитической диссоциации Аррениуса. [c.126]
На основе теории электролитической диссоциации даются определения и описываются свойства кислот, оснований и солей.
Ионные реакции и уравнения. Согласно теории электролитической диссоциации, реакции между кислотами, основаниями и солями в водных растворах протекают между ионами, на которые распадаются молекулы этих веществ. [c.209]
Основы теории электролитической диссоциации. В 1887 г-Вант-Гофф установил, что определенное экспериментально осмотическое давление в растворах солей, кислот и оснований превышает вычисленное по уравнению (2.59). Подобные отклонения измеренных величин от вычисленных по соответствуюш,им уравнениям наб. 5юдаются в сторону повышения для температуры кипения и в сторону понижения для температуры отвердевания этих растворов. Так, например, молекулярная масса Na l равна 58,5, а на основании криоскопических измерений она оказалась равной при-щ мерно 30. Не зная, чем можно объяснить эти отклонения, но стремясь сделать соответствующие уравнения пригодными для этих растворов, Вант-Гофф ввел в них поправочный множитель i, названный изотоническим коэффициентом . Подставляя коэффициент i в уравнение для расчета осмотического давления и в уравнения законов Рауля, получаем соотношения, пригодные для описания разбавленных растворов всех веществ, в том числе и для растворов солей, кислот и оснований [c.246]
5юдаются в сторону повышения для температуры кипения и в сторону понижения для температуры отвердевания этих растворов. Так, например, молекулярная масса Na l равна 58,5, а на основании криоскопических измерений она оказалась равной при-щ мерно 30. Не зная, чем можно объяснить эти отклонения, но стремясь сделать соответствующие уравнения пригодными для этих растворов, Вант-Гофф ввел в них поправочный множитель i, названный изотоническим коэффициентом . Подставляя коэффициент i в уравнение для расчета осмотического давления и в уравнения законов Рауля, получаем соотношения, пригодные для описания разбавленных растворов всех веществ, в том числе и для растворов солей, кислот и оснований [c.246]
Приведем в соответствии с теорией электролитической диссоциации определения кислот, оснований и солей. [c.62]
В 1887 г. С. Аррениусом была создана теория электролитической диссоциации, по которой кислотам и основаниям можно дать следующие определения. Кислоты — это электролиты, отщепляющие в водном растворе ионы H» «, а основания — электролиты, отщепляющие в растворе ионы ОН . В результате ассоциации этих ионов между кислотой и основанием происходит реакция нейтрализации с образованием воды и соответствующей соли.
Кислоты — это электролиты, отщепляющие в водном растворе ионы H» «, а основания — электролиты, отщепляющие в растворе ионы ОН . В результате ассоциации этих ионов между кислотой и основанием происходит реакция нейтрализации с образованием воды и соответствующей соли.
Согласно теории электролитической диссоциации все общие характерные свойства кислот — кислый вкус, изменение цвета индикаторов, взаимодействие с основаниями, основными оксидами, солями — обусловлены присутствием ионов водорода Н . [c.74]
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.) [c.179]
К началу XX в. теория электролитической диссоциации достигла больших успехов. На ее основе были объяснены многочисленные и разнообразные экспериментальные данные по электропроводности растворов, осмотическому давлению, температурам замерзания и другим физико-химическим свойствам растворов. Однако ряд экспериментальных данных теория объяснить не могла. Так, константа диссоциации электролита, выражаемая уравнением типа (152.4), в широком интервале концентраций изменялась. Особенно резкая концентрационная зависимость наблюдалась у водных растворов неорганических кислот, оснований и их солей (h3SO4, НС], NaOH, K l и т. п.). Разные экспериментальные методы часто приводили к неодинаковым значениям степени диссоциации электролита в одних и тех же условиях. [c.431]
Однако ряд экспериментальных данных теория объяснить не могла. Так, константа диссоциации электролита, выражаемая уравнением типа (152.4), в широком интервале концентраций изменялась. Особенно резкая концентрационная зависимость наблюдалась у водных растворов неорганических кислот, оснований и их солей (h3SO4, НС], NaOH, K l и т. п.). Разные экспериментальные методы часто приводили к неодинаковым значениям степени диссоциации электролита в одних и тех же условиях. [c.431]
Диссоциация кислот, оснований, солей. Определение кислот, оснований и солей дается с точки зрения теории электролитической диссоциации. [c.153]
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. [c.109]
Приведенные реакции соответствуют образованию амфотерного соединения — кислоты, основания и соли, так как кислоты являются, например, в воде солями гидроксония, а основания — солями гидроксила.
В разделе 2 вы уже познакомились с классификацией неорганических веществ, с номенклатурой оксидов, оснований, кислот, амфотерных гидроксидов и важнейших типов солей. Ниже рассматриваются общие химические свойства и способы получения этих важнейших классов неорганических веществ с позиций тех теоретических представлений, которые были получены вами при изучении предыдущих разделов, в частности, с позиции теории электролитической диссоциации. В заключение вскрывается генетическая связь между различными классами неорганических веществ. [c.225]
Согласно классической теории электролитической диссоциации С.
 Аррениуса кислоты, соли, основания (электролиты) в водных и некоторых неводных растворах существуют в виде независимых друг от друга частиц — ионов, образовавшихся при распаде молекул. Такие частицы (катионы и анионы) существуют в растворах независимо от того, наложено или нет на раствор электрическое напряжение. С. Аррениус ввел представление о частичной диссоциации электролитов в растворах. [c.191]
Аррениуса кислоты, соли, основания (электролиты) в водных и некоторых неводных растворах существуют в виде независимых друг от друга частиц — ионов, образовавшихся при распаде молекул. Такие частицы (катионы и анионы) существуют в растворах независимо от того, наложено или нет на раствор электрическое напряжение. С. Аррениус ввел представление о частичной диссоциации электролитов в растворах. [c.191] Выше были рассмотрены понятия кислота и основание с позиции теории электролитической диссоциации (см. 5.6). Однако эта теория не объясняет многих явлений, особенно тех, которые наблюдаются в нсводиых растворах. В водном растворе хлорид аммония ведет себя как соль, диссоциируя на ионы н С -, а е
В пользу такой трактовки реакции нейтрализации свидетельствует тот факт, что тепловой эффект ее для сильных кислот и сильных оснований практически один и тот же (57,3 кДж/моль). Однако введенное Аррениусом и Оствальдом определение кислот и оснований не является достаточно общим. Например, из формулы аммиака NHз, с точки зрения теории электролитической диссоциации, никак не следует, что это вещество способно проявлять основные свойства, особенно в отсутствие воды. Однако известно, что газообразный аммиак вступает в реакцию нейтрализации с газообразным хлористы.м водородом с образованием средней соли Nh5 1. [c.94]
Например, из формулы аммиака NHз, с точки зрения теории электролитической диссоциации, никак не следует, что это вещество способно проявлять основные свойства, особенно в отсутствие воды. Однако известно, что газообразный аммиак вступает в реакцию нейтрализации с газообразным хлористы.м водородом с образованием средней соли Nh5 1. [c.94]
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. Рассмотрим в свете теории элек Тролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов. [c.243]
Протонная теория кислот и оснований. Теория электролитической диссоциации неприменима к взаимодействиям, не сопровождающимся диссоциацией на ионы. Например, аммиак, реагируя с безводным фтористым водородом, образует соль фторид аммония МНз + + НР = ЫН4р. Аммиак, не имея в своем составе гидроксильной группы, ведет себя как основание. [c.170]
Следует сказать, что теория кислот и оснований Аррениуса получила свое дальнейшее развитие в XX в. Было по-иному рассмотрено представление о природе кислотно-основного взаимодействия. Так, например, с позиций теории электролитической диссоциации аммиак Nh4 никак нельзя назвать основанием. В то же время газообразный аммиак вступает в реакцию с хлоро-водородом с образованием соли Nh5 I, т. е. проявляет основные свойства. Поэтому было дано следующее определение кислоты и основания [c.91]
Было по-иному рассмотрено представление о природе кислотно-основного взаимодействия. Так, например, с позиций теории электролитической диссоциации аммиак Nh4 никак нельзя назвать основанием. В то же время газообразный аммиак вступает в реакцию с хлоро-водородом с образованием соли Nh5 I, т. е. проявляет основные свойства. Поэтому было дано следующее определение кислоты и основания [c.91]
Представления о кислотах и основаниях, основанные на теории электролитической диссоциации, применимы лишь при условии, что веш,ества реагируют в водном растворе. Однако эти представления не объясняют процессов, протекающих в неводных растворах. Так, например, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы NH и С1 ), то в жидком аммиаке он проявляет свойства кислоты — растворяет металлы с выделением водорода. Мочевина OiNHa) в жидком аммиаке проявляет свойства кислоты, в безводной уксусной кислоте — свойства основания, а в водном растворе она нейтральна. Как основание ведет себя азотная кислота, растворенная в жидком фтороводороде или в безводной серной кислоте. [c.189]
Как основание ведет себя азотная кислота, растворенная в жидком фтороводороде или в безводной серной кислоте. [c.189]
Кислоты, основания, соли в свете электролитической диссоциации. 9-й класс
Цели урока:
- Организовать деятельность учащихся по восприятию, осмыслению, первичному запоминанию таких понятий как: кислоты – электролиты, основания-электролиты, соли-электролиты.
- Развивать умения выделить главное, существенное в изучаемом материале.
- Обеспечить закрепление знаний и способов деятельности учащихся по составлению уравнений реакций ионного обмена, в молекулярном и ионном видах.
Ход урока
I. Организационный момент.
II. Подготовка учащихся к работе на основном этапе
Упр. №1. “Химический дождь”. (См. Приложение 1. Презентация к
уроку). Между какими ионами произойдёт
взаимодействие? Составьте уравнения реакций.
“Химический дождь”. (См. Приложение 1. Презентация к
уроку). Между какими ионами произойдёт
взаимодействие? Составьте уравнения реакций.
Пятиминутка. (Приложение 2) Отметьте в таблице знаком “+” пары веществ, между которыми возможны реакции ионного обмена, идущие до конца. 1 вариант – с образование осадка, 2 вариант – с образованием газообразного вещества и воды.
| Реагирующие вещества | K2CO3 | KOH | AgNO3 | FeCl3 | HNO3 |
| NaOH | |||||
| CuCl2 | |||||
| HCl |
III.
 Усвоение новых знаний и способов действия
Усвоение новых знаний и способов действия Рассмотрим в свете теории ЭД свойства веществ, растворы которых обладают электропроводностью: кислоты, основания и соли.
– Дайте определение кислот с точки зрения теории ЭД.
– Озвучьте схему, приведите примеры.
Упр. №2. Составьте уравнения возможных реакций растворов кислот с веществами. Охарактеризуйте их с позиции теории ЭД.
a) |
HCl + |
—>Zn |
b) |
HCl + |
—>Cu(OH)2 |
c) |
HCl + |
—>Na2CO3 |
—>Cu |
—>KOH |
—>AgNO3 |
||||||
—>Ca |
—>Al(OH)3 |
—>Fe(NO3)3 |
||||||
d) |
H2SO4 + |
—>Mg |
e) |
H2SO4 + |
—>Zn(OH)2 |
f) |
H2SO4 + |
—>K2CO3 |
—>Zn |
—>NaOH |
—>NaNO3 |
||||||
—>Cu |
—>Fe(OH)3 |
—>BaCl2 |
Первая группа свойств кислот обусловлена
наличием в них иона водорода.
Как можно доказать наличие данного иона? (индикаторами).
Лабораторный опыт №1.
Проверьте действие универсального индикатора на растворимые и нерастворимые кислоты.
Кислота |
Цвет универсального индикатора |
Вывод |
| Соляная кислота | ||
| Серная кислота | ||
| Угольная кислота | ||
| Кремневая кислота | Не изменяет цвет индикатора (т.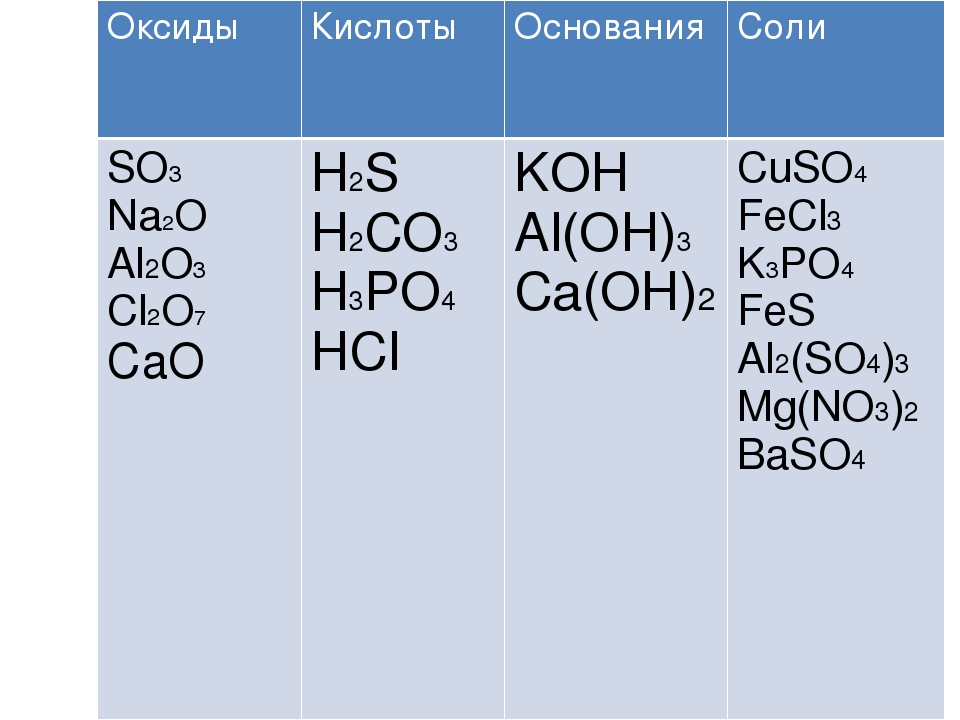 к. нет
иона водорода) к. нет
иона водорода) |
Вторая группа свойств кислот обусловлена наличием кислотного остатка в составе кислот. По ним можно отличать кислоты между собой.
Лабораторный опыт №2.
Проведите качественные реакции на некоторые кислоты.
Формула кислоты |
Реагент |
Продукт |
НСl |
Ион Ag+ (растворимые соли серебра) |
AgCl, белый творожистый осадок |
H2CO3 |
Известковая вода Ca(OH)2 |
CaCO3, помутнение прозрачного раствора известковой воды |
H2SO4 |
Ион Ba2+ (растворимые соли бария, щелочь) |
BaSO4,белый осадок |
– Дайте определение оснований с точки
зрения теории ЭД.
– Озвучьте схему, приведите примеры.
Упр. №3. “Накормите лягушку”. Какие “комары” будут “съедены” каждой из “лягушек”? Составьте уравнения реакций в молекулярном и ионном виде.
— Сформулируете определение солей с точки зрения ТЭД.
— Как диссоциируют средние (кислые, основные) соли?
Составьте уравнения диссоциации солей:
MgCl2 <—>
Fe2(SO4)3 <—>
Основные химические свойства солей. Все три типа реакций являются обменными, поэтому идут до конца, если образуется осадок, газ или слабый электролит.
Демонстрационный эксперимент:
IV. Закрепление новых знаний и способов действия.

Упр. № 4. “Химический баскетбол”. Сколько мячей попадёт в корзину? Составьте уравнения реакций.
V. Первичный контроль новых знаний и способов действия.
Упр. №5. “Часы с кукушкой”. Кукушка начинает куковать всякий раз, когда между веществом, указанным на стрелке часов, и веществом, соответствующим цифре на циферблате, возможна реакция. Напишите уравнения возможных реакций . 1 вариант – нечётные номера, 2 вариант – чётные номера.
VI. Информация о домашнем задании.
Прочитать §13-15. уметь объяснять основные понятия, иллюстрировать их примерами, упр. 4 стр.44, упр. 3 стр.48, упр.2,3 стр.50.
VII. Рефлексия.- Какие из изученных сегодня вопросов вызвали наибольшие трудности при усвоении? Как вы думаете почему?
- Что на уроке вам понравилось? Почему?
- Не забудьте поставить ваш кораблик к соответствующему острову в “Океане настроений”
Литература.
- Кузнецова Н.Е. и др. Химия: Учебник для учащихся 9 класса общеобразовательных учреждений.– М.: Вентана-Граф, 2012. – 320с.: ил.
- Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8-9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.
- Зуева М.В., Гара Н.Н. Школьный практикум. Химия 8-9 кл. – М.: Дрофа, 1999.– 128с.: ил.
Решение упражнений по теме «Оксиды, основания, кислоты, соли. Их состав, и названия»
Сценарий урока
Решение упражнений по теме «Оксиды, основания, кислоты, соли. Их состав, и названия»
Цель: Повторить состав, названия оксидов, кислот, оснований, солей.
Развивать умение учащихся применять теоретические знания при решении упражнений.
Формировать научное мировоззрение у учащихся.
Ход урока
I Организационный этап
II Актуализация опорных знаний
Беседа
Назовите основные классы неорганических соединений.

Какие вещества называются а) оксидами б) кислотами в) основаниями г) солями
Сравните состав а) оснований и солей
б) кислот и солей
III Решение упражнений
Упражнение 1: Выписать отдельно окисления, кислоты, основания, соли. Назовите вещества.
Н3РО4 Cu(OH)2 Na2O AlCl3 H2CO3 Mg(NO3)2 SO3 KOH
Беседа
В результате каких реакций образуется оксид
Упражнение 2: Закончите уравнения реакций. Назовите продукты реакций.
а) Ag + O2 в) Ca + O2
б) P + O2 г) Al + O2
Упражнение 3: Химический диктант
КОН Cu(OH)2 Ba(OH)2 Fe(OH)3 NaOH Al(OH)3
1.Укажите названия оснований (устно)
2. На какие группы делятся все основания?
На какие группы делятся все основания?
3.Подчеркните щелочи, нерастворимые основания
4.Укажите валентность металлов в основаниях.
Упражнение 4: Химический диктант
Н3РО4 HCl HNO3 H2CO3 H2SO4
Беседа
1.Дайте название веществам
2.По каким признакам можно классифицировать кислоты
3.Охарактеризуйте каждую кислоту по составу и основаниям
Проверка д/з: тестовые задания с.152
4.Как распознавать растворы кислоты и щелочи?
5.Что такое индикатор?
Упражнение 5: (устно) Распознать с помощью индикатора растворы кислоты, щелочи и Н2О
Беседа
1.Что является продуктом взаимодействия основания и кислоты?
2.Что называется солью?
Проверка д/з №3 с.160
Упражнение 6: Дайте название солям:
MgSO4 MnCl2 Ca3(PO4)2 Zn(NO3)2 BaCO3
C помощью таблицы растворимости найдите растворимые соли и подчеркните их формулы.
Упражнение 7: Химический диктант
Na3PO4 BaSO4 FeCl3 Al(No3)3 K2CO3
Самостоятельная работа
Укажите класс соединений и назовите вещества
I HNO3 Al2O3 Mg(OH)2 BaCl2
II Ca(OH)2 Na2SO4 HCl MgOНаписать формулы соединений
I гидроксид бария II серная кислота
фосфат калия гидроксид железа (II)
угольная кислота карбонат натрия
оксид фосфата (V) оксид калия
Задача: Какое количество вещества составляет гидроксид меди(II) массой 4,9г?
Домашнее задание: повторить §40,41,44,46; письменно №2(с.159) (кроме NaH SO4 Ca(HCO3)2)
Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Важнейшие классы неорганических веществ. Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коды баннеров проекта DPVA.ru Начинка: KJR Publisiers Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Реакция соли с основанием происходит, если.
 mp4
mp4 Здравствуйте, Дорогие мои!!!
Урок 5 –это продолжение темы «Определение возможности осуществления химических реакций».
На этом уроке мы с вами рассмотрим взаимодействие Соли с Основанием и условия, при которых реакции могут проходить. Мы рассмотрели пять правил на первом, втором и третьем, четвёртом уроках, сегодня:
Определение возможности осуществления химических реакций.
Урок – 5 Взаимодействие соли с
основанием.
Правило 6
Реакция соли с основанием происходит, если оба исходных вещества растворимы или мало растворимы в воде, а один из продуктов реакции нерастворим или мало растворим в воде.
Соль + основание → новая соль + новое основание
- Исходные соль и основание растворимы или малорастворимы
- Хотя бы один из продуктов нерастворимое или малорастворимое вещество
- Задание 15
Определите, можно ли провести реакцию между веществами, формулы которых: Fe(NO3)2 и KOH
Решение
Определите, к каким классам принадлежат реагирующие вещества
Соль основание
Fe(NO3)2 + KOH →
2. Вспомните условия, при котором возможна реакция соли
с основанием
Вспомните условия, при котором возможна реакция соли
с основанием
Соль + основание → новая соль + новое основание
1.Исходные соль и основание растворимы или малорастворимы
2.Хотя бы один из продуктов нерастворимое или малорастворимое
Посмотрите в таблице растворимости.Fe(NO3)2 + KOH → KNO3 + Fe(OH)2
растворима растворима→ растворима нерастворима
5. Сделайте вывод о возможности проведения реакции
Реакция между веществами, формулы которых: Fe(NO3)2 и KOH , осуществима, так как выполняются оба условия.
Задание 16
Определите, можно ли провести реакцию между веществами, формулы которых: AgCl и NaOH
Решение
1. Определите, к каким классам принадлежат реагирующие
вещества
Определите, к каким классам принадлежат реагирующие
вещества
Основание соль
NaOH + AgCl →
2.Вспомните условия, при котором возможна реакция соли с основанием
Соль + основание → новая соль + новое основание
1.Исходные соль и основание растворимы или малорастворимы
2.Хотя бы один из продуктов нерастворимое или малорастворимое
Посмотрите в таблице растворимости.
Основание соль
NaOH + AgCl →
растворимо + нерастворимо
5. Сделайте вывод о возможности проведения реакции
Реакция между веществами, формулы которых:
NaOH + AgCl →Χ
невозможна, так как не выполняется одно из
условий, поэтому проверять растворимость
получающихся солей не имеет смысла.
Задание 17
Определите, можно ли провести реакцию между веществами, формулы которых: KNO3 и Ba(OH)2
Решение
1. Определите, к каким классам принадлежат реагирующие вещества
Соль основание
KNO3 + Ba(OH)2→
2.Вспомните условия, при котором возможна реакция соли с основанием
Соль + основание → новая соль + новое основание
1.Исходные соль и основание растворимы или малорастворимы
2.Хотя бы один из продуктов нерастворимое или малорастворимое
Посмотрите в таблице растворимости.
Соль + основание соль основание
KNO3 + Ba(OH)2 → Χ Ba(NO3)2 + KOH
Растворима + растворима→ растворима + растворима
5. Сделайте вывод о возможности проведения реакции
Сделайте вывод о возможности проведения реакции
Реакция между веществами, формулы которых:
KNO3 и Ba(OH)2
невозможна, так как не выполняется одно из условий (хотя бы один из продуктов – нерастворимое вещество)
Литература:
Химия «Гимназия на дому» А.Е. Савельев
Понравилось??? Не забывайте поделиться, с друзьями.
Желаю здоровья Вам и Вашим близким!!!
«Кислоты, основания и соли. Удивительные превращения»
07 октября 2020 года на факультете физико-математических и естественных наук РУДН было проведено интерактивное мероприятие для 15 учащихся 8-9 классов ГБОУ «Школа № 827» в рамках реализации программы проведения культурно-воспитательных мероприятий, направленных на развитие интереса к науке, культуре и искусству для обучающихся школ Москвы, в том числе с поведенческими особенностями «ВМЕСТЕ!».
Мероприятие проходило в лаборатории общей химии ФФМ и ЕН РУДН. Перед началом мероприятия доцент кафедры общей химии ФФМ и ЕН Невская Е.Ю. провела для учащихся познавательную экскурсию. Школьники ознакомились с лекционными залами, учебными и научными лабораториями факультета. Учащиеся посетили научные лаборатории кафедры физической и коллоидной химии, органической химии и кафедры общей химии. Невская Е.Ю. показала участникам мероприятия красочно оформленные стенды, на которых отображена история РУДН, коллекцию минералов, рассказала об организации учебного процесса для студентов-химиков факультета.
Далее Невская Е.Ю. и ассистент кафедры общей химии Рассохин Р.В. рассказали о современном оснащении химических лабораторий. Были обсуждены вопросы получения и очистки веществ, методы их анализа.
Далее Роман Владимирович Рассохин провёл мастер-класс по изучению химических свойств кислот оснований и солей. Были показаны занимательные опыты. Школьники смогли, используя индикаторы определить состав образца, отнеся его к какому-либо классу веществ. В конце занятия участники под руководством преподавателя смогли попробовать себя в химическом эксперименте. Была проведен элемент проектной работы по химии, в ходе которой учащиеся смогли установить точную концентрацию раствора соляной кислоты и определить временную жесткость воды в выданных им образцах.
В конце занятия участники под руководством преподавателя смогли попробовать себя в химическом эксперименте. Была проведен элемент проектной работы по химии, в ходе которой учащиеся смогли установить точную концентрацию раствора соляной кислоты и определить временную жесткость воды в выданных им образцах.
Благодаря проведенному мероприятию школьники углубили знания и навыки в области химии, смогли провести химический эксперимент, изучили элементы количественного анализа веществ. Голубкова Мария, которая получила наилучший результат по выполнению исследования гидрокарбонатной жесткости воды, была награждена сувенирной продукцией РУДН и сладким призом. Ребята были приглашены на профильные занятия по химии, которые проводятся на факультете ФМ и ЕН в течение учебного года.
Оксиды. Кислоты. Основания. Амфотерность. Соли реферат по биологии
Оксиды. Кислоты. Основания. Амфотерность. Соли. 1. Оксиды Оксиды –это сложные вещества, образованные двумя элементами, одним из которых является кислород (O). Оксиды могут находиться в трех агрегатных состояниях, а именно: в твердом, жидком и газообразном. Температура плавления зависит от их строения. CuO, Fe O — твердые вещества, немолекулярного строения. Оксиды: MgO –магния NiO –никеля SiO — кремния Fe O — железа ClO — хлора CO — углерода NO — азота 1.2. Вода Массовая доля воды в организме человека составляет 65%. Взрослый человек потребляет ежедневно почти 2 л воды. Плотность воды наибольшая при 4градусов –г/см в кубе. При нуле –лёд, а при 100 –водяной пар. Вода реагирует: А) с активными металлами, образуя щелочи и водород(H). 2Na + 2H O = 2NaOH + H Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH –щелочь. Если при добавлении фиолетового лакмуса окраска становится синей –это признак того, что в растворе есть щелочь. 2K + H O = 2KOH + H Ca + 2H O = Ca(OH) + H Б) с оксидами активных металлов, образуя растворимые основания –щелочи. CaO + H O = Ca(OH) Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными.
Оксиды могут находиться в трех агрегатных состояниях, а именно: в твердом, жидком и газообразном. Температура плавления зависит от их строения. CuO, Fe O — твердые вещества, немолекулярного строения. Оксиды: MgO –магния NiO –никеля SiO — кремния Fe O — железа ClO — хлора CO — углерода NO — азота 1.2. Вода Массовая доля воды в организме человека составляет 65%. Взрослый человек потребляет ежедневно почти 2 л воды. Плотность воды наибольшая при 4градусов –г/см в кубе. При нуле –лёд, а при 100 –водяной пар. Вода реагирует: А) с активными металлами, образуя щелочи и водород(H). 2Na + 2H O = 2NaOH + H Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH –щелочь. Если при добавлении фиолетового лакмуса окраска становится синей –это признак того, что в растворе есть щелочь. 2K + H O = 2KOH + H Ca + 2H O = Ca(OH) + H Б) с оксидами активных металлов, образуя растворимые основания –щелочи. CaO + H O = Ca(OH) Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными. Б) еще примеры: Na O + H O = 2NaOH BaO + HO = Ba(OH) В) со многими оксидами неметаллов, образуя кислоты. P O + H O = 2HPO а с горячей водой: P O + 3H PO = 2H PO CO + H O = H CO SO + H O = H SO Г) вода разлагается под действие высокой температуры или электрического тока. 2H O = 2H + O Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными. 2. Кислоты В формулах кислот на первом месте всегда стоит водород, а дальше –кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь. Пример: SO — кислотный остаток. Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру). Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла. Основность кислот –это количество атомов водорода, способных замещаться атомами металла с образованием соли. Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой: SO + H O = H SO N O + H O = 2HNO 2.
Б) еще примеры: Na O + H O = 2NaOH BaO + HO = Ba(OH) В) со многими оксидами неметаллов, образуя кислоты. P O + H O = 2HPO а с горячей водой: P O + 3H PO = 2H PO CO + H O = H CO SO + H O = H SO Г) вода разлагается под действие высокой температуры или электрического тока. 2H O = 2H + O Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными. 2. Кислоты В формулах кислот на первом месте всегда стоит водород, а дальше –кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь. Пример: SO — кислотный остаток. Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру). Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла. Основность кислот –это количество атомов водорода, способных замещаться атомами металла с образованием соли. Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой: SO + H O = H SO N O + H O = 2HNO 2.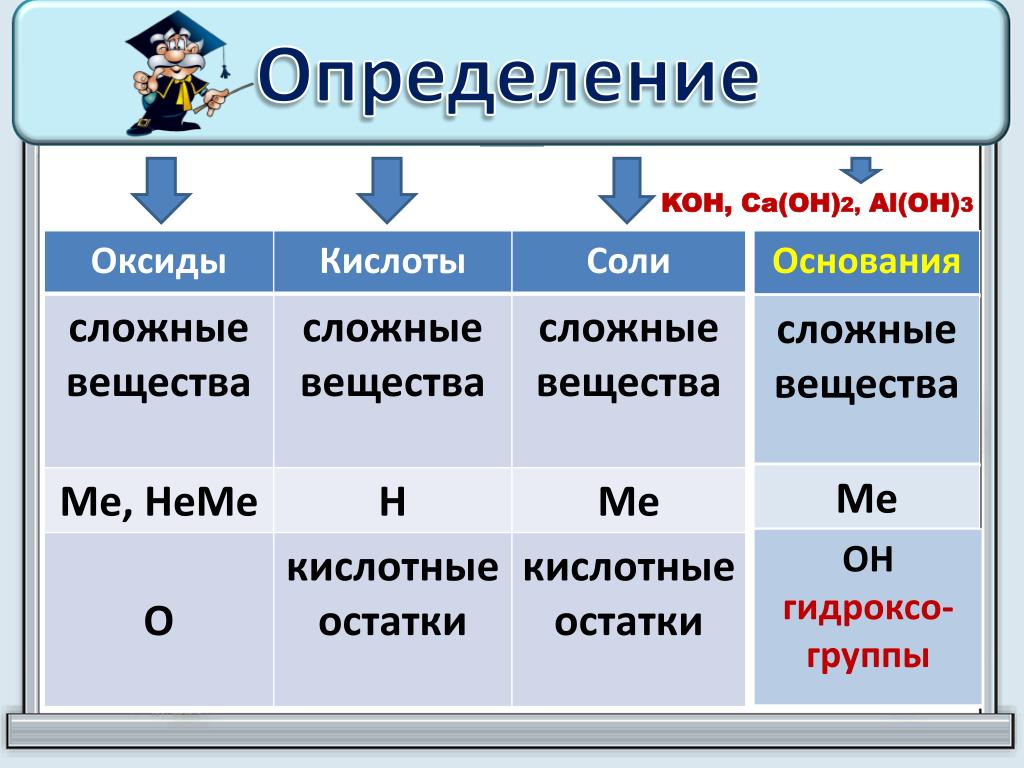 1. Химические свойства кислот 1ое свойство: кислоты действуют на индикаторы. Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами. Индикаторы: Лакмус, метилоранж, фенолфталеин. 2ое свойство: кислоты реагируют с металлами. Mg + 2HCl = MgCl + H Zn + 2HCl = ZnCl + H Cu + HCl = реакция не происходит! 3е свойство: кислоты реагируют с основными оксидами. CuO + 2HCl = CuCl + H O — — — — Cu (II) Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями. Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы. BaSO — бария Na SO — сульфит натрия K PO — фосфат калия CaCO — карбонат кальция 5.1. Химические свойства солей Соли реагируют: А) с металлами: Cu + 2AgNO = Cu(NO ) + 2Ag Образуется новая соль и металл. Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли.
1. Химические свойства кислот 1ое свойство: кислоты действуют на индикаторы. Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами. Индикаторы: Лакмус, метилоранж, фенолфталеин. 2ое свойство: кислоты реагируют с металлами. Mg + 2HCl = MgCl + H Zn + 2HCl = ZnCl + H Cu + HCl = реакция не происходит! 3е свойство: кислоты реагируют с основными оксидами. CuO + 2HCl = CuCl + H O — — — — Cu (II) Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями. Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы. BaSO — бария Na SO — сульфит натрия K PO — фосфат калия CaCO — карбонат кальция 5.1. Химические свойства солей Соли реагируют: А) с металлами: Cu + 2AgNO = Cu(NO ) + 2Ag Образуется новая соль и металл. Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли.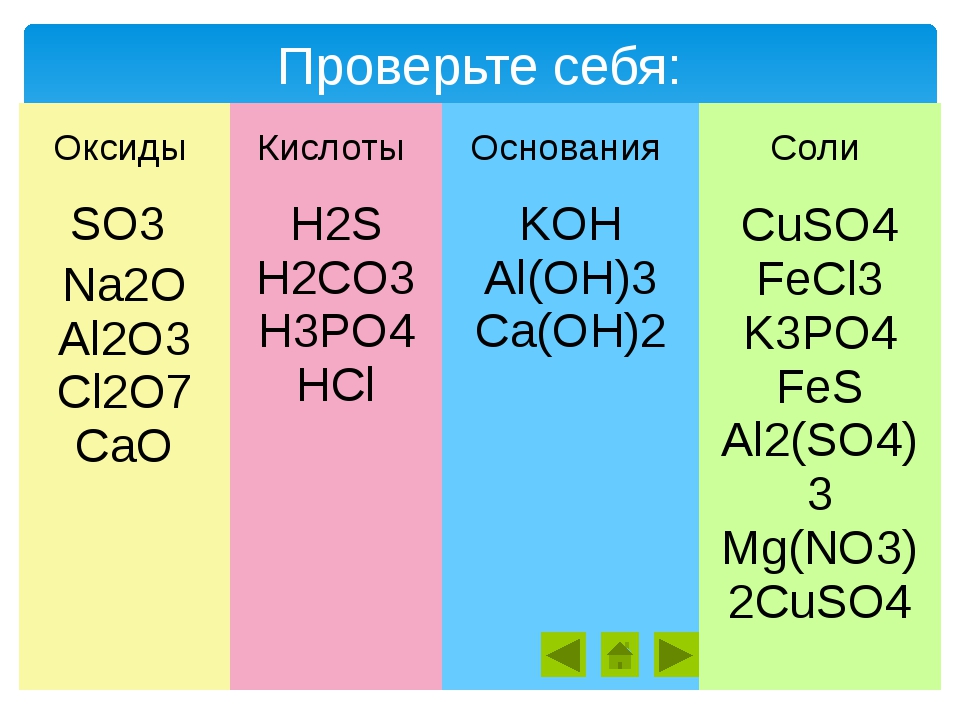 Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у. Б) с растворимыми основаниями (щелочами): AlCl +3NaOH = Al(OH) + 3NaCl K SO + Ba(OH) = 2KOH + BaSO Образуется новая соль и новое основание. Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок. В) с кислотами: CaCo + 2HCl = CaCl + H CO / \ H O CO Образуется новая соль и новая кислота. Поскольку H CO очень непрочная, она разлагается на воду и CO . Примечание: реакция между солью и кислотой будет происходить при таких условиях: а) когда образуется осадок, не растворимый в кислотах: AgNO + HCl = AgCl + HNO б) когда реагирующая кислота сильнее, чем та, которой образована соль: Ca (PO ) + 3H SO = 3CaSO + 2H PO в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая: 2NaNO + H SO = Na SO + 2HNO Г) с солями: BaCl + Na SO = BaSO + 2NaCl Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок.
Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у. Б) с растворимыми основаниями (щелочами): AlCl +3NaOH = Al(OH) + 3NaCl K SO + Ba(OH) = 2KOH + BaSO Образуется новая соль и новое основание. Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок. В) с кислотами: CaCo + 2HCl = CaCl + H CO / \ H O CO Образуется новая соль и новая кислота. Поскольку H CO очень непрочная, она разлагается на воду и CO . Примечание: реакция между солью и кислотой будет происходить при таких условиях: а) когда образуется осадок, не растворимый в кислотах: AgNO + HCl = AgCl + HNO б) когда реагирующая кислота сильнее, чем та, которой образована соль: Ca (PO ) + 3H SO = 3CaSO + 2H PO в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая: 2NaNO + H SO = Na SO + 2HNO Г) с солями: BaCl + Na SO = BaSO + 2NaCl Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок. Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций: Ответы на некоторые вопросы после параграфов: Какие вещества называют оксидами? Оксиды –это сложные вещества образованные двумя элементами одним из которых является кислород. Какие вещества относятся к кислотам? К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток. Что называется реакцией соединения? Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество. Напишите уравнения химических реакций которые происходят при таких превращениях: C CO H CO P P O HPO C + O = CO CO + H O = H CO P + O = P O Как химическим путем отличить серебро от цинка? Что такое хлороводород и как его получить? Хлороводород –это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой.
Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций: Ответы на некоторые вопросы после параграфов: Какие вещества называют оксидами? Оксиды –это сложные вещества образованные двумя элементами одним из которых является кислород. Какие вещества относятся к кислотам? К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток. Что называется реакцией соединения? Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество. Напишите уравнения химических реакций которые происходят при таких превращениях: C CO H CO P P O HPO C + O = CO CO + H O = H CO P + O = P O Как химическим путем отличить серебро от цинка? Что такое хлороводород и как его получить? Хлороводород –это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой. Почему хлороводород на воздухе дымит? Как доказать что выданный вам раствор кислота и это соляная кислота? Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж –розовеет, фенолфталеин – бесцветный. Какие вещества относятся к основаниям и как их классифицируют? Привести примеры. К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые. Все металлы не растворяются, а неметаллы наоборот. Растворимые –NaOH, KOH, нерастворимые –Cu(OH) Fe(OH) . ) Что вам известно о гидроксиде натрия? Гидроксид натрия NaOH –растворимый в воде… 11) Ca CaO Ca(OH) Ca(NO ) Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HNO = Ca(NO ) + 2H O ) P P O H PO Mg(PO ) P + 5O = 2P O P O + 3H O = 2H PO Что называется амфотерностью? Амфотерность –это способность химических соединений Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют. Что такое соли? Соли –это сложные вещества, образованные атомами металлов и кислотными остатками.
Почему хлороводород на воздухе дымит? Как доказать что выданный вам раствор кислота и это соляная кислота? Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж –розовеет, фенолфталеин – бесцветный. Какие вещества относятся к основаниям и как их классифицируют? Привести примеры. К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые. Все металлы не растворяются, а неметаллы наоборот. Растворимые –NaOH, KOH, нерастворимые –Cu(OH) Fe(OH) . ) Что вам известно о гидроксиде натрия? Гидроксид натрия NaOH –растворимый в воде… 11) Ca CaO Ca(OH) Ca(NO ) Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HNO = Ca(NO ) + 2H O ) P P O H PO Mg(PO ) P + 5O = 2P O P O + 3H O = 2H PO Что называется амфотерностью? Амфотерность –это способность химических соединений Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют. Что такое соли? Соли –это сложные вещества, образованные атомами металлов и кислотными остатками. Сформулируйте правило для составления формул солей. Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка. Ca CaO Ca(OH) CaCl CaSO Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HCl = CaCl + 2H O CaCl + H SO = CaSO + 2HCl Ba Ba(OH) Ba(NO ) BaCO BaCl Ba + H O = Ba(OH) Ba(OH) + 2HNO = Ba(NO ) + 2H O Ba(NO ) + H CO = BaCO + 2HNO BaCO + 2HCl = BaCl + H CO Обобщение знаний: Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов. Простые вещества –это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы –нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы –это растворимые в воде вещества, которые хрупкие и т.п. Какие вещества называются сложными? На какие классы делятся неорганические вещества? Сложные вещества –это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные.
Сформулируйте правило для составления формул солей. Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка. Ca CaO Ca(OH) CaCl CaSO Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HCl = CaCl + 2H O CaCl + H SO = CaSO + 2HCl Ba Ba(OH) Ba(NO ) BaCO BaCl Ba + H O = Ba(OH) Ba(OH) + 2HNO = Ba(NO ) + 2H O Ba(NO ) + H CO = BaCO + 2HNO BaCO + 2HCl = BaCl + H CO Обобщение знаний: Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов. Простые вещества –это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы –нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы –это растворимые в воде вещества, которые хрупкие и т.п. Какие вещества называются сложными? На какие классы делятся неорганические вещества? Сложные вещества –это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные. Сложные делятся на оксиды, основания, кислоты и соли. По какому признаку оксиды делят на основные и кислотные? Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными. ) С чем могут взаимодействовать кислотные и основные оксиды? Что получается? Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Сложные делятся на оксиды, основания, кислоты и соли. По какому признаку оксиды делят на основные и кислотные? Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными. ) С чем могут взаимодействовать кислотные и основные оксиды? Что получается? Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Раствор на основе солевого никотина — PerfectVape
Сделано из чистого никотина под маркой Perfect Vape! Для миксеров, которые хотят получить еще более гладкий продукт, подняться по лестнице прочности и не чувствовать ужасного удара по горлу. Сама цель никотиновой соли состоит в том, чтобы улучшить ваши впечатления от вейпинга, используя повышенную силу никотина, при этом практически не имея резкости. Соли никотина можно использовать так же, как и традиционный раствор никотина, разница заключается в возможностях того, что соль может доставить.Традиционные никотиновые смеси обладают естественными свойствами, присущими обычному раствору никотина, которые не позволяют использовать никотиновый вейп с более высокой концентрацией никотина. Соли никотина обеспечивают возможность вейпинга с гораздо более высокой концентрацией никотина без резкости или ударов в горло, которые обычно возникают при использовании обычного раствора никотина. Для тех, кто не хочет использовать более высокую концентрацию никотина, соль предлагает самый плавный опыт вейпинга. При низких концентрациях, таких как 3 или 6, использование никотиновых солей может легко заставить человека упустить из виду присутствие никотина в их соке из-за того, насколько приятным будет этот опыт.
Соли никотина обеспечивают возможность вейпинга с гораздо более высокой концентрацией никотина без резкости или ударов в горло, которые обычно возникают при использовании обычного раствора никотина. Для тех, кто не хочет использовать более высокую концентрацию никотина, соль предлагает самый плавный опыт вейпинга. При низких концентрациях, таких как 3 или 6, использование никотиновых солей может легко заставить человека упустить из виду присутствие никотина в их соке из-за того, насколько приятным будет этот опыт.
Мы предлагаем две разновидности: Smooth Salts и Hit Salts. Соли никотина завоевали популярность в индустрии электронных жидкостей благодаря своей эффективности и удобству вейпинга. С солями никотин быстрее проникает через гематоэнцефалический барьер, и производители лучше контролируют попадание никотиновой жидкости в горло.
Smooth Salts созданы с учетом необычайно гладкого вейпинга, а благодаря высокому содержанию никотина жидкости для электронных сигарет практически не пострадают. Smooth Salts полностью устраняет резкость, связанную с никотином, для жидкостей с более низкой концентрацией.
Smooth Salts полностью устраняет резкость, связанную с никотином, для жидкостей с более низкой концентрацией.
Примечание:
-Соли никотина вызывают изменение цвета. Это совершенно нормально из-за своей сложности и никоим образом не является отражением свежести или качества. Кроме того, соли никотина не являются настоящими «солями», как гранулированная поваренная соль, которую мы добавляем в пищу. Они представляют собой жидкий никотин, который был преобразован из формы свободного основания в форму соли, также известной как его кислая форма. Таким образом, слово соль означает к этому химическому процессу, а не к внешнему виду самого никотина.
-Версия Smooth, как известно, имеет «кислый» запах и вкус. Наслаждение любым / любым из вариантов солевого никотина варьируется от пользователя к пользователю.
Видео-вопрос: Определение кислот, оснований и солей в реакции нейтрализации
Стенограмма видео
Показана реакция нейтрализации
ниже. Водный HNO3 плюс водный КОН превращается
в водный KNO3 плюс жидкий h3O. Что за кислота в этом
уравнение? Что за база в этом
уравнение? Какая в этом соль
уравнение?
Водный HNO3 плюс водный КОН превращается
в водный KNO3 плюс жидкий h3O. Что за кислота в этом
уравнение? Что за база в этом
уравнение? Какая в этом соль
уравнение?
Общий вид реакция нейтрализации заключается в том, что при смешивании кислоты и основания образуется вода и соль. Этот многокомпонентный вопрос задает нам, чтобы посмотреть на четыре соединения, перечисленные в химическом уравнении, и определить, какие один из них — кислота, один — основание, а какой — соль.
Если еще раз взглянуть на общие
уравнения для реакции нейтрализации, мы можем видеть, что кислота и основание являются
реагенты реакции в левой части уравнения, в то время как соль является одной из
продукты в правой части уравнения. Обратите внимание, что мы не можем просто сказать, что
на первом месте кислота, на втором месте основание, на третьем — вода, а на третьем — соль.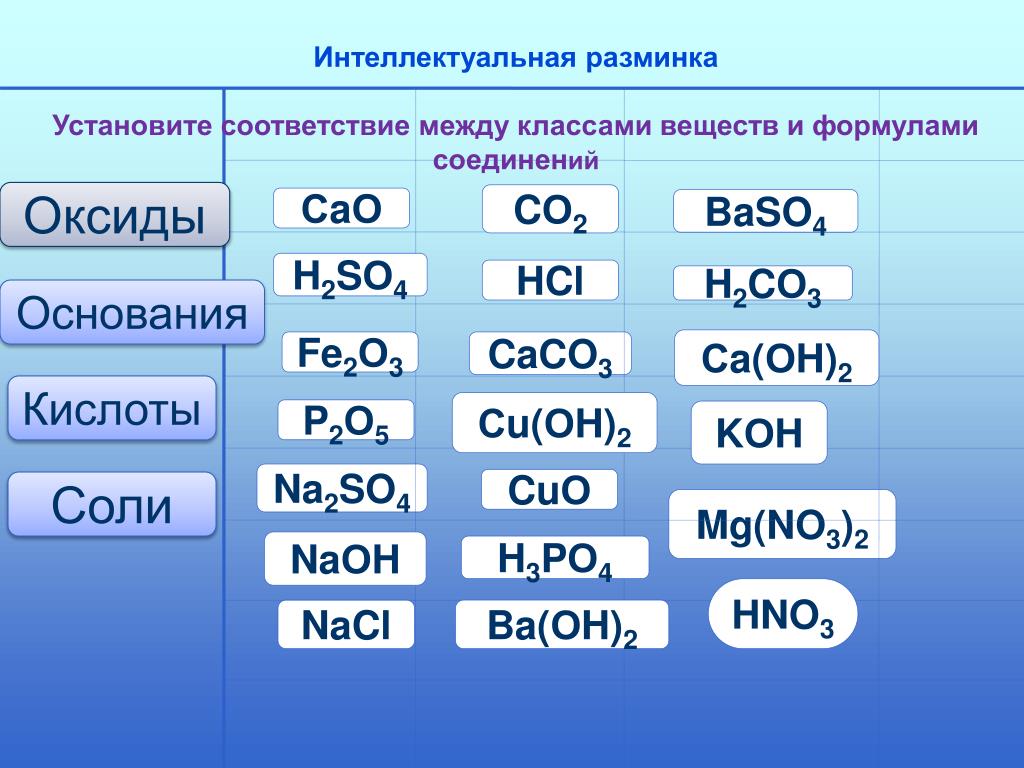 идет четвертым. Реагенты в левой части
уравнения могут быть перечислены в любом порядке, а продукты справа
Сторона уравнения может быть указана в любом порядке.
идет четвертым. Реагенты в левой части
уравнения могут быть перечислены в любом порядке, а продукты справа
Сторона уравнения может быть указана в любом порядке.
Начнем с определения соль. В химии соль — это ионный соединение, состоящее из положительного иона и отрицательного иона. Это продукт нейтрализации реакция. Так оно появится справа сторона уравнения. К счастью, это не так уж сложно чтобы определить, какой из продуктов какой. Жидкий h3O также известен как вода, покидая водный KNO3, ионное соединение, состоящее из положительного иона калия и отрицательный ион нитрата, чтобы быть солью.
Далее нам нужно определить, что
кислота и которая является основанием. Исходя из общей формулы, мы
знать, что кислота и основание являются реагентами нейтрализации
реакция. Итак, из двух реагентов на
В левой части уравнения, HNO3 и KOH, один будет кислотой, а другой —
база. Как определить, какой из них
кислота, а какая из них основание?
Как определить, какой из них
кислота, а какая из них основание?
Ну, кислоты производят ионы водорода при растворении, в то время как основания при растворении производят гидроксид или ионы ОН-.Если мы разрушим эти соединения на составляющие ионы, мы видим, что HNO3 производит ионы водорода, а KOH производит ионы гидроксида. Это значит, что HNO3 — наша кислота. и КОН — наша база.
Обратите внимание, что есть некоторые базы, которые
не производят ионы гидроксида. Однако кислота все равно будет
производят ионы водорода. Таким образом, вы можете идентифицировать кислоту и
основание в этом случае, сначала идентифицируя кислоту.Реакции нейтрализации будут
всегда следуйте общей формуле: кислота плюс основание дает воду и соль. Если мы сможем идентифицировать реагент
который производит ионы водорода, реагент, который производит ионы гидроксида, и
продукт, который является ионным соединением, мы можем идентифицировать кислоту, основание и соль,
соответственно.
В реакции нейтрализации Как показано ниже, кислота — HNO3, основание — KOH, а соль — KNO3.
: | Armstrong Flooring Commercial
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring. Для получения информации о наличии продукта и информации для вашего текущего местоположения вы можете просмотреть наш сайт в США.
Перейти в Armstrong Flooring США
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring. Для получения информации о наличии продуктов и информации для вашего текущего местоположения вы можете просмотреть наш сайт в Латинской Америке.
Перейти в Armstrong Flooring Latin America
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring.Для получения информации о наличии продуктов и информации для вашего текущего местоположения вы можете просмотреть наш сайт для Китая.
Перейти в Armstrong Flooring Greater China
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring. Для получения информации о наличии продукта и информации для вашего текущего местоположения вы можете просмотреть наш сайт для Австралии / Новой Зеландии.
Перейти в Armstrong Flooring Австралия / Новая Зеландия
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring. Для получения информации о наличии продуктов и информации для вашего текущего местоположения вы можете просмотреть наш сайт в Северной Азии.
Для получения информации о наличии продуктов и информации для вашего текущего местоположения вы можете просмотреть наш сайт в Северной Азии.
Перейти в Armstrong Flooring North Asia
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring. Для получения информации о наличии продуктов и информации для вашего текущего местоположения вы можете просмотреть наш сайт в Юго-Восточной Азии.
Перейти в Armstrong Flooring South East Asia
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring.Для получения информации о наличии продуктов и информации для вашего текущего местоположения вы можете просмотреть наш сайт в Южной Азии.
Перейти в Armstrong Flooring South Asia
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
Спасибо, что посетили нас!
Вы находитесь на сайте Canada (английский) Armstrong Flooring. Для получения информации о наличии продуктов и информации для вашего текущего местоположения вы можете просмотреть наш сайт для Ближнего Востока и Африки.
Перейти в Armstrong Flooring Ближний Восток и Африка
Нет, спасибо, я бы предпочел продолжить просмотр в Канаде (английский).
¡Gracias por visitarnos!
Actualmente se encuentra en el sitio web de Armstrong Flooring de Canada (английский) . Para conocer la disponibilidad de productos e información sobre su ubicación actual, puedeferir navegar en nuestro sitio de America latina.
Visite Armstrong Flooring de America latina
No thanks, I’d prefer to continue browsing on Canada (English).
感谢您的访问!
您当前正在访问 Canada (English) Armstrong Flooring 网站。 如需查询当前位置的产品供应水平和信息,推荐您浏览我们的大中华网站。
访问 Armstrong Flooring 大中华
No thanks, I’d prefer to continue browsing on Canada (English).
Aqueous Salt Solutions — Acid and Base Properties
It is possible to predict whether an aqueous solution of a salt with both basic and acidic properties will be basic, acidic or neutral by comparing the K a value for the acidic ion with the K b value for the basic ion.
См. Также Сильные и слабые кислоты и основания и Буферные растворы, а также pKa неорганических кислот и оснований, pKa фенолов, спиртов и карбоновых кислот и pKa аминов, диаминов и циклических органических соединений азота.
| K a vs K b | pH | Основное или кислотное | ||||||||||||||||||||||||||||||||
K a > K | Acidic | | |||||||||||||||||||||||||||||||||
| K a | > 7 | Basic | ||||||||||||||||||||||||||||||||
| K a = K b | 7 | Neutral 61| основные свойства водных растворов различных солей: | Для полной таблицы — поверните экран!
Карбонатные соли | CAMEO ChemicalsЛист данных реактивной группы Что такое реактивные группы? Реактивные группы — это категории химических веществ, которые обычно реагируют одинаково. Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности. Есть 13 химических паспортов назначен этой реактивной группе. ОписаниеВоспламеняемость Карбонатные соли — негорючие материалы. Реакционная способность Карбонатные соли действуют как слабые основания и поэтому участвуют в кислотно-основных реакциях, которые выделяют тепло и выделяют углекислый газ. Производство CO2 может вызвать повышение давления в сосудах, содержащих карбонаты. Токсичность В целом нетоксичен. Бикарбонат натрия используется как антикислотное лекарство. Прочие характеристики Карбонаты образуются в результате реакции между угольной кислотой (водный диоксид углерода) и основанием (или щелочью). Они имеют формулу Mx (CO3) y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями, и они становятся синей лакмусовой бумажкой. Карбонаты находят множество применений в стекольном производстве, производстве целлюлозы и бумаги, химикатах для очистки воды, текстильном производстве, чистящих смесях, пищевых добавках и т. Д. Примеры Бикарбонат аммония, карбонат бария, карбонат кальция, магнезит, перкарбонаты натрия, карбонат натрия, бикарбонат натрия. Документация по реактивности Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любыми
реактивных групп в базе данных. Прогнозируемые опасности и побочные газы для каждой пары реактивных групп будут будет отображаться, а также документация и ссылки, которые использовались для сделать прогнозы реактивности. Смесь карбонатных солей с:
Фармацевтические соли: теория, применение в твердых лекарственных формах и приготовление in situ в виде аэрозоляhttps: // doi. org / 10.1016 / j.ajps.2016.07.002Получить права и содержание org / 10.1016 / j.ajps.2016.07.002Получить права и содержаниеAbstract В этой статье дается теоретическая основа для солей с упором на количество лекарства в растворе. Учитываются растворимость неионизированной формы, константа диссоциации кислоты и произведение растворимости, которые являются ограничивающими ограничениями. Для растворения неионизированных лекарств поверхностный pH отличается от общего pH, что приводит к более низкой, чем ожидалось, скорости. Для солей теоретические соображения относительно сложны, и экспериментальный подход к оценке поверхностного pH, скорее всего, будет полезен для прогнозирования скорости растворения.Общие рекомендации описаны для скрининга, приготовления и характеристики лекарств как солей, которые в решающей степени зависят от цели разработки продукта. После этого предоставляется наша работа по приготовлению солей как средства для создания аэрозолей из раствора. Растворимость шести структурно родственных соединений определена в четырех кислотах. | |||||||||||||||||||||||||||||||

 Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ.
Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ.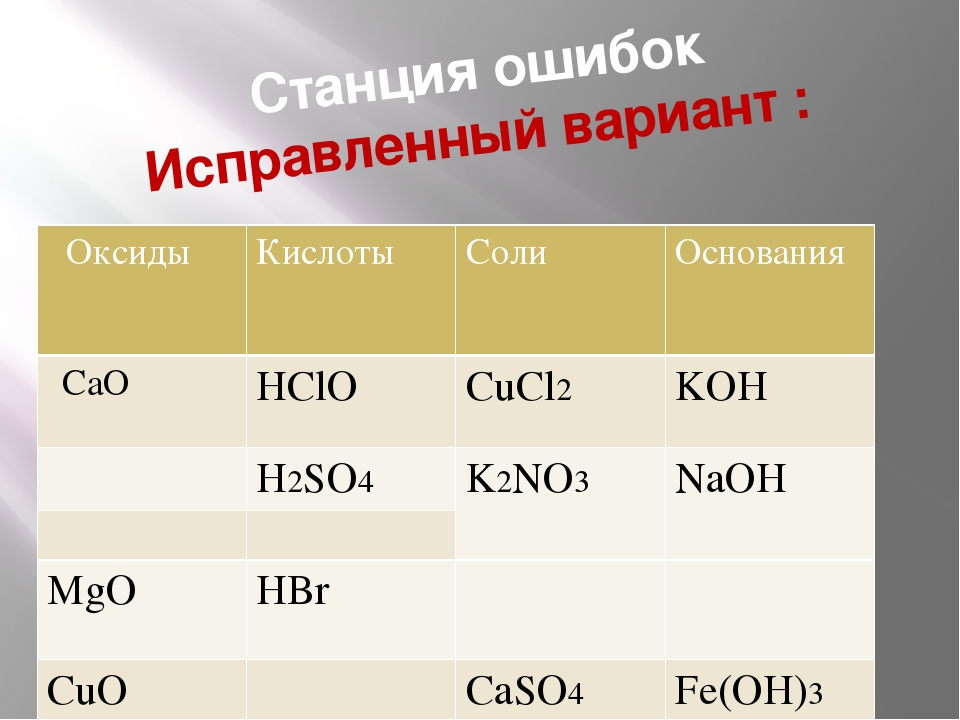 Оксиды. Гидроксиды. Соли. Кислоты,
Оксиды. Гидроксиды. Соли. Кислоты,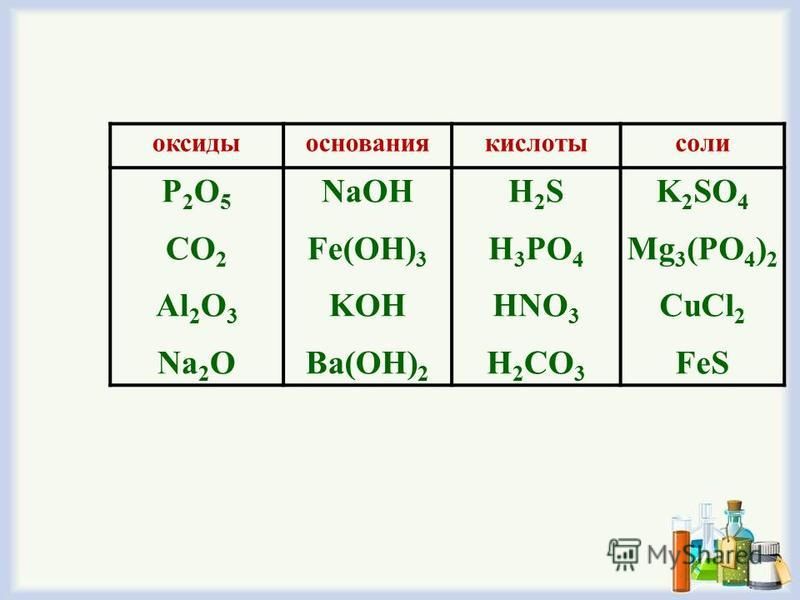 Введите свой запрос:
Введите свой запрос:
 способами, потому что они похожи по своей химической структуре.Каждое вещество с
химическая таблица была отнесена к одной или нескольким реакционным группам, и
CAMEO Chemicals использует назначения реактивных групп для определения своей реакционной способности.
предсказания.
Подробнее о прогнозах реактивности …
способами, потому что они похожи по своей химической структуре.Каждое вещество с
химическая таблица была отнесена к одной или нескольким реакционным группам, и
CAMEO Chemicals использует назначения реактивных групп для определения своей реакционной способности.
предсказания.
Подробнее о прогнозах реактивности …

