Ю.М. Коренев, В.П. Овчаренко — Общая и неорганическая химия — PDF, страница 14
являются твердыми веществами, имеющими очень высокиетемпературы плавления (> 1 000°C).3א. ОксидыВ некоторых оксидах связи ковалентные полярные. Они образуюткристаллические решетки, где атомы элемента связаны несколькими“мостиковыми” атомами кислорода, образуя бесконечную трехмернуюсеть, например, Al2O3 , SiO2 , TiO2 , BeO и эти оксиды тоже имеют оченьвысокие температуры плавления.§ 2. Классификация оксидов и закономерностиизменения химических свойств2.1.
Классификация оксидов по химическим свойствамПо химическим свойствам оксиды разделяются на следующие типы:ОКСИДЫСолеобразующиеСолеобразные(или двойные)НесолеобразующиеN2OFe3O4, Pb3O4ОсновныеАмфотерныеКислотныеNa2O, CaOAl2O3, ZnO, BeOSO3, CO2, N2O3Несолеобразующими называются оксиды, которым не соответствуют никислоты, ни основания.Солеобразными оксидами называются двойные оксиды, в состав которыхвходят атомы одного металла в разных степенях окисления. Металлы, проявляющие в соединениях несколько степеней окисления,образуют двойные, или солеобразные оксиды. Например, Pb3O4 , Fe3O4 ,Mn3O4 (формулы этих оксидов могут быть записаны также в виде2 PbO ⋅ PbO2 ; FeO ⋅ Fe2O3 ; MnO ⋅ Mn2O3 соответственно).Например, Fe3O4 ⇒ FeO ⋅ Fe2O3 : представляет собой основный оксидFeO химически связанный с амфотерным оксидом Fe2O3 , который в данномслучае проявляет свойства кислотного оксида.
Металлы, проявляющие в соединениях несколько степеней окисления,образуют двойные, или солеобразные оксиды. Например, Pb3O4 , Fe3O4 ,Mn3O4 (формулы этих оксидов могут быть записаны также в виде2 PbO ⋅ PbO2 ; FeO ⋅ Fe2O3 ; MnO ⋅ Mn2O3 соответственно).Например, Fe3O4 ⇒ FeO ⋅ Fe2O3 : представляет собой основный оксидFeO химически связанный с амфотерным оксидом Fe2O3 , который в данномслучае проявляет свойства кислотного оксида.
И Fe3O4 формально можнорассматривать как соль, образованную основанием Fe(OH)2 и кислотой[HFeO2 ], которая не существует в природе:+2+3+2+3Fe( Fe O 2 ) 2 + h3O.Fe(OH ) 2 + 2 [ H Fe O 2 ] = 14243Fe3O 4От гидрата оксида свинца (IV), как от кислоты, и Pb(OH)2 , как основания, могут быть получены два двойных оксида — Pb2O3 и Pb3O4 (сурик),которые можно рассматривать как соли. Первый является свинцовой солью4§ 2. Классификация оксидов и закономерности изменения химических свойствметасвинцовой кислоты (h3PbO3), а второй — ортосвинцовой кислоты(h5PbO4).Cреди оксидов, особенно среди оксидов d-элементов, многосоединений переменного состава (бертолиды), содержание кислорода вкоторых не соответствует стехиометрическому составу, а изменяется вдовольно широких пределах, например, состав оксида титана (II) TiOизменяется в пределах TiO0,65 – TiO1,25 . Солеобразующими оксидами называются оксиды, которые образуют соли.Оксиды этого типа делятся на три класса: основные, амфотерные икислотные.Основными оксидами называются оксиды, элементобразовании соли или основания становится катионом.которыхприКислотными оксидами называются оксиды, элемент которых приобразовании соли или кислоты входит в состав аниона.Амфотерными оксидами называются оксиды, которые в зависимости отусловий реакции могут проявлять как свойства кислотных, так и свойстваосновных оксидов.При образовании солей степени окисления элементов, образующихоксиды, не изменяются, например:+2+4+2 +4Ca O + C O2 = Ca C O3 .Если при образовании соли происходит изменение степеней окисленияэлементов, образующих оксиды, то получившуюся соль следует отнести ксоли другой кислоты или другого основания, например,+2+6t+3+6+4а) 2 Fe O + 4 S O 3 = Fe 2 ( S O 4 ) 3 + S O 2 .Fe2(SO4)3 представляет собой соль образованную серной кислотой игидроксидом железа (III) — Fe(OH)3 , которому соответствует оксид Fe2O3 .
Солеобразующими оксидами называются оксиды, которые образуют соли.Оксиды этого типа делятся на три класса: основные, амфотерные икислотные.Основными оксидами называются оксиды, элементобразовании соли или основания становится катионом.которыхприКислотными оксидами называются оксиды, элемент которых приобразовании соли или кислоты входит в состав аниона.Амфотерными оксидами называются оксиды, которые в зависимости отусловий реакции могут проявлять как свойства кислотных, так и свойстваосновных оксидов.При образовании солей степени окисления элементов, образующихоксиды, не изменяются, например:+2+4+2 +4Ca O + C O2 = Ca C O3 .Если при образовании соли происходит изменение степеней окисленияэлементов, образующих оксиды, то получившуюся соль следует отнести ксоли другой кислоты или другого основания, например,+2+6t+3+6+4а) 2 Fe O + 4 S O 3 = Fe 2 ( S O 4 ) 3 + S O 2 .Fe2(SO4)3 представляет собой соль образованную серной кислотой игидроксидом железа (III) — Fe(OH)3 , которому соответствует оксид Fe2O3 . +4+3+5б) 2 KOH + 2 N O 2 = K N O2 + K N O 3 + h3O.+3Образовавшиеся соли являются солями азотистой ( H N O2 ) и азотной+5( H N O3 ) кислот, которым соответствуют оксиды+3N 2 O3и+5N 2 O5 .2.2.
+4+3+5б) 2 KOH + 2 N O 2 = K N O2 + K N O 3 + h3O.+3Образовавшиеся соли являются солями азотистой ( H N O2 ) и азотной+5( H N O3 ) кислот, которым соответствуют оксиды+3N 2 O3и+5N 2 O5 .2.2.
Закономерности изменения свойств оксидовУвеличение степени окисления элемента и уменьшение радиуса егоиона (при этом происходит уменьшение эффективного отрицательного5א. Оксидызаряда на атоме кислорода – δО) делают оксид более кислотным. Это иобъясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.а) В одном периоде при увеличении порядкового номера происходитусиление кислотных свойств оксидов и увеличение силы соответствующихим кислот.Na2OMgOAl2O3основный основный амфотерныйоксид,оксид,оксид,сильноеслабоеамфотерныйоснование основание гидроксидSiO2P4O10SO3кислотныйкислотныйоксид, оченьоксид,слабаякислотакислотасредней силыCl2O7кислотныйоксид,сильнаякислотакислотныйоксид, оченьсильнаякислотаТаблица 2Зависимость кислотно-основных свойств оксидовот эффективного заряда на атоме кислородаОксидNa2OMgOAl2O3SiO2P4O1023SO3Cl2O7Эффективный заряд,δO– 0,81– 0,42– 0,31– 0,23– 0,13– 0,06– 0,01Кислотно-основныесвойства оксидаОсновныйОсновныйАмфотерныйКислотныйб) В главных подгруппах периодической системы при переходе отодного элемента к другому сверху вниз наблюдается усиление основныхсвойств оксидов:BeOамфотерныйMgOосновныйCaOосновныйSrOосновныйBaOосновныйRaOосновныйувеличение силы соответствующих основанийв) При повышении степени окисления элементакислотные свойства оксида и ослабевают основные:усиливаютсяТаблица 3Зависимость кислотно-основных свойствот степени окисления металлов+2Cr O+3+6Cr2 O3Cr O3––––Mn O2Mn O3Mn 2 O7–основный оксид амфотерный оксид+2Fe O+3Fe2 O3основный оксид амфотерный оксид+2Mn O+3+4Mn 2 O3основный оксид амфотерный оксид амфотерный оксид сс преобладаниемпреобладаниемосновных свойств кислотных свойств6кислотныйоксид+6кислотныйоксид+7кислотный оксид§ 3.
Способы получения оксидов§ 3. Способы получения оксидовОксиды могут быть получены в результате различных химическихреакций.1°. При взаимодействии простых веществ (за исключением золота,платины и инертных газов) с кислородом:S + O2 = SO2,2 Ca + O2 = 2 CaO,4 Li + O2 = 2 Li2O.При горении других щелочных металлов в кислороде образуются пероксиды:2 Na + O2 = Na2O2или надпероксиды:K + O2 = KO2.Оксиды этих металлов могут быть получены при взаимодействиипероксида (или надпероксида) с соответствующим металлом:tNa2O2 + 2 Na = 2 Na2Oили при термическом их разложении:t2 BaO2 = 2 BaO + O2.2°. В результате горения бинарных соединений в кислороде:а) обжиг халькогенидов:4 FeS2 + 11 O2 = 2 Fe2O3 + 8 SO2↑2 CuSe + 3 O2 = 2 CuO + 2 SeO24 CuFeS2 + 13 O2 = 4 CuO + 2 Fe2O3 + 8 SO2↑б) горение гидридов и фосфидов.4 Ph4 + 8 O2 = P4O10 + 6 h3O ⇒ 4 h4PO4CS2 + 3 O2 = CO2 + 2 SO22 Сa3P2 + 8 O2 = 6 CaO + P4O10.3°. При термическом разложении солей:a) карбонатов:tCaCO3 = CaO + CO2↑.Карбонаты щелочных металлов (за исключением карбоната лития)плавятся без разложения. б) нитратов:t2 Cu(NO3)2 = 2 CuO + 4 NO2↑ + O2↑.7א.
б) нитратов:t2 Cu(NO3)2 = 2 CuO + 4 NO2↑ + O2↑.7א.
Оксидыв) Если соль образована катионом металла, проявляющим переменныестепени окисления и анионом кислоты, обладающей окислительнымисвойствами, то могут образоваться оксиды с другими степенями окисленияэлементов, например,t4 Fe(NO3)2 = 2 Fe2O3 + 8 NO2↑ + O2↑t2 FeSO4 = Fe2O3 + SO2↑ + SO3↑t(Nh5)2Cr2O7 = N2↑ + 4 h3O + Cr2O3.4°. Термическое разложение оснований и кислородсодержащих кислотприводит к образованию оксида и воды:th3SO3 = SO2↑ + h3OtSiO2 ⋅ x h3O = SiO2 + x h3OtCa(OH)2 = CaO + h3O.Гидроксиды щелочных металлов плавятся без разложения.5°. Если химический элемент в своих соединениях проявляетразличные степени окисления и образует несколько оксидов, то:а) при окислении низших оксидов можно получить оксиды, в которыхсоответствующий элемент находится в более высокой степени окисления:4 FeO + O2 = 2 Fe2O32 NO + O2 = 2 NO22 NO2 + O3 = N2O5 + O2t= 2 SO3,V2O52 SO2 + O2б) и, аналогично, при восстановлении высших оксидов можно получитьнизшие оксиды:tFe2O3 + CO = 2 FeO + CO2. 6°.
6°.
Некоторые металлы, стоящие в ряду напряжений до водорода, могутпри высокой температуре вытеснять водород из воды. При этом такжеобразуется оксид металла:tFe + h3O ↔ FeO + h3 (t > 570°C).7°. При нагревании солей с кислотными оксидами. Направление реакции в этом случае зависит от относительной летучести оксидов — менеелетучий оксид вытесняет более летучий оксид из соли:tNa2CO3 + SiO2 = Na2SiO3 + CO2↑t2 Ca3(PO4)2 + 6 SiO2 = 6 CaSiO3 + P4O108§ 4. Химические свойства оксидовt2Na2SO4 + 2B2O3 = 4NaBO2 + 2SO2↑ + O2↑t4 NaNO3 + 2 Al2O3 = 4 NaAlO2 + 4 NO2↑ + O2↑.8°.
При взаимодействии металлов с кислотами-окислителями происходит частичное восстановление кислотообразующего элемента с образованием оксида:Cu + 2 h3SO4, конц. = CuSO4 + SO2↑ + 2 h3OZn + 4 HNO3, конц. = Zn(NO3)2 + 2 NO2↑ + 2 h3O.9°. При действии водоотнимающих веществ на кислоты или соли:4 HNO3 + P4O10 = (HPO3)4 + 2 N2O52 KMnO4 + h3SO4, конц. = K2SO4 + Mn2O7 + h3O2 KClO4 + h3SO4, конц. = K2SO4 + Cl2O7 + h3O.10°.
При взаимодействии солей слабых неустойчивых кислот с растворами сильных кислот:Na2CO3 + 2 HCl = 2 NaCl + CO2↑ + h3O. § 4. Химические свойства оксидов4.1. Основные оксидыК основным оксидам относятся:– оксиды всех металлов главной подгруппы первой группы (щелочныеметаллы Li – Fr),– главной подгруппы второй группы, начиная с магния (Mg – Ra) и– оксиды переходных металлов в низших степенях окисления,например, MnO, FeO.1°. Оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с кальция) при обычных условиях непосредственно взаимодействуют с водой, образуя гидроксиды, которые являются сильными,растворимыми в воде основаниями — щелочами, например,BaO + h3O = Ba(OH)2;Na2O + h3O = 2 NaOH.2°. Основные оксиды взаимодействуют с кислотами образуя соли:CaO + 2 HCl = CaCl2 + h3O.3°.
§ 4. Химические свойства оксидов4.1. Основные оксидыК основным оксидам относятся:– оксиды всех металлов главной подгруппы первой группы (щелочныеметаллы Li – Fr),– главной подгруппы второй группы, начиная с магния (Mg – Ra) и– оксиды переходных металлов в низших степенях окисления,например, MnO, FeO.1°. Оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с кальция) при обычных условиях непосредственно взаимодействуют с водой, образуя гидроксиды, которые являются сильными,растворимыми в воде основаниями — щелочами, например,BaO + h3O = Ba(OH)2;Na2O + h3O = 2 NaOH.2°. Основные оксиды взаимодействуют с кислотами образуя соли:CaO + 2 HCl = CaCl2 + h3O.3°.
Также к образованию соли приводит взаимодействие их с кислотными оксидами:Na2O(тв.) + СO2(газ) = Na2CO3CaO(тв.) + SO3(ж.) = CaSO49א. ОксидыtСaO(тв.) + SiO2(тв.) = CaSiO3.4.2. Кислотные оксидыБольшинство оксидов неметаллов являются кислотными оксидами(СО2 , SO3 , P4O10 и др.). Оксиды переходных металлов в высших степеняхокисления проявляют преимущественно также свойства кислотныхоксидов, например: CrO3 , Mn2O7 , V2O5 . 1°. Кислотные оксиды реагируют с водой с образованием соответствующих кислот:SO3 + h3O = h3SO4P4O10 + 6 h3O = 4 h4PO4.Некоторые оксиды, например, SiO2 , MoO3 и др. с водой непосредственно не взаимодействуют и соответствующие им кислоты могут бытьполучены косвенным путем:(x – 1) h3O + Na2SiO3 + 2 HCl = 2 NaCl + SiO2 ⋅ x h3O ↓Na2MoO4 + 2 HCl = 2 NaCl + h3MoO4 ↓.2°.
1°. Кислотные оксиды реагируют с водой с образованием соответствующих кислот:SO3 + h3O = h3SO4P4O10 + 6 h3O = 4 h4PO4.Некоторые оксиды, например, SiO2 , MoO3 и др. с водой непосредственно не взаимодействуют и соответствующие им кислоты могут бытьполучены косвенным путем:(x – 1) h3O + Na2SiO3 + 2 HCl = 2 NaCl + SiO2 ⋅ x h3O ↓Na2MoO4 + 2 HCl = 2 NaCl + h3MoO4 ↓.2°.
Взаимодействие кислотных оксидов с основными оксидами приводит к образованию солей:SO2 + Na2O = Na2SO3tSiO2 + CaO = CaSiO3.3°. Также к образованию солей ведет реакция кислотного оксида соснованием.Cl2O + 2 NaOH = 2 NaClO + h3O.Если кислотный оксид является ангидридом многоосновной кислоты,то в зависимости от относительных количеств основания и кислотногооксида, участвующих в реакции, возможно образование среднихCa(OH)2 + CO2 = CaCO3 ↓ + h3O.или кислых солейCaCO3 ↓ + h3O + CO2 ↑ = Ca(HCO3)2 р-р.4°.
Мало летучие оксиды вытесняют летучие оксиды из солей:tNa2CO3 + SiO2 = Na2SiO3 + CO2↑.4.3. Амфотерные оксидыАмфотерность (от греч. amphoteros — и тот и другой) — способностьхимических соединений (оксидов, гидроксидов, аминокислот) проявлять10§ 4. Химические свойства оксидовкак кислотные, так и основные свойства, в зависимости от свойств второгореагента, участвующего в реакции.Одно и то же вещество (например, ZnO), реагируя с сильной кислотойили кислотным оксидом, проявляет свойства основного оксида:ZnO + 2 HCl = ZnCl2 + h3OZnO + SO3 = ZnSO4.а при взаимодействии с сильным основанием или основным оксидом –свойства кислотного оксида:ZnO + 2 NaOH + h3O = Na2[Zn(OH)4] (в водном растворе)tZnO + CaO = CaZnO2 (при сплавлении).Амфотерные оксиды способны вытеснять летучие оксиды из солей:tK2CO3 + ZnO = K2ZnO2 + CO2↑.4.4.
amphoteros — и тот и другой) — способностьхимических соединений (оксидов, гидроксидов, аминокислот) проявлять10§ 4. Химические свойства оксидовкак кислотные, так и основные свойства, в зависимости от свойств второгореагента, участвующего в реакции.Одно и то же вещество (например, ZnO), реагируя с сильной кислотойили кислотным оксидом, проявляет свойства основного оксида:ZnO + 2 HCl = ZnCl2 + h3OZnO + SO3 = ZnSO4.а при взаимодействии с сильным основанием или основным оксидом –свойства кислотного оксида:ZnO + 2 NaOH + h3O = Na2[Zn(OH)4] (в водном растворе)tZnO + CaO = CaZnO2 (при сплавлении).Амфотерные оксиды способны вытеснять летучие оксиды из солей:tK2CO3 + ZnO = K2ZnO2 + CO2↑.4.4.
Помогите пожалуйста1. Какой из оксидов проявляет основные свойства:
а) оксид калия
б) оксид серы(IV)
в) оксид углерода(II)
г) оксид железа (III)?
2. Кислотный характер проявляет оксид:
а) ZnO б) P2O5 в) K2O г) CaO
3. В какой из строк приведены формулы только высших оксидов?
а) SO2 Na2O Cl2O
б) Al2O3 NO ClO2
в) CaO Cl2O7 P2O5
г) SO3 FeO h3O
4. Какой газ можно поглотить раствором щелочи?
Какой газ можно поглотить раствором щелочи?
а) CO2 б) h3 в) Nh4 г) O2
5. Оксид кальция реагирует с каждым из двух веществ:
а) гидроксидом натрия и серной кислотой
б) оксидом серы(IV) и водой
в) соляной кислотой и оксидом калия
г) оксидом углерода(IV) и гидроксидом лития
6. При взаимодействии какого вещества с водой не образуется щелочь
а) оксида калия
б) оксида меди(II)
в) оксида натрия
г) оксида кальция
7. Какое из веществ не встречается в природе
а) оксид кремния (IV)
б) вода
в) углекислый газ
г) оксид натрия
8. Формула ангидрида серной кислоты:
а) SO2 б) SO3 в) h3SO3 г) h3S
9. Какие из приведенных утверждений верны?
1. Основным оксидам соответствуют основания.
2. Основные оксиды образуют только металлы.
а) верно только 1
б) верно только 2
в) верны оба утверждения
г) оба утверждения неверны
10. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) водой и оксидом натрия
б) кислородом и оксидом серы(IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
11. Оксиды с общей формулой R2O3 и R2O5 образуют элементы
Оксиды с общей формулой R2O3 и R2O5 образуют элементы
а) углерода б) азота в) серы г) фтора
12. Между собой взаимодействуют
а) SiO2 и h3O
б) CO2 и h3SO4
в) CO2 и Ca(OH)2
г) Na2O и Ca(OH)2
13. В схеме превращений
нагреть + h3O
CaCO3 X1 X2
веществом «Х2» является
а) CaO б) Ca(OH)2 в) Cah3 г) Ca(HCO3)2
14. Оксид серы(IV) не взаимодействует с
а) Na2O б) h3O в) CO2 г) NaOH
15. В схеме превращений
+ O2 + SO3
Cu X1 X2
веществом Х2 является
а) CuSO3 б) CuSO4 в) CuO г) CuS
Оксиды — презентация онлайн
ОКСИДЫметаллов
ОСНОВНЫ
Е
КИСЛОТНЫ
Е
Ст.ок. +5, +6, +7
Ст. ок. +1,+2
НЕМЕТАЛЛОВ
КИСЛОТНЫ
Е
НЕСОЛЕОБРАЗУЮ
ЩИЕ
АМФОТЕРН
ЫЕ
Ст. ок. +3, +4
ZnO, BeO
ОКСИДЫ – СЛОЖНЫЕ ВЕЩЕСТВА СОСТОЯЩИЕ
ИЗ ДВУХ ЭЛЕМЕНТОВ, ОДИН ИЗ КОТОРЫХ
КИСЛОРОД.
NO, CO, N2O
ХИМИЧЕСКИЕ
СВОЙСТВА ОКСИДОВ
основные
кислотные
амфотерные
вода
Только щелочных ( Li,
Na, K, Rb, Cs ) и
щелочно-земельных
металлов (Ca, Sr, Ba)
Na2O + h3O = 2NaOH
образуется щелочь
Только неметаллов,
кроме оксида
кремния – SiO2
SO2 + h3O = h3SO3
Не реагируют
кислот
а
Образуется соль и
вода
Не реагируют
Образуется соль и
вода
щелоч
ь
Не реагируют
Образуется соль и
вода
При сплавлении
соль и вода
В растворе
комплексное
соединение
оксид
ы
С кислотными и
амфотерными
С основными и
амфотерными
С основными и
кислотными
ПРОВЕРЬ СВОИ
ЗНАНИЯ
1.
 В перечне веществ
В перечне веществА) BaO Б) Na2O
В) P2O5
Г) CaO
кислотными оксидами являются
1. АБГ
2. АВЕ
3. ВДЕ
2. Оксид лития взаимодействует с
1) CO
2) CO2
3) NO
Д) SO2
Е) CO2
4. БГД
4) CaO
3. Оксид железа 3 взаимодействует с каждым из двух
веществ
1) NaOH , Cu(OH)2
2) Al(OH)3 , h3O
3) NaOH , HCl
4) K2SO4 , P2O5
ОСНОВАНИЯ
щелочи
нерастворимые
амфотерные
кислоты
Образуется
соль и вода
Образуется соль и
вода
Образуется
соль и вода
Кислотные и
амфотерные
оксиды
Образуется
соль и вода
Не реагируют
Не реагирует
Растворы
солей
При условии
образования
слабого
электролита
Не реагируют
Не реагируют
щелочи
Не реагируют Не реагируют
Образуется
комплексная
соль
Основания – сложные вещества, состоящие из атома
Ме и одной или нескольких групп.
ПРОВЕРЬ СВОИ
ЗНАНИЯ
1.
 Среди перечисленных веществ
Среди перечисленных веществА) Fe(OH)3
Б) NaHCO3
В) h3O
Д) Ca(OH)2
Е) NaOH
основаниями являются
1) АБГ
2) АДЕ
3) БГД
Г) h3SO4
4) ВДЕ
2.Гидроксид кальция взаимодействует с каждым из двух
веществ
1) HNO3 и CO
2) MgO и h3SO4
3) CO2 и FeCl2
2.Гидроксид , реагирующий и с кислотой , и с щелочью ,
имеет формулу
1) Al(OH)3
2) Ca(OH)2
3) NaOH
4) Ba(OH)2
КИСЛОТЫ
Ме
HR
Металлы, стоящие в
электрохимическом ряду Ме до Н
Оксиды основные и амфотерные
МеО
МеОН
МеR
Основания растворимые и
нерастворимые
Растворы солей, при условии
образования осадка
Нерастворимые соли, при условии
образования слабой кислоты
Кислоты – сложные вещества, образованные атомами
водорода, способного замещаться или обмениваться на
атомы металла, и кислотного остатка.
ПРОВЕРЬ СВОИ
ЗНАНИЯ
1. Среди перечисленных веществ
А) NaHSO4
Б) h3S
В) HCN
Д) H5IO6
Е)K2HPO4
к классу кислот относятся
1) АБВ
2) БВД
3) БГД
2.

Г) NO
4) ВГД
С раствором серной кислоты взаимодействует
каждое из двух веществ
1) BaCl2 и CO2
2) Mg и BaCL2
3) NaCl и HCl
4) Cu и KOH
3. Раствор соляной кислоты реагирует с каждым из двух
веществ
1) KOH и NO
2) FeCL3 и CO2
3) MgO и NaCl
4) CaCO3 и Cu(OH)2
ГЕНЕТИЧЕСКАЯ СВЯЗЬ
Соль
Ме
НеМе
О2
О2
Соль и вода
МеО
Только Li,
Na,
K,Rb,Cs
Ca, Sr, Ba
,
НеМеО
оксид
Основной оксид
+Н2О
Только
+Н2О НеМе,кроме
SiO2
НR
МеОН
основание
Соль и вода
Амфотерные оксиды
Амфотерное основание
кислота
ГЕНЕТИЧЕСКАЯ
СВЯЗЬ
Ме
НеМе
кислота
МеR
соль
МеОН
основание
МеR
соль
соль
НеМеО
Кислотный
оксид
НR
МеО
Основной
оксид
Соль и
водород
Соль и Ме
Соль и
вода
Соль и
вода
Соль и
вода
Соль и
вода
р+р=н
р+р=н
ПРОВЕРЬ СВОИ
ЗНАНИЯ
22.

1) KOH , Ca(OH)2 , HCl , NaOH
3). HNO3 , h3S , HClO4 , h4
5). K2O , SO3 , CaO , MgO
7) . BaO , K2O , CuO , Na2O
2). h3SO4 , HNO3 , Ba(OH)2 , h3S
4). KOH , Ca(OH)2, Al(OH)3 , Ba(OH)2
6). Mn2O7 , Cl2O , K2O , CO2
8). KCl , KHSO4 , KNO3 , K2SO4
23. Впиши формулу неизвестного вещества генетического ряда
1) Na → Na2O → ———
2) S → SO 3 → ———-
3) Mg → ——— → Mg(OH)2
4) Cl → ——- → HClO4
24. Найди ошибку в написании генетического ряда
1) Br → Br2O3 → HBrO4
2) N → N2O5 → HNO2
Электронные состояния оксида хлора (Cl2O), изученные методами ab initio конфигурационного взаимодействия и спектроскопии
https://doi.org/10.1016/j.chemphys.2008.09.011Получить права и содержание многообразия Cl 2 O были изучены с помощью расчетов взаимодействия конфигураций с несколькими эталонами и множеством корней с большими базисными наборами, которые включают функции Ридберга. Были получены многочисленные электронно-возбужденные и ионные состояния, которые обеспечивают наиболее полную интерпретацию известных спектров поглощения (диапазон энергий до ~10 эВ) и эффективности фотоионизации (диапазон энергий 11–16 эВ).Существует хорошая корреляция между наблюдаемыми энергиями ридберговских состояний и рассчитанными в настоящее время для ряда полос, включающих 1-ю и 4-ю энергии ионизации. Мало что известно о ридберговских состояниях для 2-й и 3-й энергий ионизации. Разделение ридберговских состояний с одинаковым верхним состоянием, но разным нижним состоянием показывает систематические тенденции, которые независимо подтверждают порядок катионных состояний в спектре УФ-ПЭС: 2 A 1 < 2 A 2 < 2 B 1 < 9 A 1 < 2 B 2 .
Были получены многочисленные электронно-возбужденные и ионные состояния, которые обеспечивают наиболее полную интерпретацию известных спектров поглощения (диапазон энергий до ~10 эВ) и эффективности фотоионизации (диапазон энергий 11–16 эВ).Существует хорошая корреляция между наблюдаемыми энергиями ридберговских состояний и рассчитанными в настоящее время для ряда полос, включающих 1-ю и 4-ю энергии ионизации. Мало что известно о ридберговских состояниях для 2-й и 3-й энергий ионизации. Разделение ридберговских состояний с одинаковым верхним состоянием, но разным нижним состоянием показывает систематические тенденции, которые независимо подтверждают порядок катионных состояний в спектре УФ-ПЭС: 2 A 1 < 2 A 2 < 2 B 1 < 9 A 1 < 2 B 2 . Наинизшее электронное состояние, найденное для этой системы, представляет собой несимметричную форму 3 A″ ( C S ), где асимметрия позволяет более низкому энергетическому каналу к диссоциации. На этом уровне теоретического исследования энергия диссоциации Cl 2 O → Cl + OCl составляет 1,382 эВ. Определен также ряд низколежащих синглетных и триплетных состояний с симметрией C 2 V или D ∞ h ; в первом случае валентный угол особенно сильно зависит от электронного состояния.
На этом уровне теоретического исследования энергия диссоциации Cl 2 O → Cl + OCl составляет 1,382 эВ. Определен также ряд низколежащих синглетных и триплетных состояний с симметрией C 2 V или D ∞ h ; в первом случае валентный угол особенно сильно зависит от электронного состояния.
ключевые слова
ключевые слова
AB INITIO
Электронная структура
Electronic Spectra
Singlet Spectra
Singlet States
Triblet Studds
Triblet Energy
Рекомендуемые статьи ионизации
Рекомендуемые статьи Статьи (0)
Смотреть полный текстCopyright © 2008 Elsevier BV Все права защищены .
Рекомендуемые статьи
Ссылки на статьи
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.

- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
физические свойства оксидов периода 3
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ПЕРИОДА 3 На этой странице объясняется взаимосвязь между физическими свойствами оксидов элементов 3-го периода (от натрия до хлора) и их структурой.Очевидно, что аргон не используется, поскольку он не образует оксид. Краткий обзор тенденций Оксиды Оксиды, которые мы рассмотрим:
Оксиды в верхнем ряду известны как высшие оксиды различных элементов.Это оксиды, в которых элементы периода 3 находятся в самых высоких степенях окисления. В этих оксидах все внешние электроны элемента Периода 3 участвуют в связывании — от одного с натрием до всех семи внешних электронов хлора. | |||||||||||||||
Примечание: Если вы не уверены в степенях окисления (числах окисления), вы найдете их обсуждение, если перейдете по этой ссылке. 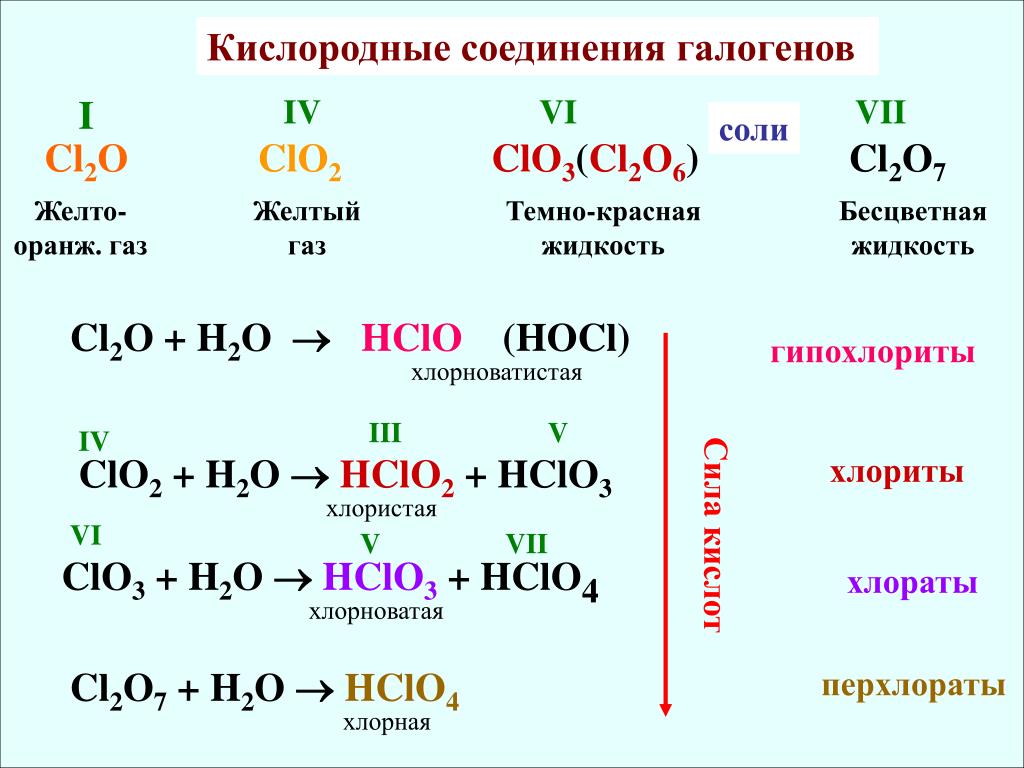 Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
Конструкции Тенденция в структуре от металлических оксидов, содержащих гигантские структуры ионов, слева от периода через гигантский ковалентный оксид (диоксид кремния) в середине к молекулярным оксидам справа. Точки плавления и кипения Гигантские структуры (оксиды металлов и диоксид кремния) будут иметь высокие температуры плавления и кипения, поскольку для разрыва прочных связей (ионных или ковалентных), действующих в трех измерениях, требуется много энергии. Оксиды фосфора, серы и хлора состоят из отдельных молекул — одни маленькие и простые; другие полимерные. Силы притяжения между этими молекулами будут представлять собой дисперсию Ван-дер-Ваальса и диполь-дипольные взаимодействия. Они различаются по размеру в зависимости от размера, формы и полярности различных молекул, но всегда будут намного слабее, чем ионные или ковалентные связи, которые необходимо разорвать в гигантской структуре. Эти оксиды, как правило, представляют собой газы, жидкости или твердые вещества с низкой температурой плавления. Электропроводность Ни один из этих оксидов не имеет свободных или подвижных электронов. Это означает, что ни один из них не будет проводить электричество, когда он твердый. Однако ионные оксиды могут подвергаться электролизу в расплавленном состоянии. Они могут проводить электричество из-за движения ионов к электродам и разряда ионов, когда они туда попадают. | |||||||||||||||
Предупреждение: Остальная часть этой страницы содержит довольно много подробностей о структурах различных оксидов.Не упускайте из виду общие тенденции того периода, когда вы смотрите на все эти детали. | |||||||||||||||
Оксиды металлов Конструкции Оксиды натрия, магния и алюминия состоят из гигантских структур, содержащих ионы металлов и ионы оксидов . | |||||||||||||||
Примечание: Вы можете найти структуру хлорида натрия (такую же, как структура оксида магния), перейдя по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
Точки плавления и кипения Между ионами каждого из этих оксидов существует сильное притяжение, и для разрушения этого притяжения требуется много тепловой энергии.Поэтому эти оксиды имеют высокие температуры плавления и кипения. | |||||||||||||||
Проблемы! Здесь я намеревался привести значения для каждого из оксидов, надеясь показать, что температуры плавления и кипения увеличиваются по мере увеличения заряда положительного иона от 1+ в натрии до 3+ в алюминии.  Можно было бы ожидать, что чем больше заряд, тем больше аттракционов. К сожалению, оксид с самой высокой температурой плавления и кипения — это оксид магния, , а не оксид алюминия! Так что эта теория пошла прахом! Можно было бы ожидать, что чем больше заряд, тем больше аттракционов. К сожалению, оксид с самой высокой температурой плавления и кипения — это оксид магния, , а не оксид алюминия! Так что эта теория пошла прахом!Причина этого, вероятно, заключается в увеличении электроотрицательности при переходе от натрия к магнию и алюминию.Это означало бы, что разница электроотрицательностей между металлом и кислородом уменьшается. Меньшая разница означает, что связь не будет такой чисто ионной. Также вероятно, что расплавленный оксид алюминия содержит сложные ионы, содержащие как алюминий, так и кислород, а не простые ионы алюминия и оксида. Все это, конечно, означает, что вы на самом деле не сравниваете подобное с подобным, поэтому не обязательно ожидать четкой тенденции. Другие проблемы, с которыми я столкнулся, связаны с оксидом натрия.В большинстве источников говорится, что он возгоняется (превращается из твердого состояния в пар) при 1275°C. Однако обычно надежные Webelements дают температуру плавления 1132°C, за которой следует температура разложения (до кипения) 1950°C. | |||||||||||||||
Электропроводность Ни один из них не проводит электричество в твердом состоянии, но возможен электролиз , если они находятся в расплавленном состоянии. Они проводят электричество из-за движения и разряда присутствующих ионов. Единственный важный пример этого — электролиз оксида алюминия при производстве алюминия. Возможность электролиза расплавленного оксида натрия зависит, конечно, от того, плавится ли он на самом деле, а не сублимируется или разлагается при обычных обстоятельствах.Если он сублимируется, вы не получите никакой жидкости для электролиза! Оксиды магния и алюминия имеют слишком высокую температуру плавления, чтобы их можно было подвергнуть электролизу в простой лаборатории. | |||||||||||||||
Примечание: Вы найдете полную информацию об электролизе оксида алюминия при извлечении алюминия, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу позже. | |||||||||||||||
Диоксид кремния (оксид кремния(IV)) Структура Электроотрицательность элементов увеличивается по мере прохождения периода, и к тому времени, когда вы доберетесь до кремния, разницы в электроотрицательности между кремнием и кислородом будет недостаточно для образования ионной связи.Диоксид кремния представляет собой гигантскую ковалентную структуру . | |||||||||||||||
Примечание: Если вас не устраивает электроотрицательность, вы найдете объяснение, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
Существуют три различные кристаллические формы диоксида кремния. Самый простой для запоминания и рисования основан на ромбовидной структуре. Кристаллический кремний имеет ту же структуру, что и алмаз. Чтобы превратить его в диоксид кремния, все, что вам нужно сделать, это изменить структуру кремния, включив в него несколько атомов кислорода. Обратите внимание, что каждый атом кремния связан со своими соседями атомом кислорода. Не забывайте, что это всего лишь крошечная часть гигантской структуры, простирающейся во всех трех измерениях. | |||||||||||||||
Примечание: Если вы хотите быть суетливым, валентные углы Si-O-Si на этой диаграмме неверны.На самом деле «мост» от одного атома кремния к соседнему расположен не по прямой линии, а в виде буквы «V» (подобной форме вокруг атома кислорода в молекуле воды). Чрезвычайно сложно изобразить это убедительно и аккуратно на диаграмме с таким количеством атомов.  Упрощение вполне приемлемо. Упрощение вполне приемлемо.Если вам нужна помощь в рисовании этой структуры, вы найдете предложение, перейдя по этой ссылке Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
Точки плавления и кипения Диоксид кремния имеет высокую температуру плавления, варьирующуюся в зависимости от конкретной структуры (помните, что данная структура является лишь одной из трех возможных структур), но все они составляют около 1700°C. Очень прочные ковалентные связи кремний-кислород должны быть разрушены по всей структуре, прежде чем произойдет плавление. Диоксид кремния кипит при 2230°С. Поскольку вы говорите о другой форме связи, нет смысла пытаться сравнивать эти значения напрямую с оксидами металлов.Что вы можете с уверенностью сказать, так это то, что, поскольку оксиды металлов и диоксид кремния имеют гигантскую структуру, все температуры плавления и кипения высокие. Электропроводность Диоксид кремния не имеет подвижных электронов или ионов, поэтому он не проводит электричество ни в твердом, ни в жидком состоянии. Молекулярные оксиды Фосфор, сера и хлор образуют оксиды, состоящие из молекул.Некоторые из этих молекул довольно просты, другие полимерны. Мы просто рассмотрим некоторые из самых простых. Температуры плавления и кипения этих оксидов будут намного ниже, чем у оксидов металлов или диоксида кремния. Межмолекулярные силы, удерживающие одну молекулу от соседей, будут дисперсионными силами Ван-дер-Ваальса или диполь-дипольными взаимодействиями. Сила их будет варьироваться в зависимости от размера молекул. Ни один из этих оксидов не проводит электричество ни в твердом, ни в жидком состоянии.Ни один из них не содержит ионов или свободных электронов. Оксиды фосфора Фосфор имеет два общих оксида: оксид фосфора (III), P 4 O 6 , и оксид фосфора (V), P 4 O 10 . Оксид фосфора(III) Оксид фосфора(III) представляет собой белое твердое вещество, плавящееся при 24°C и кипящее при 173°C. Структура его молекулы лучше всего изучена, начиная с молекулы P 4 , которая представляет собой небольшой тетраэдр. Разорвите его, чтобы увидеть связи. . . . . . а затем заменить связи новыми связями, связывающими атомы фосфора через атомы кислорода. Они будут иметь V-образную форму (скорее как в воде), но вы, вероятно, не будете оштрафованы, если нарисуете их на прямой линии между атомами фосфора на экзамене. Фосфор использует только три своих внешних электрона (3 неспаренных p-электрона) для образования связей с атомами кислорода. Оксид фосфора(V) Оксид фосфора(V) также представляет собой белое твердое вещество, возгоняющееся (превращающееся прямо из твердого состояния в пар) при 300°C. Твердый оксид фосфора(V) существует в нескольких различных формах, некоторые из которых являются полимерными. Мы сосредоточимся на простой молекулярной форме, которая также присутствует в паре. Легче всего нарисовать, начиная с P 4 O 6 .Остальные четыре атома кислорода присоединены к четырем атомам фосфора двойными связями. | |||||||||||||||
Примечание: Если внимательно присмотреться, форма этой молекулы очень похожа на то, как мы обычно рисуем повторяющуюся единицу в гигантской алмазной структуре. Однако не путайте их! Молекула P 4 O 10 останавливается здесь. Это не что-то вроде гигантской структуры — это все, что есть. В алмазе, конечно, структура почти бесконечно продолжается в трех измерениях. | |||||||||||||||
Оксиды серы Сера имеет два обычных оксида: диоксид серы (оксид серы (IV)), SO 2 , и триоксид серы (оксид серы (VI)), SO 3 . Диоксид серы Двуокись серы представляет собой бесцветный газ при комнатной температуре с легко узнаваемым запахом удушья. Он состоит из простых молекул SO 2 . Сера использует 4 своих внешних электрона для образования двойных связей с кислородом, оставляя два других в виде неподеленной пары на сере.Изогнутая форма SO 2 обусловлена этой одинокой парой. Триоксид серы Чистый триоксид серы представляет собой белое твердое вещество с низкой температурой плавления и кипения. Он очень быстро реагирует с водяным паром в воздухе с образованием серной кислоты. Это означает, что если вы сделаете что-то в лаборатории, то увидите, что это белый осадок, который резко дымит во влажном воздухе (образуя туман из капель серной кислоты). Газообразный триоксид серы состоит из простых молекул SO 3 , в связывании которых участвуют все шесть внешних электронов серы. Существуют различные формы твердого триоксида серы. Простейшим из них является тример S 3 O 9 , в котором три молекулы SO 3 соединены и образуют кольцо. Существуют и другие полимерные формы, в которых молекулы SO 3 объединяются в длинные цепочки. Например: | |||||||||||||||
Примечание: Это трудно изобразить убедительно.На самом деле, на каждом атоме серы один из атомов кислорода с двойными связями выходит из диаграммы к вам, а другой возвращается от вас. | |||||||||||||||
Тот факт, что простые молекулы соединяются таким образом, образуя более крупные структуры, делает триоксид серы твердым, а не газообразным. | |||||||||||||||
Примечание: Маловероятно, что вам понадобятся эти твердые конструкции для целей уровня UK A или его эквивалентов.  Если вы сомневаетесь, проверьте свою программу и прошлые работы. Если у вас нет ни одного из них, перейдите по этой ссылке, чтобы узнать, как их получить. Если вы сомневаетесь, проверьте свою программу и прошлые работы. Если у вас нет ни одного из них, перейдите по этой ссылке, чтобы узнать, как их получить. | |||||||||||||||
Оксиды хлора Хлор образует несколько оксидов. Здесь мы просто смотрим на два из них (единственные, упомянутые в любой из программ Великобритании) — оксид хлора (I), Cl 2 O, и оксид хлора (VII), Cl 2 O 7 . Оксид хлора(I) Оксид хлора(I) представляет собой желтовато-красный газ при комнатной температуре.Он состоит из простых небольших молекул. В этой молекуле нет ничего удивительного, и ее физические свойства как раз такие, какие вы ожидаете от молекулы такого размера. Оксид хлора(VII) В оксиде хлора (VII) хлор использует все свои семь внешних электронов в связях с кислородом. Это дает гораздо большую молекулу, и поэтому можно ожидать, что ее температура плавления и температура кипения будут выше, чем у оксида хлора (I). Оксид хлора(VII) представляет собой бесцветную маслянистую жидкость при комнатной температуре. На схеме для простоты я нарисовал стандартную структурную формулу. Фактически, форма тетраэдрическая вокруг обоих хлоров и V-образная вокруг центрального кислорода.
В меню Период 3 . . . В меню неорганической химии.. . В главное меню . . . © Джим Кларк, 2005 г. (изменено в октябре 2014 г.) | |||||||||||||||
Монооксид дихлора | Cl2O | ХимПаук
Прогнозные данные генерируются с помощью EPISuite™ Агентства по охране окружающей среды США.
Логарифмический коэффициент распределения октанол-вода (SRC):
Лог Ков (KOWWIN v1.67 оценка) = -0,41
Pt кипения, Pt плавления, оценка давления паров (MPBPWIN v1. 42):
Температура кипения Pt (градусы C): 484,57 (адаптированный метод Штейна и Брауна)
Плавка Pt (градусы C): 183,97 (средняя или взвешенная точка плавления)
VP (мм рт. ст., 25°C): 1,66E+003 (среднее значение VP по методам Антуана и Грейна)
МП (база опыта): -120,6 град С
АД (база эксп): 2,2 град С
Оценка растворимости в воде от Log Kow (WSKOW v1.41):
Растворимость в воде при 25°С (мг/л): 2,819e+005
log Kow: -0,41 (приблизительно)
используется уравнение неплавления pt
Оценка водного золя по фрагментам:
Ват Сол (v1.01 расч.) = 7,735e+005 мг/л
Программа класса ECOSAR (ECOSAR v0.99h):
Классы найдены:
Нейтральные органические вещества
Константа закона Генри (25°C) [HENRYWIN v3.10]:
Метод связи: неполный
Групповой метод: неполный
Henrys LC [оценка VP/WSol с использованием значений EPI]: 3,083E-004 атм-м3/моль
Логарифмический коэффициент распределения октанол-воздух (25°C) [KOAWIN v1.10]:
Can Not Estimate (не может рассчитать HenryLC)
Вероятность быстрой биодеградации (BIOWIN v4.
42):
Температура кипения Pt (градусы C): 484,57 (адаптированный метод Штейна и Брауна)
Плавка Pt (градусы C): 183,97 (средняя или взвешенная точка плавления)
VP (мм рт. ст., 25°C): 1,66E+003 (среднее значение VP по методам Антуана и Грейна)
МП (база опыта): -120,6 град С
АД (база эксп): 2,2 град С
Оценка растворимости в воде от Log Kow (WSKOW v1.41):
Растворимость в воде при 25°С (мг/л): 2,819e+005
log Kow: -0,41 (приблизительно)
используется уравнение неплавления pt
Оценка водного золя по фрагментам:
Ват Сол (v1.01 расч.) = 7,735e+005 мг/л
Программа класса ECOSAR (ECOSAR v0.99h):
Классы найдены:
Нейтральные органические вещества
Константа закона Генри (25°C) [HENRYWIN v3.10]:
Метод связи: неполный
Групповой метод: неполный
Henrys LC [оценка VP/WSol с использованием значений EPI]: 3,083E-004 атм-м3/моль
Логарифмический коэффициент распределения октанол-воздух (25°C) [KOAWIN v1.10]:
Can Not Estimate (не может рассчитать HenryLC)
Вероятность быстрой биодеградации (BIOWIN v4. 10):
Biowin1 (линейная модель): 0.7062
Biowin2 (нелинейная модель): 0,8550
Результаты экспертного исследования биоразложения:
Biowin3 (максимальная модель исследования): 3,0071 (недели)
Biowin4 (модель первичного обследования): 3,7224 (дни-недели)
Вероятность биодеградации MITI:
Biowin5 (линейная модель MITI): 0,4536
Biowin6 (нелинейная модель MITI): 0,5042
Вероятность анаэробного биоразложения:
Biowin7 (анаэробная линейная модель): 0,8361
Готов Прогноз биоразлагаемости: НЕТ
Биодеградация углеводородов (BioHCwin v1.01):
Структура несовместима с текущим методом оценки!
Сорбция аэрозолей (25 декабря C) [AEROWIN v1.00]:
Давление пара (жидкость/переохлаждение): 2,19E+005 Па (1,64E+003 мм рт.ст.)
Лог Коа (): недоступно
Kp (коэффициент разделения частиц/газа (м3/мкг)):
Модель Маккея: 1.37E-011
Модель октанол/воздух (Коа): нет в наличии
Фракция, сорбированная взвешенными частицами в воздухе (phi):
Модель Юнге-Панкова: 4.96E-010
Модель Маккея: 1.
10):
Biowin1 (линейная модель): 0.7062
Biowin2 (нелинейная модель): 0,8550
Результаты экспертного исследования биоразложения:
Biowin3 (максимальная модель исследования): 3,0071 (недели)
Biowin4 (модель первичного обследования): 3,7224 (дни-недели)
Вероятность биодеградации MITI:
Biowin5 (линейная модель MITI): 0,4536
Biowin6 (нелинейная модель MITI): 0,5042
Вероятность анаэробного биоразложения:
Biowin7 (анаэробная линейная модель): 0,8361
Готов Прогноз биоразлагаемости: НЕТ
Биодеградация углеводородов (BioHCwin v1.01):
Структура несовместима с текущим методом оценки!
Сорбция аэрозолей (25 декабря C) [AEROWIN v1.00]:
Давление пара (жидкость/переохлаждение): 2,19E+005 Па (1,64E+003 мм рт.ст.)
Лог Коа (): недоступно
Kp (коэффициент разделения частиц/газа (м3/мкг)):
Модель Маккея: 1.37E-011
Модель октанол/воздух (Коа): нет в наличии
Фракция, сорбированная взвешенными частицами в воздухе (phi):
Модель Юнге-Панкова: 4.96E-010
Модель Маккея: 1. 1E-009
Модель октанол/воздух (Коа): нет в наличии
Атмосферное окисление (25°C) [AopWin v1.92]:
Реакция гидроксильных радикалов:
ОБЩАЯ Константа скорости OH = 0,0000 E-12 см3/молекула-сек
Период полураспада = -------
Реакция озона:
Нет оценки реакции озона
Фракция, сорбированная взвешенными частицами в воздухе (phi): 7.97E-010 (Junge, Mackay)
Примечание: сорбированная фракция может быть устойчива к атмосферному окислению.
Коэффициент почвенной адсорбции (PCKOCWIN v1.66):
Коч: 23,74
Лог Кок: 1,376
Катализируемый кислотой гидролиз на водной основе (25°C) [HYDROWIN v1.67]:
Константы скорости НЕ могут быть оценены для этой структуры!
Оценки биоаккумуляции из Log Kow (BCFWIN v2.17):
Log BCF из метода на основе регрессии = 0,500 (BCF = 3,162)
log Kow: -0,41 (приблизительно)
Улетучивание из воды:
Генри LC: 0,000308 атм-м3/моль (рассчитано из VP/WS)
Half-Life от Model River: 2,722 часа
Half-Life от Model Lake: 107,9 часов (4,494 дня)
Удаление при очистке сточных вод:
Общее удаление: 23,92%
Общее биоразложение: 0,08 процента
Общая адсорбция шлама: 1,42%
Всего в воздух: 22.
1E-009
Модель октанол/воздух (Коа): нет в наличии
Атмосферное окисление (25°C) [AopWin v1.92]:
Реакция гидроксильных радикалов:
ОБЩАЯ Константа скорости OH = 0,0000 E-12 см3/молекула-сек
Период полураспада = -------
Реакция озона:
Нет оценки реакции озона
Фракция, сорбированная взвешенными частицами в воздухе (phi): 7.97E-010 (Junge, Mackay)
Примечание: сорбированная фракция может быть устойчива к атмосферному окислению.
Коэффициент почвенной адсорбции (PCKOCWIN v1.66):
Коч: 23,74
Лог Кок: 1,376
Катализируемый кислотой гидролиз на водной основе (25°C) [HYDROWIN v1.67]:
Константы скорости НЕ могут быть оценены для этой структуры!
Оценки биоаккумуляции из Log Kow (BCFWIN v2.17):
Log BCF из метода на основе регрессии = 0,500 (BCF = 3,162)
log Kow: -0,41 (приблизительно)
Улетучивание из воды:
Генри LC: 0,000308 атм-м3/моль (рассчитано из VP/WS)
Half-Life от Model River: 2,722 часа
Half-Life от Model Lake: 107,9 часов (4,494 дня)
Удаление при очистке сточных вод:
Общее удаление: 23,92%
Общее биоразложение: 0,08 процента
Общая адсорбция шлама: 1,42%
Всего в воздух: 22. 42 процента
(с использованием 10 000 часов Bio P, A, S)
Модель фугитивности III уровня:
Массовое количество выбросов периода полураспада
(проценты) (ч) (кг/ч)
Воздух 40,7 1e+005 1000
Вода 42,3 360 1000
Почва 17 720 1000
Осадок 0,0777 3,24e+003 0
Время стойкости: 183 часа
42 процента
(с использованием 10 000 часов Bio P, A, S)
Модель фугитивности III уровня:
Массовое количество выбросов периода полураспада
(проценты) (ч) (кг/ч)
Воздух 40,7 1e+005 1000
Вода 42,3 360 1000
Почва 17 720 1000
Осадок 0,0777 3,24e+003 0
Время стойкости: 183 часа
Молекулярные структуры, термохимия и сродство к электрону для оксидов дихлора: Cl2On/Cl2On — (n = 1-4)
Молекулярные структуры, относительные энергии, частоты колебаний и сродство к электрону для Cl2On/Cl2O (n = 1– 4) системы были исследованы с использованием гибридных теорий Хартри-Фока/функционала плотности (BHLYP и B3LYP) и чисто теорий функционала плотности (BP86 и BLYP).В этом исследовании сообщалось о трех различных типах разности энергий нейтралов и анионов: адиабатическом сродстве к электрону (EAad), вертикальном сродстве к электрону (EAvret) и энергии вертикального отрыва (VDE). Базисный набор, используемый в этой работе, имеет качество двойной ζ плюс поляризации с дополнительными диффузными функциями s- и p-типа и обозначается DZP++. Геометрии полностью оптимизированы всеми четырьмя методами DFT. Мы предсказали ряд возможных низких локальных минимумов, в том числе беспрецедентные.Самое поразительное, что в ряде случаев структуры, наблюдаемые в лаборатории, оказываются не самыми низкоэнергетическими для того или иного химического состава. Предсказаны две структуры с формально семикоординационным атомом хлора. Глобальные минимумы для систем Cl2On/Cl2O (n = 1–4): ClOCl (C2v), ClClO– (Cs), ClOOCl (C2), OOCl (C2v), ClOOOCl (C2/C1), ClO(O2)Cl − (Cs), транс-ClO(O2)OCl (Ci) и транс-ClO(O2)OCl− (Ci) соответственно. Приведены относительные энергии различных минимумов.Пять из 42 предсказанных здесь структур были определены экспериментально. Наши теоретические геометрии и частоты колебаний тщательно сравниваются с ограниченными доступными экспериментальными результатами, и функционал BHLYP в целом обеспечивает наилучшее соответствие. Основные состояния ClClO– и ClClO можно рассматривать как комплексы Cl–…ClO и Cl–…ClO2 соответственно.
Геометрии полностью оптимизированы всеми четырьмя методами DFT. Мы предсказали ряд возможных низких локальных минимумов, в том числе беспрецедентные.Самое поразительное, что в ряде случаев структуры, наблюдаемые в лаборатории, оказываются не самыми низкоэнергетическими для того или иного химического состава. Предсказаны две структуры с формально семикоординационным атомом хлора. Глобальные минимумы для систем Cl2On/Cl2O (n = 1–4): ClOCl (C2v), ClClO– (Cs), ClOOCl (C2), OOCl (C2v), ClOOOCl (C2/C1), ClO(O2)Cl − (Cs), транс-ClO(O2)OCl (Ci) и транс-ClO(O2)OCl− (Ci) соответственно. Приведены относительные энергии различных минимумов.Пять из 42 предсказанных здесь структур были определены экспериментально. Наши теоретические геометрии и частоты колебаний тщательно сравниваются с ограниченными доступными экспериментальными результатами, и функционал BHLYP в целом обеспечивает наилучшее соответствие. Основные состояния ClClO– и ClClO можно рассматривать как комплексы Cl–…ClO и Cl–…ClO2 соответственно. Адиабатическое сродство к электрону, полученное на предпочтительном уровне теории DZP++ BLYP, составляет 3,12 эВ для Cl2O, 3,96 эВ для Cl2O2, 3.66 эВ для Cl2O3 и 4,15 эВ для Cl2O4. Адиабатические ЭА для первых трех систем аналогичны таковым для Br2On (3,14, 3,80 и 3,46 эВ с BLYP для Br2On, n = 1–3), и это может отражать геометрическое сходство между этими формами брома и хлора. Но EAad для Br2O4 (1,97 эВ) отличается от Cl2O4, потому что нейтральные и анионные соединения брома имеют другую геометрию глобального минимума, чем для Cl2O4. © 2003 Wiley Periodicals, Inc. Int J Quantum Chem, 2003
Адиабатическое сродство к электрону, полученное на предпочтительном уровне теории DZP++ BLYP, составляет 3,12 эВ для Cl2O, 3,96 эВ для Cl2O2, 3.66 эВ для Cl2O3 и 4,15 эВ для Cl2O4. Адиабатические ЭА для первых трех систем аналогичны таковым для Br2On (3,14, 3,80 и 3,46 эВ с BLYP для Br2On, n = 1–3), и это может отражать геометрическое сходство между этими формами брома и хлора. Но EAad для Br2O4 (1,97 эВ) отличается от Cl2O4, потому что нейтральные и анионные соединения брома имеют другую геометрию глобального минимума, чем для Cl2O4. © 2003 Wiley Periodicals, Inc. Int J Quantum Chem, 2003
оксикислота | химическое соединение | Британика
Азотная кислота, HNO 3 , была известна алхимикам 8-го века как «aqua fortis» (сильная вода).Он образуется в результате реакции пятиокиси азота (N 2 O 5 ) и диоксида азота (NO 2 ) с водой. Небольшие количества азотной кислоты обнаруживаются в атмосфере после гроз, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу. Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов).Нитрат калия, KNO 3 , иногда называемый бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; Например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), а NaNO 3 и NaHSO 4 являются нелетучими солями, азотная кислота легко удаляется перегонкой.
Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу. Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов).Нитрат калия, KNO 3 , иногда называемый бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; Например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), а NaNO 3 и NaHSO 4 являются нелетучими солями, азотная кислота легко удаляется перегонкой.
В промышленных масштабах азотная кислота производится по процессу Оствальда. Этот процесс включает окисление аммиака NH 3 до оксида азота NO, дальнейшее окисление NO до диоксида азота NO 2 и последующее превращение NO 2 в азотную кислоту (HNO 3 ).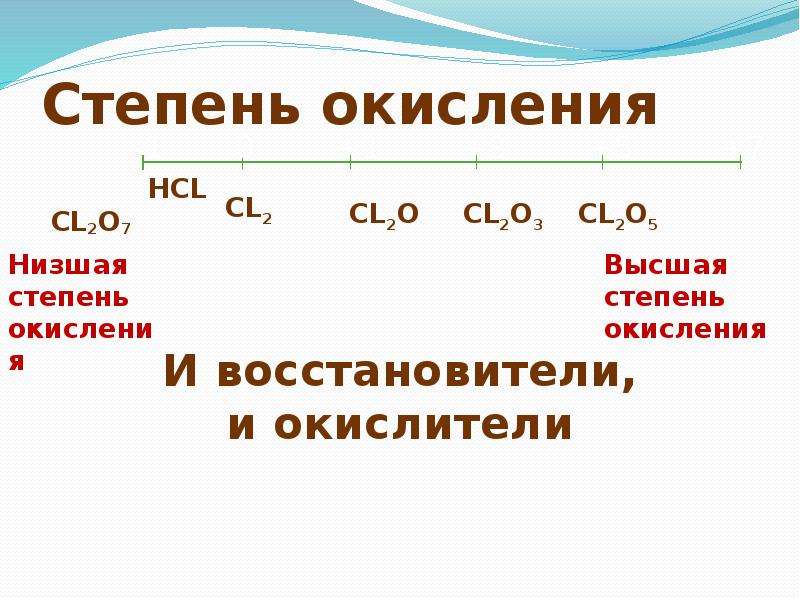 . Это поточный процесс, при котором смесь аммиака и избыточного воздуха нагревается до 600–700 °C (от 1100 до 1300 °F) и проходит через платино-родиевый катализатор. (Катализатор увеличивает скорость реакции, не расходуясь при этом сам.) Поскольку происходит окисление до NO, эта газообразная смесь буквально сгорает пламенем. Добавляется дополнительный воздух для окисления NO до NO 2 . NO 2 , избыток кислорода и нереакционноспособный азот из воздуха пропускают через распыляемую воду, где образуются HNO 3 и NO по мере диспропорционирования NO 2 . Газообразный NO рециркулируется в процессе вместе с большим количеством воздуха, а жидкая HNO 3 отводится и концентрируется. Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
. Это поточный процесс, при котором смесь аммиака и избыточного воздуха нагревается до 600–700 °C (от 1100 до 1300 °F) и проходит через платино-родиевый катализатор. (Катализатор увеличивает скорость реакции, не расходуясь при этом сам.) Поскольку происходит окисление до NO, эта газообразная смесь буквально сгорает пламенем. Добавляется дополнительный воздух для окисления NO до NO 2 . NO 2 , избыток кислорода и нереакционноспособный азот из воздуха пропускают через распыляемую воду, где образуются HNO 3 и NO по мере диспропорционирования NO 2 . Газообразный NO рециркулируется в процессе вместе с большим количеством воздуха, а жидкая HNO 3 отводится и концентрируется. Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
В чистом виде азотная кислота представляет собой бесцветную жидкость, которая кипит при 86 ° C (187 ° F) и замерзает при -42 ° C (-44 ° F). Под воздействием света или тепла он разлагается с образованием кислорода, воды и смеси оксидов азота (в основном NO 2 ).
4HNO 3 + свет (или тепло) → 4ΝΟ 2 + 2H 2 O + O 2 Следовательно, азотная кислота часто имеет желтый или коричневый цвет из-за NO 2 , который образуется при ее разложении. Азотная кислота стабильна в водном растворе, а 68-процентные растворы кислоты (т.е., 68 граммов HNO 3 на 100 граммов раствора) продается как концентрированная HNO 3 . Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; Например,
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.
Кроме того, многие соединения окисляются HNO 3 .Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 .
Под воздействием света или тепла он разлагается с образованием кислорода, воды и смеси оксидов азота (в основном NO 2 ).
4HNO 3 + свет (или тепло) → 4ΝΟ 2 + 2H 2 O + O 2 Следовательно, азотная кислота часто имеет желтый или коричневый цвет из-за NO 2 , который образуется при ее разложении. Азотная кислота стабильна в водном растворе, а 68-процентные растворы кислоты (т.е., 68 граммов HNO 3 на 100 граммов раствора) продается как концентрированная HNO 3 . Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; Например,
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.
Кроме того, многие соединения окисляются HNO 3 .Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 . Царская водка («королевская вода»), смесь одной части концентрированной HNO 3 и трех частей концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Царская водка («королевская вода»), смесь одной части концентрированной HNO 3 и трех частей концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Действие азотной кислоты на металл обычно приводит к восстановлению кислоты (т.д., уменьшение степени окисления азота). Продукты реакции определяются концентрацией HNO 3 , вовлеченным металлом (т. е. его реакционной способностью) и температурой. В большинстве случаев образуется смесь оксидов азота, нитратов и других продуктов восстановления. Относительно нереакционноспособные металлы, такие как медь (Cu), серебро (Ag) и свинец (Pb), восстанавливают концентрированную HNO 3 в первую очередь до NO 2 . Реакция разбавленной HNO 3 с медью дает NO, тогда как более активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O. При использовании чрезвычайно разбавленной HNO 3 может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
При использовании чрезвычайно разбавленной HNO 3 может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
Нитраты, представляющие собой соли азотной кислоты, образуются при взаимодействии металлов или их оксидов, гидроксидов или карбонатов с азотной кислотой. Большинство нитратов растворимы в воде, и азотная кислота в основном используется для получения растворимых нитратов металлов.Все нитраты разлагаются при нагревании и могут происходить со взрывом. Например, при нагревании нитрата калия (KNO 3 ) образуется нитрит (соединение, содержащее NO 2 — ) и выделяется газообразный кислород.
2КНО 3 + нагрев → 2КНО 2 + О 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в
2Cu(NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 .




 Оксид магния имеет структуру, аналогичную хлориду натрия. Два других имеют более сложное расположение ионов, выходящее за рамки учебных программ на этом уровне (уровень UK A или его эквиваленты).
Оксид магния имеет структуру, аналогичную хлориду натрия. Два других имеют более сложное расположение ионов, выходящее за рамки учебных программ на этом уровне (уровень UK A или его эквиваленты). В других источниках говорится о его разложении (до натрия и пероксида натрия) выше 400°С. Я понятия не имею, какова правда об этом, хотя я подозреваю, что значение точки плавления Webelements, вероятно, для давления выше атмосферного давления (хотя об этом не говорится).
В других источниках говорится о его разложении (до натрия и пероксида натрия) выше 400°С. Я понятия не имею, какова правда об этом, хотя я подозреваю, что значение точки плавления Webelements, вероятно, для давления выше атмосферного давления (хотя об этом не говорится).



 В этом случае фосфор использует для связи все пять своих внешних электронов.
В этом случае фосфор использует для связи все пять своих внешних электронов.


 42):
Температура кипения Pt (градусы C): 484,57 (адаптированный метод Штейна и Брауна)
Плавка Pt (градусы C): 183,97 (средняя или взвешенная точка плавления)
VP (мм рт. ст., 25°C): 1,66E+003 (среднее значение VP по методам Антуана и Грейна)
МП (база опыта): -120,6 град С
АД (база эксп): 2,2 град С
Оценка растворимости в воде от Log Kow (WSKOW v1.41):
Растворимость в воде при 25°С (мг/л): 2,819e+005
log Kow: -0,41 (приблизительно)
используется уравнение неплавления pt
Оценка водного золя по фрагментам:
Ват Сол (v1.01 расч.) = 7,735e+005 мг/л
Программа класса ECOSAR (ECOSAR v0.99h):
Классы найдены:
Нейтральные органические вещества
Константа закона Генри (25°C) [HENRYWIN v3.10]:
Метод связи: неполный
Групповой метод: неполный
Henrys LC [оценка VP/WSol с использованием значений EPI]: 3,083E-004 атм-м3/моль
Логарифмический коэффициент распределения октанол-воздух (25°C) [KOAWIN v1.10]:
Can Not Estimate (не может рассчитать HenryLC)
Вероятность быстрой биодеградации (BIOWIN v4.
42):
Температура кипения Pt (градусы C): 484,57 (адаптированный метод Штейна и Брауна)
Плавка Pt (градусы C): 183,97 (средняя или взвешенная точка плавления)
VP (мм рт. ст., 25°C): 1,66E+003 (среднее значение VP по методам Антуана и Грейна)
МП (база опыта): -120,6 град С
АД (база эксп): 2,2 град С
Оценка растворимости в воде от Log Kow (WSKOW v1.41):
Растворимость в воде при 25°С (мг/л): 2,819e+005
log Kow: -0,41 (приблизительно)
используется уравнение неплавления pt
Оценка водного золя по фрагментам:
Ват Сол (v1.01 расч.) = 7,735e+005 мг/л
Программа класса ECOSAR (ECOSAR v0.99h):
Классы найдены:
Нейтральные органические вещества
Константа закона Генри (25°C) [HENRYWIN v3.10]:
Метод связи: неполный
Групповой метод: неполный
Henrys LC [оценка VP/WSol с использованием значений EPI]: 3,083E-004 атм-м3/моль
Логарифмический коэффициент распределения октанол-воздух (25°C) [KOAWIN v1.10]:
Can Not Estimate (не может рассчитать HenryLC)
Вероятность быстрой биодеградации (BIOWIN v4. 10):
Biowin1 (линейная модель): 0.7062
Biowin2 (нелинейная модель): 0,8550
Результаты экспертного исследования биоразложения:
Biowin3 (максимальная модель исследования): 3,0071 (недели)
Biowin4 (модель первичного обследования): 3,7224 (дни-недели)
Вероятность биодеградации MITI:
Biowin5 (линейная модель MITI): 0,4536
Biowin6 (нелинейная модель MITI): 0,5042
Вероятность анаэробного биоразложения:
Biowin7 (анаэробная линейная модель): 0,8361
Готов Прогноз биоразлагаемости: НЕТ
Биодеградация углеводородов (BioHCwin v1.01):
Структура несовместима с текущим методом оценки!
Сорбция аэрозолей (25 декабря C) [AEROWIN v1.00]:
Давление пара (жидкость/переохлаждение): 2,19E+005 Па (1,64E+003 мм рт.ст.)
Лог Коа (): недоступно
Kp (коэффициент разделения частиц/газа (м3/мкг)):
Модель Маккея: 1.37E-011
Модель октанол/воздух (Коа): нет в наличии
Фракция, сорбированная взвешенными частицами в воздухе (phi):
Модель Юнге-Панкова: 4.96E-010
Модель Маккея: 1.
10):
Biowin1 (линейная модель): 0.7062
Biowin2 (нелинейная модель): 0,8550
Результаты экспертного исследования биоразложения:
Biowin3 (максимальная модель исследования): 3,0071 (недели)
Biowin4 (модель первичного обследования): 3,7224 (дни-недели)
Вероятность биодеградации MITI:
Biowin5 (линейная модель MITI): 0,4536
Biowin6 (нелинейная модель MITI): 0,5042
Вероятность анаэробного биоразложения:
Biowin7 (анаэробная линейная модель): 0,8361
Готов Прогноз биоразлагаемости: НЕТ
Биодеградация углеводородов (BioHCwin v1.01):
Структура несовместима с текущим методом оценки!
Сорбция аэрозолей (25 декабря C) [AEROWIN v1.00]:
Давление пара (жидкость/переохлаждение): 2,19E+005 Па (1,64E+003 мм рт.ст.)
Лог Коа (): недоступно
Kp (коэффициент разделения частиц/газа (м3/мкг)):
Модель Маккея: 1.37E-011
Модель октанол/воздух (Коа): нет в наличии
Фракция, сорбированная взвешенными частицами в воздухе (phi):
Модель Юнге-Панкова: 4.96E-010
Модель Маккея: 1. 1E-009
Модель октанол/воздух (Коа): нет в наличии
Атмосферное окисление (25°C) [AopWin v1.92]:
Реакция гидроксильных радикалов:
ОБЩАЯ Константа скорости OH = 0,0000 E-12 см3/молекула-сек
Период полураспада = -------
Реакция озона:
Нет оценки реакции озона
Фракция, сорбированная взвешенными частицами в воздухе (phi): 7.97E-010 (Junge, Mackay)
Примечание: сорбированная фракция может быть устойчива к атмосферному окислению.
Коэффициент почвенной адсорбции (PCKOCWIN v1.66):
Коч: 23,74
Лог Кок: 1,376
Катализируемый кислотой гидролиз на водной основе (25°C) [HYDROWIN v1.67]:
Константы скорости НЕ могут быть оценены для этой структуры!
Оценки биоаккумуляции из Log Kow (BCFWIN v2.17):
Log BCF из метода на основе регрессии = 0,500 (BCF = 3,162)
log Kow: -0,41 (приблизительно)
Улетучивание из воды:
Генри LC: 0,000308 атм-м3/моль (рассчитано из VP/WS)
Half-Life от Model River: 2,722 часа
Half-Life от Model Lake: 107,9 часов (4,494 дня)
Удаление при очистке сточных вод:
Общее удаление: 23,92%
Общее биоразложение: 0,08 процента
Общая адсорбция шлама: 1,42%
Всего в воздух: 22.
1E-009
Модель октанол/воздух (Коа): нет в наличии
Атмосферное окисление (25°C) [AopWin v1.92]:
Реакция гидроксильных радикалов:
ОБЩАЯ Константа скорости OH = 0,0000 E-12 см3/молекула-сек
Период полураспада = -------
Реакция озона:
Нет оценки реакции озона
Фракция, сорбированная взвешенными частицами в воздухе (phi): 7.97E-010 (Junge, Mackay)
Примечание: сорбированная фракция может быть устойчива к атмосферному окислению.
Коэффициент почвенной адсорбции (PCKOCWIN v1.66):
Коч: 23,74
Лог Кок: 1,376
Катализируемый кислотой гидролиз на водной основе (25°C) [HYDROWIN v1.67]:
Константы скорости НЕ могут быть оценены для этой структуры!
Оценки биоаккумуляции из Log Kow (BCFWIN v2.17):
Log BCF из метода на основе регрессии = 0,500 (BCF = 3,162)
log Kow: -0,41 (приблизительно)
Улетучивание из воды:
Генри LC: 0,000308 атм-м3/моль (рассчитано из VP/WS)
Half-Life от Model River: 2,722 часа
Half-Life от Model Lake: 107,9 часов (4,494 дня)
Удаление при очистке сточных вод:
Общее удаление: 23,92%
Общее биоразложение: 0,08 процента
Общая адсорбция шлама: 1,42%
Всего в воздух: 22. 42 процента
(с использованием 10 000 часов Bio P, A, S)
Модель фугитивности III уровня:
Массовое количество выбросов периода полураспада
(проценты) (ч) (кг/ч)
Воздух 40,7 1e+005 1000
Вода 42,3 360 1000
Почва 17 720 1000
Осадок 0,0777 3,24e+003 0
Время стойкости: 183 часа
42 процента
(с использованием 10 000 часов Bio P, A, S)
Модель фугитивности III уровня:
Массовое количество выбросов периода полураспада
(проценты) (ч) (кг/ч)
Воздух 40,7 1e+005 1000
Вода 42,3 360 1000
Почва 17 720 1000
Осадок 0,0777 3,24e+003 0
Время стойкости: 183 часа