Учебно-методический материал по химии (9 класс) по теме: Взаимодействие металлов с кислотами
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная h3SO4, соляная HCl и азотная HNO3.
Соляная кислота (HCl)
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl. Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
HCl H+ + Cl-
Образующиеся в этом процессе ионы водорода H+ выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + h3↑
При этом соль представляет собой хлорид металла (NiCl2, CaCl2, AlCl3), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe0 → Fe2+
Co0 → Co2+
Ni0 → Ni2+
Cr0 → Cr2+
Mn0 → Mn2+ и др.
Пример:
2 Al + 6 HCl → 2 AlCl3 + 3 h3↑
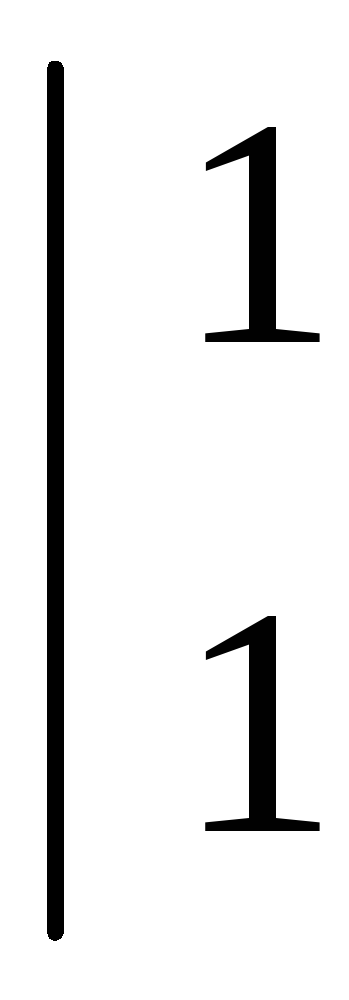
2│Al0 – 3e- → Al3+ — окисление
3│2H+ + 2e- → h3 – восстановление
Соляная кислота пассивирует свинец (Pb). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца (II), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl2↓ + h3↑
Серная кислота (h3SO4)
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
h3SO4 H+ + HSO4-
HSO4- H+ + SO42-
Образующиеся ионы Н+ выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Ме + h3SO4(разб.) → соль + h3↑
Пример:
2 Al + 3 h3SO4(разб.) → Al2(SO4)3 + 3 h3↑
1│2Al0 – 6e- → 2Al3+ — окисление
3│2H+ + 2e- → h3 – восстановление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Fe0 → Fe2+
Co0 → Co2+
Ni0 → Ni2+
Cr0 → Cr2+
Mn0 → Mn2+ и др.
Свинец (Pb) не растворяется в серной кислоте (если ее концентрация ниже 80%), так как образующаяся соль PbSO4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления (S+6). Концентрированная h3SO4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO42- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + h3SO4 (конц.) соль + вода + продукт восстановления h3SO4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из h3S, S и SO2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:
Алюминий (Al) и железо (Fe) не реагируют с холодной концентрированной h3SO4, покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag, Au, Ru, Os, Rh, Ir, Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe0 → Fe3+,
Cr0 → Cr3+,
Mn0 → Mn4+,
Sn0 → Sn4+
Свинец (Pb) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb(HSO4)2.
Примеры:
Активный металл
8 A1 + 15 h3SO4(конц.)→4A12(SO4)3 + 12h3O + 3h3S
4│2Al0 – 6e- → 2Al3+ — окисление
3│ S6+ + 8e → S2-– восстановление
Металл средней активности
2Cr + 4 h3SO4(конц.)→ Cr2(SO4)3 + 4 h3O + S
1│ 2Cr0 – 6e →2Cr3+- окисление
1│ S6+ + 6e → S0 — восстановление
Металл малоактивный
2Bi + 6h3SO4(конц.)→ Bi2(SO4)3 + 6h3O + 3SO2
1│ 2Bi0 – 6e → 2Bi3+ – окисление
3│ S6+ + 2e →S4+ — восстановление
Азотная кислота (HNO3)
Особенностью азотной кислоты является то, что азот, входящий в состав NO3- имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N5+. Следовательно, водород h3 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации). Процесс протекает по схеме:
Me + HNO3 соль + вода + продукт восстановления HNO3
Продукты восстановления HNO3:
Обычно при взаимодействии азотной кислоты с металлом образуется смесь продуктов восстановления, но как правило, один из них является преобладающим. Какой из продуктов будет основным, зависит от концентрации кислоты и активности металла.
Концентрированная азотная кислота
Концентрированным считают раствор кислоты плотностью ρ > 1,25 кг/м3, что соответствует
концентрации > 40%. Независимо от активности металла реакция взаимодействия с HNO3 (конц.) протекает по схеме:
Me + HNO3(конц.) → соль + вода + NO2
С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr, Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры, она протекает по схеме, представленной выше.
Примеры
Активный металл
Al + 6HNO3(конц.) → Al(NO3)3 + 3h3O + 3NO2↑
1│ Al0 – 3e → Al3+ — окисление
3│ N5+ + e → N4+ — восстановление
Металл средней активности
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3h3O + 3NO↑
1│ Fe0 – 3e → Fe3+ — окисление
3│ N5+ + e → N4+ — восстановление
Металл малоактивный
Ag + 2HNO3(конц.) → AgNO3 + h3O + NO2↑
1│ Ag0 – e →Ag+ — окисление
1│ N5+ + e → N4+ — восстановление
Разбавленная азотная кислота
Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла, участвующего в реакции:
Примеры:
Активный металл
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9h3O + 3Nh5NO3
8│ Al0 – 3e → Al3+ — окисление
3│ N5+ + 8e → N3- — восстановление
Выделяющийся в процессе восстановления азотной кислоты аммиак сразу взаимодействует с избытком азотной кислоты, образуя соль – нитрат аммония Nh5NO3:
Nh4 + HNO3 → Nh5NO3.
Металл средней активности
10Cr + 36HNO3(разб.) → 10Cr(NO3)3 + 18h3O + 3N2
10│ Cr0 – 3e → Cr3+ — окисление
3│ 2N5+ + 10e → N20 — восстановление
Кроме молекулярного азота (N2) при взаимодействии металлов средней активности с разбавленной азотной кислотой образуется в равном количестве оксид азота (I) – N2O. В уравнении реакции нужно писать одно из этих веществ.
Металл малоактивный
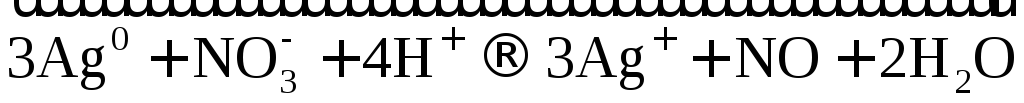
3Ag + 4HNO3(разб.) → 3AgNO3 + 2h3O + NO
3│ Ag0 – e →Ag+ — окисление
1│ N5+ + 3e → N2+ — восстановление
«Царская водка»
«Царская водка» (ранее кислоты называли водками) представляет собой смесь одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, обладающую очень высокой окислительной активностью. Такая смесь способна растворять некоторые малоактивные металлы, не взаимодействующие с азотной кислотой. Среди них и «царь металлов» — золото. Такое действие «царской водки» объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила – NOCl:
HNO3 + 3 HCl → Cl2 + 2 h3O + NOCl
Хлорид нитрозила далее разлагается по схеме:
2 NOCl → 2 NO + Cl2
Хлор в момент выделения состоит из атомов. Атомарный хлор является сильнейшим окислителем, что и позволяет «царской водке» воздействовать даже на самые инертные «благородные металлы».
Реакции окисления золота и платины протекают согласно следующим уравнениям:
Au + HNO3 + 4 HCl → H[AuCl4] + NO + 2h3O
3Pt + 4HNO3 + 18HCl → 3h3[PtCl6] + 4NO + 8h3O
На Ru, Os, Rh и Ir «царская водка» не действует.
7.3. Взаимодействие металлов с кислотами
Почти все металлы реагируют с кислотами, образуя соли. Характер взаимодействия металла с кислотой зависит от активности металла, его свойств и концентрации кислоты.
При действии
кислоты на металл роль окислителя играет
или ион водорода (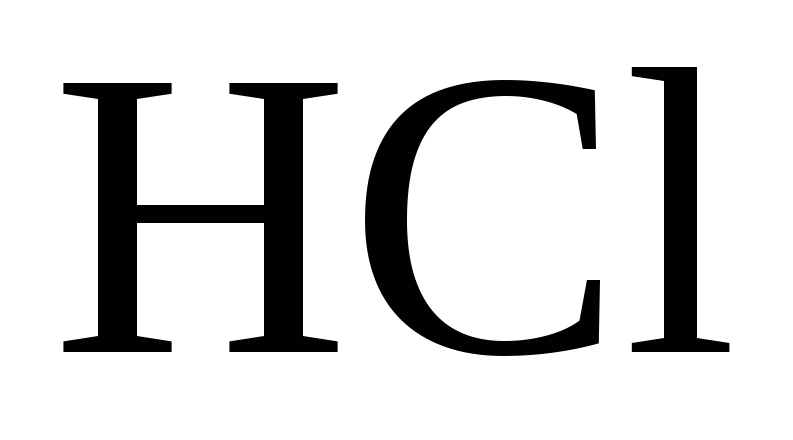 ,
разбавленная
,
разбавленная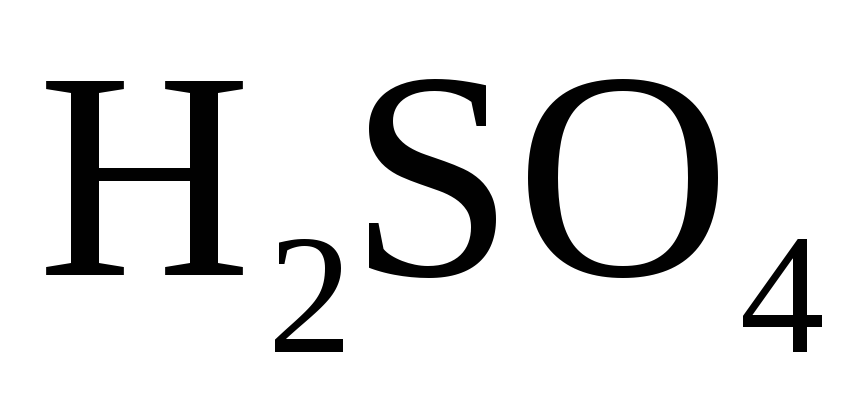 ),
или кислотный остаток кислородсодержащей
кислоты (
),
или кислотный остаток кислородсодержащей
кислоты ( ,
,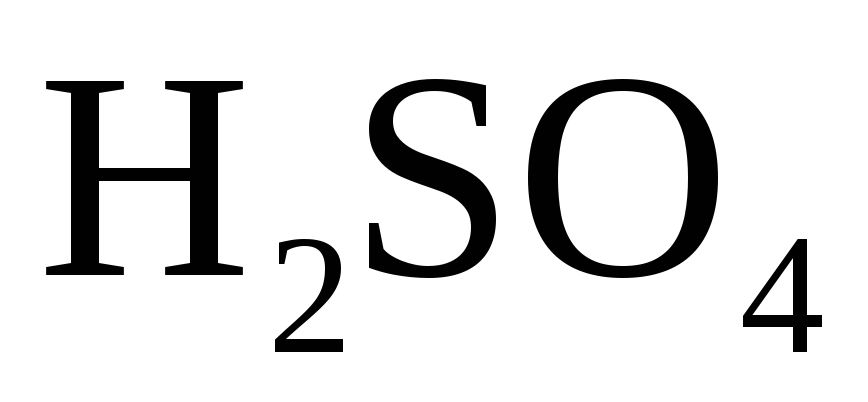 —
концентрированная).
—
концентрированная).
Взаимодействие металлов с соляной кислотой.
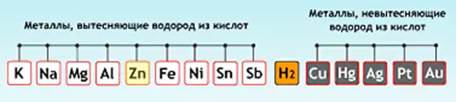
С соляной кислотой взаимодействуют металлы, стоящие в ряду напряжений до водорода.
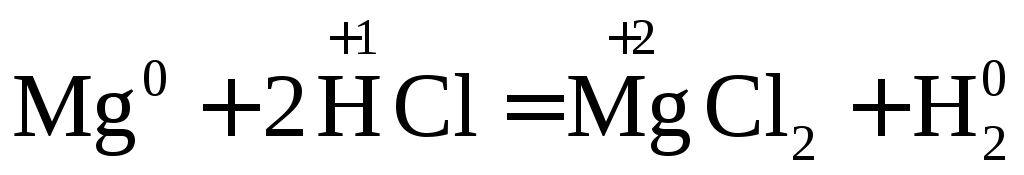 .
. 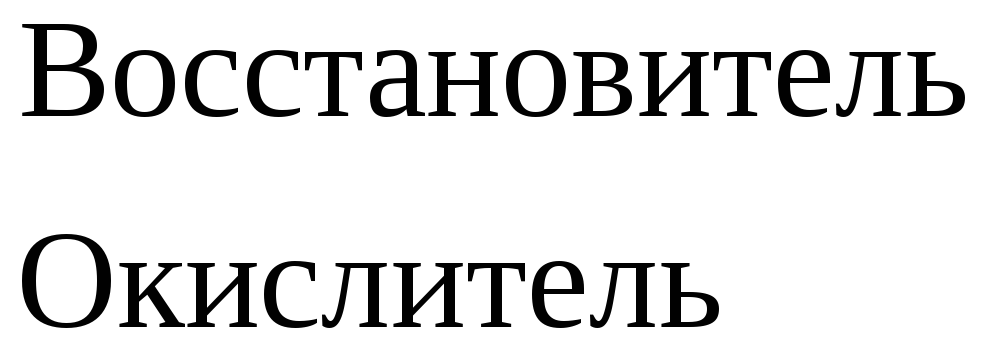
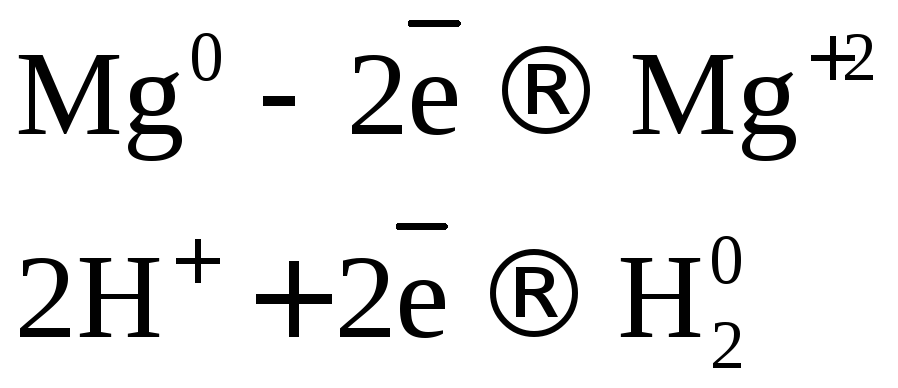
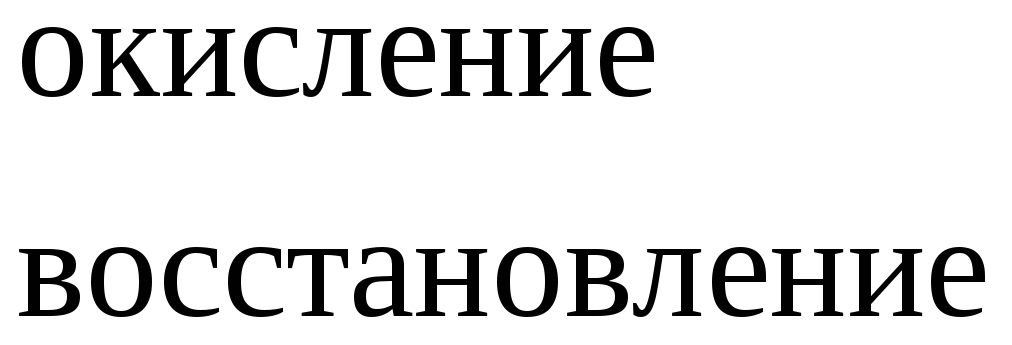
Вывод: окислителем являются катионы водорода, которые принимают электроны от атома металла.
Взаимодействие металлов с азотной кислотой
Концентрированная
и разбавленная азотная кислота
окисляет
металлы без выделения водорода, так как
в ней окислителем является нитрат-ион
( ).
).
Восстановление азотной кислоты различной концентрации при взаимодействии с металлами разной активности можно представить в виде схемы.







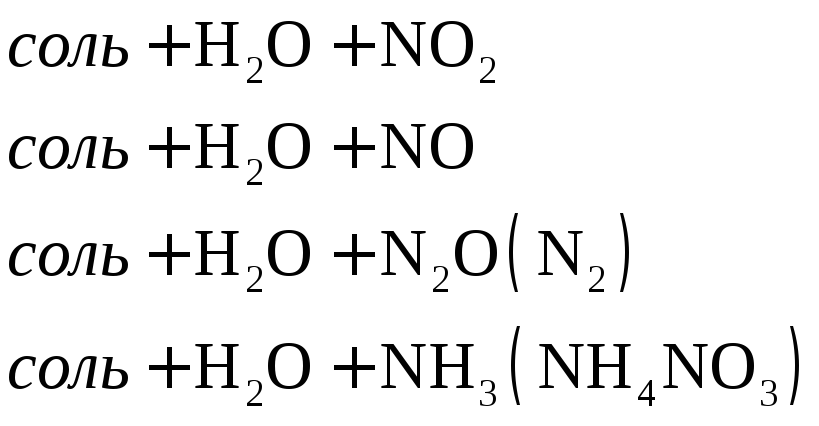
Согласно схеме степень окисления азота при взаимодействии кислоты с металлами меняется от +5 до -3.
Рассмотрим несколько примеров.

Коэффициенты в уравнении реакции подбираем ионно-электронным методом.

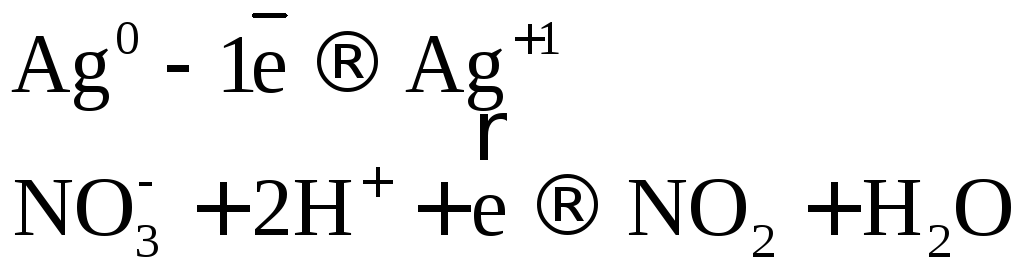

или .
 .
.
Разбавленная
азотная кислота при взаимодействии с
неактивными металлами восстанавливается
до 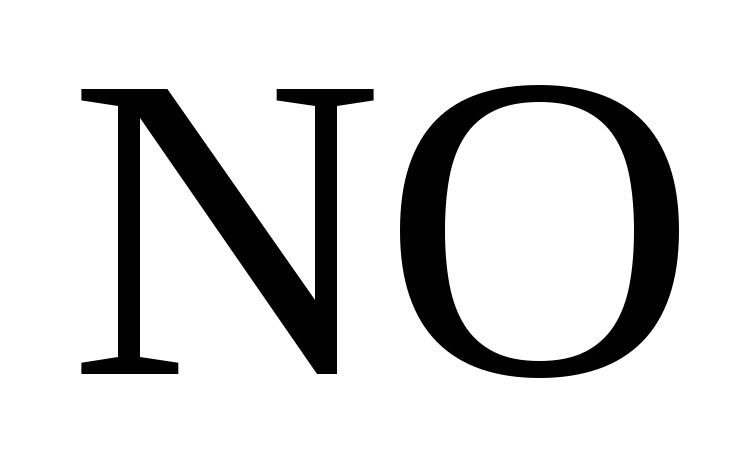
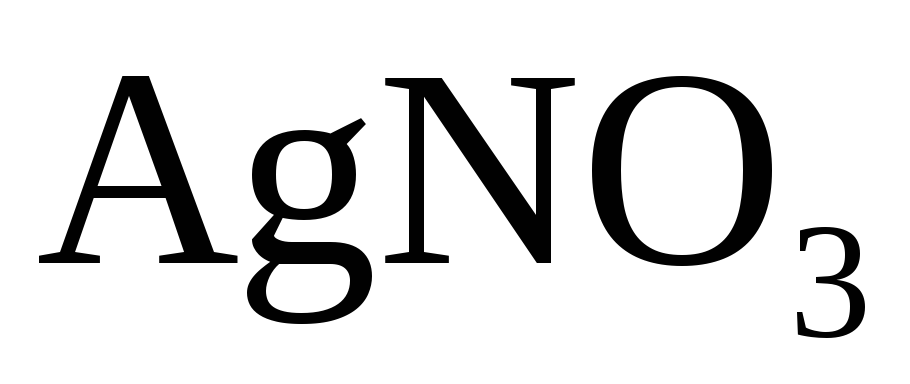 и вода.
и вода. 
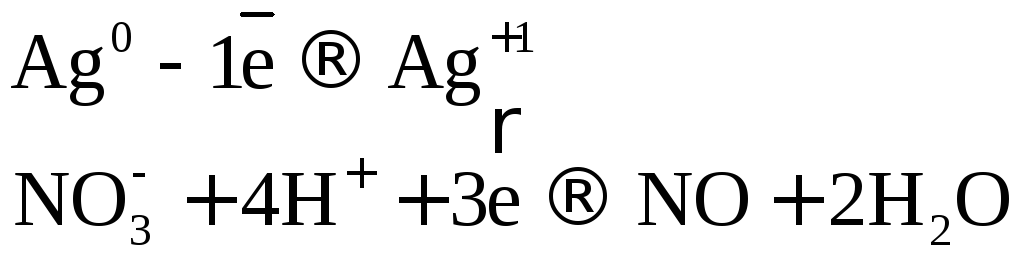
или 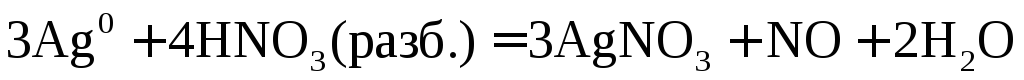 .
.
 .
.
При взаимодействии
активных металлов с разбавленной азотной
кислотой образуется соль, вода и 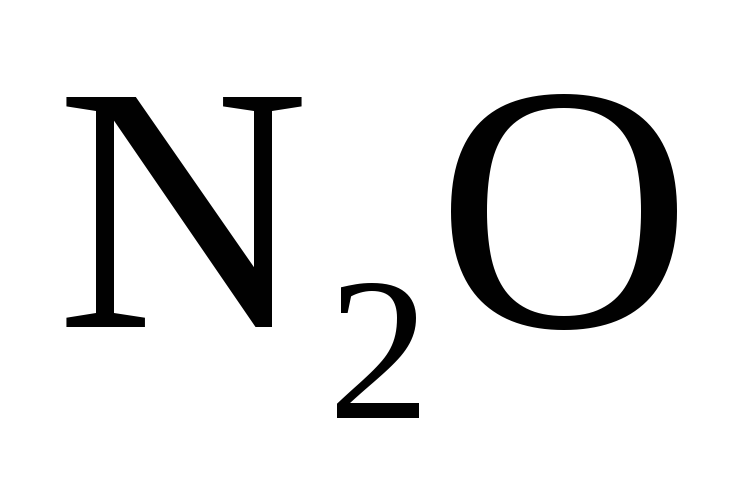
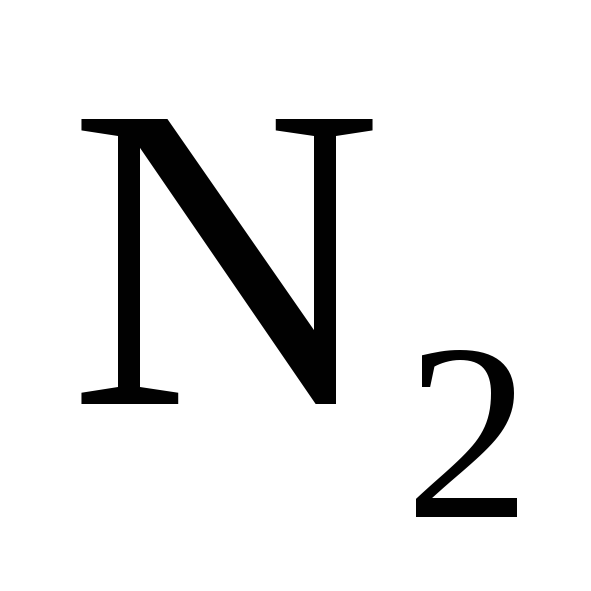 .
. 
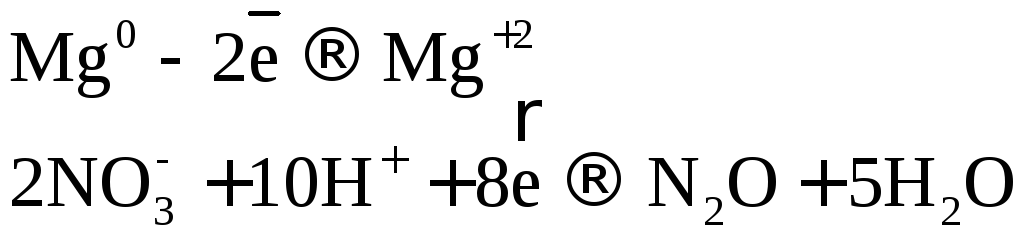

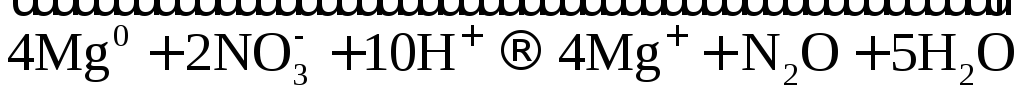
или 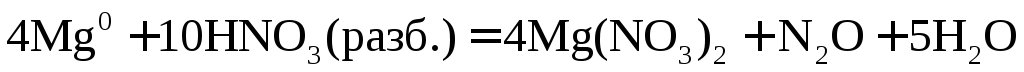 .
.
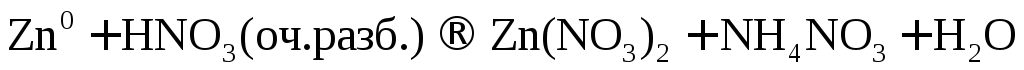 .
.
или 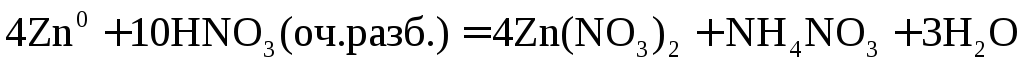
Вывод:
окислителем в азотной кислоте является
нитрат-анион. Концентрированная азотная
кислота пассивирует 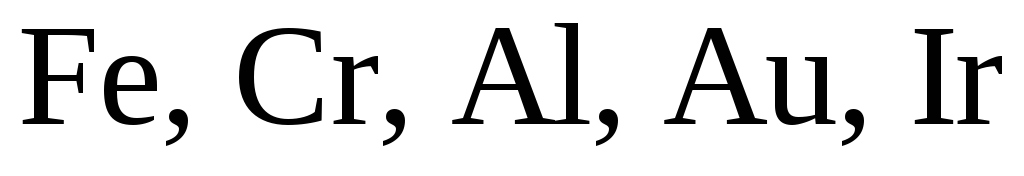
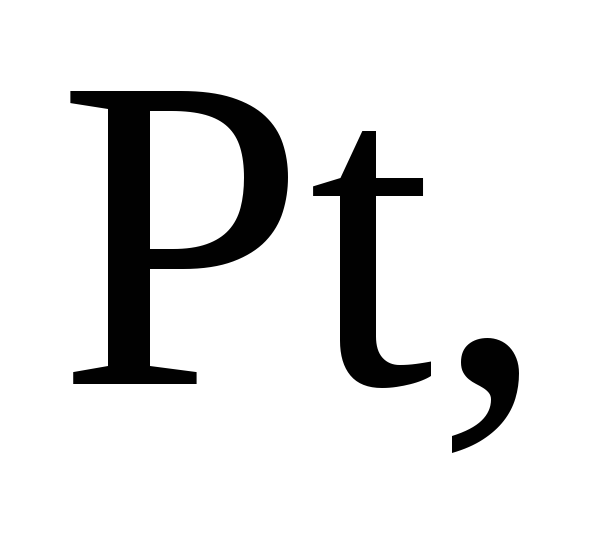 …
…
Следует иметь в виду, что во многих случаях при действии азотной кислоты на металлы образуется смесь различных азотсодержащих соединений, в которых преобладает какое-либо из них.
Взаимодействие металлов с серной кислотой
С разбавленной серной кислотой.
В разбавленной
серной кислоте окислителем являются
ионы водорода 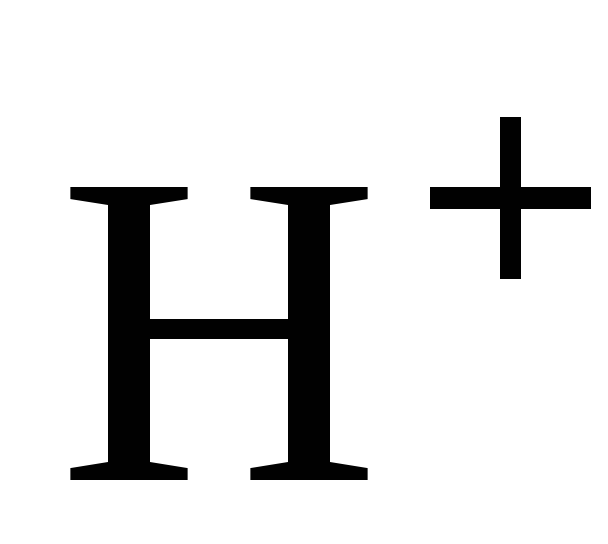
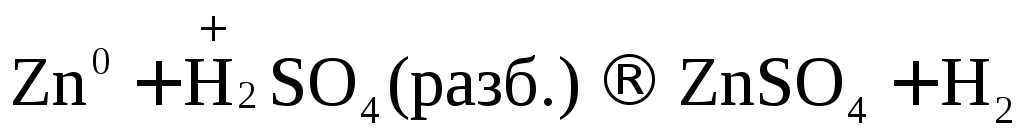

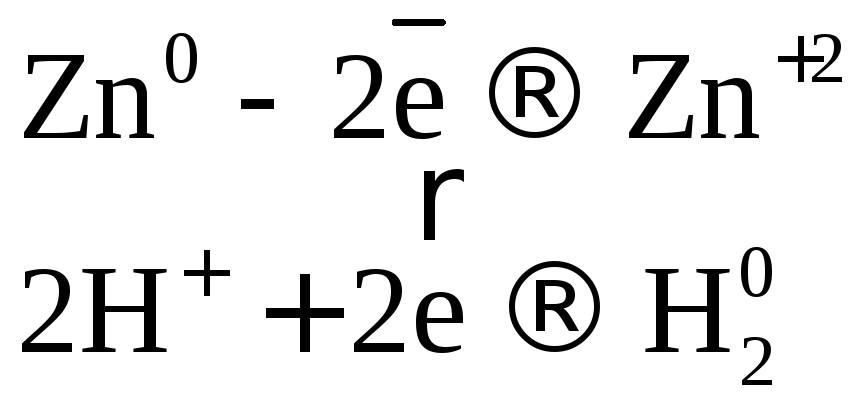
С концентрированной серной кислотой.
В концентрированной
серной кислоте окислителем является
ион  2- но так как
сульфат-ион не является сильным
окислителем, то большинство реакций
идет при нагревании. Степень окисления
серы может меняться от
+6 до
— 2. Чем
активнее металл, тем больше степень
восстановления серы.
2- но так как
сульфат-ион не является сильным
окислителем, то большинство реакций
идет при нагревании. Степень окисления
серы может меняться от
+6 до
— 2. Чем
активнее металл, тем больше степень
восстановления серы.
Взаимодействие металлов с серной кислотой можно представить в виде схемы.
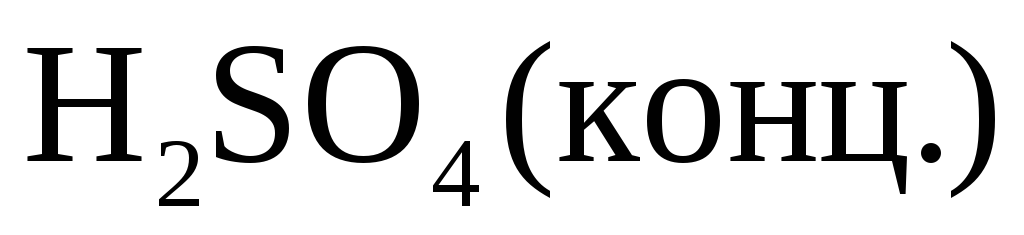




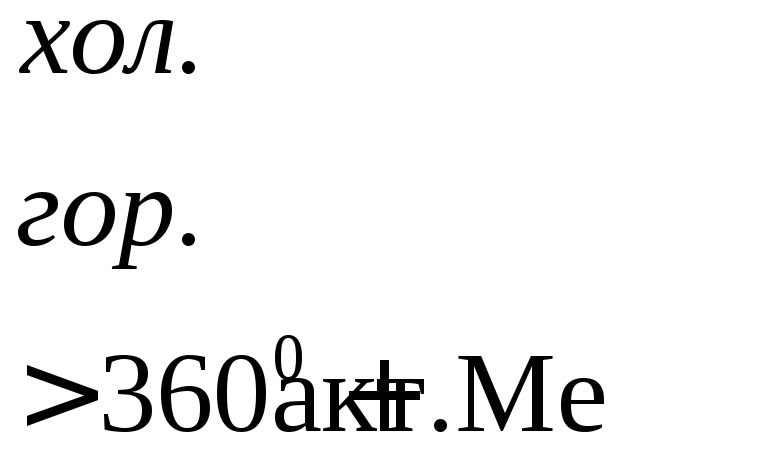
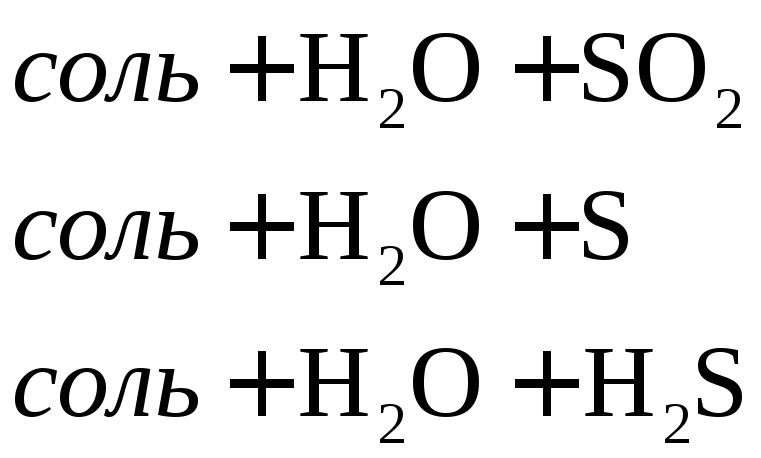
Характер взаимодействия зависит от активности металла, условий проведения реакции.
Например: при нагревании серной концентрированной кислоты с цинком сначала выделяется сернистый газ, а затем элементарная сера и сероводород.


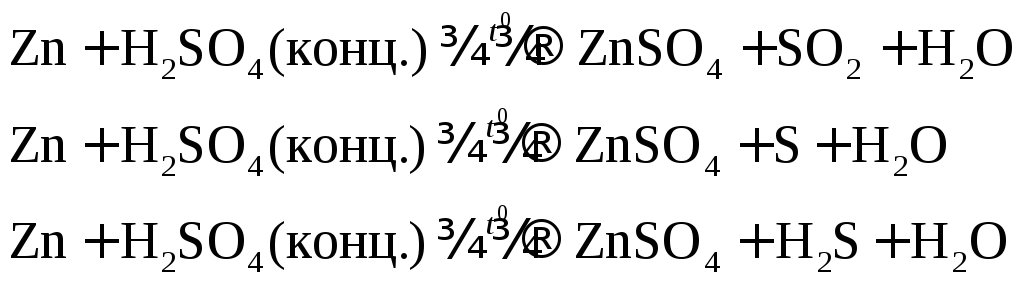
В одном из уравнений расставим коэффициенты ионно-электронным методом.
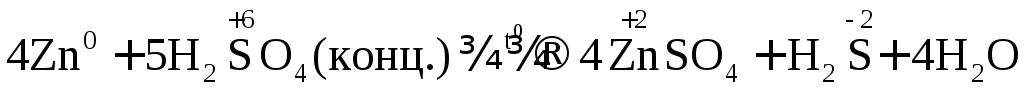

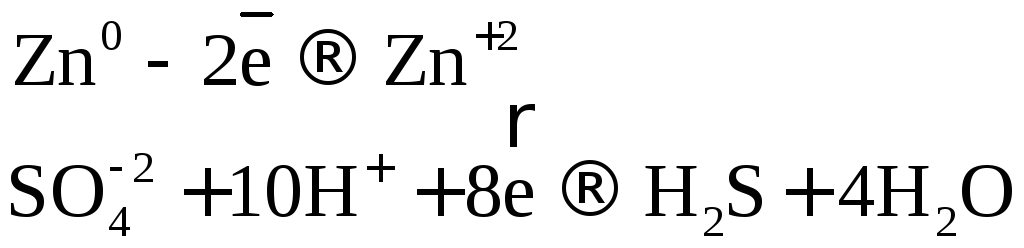

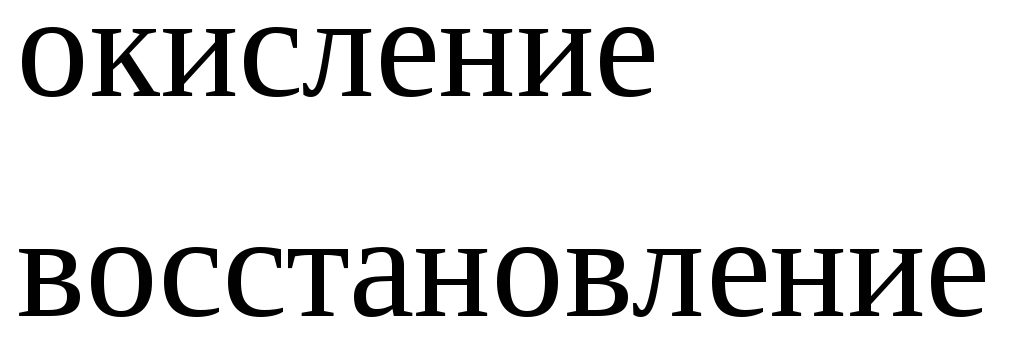

Вывод: Окислителем в концентрированной серной
кислоте является ион 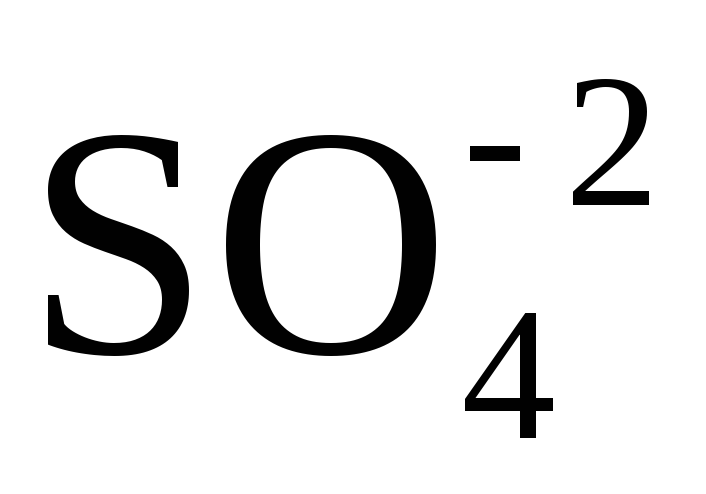 .
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.
.
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.

Концентрированная
серная кислота не действует на 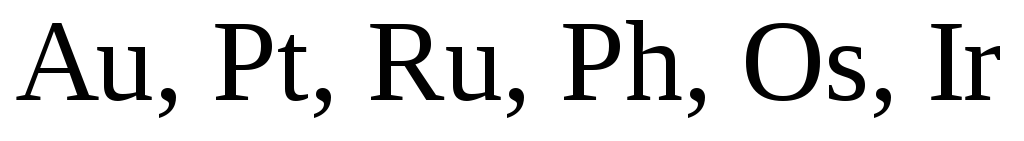 и пассивирует
и пассивирует 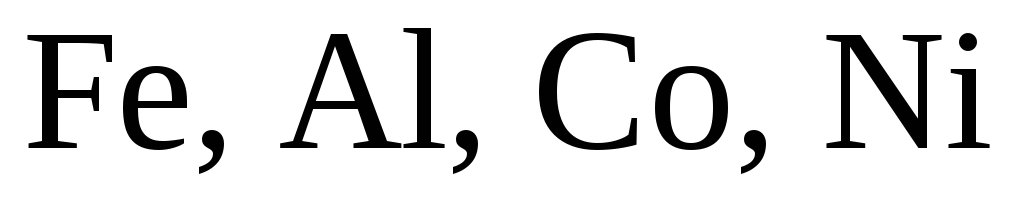 .
.
Взаимодействие кислот с металлами. Взаимодействие серной кислоты с металлами
Химическая реакция кислоты с металлом является специфичной для данных классов соединений. В ее ходе протон водорода восстанавливается и в связке с кислотным анионом заменяется на катион металла. Это пример реакции с образованием соли, хотя существует и несколько типов взаимодействий, не подчиняющихся данному принципу. Они протекают как окислительно-восстановительные и не сопровождаются выделением водорода.
Принципы реакций кислот с металлами
Все реакции неорганической кислоты с металлом приводят к образованию солей. Исключением является, пожалуй, лишь реакция благородного металла с царской водкой, смесью соляной и азотной кислоты. Любое другое взаимодействие кислот с металлами приводит к образованию соли. В случае если кислота не является ни серной концентрированной, ни азотной, то в качестве продукта выщепляется молекулярный водород.
Но когда в реакцию вступает концентрированная серная кислота, взаимодействие с металлами протекает по принципу окислительно-восстановительного процесса. Потому экспериментально было выделено два типа взаимодействий типичных металлов и крепких неорганических кислот:
- взаимодействие металлов с разбавленными кислотами;
- взаимодействие с концентрированной кислотой.
Реакции по первому типу протекают с любой кислотой. Исключением является лишь концентрированная серная кислота и азотная кислота любой концентрации. Они реагируют по второму типу и приводят к образованию солей и продуктов восстановления серы и азота.
Типичные взаимодействие кислот с металлами
Металлы, расположенные левее водорода в стандартном электрохимическом ряду, реагируют с разбавленной серной кислотой и другими кислотами различной концентрации за исключением азотной с образованием соли и выделением молекулярного водорода. Металлы, расположенные правее водорода в ряду электроотрицательности, не могут реагировать с указанными выше кислотами и взаимодействуют лишь с азотной кислотой независимо от ее концентрации, с концентрированной серной кислотой и с царской водкой. Это типичное взаимодействие кислот с металлами.
Реакции металлов с концентрированной серной кислотой
При содержании серной кислоты в растворе более 68%, она считается концентрированной и взаимодействует с металлами левее и правее водорода. Принцип протекания реакции с металлами различной активности показан на фото ниже. Здесь окислителем является атом серы в сульфат-анионе. Она восстанавливается до сероводорода, 4-валентного оксида или до молекулярной серы.

Реакции с разбавленной азотной кислотой
Разбавленная азотная кислота реагирует с металлами, расположенными левее и правее водорода. В ходе реакции с активными металлами образуется аммиак, который сразу же растворяется и взаимодействует с нитрат-анионом, образуя еще одну соль. С металлами средней активности кислота реагирует с выделением молекулярного азота. С малоактивными реакция протекает с выделением оксида 2-валентного азота. Чаще всего образуется несколько продуктов восстановления серы в одной реакции. Примеры реакций предложены в графическом приложении ниже.

Реакции с концентрированной азотной кислотой
В данном случае окислителем также выступает азот. Все реакции заканчиваются образованием соли и выделением оксида азота. Схемы протекания окислительно-восстановительных реакций предложены на графическом приложении. При этом отдельного внимания заслуживает реакция царской водки с малоактивными элементами. Такое взаимодействие кислот с металлами неспецифично.

Реакционная способность металлов
Металлы вступают в реакции с кислотами достаточно охотно, хотя есть несколько инертных веществ. Это благородные металлы и элементы, имеющие высокий стандартный электрохимический потенциал. Существует ряд металлов, который построен на основании данного показателя. Он называется рядом электроотрицательности. Если металл стоит в нем левее водорода, то он способен вступать в реакцию с разбавленной кислотой.
Существует лишь одно исключение: железо и алюминий за счет образования на их поверхности 3-валентных оксидов не могут реагировать с кислотой без нагревания. Если смесь подогревается, то изначально в реакцию вступает оксидная пленка металла, а затем он сам растворяется в кислоте. Металлы, расположенные правее водорода в электрохимическом ряду активности, не могут реагировать с неорганической кислотой, в том числе и с разбавленной серной. Исключений из правил два: эти металлы растворяются в концентрированной и разбавленной азотной кислоте и царской водке. В последней не могут быть растворены только родий, рутений, иридий и осмий.
Взаимодействие кислот с металлами
Учащиеся познакомились с химическим составом и классификацией кислот, выяснили их некоторые общие химические свойства. А именно: кислоты могут взаимодействовать с основаниями и основными оксидами.
Поэтому цель нашего урока — продолжить характеризовать общие химические свойства кислот в свете ионных представлений. Для этого нужно: научиться пользоваться рядом напряжений металлов для прогнозирования возможных химических реакций кислот.
В тетрадях записываем число и тему урока:
Взаимодействие кислот с металлами.
Если кислоты могут взаимодействовать с основаниями и основными оксидами, а ключевым элементом в их составе является металл, то возможно ли взаимодействие металлов с кислотами. Проверим это экспериментально.
Mg + HCl — выделяется газ. Следовательно, кислоты могут взаимодействовать с металлами. Попробуем разнообразить металлы. Возьмем Zn и Cu. Дети демонстрационно проводят реакции взаимодействия цинка и хлороводородной кислоты при нормальных условиях (видимых изменения нет), затем при нагревании. Наблюдается выделение газа. Другой ученик проводит реакцию взаимодействия меди с той же кислотой при обычных условиях и при нагревании. Реакция не идет. Отрицательный результат — тоже результат.
Подведем итог магний взаимодействует с кислотой при нормальных условиях, цинк — при нагревании, медь — не взаимодействует.
Почему же металлы по-разному взаимодействуют с кислотами? Разная химическая активность!
Подобные опыты проводил в прошлом веке русский химик Н.Н.Бекетов. На основании экспериментально полученных данных он составил ряд активности металлов, который называется рядом напряжения металлов. В нем металлы располагаются в порядке уменьшения химической активности. Учитель показывает активные металлы, металлы средней активности и малоактивные.
Хотелось бы мне посмотреть на вашу активность. Поднять руки вверх, выпрямить их и очень быстро сжимать и разжимать кулачки по 10 раз. (Повторить дважды) Достаточно! Теперь пальчиками потрите мочки ушей по 10 раз. (Повторить дважды). В процессе упражнения учитель быстро считает от 1 до 10. Кто успел за моим счетом, тот активный, а кто не успел — тот малоактивный.
Данный фрагмент урока объединяет физминутку и позволяет детям почувствовать понятие активности и малой активности.
Для следующего ролевого этапа урока нужны два мальчика. Один — знаменитый боксер Александр Балуев, а другой — маленький щупленький, трусливый Слабачок. Задание: сидят две подружки на стульчиках. Вам понравился стульчик под одной из подружек. Как вы будете его освобождать для себя, находясь в сценическом образе своего героя? Дети предполагают возможные ситуации: боксер силой «вытряхнет» или попытается испугать сидящих. Слабачок же, тоже попытается выгнать, угрожать, испугать, но ему это не удается. Нисколько не страшно.
А если это не персонажи, а химические элементы. Тогда можно увидеть суть наших химических реакций. Более активный металл замещает водород в составе кислоты. А почему же медь не взаимодействует с кислотой? Дети приходят к выводу, что медь — малоактивный металл и не может вытеснить водород из растворов кислот.
Вывод. Мы выяснили закономерности взаимодействия кислот с металлами: водород из кислот вытесняют металлы, стоящие до водорода в ряду активности.
Пришло время закончить работу со схемами, соответствующими проведенным химическим реакциям взаимодействия металлов с кислотой:
На доске дети составляют реакции взаимодействия хлороводородной кислоты с цинком и магнием в молекулярном и ионном виде. Как видно из кратких ионных уравнений, вместо хлороводородной кислоты можно взять какую-либо другую кислоту. Конечно, есть кислоты, которые взаимодействуют с металлами по-особому, но об этом мы поговорим на уроках химии позже.
Итак, на уроке сегодня вы
- познакомились с рядом активности металлов;
- пополнили знания о химических свойствах кислот;
- выяснили, что о возможности реакции между кислотой и металлом подскажет ряд активности.
Домашнее задание, оценки за урок.
Лабораторный опыт 7 Взаимодействие металлов с кислотами
Лабораторный опыт 7
Взаимодействие металлов с кислотами
Цель работы: исследовать особенности взаимодействия растворов кислот с металлами на основания их положения в электрохимическом ряду напряжений металлов.
Оборудование и реактивы:пробирки, штатив для пробирок, спиртовка, спички, пробиркодержатель,гранулы цинка, железные опилки, медные стружки или кусочки медной проволоки, растворы соляной и серной кислоты.
Краткие теоретические сведения
Кислоты – электролиты диссоциирующие в воде на ионы водорода и ионы кислотного остатка. H2SO4 ↔ 2H+ + SO42-Кислоты обладают разнообразными химическими свойствами и взаимодействуют с металлами, основаниями, солями и оксидами металлов.
Для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда). Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла. HCl + Hg = не образуется
H2SO4 + Zn = ZnSO4 + H2
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов. Слева находятся наиболее активные металлы, справа – неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать с металлом. Под силой кислоты понимают ее способность отдавать ионы водорода H+. Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Концентрированные кислоты с металлами ведут себя иначе, чем разбавленные:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O.
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой. Эти металлы – Al, Fe, Cr, Ni и некоторые другие – при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
Порядок работы
Задание
1.Проведите реакции, подтверждающие, особенности взаимодействия растворов кислот с металлами на основании их положения в электрохимическом ряду напряжений металлов.
1.В две пробирки положите гранулы цинка и прилейте в одну пробирку около 1 мл раствора серной кислоты, в другую — столько же соляной кислоты.
2.В другие две пробирки положите немного железных опилок и прилейте те же кислоты.
3.В следующие две пробирки положите немного медных стружек или кусочков проволоки и прилейте те же кислоты.
Если в какой – либо пробирке не происходит реакции, слегка подогрейте содержимое пробирки в пламени спиртовки.
Наблюдайте, в каких пробирках происходит выделение газа. Определите, какой это газ? Все ли металлы вытесняют водород из кислот.
Уравнение реакцииВ молекулярном и ионном виде
1
положили гранулы цинка в пробирку и прилили 1 мл раствора серной кислоты
Идет реакция растворения металла, с выделением прозрачного газа без запаха.
Zn + H2SO4®ZnSO4+ H2↑
Zn0+2H++SO42-®Zn2+ + SO42-+ H20↑
Zn0+2H+®Zn2++ H20↑
2
положили гранулы цинка в пробирку и прилили1 мл раствора соляной кислоты
Идет реакция растворения металла, с выделением прозрачного газа без запаха.
Zn + 2HCl®ZnCl2 + H2↑
Zn0+2H++2Cl—®Zn2+ + 2Cl—+ H20↑
Zn0+2H+®Zn2++ H20↑
3
положилижелезные опилки в пробирку и прилили 1 мл раствора серной кислоты
Идет реакция растворения металла, с выделением прозрачного газа без запаха.
Fe + H2SO4® FeSO4+ H2↑
Fe0+2H++SO42-® Fe2+ + SO42-+ H20↑
Fe 0+2H+® Fe 2++ H20↑
4
положилижелезные опилки в пробирку и прилили1 мл раствора соляной кислоты
Идет реакция растворения металла, с выделением прозрачного газа без запаха.
Fe + 2HCl®FeCl2 + H2↑
Fe0+2H++2Cl—® Fe2+ + 2Cl—+ H20↑
Fe0+2H+® Fe2++ H20↑
5
положилимедные опилки в пробирку и прилили 1 мл раствора серной кислоты
Признаков реакции не наблюдается
H2SO4+ Cu = реакция не идет
6
положилимедные опилки в пробирку и прилили1 мл раствора соляной кислоты
Признаков реакции не наблюдается
HCl + Cu = реакция не идет
Вывод: на практических опытах исследовали особенности взаимодействия растворов кислот с металлами на основания их положения в электрохимическом ряду напряжений металлов.
Содержание отчета
Укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний,результаты наблюдений занесите в таблицу, сделайте вывод. Для вывода воспользуйтесь схемой:
Отношение металлов к воде и к некоторым кислотам
Вопросы для вывода1.Какой из металлов, взятый для опытов, не реагирует с растворами с кислот?(Cu –медь)
Какие еще металлы не реагируют с этими кислотами?(Hg, Ag, Pt, Au)
2.К какому типу реакций относится взаимодействие кислоты с металлом? (Реакции замещения)
Контрольные вопросы
1.С какими из перечисленных веществ взаимодействует соляная кислота: Mg, Cu, Ca, Fe?(Ca, Fe,Mg)
2.При помощи, каких реакций можно осуществить следующие превращения:
Zn → ZnS → ZnO → ZnCl2 → Zn(OН)2
Zn + S→ZnS
2ZnS + 3O2→ 2ZnO + 2SO2
ZnO + 2HCl→ ZnCl2+H2O
ZnCl2 + 2NaOН→ Zn(OН)2↓ + 2NaCl
3.Подобрать коэффициенты в уравнении реакции, указать окислитель, восстановитель, процесс окисления и восстановления:
Cu + Cl2®CuCl2 (Cu-востановитель, Cl-окислитель)
Zn + 2HCl®ZnCl2 + H2(Zn -востановитель, H+-окислитель)
Взаимодействие кислот с оксидами металлов. — Студопедия.Нет
Кислоты.
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
Все кислоты обязательно содержат водород, который записывается в формуле на первом месте. Вся остальная часть формулы называется кислотным остатком.
Например, у НСl кислотным остатком является Сl—, а у Н3РО4 кислотный остаток РО43-.
Классификация кислот.
1) По содержанию кислорода:
Кислоты | |
| Бескислородные | Кислородсодержащие |
| HF | HNO3 |
| HCl | H2SO4 |
| HBr | H2SiO3 |
| HI | H2CO3 |
| H2S | H3PO4 |
По количеству водорода
Кислоты | ||
| Одноосновные | Двух основные | Трехосновные |
| HCl | H2S | H3PO4 |
| HNO3 | H2SO4 | |
По растворимости в воде
Кислоты | |
| Нерастворимые | Растворимые |
| H2SiO3 | Все остальные |
По стабильности
Кислоты | |
| Стабильные | Нестабильные |
| HCl | H2SO3 |
| H2SO4 | H2SiO3 |
| H3PO4 | H2CO3 |
Физические свойства кислот.
1. Агрегатное состояние: жидкие или твердые (H3PO4, H2SiO3).
2. Кислые на вкус.

 3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.
3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.
Окрашенные растворы: H2CrO4 , HMnO4 .
Химические свойства.
Действие их на индикаторы.
Индикаторы — вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).
В кислотах:
| Лакмус | Метилоранж | Фенолфталеин |
| красный | розовый | бесцветный |
Диссоциация кислот.
1) HCl ↔ Н+ + Cl—
2) I. H2SO4 ↔ Н + + HSO4—
 II. HSO4— ↔ Н + + SO42-
II. HSO4— ↔ Н + + SO42-
|
3) I. H3PO4 ↔ Н + + H2PO4—
II. H2PO4— ↔ Н + + HPO42-
 III. HPO42- ↔ Н + + PO43-
III. HPO42- ↔ Н + + PO43-
H3PO4 ↔ 3 Н + + PO43-
Кислоты взаимодействуют с металлами, оксидами металлов, основаниями и солями. Во всех случаях основным продуктом реакции будет соль.
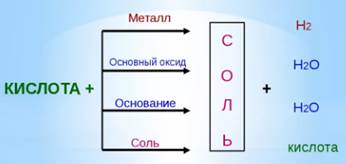
Взаимодействие кислот с металлами.
В три пробирки поместите соответственно цинк, железо, медь. Прилейте одинаковое количество соляной кислоты. Что наблюдаете? (в случае цинка — быстрое выделение пузырьков газа, в случае железа – менее интенсивное выделение газа, в случае меди признаки реакции отсутствуют). Какой вывод можно сделать?(не все металлы реагируют с кислотами).
Практическим путем учеными было выяснено, какие металлы вытесняют водород из растворов кислот. Таким образом был составлен ряд Н. Н. Бекетова, который сейчас называют электрохимический ряд напряжения металлов. Если металл находится до водорода, то он реагирует с кислотами, если после, то – нет.
Zn + 2HCl = ZnCl2 + H2↑ (реакция замещения)
Fe + 2HCl = FeCl2 + H2↑ (реакция замещения)
Cu + HCl ≠
Особенности взаимодействия с металлами серной и азотной кислот.


Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
{\displaystyle {\mathsf {3HCl+HNO_{3}\longrightarrow NOCl+2[Cl]\uparrow +2H_{2}O}}}
3HCl + HNO3 → NOCl + 2[Cl] ↑ + 2H2O
Au + HNO3 + 4HCl → H[AuCl4] + NO + 2H2O
3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO↑ + 8H2O
Взаимодействие кислот с оксидами металлов.
CuO + H2SO4 = CuSO4 + H2O (реакция обмена)

 .
.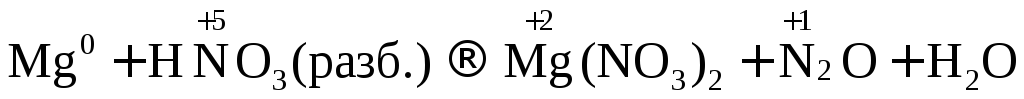 .
.