Скорость химической реакции. Факторы, влияющие на скорость химической реакции
Инфоурок › Химия ›Презентации›Скорость химической реакции. Факторы, влияющие на скорость химической реакцииОписание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:Скорость химической реакции Факторы, влияющие на скорость химической реакции Изотова И.А. ГБОУ СОШ № 603 Санкт-Петербург 2017
 Описание слайда: 3 слайд
Описание слайда: 3 слайд  Описание слайда:
Описание слайда:Скорость химической реакции — это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени
4 слайд Описание слайда:
Описание слайда:Гомогенные реакции — реакции, которые протекают в однородной среде (нет поверхности раздела между реагирующими веществами) Например, в смеси газов или в растворах. Гетерогенные реакции – реакции, которые протекают между веществами в неоднородной среде (есть поверхность раздела между реагирующими веществами). Например, на поверхности твердого вещества и жидкости, газа и жидкости, твердого вещества и газа…
5 слайд
Факторы, влияющие на скорость гомогенной химической реакции, протекающей в закрытой системе (в системе, у которой нет обмена массой с окружающей средой): площадь поверхности соприкосновения реагирующих веществ; природа реагирующих веществ; концентрация реагирующих веществ; температура; катализатор
6 слайд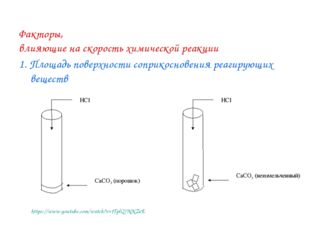 Описание слайда:
Описание слайда: Факторы, влияющие на скорость химической реакции 1. Площадь поверхности соприкосновения реагирующих веществ https://www.youtube.com/watch?v=tTplQ7NNZeE
7 слайд Описание слайда:
Описание слайда:Влияние площади поверхности соприкосновения реагирующих веществ на скорость химической реакции Лабораторный опыт № 1. Взаимодействие мрамора с раствором соляной кислоты Даны вещества: мрамор СаСО3 (порошок), мрамор СаСО3 (неизмельчённый), раствор соляной кислоты. 1. С измельченным или неизмельченным мрамором соляная кислота реагирует активнее? 2. Почему в измельченном состоянии твердые вещества активнее реагируют с жидкостями и газами? 3. В какой зависимости находятся скорость химической реакции и площадь соприкосновения реагирующих веществ?
 Описание слайда:
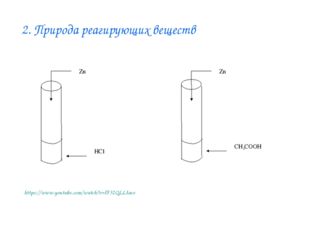
Описание слайда:2. Природа реагирующих веществ https://www.youtube.com/watch?v=lF32QLLIaeo
9 слайд Описание слайда:
Описание слайда:Влияние природы реагирующих веществ на скорость химической реакции Лабораторный опыт № 2 Взаимодействие цинка с растворами соляной и уксусной кислот Даны вещества: цинк Zn, растворы соляной и уксусной кислот одинаковой концентрации. С какой из предложенных кислот цинк реагирует активнее? В чем причина того, что с соляной кислотой цинк реагирует активнее, чем с уксусной?
10 слайд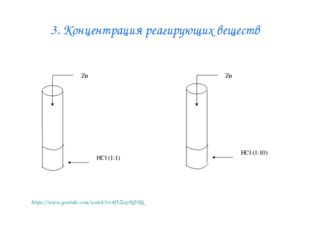 Описание слайда:
Описание слайда:3. Концентрация реагирующих веществ https://www.youtube.com/watch?v=4fJZixvNDKk
 Описание слайда:
Описание слайда:Влияние концентрации веществ на скорость химической реакции Лабораторный опыт № 3 Взаимодействие цинка с растворами соляной кислоты разной концентрации Даны вещества: цинк Zn, раствор соляной кислоты (1:1) раствор соляной кислоты (1:10) В какой зависимости находятся скорость химической реакции и концентрация реагирующих веществ?
12 слайд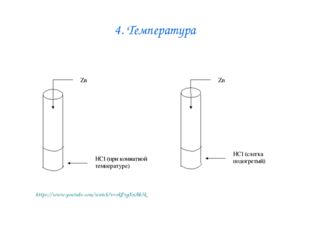 Описание слайда:
Описание слайда:4. Температура https://www.youtube.com/watch?v=rkPvgXnAb3k
13 слайд Описание слайда:
Описание слайда:Влияние температуры на скорость химической реакции Лабораторный опыт № 4 Взаимодействие цинка с растворами соляной кислоты при разной температуре Даны вещества: цинк Zn, раствор соляной кислоты в двух пробирках. 1. В какой зависимости находятся скорость химической реакции и температура? 2. Как эта зависимость выражается математически?
 Описание слайда:
Описание слайда:Правило Вант-Гоффа (1884 г.) При изменении (повышении или понижении) температуры на каждые 10 градусов скорость реакции соответственно изменяется (увеличивается или уменьшается) в 2 – 4 раза. Якоб Хендрик Вант-Гофф
15 слайд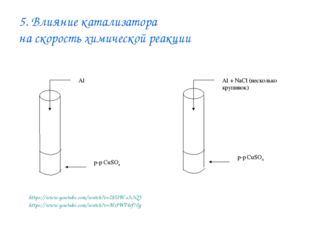 Описание слайда:
Описание слайда:5. Влияние катализатора на скорость химической реакции https://www.youtube.com/watch?v=2hUW-s3i3QY https://www.youtube.com/watch?v=MrJWT4rf70g
16 слайд Описание слайда:
Описание слайда:Катализаторы — вещества, ускоряющие химическую реакцию, но не входящие в состав продуктов реакции. Катализаторы не расходуются в ходе реакции и их состав не меняется.
17 слайд Описание слайда:
Описание слайда:Катализ (от греч. katálysis — разрушение) — изменение скорости химических реакций в присутствии катализаторов. Каталитические реакции – это реакции, идущие с участием катализаторов.
18 слайд Описание слайда:
Описание слайда:5. Влияние катализатора на скорость химической реакции Лабораторный опыт № 5 Даны вещества: алюминий Al, раствор сульфата меди (II) CuSO4, поваренная соль NaCl (кристаллическая). 1. Какую роль играет хлорид натрия в реакции замещения между сульфатом меди (II) и алюминием? 2. Что такое катализаторы? 3. Что такое катализ?
19 слайд Описание слайда:
Описание слайда:Вопросы: Что называют скоростью химической реакции? В каких единицах измеряют скорость химической реакции? От каких факторов зависит скорость химической реакции? https://www.youtube.com/watch?v=xL0w5yoHcU0
20 слайд Описание слайда:
Описание слайда:Интернет-ресурсы: https://www.youtube.com/watch?v=lF32QLLIaeo https://www.youtube.com/watch?v=4fJZixvNDKk https://www.youtube.com/watch?v=tTplQ7NNZeE https://www.youtube.com/watch?v=rkPvgXnAb3k https://www.youtube.com/watch?v=2hUW-s3i3QY https://www.youtube.com/watch?v=xL0w5yoHcU0 http://www.help-rus-student.ru/pictures/12/108_1.jpg http://www.varson.ru/images/Himia_jpeg_big/4-05.jpg

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедия, ДефектологияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРодная литератураРодной языкРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:

Общая информация
Номер материала: ДБ-503721
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий1.4.3 Скорость реакции, её зависимость от различных факторов
Видеоурок: Введение в кинетику
Лекция: Скорость реакции, её зависимость от различных факторов
 Понятие скорости реакции
Понятие скорости реакции Часто бывает так, что химические реакции происходят мгновенно. Например, происходит взрыв кислородно-водородной смеси. Другие реакции проходят быстро, например горение веществ. А еще одни происходят медленно. К «медленным» реакциям можно отнести коррозию. Так же существуют очень медленные реакции. Реакции, имеющие такую минимальную скорость, человек практически не может заметить. К данному типу реакции можно отнести преобразование гранита в песок и глину, которое происходит в течении долгого времени. Исходя из таких примеров, следует, что химические реакции проходят с различной скоростью.
Часто бывает так, что химические реакции происходят мгновенно. Например, происходит взрыв кислородно-водородной смеси. Другие реакции проходят быстро, например горение веществ. А еще одни происходят медленно. К «медленным» реакциям можно отнести коррозию. Так же существуют очень медленные реакции. Реакции, имеющие такую минимальную скорость, человек практически не может заметить. К данному типу реакции можно отнести преобразование гранита в песок и глину, которое происходит в течении долгого времени. Исходя из таких примеров, следует, что химические реакции проходят с различной скоростью.
Скорость гомогенной реакции – это определенное изменение количества вещества, происходящее за одну единицу времени в одной конкретной единице объема.
Скорость гетерогенной реакции – это определенное изменение количества вещества, происходящее за одну единицу времени на единице поверхности раздела фаз.
Скорость реакции измеряется по формуле: V=+ n2-n1/ t2-t1 * 1/v
N1 и N2 – количество вещества (измеряется в молях) в определенный момент времени t1 и t2 в системе с объемом V.
Скорость гетерогенной реакции – это такое изменение молярной концентрации вещества, которое проходит во время химической реакции за одну единицу времени.
 Факторы скорости реакции
Факторы скорости реакцииСуществует ряд факторов, влияющих на скорость реакций. Для того чтобы реакция прошла успешно, необходимо, чтобы произошло столкновение молекул исходных веществ — это самый минимальный фактор.

В случае повышения количества молекул, в какой — либо единице объема, число происходящий столкновений будет расти. Таким образом, скорость реакции начинает расти при увеличении концентрации реагирующих в процессе реакции веществ. Если реагентом является газ, скорость реакции возрастет при повышении давления. Почему? Происходит это, потому что давление газа прямо пропорционально концентрации составляющих его молекул. Столкновение частиц — не является достаточным условием протекания реакции. С помощью проведенных расчетов доказано, что количество столкновений молекул реагирующих веществ при их разумной концентрации достаточно велико. Поэтому, реакции должны протекать достаточно быстро. Но это происходит не всегда. Так как не каждое столкновение молекул реагентов будет достаточно эффективным. Многие соударения являются упругими, а при упругом столкновении, молекулы отскакивают друг от друга.
 Для успешной реакции необходимо, чтобы молекулы обладали достаточно большой кинетической энергией. Энергия активации является самой минимальной энергией, которой должны обладать молекулы реагирующих веществ. Данная энергия необходима для того, чтобы реакция прошла. Энергия обозначается как Еа. В системе, которая состоит из достаточно большого количества молекул, существует определенное разделение молекул по энергии. Какие — то из них имеют низкую, или недостаточную энергию, другая часть — высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации. Температура фактически считается мерой кинетической энергии частиц, из которых состоит, какое — либо вещество. Иными словами, чем больше скорость движения частиц, составляющих вещество, тем выше температура этого вещества. Значит, повышая температуру, можно увеличить кинетическую энергию молекул. В результате можно получить следующее: начинается рост доли молекул с энергией, превышающей Еа. Столкновение данных молекул обязательно приведет к химической реакции. Скорость химической реакции может вырасти в 2-4 раза, если повысить температуру на 10 градусов по Цельсию.
Для успешной реакции необходимо, чтобы молекулы обладали достаточно большой кинетической энергией. Энергия активации является самой минимальной энергией, которой должны обладать молекулы реагирующих веществ. Данная энергия необходима для того, чтобы реакция прошла. Энергия обозначается как Еа. В системе, которая состоит из достаточно большого количества молекул, существует определенное разделение молекул по энергии. Какие — то из них имеют низкую, или недостаточную энергию, другая часть — высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации. Температура фактически считается мерой кинетической энергии частиц, из которых состоит, какое — либо вещество. Иными словами, чем больше скорость движения частиц, составляющих вещество, тем выше температура этого вещества. Значит, повышая температуру, можно увеличить кинетическую энергию молекул. В результате можно получить следующее: начинается рост доли молекул с энергией, превышающей Еа. Столкновение данных молекул обязательно приведет к химической реакции. Скорость химической реакции может вырасти в 2-4 раза, если повысить температуру на 10 градусов по Цельсию.
 Достаточно часто случается, что химическая реакция «не хочет» проходить сама по себе. В таком случае скорость реакций повышается с помощью катализа — химического процесса, при котором используются катализаторы. Это такие вещества, которые способны ускорить протекание реакции. При этом сами катализаторы не расходуются.
Достаточно часто случается, что химическая реакция «не хочет» проходить сама по себе. В таком случае скорость реакций повышается с помощью катализа — химического процесса, при котором используются катализаторы. Это такие вещества, которые способны ускорить протекание реакции. При этом сами катализаторы не расходуются.
Как же действуют катализаторы? Во время химической реакции они вступают во взаимодействие с реагентами. При этом образуются промежуточные соединения. К концу реакции катализаторы освобождаются и возвращаются к прежнему состоянию.
Существуют два вида катализаторов. Гомогенный и гетерогенный. Первый вместе с реагентами находится в одной фазе, к примеру, жидкости или газе. Тогда как второй образует самомстоятельную от реагентов фазу. К гомогенным относятся кислоты и основания, к гетерогенным простые вещества, оксиды и сульфиды металлов.
Если постороннее вмешательство приводит к еще большему замедлению то, речь идет об ингибиторах. Они тоже нужны человеку, к примеру, для того чтобы защитить металл от коррозии.
Скорость реакции так же зависит от площади соприкосновения использующихся реагентов. На скорость гетерогенной реакции, в процессе которой реагирует твердое вещество с газообразным или жидким, оказывает влияние и перемешивание. Данный фактор связан с тем, что в результате перемешивания, удается достичь исчезновения из места реакции скапливающихся молекул продуктов реакции и «поднести» новые молекулы реагента.
Подводя итог можно сказать, что скорость реакции зависит от следующих факторов:
От концентрации реагентов. То есть чем выше концентрация, тем больше скорость реакции.
От температуры. То есть с ростом температуры, скорость любой реакции увеличивается.
От площади соприкосновения реагирующих веществ. Чем больше площадь контакта реагентов, тем выше скорость реакции.
От перемешивания. То есть, если реакция происходит между твердым веществом, жидкостью, газом, перемешивание может ее ускорить.
Химия вопрос№3,4 л.р 4
Вопрос№3
От каких факторов зависит константа скорости химической реакции?
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль /л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ , от присутствия в системе катализатора , но не зависит от их концентрации.
1. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа) . При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле: (t2 — t1) / 10 Vt2 / Vt1 = g (где Vt2 и Vt1 — скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции) . Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса: k = A • e –Ea/RT где A — постоянная, зависящая от природы реагирующих веществ; R — универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)] ; Ea — энергия активации, т. е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению. Энергетическая диаграмма химической реакции. Экзотермическая реакция Эндотермическая реакция А — реагенты, В — активированный комплекс (переходное состояние) , С — продукты. Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры. 2. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях) , чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ — путем их растворения. 3. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии) , при гетерогенном катализе — разные фазы (находятся в различных агрегатных состояниях) . Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление «отрицательного катализа»).
Вопрос№4
Сформулируйте и запишите закон действующих масс для реакции:
2NO+O2=2NO2
ЗАКОН ДЕЙСТВУЮЩИХ МАСС : скорость химической реакции пропорциональна произведению концентраций реагирующих веществ . для реакции 2NO + O2 2NO2, закон действующих масс запишется так: v=kС2(NO)·С (O2), где k – константа скорости, зависящая от природы реагирующих веществ и температуры. Скорость в реакциях с участием твердых веществ определяется только концентрацией газов или растворенных веществ: С+О2=СО2, v =kCO2
От каких факторов зависит скорость химических реакций?
Температура, давление, концентрация и наличие катализаторов влияют на скорость химической реакции
От температуры
темпиратура, наличие катализаторов, давление..
От наличия катализаторов, от температуры.
От присутствия катализаторов, температуры окружающей среды
Температура, наличие катализатора или ингибитора
На конкретных примерах укажите основные факторы, влияющие на скорость химических реакций
1) Скорость реакции зависит от природы реагирующих веществ.Металлы реагируют с соляной кислотой с различной скоростью: магний реагирует быстрее железа, а медь не реагирует вовсе (за скоростью реакции легко следить по выделению пузырьков водорода).
Mg + 2НCl = MgCl2 + Н2↑
Fe + 2НCl = FeCl2 + h3↑
Cu + HCl -/->
Галогены реагируют с водородом с различной скоростью, например хлор быстрее йода:
Сl2 + Н2 = 2НCl
I2 + h3 = 2HI
2) Для веществ в растворенном состоянии и газов скорость реакции зависит от концентрации реагирующих веществ. Оксид азота (II) реагирует с чистым кислородом быстрее, чем с воздухом, в котором кислорода около 20% (за изменением скорости реакции легко наблюдать, так как исходные вещества бесцветны, а оксид азота (IV) окрашен в коричневый цвет).
2NO + O2 = 2NO2
3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ. Чем сильнее измельчено твердое вещество, тем больше его поверхность. Уголь в виде больших кусков сгорает в печи медленнее,
чем измельченный:
С + O2 = CO2
Железные опилки реагируют с раствором сульфата меди быстрее, чем железная пластинка такой же массы:
Fe + CuSO4 = FeSO4 + Cu
4) При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2–4 раза.
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
2Fe + 3Cl2 = 2FeCl3
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет.
Fе2О3 + 3h3 = 2Fe + 3Н2О
5) Скорость реакции зависит от присутствия некоторых веществ (катализаторов и ингибиторов).
Реакция синтеза аммиака из азота и водорода протекает только в присутствии катализаторов (железа со специальными добавками):
N2 + 3h3 = 2Nh4
Реакция окисления аммиака также протекает только в присутствии катализатора (платины):
4Nh4 + 5O2 = 4NO + 6Н2О