Химические свойства амфотерных оксидов | CHEMEGE.RU
Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Поделиться ссылкой:
chemege.ru
ЕГЭ. Химические свойства оксидов
Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Щелочь |
Реакция идет, если образуется растворимое основание, а также Ca(OH)2:
CaO + H2O → Ca(OH)2
MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим* |
| Амфотерный оксид | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |
Все реакции идут за исключением SiO2 (кварц, песок): SiO2 + H2O → реакция не идет |
* Источник: [2] «Я сдам ЕГЭ. Курс самоподготовки», стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
SiO2 + 4HF(нед.) → SiF4 + 2H2O
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na 2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
SiO2 + K2SO3 → K 2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
chemrise.ru
Тема №10 «Характерные химические свойства основных, амфотерных и кислотных оксидов»
Оглавление
- Оксиды
- Типичные реакции основных оксидов
- Типичные реакции кислотных оксидов
- Типичные реакции амфотерных оксидов
- Получение оксидов
- Шпаргалка
- Итог урока

Оксиды

Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (-2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды могут быть твердыми (песок SiO2, разновидности кварца), жидкими (оксид водорода H2O), газообразными (оксиды углерода: углекислый CO 2 и угарный СО газы).
Номенклатура химических соединений развивалась по мере накопления фактического материала. Сначала, пока число известных соединений было невелико, широко использовались тривиальные названия, не отражающие состава, строения и свойства вещества, — сурик РЬ3О4, глет РЬО, жженая магнезия MgO, железная окалина Fe3О4, веселящий газ N2О, белый мышьяк As2О3• На смену тривиальной номенклатуре при шла полусистематическая номенклатура — в название были вкл
www.chem-mind.com
Оксиды: классификация, получение и свойства
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → 2Na2O2
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + h3O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → H2O + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.
Поделиться ссылкой:
chemege.ru
Свойства оксидов, основные оксиды, кислотные оксиды. Получение оксидов. Оксиды азота
Свойства оксидов
Оксиды — это сложные химические вещества, представляющие собой химические соединения простых элементов с кислородом. Они бывают солеобразующими и не образующие соли.
При этом солеобразующие бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными.
Примером окислов, не образующих соли, могут быть: NO (окись азота) — представляет собой бесцветный газ, без запаха. Он образуется во время грозы в атмосфере. CO (окись углерода) — газ без запаха, образуется при сгорании угля. Его обычно называют угарным газом. Существуют и другие окислы, не образующие соли.
Теперь разберём подробнее каждый вид солеобразующих окислов.
Основные оксиды
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие:
K2O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного).
Рассмотрим химические свойства оксидов на примерах
1. Взаимодействие с водой:
— взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O→ Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:— взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4→ CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны всем под названием «гипс»).
3. Взаимодействие с кислотными оксидами: образование солиCaO+CO2→ CaCO3 (Это вещество известно всем — обычный мел!)
Кислотные оксиды
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Примерами кислотных окислов могут быть:
CO2 (всем известный углекислый газ), P2O5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора), SO3 — триокись серы — это вещество используют для получения серной кислоты.
— химическая реакция с водой
CO2+H2O→ H2CO3 — это вещество — угольная кислота — одна из слабых кислот, её добавляют в газированную воду для «пузырьков» газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков.
— реакция с щелочами (основаниями):
CO2+2NaOH→ Na2CO3+H2O- образовавшееся вещество (соль) широко используется в хозяйстве. Её название — кальцинированная сода или стиральная сода, — отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!
— реакция с основными оксидами:
CO2+MgO→ MgCO3 — получившая соль — карбонат магния — ещё называется «горькая соль».
Амфотерные оксиды
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами). Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов.
Примером амфотерных оксидов могут быть:
ZnO — окись цинка (белый порошок, часто применяемый в медицине для изготовления масок и кремов), Al2O3 — окись алюминия (называют еще «глинозёмом»).
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
— реакция с кислотным оксидом:
ZnO+H2CO3→ ZnCO3 + H2O — Образовавшееся вещество — раствор соли «карбоната цинка» в воде.
— реакция с основаниями:
ZnO+2NaOH→ Na2ZnO2+H2O — полученное вещество — двойная соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическим и химическим способами. Самым простым способом является химическое взаимодействие простых элементов с кислородом. Например, результатом процесса горения или одним из продуктов этой химической реакции являются оксиды. Например, если раскалённое железный прутик, да и не только железный (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, — вообщем то, что имеется под рукой) поместить в колбу с кислородом, то произойдёт химическая реакция окисления железа, которая сопровождается яркой вспышкой и искрами. Продуктом реакции будет чёрный порошок оксида железа FeO:
2Fe+O2→ 2FeO
Полностью аналогичны химические реакции с другими металлами и неметаллами. Цинк сгорает в кислороде с образованием окисла цинка
2Zn+O2→ 2ZnO
Горение угля сопровождается образованием сразу двух окислов: угарного газа и углекислого газа
2C+O2→ 2CO — образование угарного газа.
C+O2→ CO2 — образование углекислого газа. Этот газ образуется если кислорода имеется в более, чем достаточном количестве, то есть в любом случае сначала протекает реакция с образованием угарного газа, а потом угарный газ окисляется, превращаясь в углекислый газ.
Получение оксидов можно осуществить другим способом — путём химической реакции разложения. Например, для получения окисла железа или окисла алюминия необходимо прокалить на огне соответствующие основания этих металлов:
Fe(OH)2→ FeO+H2O
 Твёрдый оксид алюминия — минерал корунд
Твёрдый оксид алюминия — минерал корунд Оксид железа (III). Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в грунте оксида железа (III).
Оксид железа (III). Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в грунте оксида железа (III). Твёрдый оксид алюминия — корундРастворы оксидов
Твёрдый оксид алюминия — корундРастворы оксидов2Al(OH)3→ Al2O3+3H2O,
а также при разложении отдельных кислот:
H2CO3→ H2O+CO2 — разложение угольной кислоты
H2SO3→ H2O+SO2 — разложение сернистой кислоты
Получение оксидов можно осуществить из солей металлов при сильном нагревании:
CaCO3→ CaO+CO2 — прокаливанием мела получают окись кальция (или негашенную известь) и углекислый газ.
2Cu(NO3)2→ 2CuO + 4NO2 + O2 — в этой реакции разложения получается сразу два окисла: меди CuO (чёрного цвета) и азота NO2 (его ещё называют бурым газом из-за его действительно бурого цвета).
Ещё одним способом, которым можно осуществить получение окислов — это окислительно-восстановительные реакции
Cu + 4HNO3(конц.)→ Cu(NO3)2 + 2NO2 + 2H2O
S + 2H2SO4(конц.)→ 3SO2 + 2H2O
Оксиды хлора
 Молекула ClO2
Молекула ClO2 Молекула Cl2O7
Молекула Cl2O7 Закись азота N2O
Закись азота N2O Азотистый ангидрид N2O3
Азотистый ангидрид N2O3 Азотный ангидрид N2O5
Азотный ангидрид N2O5 Бурый газ NO2
Бурый газ NO2Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6, Cl2O7. Все они, за исключением Cl2O7, имеют желтую или оранжевую окраску и не устойчивы, особенно ClO2, Cl2O6. Все оксиды хлора взрывоопасны и являются очень сильными окислителями.
Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорсодержащие кислоты:
Так, Cl2O — кислотный оксид хлора хлорноватистой кислоты.
Cl2O + H2O→ 2HClO — Хлорноватистая кислота
ClO2 — кислотный оксид хлора хлорноватистой и хлорноватой кислоты, так как при химической реакции с водой образует сразу две этих кислоты:
ClO2 + H2O→ HClO2 + HClO3
Cl2O6 — тоже кислотный оксид хлора хлорноватой и хлорной кислот:
Cl2O6 + H2O→ HClO3 + HClO4
И, наконец, Cl2O7 — бесцветная жидкость — кислотный оксид хлора хлорной кислоты:
Cl2O7 + H2O→ 2HClO4
Оксиды азота
Азот — газ, который образует 5 различных соединений с кислородом — 5 оксидов азота. А именно:
— N2O — гемиоксид азота. Другое его название известно в медицине под названием веселящий газ или закись азота — это бесцветный сладковатый и приятный на вкус на газ.
— NO — моноксид азота — бесцветный, не имеющий ни запаха ни вкуса газ.
— N2O3 — азотистый ангидрид — бесцветное кристаллическое вещество
— NO2 — диоксид азота. Другое его название — бурый газ — газ действительно имеет буро-коричневый цвет
— N2O5 — азотный ангидрид — синяя жидкость, кипящая при температуре 3,5 0C
Из всех этих перечисленных соединений азота наибольший интерес в промышленности представляют NO — моноксид азота и NO2 — диоксид азота. Моноксид азота (NO) и закись азота N2O не реагируют ни с водой, ни с щелочами. Азотистый ангидрид (N2O3) при реакции с водой образует слабую и неустойчивую азотистую кислоту HNO2, которая на воздухе постепенно переходит в более стойкое химическое вещество азотную кислоту Рассмотрим некоторые химические свойства оксидов азота:
Реакция с водой:
2NO2 + H2O→ HNO3 + HNO2 — образуется сразу 2 кислоты: азотная кислота HNO3 и азотистая кислота.
Реакция с щелочью:2NO2 + 2NaOH→ NaNO3 + NaNO2 + H2O — образуются две соли: нитрат натрия NaNO3 (или натриевая селитра) и нитрит натрия (соль азотистой кислоты).
Реакция с солями:
2NO2 + Na2CO3→ NaNO3 + NaNO2 + CO2 — образуются образуются две соли: нитрат натрия и нитрит натрия, и выделяется углекислый газ.
Получают диоксид азота (NO2) из моноксида азота (NO) с помощью химической реакции соединения c кислородом:
2NO + O2→ 2NO2
Оксиды железа
Железо образует два оксида: FeO — оксид железа (2-валентный) — порошок чёрного цвета, который получают восстановлением оксида железа (3-валентного) угарным газом по следующей химической реакции:
Fe2O3+CO→ 2FeO+CO2
Этот основной оксид, легко вступающий в реакции с кислотами. Он обладает восстановительными свойствами и быстро окисляется в оксид железа (3-валентный).
4FeO +O2→ 2Fe2O3
Оксид железа (3-валентный) — красно-бурый порошок (гематит), обладающий амфотерными свойствами (может взаимодействовать и с кислотами и со щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что наиболее часто он его используют, как основной оксид .
Есть ещё так называемы смешанный оксид железа Fe3O4. Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным железняком или магнетитом). Если железо сгорает, то в результате реакции горения образуется окалина, состоящая сразу из двух оксидов: оксида железа (III) и (II) валентные.
Оксид серы
 Сернистый газ SO2
Сернистый газ SO2Оксид серы SO2 — или сернистый газ относится к кислотным оксидам, но кислоту не образует, хотя отлично растворяется в воде — 40л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называют сернистой кислотой).
При нормальных обстоятельствах — это бесцветный газ с резким и удушливым запахом горелой серы. При температуре всего -10 0C его можно перевести в жидкое состояние.
В присутствии катализатора -оксида ванадия (V2O5) оксид серы присоединяет кислород и превращается в триоксид серы
2SO2 +O2→ 2SO3
Растворённый в воде сернистый газ — оксид серы SO2 — очень медленно окисляется, в результате чего сам раствор превращается в серную кислоту
Если сернистый газ пропускать через раствор щелочи, например, гидроксида натрия, то образуется сульфит натрия (или гидросульфит — смотря сколько взять щёлочи и сернистого газа)
NaOH + SO2→ NaHSO3 — сернистый газ взят в избытке
2NaOH + SO2→ Na2SO3 + H2O
Если сернистый газ не реагирует с водой, то почему его водный раствор даёт кислую реакцию?! Да, не реагирует, но он сам окисляется в воде, присоединяя к себе кислород. И получается, что в воде накапливаются свободные атомы водорода, которые и дают кислую реакцию (можете проверить каким-нибудь индикатором!)
www.kristallikov.net
Классификация неорганических веществ | CHEMEGE.RU
Химические вещества можно разделить на две неравные группы: простые и сложные.
Простые вещества состоят из атомов одного элемента (О2, P4).
Сложные вещества состоят из атомов двух и более элементов (CaO, H3PO4).
Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью. Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному. Есть простой способ, который позволит вам быстро и надежно определять, к акой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе. Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например, в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 32, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ. К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ. Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.
Основные классы сложных веществ — это оксиды, гидроксиды, соли.
Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, которые проявляют кислотные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Каждому солеобразующему оксиду соответствует гидроксид:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
Если все индексы кратны 2, то мы делим все индексы на 2.
Например: N2O5 + H2O → H2N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например: оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: H3PO4. Орто-форма устойчива у фосфора и мышьяка.
Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2—.
Взаимосвязь оксидов и гидроксидов:
Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
Основания можно разделить на растворимые в воде (щелочи), нерастворимые в воде, и самопроизвольно разлагающиеся.
К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3).
Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O+(H+). Кислоты состоят из водорода H+ и кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы, кислоты разделяют на одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.
По содержанию атомов кислорода кислоты делят на бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота H2SO4).
Кислоты также можно разделить на сильные и слабые.
Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это H3PO4, CH3COOH, HF и др.
- Летучие или неустойчивые кислоты: H2S — газ; H2CO3 — распадается на воду и оксид: H2CO3 → Н2О + СО2↑; H2SO3— распадается на воду и оксид: H2SO3 → H2O+ SО2↑.
- Нерастворимые в воде кислоты: H2SiO3, H3BO3 и другие.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например: HClO: 1-1 = 0, следовательно, кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония NH4+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 H2O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4](OH)2).
Помимо основных классов неорганических соединений, существует большое количество других. Например, бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например, аммиак NH3, фосфин PH3.
Поделиться ссылкой:
chemege.ru
Амфотерные оксиды и гидроксиды. Видеоурок. Химия 9 Класс
Тема: Введение
Урок: Амфотерные оксиды и гидроксиды

Рис. 1. Вещества, проявляющие амфотерные свойства
Основные оксиды реагируют с кислотными оксидами, а кислотные оксиды – с основаниями. Но существуют вещества, оксиды и гидроксиды которых в зависимости от условий, будут реагировать и с кислотами и с основаниями. Такие свойства называются амфотерными.
Вещества, обладающие амфотерными свойствами приведены Рис.1.. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
Примеры их амфотерных оксидов приведены в таблице 1.
Рассмотрим амфотерные свойства оксидов цинка и алюминия. На примере их взаимодействия с основными и кислотными оксидами, с кислотой и щелочью.
— Взаимодействие с основными оксидами и основаниями:
ZnO + Na2O → Na2ZnO2 (цинкат натрия). Оксид цинка ведет себя как кислотный.
ZnO + 2NaOH → Na2ZnO2+ H2O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
3ZnO + P2O5 → Zn3(PO4)2 (фосфат цинка)
ZnO + 2HCl → ZnCl2 + H2O
Аналогично оксиду цинка ведет себя и оксид алюминия:
— Взаимодействие с основными оксидами и основаниями:
Al2O3 + Na2O → 2NaAlO2 (метаалюминат натрия). Оксид алюминия ведет себя как кислотный.
Al2O3 + 2NaOH → 2NaAlO2+ H2O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
Al2O3 + P2O5 → 2AlPO4(фосфат алюминия)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Рассмотренные реакции происходят при нагревании, при сплавлении. Если взять растворы веществ, то реакции пойдут несколько иначе.
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
В результате этих реакций получаются соли, которые относятся к комплексным.

Рис. 2. Минералы на основе оксида алюминия
Оксид алюминия.
Оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов. Рис.2.
В результате взаимодействия этих веществ с серной кислотой, получается сульфат цинка или сульфат алюминия.
ZnO + H2SO4 → ZnSO4 + H2O
Al2O3 + 3H2SO4→ Al2 (SO4)3 + 3H2O
Реакции гидроксидов цинка и алюминия с оксидом натрия происходят при сплавлении, потому что эти гидроксиды твердые и не входят в состав растворов.
Zn(OН)2 + Na2O → Na2ZnO2 + Н2О соль называется цинкат натрия.
2Al(OН)3 + Na2O → 2NaAlO2 + 3Н2О соль называется метаалюминат натрия.

Рис. 3. Гидроксид алюминия
Реакции амфотерных оснований со щелочами характеризует их кислотные свойства. Данные реакции можно проводить как при сплавлении твердых веществ, так и в растворах. Но при этом получатся разные вещества, т.е. продукты реакции зависят от условий проведения реакции: в расплаве или в растворе.
Zn(OH)2 + 2NaOH тв. Na2ZnO2 + 2Н2О
Na2ZnO2 + 2Н2О
Al(OH)3 + NaOH тв. NaAlO2+ 2H2O
NaAlO2+ 2H2O
Zn(OH)2 + 2NaOH раствор → Na2[Zn(OH)4] Al(OH)3 + NaOH раствор → Na[Al(OH)4] тетрагидроксоалюминат натрия Al(OH)3 + 3NaOH раствор→ Na3[Al(OH)6] гексагидроксоалюминат натрия.
Получается тетрагидроксоалюминат натрия или гексагидроксоалюминат натрия зависит от того, сколько щелочи мы взяли. В последней реакции щелочи взято много и образуется гексагидроксоалюминат натрия.
Элементы, которые образуют амфотерные соединения, могут сами проявлять амфотерные свойства.
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + Н2↑(тетрагидроксоцинкат натрия)
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3Н2↑( (тетрагидроксоалюминат натрия)
Zn + H2SO4(разб.)→ ZnSO4 + H2↑
2Al + 3H2SO4(разб.)→ Al2 (SO4)3 + 3H2↑
Напомним о том, что амфотерные гидроксиды являются нерастворимыми основаниями. И при нагревании разлагаются , образуя оксид и воду.
Разложение амфотерных оснований при нагревании.
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Zn(OH)2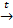 ZnO + H2O
ZnO + H2O
Подведение итога урока.
Вы узнали свойства амфотерных оксидов и гидроксидов. Эти вещества, имеют амфотерные (двойственные) свойства. Химические реакции, которые протекают с ними, имеют особенности. Вы рассмотрели примеры амфотерных оксидов и гидроксидов.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
1. Chemport.ru (Источник).
1. Химик (Источник).
Рекомендованное домашнее задание
1. №№ 6,10 (с.130) Рудзитис Г.Е. Неорганическая и органическая химия. 9 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2008 г.170с.: ил.
2. Напишите формулу гексагидроксоалюмината натрия. Как получают это вещество?
3. К раствору сульфата алюминия понемногу приливали раствор гидроксида натрия до избытка. Что наблюдали? Напишите уравнения реакций.
interneturok.ru