Предпосылки для возникновения теории химического строения
К понятию о химическом строении привела историческая необходимость ,— говорил А. М. Бутлеров в своих лекциях. Основные предпосылки, подготовившие почву для возникновения новой теории,— учение о валентности и химической связи, представление [c.188]Таким образом, за время первого (подготовительного) периода истории кинетики были намечены основные пути ее развития в XIX в., дано отграничение области химической динамики и созданы предпосылки для возникновения учения о скоростях реакции. Но для развития целенаправленных исследований скоростей реакций нужно было более глубоко исследовать химическую статику (и в первую очередь химические равновесия), уточнить основные химические понятия, разработать теорию химического строения соединений, получить более четкие представления о механизмах реакций. Многие из таких задач были решены во время второго периода истории химической кинетики. [c.146]
Предпосылками для возникновения теории химического строения были 1) установление правильного взгляда на атомы и молекулы, на определение атомных и молекулярных весов и устранение из формул знаков, отвечающих эквивалентным весам. Завершение этого процесса в теоретической химии произошло на первом международном конгрессе химиков в Карлсруэ (август 1860 г.) 2) создание основ теории валентности и, в частности, установление четырех.
ПРЕДПОСЫЛКИ ДЛЯ ВОЗНИКНОВЕНИЯ ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ [c.64]
Что явилось предпосылкой для возникновения теории химического строения Как возникла теория химического строения Как она развивалась Какое значение она имела для органической химии в XIX столетни Какова роль Бутлерова, Кекуле, Купера и. других ученых в ее создании и развитии — На все эти вопросы можно найти ответ у Марковникова. [c.759]
Ограничиваясь кратким очерком теоретических представлений в органической химии до середины прошлого века, автор в этой главе значительно более подробно рассматривает теории 50-х годов. Это они непосредственно предшествовали теории химического строения и внутри них были выработаны предпосылки для ее возникновения. Больше всего путаницы [c.7]
Предпосылки для возникновения стереохимии создавало не только от, что в связи с изучением оптически активных соединений формировалась мысль о существовании изомерии, обусловленной геометрией молекул не только то, что стали накапливаться факты из области собственно геометрической изомерии, но и то, что в связи с разработкой теории химического строения, хотя и по случайным поводам, не раз высказывалась идея углеродного тетраэдра. Правда, как мы уже говорили (стр. 10), еще в начале века встречались упоминания о тетраэдрической модели, но они, конечно, были основательно забыты и, кроме того, и не относились специально к атому углерода. Даже модель неправильного тетраэдра у Пастера, строго говоря, относилась к целой молекуле (винной кислоты), а не к атому углерода, и в то время, когда она была предложена в качестве одной из иллюстраций понятия диссимметрии молекул, т. е. до возникновения теории химического строения, никак не могла относиться к направлению связей в пространстве.
К концу 50-х годов XIX в. создались все главные предпосылки для возникновения сбш ей теории химического строения. К этому времени большинство химиков уже приняли различие понятий атом и молекула. В связи с этим после конгресса в Карлсруэ были исправлены атомные веса ряда элементов, прежде всего углерода, кислорода, серы и других, входящих в состав органических соединений. Одновременно, наконец, перестали употреблять для расчетов эквивалентные веса (вместо атомных весов). [c.304]
ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ КАК ПРЕДПОСЫЛКА ДЛЯ ВОЗНИКНОВЕНИЯ СТЕРЕОХИМИИ [c.23]
Для возникновения новой научной теории необходимо, во-первых, чтобы уже существовали в самой науке достаточные предпосылки чувствовалась потребность в такой теории и были выработаны научные понятия и положения, на которые можно было бы опираться при ее создании. Во-вторых, необходимо, чтобы среди ученых появился человек (а иногда я несколько), которому решение такой задачи было бы по плочу. В свою очередь научная среда, в которой он вращается, и вся его собственная научная деятельность, не говоря уже о его личных качествах, должны способствовать этой миссии. Поэтому, прежде чем обратиться к докладу Бутлерова О химическом строении веществ , в котором были впервые изложены основные положения классической теории химического строения, мы рассмотрим как теоретические предпосылки для ее возникновения, так и причины, благоприятствовавшие возникновению этой теории в России. [c.64]
Из сказанного выше видно, что, хотя предпосылки для возникновения теории химического строения были созданы западноевропейскими учеными, основные ее положения были высказаны русским химиком. Безуслово этому способствовали и личные качества Бутлерова и то, что в 50-х годах прошлого века в России появились теоретические исследования, на которые он мог опереться. Но, конечно, это недостаточный ответ на вопрос цочему теория химического строения возникла в России В Западной Европе было выполнено теоретических исследований не меньше и их авторами были также богато одаренные ученые. Преимущество Бутлерова перед западноевропейскими химиками заключалось в другом.
Теория типов имела, однако, и несомненные заслуги. В связи с ней были созданы предпосылки для возникновения теории химического строения учение о валентности элементов и представление о цепеобразном соединении атомов друг с другом. В самом деле, уже из формул четырех основных типов, предложенных Жераром, следует, что водород и хлор могут соединяться с одним атомом водорода, кислород —с двумя, а азот — с тремя. Такие же выводы можно было бы сделать и для других элементов, в том числе и для углерода. Приняв атом водорода за единицу, можно считать, что сам водород и галогены — элементы одноатомные (или, как стали говорить позднее, одновалентные), кислород и сера — двухатомные (двухвалентные), азот и фосфор — трехатомные (трехвалентные), углерод — четьцрехатомен (четырехвалентен). Атомность элементов отождествлялась с числом единиц сродства, которыми обладали их атомы. Соединение двух атомов, образование химической связи происходит, как тогда говорили, в результате взаимной нейтрализации ( потребления ) двух единиц сродства, по одной от каждого атома. Рассматривая формулы углеводородов и их производаых, [c.56]
Для этого было несколько причин. Во-первых, Кекуле в 1857 ж 1858 гг. высказал теоретические положения, послужившие предпос
www.chem21.info
Теория органических соединений М.Бутлерова
Тема: Теория строения органических соединений А.М. Бутлерова
Цель: Познакомить учащихся с основными предпосылками создания теории строения органических соединений А. М. Бутлерова. Рассмотреть основные положения теории. Раскрыть значение теории А. М. Бутлерова для органической химии.
Задачи:
Образовательные: изучить предпосылки создания теории химического строения, ее основные положения, зависимость свойств веществ от строения молекулы, значение теории строения для развития науки и жизнедеятельности человека. Углубить основные химические понятия: вещество, химическая реакция.
Развивающие: развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности, умение предъявлять результаты групповой деятельности.
Воспитательные: способствовать воспитанию у учащихся активной жизненной позиции.УУД
Личностные УУД: личностное, профессиональное самоопределение, смыслообразование
Регулятивные УУД: целеполагание, саморегуляция
Коммуникативные УУД: планирование учебного сотрудничества с учителем и сверстниками — определение цели, функций участников, способов взаимодействия
Познавательные УУД: анализ объектов с целью выделения признаков, структурирование знаний; осознанное и произвольное построение речевого высказывания в устной и письменной форме; выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; подведение под понятие, выведение следствий
Планируемые результаты
Предметные:
Знать понятия: гомолог, гомологический ряд, изомерия.
Уметь: записывать молекулярные и структурные формулы.
Личностные: формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию
Метапредметные: Воспроизведение своими словами правил, понятий, алгоритмов, выполнение действий по образцу, алгоритму
Основные понятия
Теория строения органических веществ. Химическое строение, гомолог, гомологический ряд, изомерия.
Формы организации работы на уроке. групповая, фронтальная, практическая.
Технология. Поисковая технология, технология уровневой дифференциации, проблемное обучение
План урока.
Организационный момент (требования к предмету: тетради, учебники, поведение в кабинете, оборудование кабинета и т. д.)
Актуализация знаний
Давайте вспомним, на каких основных законах базируется неорганическая химия?
(закон постоянства состава- каким бы способом ни было получено вещество, его химический состав и свойства остаются неизменными., закон сохранения веществ- суммарная масса реагентов равна суммарной массе продуктов реакции.)
Органическая химия также базируется на этих 2х законах, а также на теории строения органических веществ.
Давайте вспомним, что такое вещество, и на какие 2 группы они делятся?
(вид материи с определёнными химическими и физическими свойствами)
(делятся на 2 большие группы, простые и сложные, сложные в свою очередь на неорганические (Соли, кислоты, основания, оксиды), органические (УВ, элементорганические вещества).
Органическая химия есть химия углеводородов и их производных, т.е. продуктов, образующихся при замене водорода другими атомами или группами атомов». Сейчас органическую химию чаще всего называют химией соединений углерода. Почему же из более чем ста элементов Периодической системы Д. И. Менделеева природа именно углерод положила в основу всего живого?
Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединения. Ни в одном из элементов способности к усложнению не развито в такой степени, как в углероде. Ни одна пара элементов не дает столь много соединений, как углерод с водородом.
Многочисленные связи атомов углерода между собой и с атомами других элементов (водорода, кислорода, азота, серы, фосфора), входящих в состав органических веществ, могут разрушаться под влиянием природных факторов. Поэтому углерод совершает непрерывный круговорот в природе: из атмосферы (углекислый газ) – в растения (фотосинтез), из растений – в животные организмы, из живого – в мертвое, из мертвого – в живое…Органические вещества имеют ряд особенностей, которые отличают их от неорганических веществ.
Решающая роль в создании теории строения органических соединений принадлежит великому русскому ученому Александру Михайловичу Бутлерову. 19 сентября 1861 года на 36-м съезде немецких естествоиспытателей А.М.Бутлеров обнародовал ее в докладе «О химическом строении вещества» (слайд 2).
Основными предпосылками, подготовившими почву для возникновения теории химического строения было, учение о валентности.
Дайте определение понятию валентность? (откройте учебник на стр 14), (количество химических связей, которое образует один атом)
В 1853 г. Э. Франкланд ввел понятие о валентности, установил валентность для ряда металлов, исследуя металлоорганические соединения. Постепенно понятие валентности было распространено на многие элементы.
В 1858 г. А. Кекуле предложил считать атом углерода четырехвалентным.
Важным открытием для органической химии явилась гипотеза о способности атомов углерода к образованию цепей (А. Кекуле, А. Купер).
Одной из предпосылок была выработка правильного представления об атомах и молекулах. До 2-й половины 50-х г.г. XIXв. Не было общепризнанных критериев для определения понятий: «атом», «молекула», «атомная масса», «молекулярная масса». Только на международном конгрессе химиков в Карлсруэ (1860 г.) были четко определены эти понятия, что предопределило развитие теории валентности, возникновение теории химического строения.
Изучение нового материала.
Итак, переходим к изучению особенностей строения органических соединений теории Бутлерова.
Основные положения теории.
Атомы в молекулах органических веществ соединены между собой химическими связями в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен (запись в тетрадь).
Органические вещества можно расположить в ряд сходных по составу, строению и свойствам – гомологов.
Давайте вспомним, что такое гомологи? Вещества, сходные по строению и по свойствам, но отличающиеся друг от друга на группу атомов СН2 – гомологическую разность, называются гомологами. Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическими свойствам, где каждый член отличается от предыдущего на гомологическую разность СН2.
Например метан – родоначальник гомологического ряда предельных углеводородов (алканов). Его ближайший гомолог – этан.
Существует 2 вида записи формулы строения.
Формулы строения:
а) структурная формула — описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными).
Например, полная и сокращенная структурные формулы н-бутана C4H10 имеют вид:
Н Н Н Н
׀ ׀ ׀ ׀
Н – С – С – С – С – Н СН3 – СН2 – СН2 – СН3
׀ ׀ ׀ ׀
Н Н Н Н
полная структурная формула сокращенная структурная формула
б) молекулярная (брутто) формула C4H10, показывает только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражает порядка связывания атомов.
Свойства органических веществ зависят не только от их качественного и количественного состава, но и от порядка их расположения атомов в молекуле, т.е. от химического строения молекулы.
Данное положение теории строения органических соединений объясняет явление изомерии.
Давайте вспомним, что такое изомерия?
Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов, обусловливает явление изомерии.
Дайте определение понятию изомеры?
Вещества, имеющие одинаковый количественный и качественный состав молекул, но различное химическое строение и свойства называются изомерами.
Существует два основных типа изомерии – структурная и пространственная.
Структурная изомерия определяется различным порядком соединения атомов в молекуле. Различают три вида структурной изомерии:
вид изомерии, связанный с изменение строения углеродной цепи, называется изомерией углеродного скелета (изомерией цепи). Например, пентан имеет следующие изомеры:
С
׀
С – С – С – С – С С — С – С – С С — С – С
׀ ׀
С С
н-пентан, Tкип.= +36°С 2-метилбутан, Ткип.= +27°С 2,2 –диметилпропан, Ткип.= +5°С
вид изомерии, связанный с изменением места расположения кратной связи и /или атомов и групп атомов (галогенов, гидроксо-, нитрогрупп и др.), заместивших атомы водорода в углеродной цепи, называется изомерией положения. Например,
СН3 — СН2 – СН= СН2 и СН3 — СН = СН– СН
бутен-1 бутен-2
СН3 — СН2 – СН2-ОН и СН3 — СН – СН3
пропанол-1 ׀
ОН пропанол-2
межклассовая изомерия. Изомеры имеют одинаковую молекулярную формулу, но относятся к разным классам органических соединений. Например, этиловый спирт и диметиловый эфир отвечают формуле С2Н6О:
СН3 — СН2 — ОН СН3 — О — СН3
спирт Tкип.= +78,4°С эфир Tкип.= -23,7°С
Пространственная изомерия обусловливается различным расположением атомов и групп атомов в пространстве. Пространственная изомерия подразделяется на: а)геометрическую (цис- и транс-изомерию), она возможна при наличии двойной связи в корне молекулы:
СН3 СН3 СН3 Н

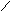

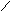
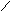
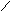 С = С С = С
С = С С = С


Н Н Н СН3
цис-изомер транс-изомер
б)оптическая (зерккальная), она возможна при наличии ассиметричного атома углерода (при атоме углерода 4 разных заместителя)
Молекула каждого вещества обладает определенным химическим строением, которое может быть установлено химическими методами. Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы — предвидеть свойства вещества.
Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга, от чего зависят и химические свойства соединения.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Закрепление(мин)
Ребята, сегодня мы пытались найти ответы на многие вопросы, которые касаются органических соединений и органической химии. Подведем итог.
Что же изучает органическая химия?
Какие химические вещества называются органическими.
В чем состоит особенность органических соединений?
Какова валентность углерода в органических соединениях?
Какова его степень окисления?
Какое химическое свойство является общим для органических соединений?
Задание на карточках.
Составьте структурные формулы органических веществ.
1 вариант2 вариант
C5H12
C2H6
C7H16
C3H8
Подведение итогов
Рефлексия.
На уроке я узнал…
Мне понравилось…
Не понравилось…
Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей
Н Н Н Н Н Н Н
׀ ׀ ׀ ׀ ׀ ׀ ׀
Н – С – С – С – С – Н Н – С – С – С – Н
׀ ׀ ׀ ׀ ׀
Н Н Н Н Н — С -Н
׀
н-бутан Н изо-бутан
infourok.ru
История развития представлений о строении вещества. Видеоурок. Химия 10 Класс
Тема: Введение в органическую химию
Урок: История развития представлений о строении веществ
Теория строения органических веществ А.М. Бутлерова
В конце XVIII в. начались исследования органических веществ. Из растений были выделены и изучены органические кислоты – щавелевая, лимонная, яблочная, молочная и др. Исследовались продукты жизнедеятельности животных организмов, например, были выведены и изучены мочевина и мочевая кислота.
По мере изучения органических веществ, были установлены факты, доказывающие, что между веществами растительного и животного происхождения нет принципиальной разницы. Например, при окислении растительного вещества – сахара – получается муравьиная кислота – вещество животного происхождения; жиры содержатся и в животных, и в растительных организмах.
Накопленные факты заставили пересмотреть представления о веществах растительного и животного происхождения и ввести общее понятие «органические вещества».
Химия, занимающаяся изучением этих веществ, была названаорганической. Такое предложение было сделано в 1807 г. шведским химиком Иенсом Берцелиусом (Jens Jakob Berzelius; 1779–1848). По его мнению и мнению других ученых, выделение химии органических веществ в отдельную науку объясняется не только их сложностью по сравнению с неорганическими (минеральными) веществами, но и тем, что органические вещества образуются только в живых организмах под влиянием «жизненной силы».
В 1824 г. ученик Берцелиуса немецкий ученый Фридрих Вёлер (Wöhler Friedrich, 1800–1882) синтезировал щавелевую кислоту – вещество растительного происхождения – из неорганического вещества – газа дициана (CN)2.
В 1828 г. Вёлер провел второй синтез: нагревая неорганическое вещество цианат аммония NH4OCN, он получил органическое вещество – продуют жизнедеятельности животного организма – мочевину (NH2)2CO.
В 1845 г. немецкий химик Герман Кольбе (Adolph Wilhelm Hermann Kolbe; 1818–1884) синтезировал из неорганических веществ уксусную кислоту; в 1854 г. французский химик М. Бертло (Berthelot, Pierre-Eugene-Marcellin, 1827- 1907) синтезировал жир; а в 1861 г. русскому химику А.М. Бутлерову удалось синтезировать сахаристое вещество. Как известно, жиры и сахара играют большую роль в процессах жизнедеятельности организма.
Эти открытия привели к краху идеалистического учения о «жизненной силе».
Чтобы объяснить многообразие органических веществ, состоящих всего из нескольких элементов, в истории органической химии выдвигались всевозможные гипотезы и теории.
Возможность описать строение органических молекул появилась после того, как в 1852 г. английский химик Эдуард Франкланд (Edward Frankland, 1825–1899) ввел понятие «валентность». Он считал, что каждый атом обладает способностью соединяться с другими атомами посредством определенного, характерного для этого атома, числа связей. Это число он назвал валентностью (от латинского valentia – «сила»).
Атом водорода обычно образует одну связь, т.е. он одновалентен, атом кислорода в большинстве соединений двухвалентен и т.д.
Немецкий ученый Фридрих Кекуле (Friedrich August Kekulé von Stradonitz, 1829–1896) предположил, что в органических соединениях валентность углерода равна четырем. Четырехвалентные атомы углерода способны, по Кекуле, соединяться друг с другом и образовывать цепи.
Однако многие химики того времени считали, что с помощью химических формул нельзя отразить строение соединения, и тем более невозможно на основании формулы предсказать свойства вещества.
Тот же Кекуле утверждал: «Конституции тела они (формулы) не представляют, являясь лишь выражением для метаморфоз тела и для сравнения различных тел».
Нам это может показаться странным, но в середине XIX века для ученых не была очевидна реальность существования атомов и молекул.
Для того чтобы связать строение и свойства органических соединений, нужно было критически обобщить все созданные гипотезы.
Человеком, который преодолел заблуждения тогдашних авторитетов, стал молодой русский ученый Александр Михайлович Бутлеров (1828–1886). Рис. 1.

Рис. 1. А.М. Бутлеров
Главные положения своей теории химического строения Бутлеров впервые изложил в докладе «О химическом строении вещества», прочитанном в химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (сентябрь 1861 г.).
Основы этой теории сформулированы таким образом:
1. «Полагая, что каждому химическому атому свойственно лишь определённое и ограниченное количество химической силы (сродства), с которой он принимает участие в образовании тела, я назвал бы химическим строением эту химическую связь, или способ взаимного соединения атомов в сложном теле»
2. «… химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением»
С этими основными постулатами связаны и все остальные положения классической теории химического строения. Бутлеров наметил путь для определения химического строения и сформулировал правила, которыми можно при этом руководствоваться.
Бутлеров впервые объяснил явление изомерии тем, что изомеры – это соединения, обладающие одинаковым элементарным составом, но различным химическим строением. В свою очередь, зависимость свойств изомеров и вообще органических соединений от их химического строения объясняется существованием в них передающегося вдоль связей «взаимного влияния атомов», в результате которого атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Самим Бутлеровым и особенно его учениками В.В. Марковниковым и А.Н. Поповым это общее положение было конкретизировано в виде многочисленных «правил». Уже в XX в. эти правила, как и вся концепция взаимного влияния атомов, получили электронную интерпретацию.
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. В настоящее время используются также физические методы.
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Научная теория может считаться справедливой только в том случае, если с ее помощью можно не только объяснить известные факты, но и предсказать неизвестные явления.
Большое значение для становления теории химического строения имело её экспериментальное подтверждение в работах как самого Бутлерова, так и его школы. Он предвидел, а затем и доказал существование изомерии положения и скелетной изомерии. Получив третичный бутиловый спирт, он сумел расшифровать его строение и доказал (совместно с учениками) наличие у него изомеров. В 1864 Бутлеров предсказал существование двух бутанов и трёх пентанов, а позднее и изобутилена.

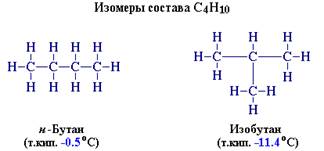
Рис. 2. Получение веществ, подтверждающих теорию строения.
В настоящее время обычно употребляют термин «строение молекулы», не используя определение «химическое». Во время Бутлерова строение вещества исследовали только химическими методами, сейчас основные методы исследования – физические, прежде всего различные виды спектроскопии.
Разработанная Бутлеровым теория строения была создана для органических соединений, однако она справедлива для всех веществ с ковалентной связью.
Теория строения органических соединений дала толчок бурному развитию органической химии. С тех пор представления о строении молекул значительно углубились, однако эта теория не потеряла своего значения до настоящего времени.
Подведение итога урока
В ходе урока вы изучили тему «История развития представлений о строении вещества». Познакомились с учением о строении вещества, истории его становления и развития. Большая часть урока посвящена основным положениям теории Бутлерова и значении этой теории. Было уделено особое внимание химическим системам и их особенностям, приведены основные сведения о строении вещества от древности до современности.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 13, 15 (с. 11) Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Перечислите открытия, которые явились предпосылками создания теории химического строения.
3. Кто и когда впервые синтезировал уксусную кислоту?
interneturok.ru
Введение| Параграф 2
«Химия. 10 класс». О.С. Габриелян
Вопрос 1.
Предпосылкой появления теории химического строения органических соединений явилось то, что ученым становилось известно все больше и больше органических веществ, которые необходимо было каким-либо образом классифицировать, а стройной теории, позволяющей это сделать, на тот момент не существовало. Без следующих открытий создание теории было бы также невозможно:
1853г — английский ученый Франклинд ввел понятие валентность.
1858г — немецкий ученый Кекуле предположил, что углерод в органических соединениях четырехвалентен и его атомы могут образовывать цепи, соединяясь друг с другом.
1860г — закреплены понятия «атом» и «молекула».
Вопрос 2.
Предпосылками к созданию теории Бутлерова и теории Менделеева был ряд открытий, тем более они были примерно в одно и тоже время:
1. Введение понятия «валентность».
2. Закреплены понятия «атом» и «молекула».
Основное положение теории Менделеева:
«Свойства элементов находятся в периодической зависимости от их атомных весов».
Основные положения теории Бутлерова:
1. Атомы в молекулах располагаются в определенной последовательности в соответствии с их валентностью, причем они целиком должны быть затрачены на соединение друг с другом.
2. Свойства органических веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от того, в каком порядке они соединены друг с другом.
3. Атомы, или группы атомов, образовавшие молекулу, взаимно влияют друг на друга, от чего зависят активность и реакционная способность молекулы.
Обе эти теории никогда не прекратят свое существование, а будут только развиваться, обе они позволили систематизировать известные вещества или элементы, понять их свойства и предсказывать свойства еще неизвестных веществ.
Вопрос 3.
Во всех органических соединениях атом углерода находится в возбужденном состоянии и имеет следующее электронное строение:
В возбуждённом состоянии атом углерода содержит 4 неспаренных электрона, и в соединениях будет образовывать 4 связи, т.е. являться четырехвалентным.
Вопрос 4.
Атом углерода является основным элементом органического мира, т.к. именно он дает все многообразие органических веществ (за счет различных комбинаций, возможности образования цепей и гибридизации).
Вопрос 5.
Примером взаимного влияния атомов в органических веществах могут служить бензол и фенол:
Примером взаимного влияния атомов в неорганических веществах могут служить серная и сернистая кислоты:
Na2SO3 + H2SO4 → Na2SO4 + SO2↑
Na2SO4 + H2SO3 → реакция не протекает.
Вопрос 6.
После открытия периодичности Менделеев предсказал свойства ещё не открытых элементов. Позже эти элементы были открыты, что блестяще подтвердило правильность теории Менделеева. До 1828г. в органической химии считалось, что органические вещества образуются только в живых организмах, но затем Вёлер синтезировал щавелевую кислоту и мочевину из неорганических веществ, что полностью разрушило виталистическую теорию и создало дополнительные предпосылки для созданий теории строения органических веществ.
Вопрос 7.
Теория строения органических веществ обеспечила возможность понимания свойств известных веществ и прогнозирования свойств еще неизвестных соединений, также их возможный синтез и применение в промышленности или в быту.
buzani.ru
План Предпосылки создания теории химического строения
План
1. Предпосылки создания теории химического строения
2. Теория химического строения А.М. Бутлерова. Основные положения
3. Современные представления о теории химического строения
1. Предпосылки создания теории. Накопление фактологического материала.
Ко времени создания А. М. Бутлеровым теории химического строения органических веществ (1861 г.) были известны многие десятки и сотни тысяч органических соединений.
Возникновение органической химии как самостоятельной науки можно отнести к 1807 г., когда известный шведский химик Й. Берцелиус впервые ввел термины «органическая химия» и «органические вещества». До этого времени вещества классифицировали по источнику их получения и поэтому еще в XVIII в. различали три химии: «растительную», «животную» и «минеральную».
В конце XVIII в. французский химик А. Лавуазье показал, что вещества, получаемые из организмов растений и животных (отсюда их название — органические вещества), содержат, в отличие от минеральных, лишь немногие элементы: углерод, водород, кислород, азот, а иногда фосфор и серу. Так как углерод обязательно присутствует во всех органических соединениях, то органическую химию по предложению А. Кекуле с середины XIX в. стали называть химией соединений углерода.
Позднее немецкий химик К. Шорлеммер дал более точное определение этой науки: органическая химия — это химия углеводородов и их производных (то есть соединений, которые могут быть получены на основе углеводородов).
Введение Й. Берцелиусом в 1830 г. термина «изомерия» для явления существования веществ одинакового состава, обладающих различными свойствами.
Успехи в синтезе органических соединений, в результате которых было развеяно учение о витализме, то есть о «жизненной силе», под влиянием которой якобы в организме живых существ образуются органические вещества:
• в 1828 г. Ф. Велер из неорганического вещества (цианата аммония) синтезировал мочевину;
• в 1842 г. русский химик Н. Н. Зинин получил анилин;
• в 1845 г. немецкий химик А. Кольбе синтезировал уксусную кислоту;
• в 1854 г. французский химик М. Бертло синтезировал жиры, и, наконец,
• в 1861 г. сам А. М. Бутлеров синтезировал сахароподобное вещество.
5. В середине XVIII в. химия становится более строгой наукой. В результате работ Э. Франкланда и А. Кекуле утвердилось понятие о валентности атомов химических элементов. Кекуле развил представление о четырехвалентности углерода. Благодаря трудам Канниццаро четче стали понятия об атомных и молекулярных массах, уточнены их значения и способы определения.
В 1860 г. более 140 ведущих химиков из разных стран Европы собрались на международный конгресс в г. Карлсруэ. Конгресс стал очень важным событием в истории химии: были обобщены успехи науки и подготовлены условия для нового этапа в развитии органической химии — появления теории химического строения органических веществ А. М. Бутлерова (1861 г.), а также для фундаментального открытия Д. И. Менделеева — Периодического закона и системы химических элементов (1869 г.).
В 1861 г. А. М. Бутлеров выступил на съезде врачей и естествоиспытателей в г. Шпейере с докладом «О химическом строении тел». В нем он изложил основы разработанной им теории химического строения органических соединений. Под химическим строением ученый понимал порядок соединения атомов в молекулах.
А. М. Бутлерова отличали энциклопедичность химических знаний, умение анализировать и обобщать факты, прогнозировать. Он предсказал существование изомера бутана, а затем получил его, равно как изомер бутилена — изобутилен.
Поделитесь с Вашими друзьями:
zodorov.ru
Введение| Параграф 2
«Химия. 10 класс». О.С. Габриелян
Вопрос 1.
Предпосылкой появления теории химического строения органических соединений явилось то, что ученым становилось известно все больше и больше органических веществ, которые необходимо было каким-либо образом классифицировать, а стройной теории, позволяющей это сделать, на тот момент не существовало. Без следующих открытий создание теории было бы также невозможно:
1853г — английский ученый Франклинд ввел понятие валентность.
1858г — немецкий ученый Кекуле предположил, что углерод в органических соединениях четырехвалентен и его атомы могут образовывать цепи, соединяясь друг с другом.
1860г — закреплены понятия «атом» и «молекула».
Вопрос 2.
Предпосылками к созданию теории Бутлерова и теории Менделеева был ряд открытий, тем более они были примерно в одно и тоже время:
1. Введение понятия «валентность».
2. Закреплены понятия «атом» и «молекула».
Основное положение теории Менделеева:
«Свойства элементов находятся в периодической зависимости от их атомных весов».
Основные положения теории Бутлерова:
1. Атомы в молекулах располагаются в определенной последовательности в соответствии с их валентностью, причем они целиком должны быть затрачены на соединение друг с другом.
2. Свойства органических веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от того, в каком порядке они соединены друг с другом.
3. Атомы, или группы атомов, образовавшие молекулу, взаимно влияют друг на друга, от чего зависят активность и реакционная способность молекулы.
Обе эти теории никогда не прекратят свое существование, а будут только развиваться, обе они позволили систематизировать известные вещества или элементы, понять их свойства и предсказывать свойства еще неизвестных веществ.
Вопрос 3.
Во всех органических соединениях атом углерода находится в возбужденном состоянии и имеет следующее электронное строение:
В возбуждённом состоянии атом углерода содержит 4 неспаренных электрона, и в соединениях будет образовывать 4 связи, т.е. являться четырехвалентным.
Вопрос 4.
Атом углерода является основным элементом органического мира, т.к. именно он дает все многообразие органических веществ (за счет различных комбинаций, возможности образования цепей и гибридизации).
Вопрос 5.
Примером взаимного влияния атомов в органических веществах могут служить бензол и фенол:
Примером взаимного влияния атомов в неорганических веществах могут служить серная и сернистая кислоты:
Na2SO3 + H2SO4 → Na2SO4 + SO2↑
Na2SO4 + H2SO3 → реакция не протекает.
Вопрос 6.
После открытия периодичности Менделеев предсказал свойства ещё не открытых элементов. Позже эти элементы были открыты, что блестяще подтвердило правильность теории Менделеева. До 1828г. в органической химии считалось, что органические вещества образуются только в живых организмах, но затем Вёлер синтезировал щавелевую кислоту и мочевину из неорганических веществ, что полностью разрушило виталистическую теорию и создало дополнительные предпосылки для созданий теории строения органических веществ.
Вопрос 7.
Теория строения органических веществ обеспечила возможность понимания свойств известных веществ и прогнозирования свойств еще неизвестных соединений, также их возможный синтез и применение в промышленности или в быту.
buzani.ru
Предпосылки теории строения
Подобно тому как в неорганической химии при изучении элементов и их соединений необходимо постоянно руководствоваться периодическим законом и Периодической системой химических элементов Д.И. Менделеева, в органической химиипри изучении веществ необходимо опираться на теорию химического строения.
Основой создания теории химического строения органических соединений А.М. Бутлеровым послужило атомно-молекулярное учение (работы А.Авагадро и С.Канниццаро). Будет неправильным предполагать, что до ее создания в мире ничего не было известно об органических веществах и не предпринимались попытки обоснования строения органических соединений. К 1861 году (год создания А.М. Бутлеровым теории химического строения органических соединений) число известных органических соединений достигало сотен тысяч, а выделение органической химии как самостоятельной науки произошло еще в 1807 году (Й. Берцелиус).
Широкое изучение органических соединений началось в XVIII веке с работ А.Лавуазье, который показал, что вещества, получаемые из живых организмов, состоят из нескольких элементов – углерода, водорода, кислорода, азота, серы и фосфора. Огромное значение имело введение терминов «радикал» и «изомерия», а также формирование теории радикалов (Л. Гитон де Морво, А. Лавуазье, Ю. Либих, Ж. Дюма, Й. Берцелиус), успехи в синтезе органических соединений (мочевина, анилин, уксусная кислота, жиры, сахароподобные вещества и др.).
Термин «химическое строение», а также основы классической теории химического строения были впервые обнародованы А.М. Бутлеровым 19 сентября 1861 года в его докладе на Съезде немецких естествоиспытателей и врачей в Шпейере.
2. Основные положения теории химического строения.
Между строением и свойствами органических соединений существует взаимосвязь. Эту взаимосвязь объясняет теория химического строения А.М.Бутлерова. (1861г.)
1. Атомы, образующие молекулу органического вещества связаны между собой в определенном порядке, причем на связь с друг другом затрачивается по одной или несколько валентностей от каждого атома. Свободных валентностей нет.
Последовательность соединения атомов Бутлеров назвал «химическим строением». Графически связи между атомами обозначаются чертой или точкой (рис. 1).
Рис. 1. Химическое строение молекулы метана: А – структурная формула, Б – электронная формула
2. Свойства органических соединений зависят от химического строения молекул, т.е. свойства органических соединений зависят от порядка соединения атомов в молекуле. Изучив свойства можно изобразить вещество.
Рассмотрим пример: вещество имеют брутто-формулу C2H6O. Известно, что при взаимодействии этого вещества с натрием выделяется водород, а при действии на него кислоты образуется вода.
C2H6O + Na = C2H5ONa + H2 ↑
C2H6O + HCl = C2H5Cl + H2O
Данному веществу может соответствовать две структурные формулы:
CH3-O-CH3 – ацетон (диметилкетон) и CH3-CH2-OH – этиловый спирт (этанол),
исходя из химических свойств, характерных для этого вещества делаем вывод, что это этанол.
Изомеры – это вещества, обладающие одинаковым качественным и количественным составом, но различным химическим строением. Выделяют несколько типов изомерии:
· структурная (линейная, разветвленная, углеродного скелета),
· геометрическая (цис- и транс- изомерия, характерная для соединений с кратной двойной связью (рис. 2)),
· оптическая (зеркальная),
· стерео (пространственная, характерна для веществ, способных по разному располагаться в пространстве (рис. 3)).
Рис. 2. Пример геометрической изомерии
Рис.3. Пример стерео изомерии: а – циклогексан, форма «кресла», б – циклогексан, форма «ванна»
3. На химические свойства органических соединений оказывают влияние и другие атомы, присутствующие в молекуле. Такие группы атомов получили название функциональных групп, за счет того, что их наличие в молекуле вещества придает ему особые химические свойства.
Например: -OH (гидроксо-группа), -SH (тио-группа), -CO (карбонильная группа), -COOH (карбоксильная группа). Причем химические свойства органического вещества в меньшей степени зависят от углеводородного скелета, чем от функциональной группы.
Именно функциональные группы обеспечивают многообразие органических соединений, за счет чего их классифицируют (спирты, альдегиды, карбоновые кислоты и т.д.
К числу функциональных групп иногда относят и углерод-углеродные связи (кратные двойные и тройные). Если в молекуле органического вещества несколько одинаковых функциональных групп, то его называют гомополифунцкиональным (CH2 (OH)-CH(OH)-CH2(OH) – глицерин), если несколько, но разных – гетерополифункциональным (NH2-CH(R)-COOH – аминокислоты).
4. Валентность углерода в органических соединениях всегда равна четырем.
3. Изомерия и изомеры.
- Углерод образует цепи различной длины;
- Цепь может быть не только линейной, но и разветвленной.
Давайте рассмотрим первый представитель предельных углеводородов – метан. СН4
Как его не верти — он будет иметь одно и тоже строение. Следовательно, метан не имеет изомеров.
Второй представитель….этан. Исходя из валентности углерода, как бы не поворачивалась молекула в пространстве, нового расположения атомов не получается.
Подобным образом рассматриваем пропан, обращая внимание на то, что изгибая углеродную цепь ничего, принципиально нового, мы не получим. С3Н6
Одинарные связи обеспечивают свободное вращение атомов углерода относительно друг друга. Записываем общую формулу бутана и структурные формулы его изомеров на доске.
Соединения, имеющие одинаковую молекулярную формулу, но различное строение и разные свойства, называются изомерами. (от греч. Изос – одинаковый, мерос — часть). Т.о.изомерия– это явление при котором вещества одинакового состава имеют разное пространственное строение, следовательно, и свойства.
Читайте также:
Рекомендуемые страницы:
Поиск по сайту
poisk-ru.ru