04. Химические и физические явления
Изменения веществ, которые не ведут к образованию новых веществ (с иными свойствами), называют физическими явлениями.
1. Вода при нагревании может переходить в пар, а при охлаждении – в лед.
2. Длина медных проводов изменяется летом и зимой: увеличивается при нагревании и уменьшается при охлаждении.
3. Объем воздуха в шаре увеличивается в теплом помещении.
Изменения с веществами произошли, но при этом вода осталась водой, медь – медью, воздух – воздухом.
Новых веществ, несмотря на их изменения по форме или агрегатному состоянию, не образовалось.
Опыт1. Закроем пробирку пробкой со вставленной в нее трубкой
2. Опустим конец трубки в стакан с водой. Рукой нагреем пробирку. Объем воздуха в ней увеличивается, и часть воздуха из пробирки выходит в стакан с водой (выделяются пузырьки воздуха).
3.
Вывод. Изменения объема воздуха – физическое явление.
Задания
Приведи 1–2 примера происходящих с веществами изменений, которые можно назвать физическим явлением. Запиши примеры в тетради.
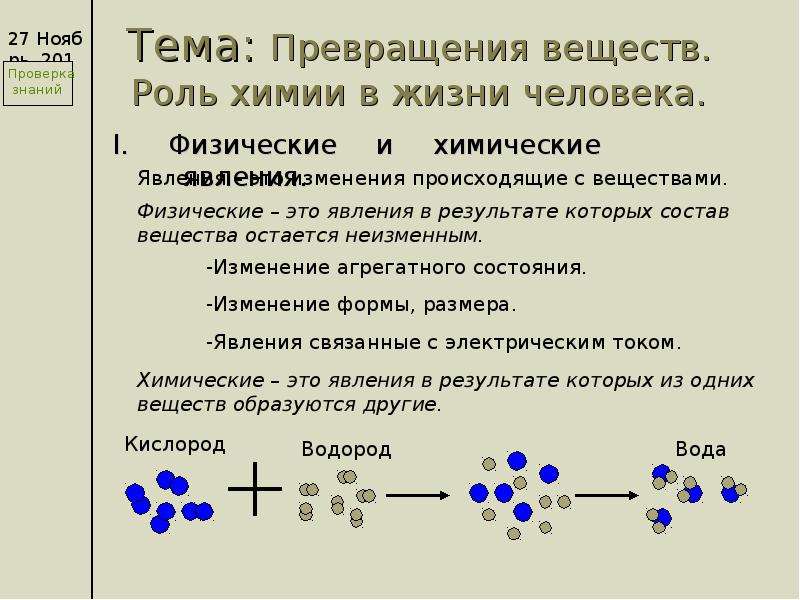
Химическое явление (реакция) – явление, при котором образуются новые вещества.
А по каким признакам можно определить, что произошла химическая реакция? При некоторых химических реакциях происходит выпадение осадка. Другие признаки – изменение цвета исходного вещества, изменение его вкуса, выделение газа, выделение или поглощение тепла и света.
Примеры таких реакций рассмотри в таблице
Признаки химических реакций | ||||
Изменение цвета исходного вещества | Изменение вкуса исходного вещества | Выпадение осадка | Выделение газа | Появление запаха |
Реакция | Признак |
Изменение цвета | |
Изменение вкуса | |
Выделение газа |
В живой и неживой природе постоянно протекают различные химические реакции. Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Понаблюдаем за некоторыми химическими реакциями.
Опыты с огнем самостоятельно проводить нельзя!!!
Опыт 1
Подержим над огнем кусочек белого хлеба, содержащего органические вещества.
Наблюдаем:
1. обугливание, то есть изменение цвета;
2. появление запаха.
Вывод. Произошло химическое явление (образовалось новое вещество — уголь)
Опыт 2
Приготовим стаканчик с крахмалом. Добавим немного воды, перемешаем. Затем капнем раствором йода.
Наблюдаем признак реакции: изменение цвета (посинение крахмала)
Вывод. Произошла химическая реакция. Крахмал превратился в другое вещество.
Опыт 3
1. Разведем в стакане небольшое количество питьевой соды.
2. Добавим туда несколько капель уксуса (можно взять сок лимона или раствор лимонной кислоты).
Наблюдаем выделение пузырьков газа.
|
Вывод. Выделение газа – один из признаков химической реакции.
Некоторые химические реакции сопровождаются выделением тепла.
Задания
Поместите в стеклянную баночку (или стакан) несколько кусочков сырого картофеля. Добавьте к ним перекись водорода из домашней аптечки. Объясните, по какому признаку можно определить, что произошла химическая реакция.
Явления природы (биологические, физические, химические) | Природоведение. Реферат, доклад, сообщение, краткое содержание, конспект, сочинение, ГДЗ, тест, книга
Как известно, явления — это изменения, происходящие с телами природы. В природе наблюдаются разнообразные явления. Светит Солнце, образуется туман, дует ветер, бегут лошади, из семени прорастает растение — это лишь некоторые примеры. Повседневная жизнь каждого человека также наполнена явлениями, происходящими при участии рукотворных тел, например, едет автомобиль, нагревается утюг, звучит музыка. Посмотрите вокруг, и вы увидите и сможете привести примеры многих других явлений.
Повседневная жизнь каждого человека также наполнена явлениями, происходящими при участии рукотворных тел, например, едет автомобиль, нагревается утюг, звучит музыка. Посмотрите вокруг, и вы увидите и сможете привести примеры многих других явлений.
Учёные разделили их на группы. Различают
| Явления природы |
Биологические явления. Все явления, которые происходят с телами живой природы, т.е. организмами, называются биологическими явлениями. К ним относятся прорастание семян, цветение, образование плодов, листопад, зимняя спячка животных, полёт птиц (рис. 29).
Физические явления. К признакам физических явлений относятся изменение формы, размеров, места расположения тел и их агрегатного состояния (рис. 30). Когда гончар изготовляет из глины какое-либо изделие, изменяется форма..PNG) При добыче каменного угля изменяются размеры кусков горной породы. Во время движения велосипедиста изменяется размещение велосипедиста и велосипеда относительно тел, расположенных вдоль дороги. Таяние снега, испарение и замерзание воды сопровождаются переходом вещества из одного агрегатного состояния в другое. Во время грозы гремит гром и появляется молния. Это физические явления.
При добыче каменного угля изменяются размеры кусков горной породы. Во время движения велосипедиста изменяется размещение велосипедиста и велосипеда относительно тел, расположенных вдоль дороги. Таяние снега, испарение и замерзание воды сопровождаются переходом вещества из одного агрегатного состояния в другое. Во время грозы гремит гром и появляется молния. Это физические явления.
| Рис. 29. Биологические явления; а — прорастание семян, б — полёг птицы; в — листопад |
| Рис. 30. Физические явления |
Согласитесь, что данные примеры физических явлений очень разные. Но какими бы разнообразными не были физические явления, ни в одном из них не происходит образование новых веществ.
Физические явления — явления, во время которых новые вещества не образуются, но изменяются размеры, форма, размещение, агрегатное состояние тел и веществ.
Химические явления. Вам хорошо известны такие явления, как горение свечи, образование ржавчины на железной цепи, скисание молока и др. (рис. 31). Это примеры химических явлений. Материал с сайта //iEssay.ru
| Рис. 31. Химические явления: а — ржавение металла; б — выделение углекислого газа при добавлении в соду уксуса; в — химический анализ воды |
Химические явления — это явления, во время которых из одних веществ образуются другие.
Химические явления имеют широкое применение. С их помощью люди добывают металлы, создают средства личной гигиены, материалы, лекарства, готовят разнообразные блюда.
На этой странице материал по темам:- сообщение о биологическом явлении
- природные химические явления
- биологические явления
- конспект на тему химические явления в природе
- биологическое сочинение на тему листопад
Эссе на тему «роль химии в моей жизни»
- Сочинения
- Свободная тема
- Химия – это область чудес
Конечно, это область чудес! Никакая другая наука не даёт возможности совершить настоящее чудо! Недаром одни из самых загадочных людей – алхимики. Они искали легендарный философский камень, превращали всё в золото. И всегда были особенными – загадочными людьми: между учеными и магами.
Они искали легендарный философский камень, превращали всё в золото. И всегда были особенными – загадочными людьми: между учеными и магами.
Другие науки тоже позволяют менять мир, но не так эффектно. Вот биология, например. Ты можешь поменять гены, скрестить помидор с картошкой… Но это нужно много времени, пока всё это чудо вырастет! А в химии взял один реагент – капнул в другой, вот тебе уже и чудо! Всё забурлило, дым повалил, цвет поменялся. И совсем новое вещество получилось! Вот это здорово!
В Интернете много роликов с химическими превращениями. Их мне них всегда интересно посмотреть. Теперь даже в телевизоре показывают такие «фокусы». А ещё я знаю, что сейчас можно увидеть «химика» на всяких праздниках, где он демонстрирует свои способности. К примеру, на празднике какого-нибудь торгового центра. Вокруг него собираются дети, а он показывает «фокусы». Тут не только малышам интересно, но и взрослым, так как это ведь наука. И на дни рождения, слышал я, теперь тоже можно пригласить такого «химика» — артиста. Там сами дети будут ему помогать, участвовать в экспериментах. По-моему, это намного интересней клоунов.
Там сами дети будут ему помогать, участвовать в экспериментах. По-моему, это намного интересней клоунов.
Ещё продаётся набор «Юного химика». Я когда-то хотел такой, но мама испугалась. А теперь я уже не очень и хочу – там, всё-таки, детский вариант, игрушки. Вот когда у нас в расписании будет химия – я с удовольствием буду на этот урок ходить. Там самый интересный класс: колбочки, трубочки, столько всякого… Уверен, что это будет очень интересный урок. Мы будем проводить лабораторные работы, эксперименты тоже ставить.
А сколько чудесного химия создала! Мы уже привыкли к разным полезным материалам, к пластику, но ведь во всём этом без химиков никуда бы. Можно взять что угодно, хоть полёт в космос – там тоже химия сыграла роль. Думаю, что дальше эта наука станет ещё важней. Ресурсы Земли на исходе, нужно научиться их синтезировать, а ещё создавать продукты питания, витамины.
Не могу сказать, собираюсь ли точно я стать химиком. Но науку эту уважаю очень!
Образец №2
Химия — это область чудес. Эта прекрасная наука изучает строение веществ, их свойства и превращения.
Эта прекрасная наука изучает строение веществ, их свойства и превращения.
Химия окружает нас повсеместно. Все предметы состоят из определенной материи, представляющей собой химическое вещество. Знание о ее строении расширяет кругозор и позволяет увидеть в старых предметах что-то новое и необычное, взглянуть на них свежими глазами.
Цепные реакции различных превращений происходят ежеминутно и в нас самих. Это и процессы метаболизма, включая расщепление белков, жиров, углеводов; синтез гормонов, ферментов, витаминов и многие другие увлекательные механизмы. Без этого невозможна жизнь взрослого, ребенка, животного, растения, то есть без химических превращений невозможна жизнь в принципе. Это основа основ, благодаря которой существует современный мир.
Химическая наука лежит в основе многих технологических процессов, которыми человечество пользуется издревле. Самый распространенный такой механизм — брожение. Спиртовое брожение используется в виноделии. Молочнокислое применяется не только для производства, но и в мышцах человека при физической нагрузке. Также различные виды брожения используются в хлебопечении, производстве молочнокислой продукции и сыров, квашении.
Также различные виды брожения используются в хлебопечении, производстве молочнокислой продукции и сыров, квашении.
Благодаря достижениям химиков мы имеем возможность пользоваться современными лекарствами. Ученые не покладая рук трудятся над производством новых необходимых человеку лекарственных соединений.
На уроках обществознания говорится, что производство — основа экономики. Пользуясь знаниями химии, я могу развить эту мысль таким образом: производство — основа экономики, а химия — основа производства.
Химические технологии используются не только в фармацевтике, но и в нефтепереработке, производстве пластика, растворителей, красок, мебели, клеев, игрушек, книг и журналов, продуктов питания, растениеводстве и других отраслях сельского хозяйства.
Для того, чтобы понимать значимость этих процессов, необходимо знать их технологию и историю. Все эти знания можно получить на уроке химии.
Химия — это область чудес. С этим сложно поспорить! Чудеса заключаются не только в зрелищных опытах, которые мы видим на уроке, но и в ее вездесущности, повседневности. Химия — один из самых важных предметов в школе, потому что дает необходимые каждому человеку практические жизненные навыки и прикладные знания.
Химия — один из самых важных предметов в школе, потому что дает необходимые каждому человеку практические жизненные навыки и прикладные знания.
Эссе по химии
| Предмет: | Химия |
| Тип работы: | Эссе |
| Язык: | Русский |
| Дата добавления: | 16.06.2019 |
- Данный тип работы не является научным трудом, не является готовой работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете узнать как правильно написать и оформить эссе:
| Как правильно написать эссе |
Посмотрите похожие темы возможно они вам могут быть полезны:
| Эссе по медицине |
| Эссе по нефтегазовому делу |
| Эссе по дизайну |
| Эссе по музыке |
Введение:
пример 1
Химия… что ты представляешь, услышав это? Периодическая таблица или урок химии? Химические эксперименты в школе или уравнения этих реакций? Да, все думают о себе. Однако мы полностью понимаем, что химия — это не только предмет, изучаемый в школах и университетах, но химия — это все вокруг нас и все внутри нас. Химия это жизнь. Оглянись вокруг. Потому что вокруг нас так много всего, даже дома. Столы, стекло, бумага, одежда, посуда … мы редко думаем о том, из чего все это состоит. Мы к ним привыкли, поэтому даже не пытаемся определить их состав и думать о том, откуда они пришли, кто их изобрел и почему.
Однако мы полностью понимаем, что химия — это не только предмет, изучаемый в школах и университетах, но химия — это все вокруг нас и все внутри нас. Химия это жизнь. Оглянись вокруг. Потому что вокруг нас так много всего, даже дома. Столы, стекло, бумага, одежда, посуда … мы редко думаем о том, из чего все это состоит. Мы к ним привыкли, поэтому даже не пытаемся определить их состав и думать о том, откуда они пришли, кто их изобрел и почему.
Вы скажете, что все они были сделаны на фабрике, а мы купили их в магазине. Да, конечно. Но до этого, в конце концов, кто-то придумал сырье, из которого он сделан, а кто-то придумал реакцию и технологию, которые могли бы извлечь это сырье и произвести материал. Это кажется таким простым, но нет, все намного сложнее.
В основе этого лежит великая химическая наука. Многие из химических реакций, с которыми мы сталкивались в лабораторных условиях, происходят в промышленных условиях при производстве наиболее важных химических веществ в повседневной жизни. Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, моющие средства, красители, косметика и даже пищевые ингредиенты — это лишь немногие, и их производство полностью или частично зависит от химической промышленности.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, моющие средства, красители, косметика и даже пищевые ингредиенты — это лишь немногие, и их производство полностью или частично зависит от химической промышленности.
Но мы уже верим, что так и должно быть.
Когда вы открываете холодильник здесь, появляется кефир. Конечно, я не думаю о реакции брожения при приготовлении кефира, и я не помню полиэтиленовую формулу, которая делает тот же пакет кефира. Или возьмите перекись водорода из аптечки и не думайте о формуле h3O2. Аспирин называется аспирин, это ацетилсалициловая кислота, но если вы посмотрите на многие вещи после изучения науки химии, все будет интереснее. Но что случилось до того, как мы начали изучать химию? Возможно, все было иначе. Но люди нашли способ и попытались изучить эту науку.
Ведь человек с первых дней своей жизни сталкивается с химией. Оказывается, не все придумали, но вся природа давно связана с химией.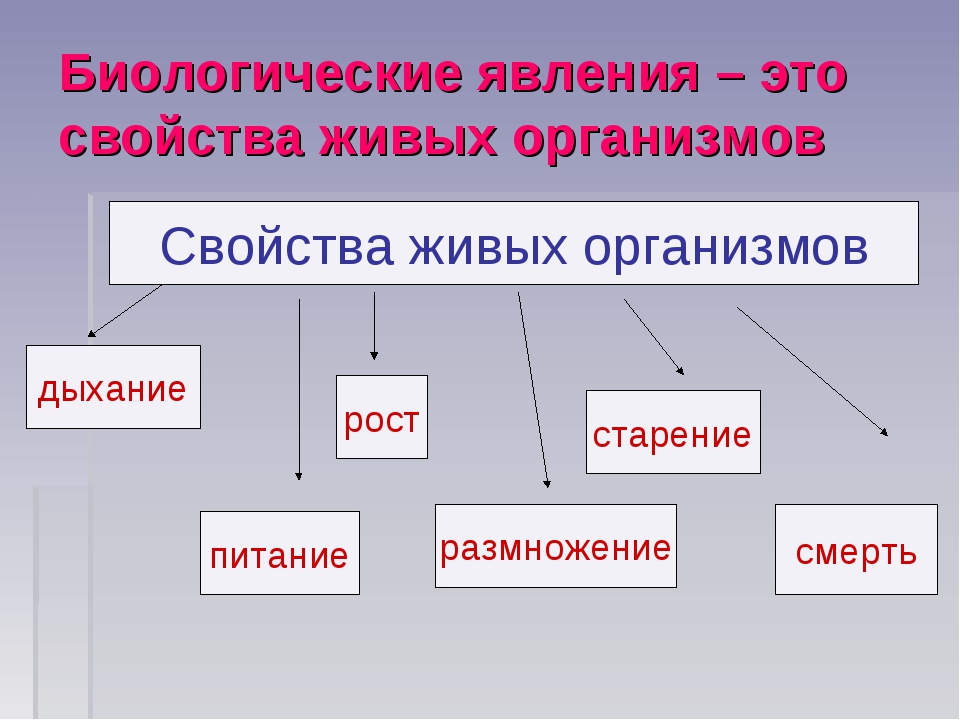 В конце концов, он состоит из химических элементов и соединений, и многие реакции основаны на химических реакциях. Воздух, которым мы дышим, состоит из смеси газов. Вода, которую мы встречаем каждый день, является сложным химическим веществом. Даже мы сами выполняем химические реакции каждый день, когда готовим или включаем газовую плиту. Мало того, в нас происходят десятки химических реакций!
В конце концов, он состоит из химических элементов и соединений, и многие реакции основаны на химических реакциях. Воздух, которым мы дышим, состоит из смеси газов. Вода, которую мы встречаем каждый день, является сложным химическим веществом. Даже мы сами выполняем химические реакции каждый день, когда готовим или включаем газовую плиту. Мало того, в нас происходят десятки химических реакций!
Это кажется невероятным, потому что там нет труб или шишек. Но это правда. Без такой реакции нет жизни. Наше тело имеет почти каждый элемент периодической таблицы. Разве это не главное доказательство того, что химия — это жизнь? Да, люди сталкиваются с химией на каждом этапе. Наша жизнь, здоровье и настроение тесно связаны с множеством химических веществ и процессов вокруг нас и нас самих.
Развитие человеческого общества предполагает использование новых материалов и химических процессов во всех сферах человеческой деятельности. Химия предлагает большие возможности и силу человечеству, но требует грамотного и ответственного использования и понимания природы химических явлений. Поэтому мы должны изучать эту великую науку. Ведь будущее зависит от нас, молодых людей.
Поэтому мы должны изучать эту великую науку. Ведь будущее зависит от нас, молодых людей.
пример 2
Сегодня современные и прогрессивные земли сильно зависят от здоровья людей, окружающей среды, продуктов питания и различных ингредиентов. Без всего этого трудно или даже невозможно представить нашу жизнь сегодня. В мире прогресса и постоянного развития невозможно отследить все, что происходит вокруг нас.
Пить, есть, дышать, по соседству. В основном, как правило, люди принимают эти факторы как часть своей повседневной жизни, неотъемлемую часть жизни, независимо от опасности их потребностей. Это также может отрицательно сказаться на здоровье людей, стать причиной опасных заболеваний и, что еще хуже, смерти. К счастью, однако, эти тревоги почти беспочвенны и не требуют от постоянных пользователей постоянного внимания.
| Они могут жить в мире и быть уверенными в себе. |
Некоторые люди не могут жить с другими из-за постоянного контроля и наблюдения. Проверьте, найдите и исправьте проблемы. Каждый приходит к одному и тому же вопросу при выборе профессии. Как найти работу, чтобы стать правильным человеком? Я думаю, что самый разумный ответ — химический аналитик.
Проверьте, найдите и исправьте проблемы. Каждый приходит к одному и тому же вопросу при выборе профессии. Как найти работу, чтобы стать правильным человеком? Я думаю, что самый разумный ответ — химический аналитик.
Также химик или лаборант. Лаборант-аналитик, Лаборант-эколог, Лаборант-исследователь, Техник-лаборант. Эта профессия позволяет работать в разных областях. Мы производим разнообразную продукцию, от лаков и фармацевтических препаратов до добычи нефти и газа. Это ответственная и важная задача: ошибки, которые могут подорвать здоровье людей, потеря большого количества ресурсов на производстве и загрязнение окружающей среды.
Но в то же время это очень интересная и разносторонняя работа. Я хотел найти что-то полезное, а не просто интересное и необходимое для общества. Лаборант-эколог, очень полезная специальность. Следите за наличием вредных веществ в окружающей среде и воде. Также очень удобно производить средства защиты растений, такие как удобрения и пестициды.
А если ты работаешь в медицине? Сколько можно сделать для здоровых людей! Однако для тех, кто решает стать аналитиком, необходимы некоторые особенности: способность концентрироваться в течение длительных периодов времени, психоневрологическая стабильность, внимание и точность.
В этой профессии семь классов.
Каждого из них отличает уровень подготовки и ответственность. Уровни образования, необходимые для этой работы: Начальное профессиональное образование является основополагающей частью профессии, и вам необходимо среднее профессиональное образование, чтобы учиться в пятой, шестой и седьмой категориях. Я думал, что этот вид деятельности был самым необходимым для меня и общества. Работа интересная и занятая. Возможности для перемещения из одного места в другое открыты.
Акция ясна и будет опубликована, когда вы получите новое звание. Поскольку мы не знаем или не понимаем, что содержит это вещество, мы не знаем, хочет ли кто-нибудь попробовать продукт и его эффекты самостоятельно. Поэтому в мире непрерывного развития нам просто нужны люди, которые отвечают за качество того, что мы производим, и всегда окружаем нас. Профессия аналитиков химического производства — это то, что всегда нужно нашему миру.
Поэтому в мире непрерывного развития нам просто нужны люди, которые отвечают за качество того, что мы производим, и всегда окружаем нас. Профессия аналитиков химического производства — это то, что всегда нужно нашему миру.
Мини сочинение на тему химия в моей жизни
Муниципальное бюджетное образовательное учреждение «Средняя общеобразовательная школа с.Мамашир» Сочинение
на тему:Химия в нашей жизниАвтор:Сайфутдинова Ризаля Назировна,
11 класс, 17 лет 422104, Кукморский район, МБОУ «СОШ села Мамашир», ул. Равиля Нигматуллина, д.14 В последнее десятилетие существует большой спор о роли химии в жизни общества. Некоторым кажется, что это никакого блага не приносит, а только толкает человечество к медленной гибели, а некоторым наоборот, химия то уже часть человечества, без которого его уже невозможно представить. Не согласиться с этими мнениями невозможно, даже это будет не правильно, так как наше понятие о химии, образованное в век постиндустриального общества, этого уже не позволяет. Химия. Думаю, нет уже в мире человека, не знавшего или хотя бы не слыхавшего об этом понятии. Появилось оно уже давно, даже можно сказать с появлением общества. Ещё в Древнем Египте пользовались разными косметическими средствами, а в начале XXI века весь мир стал «одним химическим заводом», в котором выпускают всё — и нужное, и ненужное. От этого и происходит разделение массы людей на группы «за» и «против». Химия и человечество уже являются неотделимым целым. Каждый день в повседневной жизни мы используем «плоды» химии. Даже еда. И она у нас уже не всегда натуральная. Да, многие понимают вред, но отказываться от этого уже нет смысла. Химия везде и химия во всём. Пользу химии отрицать мы тоже не можем. Вспомним, что было до появления мыла, порошков и шампуни. Да, может и появятся те, кто скажет, что это было идеальное время, но согласиться с этим не возможно. Представьте себя человеком, который моет голову золой, отстоявшей водой из древесины. Наши прабабушки поняли ценность мыл во время войны, кризисов или иных катастроф общества.
Химия. Думаю, нет уже в мире человека, не знавшего или хотя бы не слыхавшего об этом понятии. Появилось оно уже давно, даже можно сказать с появлением общества. Ещё в Древнем Египте пользовались разными косметическими средствами, а в начале XXI века весь мир стал «одним химическим заводом», в котором выпускают всё — и нужное, и ненужное. От этого и происходит разделение массы людей на группы «за» и «против». Химия и человечество уже являются неотделимым целым. Каждый день в повседневной жизни мы используем «плоды» химии. Даже еда. И она у нас уже не всегда натуральная. Да, многие понимают вред, но отказываться от этого уже нет смысла. Химия везде и химия во всём. Пользу химии отрицать мы тоже не можем. Вспомним, что было до появления мыла, порошков и шампуни. Да, может и появятся те, кто скажет, что это было идеальное время, но согласиться с этим не возможно. Представьте себя человеком, который моет голову золой, отстоявшей водой из древесины. Наши прабабушки поняли ценность мыл во время войны, кризисов или иных катастроф общества. Ведь были такие времена, когда мыло было в цену золота , и вспоминают они это с горечью. В нынешнее время в стране есть порядком несколько сотен химических заводов. Даже в Татарстане их число превышает десяти. Самыми большими в их числе являются и «Нэфис-Косметикс» успешно работает на рынке уже на протяжении шестидесяти пяти лет. Своё начало ОАО «Хитон» берёт с райпромкомбината, созданного в 1942 году, в которого входили пошивочные, сапожные, слесарные и другие мастерские, которые позднее были объединены в цеха. В 1946 году в райпромкомбинате создаётся химическое производство . а после восьми лет в нём осталось только химическое производство. В это время интенсивно начинает выпускаться масляная краска, олифа и лак. До 1993 года имя завода было изменено пять раз. На сегодняшний день он является крупнейшим производителем бытовой химии лакокрасочной продукции. История связано с братьями Крестовниками. В 1855 году было организовано московскими фабрикантами Крестовниками строительство стеариново-свечного цеха.
Ведь были такие времена, когда мыло было в цену золота , и вспоминают они это с горечью. В нынешнее время в стране есть порядком несколько сотен химических заводов. Даже в Татарстане их число превышает десяти. Самыми большими в их числе являются и «Нэфис-Косметикс» успешно работает на рынке уже на протяжении шестидесяти пяти лет. Своё начало ОАО «Хитон» берёт с райпромкомбината, созданного в 1942 году, в которого входили пошивочные, сапожные, слесарные и другие мастерские, которые позднее были объединены в цеха. В 1946 году в райпромкомбинате создаётся химическое производство . а после восьми лет в нём осталось только химическое производство. В это время интенсивно начинает выпускаться масляная краска, олифа и лак. До 1993 года имя завода было изменено пять раз. На сегодняшний день он является крупнейшим производителем бытовой химии лакокрасочной продукции. История связано с братьями Крестовниками. В 1855 году было организовано московскими фабрикантами Крестовниками строительство стеариново-свечного цеха. С 1856 года основная продукция цеха – свечи и мыло – продавалось по всей России и даже в Гамбурге. С 1926 годов начинается производство с синтетических моющих средств. В настоящее время «Нэфис-Косметикс» имеет большое конкурентное преимущество перед другими производителями. Роль химических заводов в нынешнее время очень большая. Нам, к сожалению, приходиться сталкиваться и с положительными и отрицательными сторонами химической индустрии. Только в последние два-три года «Нэфис-Косметикс» уменьшило своё отрицательное влияние на экологию. И только сейчас мы уверенно сказать, что химия это и польза и продвижение в области инновации. Для страны это, несомненно, рост. И подытожив, я думаю, можно сказать, что химия занимает огромное место в жизни общества, и оно должно служить для блага, и сохранить то, что имеем, то, что дорого в наше время – природу.
С 1856 года основная продукция цеха – свечи и мыло – продавалось по всей России и даже в Гамбурге. С 1926 годов начинается производство с синтетических моющих средств. В настоящее время «Нэфис-Косметикс» имеет большое конкурентное преимущество перед другими производителями. Роль химических заводов в нынешнее время очень большая. Нам, к сожалению, приходиться сталкиваться и с положительными и отрицательными сторонами химической индустрии. Только в последние два-три года «Нэфис-Косметикс» уменьшило своё отрицательное влияние на экологию. И только сейчас мы уверенно сказать, что химия это и польза и продвижение в области инновации. Для страны это, несомненно, рост. И подытожив, я думаю, можно сказать, что химия занимает огромное место в жизни общества, и оно должно служить для блага, и сохранить то, что имеем, то, что дорого в наше время – природу.
Популярные темы сообщений
- Природа Самарского края
Самарский край расположен на реке Волга. Растительность самарской области поистине уникальна. Здесь находится много лесов. Очень распространен дуб. Леса из дуба занимают самую большую площадь среди всех лесов Самарского края.
Здесь находится много лесов. Очень распространен дуб. Леса из дуба занимают самую большую площадь среди всех лесов Самарского края. - Свирель — музыкальный инструмент
Несмотря на то, что свирель причисляется к древнерусским инструментам, ее аналоги существуют и у множества других народов. Потому, украинскую «сопилку» можно считать двоюродной сестрой ирландского тин-вистла. - Животные тропического леса
Каждая часть тропического леса переполнена жизнью. Кого здесь только не найдешь. Просторы тропического леса богаты на самых разнообразных насекомых, птиц и зверей. Люди привыкли называть тропиками те леса, которые растут около экватора.
Физика для чайников. Что происходит у нас на кухне с точки зрения науки | ОБЩЕСТВО
С какими физическими и химическими явлениями мы сталкиваемся практически каждый день, в специальной подборке «АиФ-НН».
Нагревание чайника
Явление: конвекция и теплопередача.
В основе нагревания воды в чайнике лежит физическое явление — конвекция. Теплота передаётся чайнику снизу, а вода — плохой проводник тепла. Именно благодаря конвекции энергия переносится струями жидкости, и вода нагревается по всему объёму.
Теплота передаётся чайнику снизу, а вода — плохой проводник тепла. Именно благодаря конвекции энергия переносится струями жидкости, и вода нагревается по всему объёму.
Закрываем чайник при кипении мы тоже не случайно. При открытой крышке часть молекул, имеющих большую кинетическую энергию, будет улетать, унося энергию, поэтому вода быстрее закипит, если крышку закрыть.
Присутствует в чайной церемонии и такое физическое явление, как теплопередача. Не зря ручки у самоваров всегда были деревянными — дерево не самый лучший проводник тепла. Как, впрочем, и пластмасса, из которой сегодня делают электрические чайники.
Хорошая хозяйка также знает, что, если положить в стакан металлическую ложку, та примет часть тепла, и температура воды станет ниже. Тепловое расширение внутренних стенок будет меньше, и деформация не окажется разрушительной для стакана. Хорошо охладит чай и металлический подстаканник, поскольку он сам быстро нагревается и забирает тепло.
Заваривание чая
Явление: диффузия.
А если бросить в кипяток крупинки чая или заварной пакетик, не размешивая, можно увидеть, как распространяется чайный настой в чистой воде. Происходит диффузия жидкостей. Конечно, все мы знаем, что чай надо заваривать кипятком. Оказывается, при высокой температуре диффузия в жидкостях происходит быстрее. Примером диффузии в твёрдом теле может быть консервация. Кристаллы соли в воде распадаются на ионы, которые, хаотически двигаясь, проникают между молекулами веществ в составе тех же овощей или грибов.
На кухне можно наблюдать и физическое явление диффузии газов. Благодаря ему, сидя в другой комнате, можно понять, что готовится. Диффузия в газах может быть крайне опасной, из-за этого явления можно отравиться угарным и другими ядовитыми газами.
Гашение соды уксусом
Явление: реакция нейтрализации.
Без этого явления не было бы у хозяек вкусной выпечки. Когда мы гасим соду в ложке уксуса, происходит химическая реакция нейтрализации. Её результат — углекислый газ. Он стремится покинуть тесто и изменяет его структуру, делая пористым и рыхлым.
Её результат — углекислый газ. Он стремится покинуть тесто и изменяет его структуру, делая пористым и рыхлым.
Правда, любой химик вам скажет: гасить соду вовсе не обязательно. При температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и всё тот же углекислый газ. Однако реакция будет проходить несколько хуже, чем при гашении соды, а значит, хуже может оказаться и вкус готовых изделий из теста.
Варка курицы и пельменей
Явление: гидростатика — закон Архимеда.
Приготовившись сварить курицу, мы наполняем кастрюлю водой примерно наполовину или на три четверти — в зависимости от размера курицы. Погружённая в кастрюлю курица заметно уменьшается в весе, а вода поднимается к краям кастрюли. Это явление объясняется выталкивающей силой, или законом Архимеда. В этом случае на тело, погружённое в жидкость, действует выталкивающая сила, равная весу жидкости в объёме погружённой части тела. Тот же принцип действует и при варке пельменей. Они вытеснят часть воды наверх ровно в том объёме, который занимают сами.
Собственно, свой закон Архимед придумал, занимаясь будничным делом — принимая ванну. Легенда гласит, что нагой Архимед бежал по улице и кричал «Эврика!» («Нашёл!»).
Проверка агрегатного состояния яиц
Явление: сохранение момента импульса.
Если раскрутить покрытое скорлупой варёное и сырое яйцо, то первое начнёт вращаться, а второе останется неподвижным. Всё потому, что внутри сырого яйца есть жидкость. Постоянно смещающийся внутри центр тяжести быстро замедляет вращение. У варёного же яйца центр тяжести остаётся в одной точке.
Добавляя при варке яиц соль, можно запустить химический процесс. Оказывается, именно в солёной воде белок «свёртывается» быстрее. Такая мгновенная реакция предотвращает яйца от растрескивания в кипятке.
Опускать яйца вариться именно в холодную воду тоже надо из научных соображений. Вещества, содержащиеся в яйце, при охлаждении сжимаются по-разному: белок уменьшается в объёме гораздо существеннее, чём скорлупа. Тогда мембрана, окружающая белок, отрывается от внутренней поверхности скорлупы и легко отходит.
Работа микроволновой печи
Явление: электромагнитное излучение.
Обычная микроволновая или СВЧ-печь с точки зрения физики носит устрашающее название — магнетрон. Это основной элемент каждой микроволновки, по сути, вакуумная лампа, которая создаёт СВЧ-излучение частотой 2,45 ГГц. Такое излучение необычно воздействует на обычную воду, которая содержится в любой пище, а также на молекулы жиров и сахара.
При облучении электромагнитными волнами эти молекулы начинают колебаться. Из-за этого между ними возникает трение, за счёт него выделяется тепло. Оно-то и разогревает пищу изнутри.
Расширим картину мира
Научный сотрудник Института прикладной физики РАН, популяризатор науки Артём Коржиманов, кандидат физико-математических наук:
«Конечно, окружающие нас бытовые приборы инженеры делают так, чтобы мы не разбирались особо, как это всё действует. Мы приходим в магазин, покупаем вещь, в случае поломки несем её в мастерскую. Но знание, как всё это устроено, в некотором смысле расширяет наши потребительские возможности — например, по управлению автомобилем, выбору марки машины. Если вы понимаете, как это работает, вы сможете более обоснованно и аргументированно сделать покупку. Это экономит время и деньги.
Знание, как вселенная устроена с точки зрения физических и химических явлений, расширяет картину мира, делает её более полной. Такая информация позволяет нам быть более мобильными в восприятии всего нового. Потом, просто понимая, что гроза — это электричество, можно обезопасить себя от неё».
Интересный факт
В быту мы часто сталкиваемся со статическим электричеством. Именно из-за него во все стороны торчат волосы после соприкосновения с пластиковой расчёской, «трещат» и липнут к телу синтетические вещи.
Если рассматривать эффект с физической точки зрения, то это самопроизвольно образующийся электрический заряд, возникающий из-за трения поверхностей друг о друга. Причиной тому — соприкосновение двух различных веществ самого диэлектрика. Атомы одного вещества отрывают электроны другого. После их разъединения каждое из тел сохраняет свой разряд, но при этом разность потенциалов растёт.
Электростатический разряд происходит при очень высоком напряжении и чрезвычайно низких токах. Они не дают статическому заряду нанести человеку вред после мгновенного разряда.
Статическое электричество отлично снимает обычная вода. Вода — хороший проводник и при небольшом начальном напряжении «принимает» весь заряд на себя.
Общая психопатология | Обучение | РОП
Ощущение — первая ступень познавательной деятельности. Ощущение дает информацию лишь об одном каком-либо свойстве (качестве) предмета или явления при их непосредственном воздействии на органы чувств (анализаторы). Например, ощущение может дать такие сведения о свойствах окружающих нас предметов и явлений, как горячий или холодный, тяжелый или легкий, яркий или темный, громкий или тихий и пр.
Ощущения условно можно разделить на:
- экстероцептивные (сигналы из внешнего мира; в соответствии с анализаторами: зрительные, слуховые, тактильные, обонятельные, вкусовые ощущения)
- проприоцептивные (сигналы о положении тела в пространстве)
- интероцептивные (сигналы от внутренних органов)
- модальность (качество; основная информация, отображаемая данным ощущением; например, вкусовые ощущения предоставляют информацию о некоторых химических характеристиках предмета: сладкий или кислый, горький или соленый; температурная чувствительность — о температуре и пр.)
- интенсивность (зависит от силы действующего раздражителя и функционального состояния рецептора, определяющего степень готовности рецептора выполнять свои функции; например, при насморке интенсивность воспринимаемых запахов может быть искажена из-за затруднений в работе рецепторов)
- длительность
- пространственная локализация
Синестезия («совместное чувство») — особенность чувственного познания, когда наряду со специфической для того или иного стимула модальностью ощущения возникают ощущения и других модальностей. Самый известный пример: цветной слух, т.е. способность вместе со звуками воспринимать определенные цвета. Сам по себе феномен синестезии не является патологией, считается, что он имеет важное значение для развития тонко дифференцированных процессов восприятия, особенно у музыкантов, художников, дегустаторов и пр.
Восприятие — психический процесс, позволяющий получить информацию о явлениях и предметах в целом, в совокупности их свойств, сформировать их целостный образ. Восприятие завершается узнаванием.
Восприятие — не просто сумма ощущений, а скорее процесс и результат их обработки. Оно включает систематизацию и интерпретацию информации, поступающей от органов чувств (в том числе на основе прошлого опыта, хранящегося в памяти — см. представление).
Восприятие является сложным процессом, в котором задействованы многие сферы психической деятельности человека: внимание (необходимо для отделения объекта от фона), память (узнавание основано на хранящейся в памяти информации), мышление (например, выделение и сопоставление наиболее важных признаков), моторная сфера (например, «ощупывающие» движения глаз при рассматривании предметов и пр.), эмоции (как будет видно далее, значительная часть симптомов нарушения чувственного познания связаны с определенными эмоциональными состояниями) и даже особенности личности [так, в некоторых направлениях психологии получили развитие теории о связи познания и особенностей темперамента, познавательных (когнитивных) «стилях» личности и т.д.].
Способность к восприятию не является врожденной, процессы восприятия проходят последовательные этапы развития у ребенка в первые годы его жизни. Он постепенно учится рассматривать и различать окружающие его объекты, вслушиваться в звуки, запоминает образы и их обозначения и т.д. При этом «обучение» сложным аспектам восприятия может происходить не только у детей, но и у взрослых на протяжении всей жизни (например, становление дифференцированного восприятия оттенков вкуса у вин, звучания тонов сердца при аускультации и пр.). Как мы увидим далее, таким же постепенным, как и становление процессов восприятия, может быть и их распад при патологии соответствующих центров коры (см. агнозии).
Можно выделить восприятие:
- предметов и явлений (предметное восприятие)
- пространства
- движения
- времени
Представление — процесс воспроизведения в памяти или воображении наглядных образов предметов или явлений, которые в данный момент не воздействуют на органы чувств (т.е. эти образы основаны на сохранившихся прошлых ощущениях и восприятиях).
Представлением называют как сам процесс, так и результат этого процесса, т.е. представляемый образ.
Каждый из нас может представить перед своим «мысленным взором» образ практически любого предмета или явления, с которым ему прежде приходилось часто встречаться, или пережить хотя бы однократную, но достаточно яркую и запоминающуюся встречу. Например, мы можем представить себе образ президента своей страны, машины любимой марки, самолета, представить звучание голоса известного актера и пр. В других случаях, задавшись соответствующей целью, мы можем вообразить себе какой-либо нереалистичный образ (например, человека со 100 руками), т.е. то, чего мы в жизни никогда не видели, однако комбинировать этот образ мы будем из того, с чем прежде встречались в жизни.
На самом деле способность представлять себе такие образы у разных людей выражена по-разному, у кого-то это получается лучше (обычно у художников, дизайнеров), у кого-то хуже.
Представляемые образы обычно нестойки, т.е. когда фокус нашего внимания смещается на что-то другое, они быстро распадаются. Проецируются эти образы в некое субъективное пространство, не связанное с реальным пространством, окружающим человека в текущий момент (т.е. мы можем представить себе что-то очень большое, например самолет, размер помещения, в котором при этом находимся, не имеет никакого значения, ибо представляемые образы никак не связаны с этим реальным пространством).
Образы представлений могут возникать произвольно (в соответствии с нашим волевым усилием) или непроизвольно (например, глядя на лимон, мы вместе с этим часто непроизвольно представляем его кислый вкус). К непроизвольным представлениям можно также отнести сновидения.
Поскольку представления возникают при отсутствии действующих на органы чувств объектов, они менее ярки, менее детальны, более фрагментарны, чем обычное восприятие реальных объектов. При этом представления более схематизированы и обобщены, чем восприятие, так как отражают наиболее характерные особенности, свойственные целому классу сходных объектов. Степень обобщенности в представлениях может быть различной. Так называемые единичные представления (например, образ своей матери) индивидуальны и конкретны, хотя и они содержат некую степень обобщения, поскольку являются суммированными образами многих восприятий конкретного объекта. Общие представления более абстрактны и объединяют в себе прежде воспринимавшиеся образы множества схожих предметов (например, образ матери в целом как обобщенный образ женщины, воспитывающей своих детей).
Представление является переходной ступенью от восприятия к абстрактно-логическому мышлению (т.е. к абстрактным понятиям). В отличие от понятий представления еще не содержат выделения внутренних, скрытых от непосредственного восприятия закономерных связей и отношений.
Можно представить себе такую условную последовательность этапов обработки информации, проходящей путь от процесса ощущения к мышлению:
- ощущение (например, веса наступившего вам на ногу попутчика в метро)
- восприятие (например, попутчика, с которым вы едете в метро, который только что наступил вам на ногу и которого вы теперь рассматриваете)
- представление (например, образ того попутчика в метро, который вчера наступил вам на ногу)
- понятие (например, о характеристиках попутчиков, которые обычно больно наступают на ноги в метро)
Нейробиология процессов ощущения, восприятия, представления
Первичная, субкортикальная обработка информации, поступающей от всех органов чувств (за исключением обоняния), происходит в таламусе (зрительном бугре). Дальнейшая обработка происходит в корковых центрах анализаторов — первичных (проекционных, проводящих оценку отдельных параметров объектов), вторичных (проводящих более сложный, комплексный анализ воспринимаемой информации) и третичных (ассоциативных, объединяющих информацию от разных анализаторов). Более того, обработка поступающей информации может проводиться на разных «уровнях» и в различных «направлениях».
Например, для зрительного восприятия: из первичных зрительных центров, расположенных в затылочных долях коры больших полушарий, для дальнейшей обработки информация идет в двух направлениях: дорсальном (в направлении задней части теменной доли коры) и вентральном (в направлении нижней части височной доли коры).
Дорсальный поток информации (канал «где?») необходим для оценки пространства, локализации в нем объекта, оценки его движения; эта информация определяет движения глаз, необходимые для целостного восприятия объекта.
Вентральный поток информации (канал «что?») связан с узнаванием объекта, предметным восприятием. При этом по мере «движения» информации от первичной зрительной коры (затылка) по вентральному потоку (к направлению полюса височной зоны) происходит все более дифференцированное восприятие предметов. В височной коре «хранятся» образы представлений всех предметов, на их основе и происходит узнавание. Локализация этого «хранения» семантически организована (по смысловым категориям, т.е. предметы, относящиеся к одной категории, хранятся рядом).
Эти нейрофизиологические особенности восприятия позволяют понять различные варианты патологии восприятия, например, различные варианты агнозии или галлюцинаций.Сколько химий на свете?
Н. Е. Аблесимов,
доктор химических наук
«Химия и жизнь» №5, 6, 2009
Химию можно определить как предмет занятий химиков.
Т. Л. Браун, Г. Ю. Лемей
В начале было слово — «ал хеми», или алхимия. Оно восходит к египетскому иероглифу «хми», означавшем черную (плодородную) землю. Этим же иероглифом обозначался и сам Египет, место, где, возможно, возникла алхимия, которую часто называли «египетским искусством». Впервые термин встречается в рукописи Юлия Фирмика (IV век н.э.). Ю. Либих писал про алхимию, что она «никогда не была ничем иным, как химией».
Следующим словом стало «ятрохимия» — направление в естествознании и медицине, появившееся в XVI веке. Оно отводило основную роль в возникновении болезней нарушениям химических процессов в организме и ставило задачу отыскания химических средств их лечения. Зарождение и развитие ятрохимии, получившей наибольшее распространение в Германии и Нидерландах, связано с деятельностью Парацельса (1493–1541), а также врача и анатома Ф. Боэ (1614–1672), сформулировавшего основные ее положения и открывшего при Лейденском университете первую химическую лабораторию для анализов. Представители ятрохимии уделяли внимание изучению процессов пищеварения, а также половых и других желез; различали «кислотные» и «щелочные» болезни. Ятрохимия во второй половине XVIII века перестала существовать как направление в медицине, но дала начало экспериментальной химии.
Большинство химиков XVI–XVIII веков имели медицинское образование и служили аптекарями. Далее, поскольку синтетической химии еще не существовало, вещества для лекарств добывали в естественном состоянии из минералов и растений, а для этого требовались методы анализа, разделения и очистки веществ. Развивается аналитическая химия. Затем военные интересы и запросы потребителей вызвали к жизни остальные разделы химии.
Сейчас химия состоит из пяти крупных разделов. Это аналитическая химия, неорганическая химия, органическая химия, биохимия, физическая химия и техническая химия. А далее они делятся, образуя сотню различных химий. Такое разнообразие заставляет задуматься над тем, что пришло время химии складывать, а не делить.
Академик Ю. А. Косыгин писал: «К концу XX века наука как бы разделилась на слои… Специалист часто замыкался в своем слое, увлекаясь в его пределах деталями… Это создавало узость научного мышления, забвение целостности мира, проблемы которого могут решаться только совместной работой в разных специальностях или их взаимопроникновением. Разделение на специальности создает атмосферу затхлости и беспомощности».
Таким образом, первая задача статьи состоит в показе абсурда такого деления применительно к химии. Разделы взяты из химических энциклопедий, обзоров, web-страниц вузов и НИИ, названий учебников и журналов. Вторая задача — ознакомление неофитов с многообразием химических решений житейских задач. И третья задача. Автору как профессионалу неприятно слышать на всех углах: «выращено без химии», «продукт не содержит химических веществ» и прочие странные лозунги. Куда же вы денетесь без химии!
Аналитическая химия — разработка методов определения химического состава вещества. Она возникла раньше других химических наук, и до конца XVIII века химию определяли как науку, изучающую химический состав веществ. Исторически это первая научная собственно химия.
Агрохимия — наука о химических процессах в почве и растениях, минеральном питании растений, применении удобрений и средств химической мелиорации почв. Включает определение содержания в почвах и растениях химических элементов, белков, аминокислот, витаминов, жиров, углеводов; установление механического и минералогического состава почв, содержания в них органической части (гумуса), солей, водорослей, микроорганизмов и др. Изучает влияние удобрений на растения и почву. Многие приемы агрохимии вошли в практику земледелия с глубокой древности. Благодаря созданию s новой отрасли агрохимии — химии ядохимикатов — появилась возможность не только улучшать питание растений, но и влиять (с помощью регуляторов роста) на их развитие, а также защищать от болезней, насекомых, клещей, нематод и других вредителей. Огромное влияние на агрохимию оказало открытие избирательных гербицидов. Уничтожение сорняков с их помощью позволило улучшить условия роста растений и более эффективно использовать удобрения, так как они не расходуются на подкормку сорняков.
Аналитическая химия элементов. Институт геохимии и аналитической химии РАН (ГЕОХИ, Москва) издает серию монографий, которых уже сейчас насчитывается свыше 50, а в идеале должно быть 109 — по числу известных химических элементов.
Астрохимия изучает химические реакции между атомами, молекулами и зернами пыли в межзвездной среде, включая фазы образования звезд и планет. Синтез гелия можно считать началом всех реакций в природе, первопричиной жизни, света, тепла и метеорологических явлений на Земле. Рождение химических элементов — функция звезд. До железа включительно они рождаются в термоядерных процессах синтеза ядер в недрах бесчисленных солнц. Начиная с кобальта и далее – создаются при взрывах сверхновых через нейтроноизбыточные ядра с последующей серией бета-распадов. Радиоастрономы показали, что темные межзвездные облака содержат многие сложные молекулы (метанол, окись углерода, формальдегид, этанол, синильную кислоту, муравьиную кислоту и другие). Молекулярная радиоастрономия позволила идентифицировать все эти молекулы по их вращательным спектрам в микроволновой области.
Бионеорганическая химия изучает комплексы биополимеров или низкомолекулярных природных веществ с ионами металлов, присутствующих в живых организмах (Na+, K+, Ca2+, Mg2+, Fe2+). Исследует роль этих ионов в выполнении биологических функций ферментов. Практическое применение связано с синтезом металлосодержащих лекарственных препаратов.
Биоорганическая химия изучает связь между строением органических веществ и их биологическими функциями. Объекты исследований: биополимеры, витамины, гормоны, антибиотики и другие. Сформировалась на стыке биохимии и органической химии. Биоорганическая химия связана с практическими задачами медицины, сельского хозяйства, химической, пищевой и микробиологической промышленности.
Биохимия изучает входящие в состав организмов химические вещества, их структуру, распределение, превращения и функции. Казалось бы, эта наука должна быть разделом органической химии, однако многочисленные разветвления биохимии превратили ее в отдельное направление. Первый синтез природного вещества мочевины в 1828 году разрушил представление о «жизненной силе», участвующей в образовании веществ организмом. Внедрение в биологию идей и методов физики и химии, а равно стремление объяснить строением и свойствами биополимеров такие биологические явления, как наследственность, изменчивость или мышечное сокращение, привело в середине XX века к выделению из биохимии молекулярной биологии. Потребности народного хозяйства в получении, хранении и обработке различных видов сырья привели к развитию технической биохимии. В конце XX и начале XXI века биохимия стала ведущим химическим направлением, во всяком случае, большинство Нобелевских премий по химии присуждают именно за биохимические работы.
Галургия — раздел химической технологии по производству минеральных солей. К галургии в узком смысле относят переработку природных солей. Сырьем для галургического производства служат морская вода, отложения морских солей, а также озерные и подземные рассолы. Прикладные задачи — проектирование калийных, соляных и сульфатных предприятий; проектирование предприятий по добыче и переработке горно-химического сырья: сульфата натрия, фосфоритного, магнийсодержащего сырья и других природных солей.
Геохимия изучает химический состав Земли, распространенность в ней химических элементов и их стабильных изотопов, закономерности распределения химических элементов в различных геосферах, законы поведения, сочетания и миграции элементов в природных процессах. Геохимия исторически сформировалась как химия элементов в геосферах и во многом продолжает оставаться таковой. Это было оправданно во времена Ферсмана и Вернадского. Но свойства веществ – это свойства фаз. Один и тот же элемент может находиться в составе различных фаз и сам образовывать множество фаз с очень разными свойствами (вспомним хотя бы фазы углерода). В XX веке появились методы анализа фаз. Поэтому дальнейшее развитие геохимии — это химия фаз в геосферах. Валовой элементный анализ геологических проб должен подкрепляться фазовым анализом. Иначе наблюдается ничем сейчас не оправданный перескок через структурный уровень организации вещества: от химического элемента, минуя минеральную фазу, к породе и геологическому телу.
Гидрохимия изучает химический состав природных вод и закономерности его изменения под влиянием физических, химических и биологических воздействий. Задача — установление химического состава основных элементов экосистем океанов и морей, процессов их биогеохимической трансформации и эволюции.
Гистохимия — раздел гистологии, изучающий локализацию различных химических веществ и продуктов их метаболизма в тканях. Некоторые методы окрашивания позволяют выявлять в клетках те или иные химические вещества. Возможно дифференциальное окрашивание жиров, гликогена, нуклеиновых кислот, нуклеопротеинов, некоторых ферментов и других химических компонентов клетки. Вклад гистохимии в изучение химического состава тканей постоянно возрастает. Подобраны красители, флуорохромы и ферменты, которые можно присоединить к специфическим иммуноглобулинам (антителам) и, наблюдая связывание этого комплекса в клетке, идентифицировать клеточные структуры. Эта область исследований составляет предмет иммуногистохимии. Использование иммунологических маркеров в световой и электронной микроскопии способствует расширению знаний о биологии клетки, а также повышению точности медицинских диагнозов.
Иммунохимия изучает химические основы иммунитета. Основные проблемы: строение и свойств иммунных белков — антител, природных и синтетических антигенов, а также выявление закономерностей взаимодействия между этими главными компонентами иммунологических реакций у разных организмов. Методами иммунохимии пользуются также в прикладных целях, в частности при выделении и очистке активных начал вакцин и сывороток.
Квантовая химия. Это направление химии на основе квантовой механики рассматривает строение и свойства химических соединений, реакционную способность, кинетику и механизмы химических реакций. Из-за сложности объектов применяют приближенные методы расчета. С квантовой химией неразрывно связана компьютерная химия — дисциплина использующая математические методы для расчета молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, моделирование молекулярного поведения.
Коллоидная химия — наука о дисперсных системах и поверхностных явлениях. Отсюда берет начало популярная нынче нанотехнология. Коллоидные системы – это и человек и холодец. Поскольку у частиц дисперсной фазы и окружающей их среды большая поверхность раздела, поверхностные явления оказывают определяющее влияние на свойства системы в целом. Цель исследований – управление образованием, свойствами и разрушением дисперсных систем и граничных слоев за счет регулирования межмолекулярных взаимодействий на границах раздела фаз. Этого добиваются с помощью поверхностно-активных веществ, способных самопроизвольно концентрироваться на поверхности частиц дисперсной фазы.
Компьютерная химия — см. квантовая химия.
Косметическая химия. Ее предмет – средства и методы улучшения внешности человека. Различают врачебную и декоративную косметику. Известно выражение «кожа — это самый большой орган», и нельзя не задумываться о том, как он функционирует, как действуют вещества, которые мы наносим на его поверхность, к каким последствиям приведет то или иное воздействие. Ответы на эти вопросы ищет косметическая химия.
Космохимия — наука о химическом составе космических тел, законах распространенности и распределения химических элементов во Вселенной, процессах сочетания и миграции атомов при образовании космического вещества. Космохимия исследует преимущественно «холодные» процессы на уровне атомно-молекулярных взаимодействий веществ, в то время как «горячими» ядерными процессами в космосе – плазменным состоянием вещества, нуклеогенезом (процессом образования химических элементов) внутри звезд — занимается физика. Развитие космонавтики открыло перед космохимией новые возможности. Это непосредственное исследование пород Луны при участии космонавтов или в результате забора образцов грунта автоматическими аппаратами и доставки их на Землю. Автоматические спускаемые аппараты сделали возможным изучение вещества и условий его существования в атмосфере и на поверхности других планет Солнечной системы и астероидов, в кометах. Благодаря экстремальным условиям в космическом пространстве протекают процессы и встречаются состояния вещества, несвойственные Земле. В межзвездном пространстве обнаруживаются в крайне малых концентрациях атомы и молекулы многих элементов, а также минералы (кварц, силикаты, графит и другие) и, наконец, идет синтез различных сложных органических соединений из первичных солнечных газов H, CO, NH3, O2, N2, S и других простых соединений в равновесных условиях при участии излучений.
Криохимия изучает химические превращения веществ при низких температурах. Основные задачи — получение соединений, химически неустойчивых при нормальных условиях, выяснение нижних температурных границ химической активности веществ, разработка технологических процессов с использованием низких температур. Продукты криотехнологий — химические реактивы, ферменты, сорбенты, лекарственные вещества, резисторы, композиты, пигменты, катализаторы, электродные и пьезоматериалы, пористая керамика, порошки для стекловарения и выращивания монокристаллов.
Кристаллохимия изучает законы расположения атомов и типы симметрии в кристаллических телах, а также дефекты в их структуре. Центральное понятие кристаллохимии — кристаллическая структура. Определено свыше 120 000 кристаллических структур (около 40 000 неорганических, более 80 000 органических) — от простых веществ до белков и вирусов. Источником данных о структурах служат дифракционные методы исследования: рентгеноструктурный анализ, электронография, нейтронография, мессбауэрография. Причины образования той или иной кристаллической структуры определяются общим принципом термодинамики: наиболее устойчива структура, которая при данных давлении и температуре имеет минимальную свободную энергию. Обнаруженные Е. С. Федоровым 230 пространственных групп симметрии представляют собой естественный закон природы, не имеющий математического выражения (наряду с Периодической системой Д. И. Менделеева).
Лазерная химия изучает химические процессы, стимулируемые лазерным излучением. Высокая монохроматичность лазерного излучения позволяет селективно возбуждать молекулы одного вида, причем молекулы других видов остаются невозбужденными. Возможность фокусировки лазерного излучения позволяет вводить энергию локально, в определенную область объема, занимаемого реагирующей смесью. Лазерное воздействие на химические реакции может быть тепловым и фотохимическим. Лазерная офтальмология и микрохирургия — в конечном счете та же лазерная химия, но на службе у медицины.
Лесохимия изучает химические свойства древесины и способы ее промышленной переработки, чтобы извлечь как можно больше полезных веществ. Целлюлозно-бумажное производство занимает первое место по объемам перерабатываемого сырья и готовой продукции в лесной промышленности. Оно потребляет балансовую и дровяную древесину (80%), отходы лесозаготовок и деревообработки (щепа, опилки — 20%) для выработки целлюлозы, древесной массы и получения из них бумаги, картона. Нитрованием целлюлозы концентрированной азотной кислотой в присутствии концентрированной серной кислоты получают тринитроцеллюлозу, называемую пироксилином, которую применяют в производстве бездымного пороха, поэтому рядом с целлюлозно-бумажным комбинатом следует искать завод боеприпасов. Гидролизные производства в качестве сырья используют отходы лесопиления и деревообработки. Первоначально гидролизу подвергали хвойную древесину, получая 160–180 л этанола в расчете на 1 т абсолютно сухого сырья (в дальнейшем стали производить также дополнительно 35–40 кг кормовых дрожжей из послеспиртовой барды). Затем появились предприятия фурфурольно-дрожжевого профиля (70–80 кг фурфурола и 100 кг дрожжей в расчете на 1 т сухих растительных отходов) и чисто дрожжевого профиля. Отходы этого производства – гидролизный лигнин (30–40% в расчете на абсолютно сухое сырье), который применяют как котельное топливо, а также для получения углей различного назначения, удобрений, уксусной и щавелевой кислот, фенолов, наполнителей для полимерных материалов. Однако чаще всего этот лигнин остается в виде никому не нужных отвалов. Существует и дубильно-экстрактовое производство — источник дубящих веществ. Для их выработки применяют кору ивы, ели, лиственницы, листья бадана, древесину дуба или каштана. Из смолы получают также канифоль. Еще одно направление — пиролизное производство, получение древесного угля из древесины нагреванием ее без доступа воздуха в специальных стальных ретортах и печах.
Магнетохимия изучает связь магнитных и химических свойств веществ, влияние магнитных полей на химические процессы. Спиновая химия как раздел магнетохимии уникальна: она вводит в химию магнитные взаимодействия. Будучи пренебрежимо малыми по энергии, магнитные взаимодействия контролируют химическую реакционную способность и пишут новый, магнитный «сценарий» реакции. Получение молекулярных магнетиков, многоспиновых молекул, содержащих неспаренные электроны, спиновых меток тоже можно отнести к спиновой химии.
Медицинская химия включает в себя аспекты биологии, медицины, фармацевтики. Она занимается обнаружением, дизайном, идентификацией и получением биологически активных соединений, изучением их метаболизма, интерпретацией способа действия на молекулярном уровне и созданием зависимостей «структура – активность». Таким образом, начав с медицины в XVI веке, химия в нее возвращается, несмотря на некоторый скептицизм медиков. Достаточно сказать, что 70% лекарственных препаратов — продукты синтетической химии, а остальные 30% — фитохимии.
Металлургия — область науки и техники, охватывающая процессы получения металлов из руд или других веществ, изменения химического состава, структуры и свойств металлических сплавов. Металлургические процессы применяют и для производства неметаллических материалов, в том числе полупроводников. Различают пирометаллургию (использование процессов, проходящих при высокой температуре), гидрометаллургию (извлечение металлов химическими реакциями в водных растворах) и электрометаллургию (применение электролиза).
Механохимия изучает химические превращения веществ при деформировании, трении, ударном сжатии. Пластическая деформация твердого тела обычно приводит к накоплению в нем дефектов, изменяющих физико-химические свойства, в том числе реакционную способность. Это используют в химии для ускорения реакций, снижения температуры процессов и других путей интенсификации химических реакций в твердой фазе. Механохимическим методом проводят деструкцию полимеров, синтез интерметаллидов и ферритов, получают аморфные сплавы, активируют порошковые материалы.
Нанохимия – химия и технология объектов, размеры которых порядка 10–9 м (кластеры атомов, макромолекулы). Когда речь идет о развитии нанотехнологий, имеют в виду три направления: изготовление электронных схем (в том числе и объемных), элементы которых по размерам сравнимы с атомами; разработка и изготовление наномашин; манипуляция отдельными атомами и молекулами и сборка из них макрообъектов. Место нанохимии в нанотехнологиях – синтез нанодисперсных веществ и материалов, регулирование химических превращений тел нанометрового размера, предотвращение химической деградации наноструктур, способы лечения болезней с использованием наночастиц.
Нейрохимия — раздел биохимии, изучающий химические и клеточные механизмы деятельности нервной системы. Нейрохимия подразделяется на общую, изучающую химические свойства нервной системы вне связи с конкретной физиологической деятельностью, и функциональную (частную), изучающую химические и молекулярные механизмы деятельности нервной системы в процессе реализации той или иной физиологической функции. Познание химических механизмов деятельности мозга не просто одна из задач биологии, оно играет важную роль в стремлении человека к осознанию самого себя как личности, к пониманию своего места на Земле. Поэтому нейрохимия — одна из самых сложных, современных и бурно развивающихся областей биохимии и нейробиологии. Она тесно связана с такими направлениями биологии, как морфология и физиология нервной системы, молекулярная биология и генетика, а также с клиническими дисциплинами, в частности с нейропатологией и психиатрией.
Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений углерода). Обеспечивает создание материалов новейшей техники. Число неорганических веществ приближается к 400 тысячам.
Органическая химия изучает соединения углерода с другими элементами — так называемые органические соединения и законы их превращений. К концу XX века их число превысило 10 млн. Синтез многочисленных органических веществ привел к созданию новых отраслей промышленности — синтетических красителей, полимеров, искусственного жидкого топлива и пищи. Удалось синтезировать витамины, гормоны, ферменты. Многообразие органических соединений во многом обусловлено изомерией – способностью соединений при одинаковом составе и массе различаться строением, физическими и химическими свойствами. Органическая химия делится на огромное число направлений.
Нефтехимия изучает состав, свойства и химические превращения компонентов нефти и природного газа, а также процессы их переработки.
Органическая геохимия изучает химический и изотопный состав органических веществ, заключенных в горных породах, их эволюцию в ходе геологической истории, закономерности распределения, а также роль органического вещества в процессах миграции химических элементов в земной коре, формировании месторождений урана, меди, ванадия, германия, молибдена. Этот раздел химии изучает исходные для органического вещества биохимические соединения (углеводы, белки, лигнин) и продукты их преобразования во внешних геосферах (гумус, сапропель, ископаемые угли, горючие сланцы, нефть) под влиянием бактериальной жизни, температуры, давления и других факторов. Геохимия нефти и угля разделилась на два самостоятельных научных направления. Органическая геохимия близко соприкасается с органической космохимией в части исследования органического вещества космических тел.
Органический синтез изучает пути и методы искусственного создания органических соединений. В 1828 году Ф. Вёлер впервые синтезировал органическое вещество из неорганического вне живого организма – провел перегруппировку цианата аммония в мочевину при нагревании в водном растворе. Цели оргсинтеза – получение веществ с ценными физическими, химическими и биологическими свойствами или проверка предсказаний теории. Современный органический синтез многогранен и позволяет получать практически любые органические молекулы.
Патохимия изучает химические механизмы патологических процессов. Например, проблема отторжения органов при пересадке — во многом проблема патохимии.
Петрохимия изучает распределение химических элементов в горных породах и породообразующих минералах.
Петрургия — производство стеклокристаллических материалов и изделий из расплавов горных пород (например, базальтов и диабазов) и промышленных отходов (например, шлака и золы) методом литья. Петрургические материалы предпочтительнее металлургических, так как устойчивы в окислительной атмосфере Земли и предполагают прямое использование сырья без выделения чистых компонентов. Петрургическое производство вырабатывает трубы, плиты, лотки для защиты рабочих поверхностей бункеров, желобов, узлов горно-обогатительного, металлургического и энергетического оборудования; кислотоупорные плитки и фасонные детали для химической промышленности; футеровку шаровых мельниц, облицовочные материалы и другие изделия, работающие в условиях воздействия кислот, щелочей или абразивных сыпучих материалов и пульп, а также базальтовое (каменное) волокно.
Пегниохимия. Химики тоже шутят, а что остается делать, если в лаборатории горячее и холодное стекло выглядят одинаково! Социологи провели опрос населения. Всем респондентам задавали два вопроса: 1) как вы относитесь к химическим удобрениям? 2) какая у вас в школе оценка по химии? Оказалось: 1) 90% россиян категорически против химических удобрений; 2) остальные 10% имели по химии оценку «5». Институт пегниохимии РАН, может быть, и появится, когда мы поймем единство природы и тупик бесконечного деления знания, и посмеемся над искусством разделять и не властвовать.
К области пегниохимии, несомненно, принадлежит и химический фольклор.
Крутит и вертит мешалку мотор.
В колбе трехгорлой бордовый раствор.
Варится, киснет ацетофенон.
Скоро дойдет до кондиции он.
Только я начал бензол отгонять –
Колба рванула… Кусков не собрать.
Вспыхнул бензол, загорелся халат.
Что-то заметил сосед невпопад.
Пищевая химия. Ее цель — создание качественных продуктов питания и методов анализа в химии пищевых производств. Это один из самых древних экспериментальных разделов химии со времен появления дрожжевого хлеба. Химия пищевых добавок контролирует их ввод в продукты питания для улучшения технологии производства, а также структуры и органолептические свойства продуктов, увеличение сроков хранения, повышение биологической ценности. К числу таких добавок принадлежат консерванты, антиоксиданты, окислители, эмульгаторы, стабилизаторы, красители, вкусовые вещества и ароматизаторы, интенсификаторы вкуса и запаха, витамины, микроэлементы, аминокислоты, пряности. Создание искусственной пищи — тоже предмет пищевой химии. Это продукты, которые делают из белков, аминокислот, липидов и углеводов, предварительно выделенных из природного сырья или полученных направленным синтезом из минерального сырья. Пищевые добавки, а также витамины, минеральные кислоты, микроэлементы и прочие вещества придают конечному продукту не только питательность, но и цвет, запах и нужную структуру. В качестве исходных компонентов используют вторичное сырье мясной и молочной промышленности, семена, зеленую массу растений, гидробионты, биомассу микроорганизмов, например дрожжей. Из них выделяют высокомолекулярные вещества (белки, полисахариды) и низкомолекулярные (липиды, сахара, аминокислоты и другие). Низкомолекулярные пищевые вещества получают также микробиологическим синтезом из сахарозы, уксусной кислоты, метанола, углеводородов, ферментативным синтезом из предшественников и органическим синтезом (включая асимметрический синтез для оптически активных соединений). Различают синтетическую пищу, получаемую из синтезируемых веществ, например диеты для лечебного питания, комбинированные продукты из натуральных продуктов с искусственными пищевыми добавками, такие, как колбасно-сосисочные изделия, фарш, паштеты, и аналоги пищевых продуктов, имитирующие какие-либо натуральные продукты, — скажем, черную икру.
Плазмохимия изучает химические процессы в низкотемпературной плазме. Низкотемпературной принято считать плазму с температурой 103–105 К и степенью ионизации 10–6–10–1 получаемую в электродуговых, высокочастотных и СВЧ газовых разрядах, в ударных трубах, установках адиабатического сжатия и другими способами. В плазмохимии важно разделение низкотемпературной плазмы на квазиравновесную, которая существует при давлениях порядка атмосферного и выше, и неравновесную, которая получается при давлении менее 30 кПа и в которой температура свободных электронов значительно превышает температуру молекул и ионов. Это разделение связано с тем, что кинетические закономерности квазиравновесных процессов определяются только высокой температурой взаимодействующих частиц, тогда как специфика неравновесных процессов обусловлена большим вкладом химических реакций, инициируемых «горячими» электронами. Примером плазмохимической технологии служит: синтез ацетилена из природного газа (электродуговая печь, 1600°С): 2CH4 = С2Н2 + ЗН2.
Прикладная химия. За этим нейтральным словом скрывается самая зловещая химия — химия для войны. Обслуживает в основном нужды военно-промышленного комплекса.
Радиохимия изучает поведение радиоактивных элементов, методы их выделения и концентрирования. Это научная основа получения высокоактивных материалов и регенерации ядерного горючего, разработки методов применения радионуклидов.
Радиационная химия — см. химия высоких энергий.
Сонохимия изучает химические реакции при воздействии ультразвука; это разновидность механохимии, проявляющаяся в жидкости: упругими волнами воздействуют на вещества, чтобы изменить их структуру и свойства. Главный инструмент сонохимии — кавитация, образование в жидкой среде массы пульсирующих пузырьков. Давление в них возрастает до 800 МПа, температура (по теоретическим оценкам) — до 7400 К, образуются электрические разряды, проходит ионизация, возникает явление сонолюминисценции — звук превращается в свет. Оценки показывают, что при сонолюминесценции происходит концентрация энергии в триллион раз, то есть на 12 порядков! Отсюда берет начало одна из заманчивых возможностей ультразвука в жидкости — «пузырьковый термояд».
Спиновая химия — см. магнетохимия.
Стереохимия изучает пространственное строение молекул и его влияние либо на химические свойства (статическая стереохимия), либо на скорость и направление реакций (динамическая стереохимия).
Судебная химия — часть прикладной, преимущественно аналитической химии в широком смысле слова. Это почти необъятная область по изобилию и разнообразию решаемых ею задач, ибо всякое химическое исследование, в сущности, может быть способом судебно-химической экспертизы. Она включает в себя исследование воздуха, воды, почвы, пищевых и вкусовых припасов, предметов потребления, человеческих секретов и экскретов, подозрительных кровяных и семенных пятен, различных технических препаратов, рукописных и напечатанных документов, сырых и обработанных лекарственных веществ. Но и при узком толковании, когда под судебной химией подразумевают ту часть аналитической химии, которая специально занимается открытием ядов при умышленных и неумышленных отравлениях, область судебной химии остается весьма обширной, так как само понятие «яд» представляется чрезвычайно растяжимым. Очевидна связь судебной химии не только с токсикологией и фармакологией, но и с терапией и физиологией. Для окончательного решения вопросов, возникающих при судебно-химических исследованиях о предполагаемых отравлениях, нельзя ограничиваться указаниями на присутствие или отсутствие тех или других ядов, но необходимо установить или исключить зависимость или даже причинную связь между найденным ядом и результатами, подмеченными при вскрытии трупа, выяснить — поскольку результаты могут обусловливаться изменениями, наступившими после смерти; необходимо, наконец, решить крайне важный вопрос о том, может ли обнаруженный яд или выделенное ядовитое вещество вызывать именно те симптомы, что наблюдали при жизни. Здесь врач и химик дополняют друг друга.
Супрамолекулярная химия означает химию, описывающую сложные образования, которые представляют собой результат ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами. Ее главные объекты — супрамолекулярные устройства и ансамбли. Устройства — это структурно организованные системы, молекулярные компоненты которых обладают определенными электро-, ионо-, фото-, термохимическими и другими свойствами. Клатратная химия — самая передовая часть супрамолекулярной химии.
Термохимия изучает тепловые явления, сопровождающие химические реакции. Термохимические данные (значения теплоты образования и сгорания химических соединений, тепловых эффектов реакций) используют в химической технологии, при расчетах тепловых балансов процессов. Они же служат расчетной основой химической термодинамики.
Техническая химия. Сюда можно отнести текстильную химию, химию обработки материалов, химию стекла (а это оптическая промышленность — «глаза» микроскопистов, военных и астрономов), химические аспекты экономики. Элементы технической химии можно найти в XV—XVII веках. В середине XV века была разработана технология воздуходувных горнов. Нужды военной промышленности стимулировали работы по улучшению технологии производства пороха. Выходили фундаментальные труды по производству металлов и различных материалов, используемых в строительстве, при изготовлении стекла, крашении тканей, для сохранения пищевых продуктов, выделки кож. С расширением потребления спиртных напитков совершенствовались методы перегонки, конструировались новые перегонные аппараты. Появились многочисленные производственные лаборатории, прежде всего металлургические. Среди химиков-технологов того времени можно упомянуть Ван-ноччо Бирингуччо (1480–1539), чей классический труд «О пиротехнике» был напечатан в Венеции в 1540 году и содержал десять книг. В них шла речь о рудниках, испытании минералов, приготовлении металлов, перегонке, военном искусстве и фейерверках. Другой известный трактат, «О горном деле и металлургии», написал Георг Агрикола (1494–1555).
Топохимия изучает твердофазные реакции, протекающие в определенных участках твердого тела. Путь топохимии проходит от обжига минерального сырья до молекулярно-лучевой эпитаксии (ориентированного роста одного кристалла на поверхности другого), которую активно применяют в микроэлектронике. Ориентированный рост кристалла внутри объема другого называют эндотаксией. Эндотаксия наблюдается, например, при кристаллизации, коррозии.
Углехимия изучает происхождение, состав, строение, свойства твердых горючих ископаемых, а также методы их переработки. Основная задача углехимии — разработка технологий получения из угля, продуктов его переработки и другого углеродсодержащего сырья новых углеродных материалов и адсорбентов.
Фармакохимия (фармацея) изучает приготовление лекарственных веществ, действующих на организм человека и животных. Проверка их безопасности тоже входит в число задач фармакохимии. Из 400 химических соединений, предлагаемых в качестве лекарств, после испытаний принимается только одно!
Фемтохимия — возможность наблюдать за протеканием элементарных химических реакций в фемтосекундном временном диапазоне (10–15–10–12 с). Эти времена гораздо меньше периода колебаний атомов в молекулах (10–13–10–11 с). Благодаря такому соотношению времен фемтохимия «видит» саму химическую реакцию — как перемещаются во времени и в пространстве атомы, когда молекулы-реагенты преобразуются в молекулы продуктов. Это прямой путь исследования механизмов химических реакций, а значит, и способ управления реакциями. Успехи, достигнутые при использовании фемтосекундных импульсов, привели к открытию другой науки — фемтобиологии.
Физическая химия — наука об общих законах, определяющих строение и химические превращения веществ при изменяющихся внешних условиях. Говорят, что химики работают чистыми методами с грязными веществами, физики — грязными методами с чистыми веществами, ну а физические химики — грязными методами с грязными веществами, то есть исследуют химические явления физическими методами. Вначале это было весовой и объемный анализы, ощущение вкуса и запаха, измерение тепла и цвета. Потом пришли Р. В. Бунзен и Г. Кирхгоф со спектральным анализом, и пошло-поехало. Достижением на рубеже веков стало осознание того факта, что мир веществ скорее неравновесен, чем равновесен. Кроме того, в физхимии сплошь и рядом нарушаются законы арифметики. Вот типичный пример: 50 мл H2O + 50 мл C2H5OH = 96 мл водки + тепло.
Физическая органическая химия уделяет особое внимание исследованию механизмов органических реакций, а также количественной взаимосвязи между химическим строением органических соединений, их свойствами и реакционной способностью. Одно из достижений — открытие и доведение до практического использования стабильных радикалов, которые нашли применение в различных областях науки и техники в качестве спиновых меток, у которых неспаренный электрон служит источником сигнала электронного парамагнитного резонанса, ЭПР.
Фитохимия. Ее забота — создание высокоэффективных лекарственных препаратов на основе веществ растительного происхождения. Другое направление — экологически чистые средства защиты растений. Путь лекарства начинается в лаборатории либо химика-органика, либо фитохимика. Первый создает пока еще не исследованные соединения, второй выделяет вещества из растений. Затем созданные или выделенные вещества передают фармакологу. Он определяет, обладают ли эти вещества нужным эффектом. Чтобы найти активное соединение, применяют два метода. Первый — скрининг, то есть просеивание — перебор имеющихся веществ без предположения о том, с какой именно структурой нужно вещество. Впервые скрининг применил в начале XX столетия П. Эрлих для получения противосифилитических средств на основе органических соединений мышьяка. Второй — направленный синтез: исследователь постепенно накапливает материал, показывающий, какие химические радикалы или иные структуры ответственны за тот или иной вид действия. Природные молекулы растительного происхождения служат моделями для синтеза полезных соединений. Пример такого соединения — салициловая кислота, выделенная из коры ивы. На ее основе было создано такое популярное лекарство, как аспирин (ацетилсалициловая кислота). В настоящее время, несмотря на огромные успехи химиков-синтетиков, из растений получают более трети лекарственных препаратов. Структура многих из них настолько сложна (винбластин, сердечные гликозиды, кокаин, резерпин, хинин, колхицин, пилокарпин), что растения еще долго будут их единственным источником.
Фотохимия изучает реакции, возбуждаемые светом. Практическая фотохимия — фотография, изготовление печатных форм и микросхем методами фотолитографии, фотохимический синтез (например, капролактама). Самый значимый для Земли природный фотохимический процесс — фотосинтез, превращение зелеными растениями и фотосинтезирующими микроорганизмами энергии солнечного света в энергию химических связей органических веществ.
Химическая технология — это наука о методах и средствах рациональной химической переработки сырья, полуфабрикатов и промышленных отходов. Неорганическая химическая технология включает переработку минерального сырья (кроме металлических руд), получение кислот, щелочей, минеральных удобрений. Органическая химическая технология — переработку нефти, угля, природного газа и других горючих ископаемых, получение синтетических полимеров, красителей, лекарственных средств и других веществ.
Химическая физика изучает электронную структуру молекул и твердых тел, молекулярные спектры, элементарные акты химических реакций, процессы горения и взрыва. Сформировалась в 20-х годах XX века в связи с развитием квантовой механики и использованием ее представлений в химии. Граница между химической физикой и физической химией условна, а термин ввел немецкий химик А. Эйкен в 1930 году. Одно из достижений химической физики — теория разветвленных цепных реакций.
Химическое вооружение — боевые отравляющие вещества, средства их применения (ракеты, снаряды, мины, авиационные бомбы и прочие), нейтрализации и защиты. Применение химического оружия запрещено Женевским протоколом 1925 года, который ратифицировали свыше 100 государств. Однако его разработка, производство и накопление в некоторых странах продолжаются до сих пор.
Химия высоких энергий изучает химические реакции и превращения, происходящие в веществе под воздействием нетепловой энергии. Носители нетепловой энергии, воздействующей на вещество, — ускоренные электроны и ионы, быстрые и медленные нейтроны, альфа- и бета-частицы, позитроны, мюоны, пионы, атомы и молекулы при сверхзвуковых скоростях, кванты электромагнитного излучения, а также импульсные электрические, магнитные и акустические поля. Процессы химии высоких энергий различают по временным стадиям на физические, протекающие за фемтосекунды и менее, причем в течение этого времени нетепловая энергия распределяется в среде неравномерно и образуется «горячее пятно», физико-химические, в течение которых проявляются неравновесность и негомогенность в «горячем пятне», и, наконец, химические, в которых превращения вещества подчиняются законам общей химии. В результате образуются такие ионы и возбужденные состояния атомов и молекул, которые при комнатной температуре не могут возникнуть за счет равновесных процессов.
Химия высокомолекулярных соединений — раздел органической химии, объектами исследования которой служат макромолекулы синтетического и природного происхождения, состоящие из повторяющихся мономерных звеньев или молекулярных группировок, соединенных химическими связями и содержащих в главной цепи атомы углерода, а также кислорода, азота и серы. На основе высокомолекулярных соединений (полимеров) разрабатываются многочисленные материалы, в том числе интеллектуальные структуры, с функциональными ингредиентами, что существенно расширяет область их применения. Самая простая макромолекула — это полиэтилен:
…—CH2—CH2—CH2—CH2—CH2—CH2—CH2—…
Химия катализа изучает вещества, изменяющие скорость химических реакций. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Несмотря на появление новых способов активации молекул (плазмохимия, радиационное и лазерное воздействия и другие), катализ — основа химических производств (относительная доля каталитических процессов составляет 80–90%).
«Химия», на которую можно отправить. В 1963 году ЦК КПСС принял курс на химизацию народного хозяйства. Стал популярным лозунг: «Коммунизм есть советская власть плюс электрификация всей страны, плюс химизация народного хозяйства». На фронте химизации ударный корпус составили условно-досрочно освобожденные заключенные. В этой связи в народе называли «химией» условно-досрочное освобождение, условное осуждение с обязательным привлечением к труду. Включает этапирование в спецкомендатуру, где заключенный обязан проживать в спецобщежитии и работать на указанном предприятии. Новый гуманный Уголовный кодекс предусматривает альтернативные виды наказания за незначительные преступления: штрафы, общественные работы по месту жительства.
Химия силикатов — солей кремниевых кислот. Роль катионов в силикатах играют элементы второго, третьего и четвертого периодов таблицы Д. И. Менделеева. В природе силикаты представлены в виде минералов, входят в состав большинства горных пород, слагающих основную часть земной коры. Тесно примыкает керамика, изделия и материалы, получаемые спеканием глин и их смесей с минеральными добавками, а также оксидов и других неорганических соединений.
Химия природных соединений изучает методы получения, строение и свойства природных биоорганических соединений класса углеводов, а также их синтетических аналогов. Например, аромат кофе содержит до 500 различных компонентов. Химия чая — это также химия природных соединений. Работы немецкого химика А. Байера, изучавшего строение и синтез индиговых производных (индол и синтез природного красителя синего индиго — это цвет классических джинсов), привели к созданию химии синтетических красителей и к Нобелевской премии 1905 года «за заслуги в развитии органической химии и химической промышленности благодаря работам по органическим красителям и гидроароматическим соединениям». Это было началом огромной отрасли производства анилиновых красителей.
Химия твердого тела изучает реакции, в которых участвует одно или несколько веществ в твердом состоянии. Находит применение в микроэлектронике, синтезе новых материалов (керметов, сверхпроводников). Один из ярких примеров — самораспространяющийся высокотемпературный синтез (СВС). Современное развитие метода СВС позволило разработать технологии получения сверхтвердых и тугоплавких материалов, таких, как нитрид титана, карбид бора, диборид титана, карбид титана, а также оксидных материалов для футеровки печей (оксид циркония) и даже высокотемпературных сверхпроводников.
Химия элементоорганических соединений — наука о строении и превращениях соединений, содержащих химические связи «элемент-углерод», где «элемент» — любой из элементов Периодической таблицы, за исключением H, O, S, CI, Вг. Основные классы элементоорганических соединений — металлоорганические, кремнийорганические, борорганические, фосфорорганические, фторорганические соединения. Металлоорганические соединения (МОС) содержат в молекуле связь «металл—углерод» (М—С). Цианиды, карбиды, а в некоторых случаях и карбонилы металлов, также имеющие связь М—С, считают неорганическими соединениями. К МОС иногда относят органические соединения B, Al, Si и некоторых неметаллов. Гем — самое известное и полезное природное металлоорганическое соединение — переносчик кислорода в человеческом организме.
В химии живых организмов роль элементоорганических соединений еще не совсем ясна, тем не менее можно с уверенностью сказать, что соединения кремния, фосфора и других элементов играют важную роль в жизнедеятельности живых организмов, стоящих на высоком уровне эволюционного развития, в частности человека.
Исследователи работают над синтезом полимеров с 45 элементами Периодической системы. Оказалось, что В, Al, Si, Ti, Sn, Pb, P, As, Sb, Fe в сочетании с кислородом и азотом способны образовывать неорганические цепи полимерных молекул с боковыми органическими и органосилоксановыми группами.
Прикладные аспекты химии элементоорганических соединений направлены на создание новых веществ и материалов для медицины (лекарственные препараты, материалы для протезирования, шовные нити), радиоэлектроники (фото- и светочувствительные материалы, полупроводники, ферромагнетики), сельского хозяйства (стимуляторы роста растений, пестициды, гербициды) и других отраслей промышленности (катализаторы, регуляторы горения моторных топлив).
Цитохимия изучает химическими методами строение и функции клеток, внутриклеточных структур и продуктов их жизнедеятельности.
Электрохимия изучает свойства систем, содержащих подвижные ионы, а также явления, возникающие на границе двух фаз вследствие переноса заряженных частиц. Это нужно для электролиза, гальванотехники, защиты металлов от коррозии и создания химических источников тока. Электрические аккумуляторы, химические источники тока многократного действия — бытовое воплощение электрохимии.
Ядерная химия — пограничный раздел между ядерной физикой, радиохимией и химической физикой. Изучает взаимосвязь между превращениями атомных ядер и строением электронных оболочек атомов и молекул. Иногда ядерную химию неправильно отождествляют с радиохимией. В ней можно выделить исследование ядерных реакций и химических последствий ядерных превращений, химию «новых атомов» — позитроний (Ps), мюоний (Мu), поиск новых элементов и радионуклидов, новых видов радиоактивного распада.
Статья написана по материалам монографии:
Аблесимов Н. Е. Синопсис химии: Справочно-учебное пособие по общей химии.
Хабаровск: Изд-во ДВГУПС, 2005.
Химия в повседневной жизни человека
Нередко учащимся 8 класса задают написать сочинение, сообщение, эссе, выполнить проект на тему «Химия в жизни человека»? Это неслучайно. Уже не одно столетие химия занимает важное место в жизни людей.
Лекарства, косметика, бытовая химия, многие пищевые добавки, вещи первой необходимости – все это получено с помощью химических веществ и их реакций. Роль этой науки большей частью положительна. И лишь бесконтрольное ее использование в отраслях потребительского рынка может нанести вред.
Роль химии в жизни человека
Химия – не только научно-теоретическая дисциплина. Это одна из самых применимых на практике наук. Ее открытиями пользуются промышленность, сфера услуг и просто любая семья.
Химия в быту
Каждая современная семья использует огромное количество средств бытовой химии – на кухне, в ванной, гостиной, спальне. Они помогают экономить время, сохранять здоровье, поддерживать чистоту, создавать красивый интерьер, выращивать растения, ухаживать за автомобилями.
Вот только некоторые из этих средств:
- стиральные порошки, мыло;
- шампуни;
- клеи, краски, лаки;
- пятновыводители, очистители, крема для обуви;
- удобрения, вещества для защиты домашних растений от насекомых, болезней.
Так, при стирке активные вещества вступают в реакцию с грязью, в результате чего она как бы отталкивается от ткани. В хозяйственном мыле – это обычная щелочь природного происхождения, в порошках – синтетические ПАВ. Для создания красок тоже используют химию: едкий натр в гуаши, олифа – в масляных разновидностях.
Однако химия оставила свой след и в привычных операциях. Когда готовят пирог, то смешивают соду и лимонный сок. Происходит процесс растворения соды и выделения углекислого газа СО2. Он пробивает себе выходы, и тесто поднимается.
Очистка металлической посуды от накипи с помощью лимонной кислоты производится в результате растворения твердых карбонатных пленок (накипи) в кислой среде.
Химия и человеческий организм
Человек – это сложная система, состоящая из различных элементов и органических веществ. Но требуется постоянное их пополнение. Кальций, калий, кислород, фосфор, аминокислоты – все это должно поступать в организм с едой.
Влияние внешних веществ по-разному воздействует на человека. Так, принятие аспирина с помощью химических реакции разжижает кровь. Для одного человека, с густой кровью и склонностью к тромбам, — это спасение. Для другого, с нарушением свертываемости крови, применение этого лекарства может довести до летального исхода.
Поэтому химические вещества или продукты с ними сопровождаются инструкциями, как обезопасить себя.
Пример:
уксусную кислоту нельзя употреблять, не разбавив большим количеством воды. При работе с чистящими гелями, пастами, надо надевать перчатки. Нельзя употреблять слишком много соли из-за накопления натрия, ведущего к отекам.
Химия в промышленности
На химических реакциях основано большинство промышленных производств мира.
Так, благодаря промышленной химии, получают:
- лекарства;
- продукты питания;
- пластиковые, резинотехнические изделия;
- бензин;
- бумажные изделия;
- синтетические ткани;
- строительные и отделочные материалы;
- металлы и сплавы с новыми свойствами для медицины, космоса, электроники;
- кисломолочную продукцию и многое другое.
Как отдельный комплекс выделяют химическую промышленность, состоящую из фармацевтической, нефтехимической, горно-химической отраслей. Общество получает от них значительный объем продукции.
Эссе по теме: Химия в моей жизни.
— Что для тебя химия? – как-то спросила я своего одноклассника и соседа по парте Даньку Матвеева.
-Что, что… пробубнил он. И потом, почти не задумываясь, ответил: ” Предмет, который изучаем в школе по понедельникам и средам.’’ И всё ?!… Я была удивлена и даже обескуражена. И тогда этот же самый вопрос я задала самой себе: а что значит химия в моей жизни?
Для меня однозначно, что химия – это целый удивительный мир, мир загадок и открытий, мир прошлого, настоящего и будущего.
Именно она позволяет человеку извлекать из минерального, животного и растительного сырья вещества, одно другого чудесней и удивительней.
Она не только копирует природу, подражая ей, а и – с каждым годом всё более начинает превосходить её. Рождаются тысячи и десятки тысяч веществ, природе неизвестных. Со свойствами очень полезными и важными для практики, для жизни человека.
Перечень добрых дел, которые творит химия, поистине неисчерпаем.
Мне хочется сказать своему однокласснику: ‘’ Оглянись вокруг , посмотри повнимательней. Химия окружает нас повсюду .’’ Она прочно вошла в нашу жизнь: косметика, средства личной гигиены, пищевые добавки, красители и многое- многое другое, без чего люди сегодня уже не представляют свой быт. Все и я в том числе используем химию при приготовлении продуктов.
Мы передвигаемся на автомобилях , металл, резина и пластик которых сделаны с использованием химических процессов.
Более того, химия в нас, так как мы состоим из химических элементов и веществ. Наш организм – это самая уникальная химическая лаборатория. Ежесекундно в наших клетках происходит множество параллельных реакций. И все эмоции, которые мы переживаем, включая самое прекрасное чувство любовь — это тоже химия, а именно выброс гормонов. В таком случае, если человек не знает химию, то он не знает самого себя и не понимает, как устроен окружающий мир.
В будущем я планирую связать свою жизнь с медициной, помогать людям, лечить их. И для меня химия это одна из основных наук, которая нужна мне для овладения профессией. Хороший врач – обязательно хороший химик. Иначе быть не может, это я знаю точно. Сейчас созданы новые лекарства, благодаря которым, некогда неизлечимые болезни отступают. И я понимаю, что жизнь очень близкого мне человека, моей бабушки, зависит сейчас от таких лекарств. Я не буду вдаваться в подробности заболевания. Я просто очень благодарна людям создавшим эти препараты , что кстати невозможно было бы без химии. Благодарна за возможность ощущать её любовь, заботу, за тот житейский опыт, которым она со мной делится.
Любовь к химии мне привила моя мама, она же мой учитель химии. Именно она научила меня смотреть на жизнь глазами химика, открыла для меня дверь в удивительный мир химических превращений, мир который увлёк меня и с которым я уже не расстанусь.
Значение химии в нашей жизни
Влияние химии на качество жизни человека двояко. Она способна как помогать, так и наносить вред человеку и окружающей среде.
Вредное воздействие
Несмотря на огромную пользу, химия способна причинить вред. От стиральных порошков может возникнуть раздражение на коже, особенно у детей.
Лаки и некоторые краски при продолжительном вдыхании способны привести к интоксикации с головокружением, тошнотой, слабостью.
Удобрения при передозировке накапливаются в плодах и зелени, приводя к поражению желудочно-кишечного тракта.
Но наибольший вред способны привести пищевые химические добавки с кодом «Е», особенно если они не прошли длительного изучения или если их употреблять в больших количествах с едой.
Пример:
модифицированный крахмал в йогуртах способен пагубно влиять на поджелудочную железу. А волокна, обработанные специальными химикатами для прочности и сохранения яркой окраски, вызывают аллергические дерматиты. Особенно это характерно для продукции одной из азиатских стран.
Чтобы оградить свой организм от вредного воздействия, следует:
- соблюдать меры предосторожности, если используются такие вещества;
- не приобретать продукцию, производитель которой неизвестен;
- питаться полезной натуральной едой, ограничивая вкусные, но вредные продукты.
Эти простые правила позволят без риска для здоровья пользоваться всеми достижениями современной химии.
Польза химии
Вещества, полученные химическим путем, используют в медицине. Они помогают сохранить больным людям жизнь, поддерживают здоровье.
Одно из достижений – способность улучшать вкусовые качества: сахар, ванилин – тому наглядный пример.
В доме химические вещества убивают микробов, поддерживают комфортный микроклимат в квартире, дают тепло.
Сельским жителям и сельскохозяйственным предприятиям помогают обезопасить поле, сад, огород, приусадебное хозяйство, птицефабрику, повысить урожайность или надои. Это дает возможность обеспечивать едой жителей планеты.
Эссе на тему «Химия — это жизнь»
Химия… Что ты представляешь, услышав это? Периодическую таблицу или уроки химии? Химические опыты в школе или уравнения этих реакций? Да, каждый думает о своём. Но ты прекрасно понимаешь, что химия-это не только предмет, который изучается в школе или в вузе, химия-это всё то, что окружает нас, и все то, что внутри нас. Химия – это и есть жизнь.
Оглянись, ведь даже дома столько всего нас окружает: стол, стекло, бумага, одежда, посуда… Мы очень редко думаем, из чего состоят все эти вещи. Мы так привыкли к ним, что даже не пытаемся определить их состав, не задумываемся, откуда они взялись, кто их придумал и почему именно так. Ты скажешь, что всех их сделали на заводах и фабриках, а мы купили их в магазинах.
Да, конечно. Но до этого ведь кто-то придумал, из какого сырья сделать это, кто-то добыл это сырье, придумал реакции и технологии, с помощью которых можно, производить материал… Кажется, всё так просто. Но нет, все гораздо сложнее. В основе этого лежит великая наука-химия. Многие химические реакции, с которыми мы познакомились в лабораторных условиях, осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции. Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, моющие средства, красители, косметика и даже компоненты пищи — всё это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности.
Но мы уже думаем, что так и должно быть. Вот открываешь холодильник, а там кефир. Ты конечно же, не задумываешься о реакциях брожения с помощью которых сделали кефир, и не вспоминаешь формулу полиэтилена, из которого сделан пакет этого же кефира. Или вот достаешь из аптечки перекись водорода и не думаешь о формуле h3O2 ; и аспирин ты всегда называешь аспирином, хотя это ацетилсалициловая кислота… А ведь если на многие вещи смотреть изучав науку химии , все гораздо интереснее. А что же было до того, как люди стали изучать химию? Все, наверно, было по-другому. Но люди нашли путь и стремились познать эту науку. Ведь человек с первых дней своей жизни сталкивается с химией. Получается не люди придумали ее, а вся природа давно уже связана с химией. Ведь она состоит из химических элементов и соединений, и в основе многих явлении лежат химические реакции. Воздух, которым мы дышим, состоит из смеси газов; вода, с которой мы встречаемся ежедневно, и есть сложное химическое вещество; даже мы сами повседневно проводим химические реакции, когда готовим пищу или когда включаем газовую плиту. И не только это, даже внутри нас протекают десятки химических реакции! Вроде бы невероятно, ведь там нет ни пробирок, ни колбочек. Но это правда: не было бы этих реакций — не было бы жизни. В нашем организме есть почти все элементы таблицы Менделеева. Разве это не главное доказательство того, что химия — это жизнь?
Да, человек встречается с химией на каждом шагу. Наша жизнь, здоровье, настроение тесно связаны с бесчисленными химическими веществами и процессами вокруг нас и нас самих.
Развитие человеческого общества сопровождается с применением новых материалов и химических процессов во всех сферах деятельности человека. Химия дает в руки человечества огромные возможности и силы, но при этом требует грамотного, ответственного их использования, понимания сущности химических явлений. Поэтому мы должны изучить эту великую науку. Ведь будущее зависит от нас, от молодежи.
Химия и жизнь
Химия прочно вошла в повседневную жизнь ещё со времён Древнего Египта. В таблице наглядно показана огромная роль химии в жизни человека.
Рис. 2. Схема очистки нефти.
| Отрасль | Описание | Примеры продукции |
| Фармацевтика | Все лекарства содержат химические вещества, благотворно воздействующие на организм человека | Аспирин, нашатырный спирт, раствор йода |
| Косметология | Очищающие средства содержат глицерин, щёлочь, ферменты, эфирные масла. В аэрозолях используются сжиженные газы. Песок и сода являются главными компонентами зубных паст. Из воска изготавливается губная помада. В краску для волос добавляют металлы, водород | Зубная паста, крем, шампунь, лаки для волос и ногтей |
| Бытовая химия | Сульфаты, ПАВ (поверхностно-активные вещества), щёлочь, ферменты, глицерин используются для производства стиральных порошков, мыла, средств для мытья посуды и т.д. | Мыло, чистящие и стиральные порошки, гели |
| Энергетика | Главным источником топлива являются полезные ископаемые. При переработке нефти, газа, каменного угля выделяются различные фракции веществ, большая часть из которых используется для производства бензина, керосина, дизеля | Метан, пропан, бензин, керосин, уголь |
| Производство | Из нефтепродуктов, металлов и неметаллов изготавливают различные предметы быта и материалы. Сплавы металлов используются для изготовления корпусов машин, металлических деталей, инструментов. Металлическое напыление предохраняет предметы от повреждений. Органические соединения используются для изготовления пластмасс, резины, нитей, растворителей и т.д. | Бронза, чугун, сталь, пластмассы, каучуки, синтетическая ткань, клей, лаки, краски |
| Пищевая промышленность | Еда включает химические соединения растительного и животного происхождения. Для улучшения вкуса, продления срока хранения, поддержания цвета используются химические консерванты, стабилизаторы, красители | Уксус, пищевая сода, пищевые добавки, консерванты, лимонная кислота, сложные эфиры (ароматизаторы) |
Рис. 3. Изделия из пластика.
Энергия, которую получает человек вместе с пищей, это тоже химия. В процессе пищеварения сложные вещества расщепляются на более простые, из которых синтезируются белки, жиры, углеводы, необходимые человеческому организму.
примеров химических реакций в повседневной жизни
Примеры химических реакций в повседневной жизни включают фотосинтез, ржавчину, выпечку, пищеварение, горение, химические батареи, ферментацию и мытье водой с мылом.Химические реакции происходят повсюду в мире вокруг вас, а не только в химической лаборатории. Вот 20 примеров химических реакций в повседневной жизни и более пристальный взгляд на то, что происходит на молекулярном уровне.
Как распознать химическую реакцию
Первый шаг к распознаванию химических реакций в мире вокруг вас — это определить, когда реакция происходит.Химические реакции вызывают химические изменения. Другими словами, вещества взаимодействуют и образуют новые продукты. Не всякое изменение вещества — это химическая реакция. Например, таяние льда, разрыв листа бумаги на полоски и растворение сахара в воде — это физические изменения, которые не меняют химическую идентичность вещества.
Вот некоторые признаки химической реакции. Если присутствует более одного знака, это похоже на реакцию:
- Изменение температуры
- Изменение цвета
- Запах
- Пузырьки или образование газа
- Образование твердого вещества, называемого осадком, при смешивании жидкостей
20 Примеры химических реакций в повседневной жизни
Вот несколько общих примеров химических реакций в повседневной жизни:
- Горение
- Фотосинтез
- Аэробное клеточное дыхание
- Анаэробное дыхание (включая ферментацию)
- Окисление (включая ржавчину)
- Реакции метатезиса (например, пищевая сода и уксус)
- Электрохимия (включая химические батареи)
- Пищеварение
- Реакции мыла и моющих средств
- Кислотно-основные реакции
- Варка
- Фейерверк
- Гниение продуктов питания
- Гальваника металлов
- Дезинфекция поверхностей и ct линзы
- Наркотики
- Отбеливание
- Цвет волос
- Листья меняют цвет в зависимости от сезона
- Соль удерживает лед на дорогах и помогает заморозить мороженое
Более пристальный взгляд на химические реакции в повседневной жизни
посмотрите на некоторые повседневные реакции, а также на некоторые химические уравнения.
Возгорание
Вы испытываете реакцию возгорания, когда чиркаете спичкой, зажигаете свечу, зажигаете костер или зажигаете гриль. В реакции горения топливо реагирует с кислородом воздуха с образованием воды и углекислого газа. Вот реакция сгорания пропана, топлива, используемого в газовых грилях и некоторых каминах:
C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + энергия
Фотосинтез
Растения используют химическую реакцию, называемую фотосинтезом, для преобразования углекислого газа и воды в пищу (глюкозу) и кислород.Это ключевая реакция, потому что она производит кислород и дает пищу для растений и животных. Общая химическая реакция фотосинтеза:
6 CO 2 + 6 H 2 O + свет → C 6 H 12 O 6 + 6 O 2
Аэробное клеточное дыхание
Животные используют кислород, поставляемый растениями, для осуществления обратной реакции фотосинтеза, чтобы получить энергию для клеток. При аэробном дыхании глюкоза и кислород реагируют с образованием воды и химической энергии в форме аденозинтрифосфата (АТФ).Вот общее уравнение для аэробного клеточного дыхания:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + энергия (36 ATP)
Анаэробный Клеточное дыхание
У организмов есть способы получать энергию без кислорода. Люди используют анаэробное дыхание во время интенсивных или продолжительных упражнений, чтобы получить достаточно энергии для мышечных клеток. Дрожжи и бактерии используют анэробное дыхание в форме ферментации для производства повседневных продуктов, таких как вино, уксус, йогурт, хлеб, сыр и пиво.Уравнение для одной формы анэробного дыхания:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + энергия
Окисление
Ржавчина, ягода, и потускнение — все это примеры обычных реакций окисления. Когда железо ржавеет, оно меняет цвет и текстуру, образуя чешуйчатое покрытие, называемое ржавчиной. При реакции также выделяется тепло, но обычно происходит слишком медленно, чтобы это было заметно. Вот химическое уравнение ржавления железа:
Fe + O 2 + H 2 O → Fe 2 O 3 .XH 2 O
Электрохимия
Электрохимические реакции — это окислительно-восстановительные реакции, которые преобразуют химическую энергию в электрическую. Тип реакции зависит от аккумулятора. Спонтанные реакции происходят в гальванических ячейках, в то время как неспонтанные реакции происходят в электролитических ячейках.
Пищеварение
Пищеварение — это сложный процесс, который включает тысячи химических реакций. Когда вы кладете еду в рот, вода и фермент амилаза расщепляют сахар и другие углеводы на более простые молекулы.Соляная кислота и ферменты расщепляют белки в желудке. Бикарбонат натрия, попадающий в тонкий кишечник, нейтрализует кислоту и защищает пищеварительный тракт от растворения.
Реакции с мылом и моющими средствами
Мытье рук водой не является химической реакцией, потому что вы просто механически смываете грязь. Если вы добавите мыло или моющее средство, произойдут химические реакции, которые превратят жир в эмульсию и снизят поверхностное натяжение, чтобы вы могли удалить масляную грязь. Еще больше реакций происходит со стиральным порошком, который может содержать ферменты, расщепляющие белки, и отбеливатели, чтобы одежда не выглядела грязной.
Готовка
Простое смешивание сухих ингредиентов обычно не приводит к химической реакции. Но добавление жидкого ингредиента часто приводит к реакции. Приготовление с использованием тепла также вызывает реакции. Смешивание муки, сахара и соли не является химической реакцией. Также не смешиваются масло и уксус. Приготовление яйца — это химическая реакция, потому что при нагревании белки в яичном белке полимеризуются, а водород и сера в желтке могут реагировать с образованием газообразного сероводорода. Когда вы нагреваете сахар, происходит реакция, называемая кармелизацией.Когда вы нагреваете мясо, оно коричневеет из-за реакции Майяра. Выпечка поднимается из-за пузырьков углекислого газа, образующихся в результате реакции между разрыхлителем или содой и жидкими ингредиентами.
Кислотно-основные реакции
Кислотно-основные реакции происходят всякий раз, когда вы смешиваете кислоту (например, лимонный сок, уксус, соляную кислоту, аккумуляторную кислоту, угольную кислоту из газированных напитков) с основанием (например, пищевой содой, аммиаком, щелоком ). Хорошим примером кислотно-щелочной реакции является реакция между пищевой содой и уксусом с образованием ацетата натрия, воды и углекислого газа:
NaHCO 3 + HC 2 H 3 O 2 → NaC 2 H 3 O 2 + H 2 O + CO 2
Обычно реакция между кислотой и основанием дает соль и воду.Например, если вы прореагируете соляной кислотой (HCl) и щелоком (NaOH), вы получите поваренную соль (NaCl) и воду (H 2 O):
HCl + NaOH → NaCl + H 2 O
In В этой реакции две прозрачные жидкости образуют другую прозрачную жидкость, но вы можете сказать, что реакция происходит, потому что она выделяет много тепла.
Примеры химических реакций в повседневной жизни
Химия происходит в мире вокруг вас, а не только в лаборатории. Материя взаимодействует с образованием новых продуктов посредством процесса, называемого химической реакцией или химическим изменением.Каждый раз, когда вы готовите или убираете, это химия в действии. Ваше тело живет и растет благодаря химическим реакциям. Возникают реакции, когда вы принимаете лекарства, зажигаете спичку и делаете вдох. Эти примеры химических реакций из повседневной жизни представляют собой небольшую выборку из сотен тысяч реакций, которые вы испытываете в повседневной жизни.
Ключевые выводы: химические реакции в повседневной жизни
- Химические реакции обычны в повседневной жизни, но вы можете их не распознать.
- Обратите внимание на признаки реакции. Химические реакции часто включают изменение цвета, изменения температуры, образование газа или образование осадка.
- Простые примеры повседневных реакций включают пищеварение, сжигание и приготовление пищи.
Фотосинтез
Фрэнк Крамер / Getty Images
Растения применяют химическую реакцию, называемую фотосинтезом, для преобразования углекислого газа и воды в пищу (глюкозу) и кислород. Это одна из наиболее распространенных повседневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.Уравнение реакции:
6 CO 2 + 6 H 2 O + свет → C 6 H 12 O 6 + 6 O 2
Аэробное клеточное дыхание
Катерина Кон / Научная фотобиблиотека / Getty Images
Аэробное клеточное дыхание — это процесс, противоположный фотосинтезу, в котором молекулы энергии объединяются с кислородом, которым мы дышим, чтобы высвободить энергию, необходимую нашим клеткам, а также углекислый газ и воду.Энергия, используемая клетками, — это химическая энергия в форме АТФ или аденозинтрифосфата.
Вот общее уравнение аэробного клеточного дыхания:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + энергия (36 АТФ)
Анаэробное дыхание
Tastyart Ltd Роб Уайт / Getty Images
Анаэробное дыхание — это набор химических реакций, которые позволяют клеткам получать энергию от сложных молекул без кислорода.Ваши мышечные клетки выполняют анаэробное дыхание всякий раз, когда вы исчерпываете доставляемый к ним кислород, например, во время интенсивных или продолжительных упражнений. Анаэробное дыхание дрожжей и бактерий используется для ферментации с образованием этанола, углекислого газа и других химикатов, из которых делают сыр, вино, пиво, йогурт, хлеб и многие другие обычные продукты.
Общее химическое уравнение для одной формы анаэробного дыхания:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + энергия
Горение
WIN-Инициатива / Getty ImagesКаждый раз, когда вы зажигаете спичку, зажигаете свечу, разводите огонь или зажигаете гриль, вы видите реакцию горения.Горение объединяет энергичные молекулы с кислородом, чтобы произвести углекислый газ и воду.
Например, уравнение реакции сгорания пропана в газовых грилях и некоторых каминах выглядит следующим образом:
C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + энергия
Ржавчина
Алекс Дауден / EyeEm / Getty Images
Со временем на железе образуется красный шелушащийся налет, называемый ржавчиной. Это пример реакции окисления.Другие повседневные примеры включают образование косточек на меди и потускнение серебра.
Вот химическое уравнение ржавления железа:
Fe + O 2 + H 2 O → Fe 2 O 3 . XH 2 O
Пищеварение
Питер Дазли / Выбор фотографа / Getty Images
Во время пищеварения происходят тысячи химических реакций. Как только вы кладете еду в рот, фермент в вашей слюне, называемый амилазой, начинает расщеплять сахар и другие углеводы в более простые формы, которые ваше тело может усвоить.Соляная кислота в желудке реагирует с пищей и расщепляет ее, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровоток через стенки кишечника.
Кислотно-основные реакции
Lumina Imaging / Getty Images
Когда вы комбинируете кислоту (например, уксус, лимонный сок, серную или соляную кислоту) с основанием (например, пищевой содой, мылом, аммиаком или ацетон), вы выполняете кислотно-щелочную реакцию. Эти реакции нейтрализуют кислоту и основание с образованием соли и воды.
Хлорид натрия — не единственная соль, которая может образоваться. Например, вот химическое уравнение кислотно-основной реакции, в результате которой образуется хлорид калия, обычный заменитель поваренной соли:
HCl + КОН → KCl + H 2 O
Реакции с мылом и моющими средствами
JGI / Джейми Грилл / Getty Images
Мыло и моющие средства очищаются путем химических реакций. Мыло эмульгирует грязь, а это означает, что жирные пятна прилипают к мылу, и их можно удалить водой.Моющие средства действуют как поверхностно-активные вещества, снижая поверхностное натяжение воды, чтобы она могла взаимодействовать с маслами, изолировать их и смывать.
Кулинария
Фотографии Дины Беленко / Getty ImagesПри приготовлении пищи используется тепло, чтобы вызвать химические изменения в пище. Например, когда вы варите яйцо вкрутую, сероводород, образующийся при нагревании яичного белка, может реагировать с железом из яичного желтка, образуя серовато-зеленое кольцо вокруг желтка. Когда вы обжариваете мясо или выпечку, реакция Майяра между аминокислотами и сахарами дает коричневый цвет и желаемый вкус.
Примеры химических изменений в повседневной жизни
Химические изменения могут напоминать фейерверки или взрывы. Однако некоторые примеры химических изменений неуловимы. Изучите примеры химических изменений в кулинарии, природе и вашем доме. Получите представление о разнице между физическими и химическими изменениями.
Примеры химических изменений
Не все реакции являются химическими. Однако если в результате реакции образуется новое вещество, значит, вы наблюдаете химическое изменение.Например, фейерверк, закрывающий небо четвертого июля, является результатом химического изменения. Фотосинтез у растений также является примером химической реакции. В этом случае солнечный свет превращается в пищу для растения. Обычно химические реакции имеют несколько сигналов, в том числе:
- Изменение цвета
- Высвобождение или поглощение энергии
- Изменение запаха
- Производство газа
Химические изменения происходят повсюду вокруг вас, даже в вашем собственном доме.Изучите несколько забавных примеров из кулинарии, природы и вашего дома.
Примеры химических изменений в кулинарии
Когда вы смешиваете муку и сахар, чтобы сделать торт, вы можете не подумать, что это химическая реакция, но это так. Выпечка торта — классический пример, когда новое вещество создается путем смешивания муки, сахара, ванили, какао и тепла. Вот еще несколько примеров приготовления.
Rising Bread
Рост хлеба — это здорово, правда? Не так много! Однако не все химические изменения вызывают восхищение.Хотя дрожжи, вызывающие подъем хлеба, не вызывают острых ощущений, они представляют собой химические изменения. Почему? Итак, дрожжи расщепляют крахмал в хлебном тесте на сахар, который превращается в углекислый газ и этанол. Углекислый газ заставляет хлеб подниматься.
Карамелизация
Любите карамелизированный лук? В любом случае, это отличный пример химического изменения. При карамелизации сахар расщепляется, чтобы создать специфический аромат и вкус.
Майяр Браунинг
Майяр Браунинг — странное название, но благодаря ему получается восхитительная коричневая корочка на хлебе и жареном на гриле мясе.Браунинг Майяра, названный в честь химика Луи-Камиля Майяра, представляет собой серию химических реакций, начинающихся с аминокислот и сахара.
Природные примеры химических изменений
Кулинария — не единственное место, где вы видите химические изменения. От того, как ваше тело переваривает пищу до горящей спички, когда вы ударяете по ней, химические реакции можно найти повсюду. Погрузитесь в несколько примеров из природы и вашего дома.
Листья, меняющие цвет
Эти прекрасные цвета осени появляются не случайно.Они появились благодаря химическим изменениям в листьях. Обычно листья зеленые из-за хлорофилла, используемого для фотосинтеза. Однако до того, как деревья вздремнут зимой, хлорофилл в листьях разрушается. Когда хлорофилл расщепляется, каротин и антоцианы, естественным образом содержащиеся в листьях в течение всего лета, занимают центральное место, создавая красивые красные и желтые цвета.
Souring Food
Одной из ключевых характеристик химического изменения является запах, поэтому люди могут нюхать продукты, чтобы узнать, испортились ли они.Например, молоко портится из-за брожения. Здесь лактоза превращается в молочную кислоту бактериями, пережившими пастеризацию.
Возгорание
Когда что-то подвергается химической реакции, оно становится чем-то другим. Например, когда дерево горит, оно превращается в золу. Причина возгорания древесины — это горение.
Смешивание пищевой соды и уксуса
Если вы смешаете кислоту, такую как уксус, с основанием, например пищевой содой, вы получите химическую реакцию.В этом случае он начинает пузыриться. Это отличный способ создать самодельный вулкан.
Ржавчина автомобиля
Вы никогда не хотите, чтобы ваша машина ржавела. Однако где бы вы ни жили, это неизбежно. Ржавчина — это химическое изменение, происходящее при контакте железа с металлом. Если ваш автомобиль не сделан из пластика или пузыря, он найдет способ заржаветь.
Химическое изменение против физического изменения
Непонятной областью в химии может быть разница между химическими и физическими изменениями.В то время как химическое изменение — это когда что-то становится новым веществом, физическое изменение — это когда вещество меняет форму, но остается прежним. Например, когда вода замораживается, она меняет форму, но остается водой. Когда вода испаряется в воздух, она меняет форму, но остается водой. Если измельчить кусок сыра, сыр останется сыром, но изменит форму.
Веселые химические изменения
Химия — это развлечение. Если вы когда-нибудь строили самодельный вулкан, вы знаете, что это может быть захватывающе.Однако не все изменения являются химическими. Химические изменения происходят только тогда, когда образуется новое вещество. Имея твердое представление о химических изменениях, проверьте биотические факторы и абиотические факторы.
Химические реакции Повседневная жизнь — Химические реакции и ответы на часто задаваемые вопросы
Общие химические реакции в повседневной жизни
В нашей повседневной жизни мы замечаем множество различных химических реакций. Мы часто видим шелушащийся слой коричневого цвета, который появляется на поверхности нескольких металлических предметов, например, кузовов транспортных средств, ворот и т. Д.Во время праздников и празднований Дивали мы сжигаем крекеры, которые при горении дают яркий свет и звук. Яркий свет является результатом горения таких компонентов, как магний, который используется в составе одного из ингредиентов крекеров и бенгальских огней, которые мы сжигаем. В этой статье мы изучим эти химические процессы в повседневной жизни, которые мы видим вокруг себя.
Типы химических реакций в повседневной жизни
1. Фотосинтез:
Процесс фотосинтеза — это процесс, с помощью которого автотрофы стремятся производить пищу.Это одна из естественных химических реакций в повседневной жизни. В присутствии хлорофилла и солнечного света растения производят глюкозу в виде энергии из воды и углекислого газа из окружающей среды.
6CO₂ + 6H₂O → C₆H₁₂O₆ (вод.) + 6O₂ (г)
[Изображение будет скоро загружено]
2. Ржавчина:
Процесс окисления, который относится к реакции в присутствии кислорода, дает коричневый шелушащийся слой, который мы часто замечаем на металлических поверхностях, таких как железо.Этот слой образуется из-за окисления самого верхнего слоя для образования оксида металла. Мы знаем это и называем это ржавчиной. Точно так же несколько слоев образуются и на других металлах, например, в серебре, в котором слой зеленого цвета образуется, когда он подвергается реакции окисления.
Fe + 3O₂ + xH₂O → Fe₃O₄. xH₂O
[Изображение будет загружено в ближайшее время]
3. Клеточное дыхание:
Процесс дыхания в легких человека также включает химическую реакцию.В этой реакции молекулы глюкозы, как правило, подвергаются реакции окисления и производят воду и углекислый газ вместе с энергией. Этот процесс происходит на клеточном уровне и, следовательно, называется клеточным дыханием.
C₆H₁₂O₆ (вод.) + 60 (г) → 6CO₂ (г) + 6H₂O (л) + энергия
4. Анаэробное дыхание:
Когда живой организм склонен подвергаться процессу ферментации, присутствующие в нем компоненты содержат крахмал или сахар, превращаются в спирт, кислоты и газы.
C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂
5. Горение:
Процесс горения относится к числу химических изменений в повседневной жизни. Он имеет тенденцию включать реакцию окисления материала, когда он подвергается воздействию тепла и кислорода из окружающей среды с образованием дыма, золы и некоторых других газов.
C + O₂ → CO₂
[Изображение будет загружено в ближайшее время]
6. Кислотно-основные реакции:
Кислотно-основные реакции также являются частью химических реакций в нашей повседневной жизни.В этих реакциях более слабые кислоты, которые вырабатываются во рту за ночь из-за сладких продуктов и бактерий, нейтрализуются в присутствии основания, которое присутствует в зубной пасте, которую мы используем утром каждый день.
Кислота + основание → соль + вода
Аналогичным образом оксидный слой на металлических артефактах удаляется с помощью более слабых кислот, таких как уксус. Этот процесс помогает нам очистить слой металла и обнажить новый новый слой металла.
CH₃COOH + FeO → CH₃COOFe + H₂O
Химические реакции
Основные идеи «толкать и тянуть» исследуются на протяжении
.Противопоставление взглядов студентов и ученых
Ежедневный опыт студентов
Дети испытали множество примеров химических изменений, даже не осознавая этого. Они знакомы с процессами горения, приготовления пищи, ржавления и химическими процессами, которые предполагают растворение. Однако на этом уровне ученики не видят, что новые материалы производятся в результате химических изменений, скорее они видят, что существующие материалы просто каким-то образом были изменены.Например, они видят дым как часть дерева, который каким-то образом выделяется при горении дерева. Поскольку учащиеся редко понимают понятие «вещество», они не видят изменения веществ. Тем не менее, понимание химических изменений является фундаментальным для понимания роли химии в их жизни, и на этом уровне студенты могут начать это понимать.
Студенты часто считают, что для того, чтобы получить что-то новое, нужно просто смешать все вместе. Когда химическая реакция действительно имеет место, они считают, что тот или иной реагент просто модифицируется; на самом деле это не изменилось.Например, учащиеся считают, что ржавчина — это все еще железо / сталь; он только что стал коричневым. Точно так же обычно не замечают отслаивания ржавчины — считается, что утюг просто исчезает. Пузырьки газа, которые часто образуются при растворении таблетки в воде, часто не воспринимаются студентами как новое вещество. Такие процессы, как смешивание с водой, использование красителей в пище, замораживание и кипячение, считаются аналогичными химическим изменениям, которые происходят при приготовлении яиц.
Исследование: Johnson (2002)
Дети часто верят, что при сгорании такие материалы, как дерево или бумага, просто исчезают — в конце концов, от продукта остается не так много материала, который можно было бы увидеть.По их мнению, воздух имеет мало общего с горением. Студенты считают, что при сжигании углеродных материалов, таких как дерево, древесный уголь (углерод) появляется из горит , а не материал .
Исследование: Университет штата Аризона (2001)
Поскольку многие дети знают о таких вещах, как приготовление пищи и сжигание, они предполагают, что тепло всегда необходимо для возникновения реакций.
В обиходе слово «химический» часто используется как ярлык для нежелательных вещей, которых не должно быть в пищевых продуктах или косметике.Следовательно, учащиеся могут рассматривать химические вещества как группу веществ, обнаруженных в лабораториях, а не рассматривать все вещества в продуктах питания (например) как химические вещества.
Научная точка зрения
Все материалы сделаны из химикатов. Химические реакции включают взаимодействие между химическими веществами, так что все реагенты превращаются в новые материалы. Свойства новых материалов отличаются от свойств реагентов. Это отличается от других изменений, таких как испарение, плавление, кипение, замораживание и перемешивание, при которых изменения не связаны с новыми веществами.Хотя для начала реакций часто требуется тепло, это не обязательно.
Химические реакции включают разрыв химических связей между молекулами (частицами) реагентов и образование новых связей между атомами в частицах продукта (молекулах). Число атомов до и после химического изменения одинаково, но число молекул изменится.
Хотя многие химические реакции протекают быстро, небольшие, медленные изменения, такие как ржавление или биологические процессы, могут происходить в течение гораздо более длительных периодов времени.
Химические реакции обратимы (факт, который часто опускается во многих научных текстах), но на практике они больше всего отличаются от других наблюдаемых детьми изменений, таких как плавление, тем, что их очень трудно обратить вспять.
Люди используют химические реакции для производства широкого спектра полезных материалов; разложение отходов также включает химические реакции, которые происходят естественным образом в окружающей среде. Для некоторых антропогенных отходов таких реакций нет, и в результате они вызывают проблемы.
Критические педагогические идеи
При обучении химическим реакциям на этом уровне акцент должен делаться на улучшении понимания учащимися важности химических реакций в нашей жизни в производстве многих вещей, которые мы считаем само собой разумеющимися, а также на улучшении их понимания и понимания что вовлечено в химическое изменение.На этом этапе нет необходимости говорить о таких частицах, как атомы или молекулы, или о химических связях.
- В результате химических реакций образуются новые материалы, которые сильно отличаются от реагирующих веществ. Любые новые материалы происходят из реагирующих веществ.
- Изменения, которые могут сопровождать химическую реакцию, включают цвет, внешний вид и образование новых материалов, например, газа.
- Само по себе смешивание не может вызвать химическую реакцию.
- Хотя для инициирования химической реакции часто требуется тепло, это не всегда необходимо.
- Для производства большей части нашей энергии используются химические реакции.
- Химические реакции широко используются для тестирования, идентификации и анализа широкого спектра материалов (например, наборы для тестирования бассейнов и судебно-медицинские тесты из телешоу, таких как « CSI» ).
- Кислород в воздухе является очень реактивным химическим веществом и играет важную роль во многих химических реакциях, таких как горение, ржавление и реакции, посредством которых мы получаем энергию из пищи, которую едим.
Изучите взаимосвязь между идеями о химических реакциях в Карты развития концепции — (атомы и молекулы, химические реакции, сохранение материи, состояния материи)
При изучении химических реакций учащимся нужно будет описывать различные вещества, которые на этом уровне будут материалами, с которыми они знакомы (кухня и изменения, связанные с приготовлением пищи, являются очень хорошей отправной точкой). Им необходимо будет уметь определять изменения в этих веществах с целью в конечном итоге распознать, когда были произведены новые химические вещества. I.е. произошло химическое изменение. Как упоминалось выше, это может быть сложно, так как студенты часто не видят разницы между яичным белком, переходящим из жидкого в твердое состояние в процессе приготовления, и такими изменениями, как таяние шоколада или кипячение воды, которые не связаны с химическими изменениями. Обучение должно быть сосредоточено на том, что происходит, когда образуются новые вещества.
Эти идеи также рассматриваются в идее фокуса Проблемы с классификацией.
Также можно учитывать воздействие химических реакций на окружающую среду, например, как мы утилизируем некоторые химические вещества после их производства в таких формах, как пластиковые пакеты.
Начать обсуждение через общий опыт
Первоначальная педагогическая деятельность должна быть направлена на выявление существующих идей учащихся. На этом этапе важно, чтобы учащихся поощряли высказывать свои идеи и обсуждать их в небольших группах. Все альтернативы следует рассматривать без разрешения на данном этапе.
Начальным действием может быть наблюдение за горением свечи и обсуждение происходящих изменений. Здесь можно различить плавление воска и появление новых материалов.Можно задать следующие вопросы:
- что происходит с воском?
- что горит?
- как вы думаете, куда идет воск?
- не могли бы вы собрать его снова?
- Это тот же процесс, что и испарение воды?
- горела бы свеча, если бы вокруг не было воздуха?
- воздух или часть воздуха израсходованы при горении свечи?
Содействовать осмыслению и разъяснению существующих идей
Действия, которые ставят проблемы для изучения и оспаривают существующие идеи, полезны для поощрения студентов к поиску новых объяснений наблюдаемых ими вещей.Студенты должны изучить ряд изменений и задать вопросы, аналогичные приведенным выше. Во всех этих случаях студентов следует поощрять наблюдать за происходящими изменениями и определять, какие продукты образуются. Обсуждение также может быть сосредоточено на том, чем они отличаются от исходных материалов. Вот несколько примеров:
- Пищевая сода и уксус в стеклянной бутылке с пробкой — почему пробка отлетает?
- Добавьте бикарбонат соды в стакан с уксусом и шестью смородинами.Почему смородина движется вверх и вниз? Какие пузыри? Откуда берутся пузыри?
- Приготовление щербета — смешайте четыре части сахарной пудры, две части лимонной кислоты и одну часть пищевой соды (все это можно приобрести в супермаркетах). Студенты кладут небольшое количество смеси на язык. Что вызывает шипение? Выделяет ли какой-либо порошок сам по себе шипение?
- Наполните банку стальной мочалкой (без мыла) до половины и добавьте уксуса, чтобы покрыть стальную мочалку. Оставьте на пять дней.Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку бытового нашатыря и перемешайте. Сформируется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы.
- Изготовление карамели — студентам предлагается изучить сахар. Нагрейте концентрированный сахарный раствор, наблюдая за изменениями по пути — растворение сахара, затем потемнение. Карамелизация включает в себя ряд химических изменений.(Существует множество рецептов карамели — для улучшения вкуса, внешнего вида и текстуры можно добавить масло, пищевую соду и соль). Студентов следует поощрять искать доказательства химических изменений, а не плавления.
Практикуйтесь в использовании и создайте осознанную полезность научной модели или идеи
Другие виды деятельности могут включать изготовление шоколада. Учащимся можно предложить поискать различия между приготовлением шоколада, где шоколад тает, и производством карамели / ириса, когда сахар превращается во что-то другое.
Есть много других подобных химических изменений, которые можно исследовать — дальнейшие действия по приготовлению пищи могут включать: приготовление шоколадного торта, плавление и подрумянивание сыра, изготовление сот, выпечка хлеба, приготовление яиц-пашот и приготовление тостов. Другие изменения могут включать настройку двухкомпонентных клеев, таких как Аралдит и смешивание стальной ваты и раствора медного купороса (можно приобрести в питомниках растений). Кислород является очень важным реагентом во многих химических реакциях, и студенты могут исследовать изменения, связанные с этим компонентом воздуха.
Разъяснение и объединение идей для / путем общения с другими
На этом этапе важно уточнить и закрепить то, что наблюдали студенты, и сосредоточиться на том, что происходит в химической реакции, которая отличается от плавления, кипения и замораживания. Для достижения этой цели студентов можно попросить в группах сделать мини-плакаты, которые показывают изменения, происходящие в одной или нескольких реакциях, которые они наблюдали, в частности, сравнивая продукты с исходными материалами и демонстрируя, чем они отличаются.Этому можно способствовать, используя новые названия продуктов, такие как «сажа» или «углекислый газ». Затем студенты представляют свои плакаты классу.
Итоговое обсуждение в классе должно выявить идеи учащихся, изучить альтернативы и перейти к более общепринятым научным взглядам на химические реакции.
Должны быть выполнены задания, которые проверят полезность модели химических реакций и дополнительно укрепят представления учащихся о том, что представляет собой химическая реакция. Студентов можно также побудить сравнить продукты с исходными материалами.Например, студенты могут исследовать ржавление стального гвоздя в различных условиях (например, в воздухе / воде / соленой воде).
Для дальнейшего развития понимания учащимися роли химических изменений в их жизни они могли бы исследовать производство металлов из руд (таких как алюминий и сталь) или производство пластмасс и синтетических волокон. Акцент в этом исследовании делается на важности химических изменений в производстве материалов, которые мы используем каждый день.
Дополнительные ресурсы
Интерактивные обучающие объекты, связанные с наукой, можно найти на Страница ресурсов для учителей FUSE.
Чтобы получить доступ к интерактивному объекту обучения ниже, учителя должны войти в FUSE и выполнить поиск по идентификатору учебного ресурса:
- Mystery Substances: ваш первый случай — студенты раскрывают полицейские дела, выявляя чистые вещества и компоненты смесей. Они проводят химические испытания загадочного вещества, такого как соль, пищевая сода или сахар, а также наблюдают и записывают, как каждое вещество реагирует с рядом жидкостей и при нагревании. Затем они обращаются к своей таблице данных о химических свойствах и используют ее для сопоставления загадочного вещества или веществ, обнаруженных на месте преступления.Этот учебный объект является одним из пяти объектов.
Идентификатор учебного ресурса: K6ZRNX
- Загадка сокровищ — ученики должны открыть металлическую дверь в сокровищницу, растворив ее кислотами. Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки. Они видят, реагируют ли вещества с яичной скорлупой, лакмусовой бумагой, бикарбонатом натрия или зубами.
Идентификатор учебного ресурса: 46X2PX
- Спасите озеро — Рыбы умирают в озере из-за загрязнения воды.Студенты проверяют воду в озере с помощью химических индикаторов, чтобы определить, какая отрасль является причиной загрязнения. Затем они предлагают изменения, чтобы спасти озеро.
Идентификатор учебного ресурса: MW25YS
10 примеров химии в повседневной жизни — StudiousGuy
Если я спрошу вас, что приходит вам в голову в тот момент, когда вы слышите слово ХИМИЯ, я почти уверен, что вы представите себя стоящим в химической лаборатории и держащим в руках различные лабораторные инструменты.Это не? Но если вы внимательно посмотрите на окружающий мир, в любую секунду происходят бесконечные химические реакции. Таким образом, можно справедливо сказать, что химия составляет большую часть вашей повседневной жизни. Химия и химические реакции не ограничиваются только лабораториями, но и миром вокруг вас. Элемент углерод образует основную единицу органических, неорганических и металлоорганических соединений. Прямо в тот момент, когда вы ложитесь спать, пока не проснетесь, в каждой клетке вашего тела происходят бесконечные химические процессы.Даже процессы происходят, когда вы просыпаетесь, все ваши повседневные действия, такие как питьевая вода, душ, приготовление пищи, мыть машину, смеяться или плакать, управляются различными химическими процессами. Давайте обсудим несколько примеров химии, которые происходят вокруг нас:
1. Состав телаВаше тело — завораживающее место. Углерод и кислород — два самых важных элемента тела. Другие элементы, которые присутствуют в вашем теле, — это азот, фосфор, водород, кислород, кальций, калий, сера, магний и т. Д.
2. Химия эмоцийКогда вы чувствуете себя счастливым, грустным, экстатическим, расслабленным или напряженным, в вашем теле происходит множество химических реакций. Именно из-за химических посредников, называемых нейротрансмиттерами, высвобождаемых в мозгу, вы можете влюбиться и плакать реками из-за горя.
3. Химия в производстве пищевых продуктовРастения производят пищу для себя посредством фотосинтеза; что само по себе является сложной химической реакцией.Химическая реакция, происходящая при фотосинтезе, является наиболее распространенной и жизненно важной химической реакцией. Животные также выделяют энергию для повседневной деятельности посредством аналогичных респираторных химических реакций.
6 CO 2 + 6 H 2 O + свет → C 6 H 12 O 6 + 6 O 2
Если вы когда-нибудь читали ингредиенты на бутылке с кетчупом, джемом или солеными огурцами, вы можете быть удивлены, увидев нескончаемый список химикатов.Кто они такие? Эти химические вещества называются пищевыми консервантами; которые задерживают рост микроорганизмов в пищевых продуктах. Химические пищевые консерванты не только препятствуют росту бактерий, вирусов и грибков, но также препятствуют окислению жиров, которое делает продукты прогорклыми. Наиболее распространенными химическими пищевыми консервантами являются бензоат натрия, сорбиновая кислота, сорбат калия, сорбат кальция, сорбат натрия, пропионовая кислота и соли азотистой кислоты.
8.Химия в пищеваренииВ тот момент, когда вы кладете пищу в рот, в вашем пищеварительном тракте начинается ряд различных химических реакций. Слюна содержит фермент амилазу, который отвечает за расщепление углеводов, желудок начинает вырабатывать соляную кислоту, печень выделяет желчь, и список соединений, выделяемых во время пищеварения, продолжается. Как они работают? Все эти ферменты подвергаются химическим реакциям, поэтому происходит правильное пищеварение, а также усвоение пищи.
9. Действие солнцезащитного крема Прежде чем выходить на улицу в солнечный день, вы должны нанести солнцезащитный крем. Даже принцип действия солнцезащитного крема имеет химическую основу. В солнцезащитном креме используется комбинация органических и неорганических соединений, которые действуют как фильтр для входящих ультрафиолетовых лучей. С другой стороны, солнцезащитные кремы рассеивают ультрафиолетовый свет; так что он не может глубоко проникнуть в кожу. Кремы для загара содержат сложные химические соединения, такие как оксид цинка или оксид титана, которые предотвращают проникновение УФ-лучей глубже в кожу. 10. Химия в образовании ржавчиныСо временем на ваших железных инструментах начинает образовываться оранжево-коричневая чешуйчатая пленка, называемая ржавчиной. Ржавчина железа — это реакция окисления. Атомы металлического железа подвергаются окислению и восстановлению; вызывая ржавчину. Ярко-зеленая окраска меди и потускнение серебра также являются другими повседневными примерами химических реакций. Химическое уравнение, лежащее в основе ржавчины:
Fe + O 2 + H 2 O → Fe 2 O 3 .XH 2 O
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горениеПолено горело в огне.Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в углекислый газ, водяной пар и золу.
© chrispecoraro / iStock.comПопулярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты. Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи.Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, разновидностью, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару.Аммиак — пример основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по результатам реакции и по механизму реакции. Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы.Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и, по сути, самой жизни. Сжигание топлива, плавка чугуна, изготовление стекла и глиняной посуды, пивоварение и изготовление вина и сыра — вот многие из многих примеров деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, происходящих во всех живых системах.
Следует отличать химические реакции от физических изменений.Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако, если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH).Таким образом, мы знаем, что произошло химическое изменение или реакция.
тающий ледТающий лед, водопад Нижнее Чистилище, на притоке реки Сухеган между Мон-Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Уэйн Дионн / © Отдел развития туризма и путешествий Нью-ГэмпшираИсторический обзор
Концепция химической реакции возникла около 250 лет назад. Он возник в ранних экспериментах, в которых вещества классифицировались как элементы и соединения, а также в теориях, объясняющих эти процессы.Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПервые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, который подтвердил важность количественных измерений химических процессов.В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом. Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Другим исторически значимым событием в области химических реакций было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который в начале XIX века постулировал свою атомную теорию. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ. Такой взгляд на химические реакции точно определяет текущую тему.Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций.
 Здесь находится много лесов. Очень распространен дуб. Леса из дуба занимают самую большую площадь среди всех лесов Самарского края.
Здесь находится много лесов. Очень распространен дуб. Леса из дуба занимают самую большую площадь среди всех лесов Самарского края.