Реакции, идущие без изменения степеней окисления химических элементов
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
Li2O+h3O=2LiOH;
- многие реакции разложения:
2Fe(OH)3
Fe2O3+3h3O;
- реакции этерификации:
HCOOH+Ch4OH⇄HCOOCh4+h3O.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердымиодом:
N2+O2=2NO–Q,
h3(г)+I2(т)=2HI–Q.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
4P+5O2=2P2O5+Q,
Ch5+2O2=CO2+2h3O+Q.
Гидрирование этилена — пример экзотермической реакции:
Ch3=Ch3+h3
Ch4−Ch4+Q
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
CaCO3
CaO+CO2↑−Q;
б) крекинг бутана:

Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
h3(г)+Cl2(г)=2HCl(г)+92.3кДж,
N2(г)+О2(г)=2NO(г)–90.4кДж.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
2Al(т)+3CuCl2(р−р)=3Cu(т)+2AlCl3(р−р),
СаС2(т)+2Н2О(ж)=С2Н2↑+Са(ОН)2(р−р).
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):

Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
2HgO
2Hg+O2↑,
C2h5+3O2
2CO2+2h3O.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
2KClO3
↑+h3O
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более 70% химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только вод ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
·
·
·
·
·
·
studopedia.net
Окислительно – восстановительные реакции
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, в результате переноса электронов от одного атома к другому.
Степень окисления – формальный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только от ионов.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью − положительные.
Степень окисления − формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например: N2H4 (гидразин) 
степень окисления азота – -2; валентность азота – 3.
Расчет степени окисления
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na
0; H20).2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1
Реакции с изменением, и без изменения степени окисления
Существует два типа химических реакций:
A Реакции, в которых не изменяется степень окисления элементов:
Реакции присоединения:
SO2 + Na2O  Na2SO3
Na2SO3
Реакции
разложения: Cu(OH)2 CuO
+ H2O
CuO
+ H2O
Реакции обмена: AgNO3 + KCl  AgCl
AgCl 
NaOH
+ HNO3 NaNO3 + H2O
NaNO3 + H2O
B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений:
2Mg0 + O20 2Mg+2O-2
2Mg+2O-2
2KCl+5O3-2
–t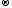 2KCl-1 + 3O20
2KCl-1 + 3O20
2KI-1 + Cl20 2KCl-1 + I20
2KCl-1 + I20
Mn+4O2 + 4HCl-1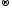
Такие реакции называются окислительно-восстановительными.
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
H20 − 2ē  2H+
2H+
S-2 − 2ē  S0
S0
Al0 − 3ē Al+3
Fe+2 − ē  Fe+3
Fe+3
 Br20
Br20Процесс присоединения электронов -− восстановление. При восстановлении степень окисления понижается.
Mn+4 + 2ē 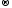 Mn+2
Mn+2
S0 + 2ē  S-2
S-2
Сr+6 +3ē 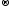 Cr+3
Cr+3
Cl20 +2ē  2Cl—
2Cl—
O20 + 4ē 
Атомы или ионы, которые в данной реакции присоединяют электроны, являются окислителями, а которые отдают электроны — восстановителями.
Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления атомов металлов равна 0, для неметаллов — (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
studfile.net
Окислительно-восстановительные реакции и реакции, протекающие без изменения степени окисления атомов
ОПЫТ 1. В две пробирки внесите по 2-3 капли раствора H2SO4. В одну из них добавить 2-3 капли раствора барий хлорида, а в другую – металлический цинк. Что представляет собой осадок, выпавший в первой пробирке? Какой газ выделяется во второй пробирке?
ОПЫТ 2. Внесите в пробирку 2-3 капли раствора HCl и 4 капли фенолфталеина. Отметив полученный цвет индикатора, добавляйте по каплям раствор натрий гидроксид до появления малиновой окраски.
В другую пробирку внесите 2-3 капли концентрированной HCl и несколько кристаллов KMnO4. Какие продукты образуются в результате реакции?
ОПЫТ 3. В одну пробирку внесите 1 микрошпатель порошка свинец (II) карбоната, а в другую столько же свинец (II) нитрата. Закрепив пробирки наклонно в металлическом штативе, нагрейте их в пламени спиртовки. Наблюдайте выделение газа в обеих пробирках.
ФОРМА ОТЧЕТА:
1. Напишите уравнения реакций для каждого из этих опытов.
2. Укажите, какие из них относятся к окислительно-восстановительным?
3. Какие вещества являются окислителями и восстановителями?
Лабораторная работа № 2
Реакции окисления-восстановления без участия среды
ОПЫТ 1. В пробирку с 3-4 каплями раствора соляной или серной кислоты опустите металлическое железо. Отметьте выделение газа.
ОПЫТ 2. В пробирку с 5-6 каплями раствора CuSO4 опустите металлический цинк. Как изменились поверхность цинка и цвет раствора?
ФОРМА ОТЧЕТА:
Напишите уравнения реакций и укажите окислитель и восстановитель.
Лабораторная работа № 3
Влияния рН среды на протекание ов реакций
ОПЫТ 1. В три пробирки внесите по 3-4 капли раствора KMnO4. В первую пробирку добавьте 2-3 капли раствора H2SO4 (рН < 7), во вторую – 2-3 капли H2O (рН ≈ 7), а в третью – 2-3 капли конц. раствора NaOH (рН > 7). Затем в каждую из пробирок внесите несколько кристаллов KNO2 или Na2SО3. Тщательно перемешайте содержимое пробирки стеклянными палочками. Отметьте изменение окраски растворов во всех пробирках.
ФОРМА ОТЧЕТА:
1. Напишите уравнения соответствующих реакций, учитывая, что фиолетовая окраска характерна для иона MnO4ˉ, зеленая – для иона MnO42‾, бесцветная – для иона Mn2+, осадок бурого цвета – MnO2.
2. Расставьте коэффициенты в уравнениях выполненных реакций методом ионно-электронных схем (метод полуреакций).
Лабораторная работа № 4
Окислительно-восстановительные реакции, в которых окислитель и восстановитель выполняют одновременно функцию среды
ОПЫТ 1. Внести в пробирку 5-8 капель H2SO4 конц. и кусочек цинка. Осторожно нагрейте содержимое пробирки и определите выделение серы (IV) оксида по его резкому характерному запаху. Через 3-5 минут появятся коллоидная сера и запах сероводорода.
ФОРМА ОТЧЕТА:
1. Запишите соответствующие уравнения реакций и расставьте коэффициенты методом полуреакции.
2. В каждом случае укажите, количество вещества (моль) серной кислоты участвовавшей в реакции.
Лабораторная работа № 5
Реакции диспропорционирования
ОПЫТ 1. В пробирку с 5-6 каплями калий нитрита добавьте 2-3 капли раствора серной кислоты. Наблюдайте выделение бурого газа.
ФОРМА ОТЧЕТА:
1. Напишите уравнение реакции взаимодействия калий нитрита с серной кислотой.
2. Напишите уравнение реакции разложения образовавшейся азотистой кислоты с получением оксидов азота NO и NO2.
3. Какая из этих реакций является окислительно-восстановительной?
4. Укажите окислитель и восстановитель.
5. ХОД ЗАНЯТИЯ:
Окислительно-восстановительными называются реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Для составления уравнений ОВР используют два метода: 1) метод электронного баланса; 2) электронно-ионный метод (метод полуреакций).
Метод электронного баланса рекомендуется использовать для реакций, протекающих в газовой или твердой фазах.
Электронно-ионный метод применяется для составления уравнений ОВР, протекающих в водных растворах. Этот метод основан на составлении двух полуреакций: для окисления восстановителя и восстановления окислителя, с последующим суммированием их в общее ионное уравнение. При использовании этого метода записывают полуреакции с ионами или молекулами сопряженных окисленной и восстановленной форм в том виде, как они существуют в растворе.
Метод полуреакций учитывает реально существующие в растворе ионы и молекулы, (слабые электролиты, газы и малорастворимые вещества записывают в молекулярном виде, сильные электролиты – в виде ионов).
Метод полуреакций учитывает роль среды. Если реакция протекает в кислой среде, то в полуреакции могут быть включены только молекулы H2O и ионы водорода Н+. На каждый недостающий атом кислорода в одной из частей полуреакции нужно добавить по одной молекуле воды, тогда во вторую часть полуреакции пойдет удвоенное число ионов водорода.
Составим уравнение реакции окисления натрий сульфита калий перманганатом в кислой среде:
5 Na2SO3 + 2 KМnO4 + 3 H2SO4 5 Na2SO4 + 2 MnSO4 + K2SO4 + 3 H2O
S O32ˉ+
H2O
– 2 ē → SO42ˉ
+ 2 H+ 5
O32ˉ+
H2O
– 2 ē → SO42ˉ
+ 2 H+ 5
MnO4ˉ + 8 H+ + 5 ē → Mn2+ + 4 H2O 2

5SO32ˉ + 5H2O + 2MnO4ˉ + 16H+ → 5SO42ˉ + 10H+ + 2Mn2+ + 8H2O
После приведения подобных членов, получим краткое ионное уравнение реакции:
5 SO32ˉ + 2 MnO4ˉ + 6 H+ → 5 SO42ˉ + 2 Mn2+ + 3 H2O
По ионному уравнению расставляют коэффициенты в молекулярном уравнении химической реакции.
Если реакция протекает в щелочной среде, то в полуреакции могут быть включены только молекулы воды и ионы ОНˉ. На каждый недостающий в одной из частей полуреакции атом кислорода нужно добавить по два иона ОНˉ, тогда во вторую части реакции пойдет уменьшенное в два раза число молекул воды.
Na2SO4 + 2 KМnO4 + 2 KOH Na2SO4 + 2 K2MnO4 + H2O
S O32ˉ
+ 2 OHˉ–
2 ē → SO42ˉ
+ H2O 1
O32ˉ
+ 2 OHˉ–
2 ē → SO42ˉ
+ H2O 1
MnO4‾ + 1 ē → MnO42ˉ 2

SO32ˉ + 2 OHˉ + 2 MnO4ˉ → SO42ˉ + H2O + 2 MnO42ˉ
Если реакция протекает в нейтральной среде, то в полуреакции могут быть включены молекулы воды и ионы Н+,ОНˉ.
Таким образом, при составлении уравнений ОВР методом полуреакций следует придерживаться такого порядка:
1) составить схемы полуреакций окисления и восстановления с указанием исходных и образующихся в условиях реакции ионов и молекул;
2) уравнять число атомов каждого элемента в левой и правой части полуреакции;
3) уравнять суммарное число зарядов в обеих частях каждой полуреакции, для чего прибавить или отнять необходимое число элетронов;
4) подобрать множители для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении;
5) сложить уравнения полуреакций и написать суммарное ионное уравнение;
6) расставить коэффициенты в молекулярном уравнении реакции.
6. вопросы ДЛЯ САМОконтроля знаний:
1. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители.
2. Типы ОВР (межмолекулярные, внутримолекулярные, диспропорционирования). Методы расстановки коэффициентов в уравнениях ОВР.
3. Влияние кислотности среды на протекание ОВР. Написать уравнения реакций взаимодействия KMnO4 с KNO2 в различных средах (кислой, нейтральной и щелочной), расставить коэффициенты в соответствующих уравнениях реакций методом полуреакций.
4. Закончите уравнения следующих ОВ реакций и расставьте коэффициенты методом полуреакции:
а) KMnO4 +FeSO4 + H2SO4 →
б) KMnO4 +K2SО3 + KOH →
в) KMnO4 + H2O2 + H2SO4 →
г) K2Cr2O7 + H2S + H2SO4 →
д) K2Cr2O7 + KI + HCl →
7. ЛИТЕРАТУРА
ОСНОВНАЯ:
1. Конспект лекций.
2. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – М.: Высш. шк., 2005. – с. 131-139;
3. Ленский, А.С. Введение в бионеорганическую и биофизическую химию: Учебн. пособие для студ. мед. вузов / А.С. Ленский. − М.: Высш. шк, 1989. – с. 231-241.
ДОПОЛНИТЕЛЬНАЯ:
Суворов, А.В.Общая химия. / А.В. Суворов, А.Б. Никольский. – СПб: Химия, 1994 г. – с. 271-287;
Зеленин, К.Н. Химия. / К.Н. Зеленин. – СПб: Специальная литература, 1997 г. – с. 184-187.
Авторы: Зав. кафедрой, доцент, к.х.н. Лысенкова А.В., доцент, к.х.н. Филиппова В.А., ст. преподаватели Прищепова Л.В. Чернышева Л.В., Одинцова М.В., ассистенты Короткова К.И., Перминова Е.А
06.09.2010
Министерство здравоохранения Республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра общей и биоорганической химии
Обсуждено на заседании кафедры ___________________
Протокол №_____________________________________
studfile.net
Внеклассный урок — Окислительно-восстановительные реакции
Окислительно-восстановительные реакции
По признаку изменения степеней окисления атомов, входящих в состав реагирующих веществ, химические реакции подразделяются на два типа.
1) Реакции, протекающие без изменения степеней окисления атомов.
Например:
+2+4-2 t +2 -2 +4 -2
CaCO3 = CaO + CO2
В этой реакции степень окисления каждого из атомов осталась без изменения.
2) Реакции, протекающие с изменением степеней окисления атомов.
Например:
0 +2 -1 0 +2 -1
Zn + CuCl2 = Cu + ZnCl2
В этой реакции степени окисления атомов цинка и меди изменились.
Реакции, протекающие с изменением степеней окисления атомов всех или некоторых элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. |
Окислительно-восстановительные реакции – наиболее распространенные химические реакции.
На практике окислительно-восстановительная реакция – это присоединение или отдача электронов. Одни атомы (ионы, молекулы) отдают другим или принимают от них электроны.
Окисление.
Процесс отдачи электронов атомом, ионом или молекулой называется окислением.
При отдаче электронов степень окисления атома повышается.
Вещество, чьи атомы, ионы или молекулы отдают электроны, называется восстановителем.
В нашем примере атомы в степени окисления 0 перешли в атомы со степенью окисления +2. То есть произошел процесс окисления. При этом атом цинка, отдавший два электрона, является восстановителем (он повысил степень окисления с 0 до +2).
Процесс окисления записывают электронным уравнением, в котором указывают изменение степени окисления атомов и число электронов, отданных восстановителем.
Например:
0 +2 0
Zn – 2e– = Zn (окисление, Zn – восстановитель).
Восстановление.
Процесс присоединения электронов называют восстановлением.
При присоединении электронов степень окисления атома понижается.
Вещество, чьи атомы, ионы или молекулы присоединяют электроны, называют окислителем.
В нашем примере переход атомов меди со степенью окисления +2 в атомы со степенью окисления 0 является процессом восстановления. При этом атом меди со степенью окисления +2, принимая два электрона, понижает степень окисления от +2 до 0 и является окислителем.
Процесс окисления тоже записывают электронным уравнением:
+2 0 0
Cu + 2e– = Cu (восстановление, Cu – окислитель).
Процесс восстановления и процесс окисления нераздельны и протекают одновременно.
0 +2 0 +2
Zn + CuCl2 = Cu + ZnCl2
| |
восстановитель окислитель
окисляется восстанавливается
raal100.narod.ru
окислительные-восстановительные реакции (на примере реакции кислоты с металлом) помогите пожалуйста
Окислительно-восстановительные реакции <a rel=»nofollow» href=»http://www.chem.msu.su/rus/school/zhukov/18.html» target=»_blank»>http://www.chem.msu.su/rus/school/zhukov/18.html</a> Все химические реакции подразделяются на две группы: протекающие без изменения степеней окисления атомов, например: 2 KOH + h3SO4 = K2SO4 + 2 h3O, окислительно–восстановительные реакции, идущие с изменением степени окисления, например: 4 N3-h4 + 3 O2o = 2 N2o + 6 h3O2– , 2 Ko + 2 h3+O = 2K+OH + h3o, 2 Ag+N5+O32– 2 Ago + 2 N4+O2 + O2o. Химические реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно–восстановительными. Окисление – это процесс отдачи электронов атомом, молекулой или ионом: Nao – 1e = Na+; Fe2+ – e = Fe3+; h3o – 2e = 2H+; 2 Br– – 2e = Br2o. Восстановление – это процесс присоединения электронов атомом, молекулой или ионом: So + 2e = S2– ; Cr3+ + e = Cr2+; Cl2o + 2e = 2Cl– ; Mn7+ + 5e =Mn2+. Атомы, молекулы или ионы, принимающие электроны, называются окислителями. Восстановителями являются атомы, молекулы или ионы, отдающие электроны. Принимая электроны окислитель в процессе протекания реакции восстанавливается, а восстановитель – окисляется. Окисление всегда сопровождается восстановлением и наоборот. Таким образом, число электронов, отдаваемых восстановителем, всегда равно числу электронов, принимаемых окислителем. <a rel=»nofollow» href=»http://onx.distant» target=»_blank»>http://onx.distant</a>. ru/posobie-1/chemistry/part_7.htm
Окислительно-восстановительные реакции (ОВР) — такие, в ходе которых изменяются степени окисления некоторых элементов. Для подбора коэффициентов в уравнениях таких реакций используют метод «электронного баланса. S + 6HNO3 = h3SO4 + 6NO2 + 2h3O Электронный баланс: S(0) — 6e = S(+6)———x1 окисление, восстановитель N(+5) + 1e = N(+4)——x6 восстановление, окиислитель
touch.otvet.mail.ru
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Классификация химических реакций в неорганической и органической химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Al+
H=
Mg+
He
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
С(графит)⇄С(алмаз)
S(ромбическая)⇄S(моноклинная)
Р(белый)⇄Р(красный)
Sn(белоеолово)⇄Sn(сероеолово)
3О2(кислород)⇄2О3(озон).
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.

Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.

3. Изомеризация алкинов (реакция А. Е. Фаворского).

4. Изомеризация галогеналканов (А. Е. Фаворский).

5. Изомеризация цианата аммония при нагревании.

Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
S+O2=SO2 — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
2SO2+O2
2SO3 — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
SO3+h3O=h3SO4 — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
4NO2+O2+2h3O=4HNO3.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
Ch3
Ch3+h3
Ch4
Ch4;
2) реакция гидратации — присоединение воды:
Ch3
Ch3+h3O
;
3) реакция полимеризации:
| (−Ch3−Ch3−)n |
| полиэтилен |
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
2HgO
2Hg+O2↑ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
2KNO3
2KNO2+O2↑ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
2KMnO4
K2MnO4+MnO2+O2↑ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
C2H5OH
Ch3=Ch3+h3O;
2) реакция дегидрирования (отщепления водорода) этана:
Ch4—Ch4
Ch3=Ch3+h3↑;
3) реакция крекинга (расщепления) пропана:
Ch4−Ch3Ch4
Ch3=Ch3+Ch5↑.
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2Na+2h3O=2NaOH+h3↑
2) взаимодействие металлов с кислотами в растворе:
Zn+2HCl=ZnCl2+h3↑;
3) взаимодействие металлов с солями в растворе:
Fe+CuSO4=FeSO4+Cu;
4) металлотермия:
2Al+Cr2O3
Al2O3+2Cr.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Ch5+Cl2
+HCl,
Ch4Cl+Cl2→
| Ch3Cl2 |
| дихлорметан |
+HCl,
Ch3Cl2+Cl2→
| CHCl3 |
| трихлорметан |
+HCl,
CHCl3+Cl2→
| CCl4 |
| тетрахлорметан |
+HCl.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
C6H6Br2
| C6H5Br |
| бромбензол |
+HBr.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
C6H6+
| C6H5NO2 |
| нитробензол |
+h3O
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2О).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
NaOH+HNO3=NaNO3+h3O
или в ионном виде:
OH–+H+=h3O;
2) реакция между щелочью и солью, идущая с образованием газа:
2Nh5Cl+Ca(OH)2=CaCl2+2Nh4↑+2h3O
или в ионном виде:
Nh5++OH–=Nh4↑+h3O;
3) реакция между щелочью и солью, идущая с образованием осадка:
CuSO4+2KOH=Cu(OH)2↓+K2SO4
или в ионном виде:
Cu2++2OH−=Cu(OH)2↓
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — h3O:
Ch4COOH+NaOH⇄NaCh4COO+h3O
или
Ch4COOH+OH−⇄Ch4COO−+h3O;
2) реакция, идущая с образованием газа:
2Ch4COOH+CaCO3=2Ch4COO–+Ca2++CO2↑+h3O;
3) реакция, идущая с образованием осадка:
2Ch4COOH+K2SiO3=2KCh4COO+h3SiO3↓
или
2Ch4COOH+SiO3−=2Ch4COO−+h3SiO3↓.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.
+
+SO4−2=
SO4+
↑
−2 |
| восстановитель |
| восстановление |
| → |
2.
+
=
−2 |
| восстановитель |
|4|2
| восстановление |
| → |
|2|1
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
+6h3
O4(k)=
(SO4)3+3
O2+6h3O
−3 |
| восстановитель |
|2
| восстановление |
| → |
|3
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
Ch4−
+ |
| уксусный альдегид |
| Ch4−
|
| этиловый спирт |
| восстановление |
| → |
|1
−2 |
| восстановитель |
2
|1
2. Альдегиды окисляются в соответствующие кислоты:
Ch4−
+
|
| уксусный альдегид |
Ch4−
+2 ↓ |
| этиловый спирт |
−2 |
| восстановитель |
|1
2 +2 |
| окислитель |
| восстановление |
| → |
2
|1
studopedia.net