Свойства тел в разных агрегатных состояниях
Агрегатные состояния вещества (от лат. aggrego — присоединяю) — это состояния одного и того же вещества в различных интервалах (промежутках) температур и давлений.
Агрегатными состояниями принято считать газообразное, жидкое и твердое.
Самыми простыми примерами существования одного и того же вещества в этих трех агрегатных состояниях, которые наблюдаются в повседневной жизни, являются лед, вода и водяной пар. Невидимый водяной пар всегда присутствует и в окружающем нас воздухе. Вода существует в интервале температур от 0°С до 100°С, лед — при температуре ниже 0°С. При температуре выше 100 °С и нормальном атмосферном давлении молекулы воды существуют только в газообразном состоянии — в виде водяного пара. Вода, лед и водяной пар — это одно и то же вещество с химической формулой Н20.
Многие вещества в обыденной жизни мы наблюдаем только в одном из агрегатных состояний. Так, кислород в окружающем нас воздухе представляет собой газ. Но при температуре -193 °С он превращается в жидкость. Охладив эту жидкость до -219 °С, мы получим твердый кислород. И наоборот, железо в обычных условиях твердое. Однако при температуре 1535 °С железо плавится и превращается в жидкость. Над расплавленным железом будет находиться газ — пар из атомов железа.
Различные агрегатные состояния существуют у каждого вещества. Отличаются эти вещества не молекулами, а тем, как эти молекулы расположены и как движутся. Расположение молекул воды в трех агрегатных состояниях показано на рис. 2.6.
Переход из одного агрегатного состояния в другое. При определенных условиях вещества могут переходить из одного агрегатного состояния в другое. Все возможные при этом превращения отображены на рис. 2.7.
Всего различают шесть процессов, при которых происходят агрегатные превращения вещества.
Переход вещества из твердого (кристаллического) состояния в жидкое называется плавлением, обратный процесс называется кристаллизацией, илиотвердеванием. Пример плавления — таяние льда, обратный процесс происходит при замерзании воды.
Переход вещества из жидкого состояния в газообразное называетсяпарообразованием, обратный процесс называется конденсацией. Пример парообразования — испарение воды, обратный процесс можно наблюдать при выпадении росы.
Переход вещества из твердого состояния сразу в газообразное (минуя жидкое) называется сублимацией, или возгонкой, обратный процесс называетсядесублимацией. Например, графит можно нагреть до тысячи, двух тысяч и даже трех тысяч градусов и, тем не менее, в жидкость он не превратится: он будет сублимироваться, т. е. из твердого состояния сразу переходить в газообразное. Непосредственно в газообразное состояние (минуя жидкое) переходит и так называемый сухой лед (твердый оксид углерода С02), который можно увидеть в контейнерах для транспортировки мороженого. Все запахи, которыми обладают твердые тела (например, нафталин), также обусловлены возгонкой: вылетая из твердого тела, молекулы образуют над ним газ (или пар), обладающий запахом.
Примером десублимации является образование на окнах зимой узоров из кристалликов льда. Эти красивые узоры образуются при десублимации водяного пара, находящегося в воздухе.
Переходы вещества из одного агрегатного состояния в другое играют важную роль не только в природе, но и в технике. Так, воду, превращенную в пар, можно использовать в паровых турбинах на электростанциях. Из расплавленных металлов на заводах получают различные сплавы: сталь, чугун, латунь и т. д. Для понимания этих процессов надо знать, что происходит с веществом при изменении его агрегатного состояния и при каких условиях это изменение возможно.
ibrain.kz
Свойства веществ в разных агрегатных состояниях
Состояние | Свойства |
Газообразное | 1. Способность принимать объем и форму сосуда. 2. Сжимаемость. 3. Быстрая диффузия (хаотичное движение молекул). 4. Екинетич. > Епотенц. |
Жидкое | 1. Способность принимать форму той части сосуда, которую занимает вещество. 2. Неспособность расширяться до заполнения сосуда. 3. Незначительная сжимаемость. 4. Медленная диффузия. 5. Текучесть. 6. Екинетич. = Епотенц. |
Твердое | 1. Способность сохранять свойственную форму и объем. 2. Незначительная сжимаемость (под давлением). 3. Очень медленная диффузия за счет колебательных движений частиц. 4. Отсутствие текучести. 5. Екинетич. < Епотенц. |
Агрегатное состояние вещества определяется силами, действующими между молекулами, расстоянием между частицами и характером их движения.
В твердом состоянии частицы занимают определенное положение относительно друг друга. Оно обладает низкой сжимаемостью, механической прочностью, поскольку молекулы не обладают свободой движения, а только колебания. Молекулы, атомы или ионы, образующие твердое вещество, называют структурными единицами. Твердые вещества делятся на аморфные и кристаллические (табл. 27).
Таблица 33
Сравнительная характеристика аморфных и кристаллических веществ
Вещество | Характеристика |
Аморфное | 1. Ближний порядок расположения частиц. 2. Изотропность физических свойств. 3. Отсутствие конкретной точки плавления. 4. Термодинамическая нестабильность (большой запас внутренней энергии). 5. Текучесть. Примеры: янтарь, стекло, органические полимеры и др. |
Кристаллическое | 1. Дальний порядок расположения частиц. 2. Анизотропность физических свойств. 3. Конкретная температура плавления. 4. Термодинамическая устойчивость (малый запас внутренней энергии). 5. Есть элементы симметрии. Примеры: металлы, сплавы, твердые соли, углерод (алмаз, графит) и др. |
Кристаллические вещества плавятся при строго определенной температуре (Тпл), аморфные – не имеют резко выраженной температуры плавления; при нагревании они размягчаются (характеризуются интервалом размягчения) и переходят в жидкое или вязкотекучие состояние. Внутреннее строение аморфных веществ характеризуется беспорядочным расположением молекул. Кристаллическое состояние вещества предполагает правильное расположение в пространстве частиц, составляющих кристалл, и образованием кристаллической (пространственной) решетки. Основной особенностью кристаллических тел является их анизотропия — неодинаковость свойств (тепло-, электропроводность, механическая прочность, скорость растворения и т.д.) по разным направлениям, в то время как аморфные тела
изотропны.Твердые кристаллы — трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка — представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз.
Основные параметры кристаллической решетки:
Энергия кристаллической решетки (Екр., кДж/моль) – это энергия, которая выделяется при образовании 1 моль кристалла из микрочастиц (атомов, молекул, ионов), находящихся в газообразном состоянии и удаленных друг от друга на расстояние, исключающее их взаимодействие.
Константа кристаллической решетки (d, [A
Координационное число (к.ч.) – число частиц, окружающих в пространстве центральную частицу, связанных с ней химической связью.
Точки, в которых размещены частицы кристалла, называются узлами кристаллической решетки
Несмотря на многообразие форм кристаллов, их можно классифицировать. Систематизация форм кристаллов была введена А. В. Гадолиным (1867 г.), она основана на особенностях их симметрии. В соответствии с геометрической формой кристаллов возможны следующие их системы (сингонии): кубическая, тетрагональная, орторомбическая, моноклинная, триклинная, гексагональная и ромбоэдрическая (рис. 18).
Одно и то же вещество может иметь различные кристаллические формы, которые отличаются по внутреннему строению, а значит, и по физико-химическим свойствам. Такое явление называется
полиморфизмом. Изоморфизм – два разных по природе вещества образуют кристаллы одинаковой структуры. Такие вещества могут замещать друг друга в кристаллической решетке, образуя смешанные кристаллы. 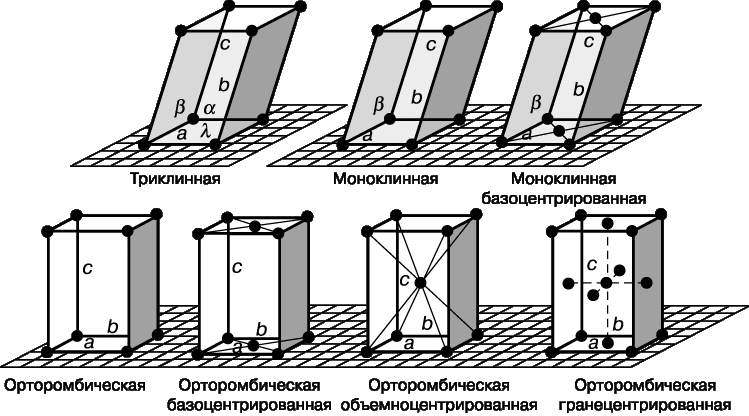
Рис. 18. Основные системы кристаллов.
В зависимости от вида частиц, находящихся в узлах кристаллической решетки и типа связей между ними кристаллы бывают четырех типов: ионные, атомные, молекулярные и металлические (рис.19).
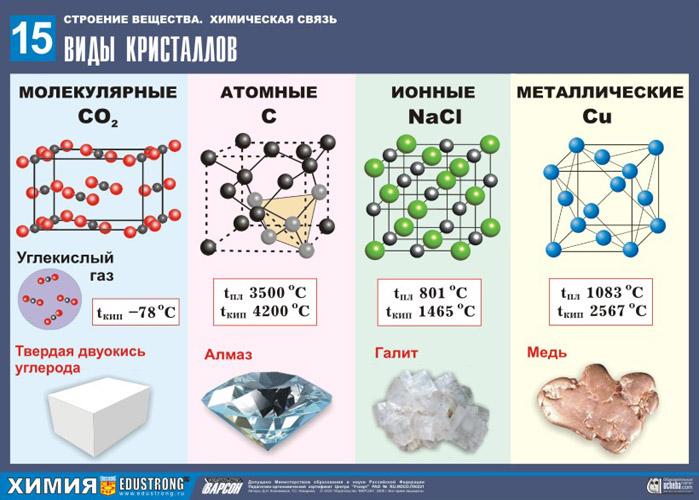
Рис. 19. Виды кристаллов
Характеристика кристаллических решеток представлена в табл. 34.
Таблица 34
Взаимодействие молекул. Агрегатные состояния вещества. Видеоурок. Физика 7 Класс
Как известно, молекула – это наименьшая частица, которая сохраняет свойства вещества. Однако не все свойства можно так описать: например, и лёд, и вода состоят из одних и тех же молекул воды (Рис. 1). Значит, знать, из каких молекул состоит вещество, бывает недостаточно, чтобы описать все его свойства.

Рис. 1. Разные свойства одного вещества
Вспомним, например, конструктор «Лего». Высыпав его из коробки, мы просто получим кучу деталей конструктора. И уже из этих деталей мы можем собрать или автомобиль, или дом. Результат будет зависеть от того, как эти детали будут соединены.
Аналогично и с веществом (Рис. 2). Чтобы описать его, нужно не только указать молекулярный или атомный состав, но еще и то, как частицы соединены, как взаимодействуют. Ярким примером этому являются графит и алмаз, свойства которых очень сильно отличаются (Рис. 3.). Но состоят они из одних и тех же атомов углерода.

Рис. 2. Разнообразие веществ
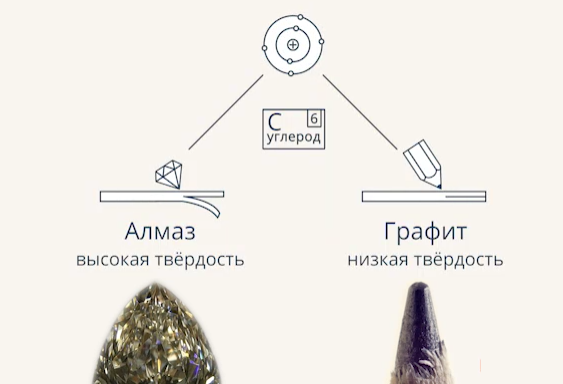
Рис. 3. Свойства алмаза и графита
Аллотропия
Свойство, когда разные простые вещества состоят из одних и тех же частиц, называется аллотропией (Рис. 4). Сами эти вещества называются аллотропными модификациями. Наибольшее число аллотропных модификаций имеет углерод. Своё название атом получил от вещества, которое состоит из этих атомов, – угля. Однако из тех же самых атомов состоит и графит, и сажа, и даже алмаз (Рис. 5). Просто в этих веществах атомы по-разному расположены и по-разному взаимодействуют. И получается, что их свойства существенно отличаются: алмаз – самый крепкий минерал в природе, из него делают инструменты, которые могут разрезать практически любой материал. А вот графит достаточно хрупкий, он легко разрушается, и графитовый стержень легко оставляет след на листе бумаги.

Рис. 4. Аллотропия

Рис. 5. Структура алмаза и графита
Кроме природных веществ, ученые научились искусственно создавать материалы, различным образом размещая атомы углерода. Такие материалы составляют основу наноматериалов (Рис. 6): это фулерен, углеродные нанотрубки и нановолокна.
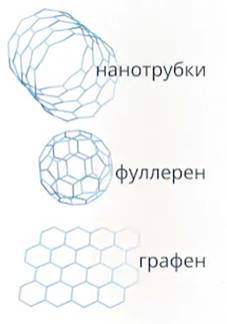
Рис. 6. Наноматериалы
Конечно, другие вещества также могут иметь аллотропные модификации. На данный момент известно более 400 материалов, которые являются аллотропными модификациями различных простых веществ.
Рассмотрим еще один пример: после дождя на асфальте появилась лужа (Рис. 7). Мы понимаем, что она состоит из молекул воды 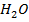 . Также мы понимаем, что если случайно туда наступить, то нога промокнет. Но если температура опустится ниже нуля, то тогда лужа замерзнет. И по ней можно будет пройтись и даже прокатиться. Получается, что свойства изменились, это теперь другое вещество? Нет, вещество осталось тем же, лужа по-прежнему состоит молекул воды
. Также мы понимаем, что если случайно туда наступить, то нога промокнет. Но если температура опустится ниже нуля, то тогда лужа замерзнет. И по ней можно будет пройтись и даже прокатиться. Получается, что свойства изменились, это теперь другое вещество? Нет, вещество осталось тем же, лужа по-прежнему состоит молекул воды 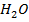 . А если вода в луже испарится и превратится в пар – это всё равно будут те же молекулы (Рис. 8). Получается, что лёд, вода, пар состоят из одних и тех же частиц, это одно вещество (Рис. 9). Но молекулы в них по-разному расположены и по-разному взаимодействуют. Вещество находится в различных состояниях. Это как человек, который может быть сонным, веселым, или, например, расстроенным (Рис. 10). Он будет выглядеть по-разному и вести себя по-другому, но будет оставаться самим собой.
. А если вода в луже испарится и превратится в пар – это всё равно будут те же молекулы (Рис. 8). Получается, что лёд, вода, пар состоят из одних и тех же частиц, это одно вещество (Рис. 9). Но молекулы в них по-разному расположены и по-разному взаимодействуют. Вещество находится в различных состояниях. Это как человек, который может быть сонным, веселым, или, например, расстроенным (Рис. 10). Он будет выглядеть по-разному и вести себя по-другому, но будет оставаться самим собой.

Рис. 7. Лужа

Рис. 8. Испарение воды в луже
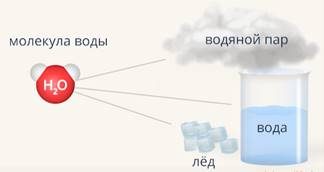
Рис. 9. Молекулы воды в разных агрегатных состояниях

Рис. 10. Состояния вещества можно сравнить с настроением человека
Для таких состояний вещества, когда их свойства существенно отличаются, есть специальный термин. Их называют агрегатными состояниями вещества. Выделяют три основных агрегатных состояния: твердое тело, жидкость и газ.
Другие состояния вещества
Что такое огонь? На жидкость и твёрдое тело не похоже. Оказывается, это газ. Но здесь он находится в особом состоянии, и его свойства сильно отличаются от привычного нам газа. При очень высоких температурах молекулы распадаются на составляющие. Это атомы, электроны, ионы, о которых вы подробнее узнаете в старших классах. Именно из этих частиц состоит плазма, ещё одно состояние вещества (Рис. 11).

Рис. 11. Пламя представляет собой плазму
Пламя свечи, костра – все это примеры плазмы, которые каждый из нас видел.
Вещества, составляющие Солнце, также находятся в состоянии плазмы, плазма присутствует в атмосфере, когда происходит полярное сияние. Ну а в технике на свойствах плазмы основан принцип работы, например, плазменных телевизоров.
Также есть неустойчивые состояние вещества, такие как перегретая и переохлажденная жидкость. Эти состояния достигаются, когда при определенных условиях жидкость нагревают выше её температуры кипения или же охлаждают ниже температуры плавления. При этом она все равно остается жидкостью. Но при незначительном воздействии на неё жидкость резко переходит в газообразное или твердое состояние соответственно.

Рис. 12. Переохлажденная и перегретая жидкость
В нашем примере: лед – твердое тело, вода – жидкость, а водяной пар – газ (Рис. 13). Другие вещества также могут находиться в каждом из этих агрегатных состояний. В итоге получается, что свойства вещества задаются не только составом молекул, но и агрегатным состоянием. А само агрегатное состояние определяется расположением молекул и их движением.

Рис. 13. Агрегатные состояния вещества
«Пар», «газ», «лёд», «вода» и прочие названия
Трудно сказать, чем отличается пар от газа. Но различие, очевидно, есть: ведь из кипящего чайника выходит именно пар, а на плите горит именно газ. Чтобы правильно применять эти термины, обратимся к их определениям. Газ – это агрегатное состояние вещества. А пар – это газ, который испарился из жидкости. Соответственно, вещества принято называть так: если при обычных природных условиях вещество находится в жидком или твердом состоянии, то его газообразное состояние называют паром. Например, испарившуюся воду называют водяными парами, испарившуюся медь – парами меди. Ну а если в обычных условиях вещество находится в газообразном состоянии, то его называют просто газом. Например, кислород, азот, неон – это все газы, парами их не называют.
Названия некоторых агрегатных состояний веществ сложились исторически. Например, человек мог встретить в природе и лёд, и воду. Поэтому два состояния одного и того же вещества имеют разное название. А вот металлы в природе обычно встречаются только в твердом состоянии и имеют одно название. Если хотят сказать про их жидкое или газообразное состояние, то тогда добавляет слово «жидкий» или «пар». Например, «жидкое золото» или «пары ртути».
Похожую ситуацию мы увидим, если проанализируем названия животных. Например, в случае с домашними животными очень часто бывает важен не только вид животного, но его пол и возраст, поэтому для самки, самца и детеныша сформировались разные названия. Например, бык-корова-теленок, петух-курица-цыпленок. Если в лесу человек встретит, например, медведя, то ему в принципе неважно, какого он пола, поэтому названия особей имеют один корень: медведь-медведица-медвежонок.
Кстати, название вещества может также пойти и от внешнего вида. Например, углекислый газ в твердом состоянии называют «сухим льдом», поскольку внешне он похож на лёд (Рис. 14).

Рис. 14. Сухой лед
Поговорим подробнее о каждом агрегатном состоянии. Начнем с твердого тела. Керамическая чашка, металлическая ложка, пластмассовый или алюминиевый корпус телефона – все это твердые тела. Если их не разбивать и не ломать, то тогда они будут сохранять свою форму. Получится, что твердое тело – это агрегатное состояние, которому свойственно сохранение формы и объема. Конечно, если не будет сильных воздействий.

Рис. 15. Примеры твердых веществ
Положение молекул в твердом теле можно представить, как строй солдат (Рис. 16). Они находятся в строго установленных местах, их положение относительно друг друга практически не меняется. Происходит это благодаря взаимодействию частиц: они одновременно и отталкиваются, и притягиваются. Силы притяжения и отталкивания уравновешиваются, поэтому частицы практически не меняют своего положения.

Рис. 16. Положение молекул в твердом теле
Что имеется в виду? Если поста
interneturok.ru
Агрегатные состояния вещества
Агрегатные состояния вещества.
15 мин самостоятельная работа.
Число, классная работа.
До слайда 2 задайте вопросы детям:
(слайд 1)
Существует три состояния вещества — твердое, жидкое и газообразное.
Твердое (камень, лед, дерево, железо)
Газообразное (пар, туман, азот, фтор)
Жидкое (вода, бензин, нефть, керосин)
Нет, разница только в расстоянии между молекулами
(слайд 2)
→ тема урока Агрегатные состояния вещества. Запишем в тетради тему урока.
Как мы уже сказали, Существует три состояния вещества — твердое, жидкое и газообразное.
Так, вода, при определенных значениях температуры может быть твердой (лед), жидкой (вода), газообразной (пар). Молекулы вещества, как мы уже с вами сказали, одинаковые. А что меняется у вещества при переходе из одного агрегатного состояния в другое?
Изменение агрегатного состояния вещества всегда связано с выделением или поглощением некоторого количества теплоты. Всего различают 6 процессов при которых происходит переход вещества из одного агрегатного состояния в другое, это: плавление и кристаллизация, парообразование и конденсация, сублимация и десублимация. Но об этих процессах мы с вами поговорим на следующем уроке.
(слайд 3) Агрегатное состояние вещества определяется:
1.Расположением частиц
2.Характером их движения и взаимодействия
Нет
(слайд 4) таблицу переносим в тетрадь.
Таблицу оформляйте в режиме: вопрос учителя →рассуждения →запись в тетради.
1. Газ
Каково расстояние между молекулами газа? — велико
Какова сила притяжения между частицами — слабая
Как движутся частицы в газах? Характер движения частиц – беспорядочно и поступательно
Поступательное движение — движение при котором в любой момент времени все точки одного тела движутся одинаково.
Меняет или сохраняет газ Объем? – меняет. Если мы сжимаем газ, то всего на всего уменьшаем расстояния между частицами
Меняет или сохраняет газ форму? Аналогично можно сказать и про форму газа, — меняет. Расстояния между частицами велики, поэтому они не притягиваются друг к другу.
Скорость диффузии – быстро, т.к. расстояния между частицами оч.велики.
Диффузия это проникновение молекул одного вещества, между молекулами другого вещества. Самым известным примером диффузии является перемешивание газов (аромат духов смешивается с кислородом и его можно почувствовать стоя вдали от человека, надушившегося ими).
2. Жидкость.
Каково расстояние между молекулами газа – ближе, чем в газах
Какова сила притяжения между частицами — велика
Характер движения частиц – колебания и скачки.
Меняет или сохраняет Объем – сохраняет. Объем жидкости изменить чрезвычайно трудно. Это можно проверить, если набрать воду в насос, закрыть отверстие внизу и попытаться сжать воду. Вряд ли ваши попытки окажутся удачными. Это означает, что жидкость сохраняет собственный объем. Почему жидкость сохраняет объем? – т.к. расстояния между частицами малы.
Меняет ли жидкость форму? Почему? Форму жидкость – меняет, т.к. частицы не только колеблются, но и совершают «скачки».
Как быстро протекает диффузия в жидкостях? Скорость диффузии – медленно, т.к. расстояния между частицами малы
Если в воду капнуть чернил, то вода через некоторое время, станет равномерного цвета или заварка и кипяток.
3. Твердое тело.
Каково расстояние между молекулами газа – равно размеру частиц
Какова сила притяжения между частицами – очень велика
Характер движения частиц – колебания
Меняет или сохраняет объем – сохраняет. Почему? Т.к. расстояния между частицами малы.
Меняет ли твердое тело форму? Почему? твердое тело – сохраняет, т.к. частицы только колеблются.
Как быстро протекает диффузия в твердых телах? Скорость диффузии – очень медленно, т.к. расстояния между частицами очень малы. (пластина свинца и золота под прессом 5 лет)
Процесс перехода вида: «твердое вещество — жидкость — газ» связан с увеличением внутренней энергии. Значит, в таких превращениях вещество поглощает тепло, и кинетическая энергия движения молекул возрастает. А в переходе вида «газ — жидкость — твердое вещество» процесс перехода идет с выделением тепла. При этом скорость молекул и внутренняя энергия – уменьшаются.
videouroki.net
Агрегатные состояния вещества.
Коллоидная химия
Агрегатные состояния вещества.
В этом разделе мы рассмотрим агрегатные состояния, в которых пребывает окружающая нас материя и силы взаимодействия между частицами вещества, свойственные каждому из агрегатных состояний.
Принято считать, что вещество может находиться в одном из трёх агрегатных состояниях:
1. Состояние твёрдого тела,
2. Жидкое состояние и
3. Газообразное состояние.
Часто выделяют четвёртое агрегатное состояние – плазму.
Иногда, состояние плазмы считают одним из видов газообразного состояния.
Плазма — частично или полностью ионизированный газ, чаще всего существующий при высоких температурах.
Плазма является самым распространённым состоянием вещества во вселенной, поскоьку материя звёд пребывает именно в этом состоянии.
Для каждого агрегатного состояния характерны особенности в характере взаимодействия между частицами вещества, что влияет на его физические и химические свойства.
Каждое вещество может пребывать в разных агрегатных состояниях. При достаточно низких температурах все вещества находятся в твёрдом состоянии. Но по мере нагрева они становятся жидкостями, затем газами. При дальнейшем нагревании они ионизируются (атомы теряют часть своих электронов) и переходят в состояние плазмы.
Газ
Газообразное состояние (от нидерл. gas, восходит к др.-греч. Χάος) характеризующееся очень слабыми связями между составляющими его частицами.
Образующие газ молекулы или атомы хаотически движутся и при этом преобладающую часть времени находятся на больших (в сравнении с их размерами) растояниях друг от друга. Вследствие этого силы взаимодействия между частицами газа пренебрежимо малы.
Основной особенностью газа является то, что он заполняет все доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ — изотропное вещество, то есть его свойства не зависят от направления.
При отсутствии сил тяготения давление во всех точках газа одинаково. В поле сил тяготения плотность и давление не одинаковы в каждой точке, уменьшаясь с высотой. Соответственно, в поле сил тяжести смесь газов становится неоднородной. Тяжелые газы имеют тенденцию оседать ниже, а более легкие — подниматься вверх.
Газ имеет высокую сжимаемость — при увеличении давления возрастает его плотность. При повышении температуры расширяются.
При сжатии газ может перейти в жидкость, но конденсация происходит не при любой температуре, а при температуре, ниже критической температуры. Критическая температура является характеристикой конкретного газа и зависит от сил взаимодействия между его молекулами. Так, например, газ гелий можно ожижить только при температуре, ниже от 4,2 К.
Существуют газы, которые при охлаждении переходят в твердое тело, минуя жидкую фазу. Превращения жидкости в газ называется испарением, а непосредственное превращение твердого тела в газ — сублимацией.
Твёрдое тело
Состояние твёрдого тела в сравнении с другими агрегатными состояниями характеризуется стабильностью формы.
Различают кристаллические и аморфные твёрдые тела.
Кристаллическое состояние вещества
Стабильность формы твёрдых тел связана с тем, что большинство, находящихся в твёрдом состоянии имеет кристалическое строение.
В этом случае расстояния между частицами вещества малы, а силы взаимодействия между ними велики, что и определяет стабильность формы.
В кристаллическом строении многих твёрдых тел легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов и пр.) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствии различного отражения ими света.
В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа.
Формы кристаллов
Каждое вещество образует кристаллы совершенно определённой формы.
Разнообразие кристаллических форм может быть сведено к семи группам:
1. Триклинная (параллелепипед),
2. Моноклинная (призма с параллелограммом в основании),
3. Ромбическая (прямоугольный параллелепипед),
4. Тетрагональная (прямоугольный параллелепипед с квадратом в основании),
5. Тригональная,
6. Гексагональная (призма с основанием правильного центрированного шестиугольника),
7. Кубическая (куб).
Многие вещества, в частности железо, медь, алмаз, хлорид натрия кристализуются в кубической системе. Простейшими формами этой системы являются куб, октаэдр, тетраэдр.
Магний, цинк, лёд, кварц кристализуются в гексагональной системе. Основные формы этой системы – шестигранные призмы и бипирамида.
Природные кристаллы, а также кристаллы, получаемые искусственным путём, редко в точности соответствуют теоретическим формам. Обычно при затвердевании расплавленного вещества кристаллы срастаются вместе и потому форма каждого из них оказывается не вполне правильной.
Однако как бы неравномерно не происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла у одного и того же вещества остаются постоянными.
Анизотропия
Особенности кристаллических тел не ограничиваются только формой кристаллов. Хотя вещество в кристалле совершенно однородно, многие из его физических свойств – прочность, теплопроводность, отношение к свету и др. – не всегда одинаковы по различным направлениям внутри кристалла. Эта важная особенность кристаллических веществ называется анизотропией.
Внутреннее строение кристаллов. Кристаллические решётки.
Внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, — молекул, атомов или ионов.
Это расположение можно представить в виде кристаллической решётки – пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий – узлах решётки – лежат центры частиц.
В зависимости от природы частиц, находящихся в узлах кристаллической решётки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают следующие виды кристаллических решёток:
1. молекулярные,
2. атомные,
3. ионные и
4. металлические.
Молекулярные и атомные решётки присущи веществам с ковалентной связью, ионные – ионным соединениям, металические – металам и их сплавам.
В узлах атомных решёток находятся атомы. Они связаны друг с другом ковалентной связью.
Веществ, обладающих атомными решётками, сравнительно мало. К ним принадлежат алмаз, кремний и некоторые неорганические соединения.
Эти вещества характеризуются высокой твёрдостью, они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства объясняются прочностью ковалентной связи.
В узлах молекулярных решёток находятся молекулы. Они связаны друг с другом межмолекулярными силами.
Веществ с молекулярной решёткой очень много. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические соединения.
Силы межмолекулярного взаимодействия значительно слабее сил ковалентной связи, поэтому молекулярные кристаллы имеют небольшую твёрдость, легкоплавки и летучи.
В узлах ионных решёток располагаются, чередуясь положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения.
К соединениям с ионной связью, образующим ионные решётки, относится большинство солей и небольшое число оксидов.
По прочности ионные решётки уступают атомным, но превышают молекулярные.
Ионные соединения имеют сравнительно высокие температуры плавления. Летучесть их в большинстве случаев не велика.
В узлах металлических решёток находятся атомы металла, между которыми свободно движутся общие для этих атомов электроны.
Наличием свободных электронов в кристаллических решётках металлов можно объяснить их многие свойства: пластичность, ковкость, металлический блеск, высокую электро- и теплопроводность
Существуют вещества, в кристаллах которых значительную роль играют два рода взаимодействия между частицами. Так, в графите атомы углерода связаны друг с другом в одних направлениях ковалентной связью, а в других – металлической. Поэтому решётку графита можно рассматривать и как атомную, и как металлическую.
Во многих неорганических соединениях, например, в BeO, ZnS, CuCl, связь между частицами, находящимися в узлах решётки, является частично ионной, а частично ковалентной. Поэтому решётки подобных соединений можно рассматривать как промежуточные между ионными и атомными.
Аморфное состояние вещества
Свойства аморфных веществ
Среди твёрдых тел встречаются такие, в изломе которых нельзя обнаружить никаких признаков кристаллов. Например, если расколоть кусок обыкновенного стекла, то его излом окажется гладким и, в отличие от изломов кристаллов, ограничен не плоскими, а овальными поверхностями.
Подобная же картина наблюдается при раскалывании кусков смолы, клея и некоторых других веществ. Такое состояние вещества называется аморфным.
Различие между кристаллическими и аморфными телами особенно резко проявляется в их отношении к нагреванию.
В то время как кристаллы каждого вещества плавятся при строго определённой температуре и при той же температуре происходит переход из жидкого состояния в твёрдое, аморфные тела не имеют постоянной температуры плавления. При нагревании аморфное тело постепенно размягчается, начинает растекаться и, наконец, становится совсем жидким. При охлаждении оно также постепенно затвердевает.
В связи с отсутствием определённой температуры плавления аморфные тела обладают другой способностью: многие из них подобно жидкостям текучи, т.е. при длительном действии сравнительно небольших сил они постепенно изменяют свою форму. Например, кусок смолы, положенный на плоскую поверхность, в теплом помещении на несколько недель растекается, принимая форму диска.
Строение аморфных веществ
Различие между кристаллическим и аморфным состоянием вещества состоит в следующем.
Упорядоченное расположение частиц в кристалле, отражаемое элементарной ячейкой, сохраняется на больших участках кристаллов, а в случае хорошо образованных кристаллов – во всём их объёме.
В аморфных телах упорядоченность в расположении частиц наблюдается только на очень малых участках. Кроме того, в ряде аморфных тел даже эта местная упорядоченность носит лишь приблизительный характер.
Это различие можно коротко сформулировать следующим образом:
- структура кристаллов характеризуется дальним порядком,
- структура аморфных тел – ближним.
Примеры аморфных веществ.
К стабильно-аморфным веществам принадлежат стекла (искусственные и вулканические), естественные и искусственные смолы, клеи, парафин, воск и др.
Переход из аморфного состояния в кристаллическое.
Некоторые вещества могут находиться как в кристаллическом, так и в аморфном состоянии. Диоксид кремния SiO2 встречается в природе в виде хорошо образованных кристаллов кварца, а также в аморфном состоянии (минерал кремень).
При этом кристаллическое состояние всегда более устойчиво. Поэтому самопроизвольный переход из кристаллического вещества в аморфное невозможен, а обратное превращение – самопроизвольный переход из аморфного состояния в кристаллическое – возможно и иногда наблюдается.
Примером такого превращения служит расстеклование – самопроизволная кристаллизация стекла при повышенных температурах, сопровождающаяся его разрушением.
Аморфное состояние многих веществ получается при высокой скорости затвердевания (остывания) жидкого расплава.
У металлов и сплавов аморфное состояние формируется, как правило, если расплав охлаждается за время порядка долей-десятков миллисекунд. Для стёкол достаточно намного меньшей скорости охлаждения.
Кварц (SiO2) также имеет низкую скорость кристаллизации. Поэтому отлитые из него изделия получаются аморфными. Однако природный кварц, имевший сотни и тысячи лет для кристаллизации при остывании земной коры или глубинных слоёв вулканов, имеет крупнокристаллическое строение, в отличие от вулканического стекла, застывшего на поверхности и поэтому аморфного.
Жидкости
Жидкость – промежуточное состояние между твёрдым телом и газом.
Жидкое состояние является промежуточным между газообразным и кристаллическим. По одним свойствам жидкости близки к газам, по другим – к твёрдым телам.
С газами жидкости сближает, прежде всего, их изотропность и текучесть. Последняя обуславливает способность жидкости легко изменять свою форму.
Однако высокая плотность и малая сжимаемость жидкостей приближает их к твёрдым телам.
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жёстких сил межмолекулярного взаимодействия.
В то же время низкая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объём, указывает на присутствие хотя и не жёстких, но всё же значительных сил взаимодействия между частицами.
Соотношение потенциальной и кинетической энергии.
Для каждого агрегатного состояния характерно своё соотношение между потенциальной и кинетической энергиями частиц вещества.
У твёрдых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твёрдых телах частицы занимают определённые положения друг относительно друга и лишь колеблются относительно этих положений.
Для газов соотношение энергий обратное, вследствии чего молекулы газов всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объём.
В случае жидкостей кинетическая и потенциальная энергия частиц приблизительно одинаковы, т.е. частицы связаны друг с другом, но не жёстко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объём.
Стуктуры жидкостей и аморфных тел схожи.
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам. В большинстве жидкостей наблюдается ближний порядок – число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всём объёме жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры.
При низких температурах, незначительно превышающих температуру плавления данного вещества, степень упорядоченности расположения частиц данной жидкости велика.
С ростом температуры она падает и по мере нагревания свойства жидкости всё больше и больше приближаются к свойствам газа. При достижении критической температуры различие между жидкостью и газом исчезает.
Вследствии сходства во внутренней структуре жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, а к твёрдым телам относят только вещества в кристаллическом состоянии.
Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах в отличие от обычных жидкостей частицы имеют незначительную подвижность – такую же как в кристаллах.
xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai
Приведи пример вещества, которое может находиться в нескольких состояниях
Одно и тоже вещество в зависимости от условий, в которых оно находится, может пребывать в различных состояниях, отличающихся по своим свойствам.
Состояния вещества
Существует 3 основные агрегатные состояния вещества, обладающие следующими особенностями:
- Твердое. Характерным признаком твердого состояния вещества является стабильность формы и объема.
- Газообразное. Оно характеризуется расположением частиц на больших расстояниях друг от друга и очень слабым взаимодействием между ними. Благодаря этому, газ не имеет определенной формы и стремится заполнить весь предоставленный ему объем.
- Жидкое. В этом состоянии силы взаимодействия между частицами, которые расположены более плотно, чем в газе, достаточно сильны, чтобы обеспечивать неизменность объема, но не достаточны для сохранения формы.
Практически все вещества могут пребывать в 3 агрегатных состояниях. Вода является наиболее типичным примером.
Агрегатные состояния воды
Различные состояния воды — это те явления, которые мы имеем возможность наблюдать в природе: дождь, роса, туман, снег, лед, пар.
Твердое состояние воды имеет место при пониженной температуре, когда она замерзает. При высоком давлении температура затвердевания оказывается выше. В твердом виде вода сохраняет форму и объем. В природных условиях в этом состоянии вода встречается в виде льда, снега, града.
Вода в жидком состоянии сохраняет объем, но не имеет постоянной формы. В природе дождь, туман, роса соответствуют ее жидкому состоянию.
Вода в газообразном состоянии представляет собой водяной пар. В этом состоянии не сохраняются ни ее форма, ни объем.
При изменении температуры происходит трансформация агрегатных состояний воды: при нагреве воды, находящейся в твердом состоянии происходит ее плавление — она из льда превращается в жидкость, при нагреве жидкости вода испаряется и переходит в газообразное состояние. При охлаждении процесс начинает развиваться в противоположном направлении — происходит конденсация пара и образование жидкости, при дальнейшем охлаждении жидкости она кристаллизуется с образованием льда. Все эти процессы чрезвычайно важны для природы нашей планеты, обеспечивая круговорот воды.
vashurok.ru
Агрегатные состояния вещества, теория и примеры
Вещества имеют сложное строение. Частицы в веществе взаимодействуют между собой. Характер взаимодействия частиц в веществе определяет его агрегатное состояние.
Виды агрегатных состояний
Выделяют следующие агрегатные состояния: твердое, жидкое, газ, плазма.
В твердом состоянии частицы, как правило, объединены в правильную геометрическую структуру. Энергия связей частиц больше, чем энергия их тепловых колебаний.
Если температуру тела увеличивать, увеличивается энергия тепловых колебаний частиц. При некоторой температуре энергия тепловых колебаний становится больше, чем энергия связей. При такой температуре связи между частицами разрушаются и образуются снова. При этом частицы совершают различные виды движений (колебания, вращения, перемещения друг относительно друга и т.д.). При этом они еще контактируют между собой. Правильная геометрическая структура нарушена. Вещество находится в жидком состоянии.
При дальнейшем росте температуры тепловые колебания усиливаются, связи между частицами становятся еще слабее и практически отсутствуют. Вещество находится в газообразном состоянии. Самой простой моделью вещества является идеальный газ, в котором считается, что частицы движутся в любых направлениях свободно, взаимодействуют между собой только в момент соударений, при этом выполняются законы упругого удара.
Можно сделать вывод о том, что с ростом температуры вещество переходит от упорядоченной структуры в неупорядоченное состояние.
Плазма – это газообразное вещество, состоящее из смеси нейтральных частиц ионов и электронов.
Температура и давление в разных агрегатных состояниях вещества
Разные агрегатные состояния вещества определяют: температура и давление. Низкое давление и высокая температура соответствуют газам. При низких температурах, обычно вещество находится в твердом состоянии. Промежуточные температуры относят к веществам в жидком состоянии. Для характеристики агрегатных состояний вещества часто применяется фазовая диаграмма. Это диаграмма, отражающая зависимость агрегатного состояния от давления и температуры.
Основной особенностью газов является их способность к расширению и сжимаемость. Газы не обладают формой, принимают форму сосуда, в который помещены. Объем газа определяет объем сосуда. Газы могут смешиваться между собой в любых пропорциях.
Жидкость не имеет формы, но имеют объем. Сжимаются жидкости плохо, только при высоком давлении.
Твердые вещества имеют форму и объем. В твердом состоянии могут находиться соединения с металлическими, ионными и ковалентными связями.
Примеры решения задач
ru.solverbook.com