Простые вещества — урок. Химия, 8–9 класс.
Все химические вещества делятся на простые и сложные.
Простыми называют вещества, образованные атомами одного химического элемента.
Некоторые простые вещества состоят из молекул.
Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие.
Из двухатомных молекул состоят водород h3, кислород O2, азот N2, галогены F2, Cl2, Br2, I2.
Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4, восемь — в молекулах серы S8.
Рис. \(1\). Модели молекул водорода и азота
Рис. \(2\). Модель молекулы озона
Другая группа простых веществ имеет немолекулярное строение. К таким веществам относятся все металлы, а также фосфор красный, алмаз, графит, кремний и другие.
Их химические формулы записывают химическим символом элемента без индекса: Fe, P, C, Si и т. д.
Химических элементов известно \(118\), а простых веществ — более \(400\). Один химический элемент может образовать несколько простых веществ.
Один химический элемент может образовать несколько простых веществ.
Явление существования нескольких простых веществ, образованных атомами одного химического элемента, называется аллотропией.
Простые вещества, состоящие из атомов одного химического элемента — аллотропные модификации (аллотропные видоизменения).
Пример:
химический элемент кислород образует простые вещества, отличающиеся составом молекул: кислород O2 и озон O3. Кислород — газ без запаха, необходим живым организмам для дыхания. Озон имеет запах, ядовит.
Химический элемент фосфор образует молекулярное вещество фосфор белый P4 и немолекулярное — фосфор красный P. Эти вещества отличаются не только строением, но и свойствами. Белый фосфор имеет запах, самовоспламеняется на воздухе. Красный фосфор без запаха, горит только при нагревании.
Химический элемент углерод образует немолекулярные вещества алмаз и графит. Они обозначаются одинаковой формулой — C, но имеют разное строение и отличаются свойствами. Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий.
Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий.
Рис. \(3\). Алмаз и графит
Химический элемент и простое вещество
Названия химического элемента и простого вещества в большинстве случаев совпадают, поэтому следует различать эти два понятия.
Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение).
Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
Пример:
Химический элемент | Простое вещество |
| Относительная атомная масса кислорода равна \(16\) | Кислород плохо растворяется в воде |
| Азот входит в состав белков | Азот используют для получения аммиака |
| Атомы водорода входят в состав молекул воды | Водород легче воздуха |
Источники:
Рис. 1. Модели молекул водорода и азота © ЯКласс
1. Модели молекул водорода и азота © ЯКласс
Рис. 2. Модель молекулы озона © ЯКласс
Рис. 3. Алмаз и графит
https://cdn.pixabay.com/photo/2014/10/24/08/09/diamond-500872_960_720.jpg
https://www.shutterstock.com/ru/image-photo/galena-called-lead-glance-natural-mineral-1360577696
Простые вещества — это… Что такое Простые вещества?
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др. )[2].
)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
Схемы строения различных модификаций углеродаa: алмаз, b: графит, c: лонсдейлит
d: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать. «Атом» — конкретное понятие, так как атомы существуют реально. «Химический элемент» — это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже[4]:
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (дикислород O2) и озон; углерода — алмаз, графит, карбин, фуллерен.
Каждый химический элемент имеет свое условное обозначение — химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество «кислород» имеет формулу O2.
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т.
 — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
— Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз. - ↑ 1 2 3 4 Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — С. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7
- ↑ 1 2 Глинка Н.Л. Общая химия. — 24 изд., испр. — Ленинград: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — С. 11-12. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6
Литература
- Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7.
- Врублевский А.
 И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки
Простые вещества — это… Что такое Простые вещества?
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть
металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
Схемы строения различных модификаций углеродаa: алмаз, b: графит, c: лонсдейлит
d: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать. «Атом» — конкретное понятие, так как атомы существуют реально. «Химический элемент» — это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже[4]:
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (
Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (
Каждый химический элемент имеет свое условное обозначение — химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество «кислород» имеет формулу O2.
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — С.
 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7
253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7 - ↑ 1 2 Глинка Н.Л. Общая химия. — 24 изд., испр. — Ленинград: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — С. 11-12. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6
Литература
- Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7.
- Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки
Вещества простые — Справочник химика 21
Формульная единица Группа атомов или ионов, представленных химической формулой вещества. Простейшая единица ионного соединения [c.
Межмолекулярные (межатомные) окислительно-восстановительные реакции характеризуются тем, что атомы, изменяющие свои степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах. Другими словами, одни вещества (простые или сложные), вступающие в химические реакции, являются окислителями, а другие — восстановителями. Межмолекулярные процессы составляют наиболее обширную группу окислительно-восстановительных реакций. Примерами могут служить реакции с участием простых и сложных веществ, а также различных атомных и молекулярных частиц (радикалов, ионов и ион-радикалов) [c.77]
Газометр объемом 10 л заполнен газом. Давление в газометре 1,15-10 Па, температура 17 °С. Плотность газа по водороду равна 16. Определите, какой газ находится в газометре и какова его масса. (Вещество простое.) [c.11]
Элементный анализ вещества позволяет определить его относительный весовой (массовый) состав в процентах, т. е. число граммов каждого элемента в 100 г анализируемого вещества. Разделив полученные массы каждого элемента на их атомные массы, находим набор чисел, дающий относительный атомный состав вещества, т.е. указывающий относительное количество атомов каждого типа в этом веществе. Простейшая хи- [c.98]
е. число граммов каждого элемента в 100 г анализируемого вещества. Разделив полученные массы каждого элемента на их атомные массы, находим набор чисел, дающий относительный атомный состав вещества, т.е. указывающий относительное количество атомов каждого типа в этом веществе. Простейшая хи- [c.98]
Простые вещества. Простые вещества марганца и его аналогов представляют собой металлы серебристо-белого цвета. Для марганца известны четыре модификации. Некоторые физические константы простых веществ приведены ниже [c.570]
Внутренняя энергия термодинамической системы, представляющей собой простое вещество (простой ТС), определяется двумя параметрами (аргументами) состояния, например U = = U T,v). Если в ТС присутствует несколько веществ и их массы гпи m2,. .. изменяются за счет химической реакции (такую систему называют сложной), то величина U определяется дополнительно массами Щ, m2,. .. компонентов U=U(T, v, mi, m2,. ..) и тогда [c. 14]
14]
А — прямая утилизация органического вещества простейшими В, С — оборот РОВ каждым видом О — повторная утилизация метаболических продуктов — отходов бактериями. [c.158]
Исходные вещества — простые углеводороды метан, этилен, пропилен, бутилен, ацетилен, бензол, толуол и др., являющиеся основным сырьем органического синтеза, получаются при химической переработке газообразных, жидких и твердых видов топлива. В настоящее время многие из перечисленных исходных веществ выпускаются десятками и сотнями тысяч тонн. [c.160]
Во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными. [c.15]
Химический индивид. Химическое соединение. В химий главными объектами изучения являются химические индивиды. Последние противопоставляются механическим смесям и отличаются от растворов, состоящих из различных химических индивидов. Химический индивид представляет собой фазу, состоящую иэ одного вида вещества — простого или сложного. Все простые вещества и химические соединения в чистом виде являются химическими индивидами . Кусок металлического алюминия, взятые объемы аммиака, воды и кристаллы поваренной соли — это примеры химических индивидов. Все они — тела, состоящие из одного вида вещества (атомов алюминия, молекул аммиака и т. п.). [c.28]
Химический индивид представляет собой фазу, состоящую иэ одного вида вещества — простого или сложного. Все простые вещества и химические соединения в чистом виде являются химическими индивидами . Кусок металлического алюминия, взятые объемы аммиака, воды и кристаллы поваренной соли — это примеры химических индивидов. Все они — тела, состоящие из одного вида вещества (атомов алюминия, молекул аммиака и т. п.). [c.28]
Нейтральные омыляемые и неомыляемые вещества—простые и сложные эфиры, углеводороды, спирты, кетоны, альдегиды и т. д. [c.219]
Для разделения двух растворенных веществ простая экстракция непригодна, как будет показано ниже. Если, например, нужно однократной обработкой разделить смесь, содержащую по 1 г веществ X и V (Ох = 2,0 (7у = 0,2), то после первой экстракции в верхней фазе находится 4/6 г X и 1/6 г У. Массовое отношение при этом составит X =4. После второго контактирования фаз в верхней фазе находится 4/6-2/6 = 8/36 г X и [c. 226]
226]
ПРОСТОЕ ВЕЩЕСТВО — простое тело, однородное вещество, состоящее из атомов одного и того же химического элемента форма существования химического элемента в свободном состоянии алмаз, графит, уголь (состоят из атомов углерода, но отличаются по своему строению н свойствам), кислород и озон (отличаются по числу атомов в молекуле и по свойствам) и т. д. [c.205]
ЧИСТОЕ ВЕЩЕСТВО — простые вещества или соединения, жидкости, сплавы, смеси, содержащие примеси в таком количестве, которое не влияет на характерные свойства основного вещества. Предельное содержание примесей определяется свойствами, получением или использованием веществ и, как правило, составляет доли процента, даже меньше. Современная наука и техника предъявляют очень высокие требования к чистоте вещества. Например, в полупроводниках на сто миллионов атомов германия допускается лишь один атом примеси другого элемента (напр., бора). Ч. в. получают специальными методами зонной плавкой, вытягиванием монокристаллов и др. Определение Ч. в. отличается от определения чистоты реактивов химических. [c.286]
Определение Ч. в. отличается от определения чистоты реактивов химических. [c.286]
По мере возрастания концентрации растворенного вещества простые закономерности, характерные для предельно разбавленных растворов, начинают искажаться, так как появляется новый тип взаимодействия — начинает сказываться взаимодействие между частицами растворенного вещества. Однако не всегда эти взаимодействия резко отличаются от тех, которые существовали при низких концентрациях. Это, в частности, относится к растворам, образованным частицами, не сильно отличающимися по размеру и химической природе, например раствору, образованному двумя изомерными углеводородами или двумя гомологичными спиртами. В таком случае [c.121]
По мере возрастания концентрации растворенного вещества простые закономерности, характерные для предельно разбавленных растворов, начинают искажаться, так как появляется новый тип взаимодействия — начинает сказываться взаимодействие между частицами растворенного вещества. Однако не всегда эти взаимодействия резко отличаются от тех, которые существовали при низких концентрациях. Это, в частности, относится к растворам, образованным частицами, не сильно отличающимися по размеру и химической природе, например к раствору, образованному двумя гомологами— углеводородами или спиртами. В таком случае закономерности, свойственные предельно разбавленным растворам, сохраняются вплоть, до больших концентраций растворенного вещества. Такие растворы называются идеальными растворами. [c.134]
Однако не всегда эти взаимодействия резко отличаются от тех, которые существовали при низких концентрациях. Это, в частности, относится к растворам, образованным частицами, не сильно отличающимися по размеру и химической природе, например к раствору, образованному двумя гомологами— углеводородами или спиртами. В таком случае закономерности, свойственные предельно разбавленным растворам, сохраняются вплоть, до больших концентраций растворенного вещества. Такие растворы называются идеальными растворами. [c.134]
В свободном состоянии химические элементы существуют в форме простых (элементарных) веществ. Простых веществ известно значительно больше, чем химических элементов, так как многие элементы способны к образованию двух или нескольких элементарных веществ, называемых аллотропными модификациями. В настоящее время известно более чем 400 простых веществ. [c.224]
Свойства химических элементов и простых веществ. Простые соединения химических элементов [c.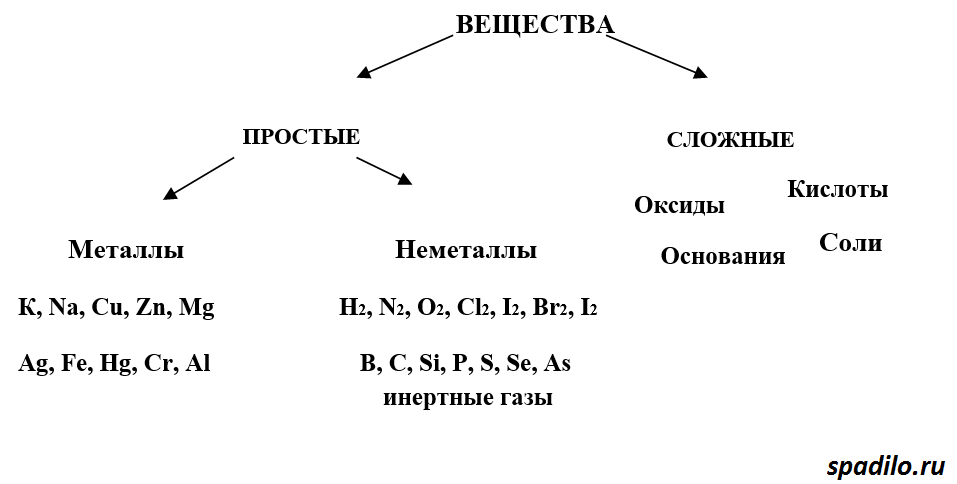 405]
405]
После того как было рассказано о химической связи между неболь-щим числом атомов, объединенных в молекулы, можно перейти к рассмотрению связи в твердых и жидких веществах. Простая, но очень плодотворная теория электрических свойств кристаллов рассматривает весь кристалл как одну большую молекулу, по всему объему которой простираются делокализованные молекулярные орбитали. Она называется зоииой теорией металлов и диэлектриков (изоляторов). [c.601]
Вещества простые и сложные. Аллотропия [c.119]
Классификация неорганических веществ. Простые и сложные вещества. [c.91]
В дальнейшем для краткости будем называть молярную массу эквивалента вещества просто эквивалентом, обозначая ее через Э(Х), как в формуле (1.8). [c.18]
Для того, чтобы установить истинную формулу вещества, показывающую действительное число атомов в молекуле, необходимо, кроме процентного состава и атомных масс элементов, знать еще и молекулярную массу соединения. Для некоторых веществ простейшие и истинные формулы совпадают. [c.33]
Для некоторых веществ простейшие и истинные формулы совпадают. [c.33]
Сложные вещества состоят из сложных атомов , которые при химических реакциях могут распадаться на атомы простых веществ. Простые атомы сочетаются в сложные атомы в простейших числовых пропорциях атом на атом, атом на два атома и т. д. Масса сложного атома равна сумме масс входящих в него простых атомов. [c.13]
Удобство такого способа вычислений при массовых анализах, когдл, вычислив один раз титр рабочего раствора г о определяемому веществу, находят количество этого вещества простым умножением титра на израсходованный объем раствора. Очевидно. Такой способ широко применяется в лабораториях, где приходится иметь дело С массовыми определениями одного и того, же элемента в большом количестве проб. Наоборот, в тех случаях, когда определения не носят массового характера и данный титрованный раствор применяется для определения не одного и того же, а различных элементов, вычислять результаты анализов удобнее, исходя из нормальности раствора. [c.227]
[c.227]
Однажды испытывал я свои конфорки на заводе. Узнал, что они выпускают и бойлеры, да и показал им образец развальцованной льдом трубы. Поглядели чисто сделано, без царапин. Спрашивают — как А я говорюГ Мы нашли такое вещество, которое затвердевает, расширяется и раздает трубы, а через 10 минут превращается в жидкость и вытекает . Они тогда А где такое вещество достать Наверное, очень дорогое и дефицитное Да нет,— говорю,— не очень… И смешно, и рассказать хочется, а знаю — нельзя, пока авторское не выдано. Теперь-то они в курсе дела, знают, что это дефицитное вещество — просто вода… [c.156]
С практической точки зрения все сказанное выше означает, что концентрации чистых жидкостей и твердых веществ просто исключаются из выражений для констант равновесия. (Однако они входят неявным образом в Крзвн-) [c.187]
При омылении или термолизе сахалинских нефтей, смол и мазутов образовывалось заметное количество фенолов, но концентрация групп СООН не изменялась по мнению Н. Е. Подклетнова [648], это свидетельствует о наличии в составе исходных веществ простых эфиров, точнее — феноксигрупп, соединенных с другими фрагментами простой эфирной связью. Из низкомолекулярных простых эфиров, содержащих атом О р неароматической системе, известны лишь обнаруженные в калифорнийской нефти алкилдигидробензофураны (кумараны, ЬХУ) и их нафтенологи, имеющие до 5 нафтеновых циклов в молекуле (табл. 3.8). Точное строение этих соединений не установлено. Концентрация кума-ранов не превышала 0,08% на дистиллят. [c.109]
Е. Подклетнова [648], это свидетельствует о наличии в составе исходных веществ простых эфиров, точнее — феноксигрупп, соединенных с другими фрагментами простой эфирной связью. Из низкомолекулярных простых эфиров, содержащих атом О р неароматической системе, известны лишь обнаруженные в калифорнийской нефти алкилдигидробензофураны (кумараны, ЬХУ) и их нафтенологи, имеющие до 5 нафтеновых циклов в молекуле (табл. 3.8). Точное строение этих соединений не установлено. Концентрация кума-ранов не превышала 0,08% на дистиллят. [c.109]
Вещества простые и сложные. Аллотропия 9. Явления физические и химические. Смеси в хими ческне соединения. ….. [c.470]
Очистка жидких органических веществ. Простая перегоик . Разделение бинарных и тройных смесей простой перегонкой и хромато-графичес анализ фракций. Экстракция. Кристаллизация. Возгонка. [c.196]
СИГМА-СВЯЗЬ И пи-связь (а-свяэь и я-связь) — типы ковалентных химических связей. о-С. может образоваться при взаимодействии (перекрываннн) атомных орбиталей любого типа. Она характеризуется цилиндрической симметрией и одной областью перекрывания. Благодаря этому возможно свободное вращение фрагментов молекулы вокруг линии ст-связи. Простейшим случаем а-связи является молекула На, в которой -электроны водородных атомов имеют антипараллельные спины. Максимальная плотность электронного облака а-связи находится на линии связи. Во всех органических веществах простые ковалентные связи между атомами углерода и другими атомами являются ст- С. я- С. возникают в ненасыщенных органических веществах только за счет р-электронов, оси орбиталей которых располагаются параллельно и перекрывание орбиталей происходит в двух областях. Последнее создает энергетический барьер для взаимного вращения фрагментов молекулы вокруг линии связи и обусловливает существование цис-транс-изомерш. Таким образом, двойная связь состоит из двух типов связи — о-С. и я-С. Тройная связь соответственно состоит из одной а-С.
о-С. может образоваться при взаимодействии (перекрываннн) атомных орбиталей любого типа. Она характеризуется цилиндрической симметрией и одной областью перекрывания. Благодаря этому возможно свободное вращение фрагментов молекулы вокруг линии ст-связи. Простейшим случаем а-связи является молекула На, в которой -электроны водородных атомов имеют антипараллельные спины. Максимальная плотность электронного облака а-связи находится на линии связи. Во всех органических веществах простые ковалентные связи между атомами углерода и другими атомами являются ст- С. я- С. возникают в ненасыщенных органических веществах только за счет р-электронов, оси орбиталей которых располагаются параллельно и перекрывание орбиталей происходит в двух областях. Последнее создает энергетический барьер для взаимного вращения фрагментов молекулы вокруг линии связи и обусловливает существование цис-транс-изомерш. Таким образом, двойная связь состоит из двух типов связи — о-С. и я-С. Тройная связь соответственно состоит из одной а-С. и двух П-С., расположенных в двух взаимно перпендикулярных плоскостях. [c.226]
и двух П-С., расположенных в двух взаимно перпендикулярных плоскостях. [c.226]
Расход гипса (или пирита) и других реагентов зависит в основном от полноты контакта реагирующих веществ. Простейшие подсчеты показывают, что при полной замене серы гипса (необходимой для сульфидирования) серой нефтяного кокса ее должно содержаться в ВОС 7—10%. Кроме того, необходимо, чтобы сера выделялась из нефтяного кокса в интервале температур, при котором достигаются лучшие условия сульфидирования. Принципиально возможно получение ВОС и с большим содержанием серы, чем это требуется при полной замене им неорганического сульфпдиза-тора. Прочность сероорганических соединений в ВОС можно регулировать добавкой в сырье коксования смеси различных реагентов. [c.108]
Наряду с сульфоэфиром образуется много побочных веществ (простые и сложные эфиры, диалкилсульфаты и -суль-фонаты, жирные кислоты, сульфоны и др.). Поэтому для получения чистого алкилсульфата требуется тщательная очистка продукта многократной перекристаллизацией. При этом отделяется также сульфат натрия, который в большом количестве образуется при нейтрализации избытка h3SO4. Не-сульфированные соединения отделяют экстрагированием. Наличие несульфированных веществ (в частности, не вошедшего в реакцию жирного спирта) вызывает появление на изотермах поверхностного натяжения минимума в области ККМ. Исчезновение этого минимума может служить хорошим критерием чистоты полученного препарата. [c.198]
При этом отделяется также сульфат натрия, который в большом количестве образуется при нейтрализации избытка h3SO4. Не-сульфированные соединения отделяют экстрагированием. Наличие несульфированных веществ (в частности, не вошедшего в реакцию жирного спирта) вызывает появление на изотермах поверхностного натяжения минимума в области ККМ. Исчезновение этого минимума может служить хорошим критерием чистоты полученного препарата. [c.198]
Все представители животного и растительного мира ириниматот деятельное участие в очистке сточных вод. Бактерии минерализуют органические вещества, простейшие (инфузории, корненожки) питаются бактериями, а водоросли продуцируют кислород и фитонциды (вещества, губительные для микроорганизмов). Черви прорывают ходы между частицами шлака, разрыхляют биологическую пленку и тем самым облегчают доступ в нее кислороду. Кроме того, черви, питаясь органическими веществами, переваривают и разлагают ряд стойких соединений — хитин, клетчатку. [c. 302]
302]
Растворы высокомолекулярных веществ представляют собой истинные растворы, термодинамически устойчивые и обратимые, не нуждающиеся в стабилизаторе. Частицы, содержащиеся в таких растворах, состоят не из множества малых молекул, как это имеет место у коллоидов, а представляют отдельные молекулы, правда, относительно очень больших размеров. В этом собственно и заключается отличие растворов высокомолекулярных соединений от растворов низкомолекулярных веществ. Тем не менее ряд ученых (Кройт, Бунгенберг де Йонг, И. И. Жуков, Эдельман и др.) относят растворы высокомолекулярных веществ к коллоидным растворам, причем некоторые называют растворенн те в них вещества обратимыми коллоидами (Кройт, Бунгенберг дё йонг), а некоторые — молекулярными коллоидами (И. И. Жуков, Эдельман). Нетрудно видеть, что основные особенности, присущие лиозолям, объясняются в случае растворов высокомолекулярных веществ просто большим размером молекул, приближающимся, а в некоторых случаях даже превосходящим размер коллоидных частиц. [c.416]
[c.416]
Возможности для проявления изомерии многоядерных соединений велики. Для вещества простейшей формулы МгЗаЬаХ на основании координационной теории можно предвидеть существование следующих геометрических изомеров [c.215]
Пособие рассматривает отдельные, наиболее сложные аспекты современной химии. Излагаются основы атомно-молекулярной теории, систематика элементов, общая характеристика элементарных веществ, простых соединений, персоединений, субкомплексных и комплексных соединений общие закономерности химических процессов — химическая термодинамика, кинетика, катализ проблемы строения вещества, химической связи, агрегатные состояния вещества. Предназначается для студентов вузов. [c.2]
Найденному уравнению отвечает линейная зависимость IgP2 = ф(1ё 1) (рис. 58). Необходимые ДЛЯ расчетов температуры кипения стандартного вещества в целях удобства показаны на том же чертеже. Этот метод был предложен В. А. Киреевым (1931 г. ), а позднее Отмером (1940 г.) он предпочтительнее предыдущего, так как является более строгим по выводу, чаще более точным и позволяет определить (АЯпар)г данного вещества простым умножением угла наклона прямой на (АЯпар) 1- Однако этот способ, как и предыдущий, точен лишь при температурах, далеких от критической при высоких температурах отношение [c.194]
), а позднее Отмером (1940 г.) он предпочтительнее предыдущего, так как является более строгим по выводу, чаще более точным и позволяет определить (АЯпар)г данного вещества простым умножением угла наклона прямой на (АЯпар) 1- Однако этот способ, как и предыдущий, точен лишь при температурах, далеких от критической при высоких температурах отношение [c.194]
Полиморфизм. Некоторые вещества (простые или сложные) в зависимости от условий кристаллизации могут образовывать кристаллы различной формы и внутренней структуры. Это явление получило название полиморфизма (греч. poly—много, многое morphe — форма polymorphos — многообразный). [c.126]
Вещества простые и сложные. Химические элементы » HimEge.ru
Три агрегатных состояния воды
Окружающий мир материален. Материя бывает двух видов: вещество и поле. Объект химии – вещество (в том числе и влияние на вещество различных полей – звуковых, магнитных, электромагнитных и др.)
Вещество — все, что имеет массу покоя (т. е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.
е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.
Вещество бывает в трех агрегатных состояниях – газообразном, жидком и твердом. Есть еще одно состояние вещества – плазма (например, плазма есть в грозовой и шаровой молнии), но в школьном курсе химию плазмы почти не рассматривают.
Вещества могут быть чистыми, очень чистыми (нужными, например, для создания волоконной оптики), могут содержать заметные количества примесей, могут быть смесями.
Все вещества состоят из мельчайших частиц – атомов. Вещества, состоящие из атомов одного вида (из атомов одного элемента), называют простыми (например, древесный уголь, кислород, азот, серебро и др.). Вещества, которые содержат связанные между собой атомы разных элементов, называют сложными.
Если в веществе (например, в воздухе) присутствуют два или большее число простых веществ, и их атомы не связаны между собой, то его называют не сложным, а смесью простых веществ. Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ.
Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ.
Вещества способны вступать между собой во взаимодействие, причем возникают новые вещества. Такие превращения называют химическими. Например, простое вещество уголь взаимодействует (химики говорят – реагирует) с другим простым веществом – кислородом, в результате образуется сложное вещество – углекислый газ, в котором атомы углерода и кислорода связаны между собой. Такие превращения одних веществ в другие называют химическими. Химические превращения – это химические реакции. Так, при нагревании сахара на воздухе сложное сладкое вещество – сахароза (из которого состоит сахар) – превращается в простое вещество – уголь и сложное вещество – воду.
Химия изучает превращения одних веществ в другие. Задача химии – выяснить, с какими именно веществами может при данных условиях взаимодействовать (реагировать) то или иное вещество, что при этом образуется.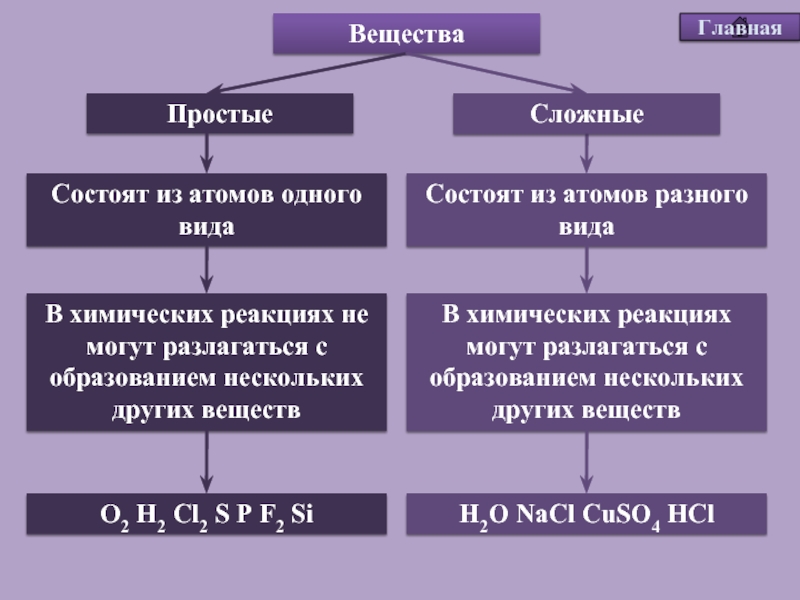 Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.
Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.
Каждое вещество характеризуется совокупностью физических и химических свойств. Физические свойства – это свойства, которые можно охарактеризовать с помощью физических приборов. Например, с помощью термометра можно определить температуру плавления и кипения воды. Физическими методами можно охарактеризовать способность вещества проводить электрический ток, определить плотность вещества, его твердость и т.д. При физических процессах вещества остаются неизменными по составу.
Физические свойства веществ подразделяют на счислимые (те, которые можно охарактеризовать с помощью тех или иных физических приборов числом, например, указанием плотности, температур плавления и кипения, растворимости в воде и др.) и несчислимые (те, которые охарактеризовать числом нельзя или очень трудно – такие, как цвет, запах, вкус и др.).
Химические свойства вещества – это совокупность сведений о том, с какими другими веществами и при каких условиях вступает в химические взаимодействия данное вещество. Важнейшая задача химии – выявление химических свойств веществ.
Важнейшая задача химии – выявление химических свойств веществ.
В химических превращениях участвуют мельчайшие частицы веществ – атомы. При химических превращениях из одних веществ образуются другие вещества, и исходные вещества исчезают, а вместо них образуются новые вещества (продукты реакции). А атомы при всех химических превращениях сохраняются. Происходит их перегруппировка, при химических превращениях старые связи между атомами разрушаются и возникают новые связи.
Число различных веществ огромно (и у каждого из них своя совокупность физических и химических свойств). Атомов, отличающихся друг от друга по важнейшим характеристикам, в окружающем нас материальном мире сравнительно невелико – около ста. Каждому виду атомов отвечает свой химический элемент. Химический элемент – это совокупность атомов с одинаковыми или близкими характеристиками. В природе встречается около 90 различных химических элементов. К настоящему времени физики научились создавать новые, отсутствующие на Земле виды атомов.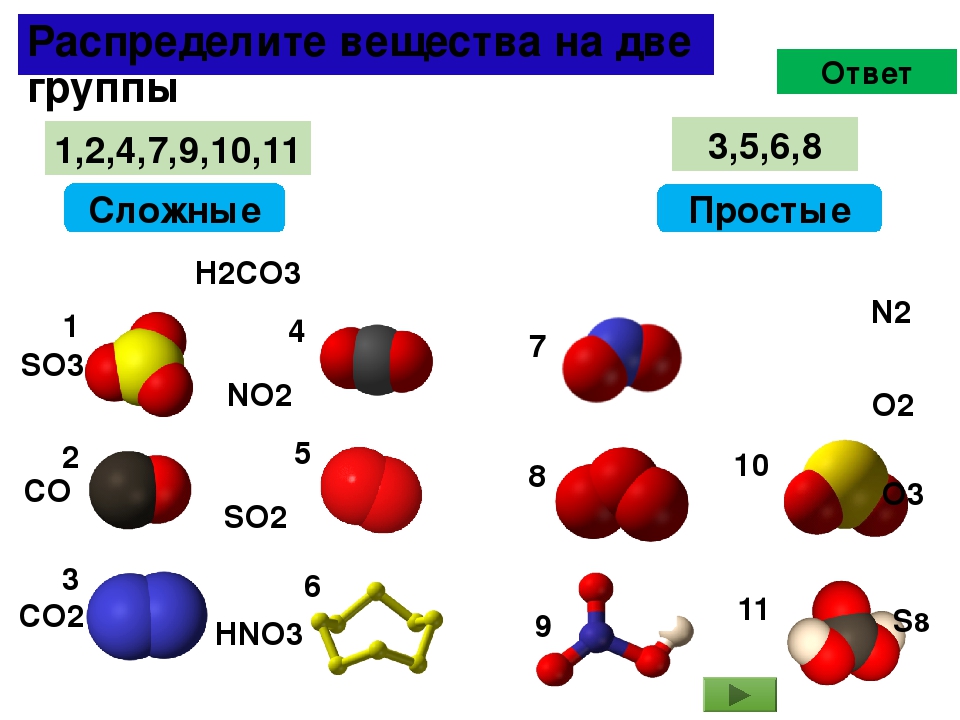 Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements). Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements). Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Каждый элемент имеет латинское название и одно- или двух-буквенный символ. В русскоязычной химической литературе нет четких правил произношения символов химических элементов. Одни произносят так: называют элемент по-русски (символы натрия, магния и др.), другие – по латинским буквам (символы углерода, фосфора, серы), третьи – как звучит название элемента по-латыни (железо, серебро, золото, ртуть). Символ элемента водорода Н у нас принято произносить так, как эту букву произносят по-французски.
Сравнение важнейших характеристик химических элементов и простых веществ приведено в таблице ниже. Одному элементу может отвечать несколько простых веществ (явление аллотропии: углерод, кислород и др.), а может – и одно (аргон и др. инертные газы).
| Х и м и ч е с к и й э л е м е н т | П р о с т о е в е щ е с т в о |
1. Заряд ядра Заряд ядра | 1. Совокупность физических свойств(цвет, запах, растворимость в воде, температуры плавления, кипения, разложения, тип кристаллической решетки и др.) 2. Совокупность химических свойств (с чем реагирует и при каких условиях) |
| 2. Значение электроотрицательности | |
| 3. Совокупность степеней окисления | |
| 4. Для элементов, встречающихся в природе: постоянство изотопного состава,и как следствие, постоянство атомной массы |
Простые и сложные вещества — получение и свойства
Все вещества, о которых мы говорим в
школьном курсе химии, принято делить
на простые и сложные. Простые
вещества — это такие вещества, в
состав молекул которых входят атомы
одного и того же элемента. Атомарный
кислород (O), молекулярный кислород
(O2) или просто кислород, озон (O3),
графит, алмаз — это примеры простых
веществ, которые образуют
химические элементы кислород и
углерод. Сложные вещества делятся на
органические и неорганические. Среди
неорганических веществ, прежде всего
выделяют следующие четыре класса:
окислы (или оксиды), кислоты
(кислродные и безкислородные),
основания (растворимые в воде
основания называются щелочами) и
соли. Соединения неметаллов
(исключая кислород и водород) не
входят в эти четыре класса, мы будем
их называть условно «и другие сложные
вещества».
Атомарный
кислород (O), молекулярный кислород
(O2) или просто кислород, озон (O3),
графит, алмаз — это примеры простых
веществ, которые образуют
химические элементы кислород и
углерод. Сложные вещества делятся на
органические и неорганические. Среди
неорганических веществ, прежде всего
выделяют следующие четыре класса:
окислы (или оксиды), кислоты
(кислродные и безкислородные),
основания (растворимые в воде
основания называются щелочами) и
соли. Соединения неметаллов
(исключая кислород и водород) не
входят в эти четыре класса, мы будем
их называть условно «и другие сложные
вещества».
Простые вещества принято делить на
металлы, неметаллы и инертные газы. К
металлам относятся все химические
элементы, у которых идет заполнение
d- и f-подуровней, это в 4-ом периоде
элементы: Sc — Zn, в 5-ом периоде: Y —
Cd, в 6-ом периоде: La — Hg, Ce — Lu, в 7
периоде Ac — Th — Lr. Если теперь среди
оставшихся элементов провести линию
от Be к At, то слева и внизу от нее
будут расположены металлы, а справа
и вверху — неметаллы. В 8 группе
Периодической системы расположены
инертные газы. Элементы,
расположенные на диагонали: Al, Ge,
Sb, Po (и некоторые другие. Например,
Zn) в свободном состоянии обладают
свойствами металлов, а гидроксиды
обладают свойствами и оснований, и
кислот, т.е. являются амфотерными
гидроксидами. Поэтому эти элементы
можно считать металло-неметаллами,
занимающими промежуточное
положение между металлами и
неметаллами. Таким образом,
классификация химических элементов
зависит от того, какими свойствами
будут обладать их гидроксиды:
основными — значит это металл,
кислотными — неметалл, и теми и
другими (в зависимости от условий) —
металло-неметалл.
Если теперь среди
оставшихся элементов провести линию
от Be к At, то слева и внизу от нее
будут расположены металлы, а справа
и вверху — неметаллы. В 8 группе
Периодической системы расположены
инертные газы. Элементы,
расположенные на диагонали: Al, Ge,
Sb, Po (и некоторые другие. Например,
Zn) в свободном состоянии обладают
свойствами металлов, а гидроксиды
обладают свойствами и оснований, и
кислот, т.е. являются амфотерными
гидроксидами. Поэтому эти элементы
можно считать металло-неметаллами,
занимающими промежуточное
положение между металлами и
неметаллами. Таким образом,
классификация химических элементов
зависит от того, какими свойствами
будут обладать их гидроксиды:
основными — значит это металл,
кислотными — неметалл, и теми и
другими (в зависимости от условий) —
металло-неметалл. Один и тот же
химический элемент в соединениях с
низшей положительной степенью
окисления (Mn+2, Cr+2) проявляет ярко
выраженные «металлические» свойства,
а в соединениях с максимальной
положительной степенью окисления
(Mn+7, Cr+6) проявляет свойства
типичного неметалла. Чтобы увидеть
взаимосвязь простых веществ, оксидов,
гидроксидов и солей приведем сводную
таблицу.
Один и тот же
химический элемент в соединениях с
низшей положительной степенью
окисления (Mn+2, Cr+2) проявляет ярко
выраженные «металлические» свойства,
а в соединениях с максимальной
положительной степенью окисления
(Mn+7, Cr+6) проявляет свойства
типичного неметалла. Чтобы увидеть
взаимосвязь простых веществ, оксидов,
гидроксидов и солей приведем сводную
таблицу.
Формы химических элементов в свободном виде, аналитическая химия
Купить неорганические реактивы, inorganic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены неорганические реактивы — категории: ;
Купить органические соединения, реактивы, organic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены органические соединения, реактивы — реактивы Карла Фишера для волюметрии, реактивы HYDRANAL, органические растворители, органические кислоты, органические соли и соединения, категории: reagents for Karl Fischer volumetry, other reagents HYDRANAL, organic solvents, organic acids, organic salts and compounds, ; , , , , органические соединения, органические соли,реактивы Карла Фишера для волюметрии
Подробнее.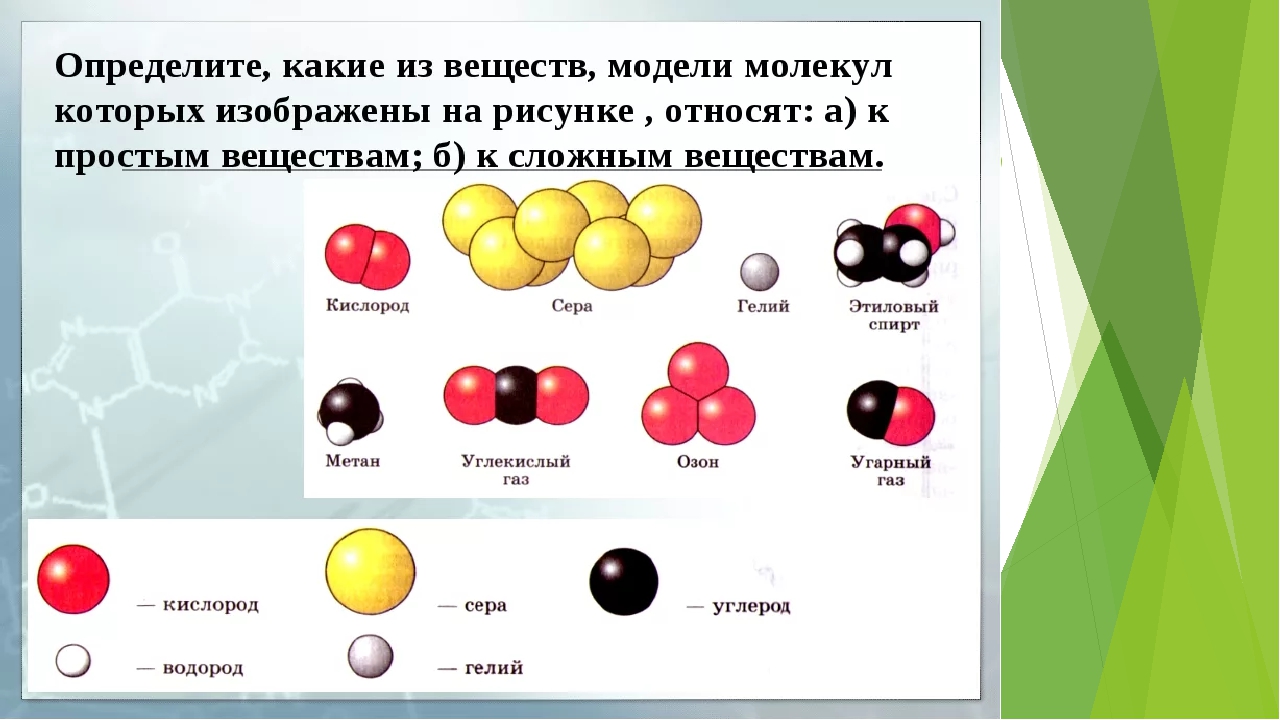 ..
Купить реактивы карла фишера для волюметрии — reagents for Karl Fischer volumetry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Использование реактивов Гидранал позволяет определить воду в составе химических реактивов, пищевых продуктов, фармацевтическихпрепаратов. Содержание воды влияет на множество химических и физических параметров выпускаемой продукции. Реактивы Карла Фишера произв…
..
Купить реактивы карла фишера для волюметрии — reagents for Karl Fischer volumetry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Использование реактивов Гидранал позволяет определить воду в составе химических реактивов, пищевых продуктов, фармацевтическихпрепаратов. Содержание воды влияет на множество химических и физических параметров выпускаемой продукции. Реактивы Карла Фишера произв…органические растворители
Подробнее… Купить органические растворители (organic solvents) в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический растворитель в Санкт-Петербурге по выгодной цене. Компания ХИМСНАБ-СПБ предлагает следующую фасовку растворителей: п/э или стеклянная бутылка 1 литр; п/э канистра 10 литров; п/э канистра 5 литров; стеклянный флакон 1 литр, бочка, и бочка, 250 кг. Реактивы и растворители.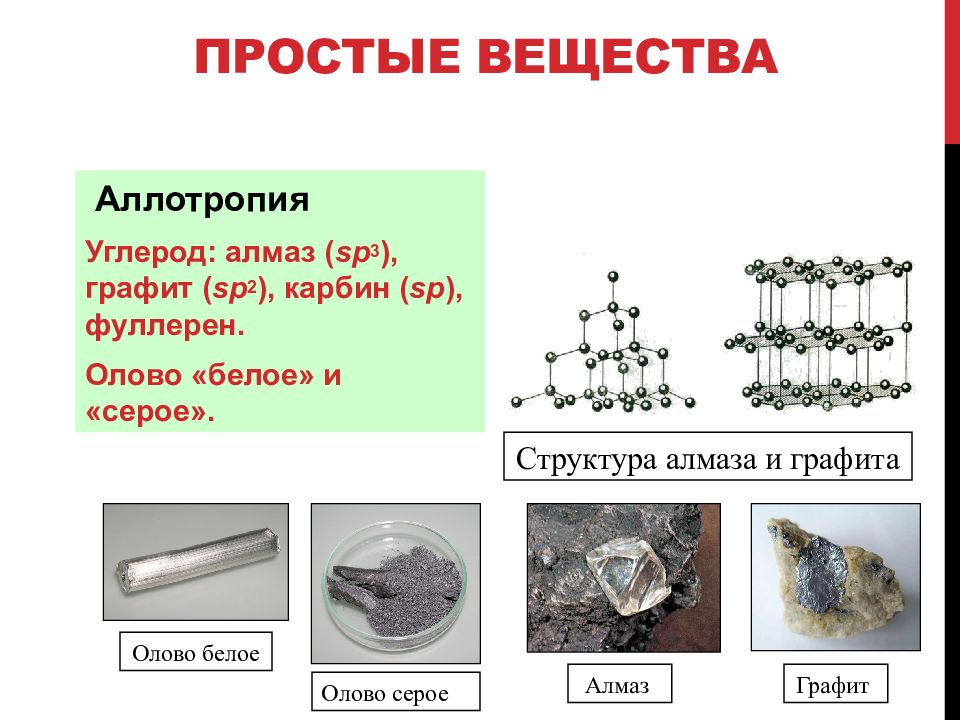 ..
..органические кислоты
Подробнее… Купить органические кислоты — organic acids в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Органические вещества, проявляющие кислотные свойства (кислоты их кислые соли и средние соли содержатся во многих товарах. Благодаря наличию свободных кислот и кислых солей многие продукты и их водные вытяжки обладают кислой реакцией. К ним относятся карбоновые кислоты, содержа…Купить химические реактивы, chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены химические реактивы — вода, неорганические реактивы, органические соединения, реактивы, растворы, особо чистые вещества, категории: water, inorganic chemicals, organic chemicals, solutions, highly purified substances, ; дистиллированная вода, вода (УФ-ВЭЖХ) для аналитики, бидистиллированная вода, вода для молекулярной биологии, , , , ,неорганические реактивы
Подробнее. ..
Купить неорганические реактивы — inorganic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Неорганическое соединение, как правило, представляет собой химическое соединение, которое не имеет связей СН , то есть соединение, которое не является органическим соединением
Химические соединения, реагенты и реактивы находят свое применение в различных областях: научные-исследов…
..
Купить неорганические реактивы — inorganic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Неорганическое соединение, как правило, представляет собой химическое соединение, которое не имеет связей СН , то есть соединение, которое не является органическим соединением
Химические соединения, реагенты и реактивы находят свое применение в различных областях: научные-исследов…органические соединения, реактивы
Подробнее… Купить органические реактивы — organic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический реактив в Санкт-Петербурге по выгодной цене. химические реактивы химические реактивы химические реактивы хим. реактивы продукцию chemicals химические реактивы, chemicals вода, неорганические реактивы, органические реактивы, растворы, особо чистые вещества особо чистые веще. ..
..растворы
Подробнее… Купить растворы — solutions в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. В каталоге ХИМСНАБ-СПБ представлен большой выбор готовых специальных растворов различного назначения: буферные растворы, растворы для заполнения, очистки и хранения электродов, стандартные растворы для кондуктометров, реактивы карла фишера для кулонометрии. Купить раствор в Санкт-Петербурге по выгодной цене: …особо чистые вещества
Подробнее… Купить особо чистые вещества (ультрачистые вещества) в Санкт-Петербурге, в компании Химснаб-СПБ, телефон +7-812-337-18-93. В высокочистых веществах содержатся примесей в незначительном количестве, что они не влияют на основные специфические свойства веществ. Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени… Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени… Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента.
Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ». Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
Что такое вещество? — Определение, типы и примеры — Видео и стенограмма урока
Типы веществ
Продолжая нашу технологическую схему, мы видим, что чистые вещества можно разделить на две подкатегории: элементы и соединения.
Элементы — это простейшая форма вещества, что означает, что они не могут быть разделены на более мелкие компоненты физически или химически. Все элементы перечислены в таблице Менделеева, а человечеству известно как минимум 118 из них! Примеры элементов включают углерод (C), водород (H), кислород (O) и натрий (Na), и это лишь некоторые из них.
Все элементы перечислены в таблице Менделеева, а человечеству известно как минимум 118 из них! Примеры элементов включают углерод (C), водород (H), кислород (O) и натрий (Na), и это лишь некоторые из них.
Соединения , с другой стороны, состоят из двух или более различных элементов, удерживаемых вместе химическими связями и функционирующих как единое целое. Хотя соединения также являются чистыми веществами, они отличаются от элементов, потому что соединения могут быть разбиты на более простые компоненты (элементы, составляющие соединение). Некоторыми примерами соединений являются диоксид углерода (CO2), ржавчина (Fe2O3) и поваренная соль (NaCl).
Примеры веществ
Давайте обсудим несколько примеров чистых веществ.
Образец кремния состоит только из одного типа атомов: атомов кремния. Следовательно, кремний — чистое вещество. Поскольку эти атомы кремния находятся в своей простейшей форме и не могут быть расщеплены дальше, вещество, кремний, также является элементом. Помните, простой способ выяснить, является ли что-то элементом, — это поискать это в периодической таблице. Все, что изображено в таблице Менделеева, является элементом и, следовательно, чистым веществом! Кремний находится под номером 14 в периодической таблице и имеет символ Si.
Помните, простой способ выяснить, является ли что-то элементом, — это поискать это в периодической таблице. Все, что изображено в таблице Менделеева, является элементом и, следовательно, чистым веществом! Кремний находится под номером 14 в периодической таблице и имеет символ Si.
Сахар имеет химическую формулу C12h32O11. Это говорит нам о том, что он состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода, связанных вместе и функционирующих как единое целое, что означает, что сахар представляет собой соединение (и может быть далее разбит на отдельные элементы: углерод, водород и кислород. ). Таким образом, сахар — это чистое вещество. Простой способ выяснить, является ли что-то составным, — это выяснить, есть ли у него химическая формула. Все, что может быть представлено химической формулой, является химическим соединением и, следовательно, чистым веществом!
Вода — это чистое вещество, в зависимости от его разновидности.Например, дистиллированная вода и морская вода имеют разные свойства.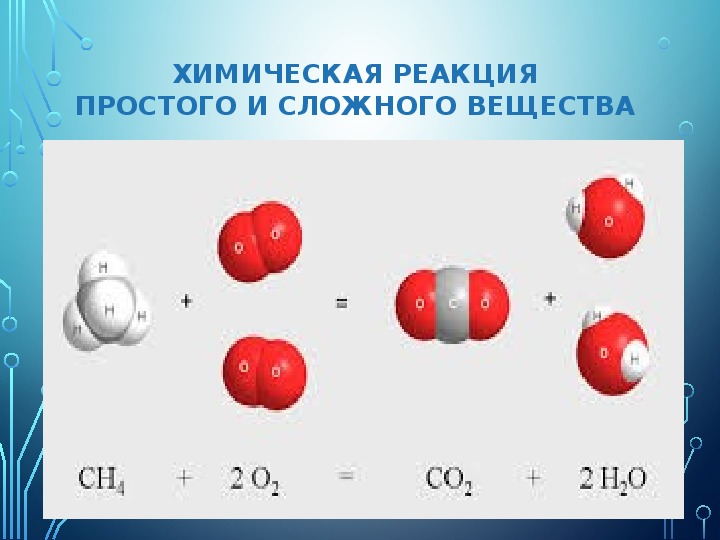 Морская вода содержит молекулы h3O, а также молекулы соли и, вероятно, многие другие ионы и атомы. Таким образом, морская вода считается смесью. Однако дистиллированная вода содержит только молекулы h3O и, следовательно, является чистым веществом. Поскольку молекулы h3O в дистиллированной воде состоят из 2 атомов водорода и 1 атома кислорода, связанных вместе и функционирующих как единое целое, чистое вещество вода классифицируется как соединение и может быть химически расщеплено на отдельные элементы — водород и кислород.
Морская вода содержит молекулы h3O, а также молекулы соли и, вероятно, многие другие ионы и атомы. Таким образом, морская вода считается смесью. Однако дистиллированная вода содержит только молекулы h3O и, следовательно, является чистым веществом. Поскольку молекулы h3O в дистиллированной воде состоят из 2 атомов водорода и 1 атома кислорода, связанных вместе и функционирующих как единое целое, чистое вещество вода классифицируется как соединение и может быть химически расщеплено на отдельные элементы — водород и кислород.
Резюме урока
Вещество — это просто чистая форма вещества . Другими словами, вещество — это материя, содержащая только один тип атома или молекулы. Чистые вещества можно разделить на две подкатегории: элементы и соединения. Элементы — это простейшая форма материи, что означает, что они не могут быть разделены на более мелкие компоненты физически или химически. Соединения , с другой стороны, состоят из двух или более различных элементов, удерживаемых вместе химическими связями и действующих как единое целое.
Два типа чистых веществ
| Элементы | Соединения |
|---|---|
| * Нельзя разделить на более мелкие компоненты * Можно найти в таблице Менделеева * Пример: Железо | * Состоит из двух или более элементов, скрепленных химическими связями и функционирующих как единое целое * Пример: диоксид углерода, вода |
Результаты обучения
Когда вы закончите, вы должны уметь:
- Сформулировать определения вещества, вещества и смеси
- Обсудите два типа чистых веществ
- Приведите примеры чистых веществ
чистых веществ и смесей — химия для детей
В чем дело?
Материя может быть определена как любое вещество, которое имеет инерцию, занимает пространство и имеет массу.
Как классифицируется вещество?
Ученые мира классифицируют материю как твердую, жидкую или газообразную, но есть еще один интересный способ ее классификации. Материя также может быть отнесена к чистым веществам и смесям.
Что такое чистое вещество?
Чистая субстанция — это материя, которая существует в своей самой основной или самой чистой форме и не может быть подвергнута дальнейшему разложению. Примеры чистых веществ включают воду, газы, такие как углекислый газ, кислород и металлы, такие как платина, золото и серебро.
Каждое чистое вещество обладает собственным набором уникальных химических и физических свойств, которые помогают нам идентифицировать его.
Примеры чистых веществ
Вода имеет температуру замерзания и плавления 0 ° C и точку кипения 100 ° C. Он бесцветный, безвкусный и без запаха.
Золото считается чистым — 24 карата. Он желтого цвета, твердый при комнатной температуре и считается хорошим проводником электричества. Он также податлив и пластичен по своей природе.
Он также податлив и пластичен по своей природе.
Виды чистых веществ
Чистые вещества можно разделить на две категории — элементы и соединения.
Элементы состоят из атомов одного типа. Известные элементы, перечисленные в таблице Менделеева, можно считать чистыми веществами. Примеры элементов включают водород, кислород, золото, серебро.
Соединения состоят из атомов разных типов, соединенных химическими связями. Примеры соединений включают воду, глюкозу, соль и диоксид углерода.
Что такое смесь?
Смесь — это комбинация двух или более чистых веществ, каждое из которых сохраняет свою индивидуальность при смешивании.Смеси присутствуют практически повсюду на Земле. Посмотрите на скалы, океан, реки или даже на атмосферу. Все они смеси! Другими словами, все, что вы можете смешать, является смесью. Даже продукты, которые вы едите.
Почему это называется смесью?
Это означает, что основная химическая структура компонентов смеси не изменяется при смешивании.
Примеры смесей
Хотя вода — чистое вещество, если вы поместите песок в стакан с водой, он превратится в смесь.Каждый из компонентов смеси можно отделить друг от друга. Вы всегда можете отделить песок от воды, отфильтровав ее.
Если вы возьмете смесь соли и воды, ее можно разделить, выпарив воду, чтобы в контейнер попала соль. Воздух также представляет собой смесь различных газов, таких как углекислый газ, кислород, азот, водяной пар и т. Д. Кровь — это смесь, состоящая из разных типов клеток крови и плазмы.
Виды смесей
- Однородная смесь — Компоненты однородной смеси имеют однородный состав и не могут быть рассмотрены по отдельности.Приставка «гомо» означает одно и то же и говорит нам о том, что, когда два вещества очень хорошо сочетаются друг с другом, они образуют однородную смесь. Например, сахар и вода не вступают в химическую реакцию и не образуют другого соединения, хотя вода становится сладкой!
- Гетерогенная смесь — Компоненты гетерогенной смеси не имеют однородного состава и могут рассматриваться отдельно, не теряя своей идентичности.
 Например, если вы смешаете порошок серы с железной пылью, вы легко увидите их по отдельности.Вы даже можете отделить железную пыль с помощью магнита.
Например, если вы смешаете порошок серы с железной пылью, вы легко увидите их по отдельности.Вы даже можете отделить железную пыль с помощью магнита.
Как отличить чистые вещества от смесей?
- Чистое вещество — это материя, которую нельзя разделить на основные компоненты с помощью физических или химических процессов. Физические и химические свойства чистых веществ неизменны, если они остаются без нарушения.
- Смесь состоит из комбинации двух или более веществ, которые не соединяются с помощью химической реакции.Физические и химические свойства смесей различаются.
Наука на расстоянии
Наука на расстоянии Наука на расстоянииКонспект лекций
проверка
Используйте этот раздел, чтобы проверить точность ваших лекционных заметок. Убедитесь, что вы записали следующие определения, объяснения и важные концепции в своих заметках.
Физическая структура — Часть первая
Атомов
Атом — это наименьшая единица чистого вещества или элемента, которая может существовать и при этом сохранять свойства исходного вещества или элемента.
- Ключевые идеи:
- обычных веществ, таких как воздух, вода, дерево и ткань, представляют собой смеси материалов и могут быть химически или физически разложены на более простые вещества.
- чистое или элементарное вещество не может быть разбито на более мелкие или простые составляющие без потери всех своих первоначальных свойств; такие чистые вещества называются элементами .
- Каждый элемент состоит из идентичных частиц материи, называемых атомов .
- Все атомы в чистом веществе или элементе идентичны друг другу, но отличаются от атомов в другом элементе.
- 92 природных элемента и еще 13 созданы в лаборатории.
Атомы жизни
Три самых распространенных элемента на Земле — это кислород, кремний и алюминий; В живых организмах шесть наиболее распространенных элементов — это углерод, водород, азот, кислород, фосфор и сера.- Ключевые идеи:
- Уникальные химические свойства всего нескольких атомов определяют форму и функции всего живого.

- Физические и химические свойства всех элементов являются результатом возникновения субструктуры их атомов.
Субатомные частицы
Есть три типа субатомных частиц, которые находятся в атомах всех элементов, кроме одного.- Ключевые идеи:
- протонов — это небольшие положительно заряженные частицы с массой, по определению, равной одной единице (одна а.е.м.).
- нейтронов — нейтральные частицы без электрического заряда, также с массой в одну единицу (один a.м.у.).
- электронов очень маленькие отрицательно заряжают частицу с очень малой массой, которой можно пренебречь.
Атомная подструктура
Каждый атом имеет одинаковую субструктуру с плотным положительно заряженным центром (иногда называемым атомным ядром ), окруженным рассеянным, быстро движущимся числом отрицательно заряженных частиц.- Ключевые идеи:
- протона всегда находятся в атомном центре.

- нейтрона всегда находятся в атомном центре.
- электронов всегда находят распределенными в быстро движущихся диффузных облаках или орбиталях определенного объема и формы на различных расстояниях от центра атома.
- в сбалансированном нейтральном атоме количество протонов всегда равно количеству электронов.
- большая часть атома — это пустое пространство.
- Сумма масс всех протонов и нейтронов в атоме называется атомной массой .
- число протонов в атоме называется атомным номером
Физические свойства атомов
Два важных физических свойства всех атомов зависят от их атомной массы и относительного количества протонов и нейтронов в атомном центре.- Ключевые идеи:
- масса или вес атома зависит от количества протонов и нейтронов, которые он содержит.
- атомов элементов, содержащих больше протонов и нейтронов, имеют большую общую массу.
- некоторые элементы имеют диапазон или ряд атомных масс, в которых количество протонов всегда постоянно, но количество нейтронов меняется.

- некоторые из этих устройств нестабильны, и атомы самопроизвольно взрываются и испускают излучение; это радиоактивных форм элемента.
Изотопы
Изотопы — это семейства атомов, которые имеют одинаковый атомный номер, но разные атомные массы.- Ключевые идеи:
- водород — элемент с тремя изотопами.
- наиболее распространенная форма водорода (записанная в химической записи как H ) имеет единственный протон в центре и не имеет нейтронов.
- Другая форма водорода, называемая дейтерий, состоит из одного протона и одного нейтрона.
- Третья форма водорода, называемая тритием, имеет один протон и два нейтрона.
- Атомная субструктура трития нестабильна и радиоактивна.
Электронные устройства
Электроны заряжены отрицательно и поэтому притягиваются к положительно заряженным протонам в центре атома. Они также отталкиваются отрицательными зарядами других электронов. Электроны обладают фиксированным количеством энергии, и этот уровень энергии определяет, насколько близко или далеко от атомного центра они расположены.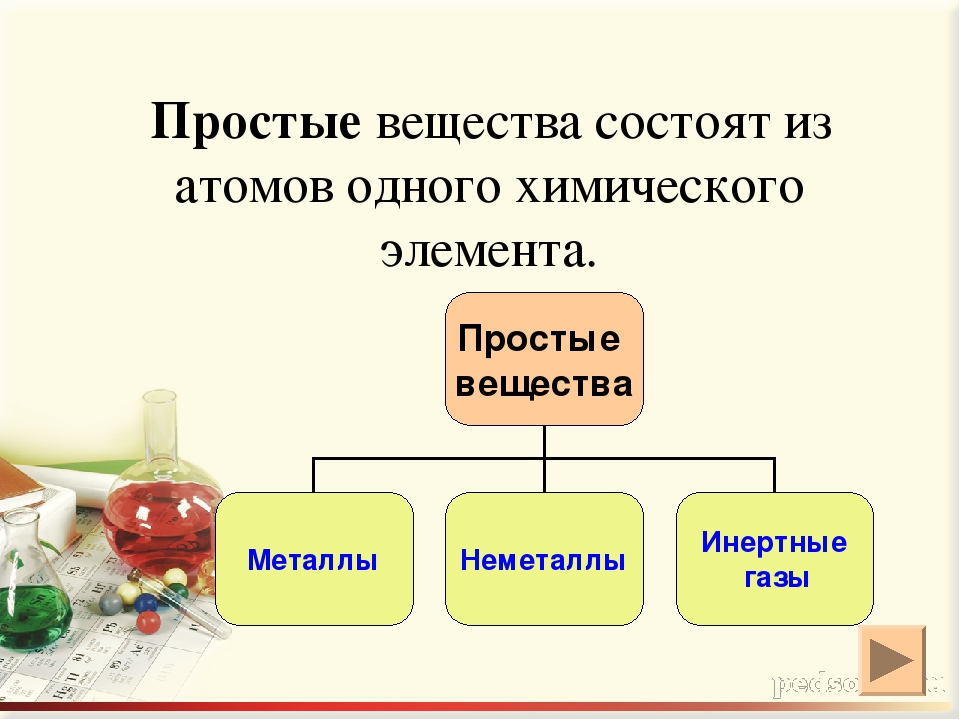
- Ключевые идеи:
- баланс всех сил содержания энергии и зарядов определяет объем или форму пространства, которое электрон может занимать вокруг атомного центра атома.
- электронов находятся в зонах, называемых энергетическими уровнями , на увеличивающихся расстояниях от атомного центра.
- уровень энергии, ближайший к центру атома, самый маленький и самый низкий по энергии. Электроны с низкой энергией занимают этот уровень.
- следующий энергетический уровень по большей части находится дальше от атомного центра. Электроны на этом уровне энергии содержат больше энергии, чем на первом.
- только два электрона могут занимать первый энергетический уровень одновременно.
- только максимум восемь электронов могут занимать второй энергетический уровень одновременно.
Орбитали
По мере того, как они диффундируют и перемещаются по ядру, электроны ограничены определенными объемами или формами пространства, называемыми орбиталями .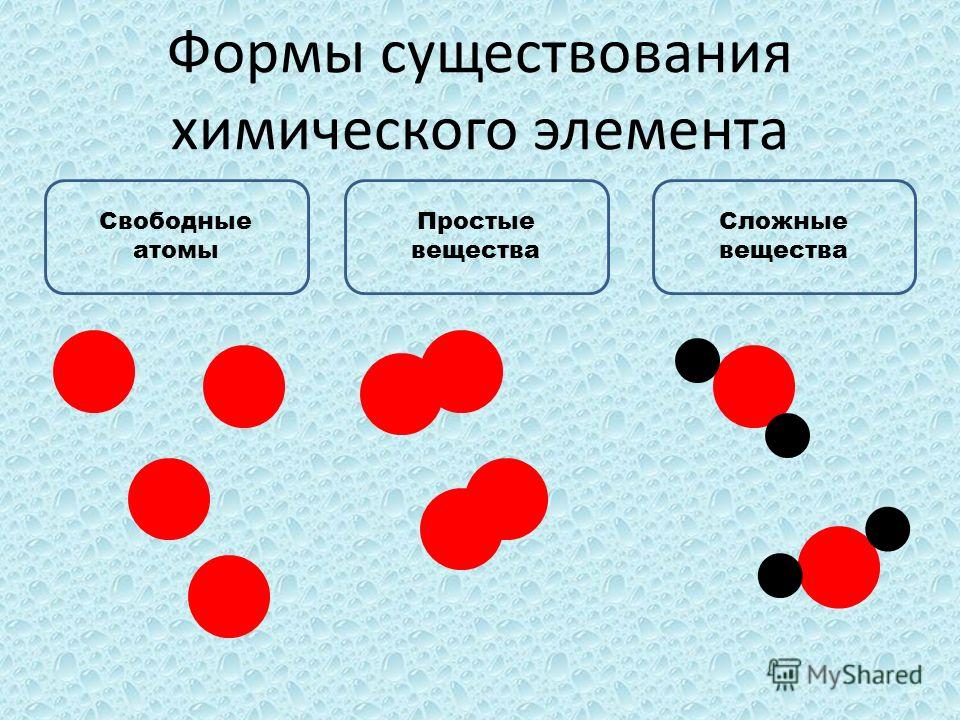
- Ключевые идеи:
- : только максимум два электрона могут находиться на любой орбитали или занимать их одновременно.
- самый низкий энергетический уровень имеет только одну орбиталь в форме сферы, называемую орбиталью 1s .
- два электрона — максимальное количество, обнаруживаемое в любой момент времени на этой орбитали.
- Второй энергетический уровень имеет четыре орбитали.
- Орбиталь 2s имеет форму сферы и удерживает максимум два электрона.
- есть три 2p-орбитали, которые имеют форму гантели и снова содержат максимум два электрона каждая.
Атомная стабильность
Атомы наиболее стабильны и наименее реактивны, когда их внешний энергетический уровень либо полностью заполнен электронами, либо полностью лишен электронов.- Ключевые идеи:
- водород, имеющий только один электрон на первом уровне энергии, является химически реактивным.
- гелий с двумя электронами на первом уровне энергии инертен и практически не имеет химических или реактивных свойств (первый уровень энергии не полон).

- Натрий имеет один электрон на внешнем уровне энергии, он очень реактивен.
- Хлор имеет семь электронов на внешнем энергетическом уровне, он тоже очень реактивен.
- Химические свойства элемента очень сильно зависят от количества электронов, которые атомы этого элемента имеют на своем внешнем энергетическом уровне.
Стабильность I: ионы
Один из способов перехода атома в более стабильное состояние состоит в том, чтобы набирать или терять электроны с его внешнего энергетического уровня до тех пор, пока этот энергетический уровень не станет полным или пустым.- Ключевые идеи:
- атом водорода может отдать свой один электрон со своего первого энергетического уровня.
- на этом энергетическом уровне теперь нет электронов, и полученная атомная форма более стабильна.
- оставшаяся атомная частица теперь состоит из одного протона с положительным зарядом, который больше не нейтрализуется электроном.
- эта атомная частица теперь называется ионом .

- атомы элемента хлора имеют семь электронов на внешнем энергетическом уровне.
- эти атомы хлора легко принимают пожертвованные электроны, чтобы заполнить этот энергетический уровень.
- новая атомная частица теперь имеет дополнительный отрицательно заряженный электрон, который не нейтрализуется протоном в атомном центре, но это более стабильное атомное расположение.
- эта атомная частица теперь является отрицательно заряженным ионом хлорида.
- ионизация — это термин, используемый для такого обмена электронами и образования положительно или отрицательно заряженных атомных частиц.
Stability II: совместное использование
Атомы могут объединяться вместе и обмениваться электронами между собой.Атомы с общими электронами связаны друг с другом в форме, называемой молекулой , которая находится в более низком энергетическом состоянии, чем любой из отдельных атомов.- Ключевые идеи:
- , когда два атома водорода приближаются друг к другу, их положительно заряженные центры притягиваются к отрицательно заряженным электронным облакам, окружающим противоположный атом.

- на определенном расстоянии друг от друга два крайних энергетических уровня (и орбитали) сливаются вместе и образуют единую сложную молекулярную орбиталь .
- эта новая орбиталь теперь содержит два электрона, по одному от каждого атома в общих отношениях.
- Эта новая компоновка более устойчива, чем исходная.
- требуется энергия, чтобы развести эти атомы друг от друга, поэтому атомы остаются вместе, как если бы они были связаны энергетическим клеем .
- эти силы, удерживающие атомы вместе, называются ковалентными связями .
- одинарная ковалентная связь удерживает два атома вместе, в то время как они разделяют два электрона.
Метан: органическая молекула
Атомы разных элементов могут обмениваться электронами, образовывать между собой ковалентные связи и создавать сложные молекулы.- Ключевые идеи:
Углерод
- имеет только четыре электрона на внешнем энергетическом уровне.

- углерод может разделять эти четыре электрона и получать четыре электрона от других атомов, образуя четыре ковалентные связи.
- водород имеет только один электрон на внешнем энергетическом уровне.
- водород может разделять этот электрон, образуя одну ковалентную связь.
- один атом углерода и четыре атома водорода могут объединиться.
- каждый атом водорода имеет два общих электрона (один от атома водорода, один от атома углерода) с атомом углерода, образуя ковалентную связь.
- Образовавшаяся молекула имеет один атом углерода в центре и четыре атома водорода, прикрепленных к нему четырьмя ковалентными связями.
- это молекула под названием метан .
- молекул, состоящих из углерода и водорода, скрепленных ковалентными связями, часто называют органических молекул , потому что они впервые были обнаружены в живых организмах.
Молекула воды
Молекула воды состоит из одного атома кислорода, связанного двумя ковалентными связями с двумя атомами водорода.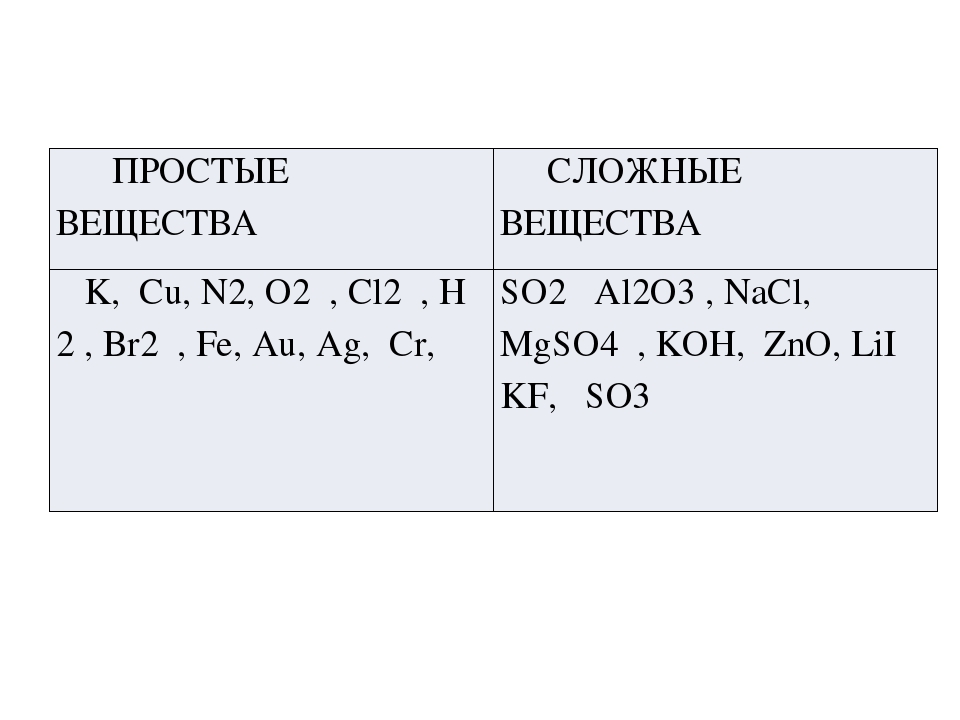 Электроны в этих связях не распределяются между атомами поровну. Этот тип ковалентной связи называется полярной .
Электроны в этих связях не распределяются между атомами поровну. Этот тип ковалентной связи называется полярной . - Ключевые идеи:
Кислород
- является электроотрицательным элементом .
- электронов плотно прижаты к атому кислорода.
- в схеме совместного использования между атомом кислорода и атомом водорода (ковалентная связь) электроны проводят больше времени рядом с атомом кислорода или вокруг него, чем атом водорода.
- атом кислорода приобретает небольшой отрицательный заряд (из-за наличия дополнительных электронов).
- атомы водорода развивают небольшой положительный заряд (от оставшегося протона, который не полностью нейтрализуется отсутствующими электронами).
- молекула воды, следовательно, имеет небольшое, очень слабое распределение электрического заряда; положительный по атомам водорода и отрицательный по атому кислорода.
- Вода представляет собой молекулу с полярностью .
Особые свойства воды I: жидкость
Полярность молекулы воды придает ей некоторые особые свойства, первое из которых состоит в том, что вода является жидкостью при комнатной температуре.
- Ключевые идеи:
- Вода представляет собой небольшую молекулу, меньшую, чем молекулярный кислород.
- Кислород — это газ при комнатной температуре, а вода — жидкость.
- Вода полярна, с небольшими положительными и отрицательными зарядами на водородном и кислородном компонентах молекулы.
- положительный заряд одной молекулы воды притягивает отрицательный заряд соседней молекулы воды, и они ненадолго удерживаются вместе.
- эта крошечная сила притяжения называется водородной связью .
- миллиарды и миллиарды водородных связей образуются и разрываются между молекулами воды каждую секунду.
- Сумма всех этих притяжений удерживает молекулы воды ближе друг к другу, чем они не образовывались.
- Материя, находящаяся в скоплении молекул воды, больше похожа на жидкость, чем на газ.
- нагревание молекул воды вызывает увеличение кинетической энергии, большее движение и разрыв водородных связей.
- при достаточно высоких температурах вода превращается в газ (пар).

Особые свойства воды II: растворитель
Растворитель — это жидкость, в которой будут растворяться другие твердые вещества и жидкости.Вода — почти универсальный растворитель, в котором до некоторой степени растворяется большинство других веществ.- Ключевые идеи:
- Вода может растворять больше веществ, чем любой другой растворитель.
- Растворенное вещество — растворенное вещество.
- Степень растворения растворенного вещества в воде зависит от природы и распределения электрических зарядов, которые оно имеет или может развить.
- Ионы, которые имеют сильный положительный или отрицательный заряд, легко и легко растворяются в воде.Электрические заряды на молекулах растворенного вещества притягиваются к полярным зарядам на молекулах воды.
- такие вещества называются гидрофильными , что означает водолюбивых .
- Молекулы, такие как метан и другие подобные молекулы (например, содержащиеся в углеводородах — см.
 Ниже), не имеют зарядов на своей поверхности и не являются полярными.
Ниже), не имеют зарядов на своей поверхности и не являются полярными. - Нет притяжения между водой и этими типами молекул, поэтому они образуют границу на границе раздела, в которой один тип молекулы остается на одной стороне, а другой тип молекулы остается на другой стороне.
- все такие вещества гидрофобны означает водобоязнь
Наука на расстоянии
© 1997, 1998, 1999, 2000, профессор Джон Бламир
Химическое вещество — Энциклопедия Нового Света
Вода и пар — это две разные формы одного и того же химического вещества.Химическое вещество — это любой материал, имеющий определенный химический состав. [1] Более того, чистое вещество не может быть разделено на другие вещества никаким механическим способом. [2] Химические элементы и соединения — вещества, смеси — нет.
Примеры известных химических веществ: чистая вода, поваренная соль (хлорид натрия) и сахар (сахароза). Обычно вещества существуют в твердой , жидкой или газовой фазе , и они могут переходить из одной фазы в другую во время изменений температуры или давления.
Обычно вещества существуют в твердой , жидкой или газовой фазе , и они могут переходить из одной фазы в другую во время изменений температуры или давления.
Вещество фиксированного состава
Представление о химическом веществе прочно утвердилось в конце восемнадцатого века после работы химика Джозефа Пруста по составу некоторых чистых химических соединений, таких как основной карбонат меди. [3] Он пришел к выводу, что: «Все образцы соединения имеют одинаковый состав; то есть все образцы имеют одинаковые массовые пропорции элементов, присутствующих в соединении». Это стало известно как закон постоянного состава, и это одна из основ современной химии. Например, образец чистой воды имеет одинаковые свойства и одинаковое отношение водорода к кислороду, независимо от того, выделен ли образец из реки (и затем очищен) или получен в результате химической реакции в лаборатории.
Химические элементы
Химическое вещество, которое не может быть расщеплено или преобразовано с помощью обычных химических процессов в другое вещество, называется химическим элементом (часто называемым просто элементом ). Элемент состоит из частиц, называемых атомами , которые состоят из отрицательно заряженных электронов , распределенных вокруг ядра положительно заряженных протонов и незаряженных нейтронов .Все атомы в образце элемента имеют одинаковое количество протонов, хотя они могут быть разными изотопами , , с разным количеством нейтронов.
Элемент состоит из частиц, называемых атомами , которые состоят из отрицательно заряженных электронов , распределенных вокруг ядра положительно заряженных протонов и незаряженных нейтронов .Все атомы в образце элемента имеют одинаковое количество протонов, хотя они могут быть разными изотопами , , с разным количеством нейтронов.
Известно около 120 элементов, около 80 из которых стабильны, то есть не превращаются в результате радиоактивного распада на другие элементы. Элементы классифицируются как металлы, неметаллы и металлоиды.
Большинство элементов классифицируются как металлы . Эти элементы, такие как железо, медь и золото, имеют характерный блеск.Вообще говоря, металлы являются хорошими проводниками тепла и электричества, они пластичны и пластичны. [4]
Около дюжины элементов [5] , таких как углерод, азот и кислород, классифицируются как неметаллы . Им не хватает металлических свойств, описанных выше. Они также обладают высоким значением электроотрицательности и склонностью к образованию отрицательных ионов, называемых анионами.
Они также обладают высоким значением электроотрицательности и склонностью к образованию отрицательных ионов, называемых анионами.
Некоторые элементы, такие как кремний, обладают некоторыми свойствами металлов и некоторыми неметаллами.Они известны как металлоидов .
Химические соединения
Два или более элемента, объединенных в одно вещество, образуют так называемое химическое соединение . Соединение состоит из атомов элементов , связанных между собой , с образованием молекул .
Огромное количество химических соединений может быть произведено путем объединения примерно 120 химических элементов. В настоящее время идентифицировано и охарактеризовано около 30 миллионов соединений. [6] Соединения, в основе которых лежат в основном атомы углерода и водорода, называются органическими соединениями , а все остальные называются неорганическими соединениями . Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями .
Соединения, в которых атомы элементов разделяют электроны, известны как ковалентные соединения. Соединения, в которых противоположно заряженные ионы удерживаются вместе за счет электростатических взаимодействий, известны как ионные соединения (или соли).
Вещества и смеси
Химические вещества часто тщательно перемешиваются, образуя так называемые смеси . Смеси не имеют фиксированного состава. В принципе, их можно разделить на составляющие вещества чисто механическими процессами. Раствор сахара (сахарозы) в воде представляет собой смесь. Еще один пример смесей — масло и почва.
Металлический серый чугун и желтая сера являются химическими элементами, и их можно смешивать в любом соотношении с образованием желто-серой смеси.Никакого химического процесса не происходит, и материал можно идентифицировать как смесь по тому факту, что сера и железо могут быть разделены с помощью механического процесса, такого как использование магнита для оттягивания железа от серы.
Напротив, если железо и сера нагреваются вместе в определенном соотношении (56 грамм (один моль) железа на 32 грамма (один моль) серы), происходит химическая реакция и образуется новое вещество, а именно: соединение сульфида железа (II) с химической формулой FeS. Полученное соединение обладает всеми свойствами химического вещества и не является смесью.Сульфид железа (II) имеет свои собственные отличные свойства, такие как температура плавления и растворимость, и два элемента не могут быть разделены с помощью обычных механических процессов; магнит не сможет восстановить железо, поскольку в соединении нет металлического железа.
Наименование химических веществ
Для обозначения химических веществ химики используют правила, сформулированные Международным союзом теоретической и прикладной химии (IUPAC) или Chemical Abstracts Service (CAS). Таким образом, каждому химическому веществу дается уникальное систематическое название.Многие соединения также известны под их более распространенными и простыми названиями, многие из которых предшествуют их систематическим названиям. Например, глюкоза — это распространенное название для давно известного типа сахара. Его систематическое название — 6- (гидроксиметил) оксан-2,3,4,5-тетрол. Кроме того, многие натуральные продукты и фармацевтические препараты получили более простые названия. Например, мягкое болеутоляющее напроксен — более распространенное название химического соединения (S) -6-метокси-α-метил-2-нафталинуксусной кислоты.
Например, глюкоза — это распространенное название для давно известного типа сахара. Его систематическое название — 6- (гидроксиметил) оксан-2,3,4,5-тетрол. Кроме того, многие натуральные продукты и фармацевтические препараты получили более простые названия. Например, мягкое болеутоляющее напроксен — более распространенное название химического соединения (S) -6-метокси-α-метил-2-нафталинуксусной кислоты.
Химики часто ссылаются на химические соединения, используя химические формулы, которые содержат более подробную информацию о структуре соединения.Для информации о веществах были разработаны удобные для компьютера системы, такие как регистрационный номер CAS, SMILES (упрощенная спецификация ввода строки молекулярного ввода) и Международный химический идентификатор (InChI). Помимо использования в компьютерных базах данных, эти системы, особенно номер CAS, стали полезными в бумажной работе в качестве уникальных кодов для идентификации конкретных веществ.
| Общее название | Систематическое название | Химическая формула | Химическая структура | Регистрационный номер CAS | ИнЧИ |
|---|---|---|---|---|---|
| спирт или этиловый спирт | этанол | C 2 H 5 OH | [64-17-5] | 1 / C2H6O / c1-2-3 / h4H, 2х3,1х4 |
Выделение, очистка, характеристика и идентификация
Часто чистое вещество необходимо изолировать от смеси, например, из природного источника (где образец часто содержит многочисленные химические вещества или после химической реакции (которая часто дает смеси химических веществ). Обычно это делается с использованием физических процессов, таких как дистилляция, фильтрация, жидкостно-жидкостная экстракция и выпаривание. Эти же методы, наряду с другими, такими как перекристаллизация, также могут использоваться для очистки вещества. После приготовления чистого материала можно исследовать его химические и физические свойства, чтобы охарактеризовать вещество. Наконец, химический анализ может быть использован для определения химического состава и определения чистоты.
Обычно это делается с использованием физических процессов, таких как дистилляция, фильтрация, жидкостно-жидкостная экстракция и выпаривание. Эти же методы, наряду с другими, такими как перекристаллизация, также могут использоваться для очистки вещества. После приготовления чистого материала можно исследовать его химические и физические свойства, чтобы охарактеризовать вещество. Наконец, химический анализ может быть использован для определения химического состава и определения чистоты.
См. Также
Банкноты
- ↑ Хилл, Дж.W., R.H. Petrucci, T.W. МакКрири и С.С.Перри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2005.
- ↑ Эббинг Д. Д. и С. Д. Гаммон. Общая химия , 7-е изд. Бостон, Массачусетс: Houghton Mifflin, 2002.
- ↑ Хилл, Дж. У., Р. Х. Петруччи, Т. МакКрири и С.С.Перри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2005.
- ↑ Хилл, Дж. У., Р.
 Х. Петруччи, Т. МакКрири и С.С.Перри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2005.
Х. Петруччи, Т. МакКрири и С.С.Перри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2005. - ↑ Граница между металлоидами и неметаллами неточная, как объяснялось в предыдущей ссылке.
- ↑ Счетчик веществ в Chemical Abstracts Проверено 2 декабря 2007 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Браун-младший, Теодор Л., Х. Юджин Лемей, Брюс Эдвард Бурстен и Джулия Р.Бердж. 2002. Химия: Центральные науки . 9 изд. Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. ISBN 0130669970
- Чанг, Раймонд, 2006. Химия . 9 изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Science / Engineering / Math. ISBN 0073221031
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Продвинутая неорганическая химия . 4-е изд. Нью-Йорк, штат Нью-Йорк: Wiley. ISBN 0-471-02775-8
- Гринвуд, Н. Н. и А. Эрншоу. 1998. Химия элементов .2-е изд. Оксфорд, Великобритания; Берлингтон, Массачусетс: Баттерворт-Хайнеманн, Elsevier Science.
 ISBN 0750633654. Онлайн-версия, получено 2 декабря 2007 г.
ISBN 0750633654. Онлайн-версия, получено 2 декабря 2007 г. - Stwertka, Альберт. 1998. Путеводитель по элементам . Исправленное издание. Оксфорд, Великобритания: Издательство Оксфордского университета. ISBN 0-19-508083-1
Кредиты
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Элементы, соединения и смеси
Элементы, Соединения и смеси
Элементы
Известно любое вещество, содержащее только один вид атома. как элемент . Потому что атомы не могут быть созданы или разрушаются в химической реакции, такие элементы, как фосфор (P 4 ) или сера (S 8 ) не может быть разбита на более простые веществами этими реакциями.
Пример: вода разлагается на смесь водорода и кислород, когда через жидкость пропускают электрический ток.С другой стороны, водород и кислород не могут быть разложены на более простые вещества. Следовательно, они являются элементарными, или простейшие, химические вещества — элементы.
Каждый элемент представлен уникальным символом. Обозначение
для каждого элемента можно найти в периодической таблице элементов.
Элементы можно разделить на три категории, которые имеют характерные свойства: металлы, неметаллы и полуметаллы. Большинство элементов — это металлы, которые находятся слева и ближе к нижняя часть таблицы Менделеева.Горстка неметаллов сгруппированы в правом верхнем углу периодической таблицы. В полуметаллы можно найти по разделительной линии между металлы и неметаллы.
Атомы
Элементы состоят из атомов, самые маленькие частица, обладающая любым из свойств элемента. Джон Дальтон в 1803 г. предложил современную теорию атома, основанную на следующие предположения.
1. Дело составлено атомов, которые неделимы и неразрушимы. |
2. Все атомы элемента являются идентичный. |
3. |
4. Атомы различных элементов. объединяйте в простые целые числа, чтобы образовать соединения. |
5. Атомы не могут быть созданы или уничтожен.Когда соединение разлагается, атомы восстановлен без изменений. |
Соединения
Элементы объединяются в химические соединения, которые часто разделены на две категории.
Металлы часто реагируют с неметаллами с образованием ионных соединений . Эти соединения состоят из положительных и отрицательных ионов, образованных путем добавления или вычитания электронов из нейтральных атомов и молекулы.
Неметаллы объединяются друг с другом, образуя ковалентную форму .
соединения , существующие в виде нейтральных молекул.
Сокращенное обозначение соединения описывает количество атомов каждого элемента, который обозначен нижним индексом, написанным после символа элемента. По соглашению, нижний индекс не используется. записывается, когда молекула содержит только один атом элемента. Таким образом, вода — это H 2 O, а диоксид углерода — это CO 2 .
Характеристики Ионные и ковалентные соединения
Ионный Соединения | Ковалентные соединения | |
Содержит положительные и отрицательные ионы (Na + Cl —) | Существуют как нейтральные молекулы (C 6 H 12 O 2 ) | |
Твердые вещества такие как поваренная соль (NaCl (s) ) | Твердые, жидкие или газы (C 6 H 12 O 6 (с) , H 2 O (л) , CO 2 (г) ) | |
Высокая точки плавления и кипения | Нижняя плавка и
точки кипения (т. | |
Сильный сила притяжения между частицами | Относительно слабое усилие притяжения между молекулами | |
Отдельно в заряженные частицы в воде, чтобы получить раствор, который проводит электричество | Остаться той же самой молекулы в воде и не будет проводить электричество | |
Определение наличия Соединение ионное или ковалентное
Рассчитайте разницу между электроотрицательностями
два элемента в соединении и среднее их
электроотрицательности, и найти пересечение этих значений на
рисунок, показанный ниже, чтобы помочь определить, является ли соединение ионным
или ковалентный, или металлический.
| Практическая задача 1: Для каждое из следующих соединений, предскажите, будете ли вы можно было бы ожидать, что он будет ионным или ковалентным. (а) оксид хрома (III), Cr 2 O 3 (б) четыреххлористый углерод, CCl 4 (в) метанол, CH 3 OH (г) фторид стронция, SrF 2 Нажмите здесь чтобы проверить свой ответ на практическую задачу 1 |
| Практическая задача 2: Использование
следующие данные, чтобы предложить способ различения
между ионными и ковалентными соединениями.
Нажмите здесь, чтобы проверить свой ответ на практическую задачу 2 |
Формулы
Молекула — самая маленькая частица, имеющая любую из
свойства соединения. Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться количеству отрицательных зарядов.
Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться количеству отрицательных зарядов.
Примеры:
| CaCl 2 | Сбалансированная формула имеет 2 положительных заряда (1 кальций ион с +2 зарядом) и 2 отрицательных заряда (2 хлорида ионы с зарядом -1) |
| Al 2 (SO 4 ) 3 | Сбалансированная формула имеет 6 положительных зарядов (2 алюминиевых ионы с зарядом +3) и 6 отрицательных зарядов (3 сульфатных ионов с зарядом -2) |
Смеси Vs.Соединения
Закон постоянного состава гласит, что
соотношение по массе элементов в химическом соединении равно
всегда одинаково, независимо от источника соединения. В
закон постоянного состава может использоваться, чтобы различать
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по массе независимо от его источника. Латунь — это
пример смеси двух элементов: меди и цинка.Оно может
содержат от 10% до 45% цинка.
В
закон постоянного состава может использоваться, чтобы различать
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по массе независимо от его источника. Латунь — это
пример смеси двух элементов: меди и цинка.Оно может
содержат от 10% до 45% цинка.
Еще одно различие между соединениями и смесями элементов это легкость, с которой можно разделить элементы. Смеси, такие как атмосфера, содержат два или более веществ, которые относительно легко отделить. Отдельные компоненты смеси могут быть физически отделены друг от друга.
Химические соединения сильно отличаются от смесей: элементы в химическом соединении могут быть разделены только уничтожение соединения.Некоторые различия между химическими соединения и смеси элементов иллюстрируются следующий пример с использованием изюмных отрубей и «Криспикс.».
Изюмовые отруби имеют следующие характерные свойства смеси .
- Крупа не имеет постоянного состава; в
соотношение изюма и хлопьев из отрубей меняется от образца к
образец.

- Легко физически разделить два «элементы», чтобы выбрать изюм, для пример, и съесть их отдельно.
Crispix обладает некоторыми характеристиками, присущими составу .
- Соотношение рисовых хлопьев и кукурузных хлопьев постоянно; Это составляет 1: 1 в каждой выборке.
- Нет возможности разделить «элементы» не разрывая узы, скрепляющие их вместе.
Определение вещества в химии.
Примеры содержания в следующих темах:
Вещества и смеси
- Вещества состоят из чистых элементов или химически связанных элементов, тогда как смеси состоят из несвязанных веществ .
- Все соединения составляют веществ , но не все веществ являются соединениями.
- Простые или кажущиеся чистыми вещества , встречающиеся в природе, на самом деле могут быть смесями химических веществ .

- Смесь относится к физической комбинации двух или более веществ , в которой сохранены идентичности отдельных веществ .
- Введение в классификацию вещества как веществ или смеси веществ .
Молярная масса соединений
- Молярная масса определенного вещества — это масса одного моля этого вещества .
- Даже самое маленькое количество вещества будет содержать миллиарды атомов, поэтому химики обычно используют моль в качестве единицы для количества вещества .
- Другими словами, моль — это количество вещества , которое содержит столько сущностей (атомов или других частиц), сколько атомов в 12 граммах чистого углерода-12.
- Каждый ион или атом имеет определенную массу; аналогично, каждый моль данного чистого вещества также имеет определенную массу.
- Молярная масса — это масса данного вещества , деленная на количество вещества , измеренная в г / моль.

Физические и химические изменения вещества
- Другой способ подумать об этом: физическое изменение не приводит к тому, что вещество становится принципиально другим веществом , но химическое изменение заставляет вещество превращаться в нечто химически новое.
- Например, смешивание соли и перца создает новое вещество без изменения химического состава любого из компонентов.
- Фазовые изменения — это изменения, которые происходят, когда веществ плавятся, замораживаются, кипятятся, конденсируются, сублимируются или осаждаются.
- Это также физические изменения, потому что они не меняют природу вещества .
- Химическое изменение может также привести к образованию осадка, например, появлению мутного материала при смешивании растворенных веществ .
Вещества, существующие в виде газов
- Вещества , находящиеся в газовой фазе, проявляют пренебрежимо малые межмолекулярные силы.

- Около абсолютного нуля вещество существует как твердое тело.
- Температура вещества — это мера средней кинетической энергии частиц.
- В стандартных условиях (1 атм, 273 K) вещество , которое существует в виде газа, называется чистым газом и (без учета любых межмолекулярных сил или объема частицы, специфичных для вещества ) имеет объем 22.4 л на моль.
- В STP, если точка кипения данного вещества ниже 273 K, то можно ожидать, что вещество находится в газовой форме.
- Вещества , находящиеся в газовой фазе, проявляют пренебрежимо малые межмолекулярные силы.
Удельная теплоемкость и теплоемкость
- Теплоемкость — это количество тепловой энергии, необходимой для изменения температуры чистого вещества на заданную величину.
- молярная теплоемкость, которая представляет собой теплоемкость на моль чистого вещества .
- удельная теплоемкость, часто называемая просто удельной теплоемкостью, которая представляет собой теплоемкость на единицу массы чистого вещества .

- В нем обсуждается, как количество тепла, необходимое для изменения температуры, зависит от массы и задействованного вещества , и эта взаимосвязь представлена удельной теплоемкостью вещества , C.
- Вычислить изменение температуры вещества с учетом его теплоемкости и энергии, используемой для его нагрева
Растворимость в твердом состоянии и температура
- Растворимость часто зависит от температуры; растворимость многих веществ увеличивается с повышением температуры.
- Во время перекристаллизации нечистое вещество поглощается объемом растворителя при температуре, при которой оно нерастворимо, а затем нагревается до тех пор, пока оно не станет растворимым.
- Примеси также растворяются, но когда раствор охлаждается, часто можно выборочно кристаллизовать или осаждать желаемое вещество в более чистой форме.
- Эта диаграмма показывает растворимость различных веществ в воде при различных температурах (в градусах Цельсия).

Число Авогадро и родинка
- Им также нужен способ сравнения этих чисел и соотнесения их с массами веществ , которые они могут измерить и наблюдать.
- Число Авогадро определяется как количество элементарных частиц (молекул, атомов, соединений и т. Д.) На моль вещества .
- Определяется как количество вещества , которое содержит столько частиц, сколько атомов в 12 граммах чистого углерода-12.
- Итак, 1 моль содержит 6,022 × 1023 элементарных единиц вещества .
- Еще одно свойство числа Авогадро состоит в том, что масса одного моля вещества равна молекулярной массе этого вещества.
Стандартные изменения свободной энергии
- Для этого объедините стандартную энтальпию и стандартную энтропию вещества , чтобы получить стандартную свободную энергию реакции:
- Напомним, что символ ° относится к стандартному состоянию вещества , измеренному в условиях давления 1 атм или эффективной концентрации 1 моль и температуры 298К.
 o_f $, равные нулю.
o_f $, равные нулю.
Преобразование между молями и атомами
- Как введено в предыдущей концепции, моль можно использовать для соотнесения масс веществ с количеством атомов в них.
- Это простой способ определить, какое количество одного вещества может реагировать с заданным количеством другого вещества .
- Из молей вещества можно также определить количество атомов в образце и наоборот.
- Следовательно, учитывая соотношение 1 моль = 6,022 x 1023 атомов, преобразование между молями и атомами вещества становится простой задачей размерного анализа.
- Преобразование между числом молей и числом атомов в данном веществе с использованием числа Авагадро
Физические и химические свойства вещества
- Например, точка замерзания вещества является физическим свойством: когда вода замерзает, это неподвижная вода (h3O) — просто она находится в другом физическом состоянии.

- Химические свойства не могут быть определены простым просмотром или прикосновением к веществу ; Чтобы исследовать химические свойства вещества, необходимо повлиять на его внутреннюю структуру.
- Физические свойства — это свойства, которые можно измерить или наблюдать без изменения химической природы вещества .
- Химическая стабильность означает, будет ли соединение реагировать с водой или воздухом (химически стабильные вещества не будут реагировать).
- Например, точка замерзания вещества является физическим свойством: когда вода замерзает, это неподвижная вода (h3O) — просто она находится в другом физическом состоянии.
Некоторые основные определения
1.1 Некоторые основные определения
Цель обучения
- Выучите основные термины, используемые для описания материи.
Определение химии — изучение взаимодействия материи с другим веществом и с энергией — использует некоторые термины, которые также должны быть определены. Мы начинаем изучение химии с определения некоторых основных терминов.
Материя: Все, что имеет массу и занимает место.есть все, что имеет массу и занимает место. Книга — это материя, компьютер — это материя, еда — это материя, а грязь в земле — это материя. Иногда бывает трудно идентифицировать материю. Например, воздух — это материя, но из-за того, что он настолько тонок по сравнению с другими веществами (например, книгой, компьютером, едой и грязью), мы иногда забываем, что воздух имеет массу и занимает место. Вещи, которые не имеют значения, включают мысли, идеи, эмоции и надежды.
Пример 1
Что из нижеперечисленного имеет значение, а не имеет значения?
- хот-дог
- любовь
- дерево
Решение
- Хот-дог имеет массу и занимает место, так что это материя.
- Любовь — это эмоция, а эмоции не имеют значения.
- Дерево имеет массу и занимает место, поэтому оно материально.

Проверьте себя
Что из нижеперечисленного имеет значение, а не имеет значения?
- Луна
- идея нового изобретения
Ответ
- Луна — это материя.
- Само изобретение может иметь значение, но его идея — нет.
Чтобы понять материю и то, как она изменяется, нам нужно уметь описывать материю. Есть два основных способа описания материи: физические свойства и химические свойства. Физические свойства: характеристика, описывающая материю в том виде, в каком она существует. характеристики, которые описывают материю в том виде, в каком она существует. Некоторые из многих физических характеристик материи — это форма, цвет, размер и температура. Важным физическим свойством является фаза (или состояние ) материи.Три основных фазы материи — это твердая, жидкая и газовая (см. Рис. 1.1 «Фазы материи»).
Рис. 1.1 «Фазы материи»).
Химические свойства: Характеристика, описывающая изменение формы вещества в присутствии другого вещества. являются характеристиками материи, которые описывают, как материя изменяется в форме в присутствии другой материи. Горит ли образец вещества? Горение — это химическое свойство. При попадании в воду ведет себя агрессивно? Эта реакция также является химическим свойством (Рисунок 1.2 «Химические свойства»).В следующих главах мы увидим, как описания физических и химических свойств являются важными аспектами химии.
Если бы материя всегда оставалась прежней, химия была бы довольно скучной. К счастью, большая часть химии связана с изменениями. Физическое изменение — изменение, которое происходит, когда образец вещества меняет одно или несколько своих физических свойств. происходит, когда образец вещества изменяет одно или несколько своих физических свойств. Например, твердое тело может плавиться (Рисунок 1.3 «Physical Changes»), или спирт в термометре может изменять объем при изменении температуры. Физическое изменение не влияет на химический состав вещества.
Физическое изменение не влияет на химический состав вещества.
Химическое изменение — процесс демонстрации химического свойства. это процесс демонстрации химического свойства, такого как горящая спичка на Рисунке 1.2 «Химические свойства». По мере того, как вещество в спичке горит, изменяется ее химический состав, и создаются новые формы материи с новыми физическими свойствами.Обратите внимание, что химические изменения часто сопровождаются физическими изменениями, так как новое вещество, вероятно, будет иметь физические свойства, отличные от исходного вещества.
Пример 2
Опишите каждый процесс как физическое или химическое изменение.
- Вода в воздухе превращается в снег.
- Волосы человека острижены.
- Хлебное тесто превращается в свежий хлеб в духовке.
Решение
- Поскольку вода переходит из газовой фазы в твердую, это физическое изменение.

- Ваши длинные волосы укорачиваются. Это физическое изменение.
- Из-за температуры духовки в хлебном тесте происходят химические изменения, из-за которых получается свежий хлеб. Это химические изменения. (На самом деле, приготовление пищи часто связано с химическими изменениями.)
Проверьте себя
Определите каждый процесс как физическое или химическое изменение.
- В камине бушует пожар.
- Вода нагревается для приготовления чашки кофе.
Ответы
- химическое изменение
- физическое изменение
Образец вещества, имеющий одинаковые физические и химические свойства, называется веществом Материя, которое имеет одинаковые физические и химические свойства. Иногда используется фраза чистое вещество , но слово чистое не нужно.Определение термина , вещество является примером того, как в химии есть конкретное определение слова, которое используется в повседневном языке с другим, более расплывчатым определением. Здесь мы будем использовать термин , вещество с его строгим химическим определением.
Здесь мы будем использовать термин , вещество с его строгим химическим определением.
Химия распознает два разных типа веществ: элементы и соединения. Элемент: Вещество, которое не может быть разложено на более простые химические вещества обычными химическими средствами. это простейшее химическое вещество; его нельзя разложить на более простые химические вещества обычными химическими средствами.Науке известно около 115 элементов, из которых 80 стабильны. (Другие элементы являются радиоактивными, это состояние мы рассмотрим в главе 15 «Ядерная химия».) Каждый элемент имеет свой уникальный набор физических и химических свойств. Примеры элементов включают железо, углерод и золото.
Составная комбинация, состоящая из более чем одного элемента. представляет собой комбинацию более чем одного элемента. Физические и химические свойства соединения отличаются от физических и химических свойств составляющих его элементов; то есть ведет себя как совершенно другое вещество. Известно более 50 миллионов соединений, и ежедневно открываются новые. Примеры соединений включают воду, пенициллин и хлорид натрия (химическое название обычной поваренной соли).
Известно более 50 миллионов соединений, и ежедневно открываются новые. Примеры соединений включают воду, пенициллин и хлорид натрия (химическое название обычной поваренной соли).
Элементы и соединения — не единственные способы присутствия материи. Мы часто сталкиваемся с объектами, которые представляют собой физические комбинации более чем одного элемента или соединения. Физические сочетания более чем одного вещества называются смесями. Физическое сочетание более чем одного вещества.. Есть два типа смесей. Гетерогенная смесь Смесь, состоящая из двух или более веществ. представляет собой смесь двух или более веществ. Иногда невооруженным глазом легко сказать, что присутствует более одного вещества. Гомогенная смесь Комбинация двух или более веществ, которая настолько тщательно перемешана, что смесь ведет себя как единое вещество. представляет собой комбинацию двух или более веществ, которые настолько тщательно перемешаны, что смесь ведет себя как единое вещество. Другое название гомогенной смеси — раствор. Другое название гомогенной смеси.. Таким образом, комбинация соли и стальной ваты представляет собой гетерогенную смесь, поскольку легко увидеть, какие частицы вещества являются кристаллами соли, а какие — стальной ватой. С другой стороны, если вы возьмете кристаллы соли и растворите их в воде, очень трудно определить наличие более одного вещества, просто взглянув, даже если вы используете мощный микроскоп. Соль, растворенная в воде, представляет собой гомогенную смесь или раствор (Рисунок 1.4 «Типы смесей»).
Другое название гомогенной смеси.. Таким образом, комбинация соли и стальной ваты представляет собой гетерогенную смесь, поскольку легко увидеть, какие частицы вещества являются кристаллами соли, а какие — стальной ватой. С другой стороны, если вы возьмете кристаллы соли и растворите их в воде, очень трудно определить наличие более одного вещества, просто взглянув, даже если вы используете мощный микроскоп. Соль, растворенная в воде, представляет собой гомогенную смесь или раствор (Рисунок 1.4 «Типы смесей»).
Пример 3
Определите следующие комбинации как гетерогенные смеси или гомогенные смеси.
- газированная вода (углекислый газ растворен в воде.)
- Смесь металлической стружки железа и порошка серы (и железо, и сера являются элементами).
Решение
- Поскольку диоксид углерода растворен в воде, мы можем сделать вывод из поведения кристаллов соли, растворенных в воде, что диоксид углерода, растворенный в воде, является (также) гомогенной смесью.

- Если предположить, что железо и сера просто смешаны вместе, должно быть легко увидеть, что такое железо, а что такое сера, так что это неоднородная смесь.
Проверьте себя
Являются ли следующие комбинации гомогенными смесями или гетерогенными смесями?
- человеческое тело
- амальгама, комбинация некоторых других металлов, растворенных в небольшом количестве ртути
Ответы
- гетерогенная смесь
- Гомогенная смесь
Есть и другие дескрипторы, которые мы можем использовать для описания материи, особенно элементов.Обычно мы можем разделить элементы на металлы и неметаллы, и каждый набор имеет определенные (но не всегда все) свойства. МеталлЭлемент, который хорошо проводит электричество и тепло, является блестящим, серебристым, твердым, пластичным и податливым. представляет собой твердый элемент при комнатной температуре (хотя ртуть — хорошо известное исключение), блестящий и серебристый, хорошо проводит электричество и тепло, его можно измельчать на тонкие листы (свойство, называемое , пластичность, ), и его можно вытягивать. в тонкую проволоку (свойство , пластичность, ).Неметаллический элемент, который существует в различных цветах и фазах, является хрупким и плохо проводит электричество или тепло. это элемент, который в твердом состоянии является хрупким, плохо проводит электричество или тепло и не может быть превращен в тонкие листы или проволоку (Рисунок 1.5 «Полиметаллы»). Неметаллы также существуют в различных фазах и цветах при комнатной температуре. Некоторые элементы обладают свойствами как металлов, так и неметаллов, и называются полуметаллами (или металлоидами). Элемент, обладающий свойствами как металлов, так и неметаллов.. Позже мы увидим, как эти описания могут быть довольно легко присвоены различным элементам.
в тонкую проволоку (свойство , пластичность, ).Неметаллический элемент, который существует в различных цветах и фазах, является хрупким и плохо проводит электричество или тепло. это элемент, который в твердом состоянии является хрупким, плохо проводит электричество или тепло и не может быть превращен в тонкие листы или проволоку (Рисунок 1.5 «Полиметаллы»). Неметаллы также существуют в различных фазах и цветах при комнатной температуре. Некоторые элементы обладают свойствами как металлов, так и неметаллов, и называются полуметаллами (или металлоидами). Элемент, обладающий свойствами как металлов, так и неметаллов.. Позже мы увидим, как эти описания могут быть довольно легко присвоены различным элементам.
Рисунок 1.6 «Описание материи» — это блок-схема взаимосвязей между различными способами описания материи.
Рисунок 1.6 Описание материала
Эта блок-схема показывает, как можно описать материю.
Химия везде: утром
У большинства людей есть утренний ритуал, процесс, через который они проходят каждое утро, чтобы подготовиться к новому дню. Химия присутствует во многих из этих видов деятельности.
Химия присутствует во многих из этих видов деятельности.
- Если вы принимаете душ или ванну утром, вы, вероятно, используете мыло, шампунь или и то, и другое. Эти предметы содержат химические вещества, которые взаимодействуют с маслом и грязью на теле и волосах, удаляя их и смывая. Многие из этих продуктов также содержат химические вещества, от которых приятно пахнуть; их называют ароматов .
- Когда вы чистите зубы утром, вы обычно используете зубную пасту, форму мыла, для чистки зубов.Зубные пасты обычно содержат крошечные твердые частицы, называемые абразивами , которые физически чистят зубы. Многие зубные пасты также содержат фторид — вещество, которое химически взаимодействует с поверхностью зубов, помогая предотвратить кариес.
- Возможно, вы каждое утро принимаете витамины, пищевые добавки или лекарства. Витамины и другие добавки содержат химические вещества, которые необходимы вашему организму в небольших количествах для правильного функционирования.
 Лекарства — это химические вещества, которые помогают бороться с болезнями и укрепляют здоровье.
Лекарства — это химические вещества, которые помогают бороться с болезнями и укрепляют здоровье. - Возможно, вы сделаете яичницу на завтрак. Для жарки яиц необходимо их нагреть до такой степени, чтобы возникла химическая реакция для приготовления яиц.
- После того, как вы поели, пища в желудке вступает в химическую реакцию, так что организм (в основном кишечник) может поглощать пищу, воду и другие питательные вещества.
- Если вы едете или едете на автобусе в школу или на работу, вы используете транспортное средство, которое, вероятно, сжигает бензин, материал, который довольно легко горит и обеспечивает энергию для питания транспортного средства.Напомним, что горение — это химическое изменение.
Это всего лишь несколько примеров того, как химия влияет на вашу повседневную жизнь. А мы еще даже до обеда не добрались!
Основные выводы
- Химия — это изучение материи и ее взаимодействия с другими веществами и энергией.

- Материя — это все, что имеет массу и занимает место.
- Вещество можно описать с точки зрения физических и химических свойств.
- Физические свойства и химические свойства вещества могут изменяться.
- Материя состоит из элементов и соединений.
- Комбинации различных веществ называются смесями.
- Элементы могут быть описаны как металлы, неметаллы и полуметаллы.
Упражнения
Укажите, каждое из них имеет значение или не имеет значения.
- книга
- ненавижу
- свет
- легковой автомобиль
- яичница
Приведите пример вещества в каждой фазе: твердом, жидком или газообразном.

Отражает ли каждое утверждение физическое свойство или химическое свойство?
- Сера желтая.
- Стальная вата горит при воспламенении пламенем.
- Галлон молока весит более восьми фунтов.
Отражает ли каждое утверждение физическое свойство или химическое свойство?
- Куча листьев медленно гниет на заднем дворе.
- В присутствии кислорода водород может взаимодействовать с образованием воды.
- Золото можно растянуть на очень тонкую проволоку.
Представляет ли каждое утверждение физическое изменение или химическое изменение?
- Вода закипает и превращается в пар.

- Пищеварительная система преобразует пищу в пригодную для употребления форму.
- Спирт во многих термометрах замерзает при температуре около -40 градусов по Фаренгейту.
- Вода закипает и превращается в пар.
Представляет ли каждое утверждение физическое изменение или химическое изменение?
- Графит, одна из форм элементарного углерода, может быть превращен в алмаз, другую форму углерода, при очень высоких температурах и давлениях.
- Дом напротив перекрашен в новый цвет.
- Элементы натрия и хлор объединяются, чтобы образовать новое вещество, называемое хлоридом натрия.
Различать элемент и соединение. О скольких из них известно?
В чем разница между гомогенной смесью и гетерогенной смесью?
Определите каждый как гетерогенную смесь или гомогенную смесь.

- Соль смешать с перцем.
- Сахар растворен в воде.
- Паста готовится в кипящей воде.
Определите каждый как гетерогенную смесь или гомогенную смесь.
- воздух
- грязь
- телевизор
Какие варианты тоже являются решениями в упражнении 9?
Какие варианты тоже являются решениями в упражнении 10?
Почему железо считается металлом?
Почему кислород считается неметаллом?
Различают металл и неметалл.

Какими свойствами обладают полуметаллы?
Элементарный углерод — это тусклое на вид твердое вещество черного цвета, которое хорошо проводит тепло и электричество. Он очень хрупкий, и его нельзя превращать в тонкие листы или длинные проволоки. Из этих свойств, как углерод ведет себя как металл? Как углерод ведет себя как неметалл?
Чистый кремний блестящий и серебристый, но плохо проводит электричество или тепло.Из этих свойств как кремний ведет себя как металл? Как кремний ведет себя как неметалл?
ответы
- материя
- неважно
- неважно
- дело
- дело
- физическая собственность
- химическое свойство
- физическая собственность
- физическое изменение
- химическая замена
- физическое изменение
Элемент — это основная химическая часть вещества; известно около 115 элементов.
 Соединение — это комбинация элементов, которая действует как различное вещество; известно более 50 миллионов веществ.
Соединение — это комбинация элементов, которая действует как различное вещество; известно более 50 миллионов веществ.- неоднородный
- однородный
- неоднородный
Железо — это металл, потому что он твердый, блестящий и хорошо проводит электричество и тепло.
Металлы обычно блестящие, хорошо проводят электричество и тепло, являются пластичными и пластичными; неметаллы бывают разных цветов и фаз, они хрупкие в твердой фазе и плохо проводят тепло или электричество.

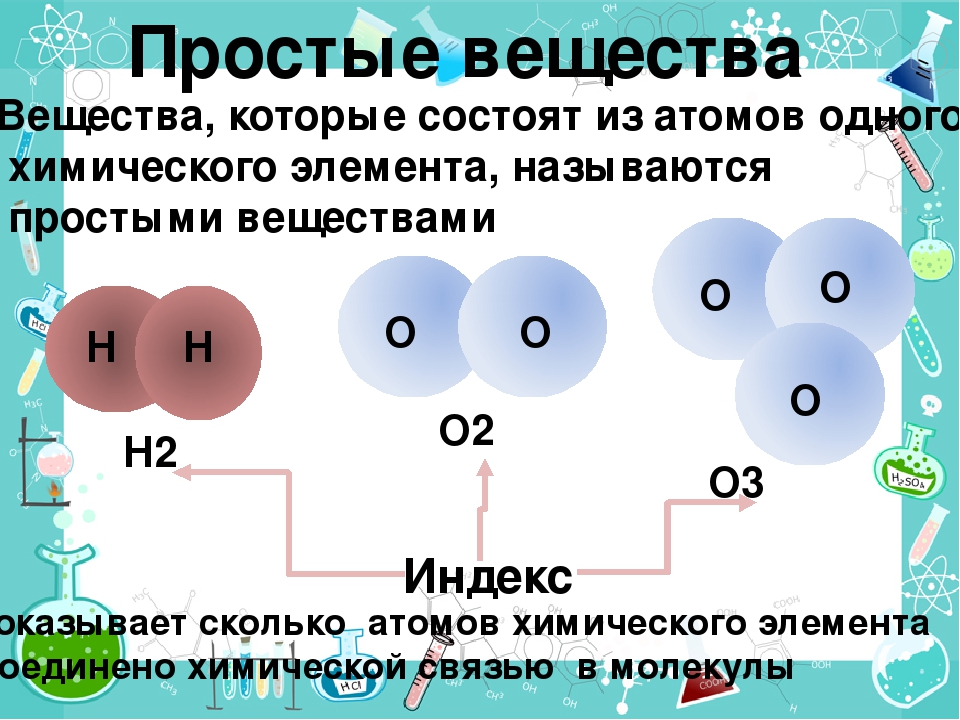 — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
— Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз. И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7
253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7.jpg) Например, если вы смешаете порошок серы с железной пылью, вы легко увидите их по отдельности.Вы даже можете отделить железную пыль с помощью магнита.
Например, если вы смешаете порошок серы с железной пылью, вы легко увидите их по отдельности.Вы даже можете отделить железную пыль с помощью магнита.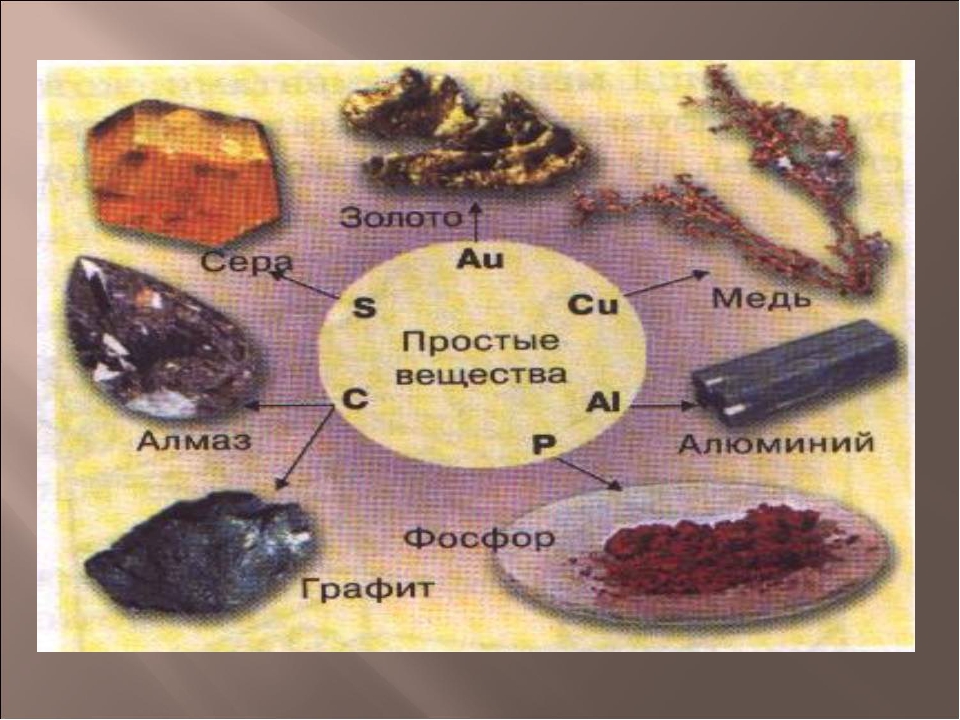







 Ниже), не имеют зарядов на своей поверхности и не являются полярными.
Ниже), не имеют зарядов на своей поверхности и не являются полярными. Х. Петруччи, Т. МакКрири и С.С.Перри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2005.
Х. Петруччи, Т. МакКрири и С.С.Перри. Общая химия , 4-е изд. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2005. ISBN 0750633654. Онлайн-версия, получено 2 декабря 2007 г.
ISBN 0750633654. Онлайн-версия, получено 2 декабря 2007 г. Атомы различных элементов имеют
разный вес и разные химические свойства.
Атомы различных элементов имеют
разный вес и разные химические свойства. е.е., часто существуют в виде жидкости или газа при
комнатная температура)
е.е., часто существуют в виде жидкости или газа при
комнатная температура)

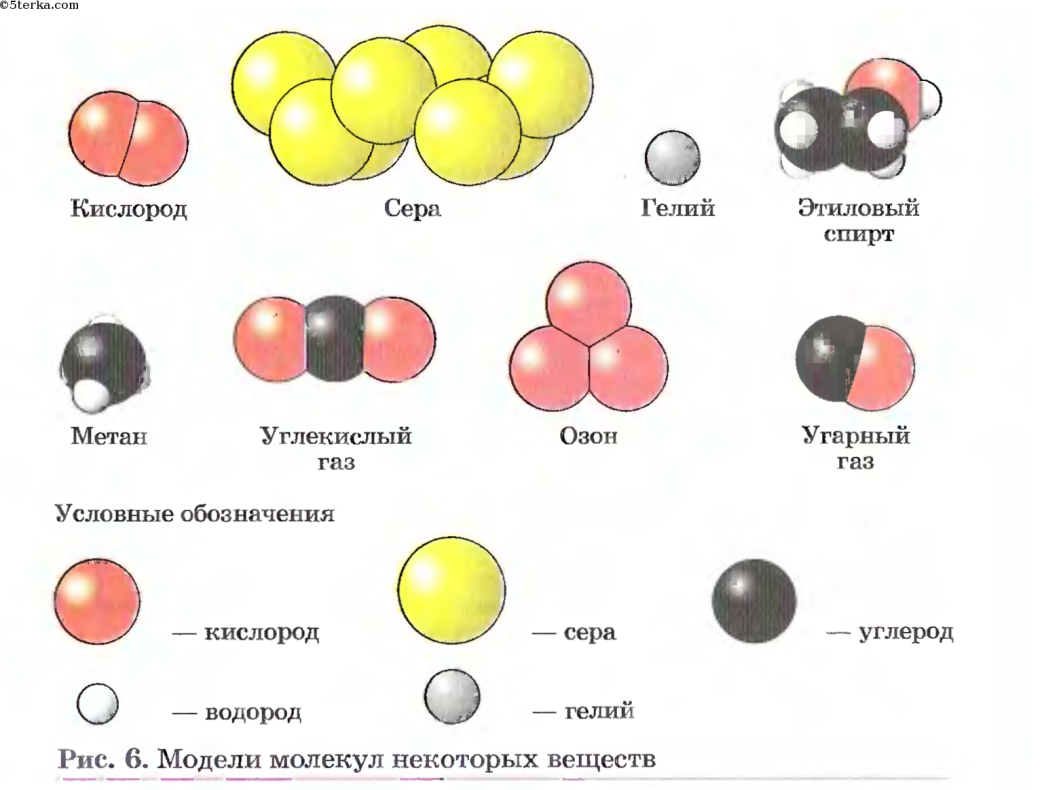



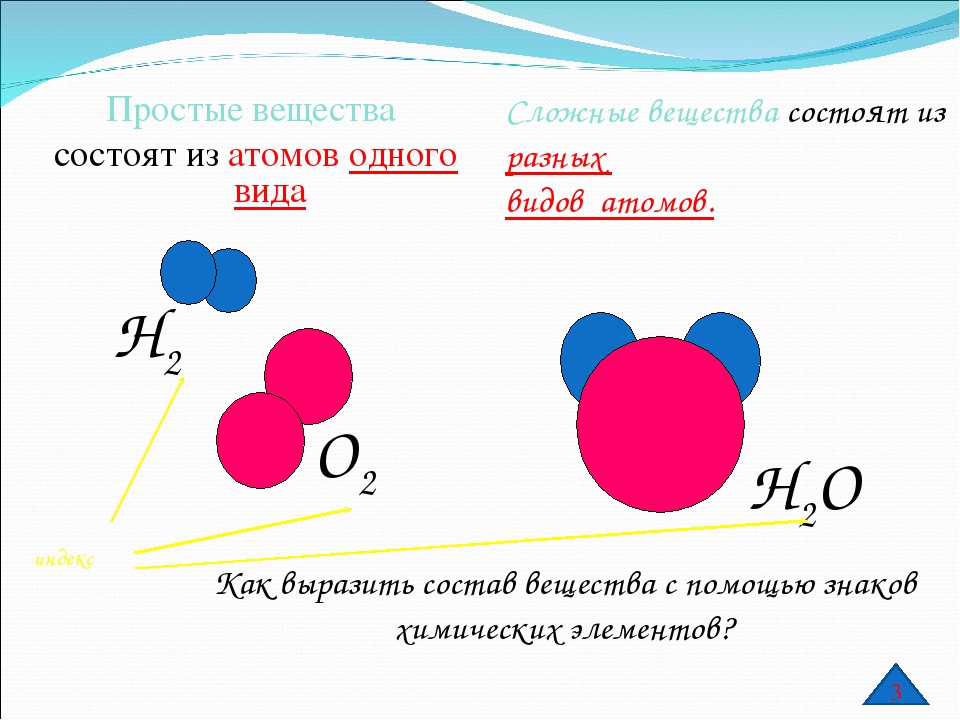
 o_f $, равные нулю.
o_f $, равные нулю.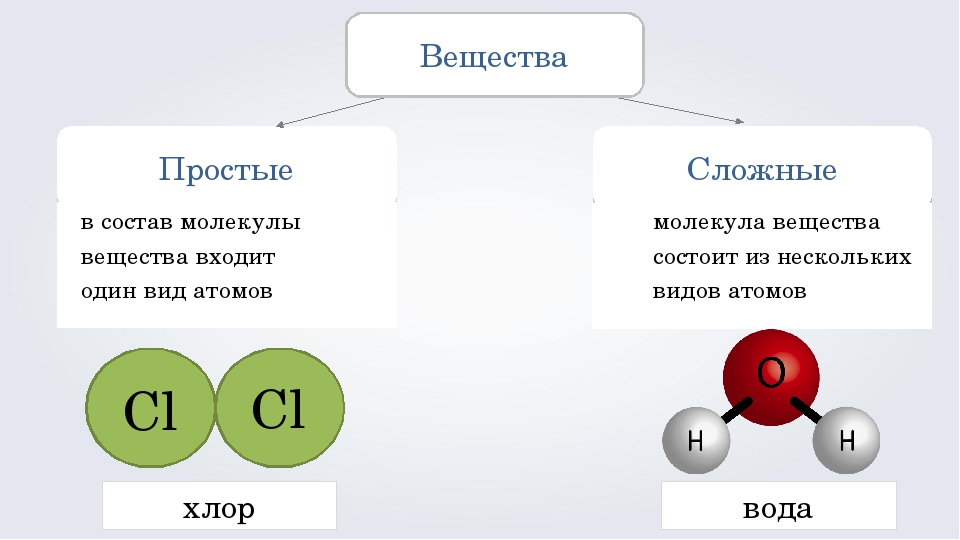



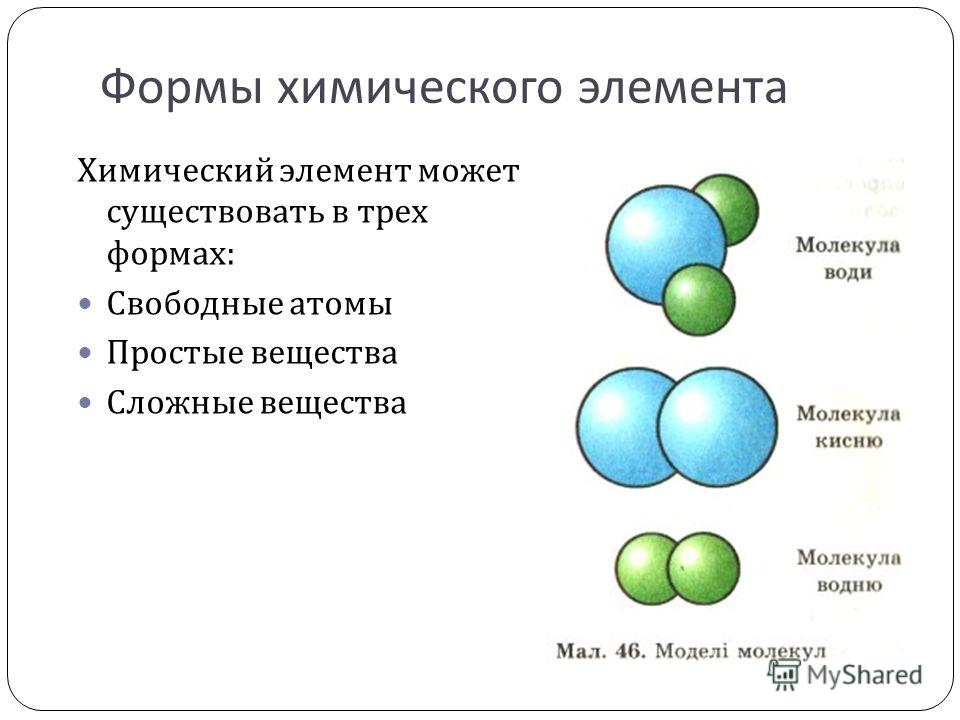 Лекарства — это химические вещества, которые помогают бороться с болезнями и укрепляют здоровье.
Лекарства — это химические вещества, которые помогают бороться с болезнями и укрепляют здоровье.




 Соединение — это комбинация элементов, которая действует как различное вещество; известно более 50 миллионов веществ.
Соединение — это комбинация элементов, которая действует как различное вещество; известно более 50 миллионов веществ.