Кислые соли — Химические свойства
Химия — Кислые соли — Химические свойства
01 марта 2011Оглавление:
1. Кислые соли
2. Химические свойства
3. Получение
1. Кислые соли реагируют с металлами, стоящими в ряду стандартных электродных потенциалов левее атома водорода:
2KНSO4 + Mg = H2 + MgSO4 + K2SO4,
2NaHCO3 + Fe = H2 + Na2CO3 + Fe23Так как эти реакции протекают в водных растворах, для опытов нельзя применять такие металлы как литий, натрий, калий, барий и другие активные металлы, которые при обычных условиях реагируют с водой.
2. Кислые соли реагируют с кислотами, в случае если образующаяся в результате реакции кислота более слабая или летучая, чем кислота, вступающая в реакцию:
NaHCO3 + HCl = NaCl + H2O + CO2Для проведения таких реакций обычно берут сухую соль и действуют на нее концентрированной кислотой.
3. Кислые соли реагируют с водными растворами щелочей c образованием средней соли и воды:
1) Ba2 + Ba2 = 2BaCO3 + 2H2O
2) 2KHSO4 + 2NaOH = 2H2O + K2SO4 + Na2SO4,
3) NaHCO3 + NaOH = H2O + Na2CO3Такие реакции используют для получения средних солей.
4. Кислые соли реагируют с растворами солей, в случае, если в результате реакции выпадает осадок, выделяется газ или образуется вода:
1) 2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4,
2) 2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
3) 2NaHCO3 + BaCl2 = BaCO3 + Na2CO3 + 2HCl
Указанные реакции используются, в том числе, для получения практически нерастворимых солей.
5. Некоторые кислые соли при нагревании разлагаются:
1) Ca2 = CaCO3 + CO2 + H2O
2) 2NaHCO3 = CO2 + H2O + Na2CO36. Кислые соли реагируют с основными оксидами с образованием воды и средних солей:
1) 2KHSO4 + MgO = H2O + MgSO4 + K2SO4,
2) 2NaHCO3 + CuO = H2O + CuCO3 + Na2CO37. При гидролизе кислые соли распадаются на катионы металла и кислые анионы: КHSO4 → К + НSO
Образующиеся кислые анионы, в свою очередь, обратимо диссоциируют: HSO → H + SO4
Просмотров: 22653
Химические свойства солей для ЕГЭ 2020 / Блог
Химические свойства солей
Соли следует рассматривать в виде продукта взаимодействия кислоты и основания. В итоге могут образовываться:
- нормальные (средние) — образуются при достаточном для полного взаимодействия количестве кислоты и основания. Названия нормальных солей состоят из двух частей. В начале называется анион (кислотный остаток), затем катион.
- кислые — образуются при избытке кислоты и недостаточном количестве щелочи, потому как при этом катионов металла становится недостаточно для замещения всех катионов водорода, имеющихся в молекуле кислоты. В составе кислотных остатков данного вида солей вы всегда увидите водород. Кислые соли образуются только многоосновными кислотами и проявляют свойства как солей, так и кислот. В названиях кислых солей ставится приставка гидро- к аниону.
- основные соли — образуются при избытке основания и недостаточном количестве кислоты, потому как в данном случае анионов кислотных остатков недостаточно для полного замещения гидроксогрупп, имеющихся в основании. основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-.
Типичные реакции нормальных солей
- С металлами реагируют хорошо. При этом, более активные металлы вытесняют менее активные из растворов их солей.
- С кислотами, щелочами и другими солями реакции проходят до конца, при условии образования осадка, газа или малодиссоциируемых соединений.
- В реакциях солей со щелочами образуются такие вещества, как гидроксид никеля (II) Ni(OH)2 – осадок; аммиак NH3 – газ; вода H2О – слабый электролит, малодиссоциируемое соединение:
- Соли реагируют между собой, если образуется осадок или в случае образования более устойчивого соединения.
- Многие нормальные соли разлагаются при нагревании с образованием двух оксидов – кислотного и основного
- Нитраты разлагаются другим, отличным от остальных нормальных солей образом. При нагревании нитраты щелочных и щелочноземельных металлов выделяют кислород и превращаются в нитриты:
- Нитраты почти всех других металлов разлагаются до оксидов:
- Нитраты некоторых тяжелых металлов (серебра, ртути и др) разлагаются при нагревании до металлов:
Типичные реакции кислых солей
- Они вступают во все те реакции, в которые вступают кислоты. Со щелочами реагируют, если в составе кислой соли и щелочи имеется один и тот же металл, то в результате образуется нормальная соль.
- Если же щелочь содержит другой металл, то образуются двойные соли.
Типичные реакции основных солей
- Данные соли вступают в те же реакции, что и основания. С кислотами реагируют, если в составе основной соли и кислоты имеется один и тот же кислотный остаток, то в результате образуется нормальная соль.
- Если же кислота содержит другой кислотный остаток, то образуются двойные соли.
Комплексные соли — соединение, в узлах кристаллической решетки которого содержатся комплексные ионы.
Изучай химические свойства:
Решай с ответами:
bingoschool.ru
Свойства кислых солей. — Химия
Просмотр содержимого документа
«Свойства кислых солей.»

Свойства кислых солей
Выполнила:
Кучукова Е.

- Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.

Физические свойства
- Кислые соли – твёрдые кристаллические вещества, обладающие различной растворимостью, и характеризующиеся высокими температурами плавления. Окраска солей зависит от металла, входящего в их состав.

Химические свойства
- Кислые соли реагируют с металлами, стоящими в ряду стандартных электродных потенциалов (ряд Бекетова) левее атома водорода:
2KНSO4 + Mg = h3 + MgSO4 + K2SO4,
2NaHCO3 + Fe = h3 + Na2CO3 + Fe2(CO3)3
Так как эти реакции протекают в водных растворах, для опытов нельзя применять такие металлы как литий, натрий, калий, барий и другие активные металлы, которые при обычных условиях реагируют с водой.

- Кислые соли реагируют с кислотами, в случае если образующаяся в результате реакции кислота более слабая или летучая, чем кислота, вступающая в реакцию:
NaHCO3 + HCl = NaCl + h3O + CO2
Для проведения таких реакций обычно берут сухую соль и действуют на нее концентрированной кислотой.

- Кислые соли реагируют с водными растворами щелочей c образованием средней соли и воды:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2h3O
2KHSO4 + 2NaOH = 2h3O + K2SO4 + Na2SO4,
NaHCO3 + NaOH = h3O + Na2CO3
Такие реакции используют для получения средних солей.

- Кислые соли реагируют с растворами солей, в случае, если в результате реакции выпадает осадок, выделяется газ или образуется вода:
2KHSO4 + MgCO3 = h3O + CO2 + K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
2NaHCO3 + BaCl2 = BaCO3 + Na2CO3 + 2HCl
Указанные реакции используются, в том числе, для получения практически нерастворимых солей.

- Некоторые кислые соли при нагревании разлагаются:
Ca(HCO3)2 = CaCO3 + CO2 + h3O
2NaHCO3 = CO2 + h3O + Na2CO3
- Кислые соли реагируют с основными оксидами с образованием воды и средних солей:
2KHSO4 + MgO = h3O + MgSO4 + K2SO4,
2NaHCO3 + CuO = h3O + CuCO3 + Na2CO3

Спасибо за внимание!
multiurok.ru
Задания 10. Классификация и химические свойства солей.
Задание №1
BB9448
Среди перечисленных веществ кислой солью является
1) гидрид магния
2) гидрокарбонат натрия
3) гидроксид кальция
4) гидроксокарбонат меди
РешениеОтвет: 2
Пояснение:
Кислые соли — это соли, содержащие два вида катионов: катион металла (или аммония) и катион водорода, и многозарядный анион кислотного остатка. Катион водорода даёт к названию соли приставку «гидро», например, гидросульфат натрия. Следовательно, из всех предложенных вариантов к кислой соли относится гидрокарбонат натрия NaHCO3.
В гидриде магния MgH2 водород является анионом, т.е. имеет степень окисления -1.
Гидроксид кальция Ca(OH)2 (гашеная известь) является основным гидроксидом или основанием. Основные гидроксиды — это сложные вещества, которые состоят из катионов металлов или аммония и гидроксид-иона (OH−) и в водном растворе диссоциируют с образованием анионов ОН− и катионов.
Гидроксокарбонат меди (CuOH)2CO3 – основная соль металла меди и угольной кислоты. Основные соли (гидроксосоли) — это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками.
Задание №2
923361
В схеме превращений 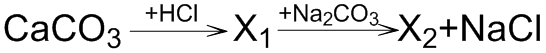 веществом «X2» является
веществом «X2» является
- 1. CaCO3
- 2. CaCl2
- 3. CaO
- 4. Ca(OH)2
Ответ: 1
Пояснение:
Карбонат кальция CaCO3 является нерастворимой в воде солью и взаимодействует с сильными кислотами, способными вытеснить слабую угольную кислоту H2CO3. В свою очередь, угольная кислота является неустойчивой и распадается на углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Далее образованная соль хлорид кальция CaCl2 вступает в реакцию обмена с карбонатом натрия Na2CO3 с образованием осадка CaCO3:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Следовательно, веществом X2 является карбонат кальция CaCO3.
Задание №3
EBABDA
В схеме превращений 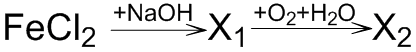 веществом «X2» является
веществом «X2» является
- 1. FeO
- 2. Fe(OH)3
- 3. FeCl2
- 4. FeCl3
Ответ: 2
Пояснение:
Хлорид железа (II) FeCl2 – растворимая средняя соль двухвалентного железа и соляной кислоты, взаимодействует с щелочами с образованием не растворимого в воде осадка белого цвета:
FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
Образующийся гидроксид железа (II) Fe(OH)2 на влажном воздухе со временем темнеет, окисляясь до гидроксида трехвалентного железа Fe(OH)3:/p>
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Задание №4
9D7D69
К кислым солям не относится вещество, формула которого
- 1. NH4Cl
- 2. NaHS
- 3. Ca(HCO3)2
- 4. NaH2PO4
Ответ: 1
Пояснение:
Кислые соли — это соли, содержащие два вида катионов: катион металла (или аммония) и катион водорода, и анион кислотного остатка. Кислых солей не образуют одноосновные кислоты, например, HNO3, HNO2, HCl.
Кислыми солями являются гидросульфид натрия NaHS (соль сероводородной кислоты H2S), гидрокарбонат кальция Ca(HCO3)2 (соль угольной кислоты H2CO3) и дигидрофосфат натрия NaH2PO4 (соль фосфорной кислоты H3PO4). Хлорид аммония NH4Cl является средней солью (соль хлороводородной кислоты HCl).
Задание №5
6C092A
Взаимодействие карбоната натрия с раствором хлорида кальция относят к реакциям
1) разложения
2) обмена
3) замещения
4) соединения
РешениеОтвет: 2
Пояснение:
Реакция между двумя растворимыми солями карбонатом натрия и раствором хлорида кальция протекает по схеме:
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Данная реакция принадлежит к реакциям обмена (реакция обмена – реакция между сложными веществами, при которых они обмениваются своими составными частями). В результате этой реакции образуется осадок карбонат кальция CaCO3.
К реакциям соединения относят реакции между двумя простыми веществами или двумя сложными, при этом образуется одно сложное или одно более сложное вещество.
К реакциям замещения относят реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного.
Задание №6
325C08
Хлорид алюминия в растворе взаимодействует с
- 1. K2SO4
- 2. MgSO4
- 3. HNO3
- 4. Ca(OH)2
Ответ: 4
Пояснение:
Хлорид алюминия AlCl3 является растворимой солью, поэтому может в реакциях обмена взаимодействовать с щелочами и растворимыми солями с образованием осадка.
AlCl3 + K2SO4 → реакция не протекает: ионы Al3+, Cl−, K+, SO42- не образуют осадков;
AlCl3 + MgSO4 → реакция не протекает: ионы Al3+, Cl−, Mg2+, SO42- не образуют осадков;
AlCl3 + HNO3 → реакция не протекает: ионы Al3+, Cl−, H+, NO3− не образуют осадков.
Реакция обмена между хлоридом алюминия AlCl3 и щелочью Ca(OH)2 протекает за счет образования нерастворимого гидроксида алюминия Al(OH)3:
2AlCl3 + 3Ca(OH)2 = 2Al(OH)3↓ + 3CaCl2
Задание №7
B15D89
Раствор хлорида железа(II) реагирует с
1) фосфатом серебра
2) нитратом цинка
3) сульфатом калия
4) сульфидом натрия
РешениеОтвет: 4
Пояснение:
Хлорид железа (II) (FeCl2) является растворимой солью, поэтому вступает в реакции обмена с другими растворимыми солями и щелочами, если в результате образуется осадок.
Из всех предложенных вариантов осадок образуется только при взаимодействии с сульфидом натрия Na2S за счет образования осадка FeS:
FeCl2 + Na2S = FeS↓ + 2NaCl
Ag3PO4 – не растворимая в воде соль, поэтому в реакциях обмена в водных растворах не участвует.
FeCl2 + Zn(NO3)2 → реакция не протекает: ионы Fe2+, Cl−, Zn2+, NO3− не образуют осадков;
FeCl2 + K2SO4 → реакция не протекает: ионы Fe2+, Cl−, K+, SO42− не образуют осадков.
Задание №8
A56360
Раствор нитрата кальция взаимодействует с
- 1. KNO3
- 2. BaCl2
- 3. Na2CO3
- 4. FeCl3
Ответ: 3
Пояснение:
Из предложенных вариантов нитрат кальция (Ca(NO3)2) вступает в реакцию обмена только с карбонатом натрия (Na2CO3) с образованием нерастворимого карбоната кальция:
Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Нитрат-анион не образует осадков с катионами K+, Ba2+, Na+ и Fe3+.
Катион кальция также не образует осадков с оставшимися анионами: NO3− и Cl−.
Задание №9
3ECB66
Гидрокарбонат кальция при обычных условиях взаимодействует с
- 1. CO2
- 2. SiO2
- 3. HNO3
- 4. BaSO4
Ответ: 3
Пояснение:
При обычных условиях гидрокарбонат кальция (Ca(HCO3)2) взаимодействует с сильной азотной кислотой, которая вытесняет слабую неустойчивую угольную кислоту из ее соли. Угольная кислота распадается на CO2 и воду:
Ca(HCO3)2 + 2HNO3 → Ca(NO3)2 + 2CO2↑ + 2H2O
Соль BaSO4 является нерастворимой, не взаимодействует с солью Ca(HCO3)2.
Также кислая соль — гидрокарбонат кальция — не взаимодействует с кислотными оксидами CO2 и SiO2.
scienceforyou.ru
Тематический тест на химические свойства солей для подготовки к ЕГЭ.
Задание №1
Из предложенного списка соединений выберите те, которые относятся к солям. Число верных ответов может быть любым.
- 1. KOH
- 2. NaBr
- 3. ZnO
- 4. KHCO3
- 5. NaHS
Задание №2
Из предложенного списка соединений выберите те, которые не относятся к солям. Число верных ответов может быть любым.
- 1. Ba(ClO)Cl
- 2. Fe(OH)SO4
- 3. Cu2O
- 4. (CuOH)2CO3
- 5. BeSO4
Задание №3
Из предложенного списка соединений выберите те, которые относятся к солям. Число верных ответов может быть любым.
- 1. ZnS
- 2. Cr(OH)Cl2
- 3. K2CrO4
- 4. CrO3
- 5. BaO
Задание №4
Из предложенного списка соединений выберите те, которые не относятся к солям. Число верных ответов может быть любым.
- 1. LiNO3
- 2. K2[Zn(OH)4]
- 3. NaAlO2
- 4. Al2O3
- 5. Na[Al(OH)4]
Задание №5
Из предложенного списка соединений выберите те, которые относятся к солям. Число верных ответов может быть любым.
- 1. KFe(SO4)2
- 2. Cr(OH)3
- 3. H2SO4
- 4. CsFeO2
- 5. PbO2
Задание №6
Из предложенного списка солей выберите те, которые реагируют с соляной кислотой. Число верных ответов может быть любым.
- 1. AgNO3
- 2. KBr
- 3. ZnS
- 4. FeI2
- 5. K2SO4
Задание №7
Из предложенного списка солей выберите те, которые реагируют с разбавленной серной кислотой. Число верных ответов может быть любым.
- 1. Fe(NO3)3
- 2. CaCO3
- 3. K2SO3
- 4. BaCl2
- 5. RbNO3
Задание №8
Из предложенного списка солей выберите те, которые реагируют с сероводородной кислотой. Число верных ответов может быть любым.
- 1. CuCl2
- 2. FeCl2
- 3. Pb(NO3)2
- 4. AgF
- 5. ZnSO4
Задание №9
Из предложенного списка солей выберите те, которые реагируют с иодоводородной кислотой. Число верных ответов может быть любым.
- 1. FeCO3
- 2. Pb(NO3)2
- 3. KHCO3
- 4. NaBr
- 5. K2SO4
Задание №10
Из предложенного списка солей выберите те, которые реагируют с азотной кислотой. Число верных ответов может быть любым.
- 1. BaSO3
- 2. AgCl
- 3. KCl
- 4. Fe(NO3)3
- 5. CuSO4
Задание №11
Из предложенного списка солей выберите те, которые реагируют с серебром. Число верных ответов может быть любым.
1) сульфат меди
2) нитрат ртути (II)
3) хлорид золота (III)
4) бромид бария
5) сульфат цинка
РешениеЗадание №12
Из предложенного списка солей выберите те, которые не реагируют с медью. Число верных ответов может быть любым.
1) хлорид железа(II)
2) нитрат серебра
3) хлорид железа(III)
4) сульфид калия
5) нитрат цинка
РешениеЗадание №13
Из предложенного списка солей выберите те, которые реагируют с железом. Число верных ответов может быть любым.
1) бромид меди(II)
2) хлорид железа(III)
3) нитрат серебра
4) нитрат свинца
5) сульфит натрия
РешениеЗадание №14
Из предложенного списка солей выберите те, которые не реагируют с цинком. Число верных ответов может быть любым.
1) нитрит калия
2) бромид железа (III)
3) хлорид золота (III)
4) сульфат меди
5) карбонат цезия
РешениеЗадание №15
Из предложенного списка солей выберите те, которые реагируют с магнием. Число верных ответов может быть любым.
1) сульфат цинка
2) хлорид бария
3) нитрат висмута
4) сульфид лития
5) фторид калия
РешениеЗадание №16
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. K2SO4
- 2. NH4HCO3
- 3. NaCl
- 4. KI
- 5. CaCO3
Задание №17
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. (NH4)2Cr2O7
- 2. BaBr2
- 3. ZnS
- 4. FeCO3
- 5. PbS
Задание №18
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. NH4NO3
- 2. Na2SO4
- 3. FeBr2
- 4. K3PO4
- 5. NaHCO3
Задание №19
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. BaCO3
- 2. K2CO3
- 3. NH4NO2
- 4. CsCl
- 5. FeCl2
Задание №20
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. SrS
- 2. ZnCO3
- 3. K2SO4
- 4. CrBr3
- 5. (CuOH)2CO3
Задание №21
Из предложенного списка солей выберите две, которые реагируют с гидроксидом стронция.
- 1. NaCl
- 2. K2SO4
- 3. NaF
- 4. ZnCO3
- 5. BaCl2
Задание №22
Из предложенного списка солей выберите две, которые реагируют с гидроксидом цезия.
- 1. NH4Cl
- 2. K2SO4
- 3. Cr(NO3)3
- 4. BaSO4
- 5. FeS
Задание №23
Из предложенного списка солей выберите две, которые реагируют с гидроксидом рубидия.
- 1. KI
- 2. ZnSO4
- 3. AgCl
- 4. CaCO3
- 5. NH4F
Задание №24
Из предложенного списка солей выберите две, которые реагируют с гидроксидом лития.
- 1. K2SO4
- 2. Pb(NO3)2
- 3. CaBr2
- 4. Na3PO4
- 5. Ag2S
Задание №25
Из предложенного списка солей выберите две, которые реагируют с гидроксидом бария.
- 1. CuSO4
- 2. NaCl
- 3. MgSO4
- 4. SrSO4
- 5. RbI
Задание №26
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом натрия.
1) едкое кали
2) сульфид цинка
3) хлорид железа(III)
4) кальцинированная сода
5) сульфат калия
РешениеЗадание №27
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом калия.
1) хлорид аммония
2) кислород
3) соляная кислота
4) иодид алюминия
5) оксид углерода (II)
РешениеЗадание №28
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом аммония.
1) гидроксид цезия
2) сульфат хрома (III)
3) хлорид калия
4) углекислый газ
5) водород
РешениеЗадание №29
Из предложенного списка веществ выберите два, которые реагируют с гидросульфидом лития.
1) сероводород
2) соляная кислота
3) хлорид калия
4) гидроксид калия
5) угарный газ
РешениеЗадание №30
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом кальция.
1) оксид азота(II)
2) гашеная известь
3) сульфат бария
4) нитрат железа(III)
5) оксид азота(I)
РешениеЗадание №31
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоалюминатом лития.
- 1. NO
- 2. CO
- 3. CO2
- 4. K3PO4
- 5. SiO2
Задание №32
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоцинкатом натрия.
- 1. H2S
- 2. KOH
- 3. LiCl
- 4. BaSO4
- 5. CO2
Задание №33
Из предложенного списка веществ выберите два, которые реагируют с гексагидроксохроматом(III) калия.
- 1. Fe(OH)3
- 2. KOH
- 3. SO2
- 4. CO
- 5. CO2
Задание №34
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоцинкатом бария.
- 1. KOH
- 2. Na2SO4
- 3. SrSO4
- 4. HNO3
- 5. FeO
Задание №35
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоалюминатом цезия.
- 1. BeO
- 2. H2SO4
- 3. SiO2
- 4. H2
- 5. SO2
Задание №36
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) нитрат свинца + углекислый газ
2) нитрат аммония + едкий натр
3) нитрат калия + сульфат аммония
4) нитрат серебра + платина
5) нитрат цинка + карбонат бария
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
РешениеОтвет: NH4NO3 + NaOH = NaNO3 + NH3 + H2O
Задание №37
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) хлорид калия + нитрат натрия
2) бромид лития + цинк
3) иодид свинца + гидроксид калия
4) фторид аммония + гидроксид лития
5) хлорид серебра + сульфид натрия
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
РешениеОтвет: NH4F + LiOH = LiF + NH3 + H2O
Задание №38
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) карбонат цинка + едкое кали
2) гидрокарбонат натрия + гидроксид натрия
3) карбонат аммония + сульфат натрия
4) гидрокарбонат кальция + углекислый газ
5) карбонат свинца + угарный газ
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
РешениеОтвет: NaHCO3 + NaOH = Na2CO3 + H2O
Задание №39
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) сульфид натрия + соляная кислота
2) сульфид свинца + бромоводородная кислота
3) сульфид серебра + разбавленная серная кислота
4) сульфит натрия + гидроксид калия
5) сульфат цинка + нитрат меди
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
РешениеОтвет: Na2S + 2HCl = 2NaCl + H2S
Задание №40
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) тетрагидроксоалюминат калия + угарный газ
2) тетрагидроксоцинкат натрия + веселящий газ
3) тетрагидроксоалюминат лития + сероводород
4) тетрагидроксоцинкат цезия + водород
5) тетрагидроксоалюминат рубидия + кислород
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
РешениеОтвет: Li[Al(OH)4] + H2S = LiHS + Al(OH)3 + H2O
Задание №41
В заданной схеме превращений
Fe(NO3)2 FeS
FeS  FeCl2
FeCl2
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. H2S
- 2. Na2S
- 3. KCl
- 4. PbCl2
- 5. HCl
Задание №42
В заданной схеме превращений
K2SO4 KCl
KCl  KNO3
KNO3
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. BaCl2
- 2. NaCl
- 3. LiNO3
- 4. AgNO3
- 5. Fe(NO3)3
Задание №43
В заданной схеме превращений
Pb(NO3)2 PbS
PbS  PbSO4
PbSO4
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. H2O
- 2. H2O2
- 3. S
- 4. SO2
- 5. H2S
Задание №44
В заданной схеме превращений
Na[Al(OH)4]  AlCl3
AlCl3 Al(NO3)3
Al(NO3)3
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. KCl
- 2. HCl
- 3. Cl2
- 4. HNO3
- 5. AgNO3
Задание №45
В заданной схеме превращений
KHCO3 K2CO3
K2CO3 KBr
KBr
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. O2
- 2. KOH
- 3. KCl
- 4. RbBr
- 5. SrBr2
Задание №46
Запишите уравнение реакции, происходящей при смешении раствора карбоната калия и избытка азотной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K2CO3 + 2HNO3 = 2KNO3 + CO2 + H2O
Задание №47
Запишите уравнение реакции, происходящей при смешении раствора питьевой соды и избытка соляной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: NaHCO3 + HCl = NaCl + CO2 + H2O
Задание №48
Запишите уравнение реакции, происходящей при смешении раствора сульфида лития и избытка соляной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Li2S + 2HCl = 2LiCl + H2S
Задание №49
Запишите уравнение реакции, происходящей при смешении раствора гидросульфида аммония и избытка иодоводородной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: NH4HS + HI = NH4I + H2S
Задание №50
Запишите уравнение реакции, происходящей при смешении раствора гидрофосфата калия и избытка азотной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K2HPO4 + 2HNO3 = 2KNO3 + H3PO4
Задание №51
Запишите уравнение реакции, происходящей при смешении раствора медного купороса и цинкового порошка. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: CuSO4 + Zn = ZnSO4 + Cu
Задание №52
Запишите уравнение реакции, происходящей при смешении раствора хлорного железа и медного порошка. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2FeCl3 + Cu = 2FeCl2 + CuCl2
Задание №53
Запишите уравнение реакции, происходящей при смешении раствора нитрата серебра и алюминиевой стружки. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 3AgNO3 + Al = Al(NO3)3 +3Ag
Задание №54
Запишите уравнение реакции, происходящей при смешении раствора бромида железа(III) и железных опилок. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2FeBr3 + Fe = 3FeBr2
Задание №55
Запишите уравнение реакции, происходящей при смешении раствора нитрата свинца и цинкового порошка. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Pb(NO3)2 + Zn = Zn(NO3)2 + Pb
Задание №56
Запишите уравнение реакции, происходящей при термическом разложении питьевой соды. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2NaHCO3 = Na2CO3 + CO2 + H2O
Задание №57
Запишите уравнение реакции, происходящей при термическом разложении нитрата калия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2KNO3 = 2KNO2 + O2
Задание №58
Запишите уравнение реакции, происходящей при термическом разложении нитрата железа(III). Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Задание №59
Запишите уравнение реакции, происходящей при термическом разложении нитрата меди. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Cu(NO3)2 = 2CuO + 4NO2 + O2
Задание №60
Запишите уравнение реакции, происходящей при термическом разложении нитрата серебра. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2AgNO3 = 2Ag + 2NO2 + O2
Задание №61
Запишите уравнение реакции, происходящей при термическом разложении нитрата ртути(II). Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Hg(NO3)2 = Hg + 2NO2 + O2
Задание №62
Запишите уравнение реакции, происходящей при термическом разложении нитрата аммония. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: NH4NO3 = N2O + 2H2O
Задание №63
Запишите уравнение реакции, происходящей при термическом разложении дихромата аммония. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Задание №64
Запишите уравнение реакции, происходящей при термическом разложении нитрита аммония. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: NH4NO2 = N2 + 2H2O
Задание №65
Запишите уравнение реакции, происходящей при термическом разложении карбоната магния. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: MgCO3 = MgO + CO2
Задание №66
Запишите уравнение реакции, происходящей при пропускании избытка углекислого газа через раствор тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K[Al(OH)4] + CO2 = KHCO3 + Al(OH)3
Задание №67
Запишите уравнение реакции, происходящей при пропускании избытка углекислого газа через раствор тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Na2[Zn(OH)4] + 2CO2 = 2NaHCO3 + Zn(OH)2
Задание №68
Запишите уравнение реакции, происходящей при пропускании избытка сернистого газа через раствор тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K[Al(OH)4] + SO2 = KHSO3 + Al(OH)3
Задание №69
Запишите уравнение реакции, происходящей при пропускании избытка сернистого газа через раствор тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Na2[Zn(OH)4] + 2SO2 = 2NaHSO3 + Zn(OH)2
Задание №70
Запишите уравнение реакции, происходящей при пропускании избытка сероводорода через раствор тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K[Al(OH)4] + H2S = KHS + Al(OH)3 + H2O
Задание №71
Запишите уравнение реакции, происходящей при пропускании избытка сероводорода через раствор тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Na2[Zn(OH)4] + 3H2S = 2NaHS + ZnS + 4H2O
Задание №72
Запишите уравнение реакции, происходящей при смешении избытка соляной кислоты и раствора тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K[Al(OH)4] + 4HCl = KCl + AlCl3 + 4H2O
Задание №73
Запишите уравнение реакции, происходящей при смешении избытка азотной кислоты и раствора тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Na2[Zn(OH)4] + 4HNO3 = 2NaNO3 + Zn(NO3)2 + 4H2O
Задание №74
Запишите уравнение реакции, происходящей при сплавлении поташа с оксидом алюминия. Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K2CO3 + Al2O3 = 2KAlO2 + CO2
Задание №75
Запишите уравнение реакции, происходящей при сплавлении кальцинированной соды с оксидом железа(III). Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Na2CO3 + Fe2O3 = 2NaFeO2 + CO2
Задание №76
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сульфид натрия Б) нитрат железа(II) В) нитрат серебра | 1) карбонат натрия, гидроксид натрия, азотная кислота 2) водород, кислород, оксид азота(IV) 3) сероводород, соляная кислота, перекись водорода 4) соляная кислота, едкий натр, медь |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №77
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) оксид меди (II) Б) сульфат меди В) оксид меди (I) | 1) водород, кислород, соляная кислота 2) водород, медь, иодоводородная кислота 3) магний, гидроксид калия, сероводород 4) цинк, сероводород, серебро |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №78
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) гидрокарбонат калия Б) сульфат натрия В) оксид свинца(II) | 1) углекислый газ, соляная кислота, вода 2) иодоводородная кислота, водород, угарный газ 3) едкое кали, бромоводородная кислота, гашеная известь 4) хлорид бария, нитрат стронция, иодид кальция |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №79
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) азотная кислота Б) тетрагидроксоалюминат натрия В) оксид алюминия | 1) соляная кислота, сероводород, сернистый газ 2) бромоводородная кислота, серная кислота, негашеная известь 3) сера, цинк, оксид бария 4) серная кислота, вода, железо |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №80
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) оксид фосфора(III) Б) фосфат калия В) гидроксид цинка | 1) гидроксид натрия, соляная кислота, гидроксид цезия 2) гидроксид рубидия, едкое кали, азот 3) гидроксид калия, перекись водорода, оксид натрия 4) гидроксид лития, нитрат серебра, серная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №81
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) угарный газ Б) кальцинированная сода В) хлорное железо | 1) O2, Cu2O, Ag 2) CuO, FeO, O2 3) KOH, Cu, Zn 4) Pb(NO3)2, BaCl2, CaCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №82
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сернистый газ Б) сульфид натрия В) серная кислота | 1) Zn, H2, NO 2) O2, Na2SO3, H2O2 3) HCl, HBr, H2S 4) Zn, CuO, Fe2O3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №83
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) оксид цинка Б) нитрат меди В) бромид калия | 1) AgNO3, Cl2, Pb(NO3)2 2) K2CO3, Cs2S, Zn 3) AgF, H2, Ni 4) HCl, KOH, H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №84
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) хлорид бария Б) хлорное железо В) оксид железа (II) | 1) серная кислота, бромид калия, сульфид цинка 2) бромоводородная кислота, водород, кислород 3) серная кислота, нитрат серебра, карбонат калия 4) йодоводородная кислота, железо, медь |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №85
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сульфид меди(II) Б) иодид натрия В) бромоводородная кислота | 1) хлор, поташ, оксид алюминия 2) бром, соляная кислота, иодоводородная кислота 3) азотная кислота, кислород, перекись водорода 4) хлорид железа(III), сульфат меди, бром |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Na2[Zn(OH)4] Б) K3PO4 В) BeO | 1) H2SO4, LiCl, BaCl2 2) HI, RbOH, Cs2O 3) HCl, CO2, H2S 4) HBr, HNO3, H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Fe(NO3)3 Б) Li2S В) Zn(OH)2 | 1) HCl, AgNO3, K3PO4 2) HBr, HNO3, KOH 3) HNO3, H2, K2SO4 4) K2CO3, Cu, KI |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) FeSO4 Б) Be(OH)2 В) CaCl2 | 1) поташ, нитрат серебра, сульфат калия 2) едкое кали, соляная кислота, плавиковая кислота 3) оксид железа(II), сульфат цинка, фторид натрия 4) гидроксид натрия, хлорид бария, серная кислота (конц.) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №89
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Ba(OH)2 Б) CuSO4 В) HCl | 1) гидроксид натрия, сульфид цинка, оксид железа(II) 2) фторид натрия, хлорид цезия, фосфат калия 3) хлорид кальция, сероводород, нитрат бария 4) углекислый газ, бромоводородная кислота, йодоводородная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №90
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) оксид меди (I) Б) азотная кислота (конц.) В) нитрат серебра | 1) азотная кислота, угарный газ, водород 2) соляная кислота, сульфид железа, нитрат цинка 3) оксид меди (II), сульфид меди (II), медь 4) хлороводородная кислота, бромид калия, йодид рубидия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №91
Определите массу твердого остатка, образовавшегося при прокаливании навески питьевой соды массой 21 г. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №92
Вычислите массовую долю соли в растворе, полученном при смешении 23 г сульфида лития и 200 г 18,25%-ного раствора соляной кислоты. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №93
Рассчитайте объем газа, который можно получить при взаимодействии 100 г горячего 10%-ного раствора нитрита калия с равной массой 10%-ного раствора хлорида аммония. Ответ приведите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №94
Определите массу осадка, который образуется при взаимодействии 100 г 20%-ного раствора едкого натра и 20 г хлорида алюминия. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №95
Вычислите объем углекислого газа, который может поглотить 100 мл 10%-ного раствора кальцинированной соды (плотность 1,06 г/см3). Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №96
Рассчитайте массу сероводорода, необходимую для полного разложения смеси 11,8 г тетрагидроксоалюмината натрия и 21,1 г тетрагидроксоцинката калия. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №97
Навеску нитрата магния частично разложили при нагревании. Полученный твердый остаток может прореагировать со 100 г 18,25%-ного раствора соляной кислоты или с 50 г 10%-ного раствора едкого натра. Определите массу исходной навески. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №98
Навеску смеси карбонатов цинка и калия прокалили до постоянной массы. После обработки полученного твердого остатка избытком раствора гидроксида калия в образовавшийся раствор пропустили углекислый газ до прекращения поглощения. Масса выпавшего при этом осадка составила 9,7 г. Определите массу исходной навески, если массовая доля карбоната калия в ней составляла 25%. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №99
Навеску нитрата свинца разложили при нагревании. Выделившийся газ может прореагировать с 80 мл 25% раствора едкого кали (плотность 1,12 г/см3). Определите массу исходной навески. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №100
При нагревании навески мела массой 40 г вещество частично разложилось. При добавлении избытка соляной кислоты к твердому остатку выделилось 6,72 л газа. Определите объем воды, который может прореагировать с такой же массой твердого остатка. Ответ приведите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решениеscienceforyou.ru
Задания 7. Характерные химические свойства оснований, амфотерных гидроксидов, кислот и солей.
Задание №1
В пробирку с раствором соли X добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. KOH
- 2. HCl
- 3. Cu(NO3)2
- 4. K2SO3
- 5. Na2SiO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеОтвет: 42
При реакции между двумя солями неорганических кислот газ образуется только при смешении горячих растворов нитритов и солей аммония вследствие образования термически неустойчивого нитрита аммония. Например,
NH4Cl + KNO2 =to=> N2 + 2H2O + KCl
Однако в списке нет как нитритов, так и солей аммония.
Значит, одна из трех солей (Cu(NO3)2, K2SO3 и Na2SiO3) реагирует либо с кислотой (HCl), либо с щелочью (NaOH).
Среди солей неорганических кислот только соли аммония выделяют газ при взаимодействии с щелочами:
NH4+ + OH = NH3 + H2O
Солей аммония, как мы уже сказали, в списке нет. Остается только вариант взаимодействия соли с кислотой.
К солям среди указанных веществ относятся Cu(NO3)2, K2SO3 и Na2SiO3. Реакция нитрата меди с соляной кислотой не протекает, т.к. не образуется ни газа, ни осадка, ни малодиссоциирующего вещества (воды или слабой кислоты). Силикат натрия реагирует с соляной кислотой, однако благодаря выделению белого студенистого осадка кремниевой кислоты, а не газа:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
Остается последний вариант — взаимодействие сульфита калия и соляной кислоты. Действительно, в результате реакции ионного обмена между между сульфитом и практически любой кислотой образуется неустойчивая сернистая кислота, которая мгновенно распадается на бесцветный газообразный оксид серы (IV) и воду.
Задание №2
При добавлении вещества X к раствору соли Y выделился бесцветный газ, окрашивающий мокрую лакмусовую бумажку в синий цвет. Выберите из предложенного списка вещества X и Y, которые соответствуют наблюдениям эксперимента.
- 1. Cu(OH)2
- 2. NH4Cl
- 3. Ba(OH)2
- 4. Na2SO3
- 5. H2SO4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №3
Сокращенному ионному уравнению
2H+ + CO32- = CO2 + H2O
соответствует взаимодействие между:
1) карбонатом рубидия и серной кислотой
2) гидрокарбонатом калия и соляной кислотой
3) карбонатом магния и серной кислотой
4) карбонатом калия и бромоводородной кислотой
5) карбонатом натрия и уксусной кислотой
Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
РешениеЗадание №5
В пробирку с концентрированным раствором вещества X добавили небольшое количество вещества Y, в результате чего не растворимое в воде вещество Y растворилось. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. CuSO4
- 2. Mg
- 3. NaOH
- 4. Al(OH)3
- 5. CaCO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №5
Реакция ионного обмена протекает между:
1) железом и соляной кислотой
2) оксидом железа (III) и алюминием
3) сульфидом натрия и хлоридом меди (II)
4) бромидом натрия и хлором
5) соляной кислотой и нитратом серебра
Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
РешениеЗадание №6
В пробирку с раствором щелочи (вещества X) добавили раствор вещества Y. В результате реакции наблюдали выделение голубого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) сульфат железа (II)
2) гидроксид натрия
3) сульфат меди (II)
4) соляная кислота
5) гидроксид аммония
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №7
В пробирку с раствором щелочи (вещества X) добавили раствор вещества Y. В результате произошла реакция, которую описывает сокращенное ионное уравнение OH— + H+ = H2O. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) сульфид калия
2) угольная кислота
3) серная кислота
4) гидроксид бария
5) гидроксид натрия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №8
При комнатной температуре концентрированная серная кислота растворяет металл (вещество X) и взаимодействует с раствором вещества Y с выделением бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) карбонат натрия
2) железо
3) алюминий
4) карбонат магния
5) цинк
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №9
При взаимодействии растворов одних веществ образуется бурый осадок (пара веществ X), а при взаимодействии растворов других веществ образуется белый творожистый осадок (пара веществ Y). Из предложенного перечня выберите две пары веществ, которые могут вступать в описанные реакции.
1) нитрат серебра и хлорид натрия
2) гидроксид натрия и нитрат железа (III)
3) карбонат калия и азотная кислота
4) серная кислота и аммиак
5) хлорид калия и ортофосфорная кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №10
Из предложенного перечня выберите две пары веществ, взаимодействие которых в водном растворе приводит к образованию осадка.
1) серная кислота и гидроксид лития
2) гидрокарбонат натрия и гидроксид натрия
3) гидроксид натрия и хлорид бария
4) гидроксид калия и хлорида алюминия
5) сульфат меди и сульфида калия
Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
РешениеЗадание №11
Сокращенное ионное взаимодействие H+ + OH— = H2O соответствует взаимодействию раствора щелочи (вещества X) раствором вещества Y. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидроксид лития
2) гидроксид магния
3) иодоводородная кислота
4) фтороводородная кислота
5) сероводородная кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №12
Через колбу с раствором электролита (вещества X) пропустили газ Y, который поглотился раствором, при этом никаких признаков реакции не наблюдалось. Из предложенного перечня выберите вещества X и Y, которые соответствуют условию задания.
- 1. CO2
- 2. CaCO3
- 3. NH3
- 4. AlCl3
- 5. BaCl2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №13
В результате взаимодействия соляной кислоты с раствором вещества X образуется газообразное вещество. При пропускании этого газообразного вещества через раствор вещества Y выпал белый осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) карбонат кальция
2) карбонат калия
3) гидроксид кальция
4) гидроксид калия
5) аммиак
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №14
Гидроксид натрия может реагировать с веществом X с образованием как кислой, так и средней солей, а с веществом Y — с образованием комплексной соли. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) сульфит калия
2) гидроксид магния
3) гидроксид алюминия
4) хлорид лития
5) оксид серы (IV)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №15
Соляная кислота реагирует с раствором вещества X без проявления каких-либо признаков реакции, а с веществом Y — с выделением бесцветного газа с резким запахом. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) карбонат бария
2) гидроксид цинка
3) сульфит бария
4) гидроксид бария
5) сульфат бария
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №16
Вещества X и Y не растворимы в воде. При добавлении разбавленной серной кислоты к веществу X оно растворяется, а при добавлении серной кислоты к веществу Y — растворение сопровождается выделением газа. Из предложенного перечня выберите вещества X и Y, которые вступают в описанные реакции.
- 1. Zn(OH)2
- 2. Ca(OH)2
- 3. Zn
- 4. Ag
- 5. Cu
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №17
Вещество X, 1 моль которого при полной диссоциации в растворе образует наибольшее количество ионов, взаимодействует с веществом Y с образованием белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) хлорид меди (II)
2) нитрат серебра
3) хлорид лития
4) иодид серебра
5) хлорид железа (III)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №18
При взаимодействии раствора кислородсодержащей соли X с бескислородной солью Y выпадает осадок белого цвета. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. Fe2(SO4)3
- 2. KOH
- 3. NaCl
- 4. BaCl2
- 5. PbSO4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №19
Вещество X, 1 моль которого при полной диссоциации в растворе образует наибольшее количество ионов натрия, взаимодействует с веществом Y с образованием белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидроксид натрия
2) фосфат кальция
3) нитрат натрия
4) нитрат кальция
5) карбонат натрия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №20
Вещество X растворяется как в растворе серной кислоты, так и в растворе гидроксида натрия, а вещество Y реагирует с этими растворами с образованием осадков в обоих случаях. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1. Zn(NO3)2
- 2. Pb(NO3)2
- 3. Al(OH)3
- 4. FeCl3
- 5. FeCl2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №21
В пробирку с раствором соли аммония Х добавили раствор вещества Y.
В результате реакции наблюдали образование белого осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) нитрат аммония
2) хлорид аммония
3) хлороводород
4) сульфат магния
5) карбонат аммония
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №22
В пробирку с раствором вещества X добавили кислоту Y. В результате произошла реакция, которую описывает сокращённое ионное уравнение
H+ + HCO−3 = H2O + CO2↑
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) угольная кислота
2) фтороводородная кислота
3) бромоводородная кислота
4) карбонат калия
5) гидрокарбонат аммония
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №23
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидрокарбонат бария
2) гидроксид натрия
3) нитрат аммония
4) бромид лития
5) сероводород
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №24
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции образовалось слабое растворимое основание и выделился осадок. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) сульфат лития
2) хлорид кальция
3) карбонат аммония
4) гидроксид бария
5) гидроксид калия
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №25
В пробирку с раствором соли X добавили раствор вещества Y. В результате произошла реакция, которую описывает сокращённое ионное уравнение
H2PO4− + 2OH− = PO43− + 2H2O
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) дигидрофосфат аммония
2) дигидрофосфат кальция
3) дигидрофосфат калия
4) гидроксид бария
5) гидроксид натрия
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №26
В пробирку с раствором вещества X добавили раствор щёлочи Y.
В результате произошла реакция, которую описывает сокращённое ионное уравнение
HS– + OH– = S2– + H2O
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидросульфид аммония
2) гидросульфид калия
3) сероводородная кислота
4) гидроксид стронция
5) гидроксид калия
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №27
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) нитрат натрия
2) аммиак
3) бромоводород
4) хлорид алюминия
5) оксид серы(IV)
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решениеscienceforyou.ru