Подгруппа серы
Нахождение в природе. Содержание серы в земной коре составляет до 0,1 %. Остальных элементов подгруппы (Se, Te) мало. В природе сера встречается в свободном состоянии (самородная сера), а также в виде сульфидов и сульфатов. Важнейшие природные сульфиды: пирит (FeS2), цинковая обманка (ZnS), свинцовый блеск (PbS), медный блеск(Cu2S), халькопирит (CuFeS2), киноварь(HgS). Важнейшие природные сульфаты: глауберова соль (Na2SO4·10H2O), гипс (CaSO4·2H2O) и др.
Химические свойства. Сера и ее аналоги могут участвовать в реакциях восстановления (в качестве окислителя) (а), окисления (б) и в реакциях диспропорционирования (в) по схеме:
(а)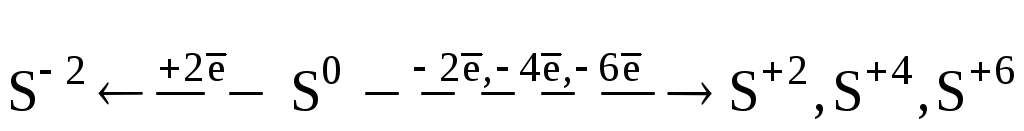
а) S + Zn = ZnS б) S + 3F2 = SF6
S + H2 = H2S S + Cl2 = SCl2
S + O2 = SO2
в) 3S + 6KOH = K2SO3 + 2K2S + 3H2O
Лабораторный способ получения: FeS + 2HCl = FeCl2 + H2S
Сероводород и сероводородная кислота. H2S – газ, бесцветный, с характерным запахом, ядовит, плотность 1,19 г/см3, легко сжижается; tº( кипения) = –60,3ºС, tº (затвердевания)= –85,5ºС. Плохо растворим в воде (1объем H2O растворяет 3 объема H2S), максимальная концентрация кислоты H 2S 0,11 моль/л. Водный раствор – слабая сероводородная кислота:
H2S H++ HS‾ H+ + S2–
В присутствии кислоты (Н+) ее диссоциация практически подавляется.
Образует два ряда солей – сульфиды (Na2S) и гидросульфиды(NaHS).
Сероводород – сильный восстановитель:
2H2S + 3O2(избыток) = 2H2O + 2SO2
2H2S + O2 (недостаток) = 2H2O + 2S
Сероводородная кислота и сульфиды взаимодействуют со всеми окислителями:
H2S + Br2 = S + 2HBr
H2S + 2FeCl3 = 2FeCl2
H2S + H2SO4(конц.) = S + SO2 + 2H2O
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
Лишь сульфиды щелочных и щелочно-земельных металлов растворимы в воде, сульфиды остальных металлов – осадки различной окраски и растворимости:
ZnS↓, MnS↓ , CdS↓, Sb2S3↓, SnS2↓, PbS↓, CuS↓, HgS↓
белый розовый желтый оранжевый черный черный черный черный
ПР:2,5∙10–22, 2,5∙10-10
, 7,2∙10–27, кислотный характер 2,5∙10–27 6,3∙10–36 1,6∙10–52Сульфиды металлов, стоящих в ряду напряжений до железа (включительно), имеют довольно большие значения ПР и легко растворяются в разбавленных кислотах:
ZnS + 2HCl = ZnCl2 + H2S (ПР = 2,5∙10–22 )
MnS + 2HCl = MnCl2 + H2S (ПР = 2,5∙10–10)
FeS + 2HCl = FeCl2 + H2S (ПР = 5∙10–18)
Для растворения осадков с меньшим ПР ( ≤ 1·10–25) к кислоте добавляют более сильный окислитель, например, H2O2:
NiSγ + 2HCl + H2O2 = NiCl2 + S + 2H2O (ПР = 2∙10–26)
CoSγ
Сульфиды всех металлов, кроме HgS, растворяются в концентрированной HNO3:
3CuS + 8HNO3 = 3Cu(NO3)2 + 2NO + 3S + 4H2O
Черный осадок сульфида свинца (PbS) при растворении в концентрированной азотной кислоте или в пероксиде водорода превращается в белый (PbSO4):
3PbS + 8HNO3 = 3PbSO4+ 8NO + 4H2O
черный белый
 3 PbS
+ 4H2O
– 8ē = PbSO4 + 8H+
3 PbS
+ 4H2O
– 8ē = PbSO4 + 8H+
8 NO3‾ + 4H+ + 3ē = NO + 2H2O
PbS + 4H2O2 = PbSO4+ 4H 2O
черный белый
 1 PbS
+ 4H2O
– 8ē = PbSO4 + 8H+
1 PbS
+ 4H2O
– 8ē = PbSO4 + 8H+
4 Н2О2 + 2ē = 2ОН–
Самый труднорастворимый осадок HgS (ПР=1,6·10–52) можно перевести в раствор царской водкой или избытком КI (за счет комплексообразования):
3HgS + 2HNO3 + 12HCl = 3H2 [HgCl4] + 2NO + 4H2O + 3S
HgS + 2HCl + 4KI = K2 [HgI4] + 2KCl + H2S
Тиосоли. Сульфиды олова(IV), мышьяка и сурьмы (SnS2, AS2S3, As2S5, Sb2S3 и Sb2S5) обладают кислотными свойствами (подобно их оксидам) и способны растворяться в
Примеры:
As2S5 + 3Na2S = 2Na3AsS4
(P2O5 + 3Na2O = 2Na3PO4)
Sb2S3 + 3Na2S = 2Na3SbS3
(P2O3 + 3Na2O = 2Na3PO3)
4Sb2S5 + 24NaOH = 5Na3SbS4 + 3Na3SbO4 + 12H2O
Сульфиды подвергаются гидролизу:
(NH4)2S + H2O NH4HS + NH4OH
Сульфиды алюминия и хрома в водных растворах не могут существовать, т.к. подвергаются полному и необратимому гидролизу:
2AlCl3 + 3Na2S + 3H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl2CrCl3 + 3Na2S + 3H2O = 2Cr(OH)3↓ + 3H2S↑ + 6NaCl
Известны полисульфиды аналогичные по составу пероксидным соединениям H2S2 (Fe[S2] пирит – производное от H2S2) H2S3,H2S5 и др.
Кислородные соединения серы.
Ниже приведены оксиды серы, соответствующие им кислоты и соли:
+2 +4 +6
SO SO2 SO3
(HHSO2) (H2SO3
сульфоксиловая сернистая серная кислота
KHSO2 Na2SO3 Na2SO4
сульфоксилат калия сульфит натрия сульфат натрия
SO – оксид серы (II.) Получают из оксида серы (IV), пропуская его над парами серы:
S + O2 = SO2 SO2 + S(пары
) 2SO
или
S2O2
2SO
или
S2O2
низкое давление
Это бесцветный газ, устойчив, разлагается водой, реагирует с Ме, Г2
и другими неметаллами. Его можно раасматривать как ангидрид сульфоксиловой кислоты: SO
+ KOH  KHSO2
KHSO2
SO2 – оксид серы (IV). Получают при сжигании серы на воздухе:
S + O2 = SO2
При растворении SO2 в воде образуется слабая и неустойчивая сернистая кислота, которой соответствуют два ряда солей – средние (сульфиты) и кислые (гидросульфиты):
SO2 + H2O H2SO3 H2SO3 H+ + HSO3– HSO3– H+ + SO32–
Сера в степени окисления (IV) и ее производные проявляют окислительно-восстановительную двойственность, участвуют в реакциях восстановления (а), окисления (б) и диспропорционирования:
(а) 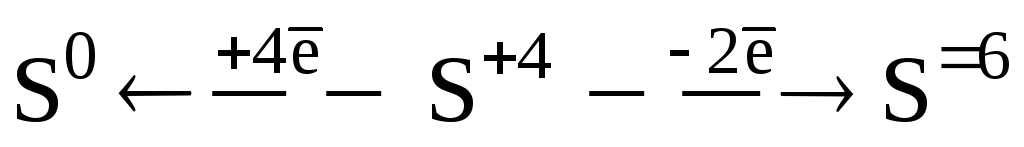 (б)
(б)
а) S – окислитель (малохарактерно):
H2SO3 + 2H2S = 3S + 3H2O
1 SO32– + 6H+ + 4ē =3S + 3H2O
2 H2S –2ē = S +2H+
б) Na2SO3 — восстановитель, в любой среде: SO32– →SO42–
H2SO4 +MnSO4 +…..
KMnO4 + Na2SO3 + H2O → Na2SO4 + MnO2 +….
KOH + K2MnO4 +……
При кипячении серы с сульфитом натрия образуется новая соль
Na2SO3 + S 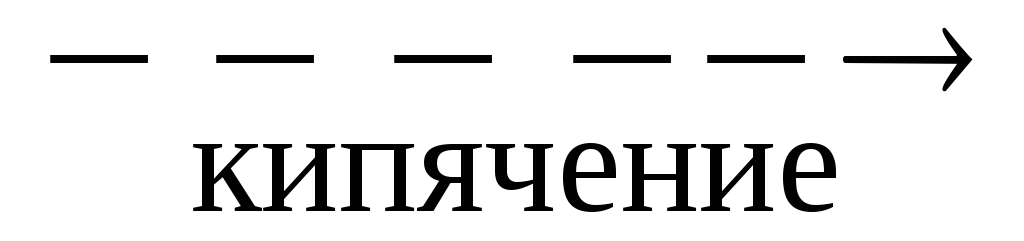 Na2S2O3 — тиосульфат
натрия
(антихлор).
Na2S2O3 — тиосульфат
натрия
(антихлор).
Отличие в структурной формуле тиосерной кислоты от серной:

Тиосульфат натрия – восстановитель:
S2O32– + H2O – 2ē = S + SO42– +2H+,
взаимодействует с галогенами:
Na2S2O3 + Cl2 + H2O = Na2SO4 + S + 2HCl, но
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
тетратионат натрия
Серная кислота — H2SO4. Получают ее по схеме:
1. S + O2 = SO2
2. 2SO2 + O2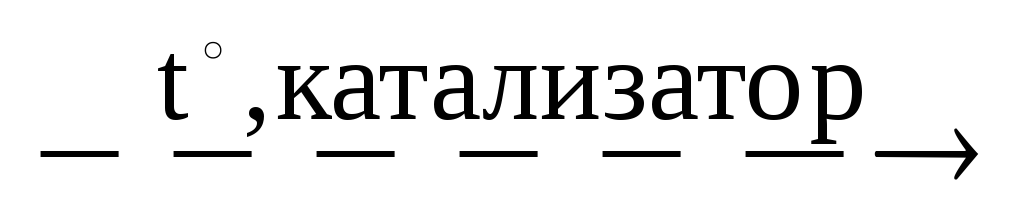 2SO3
2SO3
3. SO3 + H2O = H2SO4 (ΔH= – 79,5КДж)
Действие H2SO4 на металлы и неметаллы.
Элементы | H2SO4разб. | H2SO4конц. |
Ме до Н | Н2↑ | |
Al, Cr, Fe | холодн.-пассивируются | |
Al — Zn | SO2, S, H2S | |
Cu — Hg | – | SO2 |
неметаллы | – | SO2 + ЭОn |
H2SO4, HCl и др.+ (Fe, Co, Ni, Cr) = Me2+ + Н2
разбавленные
HNO3, H2SO4 , HCl + (Fe, Cr) = Me3+
разб.,конц. конц.,tº конц.
Примеры:
Cu + 2H2SO4 (конц, tº) = CuSO4 + SO2 + 2H2O
Hg – “ – “ – “ → HgSO4 + “ – “ – “–
Ag – “ – “ – “ → Ag2SO4 + “ – “ – “–
C + 2H2SO4(конц.) = CO2 + 2SO2 + 2H2O
S + 2H2SO4(конц.) = 3SO2 + 2H2O
Промышленное получение H2SO4 . Сырьем для получения серной кислоты служит пирит (FeS2), который при обжиге в печах дает оксид серы (SO2), из которого далее по одному из методов (контактному или нитрозному) получают серную кислоту.
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
1.Контактный метод. По этому методу SO2 после очистки, осушки поступает в контактный аппарат, где в присутствии катализатора и при нагревании окисляется до SO3 :
2SO2 + O2 2SO3
2SO3
Pt
SO3 поступает в поглотительную башню, где растворяется в Н2SO4 (концентрированной), превращаясь в олеум:
n SO2 + H2SO4 (конц.) = (H2SO4·n SO2)
олеум
2. Нитрозный метод – окисление SO2 в SO3 происходит с помощью оксидов азота:
а) SO2 + H2O + NO2 = H2SO4 + NO
б) 2NO + O2 = 2NO2
Олеум: x H2SO4 ∙y SO3
x = y = 1: H2S2O7 — пиросерная кислота, соли — пиросульфаты
O O
║ ║
H–O–S–O–S–O–H
║ ║
O O
H2S2O8 – надсерная (пероксодвусерная) кислота, ее соли — персульфаты являются сильными окислителями:
O O
║ ║
H–O–S–O–O–S–O–H ( S2O82– + 2ē = 2SO42–)
║ ║
O O
Надсерная кислота (бесцветные гигроскопические кристаллы), обугливает бумагу, сахар, парафин, Получают электролизом концентрированного гидросульфата KHSO4
Электролиз:
– (Kатод) 2HOH +2ē = H2 +2OH– + (Aнод) 2HSO4‾ –2ē = H2S2O8
2K+
Без диафрагмы: 2KOH + H2S2O8 = K2S2O8 + 2H2O
персульфат калия
Персульфаты сильные окислители:
5K2S2O8 + 2MnSO4 + 8H2O = 2HMnO4 + 5K2SO4 + 7H2SO4
2 Mn2+ + 4H2O – 5ē = MnO4‾ + 8H+
5 S2O82– + 2ē = 2SO42–
Cr2(SO4)3 +3(NH4)2S2O8 +7H2O = (NH4)2Cr2O7 +2(NH4)2SO4+7H2SO4
1 2Cr3+ + 7H2O –6ē = Cr2O72–+ 14H+
3 S2O82– + 2ē = 2SO42–
При взаимодействии H2S2O8 с концентрированным раствором H2O2 образуется одноосновная мононадсерная кислота H2SO5:
H2S2O8 + H2O2 = 2H2SO5
H2SO5 — сильнейший окислитель. При контакте с органическими соединениями (бензол и др.) происходит взрыв.
Кроме надкислот серы известны также пероксиды серы : SO4, S2O7
S 

O O O O
║ ║
O O S ─O─O─S S2O7
SO4 O ─ O ─ O
studfile.net
Элементы главной подгруппы VI группы периодической системы сера, селен, теллур
Общая характеристика. Элементы кислород, сера, селен, теллур и полоний составляют главную подгруппу шестой группы периодической системы. Общая характеристика этих элементов такова [c.144]Общая характеристика неметаллов шестой группы периодической системы. Элементы VI группы периодической системы подразделяют на две подгруппы. Главную подгруппу составляют кислород, сера, селен, теллур и полоний. К побочной подгруппе относят хром, молибден, вольфрам и уран. [c.140]
VI группа, главная подгруппа кислород, сера, селен, теллур, полоний. На внешнем уровне атомов этих элементов по шесть электронов П5 Первые четыре элемента имеют ярко выраженные неметаллические свойства. Их называют халькогенами ( образующими руды ), полоний — редкий, малоизученный элемент. Во внешнем уровне атома кислорода нет -подуровня, как и у атомов других элементов 11 периода периодической системы, поэтому кислород проявляет валентность, равную 2, остальные халькогены — 2, 4, 6. Валентность 2 соответствует невозбужденному состоянию атома, 4 —состоянию -возбуждения, 6 — состоянию 5 -возбуждения электронных облаков атома. [c.233]
Общая характеристика элементов. К главной подгруппе VI группы периодической системы относятся кислород, сера, селен, теллур и полоний. [c.254]
Общая характеристика элементов. К главной подгруппе VI группы периодической системы относятся кислород, сера, селен, теллур и полоний. Атомы этих элементов содержат (табл. 18) на внещнем энергетическом уровне по шесть электронов (два на 5- и четыре на /3-подуровнях), поэтому они проявляют стремление к дополнению электронами внешнего энергетического уровня до октета. [c.270]
По химическим свойствам элементы главной подгруппы VI группы периодической системы — сера, селен и теллур (кислород и полоний здесь не рассматриваются) относятся к неметаллам. Хотя селен и теллур, особенно последний, в элементарном состоянии могут существовать в металлических модификациях и способны давать соли с сильными кислотами, выступая в качестве катионов, металлоидный характер у них является преобладающим. При образовании химических соединений сера, селен и теллур могут присоединять или отдавать электроны, проявляя максимальную отрицательную валентность, равную 2, и максимальную положительную, равную 6. Отдача электронов у халькогенов осуществляется легче, чем у галогенов, а присоединение идет несколько труднее. Химическая активность элементов уменьшается по направлению от серы к теллуру, однако в общем является настолько высокой, что ограничивает их применение в катализе. В каталитической практике халькогены и их соединения (за исключением серной кислоты, данные по которой не включены в материал справочника) используются редко, и возможности их применения еще недостаточно изучены. Ниже описываются химические свойства элементарных халькогенов и основных их соединений, употребляющихся в катализе. [c.511]
Элементы главной подгруппы шестой группы периодической системы — это кислород, сера, селен, теллур и полоний. Последний из них — радиоактивный металл известны как природные, так и искусственно полученные его изотопы. [c.452]
Вопрос о существовании подгрупп в группах менделеевской системы также нашел свое объяснение. Главная подгруппа в группах менделеевской системы составлена из элементов, атомы которых имеют в своих внешних электронных оболочках число электронов, соответствующее номеру группы в системе Менделеева. Например, в шестой группе периодической системы элементы кислород, сера, селен, теллур и полоний имеют во внешних своих электронных оболочках по 6 электронов другие же элементы той же шестой группы — хром, молибден, вольфрам и уран — выделены в особую подгруппу — они имеют во внешних своих электронных оболочках не по шесть, а по одному или по два электрона, чем объясняются различные их свойства. Из первой группы периодической системы выделены в особую подгруппу медь, серебро и золото, а из второй группы — цинк, кадмий и ртуть, отличающиеся от остальных элементов своих групп второй снаружи электронной оболочкой (по 18 электронов вместо 8 у остальных элементов). [c.215]
Названия соединений элементов с элементами главной подгруппы шестой группы периодической системы Д. И. Менделеева серой, селеном и теллуром строятся так же, как и названия соединений с галогенами по международной номенклатуре первое слово названия — сульфид, селенид, теллурид по русской для соединений с серой — сернистый. [c.32]
В главной подгруппе VI группы периодической системы элементов Д. И. Менделеева расположены р-элементы — кислород О (…2з 2р ) и его электронные аналоги — сера 5, селен 5е, теллур Те и полоний Ро (…пз пр ). [c.280]
В главной подгруппе шестой группы периодической системы элементов Д. И. Менделеева находятся элементы кислород (О), сера (8), селен (Зе), теллур (Те) и полоний (Ро). Эти элементы имеют общее название халькогены, что означает образующие руды . [c.351]
К подгруппе кислорода относят элементы главной подгруппы VI группы периодической системы типические элементы — кислород и серу, элементы больших периодов — селен, теллур и полоний (мало изученный в химическом отношении). По аналогии с галогенами эти элементы (кроме полония) называют халькогенами. Во внешнем слое их атомов по шесть электронов (з р ). Поэтому халькогены ведут себя как типичные неметаллы, хотя и менее активные, чем галогены. Присоединяя по два электрона, атомы их превращаются в отрицательно двухзарядные ионы, входящие в соединения с металлами и водородом. Но водородные соединения халькогенов менее устойчивы и труднее образуются, чем у галогенов. К тому же с увеличением атомных номеров сродство к электрону у халькогенов уменьшается, а теллур непосредственно с водородом уже не взаимодействует. В подгруппе окислительная активность нейтральных атомов сверху вниз понижается, восстановительные свойства отрицательных ионов усиливаются. [c.168]
Общие сведения. В главную подгруппу VI группы периодической системы входят элементы
www.chem21.info
Урок по теме «Общая характеристика элементов подгруппы кислорода»
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
- обучающая: охарактеризовать элементы подгруппы кислорода на основании их положения в Периодической системе и строения атомов; расширить знания учащихся о свойствах элементов главных подгрупп; познакомиться со свойствами элементов – простых веществ;
- коррекционная: отработка умений фиксации взора, ориентации в определенном перцептивном поле, развитие и совершенствование прослеживающих и констатирующих функций неполноценного зрения;
- воспитательная: формирование навыков здорового образа жизни, бережного отношения к природным богатствам, экологически грамотное поведение в природе и обществе как социально и личностно значимого компонента образованности человека.
Задачи урока:
- используя предварительную работу учащихся при подготовке к уроку, частично – поисковый, творческий подход к обучению, опираясь на ранее полученные знания, направлять деятельность учащихся на установление закономерности в изменении свойств элементов и их соединений в зависимости от положения в Периодической системе и строения атомов; способствовать приобретению умений учащихся самостоятельно оценивать свои знания.
Оборудование урока:
- Периодическая система химических элементов Д.И. Менделеева; вода, сера кристаллическая, прибор для нагревания; минералы: пирит, медный блеск, свинцовый блеск, цинковая обманка.
Форма проведения урока:
- урок по технологии “Развивающее обучение” с использованием ИКТ.
Тип урока: объяснительно-поисковый.
Ход урока
I. Организационный этап.
II. Постановка цели урока и актуализация.
Учитель: Ребята, мы с вами изучили Периодический закон и Периодическую систему химических элементов Д.И. Менделеева, можем охарактеризовать элементы исходя из их положения в системе, зная строение их атомов. А теперь мы приступаем к изучению подгрупп химических элементов. Начинаем с подгруппы кислорода. Свои ответы я предлагаю вам оценивать самостоятельно. Для этого вы берете жетон, цвет которого соответствует отметке: красный – “5”, зеленый – “4”, желтый – “3”. В конце урока подведем итоги. Итак, тема нашего урока:
Записать в тетрадь:
Общая характеристика элементов подгруппы кислорода (слайд №1).
III. Воспроизведение учащимися знаний, полученных ранее.
Памятка к изучению подгруппы элементов (слайд №2):
1. Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной подгруппе.
2. Составьте схемы строения атомов элементов, укажите принадлежность к металлам или неметаллам.
3. Укажите, окислителями или восстановителями являются элементы, их возможные степени окисления.
4. Приведите формулы высших оксидов, гидроксидов, летучих водородных соединений элементов и укажите их характер.
Работа учащихся у доски по плану памятки:
1. Учащийся выписывает знаки элементов VI группы главной (А) подгруппы, называет их.
Записать в тетрадь:
VI группа, главная подгруппа: O – кислород, S – сера, Se – селен, Te – теллур, Po– полоний.
Дополнение учителя: эти элементы имеют групповое название “халькогены”, что означает “образующие руды”.
2. Учащийся изображает схемы строения атомов О, S, Se, Те, Po и объясняет их принадлежность к металлам или неметаллам.
Записать в тетрадь:
- О +8 2е, 6е
- S +16 2е, 8е,6е
- Sе +34 2е,8е,18е,6е
- Те +52 2е,8е,18е,18е,6е
- Ро +84 2е,8е,18е,32е,18е,6е
Так как на внешнем энергетическом уровне содержится 6 электронов, до завершения уровня не хватает 2-х электронов, следовательно элементы могут присоединять 2 электрона и проявляют неметаллические свойства (кислород и сера – неметаллы). Но элементы могут и отдавать электроны с внешнего энергетического уровня, то есть, 6 электронов. Способность отдавать электроны усиливается с увеличением заряда ядра атома и увеличением радиуса атома элементов, т.е. сверху вниз. Таким образом, селен и теллур уже будут проявлять некоторые металлические свойства, а полоний – это металл.
3. Учащийся у доски указывает окислители и восстановители и называет возможные степени окисления элементов:
Так как на внешнем энергетическом уровне содержится 6 электронов, до завершения уровня не хватает 2-х электронов, следовательно элементы могут присоединять 2 электрона и минимальная степень окисления элементов будет равна минус два, а сами элементы будут являться окислителями.
Записать в тетрадь: (слайд №3)
- Э0 +2 е— = Э-2 Э0 – окислитель
Среди этих элементов O — сильный окислитель.
Но так как радиусы атомов увеличиваются сверху вниз, то способность принимать электроны падает и нарастает способность к отдаче электронов, то есть окислительная способность уменьшается, а восстановительная способность усиливается. На внешнем энергетическом уровне элементы содержат 6 электронов, следовательно могут отдать все 6 электронов и максимальная степень окисления у них будет равна плюс 6.
Записать в тетрадь: (слайд №3)
- Э0 — 6е— = Э+6 Э0 – восстановитель
- S, Se, Te – могут быть как восстановителями, так и окислителями.
Дополнение учителя: для кислорода не типична степень окисления, равная +6, он проявляет степень окисления -2, в соединении со фтором +2. Также эти элементы могут проявлять степени окисления +2, +4 и +6 в соединениях с кислородом и другими активными неметаллами, -2 в соединениях с металлами и водородом.
Записать в тетрадь: (слайд №4)
Степени окисления элементов: О-2; O+2F2;
- с кислородом и активными неметаллами S+2,+4,+6 , Se+4,+6 , Te+4,+6;
- с металлами и водородом S-2 , Se-2 , Te-2.
4. Учащийся у доски записывает формулы оксидов и гидроксидов в высшей степени окисления элементов, их летучие водородные соединения.
Высшие оксиды образуются элементами в максимальной степени окисления +6 и имеют общую формулу RО3:
Записать в тетрадь:
Оксиды элементов (+6):
- SO3 – кислотный оксид
- SeO3 – кислотный оксид
- ТеО3 – кислотный оксид
- РоО3 – неустойчив.
(Помощь учителя в определении характера оксидов.)
Записать в тетрадь.
Гидроксиды элементов (+6):
- H2SO4 – серная кислота
- H2SeO4 – селеновая кислота
- Н2ТеО4 – теллуровая кислота
Сила кислот убывает сверху вниз.
Водородные соединения имеют общую формулу Н2R и образуются элементами в минимальной степени окисления ( — 2).
Записать в тетрадь.
Водородные соединения элементов:
- Н2О – оксид водорода (вода)
- Н2S – сероводород
- H2Se – селеноводород
- Н2Те – теллуроводород
- Н2Ро – не изучен
Дополнение учителя: кроме воды, – это ядовитые газы. Водные растворы этих соединений – это кислоты, сила которых возрастает от сероводорода к теллуроводороду, т.е. сверху вниз в подгруппе.
IV. Введение новых знаний.
Изучение элементов – простых веществ. Объяснение учителя.
1. Кислород – О2, газ без цвета, вкуса и запаха, тяжелее воздуха, малорастворим в воде, при t=-1830С сжижается (светло-голубого цвета), поддерживает дыхание и горение. Сильный окислитель. Открыт в 1774 году Джозефом Пристли (слайд №5).
2. Озон – О3, газ голубого цвета с характерным запахом свежести, в 1,5 раза тяжелее воздуха, в жидком состоянии темно-синий, ядовит, разрушает ткани дыхательных путей. Более сильный окислитель, чем О2 (красители обесцвечиваются, спирт воспламеняется).
Благоприятно влияет на организм человека в небольшом количестве (аромат свежести во время грозы).
Записать в тетрадь (слайд №6):
Явление, когда один и тот же элемент образует несколько простых веществ, называют аллотропией.
О2 и О3 – аллотропные видоизменения.
3. Сера – S имеет два аллотропных видоизменения: (слайд №7)
S8 ромбическая – или просто сера - хрупкое вещество желтого цвета, не растворима в воде и ею не смачивается, легкоплавка, неэлектроповодна и теплопроводна. В узлах ее кристаллической решетки находятся циклические восьмиатомные молекулы типа “корона”.
пластическая – темного цвета, растягивается и сжимается как резина. Получают из Sобычной нагреванием до t=444 и последующим охлаждением.
Демонстрации:
1. сера, ее растворимость в воде;
2. показ минералов, содержащие серу: PbS – свинцовый блеск, Cu2S – медный блеск, ZnS – цинковая обманка, FeS2 – пирит;
3. получение серы пластической: кристаллическую нагреть до t0 = 112,80С, образуется расплав серы, далее продолжить нагревание до t0 = 444,60C (кипение), затем быстро вылить кипящую серу в холодную воду и наблюдать образование серы пластической.
4. Селен – Seоткрыт в 1817 г. Берцеллиусом. В чистом виде Se — твердое вещество серого цвета с металлическим отсветом, ядовит. Способен заменять серу при построении белковых молекул растений, при употреблении в пищу которых переходит в организм животных и человека. По свойствам похож на серу. Используется при вулканизации каучука (для получения резины), для изготовления выпрямителей переменного тока, в стекольной промышленности для обесцвечивания стекол.
5. Теллур – Te неметалл, по внешнему виду напоминает металл, твердое кристаллическое вещество коричневого цвета с металлическим блеском, поводит электрический ток. Применяется в производстве свинцовых кабелей. Соединения теллура ядовиты, с ужасным непереносимым запахом. Постепенно нервные окончания носа работающих с соединениями теллура, парализуются и перестают чувствовать этот запах, что приводит к отравлению.
6. Полоний – Ро открыт в 1898 году Марией Кюри. Металл, по внешнему виду похожий на никель, в 300 раз радиоактивнее урана. Свойства его почти не изучены.
Изучение нахождения в природе наиболее распространенных элементов и их применения.
Сообщения учащихся (подготовка сообщений производится учащимися самостоятельно дома):
- Кислород в природе, его применение (слайд №8)
- Озон в природе, его применение.
- Сера в природе, ее применение (слайд №9)
V. Обобщение и систематизация знаний.
Беседа с учащимися по вопросам:
- Назовите элементы подгруппы кислорода.
- Назовите возможные степени окисления кислорода и серы.
- Назовите окислители и восстановители.
- Какое явление называется аллотропией?
- Какие элементы имеют аллотропные видоизменения? Назовите эти видоизменения.
- Назовите основные физические свойства кислорода и серы.
- Где в природе встречаются кислород и сера?
VI. Подведение итогов урока.
VII. Определение и разъяснение домашнего задания (слайд №10).
urok.1sept.ru