Подгруппа серы — Справочник химика 21
Водородные соединения элементов подгруппы серы [c.345]Приведите формулы оксидов и оксокислот элементов подгруппы серы со степенью окисления — -4. Как изменяются кислотно-основные и окислительно-восстановительные свойства в подгруппе [c.115]
У других элементов данной подгруппы (серы, селена и теллура) спаренные электроны s- и р-орбиталей легко возбуждаются и могут переходить на соответствующие d-орбитали. При этом увеличивается число неспаренных электронов, а значит и валентность элементов до четырех [c.353]
В водородных соединениях элементов подгруппы серы полярность химической связи Э-Н невысока и проявления основных свойств элемента не наблюдается. Однако, в силу ослабления химической связи Э-Н и возможности ее [c.345]
И. Объясните многообразие оксокислот элементов подгруппы серы.
Водородные соединения элементов подгруппы серы в водном растворе являются слабыми кислотами. [c.467]
Атомы элементов подгруппы хрома имеют следующее распределение электронов в двух крайних слоях Сг и Мо)8+5)1, (8+4)2. Все эти элементы являются металлами и в химических реакциях проявляют восстановительные свойства. Они не образуют отрицательных ионов. В отличие от элементов подгруппы серы элементы ряда хрома не образуют с водородом газообразных соединений. В зависимости от числа теряемых электронов элементы ряда хрома проявляют различную валентность. [c.293]
Сера. У следующего члена подгруппы— серы— способность к ассоциации атомов выражена значительно сильнее. Твердая сера имеет много модификаций, а жидкая обладает необычными свойствами, поэтому строение серы вызывает большой интерес и изучалось неоднократно. Ниже 95,6° С наиболее устойчива ромбическая сера. При 95,6° С она [c.209]
Разумеется, не одни лишь особенности строения атомных ядер изотопов определяют содержание элементов в земной коре. Важное значение имеет и геологическая история элемента (так, в земной коре наблюдается дефицит легколетучих элементов — ртути, элементов подгруппы серы и т. п.). Однако тип атомного ядра изотопа, несомненно, относится к числу решающих факторов. [c.20]
Важное значение имеет и геологическая история элемента (так, в земной коре наблюдается дефицит легколетучих элементов — ртути, элементов подгруппы серы и т. п.). Однако тип атомного ядра изотопа, несомненно, относится к числу решающих факторов. [c.20]
Перечислите важнейшие соединения элементов подгруппы серы, их способы получения и области применения. [c.115]
Теперь попробуем применить этот же принцип к описанию элемента полония (№ 84). Вряд ли Вам что-либо известно об этом элементе. Элемент полоний расположен в главной подгруппе VI группы. На внешнем уровне 6 электронов. Число орбиталей значительно больше — 36. Это позволяет предположить наличие у простого вещества металлических свойств (это предположение также возникает из-за четко проявляющегося усиления металлических свойств в подгруппе серы).
Элементы подгруппы серы [c.196]
Для кислорода и подгруппы серы способность к комплексообразованию, так же как и для подгруппы фосфора, сильно ослаблена. Это типичные неметаллы, и только у теллура проявляются в какой-то степени металлические свойства, и он в растворах сильных кислот может давать катионы Те +, например ТеЬ. [c.395]
Это типичные неметаллы, и только у теллура проявляются в какой-то степени металлические свойства, и он в растворах сильных кислот может давать катионы Те +, например ТеЬ. [c.395]
Сера, селен и теллур образуют разнообразные серо-, селен- и теллурсодержащие производные углеводородов. Особенно сильно развита химия серосодержащих соединений. Атомы подгруппы серы имеют близкие по структуре электронные конфигурации 8[Ке] 8е[Аг] и [c.514]
Элементы подгруппы хрома по химическим свойствам значительно больще отличаются от элементов подгруппы серы, чем это имеет место в главной и побочной подгруппах V группы периодической системы, и проявляют заметное сходство с соседями по V группе — ванадием, ниобием и танталом. [c.569]
Указать положение элементов подгруппы серы в периодической системе Менделеева, строение и размеры их атомов и проявляемые ими валентности. [c. 101]
101]
ЭЛЕМЕНТЫ ПОДГРУППЫ СЕРЫ, ИХ ВОДОРОДНЫЕ СОЕДИНЕНИЯ. [c.105]
Так, например, элементы шестой главной подгруппы сера, селен и теллур в своей высшей степени окисления — -6 в концентрированных кислотах Н2504, Н25е04, НеТеОб являются только окислителями, так как больше не могут отдавать электронов. Сера, селен и теллур в низшей степени окисления —2 в соединениях НаЗ, НгЗе и НгТе проявляют только восстановительные свойства, так как больше не могут присоединять электронов. Атомы этих элементов в промежуточной степени окисления +4 в соединениях типа Н2ЭО3 могут быть в зависимости от условий как восстановителями, так и окислителями, причем с более сильным окис сителем они будут играть роль восстановителя, а с более сильным восстановителем — роль окислителя. Таким образом, атомы этих элементов в степени окисления +6 проявляют аналогичные свойства и значительно отличаются от атомов, находящихся в степени окисления -(-4 или, тем более, в степени окисления —2.
Элементы подгруппы серы, строение их атомов, восстановительно-окислительные свойства. Аллотропия серы. Соединения серы и ее аналогов с водородом. Сульфиды и полисульфиды и их свойства. [c.105]
Водородное соединение элемента подгруппы серы весит. 2,43 2, занимает при температуре 27° давлении 750 лш рт. ст. объем 750. ш. Какой это элемент [c.106]
Дайте общую характеристику элементов подгруппы серы [c.43]
Если только формально соблюдать принцип нарастания атомного веса, то в подгруппе серы надо было бы поместить иод, что явно противоречит закону размещения в подгруппе родственных элементов, ибо иод не имеет ничего общего с серой и селеном. ТочнО так же нельзя поместить теллур в подгруппу галогенов. Поэтому Д. И. Менделеев, учитывая химические свойства Л и Те, справедливо поместил их в родственные подгруппы, допустив нарушение принципа нарастания. атомных весов. [c.281]
атомных весов. [c.281]
Хром, молибден и вольфрам составляют побочную подгруппу шестой группы периодической системы. По многим своим свойствам эти элементы сильно отличаются от элементов главной подгруппы — серы, селена и теллура, однако в некоторых свойствах между ними проявляется сходство.
Элемент полоний расположен в главной подгруппе VI группы. На внешнем уровне б электронов. Число орбиталей значительно больше — 36. Это позволяет предположить наличие у простого вещества металлических свойств. (Это предположение также возникает из-за четко проявляющегося усиления металлических свойств в подгруппе серы.) Электронная конфигурация внешнего уровня бв р — такая конфигурация позволяет предположить наличие степеней окисления -Ьб, — -4, +2 и 0. Отрицательные степени окисления не должны быть характерны из-за низкого значения относительной электроотрицательности. Соответствуюпще оксиды [c.202]
Значительное сходство соединений элементов подгрупп серы и хрома проявляется только для w — +6, в остальном элементы подгрупп VIA и VIB малопохожи аналогов НзХ (Х.
Глава VHI.- epa f ее соединения. Элементы подгруппы серы [c.382]
Зиачительное сходство соединений элементов подгрупп серы и хрома проявляется только для м -+6, остальные соединения элементов этих подгрупп мало похожи аналогов Н2Х (X — 8, 5е, Те) в подгруппе хрома нет, для подгруппы серы характерны ЭО2 и Н2ЭО3 (3, е. Те), а для Сг, Мо. V/ оксиды ЭО2 малохарактерны и, кроме того, эти оксиды проявляют более основные свойства (реагируют с кислотами), чем 50г. 8е02, ТеОг. [c.510]
Следовательно, зная степень окисления атома, данного элемента в соединении, можно определить, восстановителем или окислителем является это соединение. Например, элементы шестой главной подгруппы сера, селен и теллур в своей высшей степени окисления — -6 в концентрированных кислотах h3SO4, НгЗеО.
Легко выделяются в элементарном состоянии по VIA подгруппе сера, селен, теллур в VA — мышьяк, сурьма, висмут и в VIIIA — платиновые металлы в IB — медь, серебро, золото во IIB — ртуть. [c.19]
На рис. 60 хорошо виден также разрыв между радиусами б5-электронов Еа и Н1, зависящий от вклинивания серии 4/-элементов и от сжатия лантаноидов. Таким образом, ряд 5с/-элементов можно делить не только на позднюю и раннюю серии, но и выделить из ранних еще и Еа, который в отличие от № ра с-лантаноидов НГ — Нй молточку зрения Д. И. Менделеева, принимавплего за главную подгруппу серию В, А1, Оа, 1п, Т1. Если бы мы, приняв гипотезу о большей стройности М и М элементных серий, соединили точку V с точками Ей и № 103 и считали последние не за 4/- и 5/-элементы, а за члены Ъй- и 6й-серий, потеряна была бы -электрон- [c.118]
И. Менделеева, принимавплего за главную подгруппу серию В, А1, Оа, 1п, Т1. Если бы мы, приняв гипотезу о большей стройности М и М элементных серий, соединили точку V с точками Ей и № 103 и считали последние не за 4/- и 5/-элементы, а за члены Ъй- и 6й-серий, потеряна была бы -электрон- [c.118]
Домашняя подготовка. Элементы подгруппы серы (строение их атомов). Распространение и добыча серы Аллотропия серы. Соединение серы и ее аналогов с водородом. Сульфиды и полисульфиды их свойства. Соединения четырехвалентной серы и их окислительно-восстановительные свойства. Окислы (оксиды) шестивалентной серы и ее аналогов. Получение серного ангидрида и серной кислоты. Свойства серной кислоты. Сульфаты, персульфаты, тиосоедине-ния, их структурные формулы.
Для хрома, как для Т1 и V, высшее состояние окисления определяется общим числом Зй- и 4 5-электронов. Несмотря иа то что наиболее устойчивым состоянием для титана является состояние а является лишь мягким окислителем, хром(VI), существующий только в оксо-соединениях, таких, как СгОз. СгОГ и Сг0.2р2, представляет собой довольно сильный окислитель. Помимо сходства в стехиометрическом составе соединений, хром напоминает элелгенты подгруппы серы только кислотными свойства.ми трехокиси, а также ковалентной природой связн и легкостью гидролиза СгОзС . [c.228]
СгОГ и Сг0.2р2, представляет собой довольно сильный окислитель. Помимо сходства в стехиометрическом составе соединений, хром напоминает элелгенты подгруппы серы только кислотными свойства.ми трехокиси, а также ковалентной природой связн и легкостью гидролиза СгОзС . [c.228]
Разнообразие стереохимии в сочетании с многочисленными состояниями окисления делает химию молибдена и вольфра.ма, пожалуй, наиболее сложны.м разделом химии переходных эле.ментов. Иногда к VI группе вместе с Мо и W относят также и уран между ни.ми действительно наблюдается некоторая, хотя и довольно поверхностная, аналогия. Все три элемента образуют летучие гексафториды, оксогалогениды и оксо-анионы, которые в некоторых отношениях подобны друг другу, с элементами подгруппы серы молибден и вольфрам не имеют почти ничего общего, если не считать некоторой аналогии в стехиометрии, например в соединениях SeFg, WFg, SO4 , MoO . Однако такое сопоставление вряд ли может оказаться плодотворным. [c. 356]
356]
Справочник Термодинамические канстанты веществ под редакцией В. П. Глушко, В. А. Медведева и др. содержит систему взаимно согласованных значений основных термодинамических свойств веществ при 298,15° К и частично при 0°К, а также параметры фазовых переходов. В первый выпуск вошли кислород, водород, галогены, соединения между этими элементами и элементы нулевой группы периодической системы. Наряду со свойствами индивидуальных веществ описываются и свойства их растворов. Второй выпуск посвящен элементам подгруппы серы и их соединениям. Третий и четвертый — соответственно элементам подгрупп азота и углерода и их соединениям между собой и с ранее названными элементам. Весь материал подобран очень тщательно и снабжен литературой. Все издание рассчитано на 10 выпусков. [c.76]
О полимерных кремнеэлементоорганических соединениях, в особенности полиэлементосилоксанах (полимерах, построенных из чередующихся группировок —Si—О—М—О—) говорится в гораздо большем числе обзорных сообщений [4, 5, 6, 8, 10, 11, 36—39, 43, 75, 77, 79—81, 92, 99, 102, 108, ПО, 120]. Однако, как правило, это далеко не исчерпывающее описание отдельных типов элементосилок-сановых полимеров или беглое перечисление известных типов без детализации. Наиболее полными в этой области являются работы К. А. Андрианова [6, 8] и Дж. Джонса [102], но и они охватывают материалы, опубликованные лишь до 1962 г. До сих пор в литературе нет ни одного обзора, систематизирующего работы по кремнеорганическим соединениям, содержащим элементы подгруппы серы или связи кремний — кислород — щелочной металл. [c.11]
Однако, как правило, это далеко не исчерпывающее описание отдельных типов элементосилок-сановых полимеров или беглое перечисление известных типов без детализации. Наиболее полными в этой области являются работы К. А. Андрианова [6, 8] и Дж. Джонса [102], но и они охватывают материалы, опубликованные лишь до 1962 г. До сих пор в литературе нет ни одного обзора, систематизирующего работы по кремнеорганическим соединениям, содержащим элементы подгруппы серы или связи кремний — кислород — щелочной металл. [c.11]
Элементы VI группы подгруппы серы образуют с ураном большое число соединений уранила вплоть до уранилтеллурида (иОг)ТеОз. Элементы подгруппы хрома, являющиеся аналогами урана, как элементы 6d, с ураном дают многочисленные сложные окислы, в том числе соединения типа U02Me04, которые иногда называют хроматами (молибдатами, вольфраматами) уранила, хотя никаких структурных доказательств существования в них группы уранила нет. [c.61]
Из цепных спиралевидных макромолекул состоят кристаллы селена и теллура (рис. 51, в). Из таких же молекул построена и полимерная сера, получающаяся при нагревании низкомолекуля рной при этом восьмичленные циклы рвутся и, соединяясь друг с другом, образуют длинные цепи, содержащие тысячи атомов S. Однако при охлаждении расплава полимерной серы ее макромолекулы не укладываются в строгом порядке, и она переходит не в кристаллическое, а в стеклообразное состояние. Последний элемент подгруппы серы — полоний, в атоме которого содержатся электроны с п = 6, обладает явными металлическими свойствами. [c.141]
51, в). Из таких же молекул построена и полимерная сера, получающаяся при нагревании низкомолекуля рной при этом восьмичленные циклы рвутся и, соединяясь друг с другом, образуют длинные цепи, содержащие тысячи атомов S. Однако при охлаждении расплава полимерной серы ее макромолекулы не укладываются в строгом порядке, и она переходит не в кристаллическое, а в стеклообразное состояние. Последний элемент подгруппы серы — полоний, в атоме которого содержатся электроны с п = 6, обладает явными металлическими свойствами. [c.141]
Подгруппа VIA (кислород, сера, селен, теллур, полоний)
Элементы главной подгруппы VI группы — кислород, сера, селен, теллур и полоний — называются халькогенами. Наружный энергетический уровень имеет конфигурацию ns np . Кислород в соединениях может проявлять только степень окисления —2 (кроме OF2), а остальные эле- [c.192] Общая характеристика неметаллов шестой группы периодической системы. Элементы VI группы периодической системы подразделяют на две подгруппы. Главную подгруппу составляют кислород, сера, селен, теллур и полоний. К побочной подгруппе относят хром, молибден, вольфрам и уран. [c.140]
Элементы VI группы периодической системы подразделяют на две подгруппы. Главную подгруппу составляют кислород, сера, селен, теллур и полоний. К побочной подгруппе относят хром, молибден, вольфрам и уран. [c.140]
Общая характеристика. Элементы кислород, сера, селен, теллур и полоний составляют главную подгруппу шестой группы периодической системы. Общая характеристика этих элементов такова [c.144]
Общая характеристика элементов. К главной подгруппе VI группы периодической системы относятся кислород, сера, селен, теллур и полоний. [c.254]
Главную подгруппу шестой группы составляют кислород, сера, селен, теллур и полоний. Все эти элементы имеют электронные конфигурации внешнего валентного слоя типа ns np (гг=2, 3, 4 и 5 соответственно у кислорода, серы, селена и теллура (см. табл.. 1), что обусловливает прежде всего окислительные свойства этих элементов, хотя при переходе от кислорода к теллуру и полонию окислительная способность элементов резко ослабляется. [c.288]
[c.288]
VI группа, главная подгруппа кислород, сера, селен, теллур, полоний. На внешнем уровне атомов этих элементов по шесть электронов П5 Первые четыре элемента имеют ярко выраженные неметаллические свойства. Их называют халькогенами ( образующими руды ), полоний — редкий, малоизученный элемент. Во внешнем уровне атома кислорода нет -подуровня, как и у атомов других элементов 11 периода периодической системы, поэтому кислород проявляет валентность, равную 2, остальные халькогены — 2, 4, 6. Валентность 2 соответствует невозбужденному состоянию атома, 4 —состоянию -возбуждения, 6 — состоянию 5 -возбуждения электронных облаков атома. [c.233]
Элементы шестой группы подразделяются на типические (кислород, сера), подгруппу селена (селен, теллур, полоний) и подгруппу хрома (хром, молибден, вольфрам). [c.336]
ПОДГРУППА У1А (КИСЛОРОД, СЕРА, СЕЛЕН, ТЕЛЛУР, ПОЛОНИЙ) [c.435]
Элементы главной подгруппы шестой группы периодической системы — это кислород, сера, селен, теллур и полоний. Последний из них — радиоактивный металл известны как природные, так и искусственно полученные его изотопы. [c.452]
Последний из них — радиоактивный металл известны как природные, так и искусственно полученные его изотопы. [c.452]
Общая характеристика элементов. К главной подгруппе VI группы периодической системы относятся кислород, сера, селен, теллур и полоний. Атомы этих элементов содержат (табл. 18) на внещнем энергетическом уровне по шесть электронов (два на 5- и четыре на /3-подуровнях), поэтому они проявляют стремление к дополнению электронами внешнего энергетического уровня до октета. [c.270]
У элементов главной подгруппы VI группы с внешней электронной конфигурацией положительные валентности совсем не проявляются у кислорода, который имеет единственную отрицательную валентность 2—. Таким образом, кислород не имеет валентности 6-Ь, необходимой для помещения его в VI группу, и может быть помещен сюда только по отрицательной валентности 2—. Аналоги кислорода — сера, селен, теллур, полоний — проявляют валентность 6-Ь. Они легко теряют четыре внешних р-электрона и проявляют также валентность 4-Ь и менее устойчивую валентность 2-Ь- В соединениях с более электроположительными элементами аналоги кислорода имеют валентность 2—. [c.80]
[c.80]
К главной подгруппе VI группы относятся кислород, сера, селен, теллур, полоний. Самым типичным представителем ее является кислород — газ без цвета и запаха, немного тяжелее воздуха. Атом кислорода имеет шесть электронов в наружном слое и легко присоединяет два электрона, проявляя соответ ственно окисленность —2, [c.40]
Кислород, сера, селен, теллур и полоний составляют главную подгруппу VI группы и называются халькогенами. [c.175]
В подгруппу кислорода входят пять элементов кислород, сера, селен, теллур и полоний (полоний — радиоактивный элемент). Это р-элементы VI группы периодической системы Д. И. Менделеева. Они имеют групповое название — х а л ь к о г е н ы, что означает образующие руды . [c.173]
Халькогены — общее название элементов главной подгруппы VI группы, в которую входят кислород, сера, селен, теллур и полоний. [c.378]
[c.378]
Кислород, сера, селен, теллур и полоний составляют 6А подгруппу р-элементов в периодической системе. [c.554]
Шестая группа периодической системы состоит из подгруппы кислорода, включающей пять элементов кислород, сера, селен, теллур и полоний и подгруппы хрома, имеющей четыре металла хром, молибден, вольфрам и уран. [c.266]
Элементы VIA-подгруппы — это кислород, сера, селен, теллур и радиоактивный металл полоний. Первые четыре из них имеют неметаллический характер и объединяются общим названием халькогены, что означает образующие руды . [c.371]
Общая характеристика подгруппы. Атомы элементов главной подгруппы VI группы по размерам меньше атомов элементов главной подгруппы V группы. На внешнем энергетическом уровне атомов этой подгруппы находится по 6 электронов (пя , пр ). Вследствие этого кислород, сера, селен, теллур и полоний характеризуются значительно более высоким сродством к электрону (см. табл. ХХ-1), чем находящиеся в одном с ними горизонтальном ряду элементы подгруппы азота, и стремление их атомов к насыщению внешнего энергетического уровня до октета активнее. [c.368]
табл. ХХ-1), чем находящиеся в одном с ними горизонтальном ряду элементы подгруппы азота, и стремление их атомов к насыщению внешнего энергетического уровня до октета активнее. [c.368]
Вопрос о существовании подгрупп в группах менделеевской системы также нашел свое объяснение. Главная подгруппа в группах менделеевской системы составлена из элементов, атомы которых имеют в своих внешних электронных оболочках число электронов, соответствующее номеру группы в системе Менделеева. Например, в шестой группе периодической системы элементы кислород, сера, селен, теллур и полоний имеют во внешних своих электронных оболочках по 6 электронов другие же элементы той же шестой группы — хром, молибден, вольфрам и уран — выделены в особую подгруппу — они имеют во внешних своих электронных оболочках не по шесть, а по одному или по два электрона, чем объясняются различные их свойства. Из первой группы периодической системы выделены в особую подгруппу медь, серебро и золото, а из второй группы — цинк, кадмий и ртуть, отличающиеся от остальных элементов своих групп второй снаружи электронной оболочкой (по 18 электронов вместо 8 у остальных элементов). [c.215]
[c.215]
Во внешнем электронном уровне атомов этих элементов по. шесть электронов вследствие чего они имеют сильно выраженный неметаллический характер (кроме полония, химия которого мало изучена). Электроотрицательность их выше, чем у элементов подгруппы азота. В соединениях с водородом и металлами кислород, сера, селен и теллур проявляют нормальную валентность, равную двум окислительное число —2. [c.306]
В табл. 63 приведены электронные структуры атомов элементов главной подгруппы VI группы. У этих атомов на последнем электронном слое 6 электронов а на предпоследнем — у кислорода 2, у серы 8, у селена, теллура и полония — по 18 электронов. Максимальная валентность элементов главной подгруппы VI группы равна 6 (кроме кислорода, который всегда двухвалентен). В соединениях сера, селен, теллур и полоний могут быть двух-, четырех- и шестивалентными. [c.534]
Элементы главной подгруппы VI группы — кислород, сера, селен, теллур и полоний — называются халькогенами. Наружный энгагетический уровень имеет конфигурацию ns np. Кислород в соединениях может проявлять только степень окисления —2 (кроме OF2), а остальные элементы не только —2, но и +4 и +6. Это объясняется наличием вакантных -подуровней наружных уровней. [c.213]
Наружный энгагетический уровень имеет конфигурацию ns np. Кислород в соединениях может проявлять только степень окисления —2 (кроме OF2), а остальные элементы не только —2, но и +4 и +6. Это объясняется наличием вакантных -подуровней наружных уровней. [c.213]
Общие сведения. В главную подгруппу VI группы периодической системы входят элементы кислород, сера, селен, теллур и полоний. Первые четыре элемента, имеющие неметаллический характер, объединяются под названием халъкогенов, что значит образующие руды . Все элементы главной подгруппы VI группы могут давать соединения с водородом и в своих соединениях с сильно электроположительными элементами заряжены отрицательно. Сильнее всего неметаллический характер выражен у кислорода и серы. Селен и теллур занимают промежуточное положение между неметаллами и металлами. Так, в элементарном состоянии селен существует как в неметаллической, так д в металлической модификациях. Для элементарного теллура металлическая модификация является даже наиболее обычной. Но по своим химическим свойствам и эти два элемента стоят ближе к неметаллам. Их сходство с металлами в химическом отношении проявляется лишь в том, что селен и теллур могут образовывать соли с сильными кислотами, в которые они взводят в качестве электроположительной составной части. Особенно это относится к теллуру, хотя и его соли очень мало устойчивы. У последнего (наиболее тяжелого) элемента грзшпы, радиоактивного и сравнительно короткоживущего полония, металлический характер выражен более ярко. Он способен существовать в водном [c.735]
Но по своим химическим свойствам и эти два элемента стоят ближе к неметаллам. Их сходство с металлами в химическом отношении проявляется лишь в том, что селен и теллур могут образовывать соли с сильными кислотами, в которые они взводят в качестве электроположительной составной части. Особенно это относится к теллуру, хотя и его соли очень мало устойчивы. У последнего (наиболее тяжелого) элемента грзшпы, радиоактивного и сравнительно короткоживущего полония, металлический характер выражен более ярко. Он способен существовать в водном [c.735]
Кислород, сера, селен, теллур и полоний по одинаковому числу электронов в наружной электронной оболочке их атомов и по некоторым общим свойствам объединяются в одну нодгрзшпу периодической системы — подгруппу кислорода. [c.287]
Кислород, сера, селен, теллур и полоний составляют главную подгруппу шестой группы периодической системы. У атомов серы, селена и теллура валентные электроны находятся на уровнях, отвечающих главным квантовым числам соответственно 3, 4 и 5, для которых, кроме з- и р-ор-бит, возможны -орбиты. Но последние энергетически менее выгодны, вследствие чего все валентные электроны у атомов этих элементов в невозбужденных состояниях размещаются на з- и р-орбптах. Следовательно, атомы 5, 5е и Те в основном состоянии могут образовать только две [c.205]
Но последние энергетически менее выгодны, вследствие чего все валентные электроны у атомов этих элементов в невозбужденных состояниях размещаются на з- и р-орбптах. Следовательно, атомы 5, 5е и Те в основном состоянии могут образовать только две [c.205]
Сера принадлежит к группе кислорода, к которой относятся элементы, составляющие главную подгруппу шестой группы периодической системы кислород, сера, селен, теллур и полоний. Подобно галогенам, эти элементы образуют естественную группу сходных по свойствам элементов. Положение их в периодической системе свидетельствует о том, что они должны обладать хорошо выраженными свойствами металлоидов. Однако по сравнению с галогенами металлоидные свойства элементов этой группы выражены песколько слабее. Высшая положительная валентность у них равна шести, отрицательная валентность равна двум. С кислородом эти элементы образуют соединения более легко, чем галогены (у них на внешнем слое 6 электронов, а у галогенов 7), и сами окислы их более устойчивы, чем кислородные соеди-яения галогенов. Их водородные соединения, наоборот, образуются труднее и мопее устойчивы по сравнению с водородными соединениями галогенов. [c.151]
Их водородные соединения, наоборот, образуются труднее и мопее устойчивы по сравнению с водородными соединениями галогенов. [c.151]
Подгруппа VIA. При переходе по периоду к более высоким номерам групп вместе с электронными конфигурациями меняется и размер атомов и ионов. Несмотря на увеличение числа электронов, атомный и ионный радиусы уменьшаются. Радиусы атомов главной подгруппы меньше, чем подгруппы VA и растут от кислорода к полонию. Поэтому их восстановительные свойства ниже подгруппы азота и усиливаются к полонию. Устойчивость соединений максимального валентного состояния падает от серы к полонию, В подгруппе— селен, теллур, полоний — при движении сверху вниз свойства элементов и поведение веществ изменяются закономерно. Увеличивается размер атома, иона, уменьшаются энергия ионизации и электроотрицательность, т. е. усиливаются металлические призна- [c.348]
Урок-зачет по теме «Подгруппа серы»
Подгруппа серы
PPTX / 3.
 16 Мб
16 Мб/data/files/g1593526592.pptx (Подгруппа серы)
«СЕРА. Строение атома, аллотропия, свойства и применение серы»
Цели: Определить положение серы в периодической системе химических элементов Д.И. Менделеева, рассмотреть строение атома серы, физические и химические свойства, области применения серы.
Задачи урока:
Образовательные:
— Рассмотреть строение атома серы согласно его положение в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации серы.
— Изучить физические и химические свойства серы, нахождение в природе, его области применения.
— Продолжить формирование умения учащихся работать с периодической системой химических элементов Д. И. Менделеева.
И. Менделеева.
-Совершенствовать умения составлять уравнения химических реакций.
Развивающие:
— Развивать память и внимание учащихся.
— Формировать положительную мотивацию на изучение предмета химии.
-Учить применять имеющиеся знания в новой ситуации.
Воспитательные:
Показать значимость химических знаний для современного человека.
Оборудование: ПСХЭ, компьютер, мультимедийный проектор, учебное электронное издание – виртуальная лаборатория. Коллекция «Минералы», образец серы, вода, химический стакан, стеклянная палочка, спиртовка, пробиркодержатель, кристаллизатор. Географическая карта. Пластилин (шаростержневые молекулы)
Ход урока.
Организационный момент.
Учащиеся заранее распределяются по группам. Каждая группа получает задание самостоятельно подготовиться по каждому разделу(строение атомов, нахождение в природе, аллотропия, историческая справка, физические и химические свойства, области применения)
Каждая группа получает задание самостоятельно подготовиться по каждому разделу(строение атомов, нахождение в природе, аллотропия, историческая справка, физические и химические свойства, области применения)
II. Проверка изученного материала (экспресс-опрос)
Слайд 2 (Потом на экран все вопросы)
На прощлом уроке мы начали изучение VI группы главной подгруппы ПСХЭ(подгруппы кислорода).
При проверке домашнего задания у доски 3 человека от каждого варианта-задание 9-пластилин, задание 8- химические свойства, задание 1 строение атомов.
Какие элементы входят в состав VI-А подгруппы, особенности строения атомов? O, S, Se, Te, Po
8 O 1 s2 2 s2 2 p4
16 S ….. 3 s2 3 p4
34 Se ….4 s2 4 p4
52 Te …. 5 s2 5 p4
5 s2 5 p4
84 Po …..6 s2 6
| 1. |
Названия соединений серы
Сложность: лёгкое |
1 |
| 2. |
Физические свойства серы и соединений
Сложность: лёгкое |
2 |
3.
|
Свойства серной кислоты
Сложность: лёгкое |
1 |
| 4. |
Строение и физические свойства серы
Сложность: среднее |
1 |
5.
|
Оксиды серы
Сложность: среднее |
2 |
| 6. |
Различия разбавленной и концентрированной серной кислоты
Сложность: среднее |
2 |
7.
|
Определи степени окисления серы
Сложность: среднее |
2 |
| 8. |
Реакции серной кислоты
Сложность: сложное |
3 |
9.
|
Установи соответствие
Сложность: сложное |
4 |
VI группа главная подгруппа периодической таблицы Менделеева (кислород, сера)
К элементам главной подгруппы VI группы периодической таблицы Менделеева относятся:
- Кислород O
- Сера S
- Селен Se
- Теллур Te
- Полоний Po
Общая характеристика элементов 6 группы главной подгруппы
От O к Po (сверху вниз в периодической таблице)
Увеличивается
- атомного радиуса,
- металлических, основных, восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 6 электронов на внешнем слое ns2np4:
O – 2s2 2p4;
S – 3s23p4;
Se – 4s2 4p4;
Te – 5s2 5p4;
Po – 6s2 6p4
Электронное строение кислорода и серы
Нахождение в природе кислорода и серы
Кислород занимает первое место среди элементов по распространенности в земной коре. Содержится он главным образом в силикатах и составляет около 47 % массы твёрдой земной коры. В больших количествах связанного кислорода содержится в воде — 85,82 % по массе. Также кислород содержится более, чем в 1500 соединений земной коры. В атмосфере доля свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Сера встречается в виде самородной серы, сульфатов (CaSO4∙2H2O, CaSO4∙H2O, Na2SO4∙10H2O, MgSO4∙7H2O), сульфидов (FeS2, CuS, CuFeS2, PbS, ZnS, HgS) и в промышленных газах.
Самородная сера встречается в местах вулканической активности совместно с сернистыми фумаролами и сернистыми водами (с содержанием > 25 %).
Аллотропные модификации серы
Кислород
Способы получения кислорода
В природе
Кислород образуется в процессе фотосинтеза:
mCО2 + nH2O → mO2 + Сm(H2O)n
Промышленный способ
- Разделение жидкого воздуха на О2 и N2 (ректификация);
2H2O → 2Н2↑ + О2↑
Лабораторный способ
- термическое окислительно-восстановительное разложение солей:
2КСlO3 = 3О2↑ + 2KCI
2КМпO4 = О2↑ + МпО2 + К2МпО4↑
2KNO3 = О2↑ + 2KNО2
2Cu(NO3)O2 = О2↑ + 4NО2↑ + 2CuO
2AgNO3 = О2↑ + 2NО2↑ +2Ag
2H2O2 = 2H2O + O2 (kt — MnO2)
2HgO = 2Hg + O2
- Для автономного дыхания кислород получают в герметически замкнутых помещениях и в аппаратах при помощи реакции:
2Na2O2 + 2СO2 = О2↑ + 2Na2CO3
Физические свойства кислорода
При обычных условиях молекулярный кислород O2 – это малорастворимый в воде газ без цвета, запаха
и вкуса.
При сильном охлаждении под давлением переходит в бледно — голубую жидкость с Ткип = — 183°С. При Т = -219°С образует сине — голубые кристаллы.
Химические свойства кислорода
Кислород — сильный окислитель, уступающий по химической активности только фтору.
Вступает во взаимодействия со всеми элементами, кроме инертных газов (Не, Ne и Аг). Со многими простыми веществами реагирует непосредственно при обычных условиях или при нагревании или в присутствии катализаторов (кроме Au, Pt, Hal2, благородные газы).
Большинство реакций с участием О2 экзотермичны, часто часто сопровождаются горением, иногда — взрывом.
Взаимодействие с простыми веществами
С металлами
- Кислород взаимодействует с металлами, с образованием оксидов металлов:
Me + О2 = МеxOy оксиды
4Li + О2 = 2Li2O оксид лития
2Na + О2 = Na2О2 пероксид натрия
К + О2 = КО2 супероксид калия
- С железом образуется смесь оксидов:
3Fe + 2O2 = Fe3O4 (Fe2O3*FeO)
- С марганцем образуется диоксид марганца:
Mn + O2 = MnO2
С неметаллами
При взаимодействии с неметаллами (кроме фтора и инертных газов) образуются оксиды, со степенью окисления кислорода – 2:
Si + O2 = SiO2 (t=400-5000С)
С + О2(изб) = СО2; С + О2(нед) = СО
N2 +О2 = 2NO — Q
S + О2 = SО2;
4Р + 5О2 = 2Р2О5
Окисление сложных веществ
Горение сульфидов
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Горение водородных соединений
4HI + О2 = 2I2 + 2Н2O
2H2S + 3O2 = 2SO2 + 2H2O
CH4 + 2O2 = CO2 + 2H2O
Окисление оксидов
Кислород окисляет входящие в оксид элементы до более высокой степени окисления:
4FeO + О2 = 2Fe2О3
2SО2 + О2 = 2SО3
4NО2 + О2 + 2H2O = 4HNО3
Окисление гидроксидов и солей
Окисление гидроксидов и солей в водных растворах происходит, если исходное вещество неустойчиво на воздухе:
2HNO2 + O2 = 2HNO3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Окисление аммиака
В отсутствие катализатора при окислении аммиака кислородом образуется азот, а в присутствии катализатора — оксида азота(II):
4NH3 + 3О2 =2N2 + 6Н2O
4NH3 + 5О2 = 4NO + 6Н2O
Окисление фосфина
На воздухе самопроизвольно воспламеняется:
2PH3 + 4О2 = P2О5 + 3Н2O
Окисление силана
На воздухе он самовоспламеняется (часто со взрывом) с образованием SiO2 и H2O:
SiH4 + 2О2 = SiО2 + 2Н2O
Окисление органических веществ
CxHy + О2 = CО2 + Н2O
Продукты окисления различных элементов, входящих в молекулы органических соединений:
С → CO2
Н → Н2O
Hal → Hal2
N → N2
P → P2O5
S → SO2
Например:
2C2H5 + 4О2 = 4CО2 + 5Н2O
C2H5Сl + 3О2 = 2CО2 + 2Н2O + HCl
2C2H5NH2 + 8,5О2 = 4CО2 + 7Н2O + N2
Кроме горения возможны также реакции неполного окисления:
СН3-СН2-СН2-СН3 + 3O2 → 2СН3-СOOH + 2H2O
- каталитическое окисление алкенов, с образованием окиси этилена:
- окисление первичных спиртов до альдегидов, вторичных – до кетонов:
- окисление альдегидов до кислот:
Сера
Способы получения серы
Промышленный способ
- Извлечение самородной серы из ее месторождений или вулканов
- Получение серы из серной руды с помощью пароводяного,
фильтрационного, термического, центрифугального и экстракционного методов.

- Переработка природных газов, содержащих H2S и их окисление при недостатке О2.
Лабораторный способ
- Взаимодействие SО2 и H2S в водном растворе:
SО2 + 2H2S = 3S↓ + 2H2О
- Неполное окисление сероводорода:
2H2S + SO2 → 3S + 2H2O
Физические свойства серы
Сера — твердое хрупкое вещество желтого цвета. Не смачивается водой и практически нерастворимо в ней. Имеет несколько аллотропных модификаций. См. аллотропные модификации серы.
Химические свойства серы
При обычных температуре и давлении химическая активность серы небольшая. При нагревании сера довольно активна, и проявляет свойства как окислителя, так и восстановителя.
Свойства окислителя сера проявляет при взаимодействии с элементами, расположенными ниже и левее в Периодической системе, а свойства восстановителя — с элементами, расположенными выше и правее в Периодической системе.
Непосредственно сера не взаимодействует с азотом и йодом.
Взаимодействие с простыми веществами
С кислородом
Горение серы на воздухе с образованием оксида серы (IV):
S + O2 → SO2
В присутствии катализаторов:
2S + 3O2 = 2SO3
С водородом
С водородом сера вступает в реакцию при нагревании, образуя сероводород:
S + H2 → H2S
С галогенами
При взаимодействии со всеми галогенами, кроме йода образуются галогениды:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
С фосфором
Взаимодействие серы с фосфором приводит к образованию сульфидов фосфора
2P + 3S → P2S3
2P + 5S → P2S5
С углеродом
В реакции серы с углеродом образуется сероуглерод:
2S + C → CS2
С металлами
При
взаимодействии с металлами сера выступает
в качестве окислителя, образуя сульфиды.
Щелочные металлы реагируют с серой без нагревания, остальные металлы (кроме золота Au и платины Pt) –при нагревании:
S + Fe → FeS
S + Hg → HgS
3S + 2Al → Al2S3
S + Сu = CuS
S + 2Ag = Ag2S
Взаимодействие со сложными веществами
С водой
Сера вступает в реакцию диспропорционирования с перегретым паром:
S + H2O (пар) → 2H2S + SO2
С окислителями
В реакциях с окислителями сера окисляется до оксида серы (IV) SO2 или до серной кислоты H2SO4 при протекании реакции в растворе:
S + 2HNO3(разб.) = H2SO4 + 2NO↑
S + 6HNO3(конц.) → H2SO4 + 6NO2↑ + 2H2O
S + 2H2SO4(конц. )→ 3SO2↑ + 2H2O
)→ 3SO2↑ + 2H2O
S + 2KClO3 → 3SO2↑ + 2KCl
S + К2Сr2O7 = Сr2O3 + K2SO4
S + Na2SO3 → Na2S2O3
С щелочами
При взаимодействии с щелочами сера диспропорционирует до сульфита и сульфида:
S + NaOH → Na2SO3 + Na2S + H2O
Подгруппа кислорода в химии — формулы и определения с примерами
Содержание:
Характеристика элементов подгруппы кислорода:
В основной подгруппе шестой группы периодической таблицы (подгруппе кислорода) расположены кислород, сера, селен, теллур и полоний (ввиду того, что полоний — радиоактивный элемент, его свойства подробно изучаются в радиохимии).
Строение атомов элементов подгруппы кислорода
На внешнем энергетическом уровне атомов этих элементов имеется шесть электронов:
Поэтому эти элементы для завершения внешнего энергетического уровня, то есть пополнения восемью электронами, присоединяют два электрона и проявляют в соединениях степень окисления —2. В соединении с фтором кислород проявляет степень окисления +2, в соединении с водородом —1. Во всех других соединениях степень окисления кислорода равна —2.
В соединении с фтором кислород проявляет степень окисления +2, в соединении с водородом —1. Во всех других соединениях степень окисления кислорода равна —2.
На внешнем энергетическом уровне атомов серы, селена и теллура имеются свободные d-орбитали, на которые могут переходить спаренные р- и s-электроны внешнего уровня.
Присоединяя электроны, S, Se и Те проявляют степени окисления —2, отдавая электроны, проявляют степени окисления +4, +6:
Кислород — элемент второго периода, на внешнем энергетическом уровне его атома нет d-орбиталей, поэтому он не может проявлять степени окисления +4, +6.
Сера
Распространение в природе: Сера широко распространена в природе как в свободном состоянии, так и в соединениях
.
( ГЛАВА VII ) подгруппа кислорода
На территории Узбекистана имеются природные залежи серы.
В настоящее время на действующих в нашей стране предприятиях по переработке газа и газового конденсата налажено получение серы и ее соединений. В частности, в медных рудах, добываемых в Узбекистане, присутствуют сера, селен и теллур.
В частности, в медных рудах, добываемых в Узбекистане, присутствуют сера, селен и теллур.
Селен и теллур используются в качестве сырья при производстве полупроводников, солнечных батарей, терморегуляторов, при создании особых сортов стали и стекла.
Физические свойства: Сера имеет три аллотропические модификации: ромбическая сера ; моноклиническая сера ; пластическая сера .
В природе встречается ромбическая сера, она представляет собой твердое кристаллическое вещество желтого цвета, не растворимое в воде. Несмотря на то, что плотность серы равна 2 г/см3, серный порошок всплывает на поверхность воды, так как частицы серы не смачиваются водой.
Всплывание твердых веществ на поверхность воды называется флотацией. Метод флотации широко используется при очистке серных руд от «инородных» тел.
Сера растворяется в сульфиде углерода (IV) и органических растворителях. Она плохо проводит электрический ток и тепло. Сера плавится при температуре 112,8°С, кипит при 444,5 °С. При резком охлаждении расплавленной серы в холодной воде она превращается в пластическую серу, которая представляет собой тягучее вещество.
При резком охлаждении расплавленной серы в холодной воде она превращается в пластическую серу, которая представляет собой тягучее вещество.
Химические свойства: В химических реакциях сера участвует как окислитель, а при взаимодействии с кислородом — как восстановитель.
Сера окислитель:
1. Вступая в реакцию с водородом, сера образует сульфид водорода:
2. Взаимодействуя с металлами, сера образует сульфиды:
Сера восстановитель: Вступая в реакцию с кислородом, хлором и фтором, сера отдает электрон:
Применение: Сера используется в народном хозяйстве в различных целях.
Водородные соединения серы
Почему водный раствор сульфида водорода проявляет кислотное свойство?
Молекулярная формула сульфида водорода (сероводорода) ; структурная формула H-S-H;
электронная формула:
Получение: Сульфид водорода получают действием соляной кислоты на соли сероводородной кислоты, то есть сульфиды:
Сульфид водорода получают также воздействием водорода на расплавленную (при 200—350°С) серу:
Физические свойства: Сульфид водорода — газ с острым запахом (запах протухшего яйца), ядовит. Плавится при температуре —60°С, кипит при —61,8°С . В 1 л воды растворяется 3,85 г сульфида водорода (в одном объеме воды 2,5 объема ).
Плавится при температуре —60°С, кипит при —61,8°С . В 1 л воды растворяется 3,85 г сульфида водорода (в одном объеме воды 2,5 объема ).
Водный раствор сульфида водорода называется сероводородной кислотой.
Химические свойства: Сульфид водорода — горючий газ, он горит в присутствии кислорода.
Если кислорода достаточно, то получаются сернистый газ и вода:
Если кислорода недостаточно, то образуются сера и вода:
Сульфид водорода и сероводородная кислота — сильные восстановители:
Как и другие кислоты, сероводородная кислота вступает в химические реакции, общие для всех кислот:
Для сульфида водорода, сероводородной кислоты и водорастворимых сульфидов реактивом является :
Кислородные соединения серы
Оксиды серы: Сера образует два оксида, имеющих практическое значение: оксид серы (IV)- (сернистый ангидрид) и оксид серы (VI)-(серный ангидрид).
Оксид серы(1V) в природе встречается в составе вулканических газов и газов, образованных в результате горения природного угля. — газ с полярной ковалентной связью. В лабораторных условиях получают путем воздействия на соли сернистой кислоты соляной и серной кислотами:
— газ с полярной ковалентной связью. В лабораторных условиях получают путем воздействия на соли сернистой кислоты соляной и серной кислотами:
Оксид серы (IV) получают также путем воздействия на медную стружку концентрированной серной кислотой:
В промышленности оксид серы (IV) получают путем обжига на воздухе сульфидов металлов:
Оксид серы (IV) — бесцветный газ с резким удушливым запахом, который при — 10°С переходит в жидкое, а при —73°С — в твердое состояние. Будучи кислотным оксидом, растворяясь в воде, образует сернистую кислоту:
Взаимодействуя с основными оксидами и щелочами, оксид серы (IV) образует сульфиты:
Оксид серы (IV) окисляется в присутствии катализатора и образует оксид серы (VI):
Оксид серы (IV) окисляет сульфид водорода, в результате сам восстанавливается до серы:
обесцвечивает органические красители, убивает микроорганизмы, используется при изготовлении сухофруктов (кураги), выращивании ягод.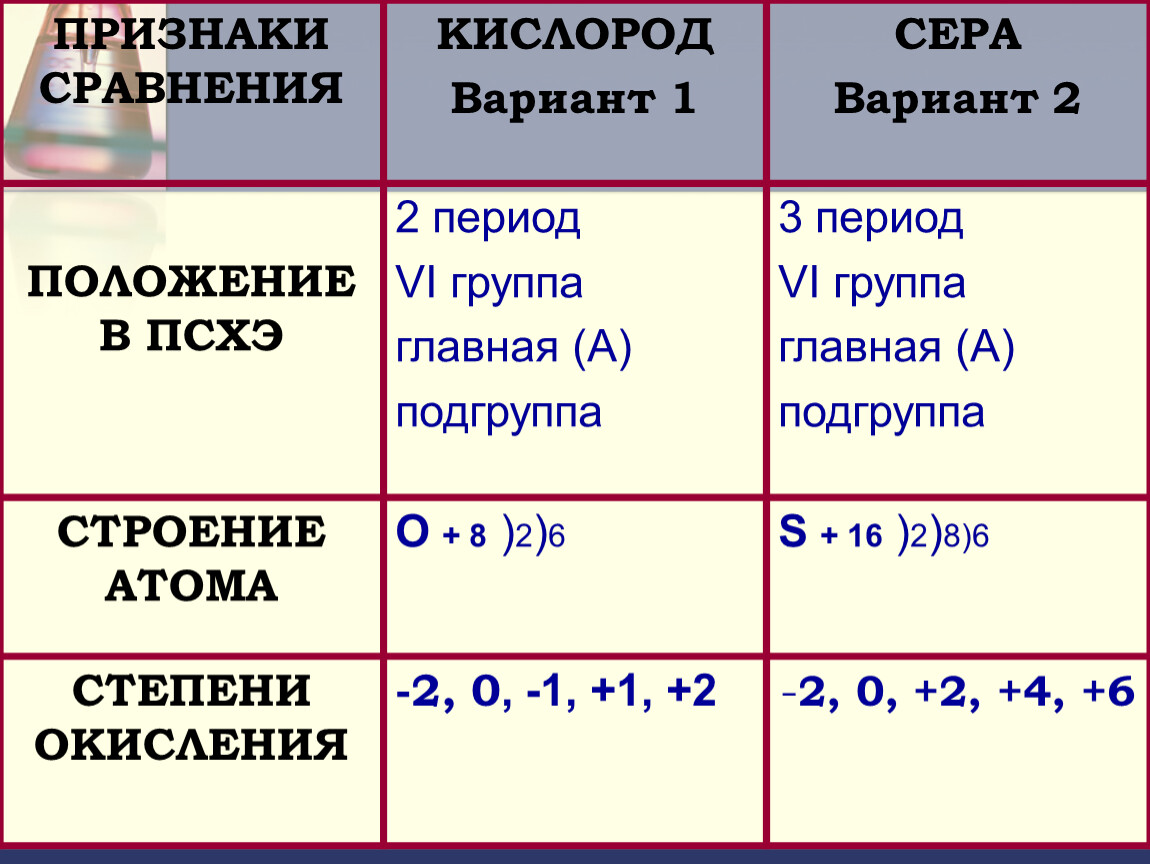 Жидкий используется при очистке нефти.
Жидкий используется при очистке нефти.
Оксид серы (VI) — высший оксид серы, бесцветная жидкость, кипящая при 45°С, а при 17°С превращающаяся в белую кристаллическую массу. Оксид серы (VI) проявляет свойства, присущие кислотным оксидам. Легко вступает в реакцию с водой и образует серную кислоту:
Сам оксид серы (VI) также хорошо растворяется в концентрированной серной кислоте, при этом образуется олеум:
В промышленности оксид серы (VI) получают путем окисления оксида серы (IV) в присутствии катализатора. Оксид серы (VI) применяется в основном в производстве серной кислоты.
Серная кислота
На какие металлы не воздействует концентрированная серная кислота?
Молекулярная формула серной кислоты Электронная и структурная формулы:
Получение серной кислоты осуществляется с помощью химических реакций, протекающих по следующей схеме:
Физические свойства: Серная кислота — тяжелая бесцветная маслянистая жидкость без запаха. Плотность 96% -ной концентрированной кислоты равна 1,84 г/см3. При растворении в воде она выделяет большое количество теплоты, поэтому при ее разбавлении следует соблюдать осторожность, приливая серную кислоту к воде небольшими частями. Ни в коем случае нельзя воду приливать к кислоте! Химические свойства. Концентрированная и разбавленная серные кислоты отличаются друг от друга по химическим свойствам. Разбавленная серная кислота проявляет все свойства, присущие кислотам.
Плотность 96% -ной концентрированной кислоты равна 1,84 г/см3. При растворении в воде она выделяет большое количество теплоты, поэтому при ее разбавлении следует соблюдать осторожность, приливая серную кислоту к воде небольшими частями. Ни в коем случае нельзя воду приливать к кислоте! Химические свойства. Концентрированная и разбавленная серные кислоты отличаются друг от друга по химическим свойствам. Разбавленная серная кислота проявляет все свойства, присущие кислотам.
1. Взаимодействует со всеми металлами, стоящими в ряду активности перед водородом, при этом образуются соли и вытесняется водород:
2. Взаимодействует с основными и амфотерными оксидами и образует соли и воду:
3. Взаимодействует с основаниями и образует соли и воду:
4. Взаимодействует с солями слабых и летучих кислот и образует новые соли и новые кислоты:
Концентрированная серная кислота является очень сильным окислителем, поэтому она реагирует почти со всеми металлами, кроме серебра Ag, золота Аu и платины Pt, а также железа Fe при 100% -ной концентрации.
При этом в зависимости от активности металлов, концентрации серной кислоты и условий реакции выделяются газы
При кипячении концентрированная серная кислота взаимодействует также с неметаллами:
Концентрированная серная кислота обугливает такие вещества, как сахар, бумага, дерево и ткани, вытягивая воду из содержащейся в них целлюлозы:
Для определения серной кислоты и сульфатов на них воздействуют растворимой солью бария (хлорид бария). В результате реакции выпадает осадок белого цвета, не растворимый ни в воде, ни в азотной кислоте:
Сульфаты. Сульфат натрия . Безводный сульфат натрия используется при производстве стекла и соды, при изготовлении различных лекарств в медицине. Соединение называется глауберовой солью
Сульфат кальция . в природе встречается в виде гипса При нагревании природного гипса при 150— 170°С он теряет 3/4 воды и превращается в алебастр
Алебастр — важный строительный материал, часто используемый при строительстве объектов. В медицине гипс используется для наложения всевозможных гипсовых повязок.
В медицине гипс используется для наложения всевозможных гипсовых повязок.
Сульфат меди(Н) . В соединении с водой сульфат меди (II) образует медный купорос — кристаллогидрат Медный купорос используется для облицовки поверхности металлов медным покрытием, а также для борьбы с вредителями сельскохозяйственных растений.
Железный купорос Кристалл темно-зеленого цвета, используется для борьбы с вредителями сельскохозяйственных растений, а также для изготовления различных красок.
Скорость химических реакций
Можно ли ускорить протекание химических реакций?
Химические реакции протекают с различной скоростью. Некоторые реакции протекают за доли секунды, а другие могут длиться в течение нескольких дней, то есть идут очень медленно. Есть и такие реакции, для завершения которых требуются даже годы.
Если в химическом производстве некоторые реакции требуют ускорения, то некоторые необходимо замедлить. Например, процесс ржавления железных изделий требует замедления.
— Изменение концентраций веществ, участвующих в химической реакции, за единицу времени называется скоростью химической реакции.
Например, начальная концентрация вещества, вступающего в реакцию, равна 1 моль/л. Через 10 с, в течение которых продолжалась реакция, концентрация этого вещества составила 0,4 моль/л. Скорость совершившейся реакции определяется путем выполнения следующих действий.
Скорость химической реакции — v. В течение реакции концентрация вещества уменьшилась на 0,6 моль/л: (1 моль/л — 0,4 моль/л = 0,6 моль/л). Продолжительность реакции — 10 секунд.
‘
Следовательно, скорость этой реакции равна 0,06 моль/л с.
1. Влияние концентрации реагирующих веществ на скорость химических реакций.
При изучении химических свойств кислорода в курсе химии 7 класса вы узнали, что на воздухе сера горит очень медленно, а в присутствии чистого кислорода быстро сгорает ярким пламенем.
При горении серы в присутствии чистого кислорода количество молекул кислорода, ударяющихся о поверхность серы, намного больше, чем в воздухе. Это связано с тем, что кислород занимает 21% объема воздуха.
Скорость химических реакций равна произведению концентраций веществ, участвующих в реакции. Например, для реакции А+В=С v = к [А] • [В], где [А] и [В] — молярные концентрации веществ А и В, к — коэффициент пропорциональности.
2. Влияние температуры на скорость химических реакций.
При повышении температуры скорость реакции увеличивается в 2—4 раза:
где — скорость реакции при температуре — скорость реакции при температуре — температурный коэффициент скорости химической реакции.
Например, при температурном коэффициенте скорости реакции = 2 и повышении температуры среды до 40°С скорость данной реакции увеличивается в 16 раз; до 50°С — в 32 раза, до 70°С — в 128 раз. Такое резкое увеличение скорости реакции можно объяснить ускорением движения молекул и увеличением частоты их столкновений, а также возрастанием количества активных молекул. Скорость химических реакций зависит также от природы реагирующих веществ, поверхности твердых веществ и катализатора (вспомните понятие о катализаторах из курса химии 7 класса).
Скорость химических реакций зависит также от природы реагирующих веществ, поверхности твердых веществ и катализатора (вспомните понятие о катализаторах из курса химии 7 класса).
3. Влияние природы веществ на скорость химической реакции.
- а) реакция протекает настолько быстро, что выделяющийся водород сгорает. Реакция сопровождается горением;
- б) реакция протекает быстро, но медленнее, чем реакция воды с калием;
- в) взаимодействие железа с водой происходит при участии атмосферного кислорода в течение длительного времени;
- г) медь не взаимодействует с водой.
4. Для твердых веществ скорость реакции прямо пропорциональна поверхности веществ, вступающих в реакцию.
Рассмотрим эту зависимость на примере реакции соединения железа с серой.
Реакция Fe + S = FeS протекает быстрее до строго определенной степени измельчения частиц железа. При увеличении степени измельчения частиц до порошкообразного состояния скорость реакции ослабевает, так как происходит спекание, которое снижает взаимное столкновение молекул.
5. Влияние катализатора на скорость химической реакции.
Реакция расщепления пероксида водорода ускоряется в присутствии
МпОг Процесс получения оксида серы (VI) ускоряется в присутствии катализатора оксида ванадия (V).
— Вещества, которые ускоряют химические реакции, но сами остаются без изменений, называются катализаторами.
Ингибиторы — это вещества, которые снижают возможность веществ вступать в химическую реакцию.
Элементы знаний, умений и навыков: скорость химической реакции, концентрация, температура, температурный коэффициент скорости, столкновение молекул, катализатор, ингибитор.
Химическое равновесие
Почему реакция расщепления известняка считается необратимой?
Химические реакции подразделяются на обратимые и необратимые. Необратимые реакции протекают только в сторону образования продуктов реакции. Например,
В обратимых же реакциях химический процесс протекает в противоположные стороны.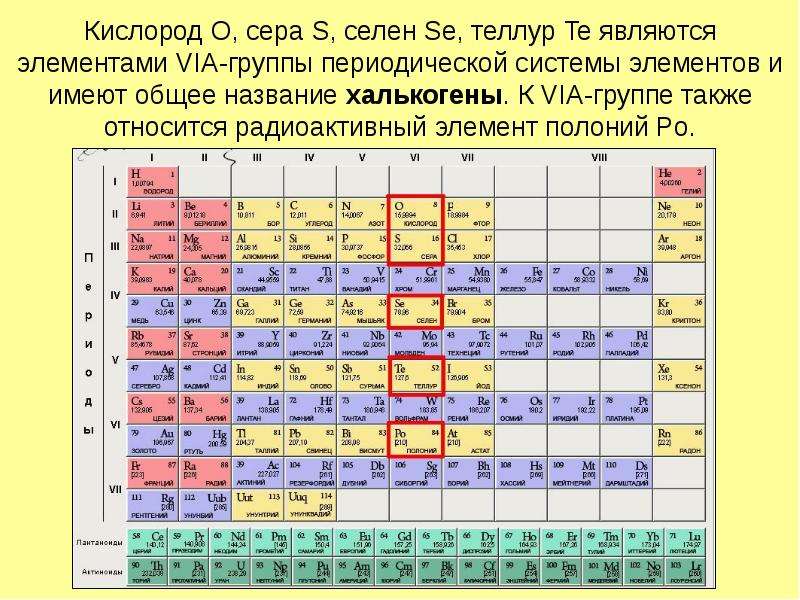 То есть сначала образуются продукты реакции, которые одновременно могут превращаться в исходные вещества. Например, оксид серы (IV), взаимодействуя с водой, образует сернистую кислоту:
То есть сначала образуются продукты реакции, которые одновременно могут превращаться в исходные вещества. Например, оксид серы (IV), взаимодействуя с водой, образует сернистую кислоту:
С увеличением количества сернистой кислоты в растворе начинает протекать обратная реакция:
- — Реакции, протекающие при одних и тех же условиях в противоположные стороны, называются обратимыми:
- — Реакция, идущая с образованием новых продуктов, т.е. слева направо, называется прямой, а идущая с образованием исходных продуктов, то есть справа налево, — обратной реакцией.
В обратимых химических реакциях по мере расходования исходных веществ их концентрации в растворе уменьшаются. В результате снижается скорость прямой реакции. И наоборот, за счет увеличения концентрации продуктов, образующихся в течение реакции, увеличивается скорость обратной реакции. Иначе говоря, сколько молекул продукта реакции будет образовываться за единицу времени, столько молекул будет расщепляться.
- — Состояние, когда скорость прямой реакции сравняется со скоростью обратной реакции, называется химическим равновесием. Скорость прямой реакции выражается буквой — , скорость обратной реакции буквой —
Химическое равновесие может быть нарушено при изменении давления, температуры и концентрации веществ. Катализатор не только не сдвигает химическое равновесие, а наоборот, способствует его быстрейшему установлению. Повышение температуры ускоряет реакции, протекающие с поглощением тепла.
Реакция окисления оксида серы (IV) является обратимой экзотермической реакцией:
Повышение температуры этой реакции ускоряет обратную реакцию, а понижение температуры ускоряет прямую реакцию.
Увеличение давления сдвигает химическое равновесие в сторону реакции, приводящей к уменьшению объема продукта:
Из расчетов, выполненных на основе уравнения реакции, видно, что в прямой реакции происходит уменьшение объема. Значит, увеличение давления ускоряет прямую реакцию.
Увеличение концентрации одного из веществ в реакции, находящейся в состоянии химического равновесия, приводит к сдвигу химического равновесия в сторону расходования этого вещества. Например, в реакционной среде находящейся в состоянии химического равновесия, с увеличением концентрации С02 химическое равновесие сдвигается в сторону прямой реакции, а при повышении концентрации — в сторону обратной реакции.
Элементы знаний, умений и навыков: обратимая реакция, прямая реакция, обратная реакция, химическое равновесие, сдвиг равновесия, факторы, обусловливающие сдвиг равновесия.
Промышленное производство серной кислоты
Какие катализаторы используются при производстве серной кислоты?
Серная кислота — одно из важнейших неорганических соединений в химической промышленности. Сырьем для промышленного производства серной кислоты служат: чистая сера S, железный колчедан (пирит) , сульфиды цветных металлов CuS, ZnS, PbS, сульфид водорода .
Процессы промышленного производства серной кислоты, начиная с подготовки сырья и кончая получением готового продукта, подразделяются на несколько этапов.
1. Получение оксида серы (IV). 2. Очистка оксида серы (IV). 3. Окисление оксида серы (IV) и получение оксида серы (VI).
1. Получение оксида серы (IV).
Для получения оксида серы (IV) из имеющегося сырья необходимо осуществить следующие химические реакции:
В промышленности для производства используется пирит. Для обеспечения высокой продуктивности реакции обжига (окисления) пирита необходимо:
1) реакции обжига проводить при участии чистого кислорода вместо воздуха. Это позволяет увеличить концентрацию одного из реагирующих веществ — кислорода, а следовательно, и скорость реакции;
2) измельчать частицы пирита, при этом увеличивается поверхность столкновения частиц пирита с кислородом, в результате чего реакция ускоряется. Однако чрезмерное измельчение пирита замедляет реакцию, так как пирит спекается и кислород не может проникнуть в уплотненные слои. Но использование чрезмерно измельченного пирита по принципу противотока также дает хорошие результаты. Пирит засыпается в печь для обжига колчедана (окисление ,) сверху в виде порошка, а воздух подается снизу. Смесь мелких частиц пирита и воздуха называется кипящим слоем. В таких условиях пирит окисляется за очень короткий срок.
Пирит засыпается в печь для обжига колчедана (окисление ,) сверху в виде порошка, а воздух подается снизу. Смесь мелких частиц пирита и воздуха называется кипящим слоем. В таких условиях пирит окисляется за очень короткий срок.
2. Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)— Оксид серы (IV) содержит в своем составе различные примеси и пыль, которые снижают каталитические свойства катализатора. Поэтому сначала подвергается очистке, затем подается в контактный аппарат. Очистка осуществляется путем пропускания через такие аппараты, как циклон или электрофильтр, затем оксид серы (IV) поступает в сушильную башню для осушки. Для осушки используется концентрированная серная кислота.
3. Окисление оксида серы (IV) и получение оксида серы (VI).
Для получения оксида серы (VI) из оксида серы (IV) последний окисляется в присутствии катализатора:
Реакция является экзотермической, и при 400°С выход оксида серы (VI) составляет 99,2%. С повышением температуры выход продукта уменьшается, например, при 600°С он составляет лишь 73%.
С повышением температуры выход продукта уменьшается, например, при 600°С он составляет лишь 73%.
Теплота, выделяющаяся в ходе реакции, расходуется на нагревание в теплообменнике.
Для выбора оптимальных условий окисления оксида серы (IV) необходимо подобрать факторы, позволяющие сдвинуть равновесие обратимой реакции вправо.
1. Температура. Для увеличения выхода оксида серы (VI) температуру реакции следует постепенно понижать с 600°С до 400—450°С .
2. Катализатор. Катализатором могут служить оксиды железа, платины и ванадия. К катализаторам предъявляются следующие требования: а) низкая цена; б) устойчивость к каталитическим донорам; в) долговечность. В настоящее время в качестве катализатора используется оксид ванадия (V).
3. Оксид серы (IV), поступающий в контактный аппарат, должен быть осушен от водяных паров и очищен от различных твердых частиц и пыли, повреждающих катализатор. Оксид серы (IV), осушенный от водяного пара и очищенный от пыли и различных примесей, в смеси с воздухом поступает в теплообменник, где он нагревается до определенной температуры, а оттуда в контактный аппарат, где он окисляется до .
Образовавшийся в контактном аппарате и охлажденный в теплообменнике оксид серы (VI) подается в поглотительную башню.
Гидратация оксида серы (VI), то есть получение серной кислоты.
В поглотительной башне из оксида серы (VI) получается серная кислота, для чего вступает во взаимодействие с водой. В результате этого взаимодействия серная кислота образуется в виде мельчайших капель, которые затуманивают поглотительную башню. Этот сернокислотный туман трудно конденсируется, поэтому в поглотительной башне поглощается с помощью серной кислоты 98 %-ной концентрации. Вода, содержащаяся в концентрированной , гидратирует :
Затем обезвоженная поглощает и образует соединение, называемое олеумом:
Процесс промышленного производства серной кислоты является непрерывным (рис. 25).
Элементы знаний, умений и навыков: сырье, обжиг пирита, кипящий слой, контактный аппарат, теплообменник, олеум.
Пример:
Во сколько раз увеличится скорость реакции, если коэффициент скорости равен 3, а температура повышена с 50°С до 70°С? При первоначальной температуре (50°С) реакция завершается за 2 мин 15 с, за какое время она завершится при 70°С?
Решение:
1) увеличение скорости реакции (при переходе от 50°С к 70°С) найдем согласно правилу Вант-Гоффа:
Скорость химической реакции увеличится в 9 раз;
2) при начальной температуре то есть при 50°С реакция завершается за 2 мин 15 с (135 секунд), при температуре — за время, большее в 9 раз.
Ответ. 15 с.
Самостоятельная работа по теме «Подгруппа кислорода». 9-й класс
Самостоятельная работа по теме «Подгруппа кислорода» ВАРИАНТ 11. В VIА группу не входит элемент:
а) О
б) S
в) Se
г) Cr
2. Число электронных слоёв и число валентных электронов в атоме серы соответственно равны:
а) 4 и 6
б) 3 и 6
в) 2 и 6
г) 4 и 5
3. Сера проявляет степень окисления +6 в соединении:
а) SО2
б) H2SO3
в) SО3
г) H22S
4. С сероводородом взаимодействуют все вещества, указанные в ряду:
а) Н2О, Cu, Cu(OH)2
б) CО2, HCl, KOH
в) SО3, S, Zn(OH)2
г) О2, CuCl2, NaOH
5. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
а) магний;
б) медь;
в) цинк;
г) железо.
6. C образованием газа идёт реакция, схема которой
а) Li2SO4 + Ba(OH)2 →
б) H2SO4 + Ca(OH)2 →
в) K2SO3 + H2SO4 →
г) H2S + NaOH→
7. «Вещество обугливает органические вещества, отнимая от них воду. Попадание его на кожу приводит к тяжелым ожогам» – данное высказывание относится к:
а) сернистой кислоте;
б) серной кислоте;
в) сероводороду;
г) к сернистому газу.
8. Коэффициент перед формулой окислителя в уравнении реакции между концентрированной серной кислотой и медью равен:
а) 1
б) 2
в) 3
г) 4
9. Осуществите превращения: H2S → SО2 → Na2SO3 → Na2SO4
К 3 уравнению составьте сокращённое ионно-молекулярное уравнение.
Самостоятельная работа по теме «Подгруппа кислорода» ВАРИАНТ 21. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно:
У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно:
а) 4 и + 16;
б) 6 и + 32;
в) 6 и + 16;
г) 4 и + 32.
2. Сколько электронов недостает атому селена для завершения своего внешнего энергетического уровня?
а) 2;
б) 6;
в) 8;
г) 4.
3. Сера проявляет степень окисления +4 в соединении:
а) H2S;
б) K2SO4;
в) Na2SO3;
г) SO3.
4. С оксидом серы (VI) взаимодействуют все вещества, указанные в ряду:
а) Н2О, О2, NaCl
б) CaО, NaCl, Cu(OH)2
в) CО2, K2О, Ca(OH)2
г) H2О, BaO, NaOH
5. B разбавленной серной кислоте растворяется:
а) Cu;
б) Zn;
в) Ag;
г) Au.
6. C образованием осадка идёт реакция, схема которой
а) Na2SO4 + KCl →
б) H2SO4 + BaCl2 →
в) CuCl2 + H2SO4 →
г) CuSO4 + HCl →
7. «Это вещество не растворимо в воде, но хорошо растворяется во многих органических
растворителях» – данное высказывание относится к:
«Это вещество не растворимо в воде, но хорошо растворяется во многих органических
растворителях» – данное высказывание относится к:
а) сернистой кислоте;
б) серной кислоте;
в) сероводороду;
г) сере.
8. Коэффициент перед формулой восстановителя в уравнении реакции между сероводородом и кислородом равен:
а) 4
б) 3
в) 2
г) 1
9. Осуществите превращения: S → H2S → SО2 → Na2SO3
К 3 уравнению составьте сокращённое ионно-молекулярное уравнение.
Самостоятельная работа по теме «Подгруппа кислорода» ВАРИАНТ 31. В атомах элементов VIА группы одинаковое число:
а) электронных энергетических уровней;
б) электронов;
в) электронов на внешнем энергетическом уровне;
г) протонов и нейтронов.
2. Число электронных слоёв и число валентных электронов в атоме селена соответственно равны:
а) 4 и 6
б) 3 и 6
в) 2 и 6
г) 4 и 5
3. Минимальную степень окисления сера проявляет в соединении:
Минимальную степень окисления сера проявляет в соединении:
а) S;
б) Na2SO4;
в) SO2;
г) Н2S.
4. В сокращенном ионном уравнении реакции серной кислоты с гидроксидом натрия сумма коэффициентов равна:
а) 6;
б) 5;
в) 3;
г) 4.
5. При действии разбавленной серной кислоты на серебро:
а) образуются сульфат серебра(I) и водород;
б) образуются сульфат серебра(I) и вода;
в) образуются сульфид серебра(I) и вода;
г) реакция не идет.
6. С оксидом серы (IV) взаимодействуют все вещества, указанные в ряду:
а) Н2О, О2, Ca(OH)2
б) KОH, Na2O, Ba(NO3)2
в) CО2, CaО, CaCO3
г) H2S, FeCl3, Cu(OH)2
7. «Желтое кристаллическое вещество, которое используют при производстве спичек» – данное высказывание относится к:
а) сульфату бария;
б) сульфиду свинца;
в) сероводороду;
г) сере.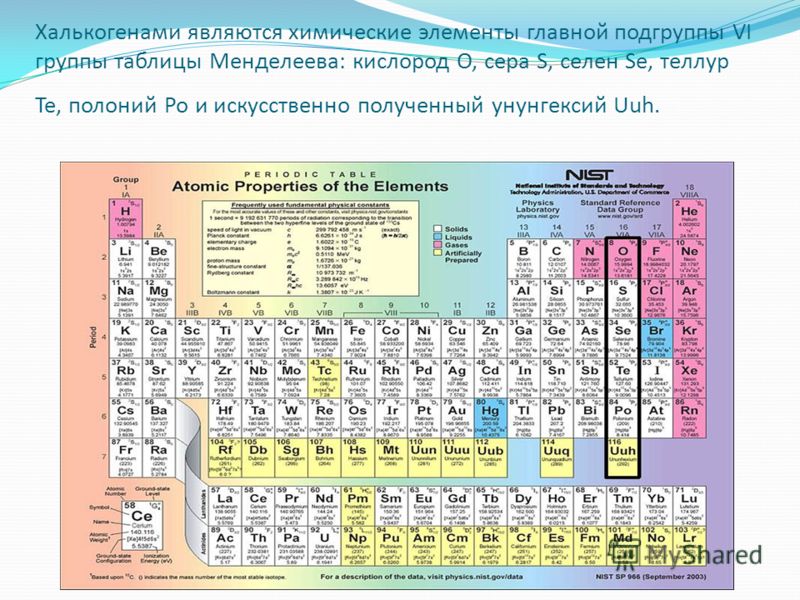
8. Коэффициент перед формулой восстановителя в уравнении реакции между оксидом серы (IV) и кислородом равен:
а) 4
б) 3
в) 2
г) 1
9. Осуществите превращения: H2S← СuS → SО2 → SО3
К 3 уравнению составьте электронный баланс, назовите окислитель и восстановитель.
Самостоятельная работа по теме «Подгруппа кислорода» ВАРИАНТ 41. В атомах элементов подгруппы кислорода одинаковое число:
а) электронных энергетических уровней;
б) электронов на втором энергетическом уровне;
в) валентных электронов;
г) протонов и нейтронов.
2. Самой большой электроотрицательностью обладает:
а) O;
б) S;
в) Se;
г) Te.
3. Окислительные свойства оксид серы(IV) проявляет в реакции:
а) SO2 + NaOH = NaHSO3;
б) SO2 + Br2 + 2H2O = H2SO4 + 2HBr;
в) SO2 + 2H2S = 3S + 2H2O;
г) 2SO2 + O2 = 2SO3.
4. В сокращенном ионном уравнении реакции сульфата натрия с нитратом бария сумма коэффициентов равна:
а) 6;
б) 5;
в) 3;
г) 4.
5. При нагревании медь реагирует c:
а) соляной кислотой;
б) сероводородной кислотой;
в) концентрированной серной кислотой;
г) разбавленной серной кислотой.
6. Коэффициент перед формулой восстановителя в уравнении реакции между цинком и раствором сульфата меди (II) равен:
а) 4
б) 3
в) 2
г) 1
7. «Нелетучее, крайне гигроскопичное вещество, при растворении которого в воде выделяется большое количество теплоты» – данное высказывание относится к:
а) сернистой кислоте;
б) серной кислоте;
в) олеуму;
г) к сероводородной кислоте.
8. Укажите схему возможной реакции:
а) Na2SO4 + KCl →
б) H2SO4 + Li2SO4 →
в) H2SO4(разб. ) + Hg →
) + Hg →
г) CuSO4 + NaOH →
9. Осуществите превращения: S → ZnS→ H2S →SО2
К 3 уравнению составьте электронный баланс, назовите окислитель и восстановитель.
Самостоятельная работа по теме «Подгруппа кислорода» ВАРИАНТ 51. Число энергетических уровней и число валентных электронов в атоме серы равны соответственно
а) 6 и 4;
б) 4 и 6;
в) 3 и 2;
г) 5 и 6.
2. Сера проявляет степень окисления -2 в соединении:
а) H2S;
б) K2SO4;
в) Na2SO3;
г) SO3.
3. Реакции полного сгорания сероводорода соответствует схема превращения:
4. В сокращенном ионном уравнении реакции серной кислоты с карбонатом калия сумма коэффициентов равна:
а) 6;
б) 5;
в) 3;
г) 4.
5. При взаимодействии оксида серы (IV) с раствором гидроксида калия могут образоваться соли:
а) K2SO4 и KНSO4;
б) K2SO3 и K2SO4;
в) K2SO3 и KНSO3;
г) KНSO3 и KНSO44.
6. Оксид серы(IV) является:
а) основным
б) кислотным
в) амфотерным
г) несолеобразующим
7. «Легкоплавкое вещество, которое очищают от примесей путем плавления» – данное высказывание относится к:
а) сульфиду магния;
б) сульфату бария;
в) сероводороду;
г) сере.
8. Укажите схему возможной реакции:
а) Cu + FeSO4 →
б) H2SO4(разб.) + Fe(OH)2 →
в) H2SO4(разб.) + Cu →
г) K2SO4 + NaOH →
9. Осуществите превращения:
К реакции ионного обмена составьте сокращённое ионно-молекулярное уравнение.
Самостоятельная работа по теме «Подгруппа кислорода»ВАРИАНТ 61. Группу элементов – кислород, сера, селен, теллур и полоний – нельзя назвать:
а) халькогенами;
б) элементами подгруппы кислорода;
в) галогенами;
г) элементами VIа группы.
2. Сера проявляет степень окисления -2 в соединении:
а) SO2;
б) Н2SO3;
в) К2SO32;
г) СS2
3. Взаимодействию концентрированной серной кислоты с медью соответствует схема превращения:
4. В сокращенном ионном уравнении реакции серной кислоты с гидроксидом алюминия сумма коэффициентов равна:
а) 3;
б) 4;
в) 5;
г) 8.
5. Оксид серы (VI) взаимодействует с каждым из двух веществ:
а) вода и хлороводород;
б) оксид кальция и гидроксид натрия;
в) кислород и оксид магния;
г) вода и медь.
6. Практически осуществима реакция между раствором сульфита натрия и растворами:
а) нитрата лития;
б) нитрата аммония;
в) хлорида натрия;
г) азотной кислоты.
7. «Вещество с резким характерным запахом воспламеняющейся спички» – данное высказывание относится к:
а) сернистому газу;
б) хлороводороду;
в) сероводороду;
г) оксиду серы(VI).
8. Коэффициент перед формулой восстановителя в уравнении реакции между сероводородом и кислородом равен:
а) 4
б) 3
в) 2
г) 1
9. Осуществите превращения: S → SО2 → Na2SO3 → SО2
К 1 уравнению составьте электронный баланс, назовите окислитель и восстановитель.
К филогении фототрофных пурпурных серных бактерий — рода Ectothiorhodospira
Ambler RP, Daniel M, Hermoso I, Meyer T, Bartsch RG, Kamen MD (1979) Cytochrome C 2 изменение последовательности среди известных видов пурпурных не — серные фотосинтезирующие бактерии. Природа (Лондон) 278: 659–660
Google Scholar
Broda E (1971) Происхождение бактериального дыхания. В: Buvet R, Ponnamperuma C (ред.) Химическая эволюция и происхождение жизни.North-Holland Publ Comp, Амстердам, стр. 446–452
Google Scholar
Брода Э. (1978) Эволюция биоэнергетических процессов. Pergamon Press, Оксфорд, Нью-Йорк, стр. 93–106
(1978) Эволюция биоэнергетических процессов. Pergamon Press, Оксфорд, Нью-Йорк, стр. 93–106
Google Scholar
Dickerson RE (1980) Эволюция и перенос генов у пурпурных фотосинтезирующих бактерий. Nature (Лондон) 283:210–212
Google Scholar
Fowler VJ, Ludwig W, Stackebrandt E (1983) Каталогизация рибосомных рибонуклеиновых кислот в бактериальной систематике: филогения рода Actinomadura .В: Гудфеллоу М., Минникин Д.Е. (ред.) Использование хемотаксономических методов для бактерий. Academic Press, Лондон (в печати)
Google Scholar
Fox GE, Stackebrandt E, Hespell RB, Gibson J, Maniloff I, Dyer TA, Wolfe RS, Balch WE, Tanner RS, Magrum LJ, Zablen LB, Blackemore R, Gupta R, Bonen L, Lewis BJ, Stahl Д.А., Люэрсен К.Р., Чен К.Н., Везе К.Р. (1980) Филогенез прокариот. Наука 209:457–463
Google Scholar
Gibbons NE, Murray RGE (1978) Предложения относительно высших таксонов бактерий. Int J Syst Bacteriol 28:1–6
Int J Syst Bacteriol 28:1–6
Google Scholar
Gibson J, Stackebrandt E, Zablen LB, Gupta R, Woese CR (1979) Филогенетический анализ пурпурных фотосинтезирующих бактерий. Curr Microbiol 3:59–64
Google Scholar
Hansen TA, Gemerden H (1972) Утилизация сульфидов пурпурными несерными бактериями. Арх Микробиол 86:49–56
Google Scholar
Hansen TA, Veldkamp H (1973) Rhodospeudomonas sulfidophila nov spec, новый вид пурпурных несерных бактерий.Арх микробиол 92:45–58
Google Scholar
Имхофф Дж. Ф. (1982) Таксономические и филогенетические последствия композиций липидов и хинонов у фототрофных микроорганизмов. В: Wintermans JFGM, Kuiper PJC (ред.) Биохимия и метаболизм растительных липидов. Elsevier Biochemical Press, Амстердам, стр. 541–544
Google Scholar
Imhoff JF, Trüper HG (1981) Ectothiorhodospira abdelmalekii sp nov, галофильная и алкалофильная фототрофная бактерия. Zbl Bakt Hyg I Abt Orig C2:228–234
Zbl Bakt Hyg I Abt Orig C2:228–234
Google Scholar
Imhoff JF, Hashwa F, Trüper HG (1978) Выделение чрезвычайно галофильных фототрофных бактерий из щелочного Вади Натрун, Египет. Arch Hydrobiol 84:381–388
Google Scholar
Имхофф Дж.Ф., Сахл Х.Г., Солиман Г.Ш., Трюпер Х.Г. (1979) Вади Натрун: Химический состав и развитие микробной массы в щелочных озерах пустыни.Геомикробиол J 1:219–234
Google Scholar
Imhoff JF, Tindall BJ, Grant WD, Trüper HG (1981) Ectothiorhodospira vacuolata sp nov, новая фототрофная бактерия из содовых озер. Arch Microbiol 130:238–242
Google Scholar
Иванова Т.Л., Турова Т.П., Антонов А.С. (1983) Определение таксономических взаимоотношений бактерий, относящихся к роду Ectothiorhodospira .Микробиология 52:538–542
Google Scholar
Ludwig W, Stackebrandt E (1983) Филогенетический анализ Legionella. Arch Microbiol 135:45–50
Arch Microbiol 135:45–50
Google Scholar
Мандель М., Лидбеттер Э.Р., Пфенниг Н., Трюпер Х.Г. (1971)Основной состав дезоксирибонуклеиновой кислоты фототрофных бактерий. Int J Syst Bacteriol 21:222–230
Google Scholar
Pfennig N, Trüper HG (1971) Высшие таксоны фототрофных бактерий.Int J Syst Bacteriol 21:17–18
Google Scholar
Pfennig N, Trüper HG (1974) Фототрофные бактерии. В: Бьюкенен Р.Е., Гиббонс Р.Е. (ред.) Руководство Берджи по определяющей бактериологии, 8-е изд. Williams & Wilkins, Балтимор, стр. 24–64
Google Scholar
Seewaldt E, Schleifer KH, Bock E, Stackebrandt E (1982) Тесное филогенетическое родство Nitrobacter и Rhodopseudomonas palustries .Arch Microbiol 131:287–290
Google Scholar
Stackebrandt E, Woese CR (1981) Эволюция прокариот. В: Карлайл М.И., Коллинз И.Ф., Мозли Б.Э.Б. (ред.) Молекулярные и клеточные аспекты микробной эволюции. Cambridge University Press, стр. 1–32.Дж Мол Эвол 17: 227–236
В: Карлайл М.И., Коллинз И.Ф., Мозли Б.Э.Б. (ред.) Молекулярные и клеточные аспекты микробной эволюции. Cambridge University Press, стр. 1–32.Дж Мол Эвол 17: 227–236
Google Scholar
Stackebrandt E, Seewaldt E, Ludwig W, Schleifer KH, Huser BA (1982) Филогенетическое положение Methanothrix soehngenii . Zbl Bakt Hyg I Abt Orig C3:90–100
Google Scholar
Trüper HG (1982) Микробиологические процессы в круговороте серы во времени. В: Holland HD, Schidlowski M (eds) Месторождения полезных ископаемых и эволюция биосферы.Springer, Berlin Heidelberg New York, стр. 5–30
Google Scholar
Trüper HG, Imhoff JF (1981) Род Ectothiorhodospira . В: Starr MP, Stolp H, Trüper HG, Balows A, Schlegel HG (ред.) Прокариоты. Springer, Berlin Heidelberg New York, стр. 274–278
. Google Scholar
Trüper HG, Pfennig N (1981) Характеристика и идентификация аноксигенных фототрофных бактерий. В: Starr MP, Stolp H, Trüper HG, Balows A, Schlegel HG (ред.) Прокариоты. Springer, Berlin Heidelberg New York, стр. 299–312
В: Starr MP, Stolp H, Trüper HG, Balows A, Schlegel HG (ред.) Прокариоты. Springer, Berlin Heidelberg New York, стр. 299–312
Google Scholar
Турова Т.П., Иванова Т.Л., Антонов А.С. (1982) Гибридизация ДНК пурпурных фототрофных бактерий. Изв Акад Наук ССР, Сер Биол 5:763–767
Google Scholar
Woese CR, Gibson J, Fox GE (1980) Отражают ли генеалогические закономерности пурпурных фотосинтезирующих бактерий межвидовой перенос генов? Природа (Лондон) 238:212–214
Google Scholar
Woese CR, Blanz P, Hespell RB, Hahn CM (1982) Филогенетические отношения между различными спиральными бактериями.Curr Microbiol 7:119–124
Google Scholar
Геномные свойства морских бактерий группы А указывают на их роль в морском цикле серы
Acinas SG, Klepac-Ceraj V, Hunt DE, Pharino C, Ceraj I, Distel DL et al .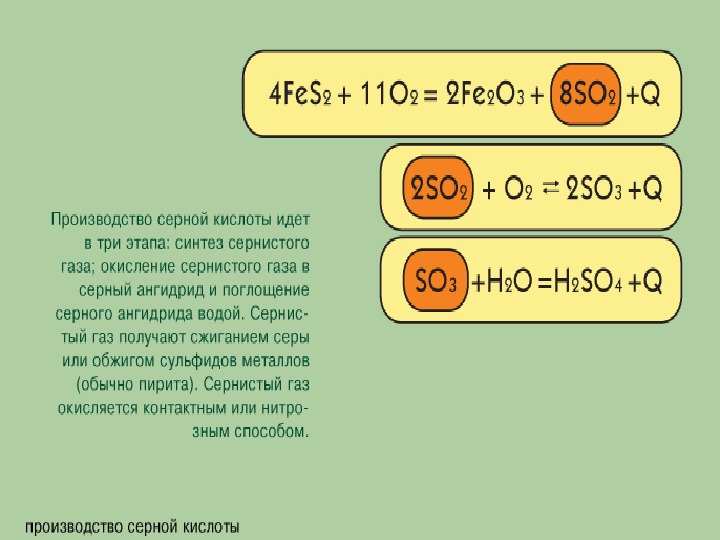 (2004). Мелкомасштабная филогенетическая архитектура сложного бактериального сообщества. Природа 430 : 551–554.
(2004). Мелкомасштабная филогенетическая архитектура сложного бактериального сообщества. Природа 430 : 551–554.
КАС Статья Google Scholar
Агуяр П., Беверидж Т., Рейзенбах А. .(2004). Sulfurihydrogenibium azorense , sp. nov., термофильный водородокисляющий микроаэрофил из наземных горячих источников на Азорских островах. Int J Syst Evol Microbiol 54 : 33–39.
КАС Статья Google Scholar
Allers E, Wright JJ, Konwar KM, Howes CG, Beneze E, Hallam SJ и др. . (2012). Разнообразие и структура популяций морских бактерий группы А в северо-восточной субарктической части Тихого океана. ISME J 7 : 256–268.
Артикул Google Scholar
Альтшул С.Ф., Гиш В., Миллер В., Майерс Э.В., Липман Д.Дж. (1990). Базовый инструмент локального поиска выравнивания. Дж Мол Биол 215 : 403–410.
Дж Мол Биол 215 : 403–410.
КАС Статья Google Scholar
Андерсон Дж.Дж., Девол А.Х. (1973). Обновление глубоководных вод в заливе Саанич, периодически бескислородном бассейне. Устьевые и прибрежные морские науки 1 : 1–10.
Артикул Google Scholar
Бано Н., Холлибо Дж.Т. (2002). Филогенетический состав ассоциаций бактериопланктона Северного Ледовитого океана. Appl Environ Microbiol 68 : 505–518.
КАС Статья Google Scholar
Бендтсен Д.Д., Нильсен Х., Уиддик Д., Палмер Т., Брунак С. .(2005). Прогнозирование двойных аргининовых сигнальных пептидов. BMC Bioinformatics 6 : 167.
Артикул Google Scholar
Боград С.Дж., Кастро К.Г., Ди Лоренцо Э., Паласиос Д. М., Бейли Х., Гилли В. и др. . (2008). Снижение содержания кислорода и обмеление гипоксической границы в Калифорнийском течении. Geophys Res Lett 35 : 1–6.
М., Бейли Х., Гилли В. и др. . (2008). Снижение содержания кислорода и обмеление гипоксической границы в Калифорнийском течении. Geophys Res Lett 35 : 1–6.
Артикул Google Scholar
Canfield DE, Stewart FJ, Thamdrup B, De Brabandere L, Dalsgaard T, Delong EF и др. .(2010). Загадочный круговорот серы в водах зоны минимума кислорода у чилийского побережья. Наука 330 : 1375–1378.
КАС Статья Google Scholar
Чиполлоне Р., Асенци П., Виска П. . (2007). Общие темы и вариации в роданском надсемействе. IUBMB Life 59 : 51–59.
КАС Статья Google Scholar
Кларк К.Р.(1993). Непараметрический многомерный анализ изменений в структуре сообщества. Aust J Ecol 18 : 117–143.
Артикул Google Scholar
Кларк К. Р., Горли Р.Н. (2006) РУКОВОДСТВО v6. Руководство пользователя/учебник. Плимутская рутина в многомерном экологическом исследовании . Плимутская морская лаборатория: Плимут, Великобритания.
Р., Горли Р.Н. (2006) РУКОВОДСТВО v6. Руководство пользователя/учебник. Плимутская рутина в многомерном экологическом исследовании . Плимутская морская лаборатория: Плимут, Великобритания.
Google Scholar
Делонг Э.Ф., Престон К.М., Минсер Т., Рич В., Халлам С.Дж., Фригаард Н.Ю. и др. .(2006). Геномика сообщества среди стратифицированных микробных сообществ в недрах океана. Наука 311 : 496–503.
КАС Статья Google Scholar
деМаре Ф., Курц Д.М., Нордлунд П. . (1996). Структура рубреритрина Desulfovibrio vulgaris обнаруживает уникальную комбинацию рубредоксиноподобных доменов FeS4 и ферритиноподобных дижелезных доменов. Nat Struct Mol Biol 3 : 539–546.
Артикул Google Scholar
ДеСантис Т.З., Хугенхольц П., Ларсен Н., Рохас М., Броди Э. Л., Келлер К. и др. . (2006). Greengenes, проверенная химера база данных генов 16S рРНК и рабочая среда, совместимая с ARB. Appl Environ Microbiol 72 : 5069–5072.
Л., Келлер К. и др. . (2006). Greengenes, проверенная химера база данных генов 16S рРНК и рабочая среда, совместимая с ARB. Appl Environ Microbiol 72 : 5069–5072.
КАС Статья Google Scholar
DeSantis TZJ, Hugenholtz P, Keller K, Brodie EL, Larsen N, Piceno YM и др. .(2006а). NAST: сервер множественного выравнивания последовательностей для сравнительного анализа генов 16S рРНК. Рез. нуклеиновых кислот 34 : W394–W399.
КАС Статья Google Scholar
Эдгар RC . (2004). MUSCLE: множественное выравнивание последовательностей с высокой точностью и высокой пропускной способностью. Рез. нуклеиновых кислот 32 : 1792–1797.
КАС Статья Google Scholar
Эмерсон С., Ватанабэ Ю.В., Оно Т., Мекинг С. .(2004). Временные тренды кажущейся утилизации кислорода в верхнем пикноклине северной части Тихого океана: 1980-2000 гг. Дж Океаногр 60 : 139–147.
Дж Океаногр 60 : 139–147.
Артикул Google Scholar
Фриланд Х . (2007). Краткая история океанской станции «Папа» и линии P. Prog Oceanogr 75 : 120–125.
Артикул Google Scholar
Фригаард Н.Ю., Брайант Д.А.(2008). Геномное понимание метаболизма серы фототрофных зеленых серных бактерий. Метаболизм серы в фототрофных организмах . Спрингер: Нью-Йорк, стр. 337–355.
Глава Google Scholar
Фукс Б.М., Вобкен Д., Зубков М.В., Беркилл П., Аманн Р. . (2005). Молекулярная идентификация популяций пикопланктона в контрастных водах Аравийского моря. Aquat Microb Ecol 39 : 145–157.
Артикул Google Scholar
Фурман Дж.А., Дэвис А.А. (1997). Широко распространенные археи и новые бактерии из морских глубин, как показано последовательностями гена 16S рРНК. Серия Marine Ecol Prog 150 : 275–285.
Серия Marine Ecol Prog 150 : 275–285.
Артикул Google Scholar
Фурман Дж.А., МакКаллум К., Дэвис А.А. (1993). Филогенетическое разнообразие подповерхностных морских микробных сообществ Атлантического и Тихого океанов. Appl Environ Microbiol 59 : 1294–1302.
КАС пабмед ПабМед Центральный Google Scholar
Гордон Д.А., Джованнони С.Дж. (1996). Обнаружение стратифицированных микробных популяций, относящихся к видам Chlorobium и Fibrobacter , в Атлантическом и Тихом океанах. Appl Environ Microbiol 62 : 1171–1177.
КАС пабмед ПабМед Центральный Google Scholar
Грегерсен Л.Х., Брайант Д.А., Фригаард Н.Ю.(2011). Механизмы и эволюция окислительного метаболизма серы у зеленых серных бактерий. Front Microbiol 2 : 1–14.
Артикул Google Scholar
Гримо Р., Эзрати Б., Митчелл Дж.К., Лафит Д., Бриан С., Деррик П.Дж. и др. . (2001). Восстановление окисленных белков: идентификация новой метионинсульфоксидредуктазы. J Biol Chem 276 : 48915–48920.
КАС Статья Google Scholar
Grote J, Schott T, Bruckner CG, Glöckner FO, Jost G, Teeling H и др. .(2012). Геном и физиология модельной протеобактерии Epsilon, ответственной за детоксикацию сульфидов в морских зонах истощения кислорода. Proc Natl Acad Sci USA 109 : 506–510.
КАС Статья Google Scholar
Guindon S, Lethiec F, Duroux P, Gascuel O . (2005). PHYML Online — веб-сервер для быстрого филогенетического вывода на основе максимального правдоподобия. Рез. нуклеиновых кислот 33 : W557–W559.
КАС Статья Google Scholar
Халлам С.Дж., Константинидис К.Т., Патнэм Н., Шлепер С., Ватанабе И., Сугахара Дж. и др. . (2006). Геномный анализ некультивируемого морского кренархеота Cenarchaeum symbiosum. Proc Natl Acad Sci USA 103 : 18296–18301.
КАС Статья Google Scholar
Хеддерих Р., Климмек О., Крёгер А., Дирмайер Р., Келлер М., Штеттер К.О.(1999). Анаэробное дыхание с элементарной серой и дисульфидами. Fems Microbiol Rev 22 : 353–381.
Артикул Google Scholar
Хелм КП, Биндофф Н.Л., Черч Дж.А. (2011). Наблюдается снижение содержания кислорода в мировом океане. Geophys Res Lett 38 : 1–6.
Артикул Google Scholar
Хильд Э., Такаяма К., Олссон Р.М. , Челлеберг С. .(2000). Доказательства роли rpoE в стрессированных и нестрессированных клетках морского штамма Vibrio angustum S14. J Бактериол 182 : 6964–6974.
, Челлеберг С. .(2000). Доказательства роли rpoE в стрессированных и нестрессированных клетках морского штамма Vibrio angustum S14. J Бактериол 182 : 6964–6974.
КАС Статья Google Scholar
Hyatt D, Chen GL, LoCascio PF, Land ML, Larimer FW, Hauser LJ . (2010). Prodigal: распознавание прокариотических генов и идентификация сайта инициации трансляции. Биоинформатика BMC 11 : 119.
Артикул Google Scholar
Янкелевич А., Климмек О., Крёгер А. . (1995). Перенос электрона от гидрогеназы и формиатдегидрогеназы к полисульфидредуктазе в мембране Wolinella succinogenes . Biochimica et Biophysica Acta (BBA)-Bioenergetics 1231 : 157–162.
Артикул Google Scholar
Джормакка М., Йокояма К., Яно Т., Тамакоши М., Акимото С., Шимамура Т. и др. .(2008). Молекулярный механизм сохранения энергии при полисульфидном дыхании. Nat Struct Mol Biol 15 : 730–737.
и др. .(2008). Молекулярный механизм сохранения энергии при полисульфидном дыхании. Nat Struct Mol Biol 15 : 730–737.
КАС Статья Google Scholar
Канехиса М., Гото С. . (1999). KEGG: Киотская энциклопедия генов и геномов. Nucleic Acids Res 27 : 29–34 Загружено 18 июня 2011 г.
Статья Google Scholar
Карп П.Д., Райли М., Сайер М., Полсен ИТ, Пейли С.М., Пеллегрини-Тул А. .(2000). Базы данных экоциклов и метациклов. Nucleic Acids Res 28 : 56–59 Загружено 21 октября 2011 г.
CAS Статья Google Scholar
Килинг Р.Ф., Кёрцингер А., Грубер Н. . (2010). Деоксигенация океана в условиях потепления. Ann Rev Mar Sci 2 : 199–229.
Артикул Google Scholar
Климмек О. , Крёгер А., Штойдель Р., Холдт Г. .(1991). Рост Wolinella succinogenes с полисульфидом в качестве терминального акцептора фосфорилирующего транспорта электронов. Arch Microbiol 155 : 177–182.
, Крёгер А., Штойдель Р., Холдт Г. .(1991). Рост Wolinella succinogenes с полисульфидом в качестве терминального акцептора фосфорилирующего транспорта электронов. Arch Microbiol 155 : 177–182.
КАС Статья Google Scholar
Конвар К.М., Хэнсон Н.В., Пейдж А.П., Халлам С.Дж. (2013). MetaPathways: модульный конвейер для создания баз данных о путях/геномах на основе информации о последовательности окружающей среды. Биоинформатика BMC 14 : 202.
Артикул Google Scholar
Krafft T, Bokranz M, Klimmek O, Schröder I, Fahrenholz F, Kojro E и др. . (1992). Клонирование и нуклеотидная последовательность гена pst A полисульфидредуктазы Wolinella succinogenes. Eu J Biochem 206 : 503–510.
КАС Статья Google Scholar
Крафт Т., Гросс Р. , Крегер А. .(1995). Функция генов Wolinella succinogenes psr в транспорте электронов с полисульфидом в качестве терминального акцептора электронов. Eu J Biochem 230 : 601–606.
, Крегер А. .(1995). Функция генов Wolinella succinogenes psr в транспорте электронов с полисульфидом в качестве терминального акцептора электронов. Eu J Biochem 230 : 601–606.
КАС Статья Google Scholar
Крживинский М., Шейн Дж., Бироль И., Коннорс Дж., Гаскойн Р., Хорсман Д. и др. . (2009). Circos: информационная эстетика для сравнительной геномики. Genome Res 19 : 1639–1645.
КАС Статья Google Scholar
Курц С., Филлиппи А., Делчер А.Л., Смут М., Шамуэй М., Антонеску С. и др. . (2004). Универсальное и открытое программное обеспечение для сравнения больших геномов. Геном Биол 5 : R12.
Артикул Google Scholar
Lilley MD, Baross JA, Gordon LI . (1982). Растворенный водород и метан в заливе Саанич, Британская Колумбия. Deep Sea Res 29 : 1471–1484.
Deep Sea Res 29 : 1471–1484.
КАС Статья Google Scholar
Мадрид В.М., Тейлор Г.Т., Скрэнтон М.И., Чистосердов А.Ю. (2001). Филогенетическое разнообразие бактериальных и архейных сообществ бескислородной зоны бассейна Кариако. Appl Environ Microb 67 : 1663–1674.
КАС Статья Google Scholar
Milucka J, Ferdelman TG, Polerecky L, Franzke D, Wegener G, Schmid M et al .(2012). Нульвалентная сера является ключевым промежуточным звеном в окислении морского метана. Природа 491 : 541–546.
КАС Статья Google Scholar
Мирошниченко М.Л., Колганова Т.В., Весенний С., Черных Н., Бонч-Осмоловская Е.А. (2010). Caldithrix palaeochoryensis sp. nov., термофильная, анаэробная, хемоорганотрофная бактерия из геотермально нагретого осадка, и исправленное описание рода Caldithrix . Int J Syst Evol Microbiol 60 : 2120–2123.
Int J Syst Evol Microbiol 60 : 2120–2123.
КАС Статья Google Scholar
Мирошниченко М.Л., Кострикина Н.А., Черных Н.А., Пименов Н.В., Турова Т.П., Антипов А.Н. и др. . (2003). Caldithrix abyssi род. ноябрь, сп. nov., термофильная анаэробная бактерия, восстанавливающая нитраты, выделенная из гидротермального источника Срединно-Атлантического хребта, представляет новую бактериальную линию. Int J Syst Evol Microbiol 53 : 323–329.
КАС Статья Google Scholar
Прюитт К.Д., Маглотт Д.Р. (2001). RefSeq и LocusLink: ресурсы NCBI, ориентированные на гены. Nucleic Acids Res 29 : 137–140 Загружено 13 ноября 2012 г.
CAS Статья Google Scholar
Раско Д.А., Майерс Г.С., Равель Дж. (2005). Визуализация сравнительного геномного анализа по соотношению баллов BLAST. Bmc Биоинформатика 6 : 2.
Bmc Биоинформатика 6 : 2.
Артикул Google Scholar
Рич В.И., Фам В.Д., Эппли Дж., Ши Ю., Делонг Э.Ф. (2011). Анализ временных рядов микробного пикопланктона в заливе Монтерей с использованием микроматрицы «геномного прокси». Environ Microbiol 13 : 116–134.
КАС Статья Google Scholar
Шаттенхофер М., Фукс Б.М., Аманн Р., Зубков М.В., Тарран Г.А., Пернталер Дж.(2009). Широтное распределение прокариотических популяций пикопланктона в Атлантическом океане. Environ Microbiol 11 : 2078–2093.
КАС Статья Google Scholar
Шредер И., Крёгер А., Мэйси Дж.М. (1988). Выделение редуктазы серы и восстановление серного дыхания Wolinella succinogenes . Arch Microbiol 149 : 572–579.
Артикул Google Scholar
Степанаускас Р . (2012). Одноклеточная геномика: индивидуальный взгляд на микробы. Curr Opin Microbiol 15 : 613–620.
(2012). Одноклеточная геномика: индивидуальный взгляд на микробы. Curr Opin Microbiol 15 : 613–620.
КАС Статья Google Scholar
Стивенс Х., Уллоа О. (2008). Бактериальное разнообразие в зоне минимума кислорода восточной тропической части южной части Тихого океана. Environ Microbiol 10 : 1244–1259.
КАС Статья Google Scholar
Страмма Л., Джонсон Г.К., Спринтолл Дж., Морхольц В. .(2008). Расширение зон кислородного минимума в тропических океанах. Наука 320 : 655–658.
КАС Статья Google Scholar
Suzuki MT, Preston CM, Beja O, de la Torre JR, Steward GF, DeLong EF . (2004). Филогенетический скрининг клонов, содержащих ген рибосомной РНК, в библиотеках бактериальных искусственных хромосом (ВАС) с разных глубин в заливе Монтерей. Microb Ecol 48 : 473–488.
Microb Ecol 48 : 473–488.
КАС Статья Google Scholar
Свон Б.К., Мартинес-Гарсия М., Престон К.М., Щирба А., Войке Т., Лами Д. и др. . (2011). Потенциал хемолитоавтотрофии среди вездесущих линий бактерий в Темном океане. Наука 333 : 1296–1300.
КАС Статья Google Scholar
Штуковска М., Буньо М., Потемпа Дж., Трэвис Дж., Курц Д.М.(2002). Роль рубреритрина в реакции на окислительный стресс Porphyromonas gingivalis . Мол Микробиол 44 : 479–488.
КАС Статья Google Scholar
Татусов Р.Л., Натале Д.А., Гаркавцев И.В., Татусова Т.А., Шанкаварам Ю.Т., Рао Б.С. и др. . (2001). База данных COG: новые разработки в филогенетической классификации белков из полных геномов. Nucleic Acids Res 29 : 22–28 Загружено 5 февраля 2013 г.
КАС Статья Google Scholar
Тилинг Х., Мейердеркс А., Бауэр М., Аманн Р., Глокнер Ф.О. (2004а). Применение тетрануклеотидных частот для отнесения геномных фрагментов. Environ Microbiol 6 : 938–947.
КАС Статья Google Scholar
Тилинг Х., Вальдманн Дж., Ломбардо Т., Бауэр М., Глокнер Ф.О. (2004б).TETRA: веб-сервис и отдельная программа для анализа и сравнения моделей использования тетрануклеотидов в последовательностях ДНК. BMC Bioinformatics 5 : 163.
Артикул Google Scholar
Ванони М.А., Курти Б. (2008). Структурно-функциональные исследования глутаматсинтаз: класс саморегулирующихся железо-серных флавоферментов, необходимых для усвоения азота. Срок службы IUBMB 60 : 287–300.
КАС Статья Google Scholar
Уолш Д. А., Халлам С.Дж. (2011). Структура и динамика бактериального сообщества в сезонно бескислородном фьорде: залив Саанич, Британская Колумбия. В молекулярной микробной экологии II: метагеномика в различных средах обитания de Bruijn FJ, (ред.). John Wiley & Sons, Inc.: Хобокен, Нью-Джерси, США.
А., Халлам С.Дж. (2011). Структура и динамика бактериального сообщества в сезонно бескислородном фьорде: залив Саанич, Британская Колумбия. В молекулярной микробной экологии II: метагеномика в различных средах обитания de Bruijn FJ, (ред.). John Wiley & Sons, Inc.: Хобокен, Нью-Джерси, США.
Уолш Д.А., Заикова Э., Халлам С.Дж. (2009). Большой объем (20 л+) фильтрации проб прибрежной морской воды. J Vis Exp 28 : 1161.
Google Scholar
Уолш Д.А., Заикова Э., Хоус К.Г., Сонг Ю.С., Райт Дж.Дж., Триндж С.Г. и др. . (2009). Метагеном универсального хемолитоавтотрофа из расширяющихся океанических мертвых зон. Наука 326 : 578–582.
КАС Статья Google Scholar
Уорд Б.Б., Килпатрик К.А., Вопат А.Е., Миннич Э.К., Линдстром М.Э.(1989). Окисление метана в заливе Саанич. Доп. полка Рез. 9 : 65–75.
Артикул Google Scholar
Уитни Ф.А., Фриленд Х.Дж., Роберт М. (2007). Устойчиво снижающийся уровень кислорода во внутренних водах восточной субарктической части Тихого океана. Прог Океангр 75 : 179–199.
Артикул Google Scholar
Войк Т., Се Г., Коупленд А., Гонсалес Дж. М., Хан С., Кисс Х. и др. .(2009). Сборка морского метагенома, по одной клетке за раз. PLoS One 4 : e5299.
Артикул Google Scholar
Райт Дж.Дж., Конвар К.М., Халлам С.Дж. (2012). Микробная экология расширяющихся зон кислородного минимума. Nat Rev Microbiol 10 : 381–394.
КАС Статья Google Scholar
Райт Дж.Дж., Ли С., Зайкова Э., Уолш Д.А., Халлам С.Дж.(2009). Экстракция ДНК из фильтров Sterivex 0,22 мкМ и центрифугирование в градиенте плотности хлорида цезия. J Vis Exp 31 : pii 1352.
J Vis Exp 31 : pii 1352.
Google Scholar
Заикова Э., Хоули А., Уолш Д.А., Халлам С.Дж. (2009). Отбор проб и сбор морской воды. J Vis Exp 28 : e1159.
Google Scholar
Заикова Э., Уолш Д.А., Стилвелл К.П., Мон В.В., Тортелл П.Д., Халлам С.Дж. .(2010). Динамика микробного сообщества в сезонно бескислородном фьорде: залив Саанич, Британская Колумбия. Environ Microbiol 12 : 172–191.
КАС Статья Google Scholar
Arabidopsis SLIM1 является центральным транскрипционным регулятором реакции растений на серу и метаболизма | Растительная клетка
Аннотация
Сера является важным макроэлементом, необходимым для роста растений.Чтобы идентифицировать ключевые факторы транскрипции, регулирующие путь ассимиляции серы, мы провели скрининг мутантов Arabidopsis thaliana с использованием конструкции флуоресцентного репортерного гена, состоящей из промотора SULTR1;2 , реагирующего на ограничение серы, и зеленого флуоресцентного белка в качестве фонового индикатора для мониторинг реакции растений на серу. Выделенный мутант sulfure limited1 ( slim1 ) не смог индуцировать транскрипты SULTR1;2 в условиях низкого содержания серы (–S).Мутации, вызывающие фенотипы slim1 , не отвечающие на ограничение серы, были идентифицированы в транскрипционном факторе семейства EIL, ETHYLENE-INSENSITIVE3-LIKE3 ( EIL3 ), чья функциональная идентичность с SLIM1 была подтверждена генетической комплементацией. Поглощение сульфата и рост растений на –S были значительно снижены мутациями slim1 , но восстановлены за счет сверхэкспрессии SLIM1 . SLIM1 функционировал как центральный регулятор транскрипции, который контролировал как активацию приобретения сульфатов, так и деградацию глюкозинолатов в условиях -S.Метаболитный анализ показал стабильное накопление глюкозинолатов у мутантов slim1 даже в условиях -S, особенно в молекулярных видах с метилсульфинилалкильными боковыми цепями, полезными для здоровья человека.
Выделенный мутант sulfure limited1 ( slim1 ) не смог индуцировать транскрипты SULTR1;2 в условиях низкого содержания серы (–S).Мутации, вызывающие фенотипы slim1 , не отвечающие на ограничение серы, были идентифицированы в транскрипционном факторе семейства EIL, ETHYLENE-INSENSITIVE3-LIKE3 ( EIL3 ), чья функциональная идентичность с SLIM1 была подтверждена генетической комплементацией. Поглощение сульфата и рост растений на –S были значительно снижены мутациями slim1 , но восстановлены за счет сверхэкспрессии SLIM1 . SLIM1 функционировал как центральный регулятор транскрипции, который контролировал как активацию приобретения сульфатов, так и деградацию глюкозинолатов в условиях -S.Метаболитный анализ показал стабильное накопление глюкозинолатов у мутантов slim1 даже в условиях -S, особенно в молекулярных видах с метилсульфинилалкильными боковыми цепями, полезными для здоровья человека.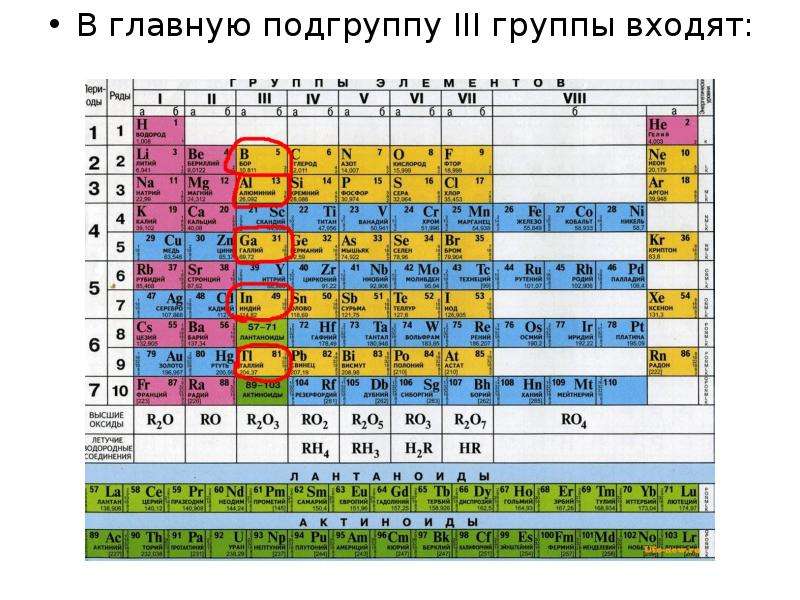 Сверхэкспрессия SLIM1 и его гомологов риса ( Oryza sativa ), но не других генов EIL Arabidopsis , восстанавливала фенотипы, не отвечающие на ограничение содержания серы, у мутантов slim1 , что свидетельствует об уникальности подгруппы 3SLIM1 как EIL. регуляторы отклика серы.
Сверхэкспрессия SLIM1 и его гомологов риса ( Oryza sativa ), но не других генов EIL Arabidopsis , восстанавливала фенотипы, не отвечающие на ограничение содержания серы, у мутантов slim1 , что свидетельствует об уникальности подгруппы 3SLIM1 как EIL. регуляторы отклика серы.
ВВЕДЕНИЕ
Современное сельское хозяйство требует адекватного внесения серы для достижения максимальной урожайности и производительности. Растения используют сульфат, окисленную форму серы, присутствующую в почве, в качестве источника серы (Crawford et al., 2000; Leustek et al., 2000; Saito, 2004). Напротив, животные, включая человека, нуждаются в серосодержащих аминокислотах и белках в качестве пищевых источников серы из-за их неспособности ассимилировать сульфат в Cys и Met.Значение пути ассимиляции сульфатов растениями проявляется в их способности восполнять этот метаболический пробел в глобальном круговороте серы в природе (Crawford et al.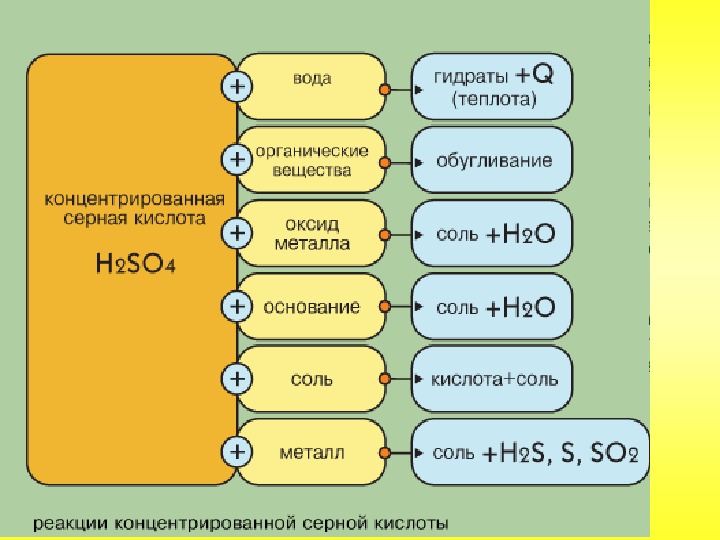 , 2000). В дополнение к своему основному питательному значению сера присутствует в ряде растительных метаболитов, представляющих важную биологическую активность в качестве регуляторов окислительно-восстановительного потенциала, витаминов, коферментов, ароматизаторов и защитных химических веществ (Crawford et al., 2000; Leustek et al., 2000; Saito, 2004; Грабб и Абель, 2006; Халкиер и Гершензон, 2006).
, 2000). В дополнение к своему основному питательному значению сера присутствует в ряде растительных метаболитов, представляющих важную биологическую активность в качестве регуляторов окислительно-восстановительного потенциала, витаминов, коферментов, ароматизаторов и защитных химических веществ (Crawford et al., 2000; Leustek et al., 2000; Saito, 2004; Грабб и Абель, 2006; Халкиер и Гершензон, 2006).
Активация систем транспортировки сульфатов имеет решающее значение для роста растений в среде с низким содержанием серы (–S).Когда почвенная среда недостаточно удобрена сульфатом, растения будут поддерживать свой рост за счет увеличения способности систем поглощения сульфата корнями (Clarkson et al., 1983; Deane-Drummond, 1987; Smith et al., 1995, 1997). У Arabidopsis thaliana этой цели служат переносчики сульфатов с высоким сродством, которые облегчают начальное поглощение сульфата (Takahashi et al., 2000; Vidmar et al., 2000; Shibagaki et al., 2002; Yoshimoto et al., 2002). . Транспортеры, опосредующие сосудистый транспорт сульфата (Takahashi et al., 1997; Йошимото и др., 2003 г.; Kataoka et al., 2004a) и высвобождение вакуолярного сульфата также может способствовать эффективному использованию пулов сульфатов в условиях –S (Kataoka et al., 2004b). Кроме того, катаболическая рециркуляция вторичных метаболитов серы и запасных соединений может стать необходимой для адаптации к среде с –S (Hirai et al., 1995, 2005; Kutz et al., 2002). Однако такие метаболические компромиссы существенно ухудшают качество сельскохозяйственных культур. В частности, для крестоцветных растений деградация и снижение производства глюкозинолатов, основных серосодержащих вторичных метаболитов, имеют решающее значение как для урожая, так и для качества, поскольку они действуют как защитные химические вещества для самих растений (Grubb and Abel, 2006; Halkier and Gershenzon, 2006). и дополнительно полезны для человека как фитохимические вещества, предотвращающие рак в рационе (Talalay and Fahey, 2001).
. Транспортеры, опосредующие сосудистый транспорт сульфата (Takahashi et al., 1997; Йошимото и др., 2003 г.; Kataoka et al., 2004a) и высвобождение вакуолярного сульфата также может способствовать эффективному использованию пулов сульфатов в условиях –S (Kataoka et al., 2004b). Кроме того, катаболическая рециркуляция вторичных метаболитов серы и запасных соединений может стать необходимой для адаптации к среде с –S (Hirai et al., 1995, 2005; Kutz et al., 2002). Однако такие метаболические компромиссы существенно ухудшают качество сельскохозяйственных культур. В частности, для крестоцветных растений деградация и снижение производства глюкозинолатов, основных серосодержащих вторичных метаболитов, имеют решающее значение как для урожая, так и для качества, поскольку они действуют как защитные химические вещества для самих растений (Grubb and Abel, 2006; Halkier and Gershenzon, 2006). и дополнительно полезны для человека как фитохимические вещества, предотвращающие рак в рационе (Talalay and Fahey, 2001).
Усвоение серы и производство глюкозинолатов являются двумя основными метаболическими процессами, на которые влияет серное питание. Недавние исследования микрочипов показали, что активация сульфата и подавление производства глюкозинолатов могут происходить параллельно в ответ на ограничение серы (Hirai et al., 2003, 2004, 2005; Maruyama-Nakashita et al., 2003, 2005; Nikiforova et al. , 2003). По-видимому, вся сеть метаболизма серы координированно регулируется в среде –S.Сообщалось о транскрипционных факторах и сигнальных белках, оказывающих стимулирующее действие на биосинтез индолглюкозинолатов из Arabidopsis (Celenza et al., 2005; Levy et al., 2005; Skirycz et al., 2006). Однако регуляторные белки для процесса приобретения сульфата, которые могут полностью влиять на поступление серы в метаболические пути, еще не идентифицированы. Это исследование сообщает об идентификации и функциональной характеристике центрального фактора транскрипции, который соответствует этой ассимиляционной регуляции у Arabidopsis .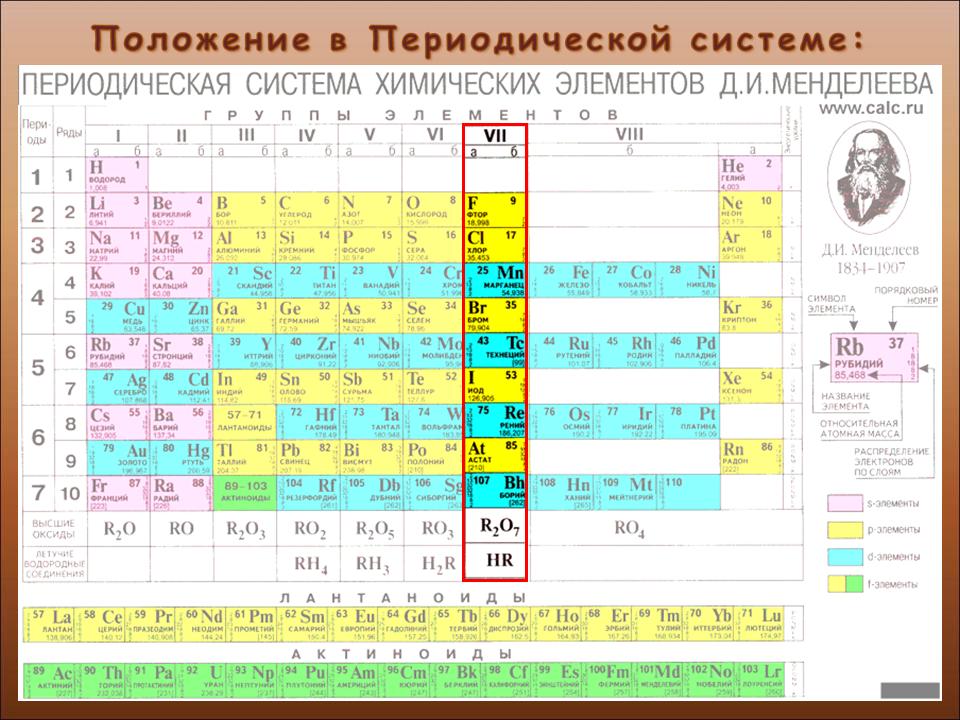 Мы демонстрируем функцию этого ключевого фактора транскрипции, который существенно способствует регуляции метаболизма, необходимой для адаптации к среде –S.
Мы демонстрируем функцию этого ключевого фактора транскрипции, который существенно способствует регуляции метаболизма, необходимой для адаптации к среде –S.
РЕЗУЛЬТАТЫ
Идентификация
мутантов Arabidopsis slim1 с помощью флуоресцентной визуализации Мы использовали генетический подход для идентификации ключевых регуляторных белков, контролирующих восходящие сигнальные каскады метаболизма серы у Arabidopsis . Скрининг с помощью флуоресцентного репортера был разработан для мониторинга количества переносчика сульфата SULTR1; 2 в корнях Arabidopsis , визуализируемого как флуоресценция in vivo зеленого флуоресцентного белка медузы (GFP).SULTR1;2 является транспортером сульфата с высоким сродством у Arabidopsis , локализуется в корневых волосках, эпидермисе и коре корней и вносит основной вклад в поглощение сульфата из окружающей среды (Shibagaki et al. , 2002; Yoshimoto и др., 2002). мРНК SULTR1;2 накапливается в условиях –S; таким образом, конструкция слитого гена P SULTR1;2 -GFP , состоящая из 2160 п.н. промоторной области SULTR1;2 гена переносчика сульфата и последовательности, кодирующей GFP, проявляет зеленую флуоресценцию, когда растения неадекватно снабжаются сульфатом. (Рисунок 1
, 2002; Yoshimoto и др., 2002). мРНК SULTR1;2 накапливается в условиях –S; таким образом, конструкция слитого гена P SULTR1;2 -GFP , состоящая из 2160 п.н. промоторной области SULTR1;2 гена переносчика сульфата и последовательности, кодирующей GFP, проявляет зеленую флуоресценцию, когда растения неадекватно снабжаются сульфатом. (Рисунок 1 Рисунок 1.
Неотвечающие фенотипы Arabidopsis slim1 Мутанты.
Родительские растения и slim1-1 и slim1-2 Мутанты выращивали в течение 11 дней с 1500, 300, 100 или 30 мкМ сульфата (S1500, S300, S100 и S30) или без сульфата (S0 ). Флуоресценцию GFP из индикаторной конструкции ( P SULTR1; 2 -GFP ) визуализировали с помощью анализатора изображений, как описано в Методах. Светлое поле и флуоресцентные изображения представлены на левой панели.Содержание мРНК корней SULTR1;2 и GFP показано на правой панели. Содержание мРНК определяли количественно с помощью ПЦР в реальном времени и нормализовали с использованием убиквитина в качестве внутреннего стандарта. Значения представлены как средние ± se ( n = 3).
Значения представлены как средние ± se ( n = 3).
Рисунок 1.
Фенотипы –S-без ответа у мутантов Arabidopsis slim1 .
Родительские растения и slim1-1 и slim1-2 Мутанты выращивали в течение 11 дней с 1500, 300, 100 или 30 мкМ сульфата (S1500, S300, S100 и S30) или без сульфата (S0 ).Флуоресценцию GFP из индикаторной конструкции ( P SULTR1; 2 -GFP ) визуализировали с помощью анализатора изображений, как описано в Методах. Светлое поле и флуоресцентные изображения представлены на левой панели. Содержание мРНК корней SULTR1;2 и GFP показано на правой панели. Содержание мРНК определяли количественно с помощью ПЦР в реальном времени и нормализовали с использованием убиквитина в качестве внутреннего стандарта. Значения представлены как средние ± se ( n = 3).
, родительская линия; Маруяма-Накашита и др., 2004б). Используя этот трансгенный Arabidopsis в качестве родительской линии (фон Колумбия-0), были созданы семена М2, подвергшиеся мутагенезу этилметансульфоната, и сеянцы были проверены на изменения флуоресценции GFP в условиях культивирования –S. Проростки М2, демонстрирующие пониженные уровни флуоресценции GFP, были выделены в качестве мутантов-кандидатов. Те растения, которые демонстрировали значительное снижение сигналов GFP, были повторно отобраны в растениях M3, а популяции F2 были получены из скрещиваний с родительскими растениями.Семейство аллельных мутантов с косегрегирующими рецессивными мутациями было выбрано для дальнейшего анализа и названо slim1 в честь их фенотипов, не отвечающих на ограничение содержания серы (рис. 1). У мутантов slim1-1 и slim1-2 почти полностью отсутствовали флуоресцентные сигналы GFP, которые в норме должны наблюдаться у родительских растений на среде -S (рис. 1). Соразмерно аномалии экспрессии репортера GFP индукция мРНК SULTR1;2 под действием –S была отменена как у мутантов slim1-1 , так и у мутантов slim1-2 (рис. 1).
Проростки М2, демонстрирующие пониженные уровни флуоресценции GFP, были выделены в качестве мутантов-кандидатов. Те растения, которые демонстрировали значительное снижение сигналов GFP, были повторно отобраны в растениях M3, а популяции F2 были получены из скрещиваний с родительскими растениями.Семейство аллельных мутантов с косегрегирующими рецессивными мутациями было выбрано для дальнейшего анализа и названо slim1 в честь их фенотипов, не отвечающих на ограничение содержания серы (рис. 1). У мутантов slim1-1 и slim1-2 почти полностью отсутствовали флуоресцентные сигналы GFP, которые в норме должны наблюдаться у родительских растений на среде -S (рис. 1). Соразмерно аномалии экспрессии репортера GFP индукция мРНК SULTR1;2 под действием –S была отменена как у мутантов slim1-1 , так и у мутантов slim1-2 (рис. 1).
 2А
2А).
(B) Позиции slim1-1 , slim1-2 , slim1-3 и slim1-4 аллелей.Экзоны обозначены толстыми полосами. Черные и белые полосы обозначают кодирующие и непереведенные области соответственно.
(C) Выравнивание белков семейства SLIM1 и EIL в Arabidopsis . Выравнивание полных белковых последовательностей проводили с помощью программы ClustalW в банке данных ДНК Японии (DDBJ) (http://www.ddbj.nig.ac.jp/search/clustalw-j.html), а N-концевой консервативные области показаны на этом рисунке. Красные символы обозначают позиции slim1-1 , slim1-2 , slim1-3 , slim1-4 и ein3-3 .Предполагаемые ДНК-связывающие домены (от BD I до BD IV) подчеркнуты. Аминокислотные остатки, консервативные в> 50% всех 35 белков семейства EIL (рис. 8A; см. Дополнительную фигуру 4 онлайн), выделены желтым цветом, а те, которые имеют сходство с этими консервативными остатками, выделены бледно-желтым цветом. Аминокислотные остатки, консервативные в >30%, но <50% всех белков семейства EIL, выделены светло-синим и светло-оранжевым цветом (для различения появления разных остатков в одном и том же положении использовались два цвета).Зеленые символы — аминокислотные остатки, специфичные для членов семейства SLIM1; они консервативны в >80% (четыре белка) всех белков подсемейства SLIM1 (рис. 8А), но не обнаружены в других белках семейства EIL в соответствующих положениях.
Аминокислотные остатки, консервативные в >30%, но <50% всех белков семейства EIL, выделены светло-синим и светло-оранжевым цветом (для различения появления разных остатков в одном и том же положении использовались два цвета).Зеленые символы — аминокислотные остатки, специфичные для членов семейства SLIM1; они консервативны в >80% (четыре белка) всех белков подсемейства SLIM1 (рис. 8А), но не обнаружены в других белках семейства EIL в соответствующих положениях.
Рисунок 2.
Идентификация SLIM1 .
(A) Физическая карта расположения гена SLIM1 . Номера событий рекомбинации указаны ниже клонов ВАС.
(B) Положения аллелей slim1-1 , slim1-2 , slim1-3 и slim1-4 .Экзоны обозначены толстыми полосами. Черные и белые полосы обозначают кодирующие и непереведенные области соответственно.
(C) Выравнивание белков семейства SLIM1 и EIL в Arabidopsis . Выравнивание полных белковых последовательностей проводили с помощью программы ClustalW в банке данных ДНК Японии (DDBJ) (http://www.ddbj.nig.ac.jp/search/clustalw-j.html), а N-концевой консервативные области показаны на этом рисунке. Красные символы обозначают позиции slim1-1 , slim1-2 , slim1-3 , slim1-4 и ein3-3 .Предполагаемые ДНК-связывающие домены (от BD I до BD IV) подчеркнуты. Аминокислотные остатки, консервативные в> 50% всех 35 белков семейства EIL (рис. 8A; см. Дополнительную фигуру 4 онлайн), выделены желтым цветом, а те, которые имеют сходство с этими консервативными остатками, выделены бледно-желтым цветом. Аминокислотные остатки, консервативные в >30%, но <50% всех белков семейства EIL, выделены светло-синим и светло-оранжевым цветом (для различения появления разных остатков в одном и том же положении использовались два цвета).Зеленые символы — аминокислотные остатки, специфичные для членов семейства SLIM1; они консервативны в >80% (четыре белка) всех белков подсемейства SLIM1 (рис.
Выравнивание полных белковых последовательностей проводили с помощью программы ClustalW в банке данных ДНК Японии (DDBJ) (http://www.ddbj.nig.ac.jp/search/clustalw-j.html), а N-концевой консервативные области показаны на этом рисунке. Красные символы обозначают позиции slim1-1 , slim1-2 , slim1-3 , slim1-4 и ein3-3 .Предполагаемые ДНК-связывающие домены (от BD I до BD IV) подчеркнуты. Аминокислотные остатки, консервативные в> 50% всех 35 белков семейства EIL (рис. 8A; см. Дополнительную фигуру 4 онлайн), выделены желтым цветом, а те, которые имеют сходство с этими консервативными остатками, выделены бледно-желтым цветом. Аминокислотные остатки, консервативные в >30%, но <50% всех белков семейства EIL, выделены светло-синим и светло-оранжевым цветом (для различения появления разных остатков в одном и том же положении использовались два цвета).Зеленые символы — аминокислотные остатки, специфичные для членов семейства SLIM1; они консервативны в >80% (четыре белка) всех белков подсемейства SLIM1 (рис.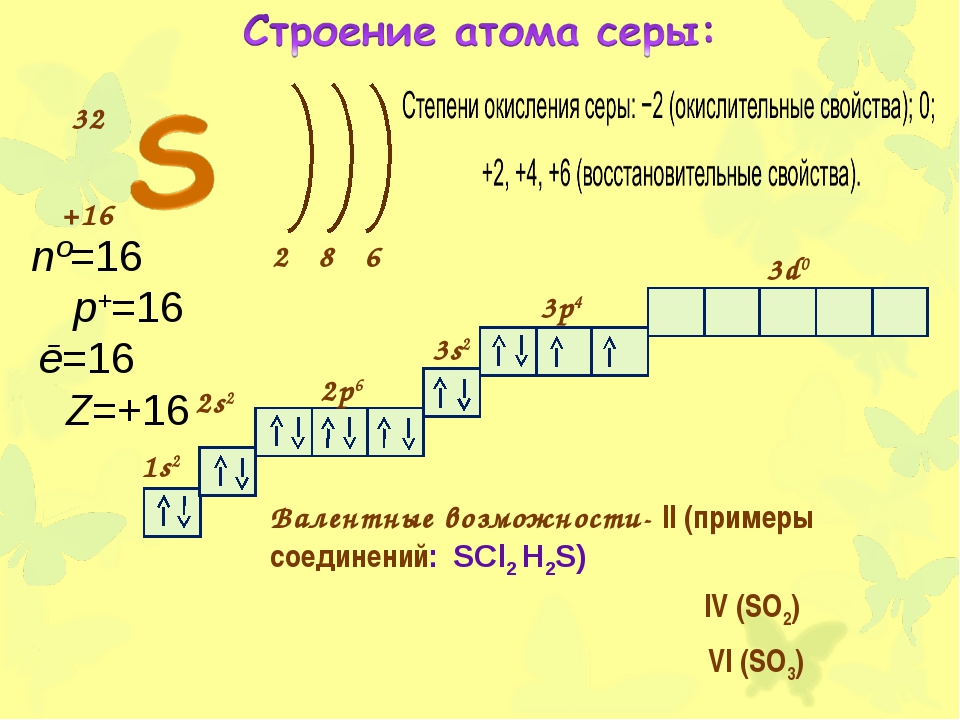 8А), но не обнаружены в других белках семейства EIL в соответствующих положениях.
8А), но не обнаружены в других белках семейства EIL в соответствующих положениях.
 3
3 , рис. 3.
Комплементация slim1 Мутанты SLIM1 Гиперэкспрессия. Кодирующая последовательность
SLIM1 была сверхэкспрессирована в мутантах slim1-1 и slim1-2 под промотором 35S CaMV ( 35S-SLIM1/slim1-1 и 35S-1SLIM29/slim1). Растения выращивали на средах S1500, S15 и S0 и контролировали флуоресценцию GFP, как показано на рисунке 1.
Рисунок 3.
Комплементация мутантов slim1 SLIM1 Сверхэкспрессия.Кодирующая последовательность
SLIM1 была сверхэкспрессирована в мутантах slim1-1 и slim1-2 под промотором 35S CaMV ( 35S-SLIM1/slim1-1 и 35S-1SLIM29/slim1). Растения выращивали на средах S1500, S15 и S0 и контролировали флуоресценцию GFP, как показано на рисунке 1.
). Экспрессия GFP из индикаторной конструкции ( P SULTR1;2 -GFP ) была восстановлена у обоих мутантов за счет сверхэкспрессии SLIM1 , установив функцию SLIM1 в –S-чувствительной регуляции SULTR1;2 (рис. 3).Экспрессия мРНК SULTR1;2 также была восстановлена у обоих мутантов за счет сверхэкспрессии SLIM1 (данные не показаны). мРНК SLIM1 экспрессировалась как в корнях, так и в побегах; однако на него не повлияли изменения условий содержания серы (см. Дополнительный рисунок 1 онлайн). Тканеспецифическую экспрессию SLIM1 исследовали в трансгенных растениях Arabidopsis , экспрессирующих GFP под контролем промотора SLIM1 ( P SLIM1 -GFP ).Сигналы GFP были преимущественно обнаружены в сосудистых тканях корней и гипокотилей (см. Дополнительную фигуру 2А онлайн). В корнях GFP экспрессировался в клетках паренхимы перицикла и ксилемы (см. Дополнительную фигуру 2B онлайн). Как и ожидалось, исходя из его функции в качестве фактора транскрипции, слитый белок GFP-SLIM1 был локализован исключительно в ядрах ( 35S-SLIM1-GFP ; см. дополнительные рисунки 2C и 2D в Интернете). На ядерную локализацию GFP-SLIM1 не влияла доступность серы (данные не показаны).
3).Экспрессия мРНК SULTR1;2 также была восстановлена у обоих мутантов за счет сверхэкспрессии SLIM1 (данные не показаны). мРНК SLIM1 экспрессировалась как в корнях, так и в побегах; однако на него не повлияли изменения условий содержания серы (см. Дополнительный рисунок 1 онлайн). Тканеспецифическую экспрессию SLIM1 исследовали в трансгенных растениях Arabidopsis , экспрессирующих GFP под контролем промотора SLIM1 ( P SLIM1 -GFP ).Сигналы GFP были преимущественно обнаружены в сосудистых тканях корней и гипокотилей (см. Дополнительную фигуру 2А онлайн). В корнях GFP экспрессировался в клетках паренхимы перицикла и ксилемы (см. Дополнительную фигуру 2B онлайн). Как и ожидалось, исходя из его функции в качестве фактора транскрипции, слитый белок GFP-SLIM1 был локализован исключительно в ядрах ( 35S-SLIM1-GFP ; см. дополнительные рисунки 2C и 2D в Интернете). На ядерную локализацию GFP-SLIM1 не влияла доступность серы (данные не показаны). SLIM1 Требуется для роста растений в среде –S SLIM1 играет важную роль в активации поглощения сульфатов и правильного роста в среде –S (Рисунок 4
SLIM1 Требуется для роста растений в среде –S SLIM1 играет важную роль в активации поглощения сульфатов и правильного роста в среде –S (Рисунок 4 Рисунок 4.
SLIM1 контролирует поглощение сульфатов и рост растений в –S. по SLIM1. Значения представлены как средние ± se ( n = 8). Звездочки указывают на статистически значимые различия (P < 0.05) между мутантами slim1 и трансгенными линиями со сверхэкспрессором SLIM1 (2 и 5 для фона slim1-1 и 1 для фона slim1-2 соответственно). НВ, свежий вес.
(B) Корневое удлинение под –S. Растения выращивали в вертикальном положении в течение 11 дней на агаризованной среде S0. Звездочками указано положение кончиков корней.
(C) Длина корней растений в (B) . Значения представлены как средние ± se ( n = 25). Звездочки указывают на статистически значимые различия (P < 0. 05) между мутантами slim1 и трансгенными линиями со сверхэкспрессором SLIM1 (2, 5 и 8 для slim1-1 и 1 и 6 для фона slim1-2 соответственно).
05) между мутантами slim1 и трансгенными линиями со сверхэкспрессором SLIM1 (2, 5 и 8 для slim1-1 и 1 и 6 для фона slim1-2 соответственно).
Рисунок 4.
SLIM1 Контролирует поглощение сульфатов и рост растений на –S.
(A) Высокоаффинное поглощение сульфатов контролируется SLIM1. Значения представлены как средние ± se ( n = 8). Звездочки указывают на статистически значимые различия (P <0,05) между мутантами slim1 и трансгенными линиями с гиперэкспрессором SLIM1 (2 и 5 для slim1-1 и 1 для фона slim1-2 соответственно).НВ, свежий вес.
(B) Корневое удлинение под –S. Растения выращивали в вертикальном положении в течение 11 дней на агаризованной среде S0. Звездочками указано положение кончиков корней.
(C) Длина корней растений в (B) . Значения представлены как средние ± se ( n = 25). Звездочки указывают на статистически значимые различия (P <0,05) между мутантами slim1 и трансгенными линиями с гиперэкспрессором SLIM1 (2, 5 и 8 для slim1-1 и 1 и 6 для фона slim1-2 соответственно).
 4B и 4C). Наблюдаемые дефекты роста были устранены путем сверхэкспрессии SLIM1 (рис. 4В и 4С). SLIM1 Регулирует S-чувствительные гены Для характеристики нижестоящих генов, на транскрипты которых влияет мутация slim1 , родительскую линию и мутанты slim1 выращивали на среде S15 (15 мкМ сульфат) или S1500 (1500 мкМ сульфат) в течение 10 дней, а их корневые РНК гибридизовали с Affymetrix. Массивы ATH-1 GeneChip (данные массива размещены на сайте www.ncbi.nlm.nih.gov/geo под регистрационным номером GSE4455). РНК получали из двух отдельных культур (a и b в дополнительной таблице 1 онлайн), чтобы иметь биологические дубликаты для каждой линии растений в условиях S15 и S1500 соответственно. Подробные процедуры анализа данных описаны в Методах. Вкратце, после нормализации для каждого чипа каждый ген нормализовали по уровню экспрессии этого гена в контрольном образце S1500. -S-чувствительные гены были отобраны из данных родительской линии с помощью теста Стьюдента t (граничное значение P: 0.
4B и 4C). Наблюдаемые дефекты роста были устранены путем сверхэкспрессии SLIM1 (рис. 4В и 4С). SLIM1 Регулирует S-чувствительные гены Для характеристики нижестоящих генов, на транскрипты которых влияет мутация slim1 , родительскую линию и мутанты slim1 выращивали на среде S15 (15 мкМ сульфат) или S1500 (1500 мкМ сульфат) в течение 10 дней, а их корневые РНК гибридизовали с Affymetrix. Массивы ATH-1 GeneChip (данные массива размещены на сайте www.ncbi.nlm.nih.gov/geo под регистрационным номером GSE4455). РНК получали из двух отдельных культур (a и b в дополнительной таблице 1 онлайн), чтобы иметь биологические дубликаты для каждой линии растений в условиях S15 и S1500 соответственно. Подробные процедуры анализа данных описаны в Методах. Вкратце, после нормализации для каждого чипа каждый ген нормализовали по уровню экспрессии этого гена в контрольном образце S1500. -S-чувствительные гены были отобраны из данных родительской линии с помощью теста Стьюдента t (граничное значение P: 0. 01). Нормализованные значения выборок S15 (соотношения S15/S1500) -S-чувствительных генов сравнивали между родительской линией и мутантами slim1 , чтобы выбрать SLIM1-зависимые гены, демонстрирующие статистически значимые различия при одностороннем дисперсионном анализе теста Бенджамини и Коррекция множественного тестирования Хохберга (коэффициент ложного обнаружения: 0,05) и апостериорный тест Тьюки. В дополнительной таблице 1 онлайн представлен список -S-чувствительных SLIM1-зависимых генов, выбранных в рамках этих статистических тестов.Рисунок 5A
01). Нормализованные значения выборок S15 (соотношения S15/S1500) -S-чувствительных генов сравнивали между родительской линией и мутантами slim1 , чтобы выбрать SLIM1-зависимые гены, демонстрирующие статистически значимые различия при одностороннем дисперсионном анализе теста Бенджамини и Коррекция множественного тестирования Хохберга (коэффициент ложного обнаружения: 0,05) и апостериорный тест Тьюки. В дополнительной таблице 1 онлайн представлен список -S-чувствительных SLIM1-зависимых генов, выбранных в рамках этих статистических тестов.Рисунок 5A Рисунок 5.
Профили транскриптома slim1 мутантов.
(A) Список –S-чувствительных SLIM1-зависимых генов. Гены были извлечены с помощью статистических тестов чувствительности к –S и зависимостей SLIM1, как описано в разделе «Методы». Нормализованные значения выборок S15 (соотношения S15:S1500) показаны как среднее геометрическое дублированных данных. Скорости -S-отзывчивой повышающей и понижающей регуляции транскриптов выделены красными и синими цветными индексами соответственно.
(B) Количественная оценка уровней транскриптов SLIM1-зависимых генов. ПЦР в реальном времени проводили с использованием геноспецифических праймеров (см. Дополнительную таблицу 6 онлайн). Серые и белые столбцы обозначают дублированные корневые РНК, полученные из 10-дневных проростков в условиях S1500 и S15 соответственно. Содержание мРНК нормализовали, используя убиквитин в качестве внутреннего стандарта.
Рисунок 5.
Профили транскриптомов slim1 Mutants.
(A) Список –S-чувствительных SLIM1-зависимых генов.Гены были извлечены с помощью статистических тестов чувствительности к –S и зависимостей SLIM1, как описано в разделе «Методы». Нормализованные значения выборок S15 (соотношения S15:S1500) показаны как среднее геометрическое дублированных данных. Скорости -S-отзывчивой повышающей и понижающей регуляции транскриптов выделены красными и синими цветными индексами соответственно.
(B) Количественная оценка уровней транскриптов SLIM1-зависимых генов. ПЦР в реальном времени проводили с использованием геноспецифических праймеров (см. Дополнительную таблицу 6 онлайн).Серые и белые столбцы обозначают дублированные корневые РНК, полученные из 10-дневных проростков в условиях S1500 и S15 соответственно. Содержание мРНК нормализовали, используя убиквитин в качестве внутреннего стандарта.
ПЦР в реальном времени проводили с использованием геноспецифических праймеров (см. Дополнительную таблицу 6 онлайн).Серые и белые столбцы обозначают дублированные корневые РНК, полученные из 10-дневных проростков в условиях S1500 и S15 соответственно. Содержание мРНК нормализовали, используя убиквитин в качестве внутреннего стандарта.
Результаты показали, что некоторые изоформы переносчиков сульфатов ( SULTR1;1 , SULTR1;2 , SULTR3;4 и SULTR4;2 ) активировались при ограничении содержания серы более значительно в родительской линии, чем в обеих группах. Мутанты slim1 (рис. 5А; см. дополнительную таблицу 1 онлайн). SULTR1;1 , SULTR1;2 и SULTR4;2 играют важную роль в приобретении и переносе сульфатов в среде –S (Takahashi et al., 2000; Vidmar et al., 2000; Shibagaki et al. , 2002; Yoshimoto et al., 2002; Kataoka et al., 2004b). Предполагается, что предполагаемая тиоглюкозидаза (At2g44460), проявляющая четкую реакцию -S и зависимость от SLIM1, участвует в гидролитической деградации глюкозинолатов для рециркуляции катаболической серы. Рядом с путями синтеза Cys, –S-индуцируемая изоформа Ser ацетилтрансферазы ( Serat3;1 ) (Kawashima et al., 2005) показали аналогичный профиль экспрессии. Кроме того, ответ дикого типа других -S-активированных генов с неизвестными функциями обычно отсутствовал у мутантов slim1 ; исключениями были белок семейства MS5 (At1g04770) и предполагаемая пектинэстераза (At3g10720). Изменения уровней транскриптов предполагаемой тиоглюкозидазы (At2g44460), SULTR1;1 , SULTR1;2 и SULTR4;2 были подтверждены количественной ОТ-ПЦР в реальном времени, демонстрирующей воспроизводимые профили экспрессии -S чувствительности и Зависимости SLIM1 (рис. 5B).
, 2002; Yoshimoto et al., 2002; Kataoka et al., 2004b). Предполагается, что предполагаемая тиоглюкозидаза (At2g44460), проявляющая четкую реакцию -S и зависимость от SLIM1, участвует в гидролитической деградации глюкозинолатов для рециркуляции катаболической серы. Рядом с путями синтеза Cys, –S-индуцируемая изоформа Ser ацетилтрансферазы ( Serat3;1 ) (Kawashima et al., 2005) показали аналогичный профиль экспрессии. Кроме того, ответ дикого типа других -S-активированных генов с неизвестными функциями обычно отсутствовал у мутантов slim1 ; исключениями были белок семейства MS5 (At1g04770) и предполагаемая пектинэстераза (At3g10720). Изменения уровней транскриптов предполагаемой тиоглюкозидазы (At2g44460), SULTR1;1 , SULTR1;2 и SULTR4;2 были подтверждены количественной ОТ-ПЦР в реальном времени, демонстрирующей воспроизводимые профили экспрессии -S чувствительности и Зависимости SLIM1 (рис. 5B).
Другой заметный сдвиг транскриптома в результате мутации slim1 наблюдался в синтезе глюкозинолатов. Они были подавлены ограничением серы более значительно в родительской линии, чем в мутантах slim1 (рис. 5А; см. дополнительную таблицу 1 онлайн). Метил(тио)алкилмалатсинтазы (MAM1 и MAML) и предполагаемая аминотрансфераза аминокислот с разветвленной цепью (At3g19710) для удлинения цепи Met (Field et al., 2004; Textor et al., 2004), цитохромы P450 для биосинтеза индолглюкозинолатов ( CYP79B2, CYP79B3 и CYP83B1) (Hull et al., 2000; Миккельсен и др., 2000; Бак и др., 2001; Hansen et al., 2001a) и Myb34 (ATR1), регулятор генов биосинтеза индолглюкозинолатов (Celenza et al., 2005), показали эти закономерности. Аденилилсульфаткиназа (AKN2), которая обеспечивает 3′-фосфоаденозин-5′-фосфосульфат для биосинтеза глюкозинолата, и фермент ассимиляции сульфата, АТФ-сульфурилаза (APS4), также были обнаружены в этой категории. При количественной оценке RT-PCR в реальном времени транскрипты предполагаемой аминотрансферазы аминокислот с разветвленной цепью (At3g19710), CYP79B2 и APS4 были снижены за счет мутаций slim1 в условиях S1500 (рис.
Они были подавлены ограничением серы более значительно в родительской линии, чем в мутантах slim1 (рис. 5А; см. дополнительную таблицу 1 онлайн). Метил(тио)алкилмалатсинтазы (MAM1 и MAML) и предполагаемая аминотрансфераза аминокислот с разветвленной цепью (At3g19710) для удлинения цепи Met (Field et al., 2004; Textor et al., 2004), цитохромы P450 для биосинтеза индолглюкозинолатов ( CYP79B2, CYP79B3 и CYP83B1) (Hull et al., 2000; Миккельсен и др., 2000; Бак и др., 2001; Hansen et al., 2001a) и Myb34 (ATR1), регулятор генов биосинтеза индолглюкозинолатов (Celenza et al., 2005), показали эти закономерности. Аденилилсульфаткиназа (AKN2), которая обеспечивает 3′-фосфоаденозин-5′-фосфосульфат для биосинтеза глюкозинолата, и фермент ассимиляции сульфата, АТФ-сульфурилаза (APS4), также были обнаружены в этой категории. При количественной оценке RT-PCR в реальном времени транскрипты предполагаемой аминотрансферазы аминокислот с разветвленной цепью (At3g19710), CYP79B2 и APS4 были снижены за счет мутаций slim1 в условиях S1500 (рис. 5B).Напротив, они были несколько более распространены у мутантов slim1 , чем у родительской линии в условиях S15 (рис. 5В). Кроме того, цитохром P450 CYP79F2, который катализирует образование альдоксима на пути биосинтеза глюкозинолатов, происходящих из Met с удлиненной цепью (Hansen et al., 2001b; Reintanz et al., 2001; Chen et al., 2003), регулировался под действием той же схеме (рис. 5В).
5B).Напротив, они были несколько более распространены у мутантов slim1 , чем у родительской линии в условиях S15 (рис. 5В). Кроме того, цитохром P450 CYP79F2, который катализирует образование альдоксима на пути биосинтеза глюкозинолатов, происходящих из Met с удлиненной цепью (Hansen et al., 2001b; Reintanz et al., 2001; Chen et al., 2003), регулировался под действием той же схеме (рис. 5В).
Стадия восстановления, катализируемая 5′-аденилилсульфатредуктазой (APR), важна для ассимиляции серы, и транскрипты для трех изоформ APR накапливаются в условиях –S (Gutierrez-Marcos et al., 1996; Сетя и др., 1996; Воклар и др., 2002). Данные этого микрочипа показали накопление S-чувствительных транскриптов APR2 и APR3 в родительской линии, хотя они в равной степени реагировали на ограничение по сере у мутантов slim1 (данные не показаны). Результаты, вероятно, указывают на то, что APR регулируется независимо от SLIM1.
Накопление метаболита в
slim1 Мутанты Метаболитный анализ подчеркнул заметный вклад SLIM1-опосредованной регуляции в ассимиляцию серы и метаболизм.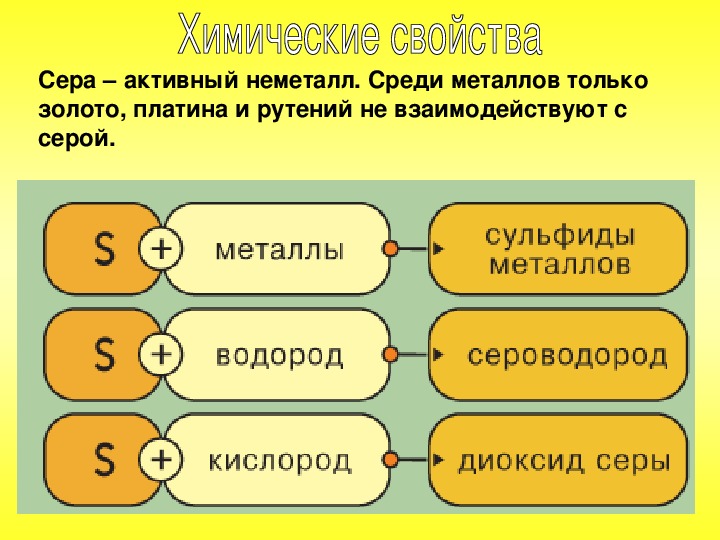 Сульфат, Cys, глутатион (GSH), Met и O -ацетилсерин (OAS) измеряли в родительской линии и мутантах slim1 , выращенных на средах S15 (15 мкМ сульфата) или S1500 (1500 мкМ сульфата) (рис. 6
Сульфат, Cys, глутатион (GSH), Met и O -ацетилсерин (OAS) измеряли в родительской линии и мутантах slim1 , выращенных на средах S15 (15 мкМ сульфата) или S1500 (1500 мкМ сульфата) (рис. 6 ). Рисунок 6.
Содержание сульфата и первичного метаболита серы в мутантах slim1 .
Растения выращивали в течение 10 дней в условиях S15 (15 мкМ сульфата) или S1500 (1500 мкМ сульфата). Звездочки указывают на статистически значимые различия (P < 0.05) между мутантами slim1 и родительской линией.
Рисунок 6.
Содержание сульфатов и первичных метаболитов серы в мутантах slim1 .
Растения выращивали в течение 10 дней в условиях S15 (15 мкМ сульфата) или S1500 (1500 мкМ сульфата). Средние значения ± se были рассчитаны из трех повторных экспериментов. Звездочками отмечены статистически значимые различия (P < 0,05) между мутантами slim1 и родительской линией.
). Наиболее существенные изменения наблюдались в содержании ОАС и GSH в побегах. По сравнению с родительской линией мутанты slim1 на среде S15 показали избыточное накопление OAS и значительное снижение GSH в побегах (рис. 6). В корнях содержание OAS было ниже у slim1-2 , чем у родительской линии в условиях S15 (рис. 6), но более суровые условия –S (S0) индуцировали более высокое накопление OAS у обоих мутантов slim1 (данные не показаны). ). При тех же условиях –S мутации slim1 и вызывали незначительное уменьшение и увеличение запасов сульфатов в побегах и корнях соответственно.Кроме того, содержание Cys было снижено, а содержание Met увеличено в побегах за счет мутаций slim1 в условиях S15. Влияние SLIM1-опосредованной регуляции на вторичный метаболизм серы оценивали путем измерения содержания глюкозинолатов (Рисунок 7
По сравнению с родительской линией мутанты slim1 на среде S15 показали избыточное накопление OAS и значительное снижение GSH в побегах (рис. 6). В корнях содержание OAS было ниже у slim1-2 , чем у родительской линии в условиях S15 (рис. 6), но более суровые условия –S (S0) индуцировали более высокое накопление OAS у обоих мутантов slim1 (данные не показаны). ). При тех же условиях –S мутации slim1 и вызывали незначительное уменьшение и увеличение запасов сульфатов в побегах и корнях соответственно.Кроме того, содержание Cys было снижено, а содержание Met увеличено в побегах за счет мутаций slim1 в условиях S15. Влияние SLIM1-опосредованной регуляции на вторичный метаболизм серы оценивали путем измерения содержания глюкозинолатов (Рисунок 7 Рисунок 7.
Содержание глюкозинолатов в мутантах slim1
(A) Профили метилсульфинилалкилглюкозинолатов, проанализированные с помощью жидкостной хроматографии-масс-спектрометрии На панелях показаны данные образцов побегов мутанта slim1-1 и родительского растения. Растения выращивали в течение 10 дней в условиях S15 (15 мкМ сульфата) или S1500 (1500 мкМ сульфата). Масс-хроматограммы ионов [MH] — для 4-метилсульфинилбутилглюкозинолата (4MSOB; отношение массы к заряду [ m/z ] = 436), 5-метилсульфинилпентилглюкозинолата (5MSOP; m/z = 450) , 6-метилсульфинилгексилглюкозинолат (6MSOH; m/z = 464), 7-метилсульфинилгептилглюкозинолат (7MSOH; m/z = 478) и 8-метилсульфинилоктилглюкозинолат (8MSOO; m/z = 4) наложены в одних и тех же масштабах.Положения 4MSOB, 5MSOP, 6MSOH, 7MSOH и 8MSOO указаны красными стрелками.
Растения выращивали в течение 10 дней в условиях S15 (15 мкМ сульфата) или S1500 (1500 мкМ сульфата). Масс-хроматограммы ионов [MH] — для 4-метилсульфинилбутилглюкозинолата (4MSOB; отношение массы к заряду [ m/z ] = 436), 5-метилсульфинилпентилглюкозинолата (5MSOP; m/z = 450) , 6-метилсульфинилгексилглюкозинолат (6MSOH; m/z = 464), 7-метилсульфинилгептилглюкозинолат (7MSOH; m/z = 478) и 8-метилсульфинилоктилглюкозинолат (8MSOO; m/z = 4) наложены в одних и тех же масштабах.Положения 4MSOB, 5MSOP, 6MSOH, 7MSOH и 8MSOO указаны красными стрелками.
(B) Содержание метилсульфинилалкила (MSOX), метилтиоалкила (MTX) и производного Trp индолглюкозинолата slim1 мутантов. Растения выращивали и анализировали, как в (А) . Средние значения ± se были рассчитаны из трех повторных экспериментов. Статистически значимые различия (P <0,05) между мутантами slim1 и родительской линией показаны звездочками справа от столбцов для каждого соединения MSOX, MTX и индолглюкозинолатов. I3M, индол-3-илметилглюкозинолат; 1MI, 1-метоксииндол-3-илметилглюкозинолат; 4MSOB, 4-метилсульфинилбутилглюкозинолат; 5MSOP, 5-метилсульфинилпентилглюкозинолат; 6MSOH, 6-метилсульфинилгексилглюкозинолат; 7MSOH, 7-метилсульфинилгептилглюкозинолат; 8MSOO, 8-метилсульфинилоктилглюкозинолат; 4MTB, 4-метилтиобутилглюкозинолат; 5MTP, 5-метилтиопентилглюкозинолат; 6МТГ, 6-метилтиогексилглюкозинолат; 7МТГ, 7-метилтиогептилглюкозинолат; 8МТО, 8-метилтиооктилглюкозинолат.
I3M, индол-3-илметилглюкозинолат; 1MI, 1-метоксииндол-3-илметилглюкозинолат; 4MSOB, 4-метилсульфинилбутилглюкозинолат; 5MSOP, 5-метилсульфинилпентилглюкозинолат; 6MSOH, 6-метилсульфинилгексилглюкозинолат; 7MSOH, 7-метилсульфинилгептилглюкозинолат; 8MSOO, 8-метилсульфинилоктилглюкозинолат; 4MTB, 4-метилтиобутилглюкозинолат; 5MTP, 5-метилтиопентилглюкозинолат; 6МТГ, 6-метилтиогексилглюкозинолат; 7МТГ, 7-метилтиогептилглюкозинолат; 8МТО, 8-метилтиооктилглюкозинолат.
Рисунок 7.
Содержание глюкозинолатов в мутантах slim1 .
(A) Профили метилсульфинилалкилглюкозинолатов, проанализированные с помощью жидкостной хроматографии-масс-спектрометрии. На панелях показаны данные образцов побегов slim1-1 мутанта и родительского растения. Растения выращивали в течение 10 дней в условиях S15 (15 мкМ сульфата) или S1500 (1500 мкМ сульфата). Масс-хроматограммы ионов [MH] — для 4-метилсульфинилбутилглюкозинолата (4MSOB; отношение массы к заряду [ m/z ] = 436), 5-метилсульфинилпентилглюкозинолата (5MSOP; m/z = 450) , 6-метилсульфинилгексилглюкозинолат (6MSOH; m/z = 464), 7-метилсульфинилгептилглюкозинолат (7MSOH; m/z = 478) и 8-метилсульфинилоктилглюкозинолат (8MSOO; m/z = 4) наложены в одних и тех же масштабах. Положения 4MSOB, 5MSOP, 6MSOH, 7MSOH и 8MSOO указаны красными стрелками.
Положения 4MSOB, 5MSOP, 6MSOH, 7MSOH и 8MSOO указаны красными стрелками.
(B) Содержание метилсульфинилалкила (MSOX), метилтиоалкила (MTX) и производного Trp индолглюкозинолата slim1 мутантов. Растения выращивали и анализировали, как в (А) . Средние значения ± se были рассчитаны из трех повторных экспериментов. Статистически значимые различия (P <0,05) между мутантами slim1 и родительской линией показаны звездочками справа от столбцов для каждого соединения MSOX, MTX и индолглюкозинолатов.I3M, индол-3-илметилглюкозинолат; 1MI, 1-метоксииндол-3-илметилглюкозинолат; 4MSOB, 4-метилсульфинилбутилглюкозинолат; 5MSOP, 5-метилсульфинилпентилглюкозинолат; 6MSOH, 6-метилсульфинилгексилглюкозинолат; 7MSOH, 7-метилсульфинилгептилглюкозинолат; 8MSOO, 8-метилсульфинилоктилглюкозинолат; 4MTB, 4-метилтиобутилглюкозинолат; 5MTP, 5-метилтиопентилглюкозинолат; 6МТГ, 6-метилтиогексилглюкозинолат; 7МТГ, 7-метилтиогептилглюкозинолат; 8МТО, 8-метилтиооктилглюкозинолат.
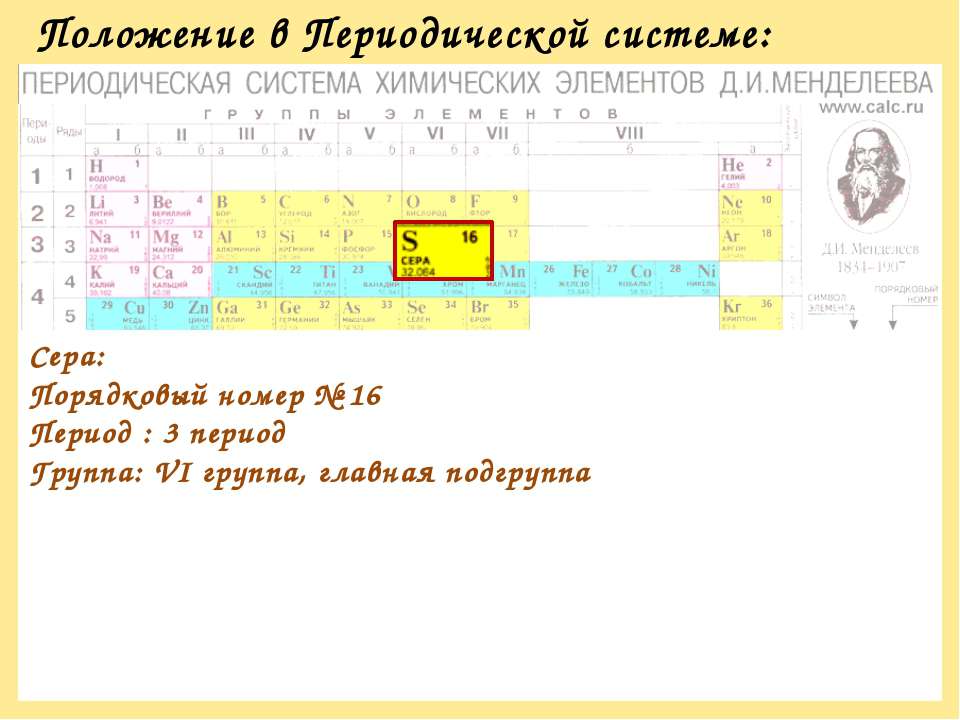 7В).
7В).Белки SLIM1 функционально отличаются от других EIL
В геноме Arabidopsis шесть генов аннотированы для кодирования белков семейства EIL (от EIN3 и от EIL1 до EIL5) (рис. 2B и 8A, рис. 8.
SLIM1 выполняет уникальную функцию в семействе EIL.
(A) Филогенетические взаимоотношения белков семейства SLIM1 и EIL. Белки Arabidopsis и SLIM1 риса выделены зеленым цветом. Arabidopsis EIN3, EIL1 и EIL2, которые опосредуют реакцию на этилен, выделены желтым цветом. Arabidopsis Белки семейств SLIM1 и EIL обозначены их кодами инициативы Arabidopsis Genome Initiative. Номера локусов EIL риса указаны в соответствии с базами данных Rice Annotation Project (RAP) и Института геномных исследований (TIGR) соответственно.Остальные члены обозначены инвентарными номерами белковых последовательностей. Значения начальной загрузки показаны в узлах дерева красными символами.
(B) Реакция лимитирования серы индикатора P SULTR1;2 -GFP была восстановлена с помощью промотора CaMV 35S сверхэкспрессии Arabidopsis SLIM1 и его гомологов риса, Os SLIM01;1;1 ТОНКИЙ1;2 . Растения выращивали на агаровой среде S1500 или S0, а флуоресценцию GFP контролировали, как показано на рисунке 1.Интенсивность флуоресценции родительской линии на S0 описывается как 100. В каждом столбце указаны независимые трансгенные или мутантные линии. Представлены средние значения ± se ( n = 3) для каждой линии.
Растения выращивали на агаровой среде S1500 или S0, а флуоресценцию GFP контролировали, как показано на рисунке 1.Интенсивность флуоресценции родительской линии на S0 описывается как 100. В каждом столбце указаны независимые трансгенные или мутантные линии. Представлены средние значения ± se ( n = 3) для каждой линии.
Рис. 8.
SLIM1 Выполняет уникальную функцию в семействе EIL.
(A) Филогенетические взаимоотношения белков семейства SLIM1 и EIL. Белки Arabidopsis и SLIM1 риса выделены зеленым цветом. Arabidopsis EIN3, EIL1 и EIL2, которые опосредуют реакцию на этилен, выделены желтым цветом. Arabidopsis Белки семейств SLIM1 и EIL обозначены их кодами инициативы Arabidopsis Genome Initiative. Номера локусов EIL риса указаны в соответствии с базами данных Rice Annotation Project (RAP) и Института геномных исследований (TIGR) соответственно. Остальные члены обозначены инвентарными номерами белковых последовательностей. Значения начальной загрузки показаны в узлах дерева красными символами.
Значения начальной загрузки показаны в узлах дерева красными символами.
(B) Реакция лимитирования серы индикатора P SULTR1;2 -GFP была восстановлена с помощью промотора CaMV 35S сверхэкспрессии Arabidopsis SLIM1 и его гомологов риса, Os SLIM01;1;1 ТОНКИЙ1;2 .Растения выращивали на агаровой среде S1500 или S0 и контролировали флуоресценцию GFP, как показано на фиг. 1. Интенсивность флуоресценции родительской линии на S0 описывается как 100. В каждом столбце указаны независимые трансгенные или мутантные линии. Представлены средние значения ± se ( n = 3) для каждой линии.
; Го и Экер, 2004). EIN3 является фактором транскрипции, контролирующим экспрессию генов, чувствительных к этилену, а EIL1 и EIL2 являются ближайшими функциональными гомологами EIN3 (Chao et al., 1997; Solano et al., 1998; Го и Экер, 2004). Напротив, функции EIL3 (SLIM1), EIL4 и EIL5 еще не проверены (Guo and Ecker, 2004). Чтобы оценить, является ли SLIM1 единственной формой, специализирующейся на ответе на серу, другие члены семейства EIL из Arabidopsis , EIN3 , EIL2 , EIL4 и EIL5 были сверхэкспрессированы в slim1-1 -2 мутантов. Результаты ясно показали, что SLIM1 является единственной формой, способной восстанавливать -S-чувствительную экспрессию GFP из индикаторной конструкции P SULTR1;2 -GFP в фонах slim1 (рис. 8B).Ни один из других белков EIL Arabidopsis не проявлял такой же функции (фиг. 8B).
Результаты ясно показали, что SLIM1 является единственной формой, способной восстанавливать -S-чувствительную экспрессию GFP из индикаторной конструкции P SULTR1;2 -GFP в фонах slim1 (рис. 8B).Ни один из других белков EIL Arabidopsis не проявлял такой же функции (фиг. 8B). Выравнивание и филогенетический анализ белков семейства EIL показали, что белки SLIM1 повсеместно встречаются в царстве растений (рис. 8А). Arabidopsis SLIM1, два гомолога риса ( Oryza sativa ), Os SLIM1;1 и Os SLIM1;2, и белки петунии ( Petunia hybrida ) и Fagus sylvatica сформировали уникальную ветвь, которую можно отличить от других члены группы (рис. 8А).Os SLIM1;1 и Os SLIM1;2 сверхэкспрессировались в мутантах slim1 , и была продемонстрирована способность восстанавливать экспрессию GFP из индикаторной конструкции P SULTR1;2 -GFP в Arabidopsis. в ответ на ограничение серы (рис. 8B). Эти результаты убедительно свидетельствуют о том, что белки в подгруппе SLIM1/EIL3 функционально отличаются от других членов семейства EIL, опосредующих реакцию на этилен, и могут иметь уникальные функции в регуляции реакции на серу у различных видов растений.
8B). Эти результаты убедительно свидетельствуют о том, что белки в подгруппе SLIM1/EIL3 функционально отличаются от других членов семейства EIL, опосредующих реакцию на этилен, и могут иметь уникальные функции в регуляции реакции на серу у различных видов растений.
ОБСУЖДЕНИЕ
Значение SLIM1 в реакции растений на серу
В этом исследовании мы идентифицировали транскрипционный фактор SLIM1, который регулирует основные пути поглощения и метаболизма сульфатов в среде –S в корнях Arabidopsis . Насколько нам известно, это первое сообщение об идентификации транскрипционного фактора, регулирующего ассимиляционный метаболизм серы у высших растений. Значимость функции SLIM1 подтверждается его способностью контролировать экспрессию переносчика сульфата SULTR1;2, основного фактора, способствующего поглощению сульфата в корнях Arabidopsis .SLIM1 был необходим для -S-чувствительной индукции транскриптов SULTR1;2 , что приводило к значительному увеличению активности поглощения сульфатов с высоким сродством, что в конечном итоге способствовало поддержанию роста растений на -S.
Система транспорта сульфатов с высоким сродством преобладает в среде –S для эффективного поглощения сульфата из почвы. Этот феномен хорошо охарактеризован классическими физиологическими экспериментами (Clarkson et al., 1983; Deane-Drummond, 1987).Более поздние молекулярно-биологические исследования показали, что эта -S-индуцируемая транспортная система может быть связана с функцией двух генов переносчиков сульфатов, SULTR1;1 и SULTR1;2 , у Arabidopsis (Takahashi et al., 2000; Vidmar et al., 2000; Shibagaki et al., 2002; Yoshimoto et al., 2002). Подобные индуцибельные переносчики сульфатов существуют и у других видов растений (Smith et al., 1995, 1997; Vidmar et al., 1999; Howarth et al., 2003; Buchner et al., 2004a, 2004b; Hopkins et al., 2005). Исследования устойчивого к селенату мутанта и нокаута Т-ДНК гена SULTR1;2 дополнительно подтвердили, что высокоаффинный переносчик сульфата SULTR1;2 преимущественно опосредует эту –S-индуцируемую транспортную систему в корнях Arabidopsis (Shibagaki et al. ., 2002; Маруяма-Накашита и др., 2003). Кроме того, исследования экспрессии генов с конструкциями промотор-репортер показали, что и SULTR1;1 , и SULTR1;2 регулируются своими –S-чувствительными промоторами в ответ на питание серой (Maruyama-Nakashita et al., 2004а, 2004б). По крайней мере, для SULTR1;1 идентификация чувствительного к сере цис -действующего элемента, SURE, в его 5′-области подтверждает важность регуляции транскрипции при ответе на серу (Maruyama-Nakashita et al., 2005). Эти результаты указывают на существование транс -действующих регуляторных белков, контролирующих экспрессию генов высокоаффинных переносчиков сульфатов у Arabidopsis .
., 2002; Маруяма-Накашита и др., 2003). Кроме того, исследования экспрессии генов с конструкциями промотор-репортер показали, что и SULTR1;1 , и SULTR1;2 регулируются своими –S-чувствительными промоторами в ответ на питание серой (Maruyama-Nakashita et al., 2004а, 2004б). По крайней мере, для SULTR1;1 идентификация чувствительного к сере цис -действующего элемента, SURE, в его 5′-области подтверждает важность регуляции транскрипции при ответе на серу (Maruyama-Nakashita et al., 2005). Эти результаты указывают на существование транс -действующих регуляторных белков, контролирующих экспрессию генов высокоаффинных переносчиков сульфатов у Arabidopsis .
Стратегия, которую мы использовали здесь для скрининга регуляторных белков, использует слитую генную конструкцию промотор-GFP SULTR1;2 (Maruyama-Nakashita et al., 2004б). При использовании этого метода репортерная активность (т. е. флуоресценция GFP) фенокопирует обилие транскриптов SULTR1;2 , что, в свою очередь, отражает активность поглощения сульфата корнями Arabidopsis . Мутант slim1 , описанный в этой работе, демонстрирует полезность этой стратегии для идентификации метаболических мутантов, которые имеют тенденцию иметь тонкие различия морфологических фенотипов и жизнеспособности. На самом деле, мы обнаружили, что рост мутантов slim1 нарушается в тяжелых условиях –S, демонстрируя 30% уменьшение длины их корней и 60% снижение скорости поглощения сульфата (рис. 4).Как следует из этих характеристик мутантов slim1 , транскрипционный фактор SLIM1 важен для регуляции захвата и ассимиляции сульфатов (Рис. 4 и 5). С методологической точки зрения такие метаболические или биохимические фенотипы, связанные с изменениями метаболизма и процессов транспорта питательных веществ, можно измерить только путем тщательной оценки установленных мутантных линий. С другой стороны, первоначальные настройки скрининга мутантов должны быть простыми и достаточно прослеживаемыми, чтобы сообщать о метаболических изменениях мутантных кандидатов из растений дикого типа.
Мутант slim1 , описанный в этой работе, демонстрирует полезность этой стратегии для идентификации метаболических мутантов, которые имеют тенденцию иметь тонкие различия морфологических фенотипов и жизнеспособности. На самом деле, мы обнаружили, что рост мутантов slim1 нарушается в тяжелых условиях –S, демонстрируя 30% уменьшение длины их корней и 60% снижение скорости поглощения сульфата (рис. 4).Как следует из этих характеристик мутантов slim1 , транскрипционный фактор SLIM1 важен для регуляции захвата и ассимиляции сульфатов (Рис. 4 и 5). С методологической точки зрения такие метаболические или биохимические фенотипы, связанные с изменениями метаболизма и процессов транспорта питательных веществ, можно измерить только путем тщательной оценки установленных мутантных линий. С другой стороны, первоначальные настройки скрининга мутантов должны быть простыми и достаточно прослеживаемыми, чтобы сообщать о метаболических изменениях мутантных кандидатов из растений дикого типа. В этой работе мы использовали систему флуоресцентной визуализации, чтобы решить эту проблему, и в конечном итоге определили функцию SLIM1 , который представляет собой транскрипционный фактор, играющий важную роль в регуляции поглощения сульфатов и метаболизма у высших растений.
В этой работе мы использовали систему флуоресцентной визуализации, чтобы решить эту проблему, и в конечном итоге определили функцию SLIM1 , который представляет собой транскрипционный фактор, играющий важную роль в регуляции поглощения сульфатов и метаболизма у высших растений.
SLIM1, уникальный белок семейства EIL, контролирующий метаболизм серы
Семейство Arabidopsis EIL состоит из шести отдельных членов (EIN3 и от EIL1 до EIL5) (рис. 8A; Guo and Ecker, 2004).Функции EIN3 и EIL1 были тщательно изучены для контроля генов, чувствительных к этилену, у Arabidopsis (Chao et al., 1997; Solano et al., 1998; Guo and Ecker, 2004). EIN3 является членом, функция которого впервые была охарактеризована нечувствительными к этилену фенотипами мутантов ein3 (Chao et al., 1997). EIL1 и EIL2 являются ближайшими гомологами EIN3 (рис. 8B) и способны дополнять фенотип мутанта ein3 (Chao et al., 1997). Совсем недавно функциональная избыточность EIL1 с EIN3 была доказана генетически (Alonso et al., 2003). Молекулярные исследования чувствительных к этилену промоторных элементов позволяют предположить, что EIN3, EIL1 и EIL2, но не EIL3, могут связываться с расположенной выше EIN3-связывающей последовательностью в чувствительном к этилену гене ERF1 (Solano et al., 1998). Исходя из этих наблюдений, функции EIL3/SLIM1, EIL4 и EIL5 до сих пор неясны в отношении того, участвуют ли они в ответе на этилен или в совершенно несвязанных путях (Guo and Ecker, 2004).
Совсем недавно функциональная избыточность EIL1 с EIN3 была доказана генетически (Alonso et al., 2003). Молекулярные исследования чувствительных к этилену промоторных элементов позволяют предположить, что EIN3, EIL1 и EIL2, но не EIL3, могут связываться с расположенной выше EIN3-связывающей последовательностью в чувствительном к этилену гене ERF1 (Solano et al., 1998). Исходя из этих наблюдений, функции EIL3/SLIM1, EIL4 и EIL5 до сих пор неясны в отношении того, участвуют ли они в ответе на этилен или в совершенно несвязанных путях (Guo and Ecker, 2004).
Эта работа подтвердила, что EIL3, переименованный в SLIM1 в соответствии с его функциональностью, выполняет специфическую функцию в регуляции поглощения сульфатов и метаболизма у Arabidopsis . SLIM1, но никакие другие белки EIL из Arabidopsis , был способен восстанавливать невосприимчивые к ограничению серы фенотипы мутантов slim1 (фиг. 8B). Соответственно, предполагается, что SLIM1 специализируется на реакции на серу. Фактически, отсутствие EIL3 в реакции на этилен (Solano et al., 1998; Guo and Ecker, 2004) указывало на его особую функцию.Кроме того, -S-чувствительные SLIM1-зависимые гены (рис. 5A) не регулировались обработкой 1-аминоциклопропан-1-карбоновой кислотой (см. Дополнительную фигуру 3 онлайн), что позволяет предположить, что SLIM1-опосредованная регуляция может быть отделена от сигнальных путей этилена. . Далее мы продемонстрировали, что гомологи SLIM1 из риса могут дополнять мутанты Arabidopsis slim1 , предполагая их функциональную идентичность с продуктом гена SLIM1 Arabidopsis в регуляции (рис. 8).Это дополнительно подчеркивает значение этой новой функциональной категории белков семейства EIL и предполагает общность их функций в ответе растений на серу как у двудольных, так и у однодольных видов растений. Вопреки генетически подтвержденным данным, показывающим ее значение в ответе на серу, мРНК SLIM1 сама по себе не модулировалась изменениями условий серы (см.
Фактически, отсутствие EIL3 в реакции на этилен (Solano et al., 1998; Guo and Ecker, 2004) указывало на его особую функцию.Кроме того, -S-чувствительные SLIM1-зависимые гены (рис. 5A) не регулировались обработкой 1-аминоциклопропан-1-карбоновой кислотой (см. Дополнительную фигуру 3 онлайн), что позволяет предположить, что SLIM1-опосредованная регуляция может быть отделена от сигнальных путей этилена. . Далее мы продемонстрировали, что гомологи SLIM1 из риса могут дополнять мутанты Arabidopsis slim1 , предполагая их функциональную идентичность с продуктом гена SLIM1 Arabidopsis в регуляции (рис. 8).Это дополнительно подчеркивает значение этой новой функциональной категории белков семейства EIL и предполагает общность их функций в ответе растений на серу как у двудольных, так и у однодольных видов растений. Вопреки генетически подтвержденным данным, показывающим ее значение в ответе на серу, мРНК SLIM1 сама по себе не модулировалась изменениями условий серы (см.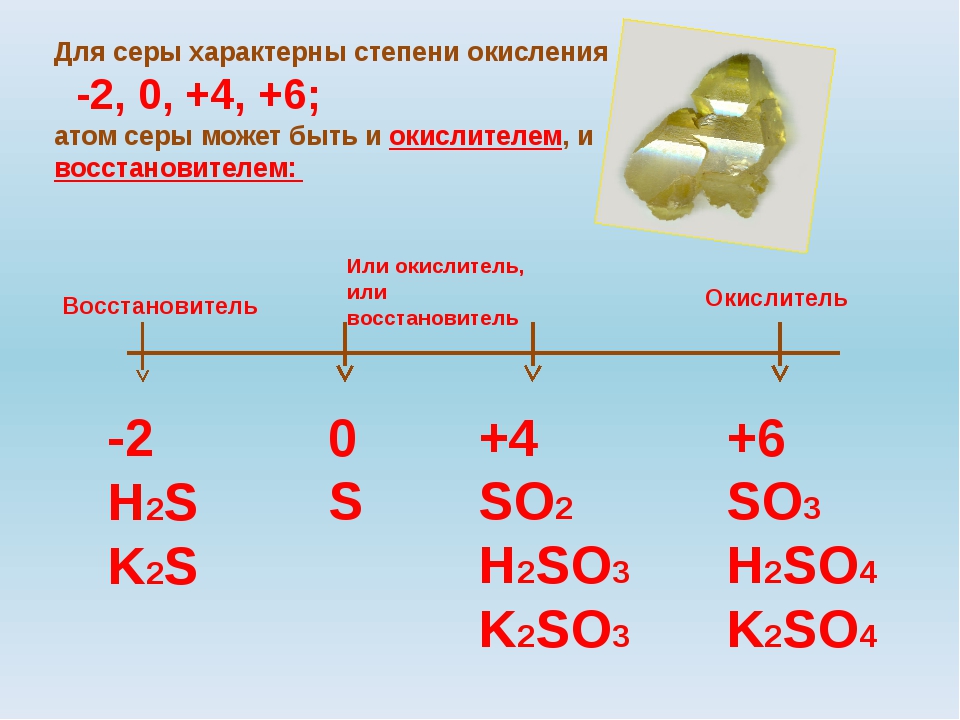 Дополнительную фигуру 1 онлайн). Предположительно, для регуляции SLIM1 может потребоваться посттранскрипционный механизм, как и в случае EIN3, уровень белка которого строго регулируется статусом этилена и углерода (Guo and Ecker, 2003; Potuschak et al., 2003; Янагисава и др., 2003). Однако, в отличие от случая с EIN3, на ядерную локализацию белка GFP-SLIM1 не влияли условия содержания серы (данные не показаны). Необходимы дальнейшие исследования для изучения посттранскрипционной модификации его функций в среде –S.
Дополнительную фигуру 1 онлайн). Предположительно, для регуляции SLIM1 может потребоваться посттранскрипционный механизм, как и в случае EIN3, уровень белка которого строго регулируется статусом этилена и углерода (Guo and Ecker, 2003; Potuschak et al., 2003; Янагисава и др., 2003). Однако, в отличие от случая с EIN3, на ядерную локализацию белка GFP-SLIM1 не влияли условия содержания серы (данные не показаны). Необходимы дальнейшие исследования для изучения посттранскрипционной модификации его функций в среде –S.
В недавнем исследовании сообщалось, что синтетические олигонуклеотиды, разработанные для консервативной последовательности связывания EIL, AYGWAYCT (Solano et al., 1998; Kosugi and Ohashi, 2000), были способны взаимодействовать с синтезированным in vitro Ser-162 в Gln-288. области, включая предполагаемые ДНК-связывающие домены III и IV EIL3 (Yamasaki et al., 2005). Это контрастирует с предыдущими данными, показывающими неспособность белка EIL3 связываться с соответствующими нуклеотидными последовательностями в промоторе гена ERF1 (Solano et al. , 1998). Связывание EIL3 с этой консервативной последовательностью может быть нестабильным, так как его можно обнаружить только с помощью поверхностного плазмонного резонанса, но не с помощью анализа сдвига электромобильности (Yamasaki et al., 2005). Различия в кинетике связывания могут подразумевать различную функцию SLIM1/EIL3 в регуляции транскрипции, отделенную от путей передачи сигналов этилена.Мы искали наличие этой консервативной последовательности связывания EIL в вышестоящих областях -S-чувствительных генов, классифицированных в анализе транскриптома (рис. 5А). Последовательности AYGWAYCT чаще всего обнаруживались в SLIM1-зависимых генах, уровни транскриптов которых в родительской линии были выше в S15, чем в S1500 (см. Дополнительную таблицу 2 онлайн). Судя, по крайней мере, по частотам предполагаемых последовательностей связывания SLIM1 в вышестоящих областях, роль SLIM1 в регуляции транскрипции, вероятно, ограничивается -S-отзывчивой активацией.Предполагаемые последовательности связывания присутствовали в SULTR4;2 , но отсутствовали в SULTR1;1 и SULTR1;2 (см.
, 1998). Связывание EIL3 с этой консервативной последовательностью может быть нестабильным, так как его можно обнаружить только с помощью поверхностного плазмонного резонанса, но не с помощью анализа сдвига электромобильности (Yamasaki et al., 2005). Различия в кинетике связывания могут подразумевать различную функцию SLIM1/EIL3 в регуляции транскрипции, отделенную от путей передачи сигналов этилена.Мы искали наличие этой консервативной последовательности связывания EIL в вышестоящих областях -S-чувствительных генов, классифицированных в анализе транскриптома (рис. 5А). Последовательности AYGWAYCT чаще всего обнаруживались в SLIM1-зависимых генах, уровни транскриптов которых в родительской линии были выше в S15, чем в S1500 (см. Дополнительную таблицу 2 онлайн). Судя, по крайней мере, по частотам предполагаемых последовательностей связывания SLIM1 в вышестоящих областях, роль SLIM1 в регуляции транскрипции, вероятно, ограничивается -S-отзывчивой активацией.Предполагаемые последовательности связывания присутствовали в SULTR4;2 , но отсутствовали в SULTR1;1 и SULTR1;2 (см. Дополнительную таблицу 3 онлайн). Гены без консервативных связывающих последовательностей, но демонстрирующие явную SLIM1-зависимую экспрессию, такие как SULTR1;1 и SULTR1;2 , по-видимому, нуждаются в дополнительных регуляторных элементах ниже SLIM1 для немедленной активации экспрессии их генов в условиях –S. Фактически, SLIM1 преимущественно экспрессировался в сосудах (см. Дополнительную фигуру 2 онлайн), что позволяет предположить, что горизонтальная передача сигнала станет необходимой для индукции экспрессии переносчиков сульфата с высоким сродством, которые локализуются в поверхностных клеточных слоях корней.Пространственная локализация SLIM1 предполагает, что, по крайней мере, для регуляции, опосредованной SLIM1 , статус серы в первую очередь определяется в центральной сосудистой области растений, а не на поверхности корня, где транспортер сульфата SULTR1;2 присутствует и находится в прямой контакт с почвенной средой (Yoshimoto et al.
Дополнительную таблицу 3 онлайн). Гены без консервативных связывающих последовательностей, но демонстрирующие явную SLIM1-зависимую экспрессию, такие как SULTR1;1 и SULTR1;2 , по-видимому, нуждаются в дополнительных регуляторных элементах ниже SLIM1 для немедленной активации экспрессии их генов в условиях –S. Фактически, SLIM1 преимущественно экспрессировался в сосудах (см. Дополнительную фигуру 2 онлайн), что позволяет предположить, что горизонтальная передача сигнала станет необходимой для индукции экспрессии переносчиков сульфата с высоким сродством, которые локализуются в поверхностных клеточных слоях корней.Пространственная локализация SLIM1 предполагает, что, по крайней мере, для регуляции, опосредованной SLIM1 , статус серы в первую очередь определяется в центральной сосудистой области растений, а не на поверхности корня, где транспортер сульфата SULTR1;2 присутствует и находится в прямой контакт с почвенной средой (Yoshimoto et al. , 2002). Идентификация непосредственных мишеней SLIM1 и нижестоящих молекул, передающих сигналы от сосудистой сети к эпидермису, требует дальнейшего изучения.
, 2002). Идентификация непосредственных мишеней SLIM1 и нижестоящих молекул, передающих сигналы от сосудистой сети к эпидермису, требует дальнейшего изучения.
SLIM1 контролирует метаболизм серы
Данные транскриптома ясно показали, что SLIM1 функционирует как регуляторный белок-хаб, универсально участвующий в регуляции -S-чувствительных генов, которые играют важную роль в оптимизации транспорта и внутреннего использования сульфата в Arabidopsis (рис. 5). Как показано на метаболических путях на Рис. 9Рис. 9.
SLIM1-опосредованная регуляция ассимиляции серы и метаболизма глюкозинолатов.
SLIM1-зависимые гены выделены цветовыми индексами, как на рисунке 5A. Красный и синий указывают на SLIM1-зависимые пути, регулируемые положительно и отрицательно, соответственно, ограничением серы. AKN2, 5’аденилилсульфаткиназа; APR, 5’аденилилсульфатредуктаза; APS4, АТФ-сульфурилаза; BCAT, аминотрансфераза аминокислот с разветвленной цепью; CS, Цис-синтаза; CYP, цитохром Р450; MAM, метил(тио)алкилмалатсинтаза; Serat, Ser ацетилтрансфераза; SIR, сульфитредуктаза; SOT, десульфоглюкозинолатсульфотрансфераза; SULTR, переносчик сульфатов; UGT74B1, UDP-глюкоза: тиогидроксимовая кислота S -глюкозилтрансфераза; АПС, аденозин-5′-фосфосульфат; PAPS, 3′-фосфоаденозин-5′-фосфосульфат.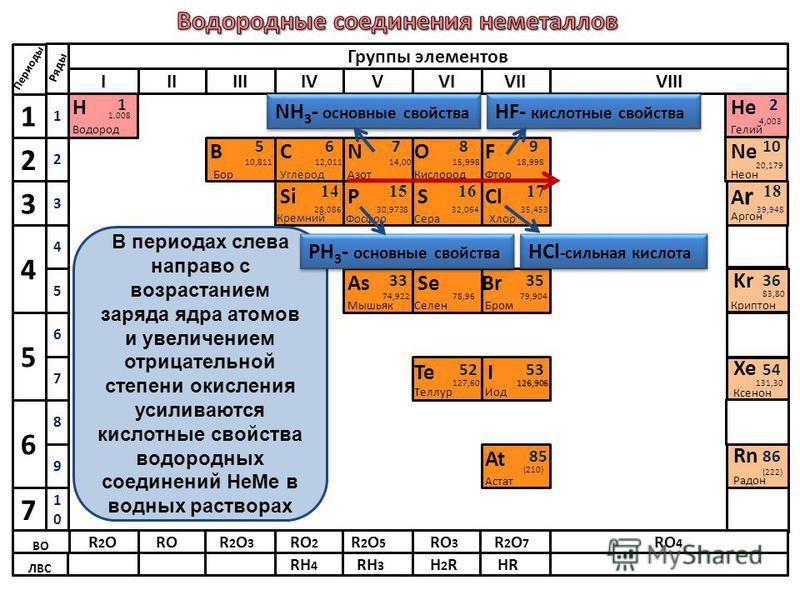
Рисунок 9.
SLIM1-опосредованная регуляция ассимиляции серы и метаболизма глюкозинолатов.
SLIM1-зависимые гены выделены цветовыми индексами, как на рисунке 5A. Красный и синий указывают на SLIM1-зависимые пути, регулируемые положительно и отрицательно, соответственно, ограничением серы. AKN2, 5’аденилилсульфаткиназа; APR, 5’аденилилсульфатредуктаза; APS4, АТФ-сульфурилаза; BCAT, аминотрансфераза аминокислот с разветвленной цепью; CS, Цис-синтаза; CYP, цитохром Р450; MAM, метил(тио)алкилмалатсинтаза; Serat, Ser ацетилтрансфераза; SIR, сульфитредуктаза; SOT, десульфоглюкозинолатсульфотрансфераза; SULTR, переносчик сульфатов; UGT74B1, UDP-глюкоза: тиогидроксимовая кислота S -глюкозилтрансфераза; АПС, аденозин-5′-фосфосульфат; PAPS, 3′-фосфоаденозин-5′-фосфосульфат.
, не только все, но и большинство -S-чувствительных генов, играющих ключевую роль в ассимиляции серы и метаболизме, контролировались с помощью SLIM1. Все эти пути должны быть должным образом отрегулированы для получения сульфата и эффективного использования внутренних пулов серы, когда растений Arabidopsis испытывают нехватку серы.
В условиях –S растения дикого типа Arabidopsis максимизируют эффективность использования серы за счет индукции SULTR1;1 и SULTR1;2 для поглощения сульфата (Shibagaki et al., 2002; Yoshimoto et al., 2002) и SULTR4;1 и SULTR4;2 для высвобождения вакуолярного сульфата в тканях корня (Kataoka et al., 2004b). Эти пути были почти полностью выключены у мутантов slim1 (рис. 5В). Кроме того, модуляция содержания сульфатов свидетельствует о нарушении вакуолярной рециркуляции сульфатов в корнях мутантов slim1 (рис. 6). Хотя транскрипты этих переносчиков сульфатов модулируются SLIM1, эффекты этого фактора транскрипции не были исключительными для контроля SULTR1;1 , который также следует за –S-зависимой регуляцией под действием ранее идентифицированного цис--действующего элемента, SURE ( Маруяма-Накашита и др., 2005). Фактически, мРНК SULTR1;1 частично индуцировалась -S даже у мутантов slim1 (рис. 5В). Напротив, отсутствие SURE в промоторной области SULTR1;2 свидетельствует о том, что этот основной фактор, способствующий поглощению сульфата, контролируется преимущественно SLIM1 в условиях –S. Как следствие SLIM1-опосредованной регуляции SULTR1;2 , активность поглощения сульфата была значительно снижена мутациями slim1 (рис. 4А), что было сравнимо с результатами делеции SULTR1;2 (Shibagaki et al., 2002). Поскольку экспрессия генов, чувствительных к -S, имеет решающее значение для выживания растений в условиях -S, вполне разумно, что растения развили мультиплексные регуляторные механизмы для контроля экспрессии генов. Дальнейшая идентификация сигнальных компонентов должна раскрыть полный набор механизмов, лежащих в основе этой гипотезы.
5В). Напротив, отсутствие SURE в промоторной области SULTR1;2 свидетельствует о том, что этот основной фактор, способствующий поглощению сульфата, контролируется преимущественно SLIM1 в условиях –S. Как следствие SLIM1-опосредованной регуляции SULTR1;2 , активность поглощения сульфата была значительно снижена мутациями slim1 (рис. 4А), что было сравнимо с результатами делеции SULTR1;2 (Shibagaki et al., 2002). Поскольку экспрессия генов, чувствительных к -S, имеет решающее значение для выживания растений в условиях -S, вполне разумно, что растения развили мультиплексные регуляторные механизмы для контроля экспрессии генов. Дальнейшая идентификация сигнальных компонентов должна раскрыть полный набор механизмов, лежащих в основе этой гипотезы.
Анализ метаболитов также показал, что мутанты slim1 могут страдать от более серьезной нехватки серы, о чем свидетельствует значительное снижение содержания GSH и избыточное накопление OAS в их побегах (рис. 6).Эти профили метаболитов типичны для растений, культивируемых с -S, и предполагается, что они вызваны недостаточным поступлением серы на путь восстановления сульфатов и синтеза Cys в побегах. -S-индуцируемая изоформа Ser acetyltransferase, Serat3;1 (Kawashima et al., 2005), которая может иметь специфическую функцию в синтезе Cys в среде -S, проявляла SLIM1-зависимую экспрессию (рис. 5А). В отличие от этих метаболических генов, -S ответ аденилилсульфатредуктазы (APR2 и APR3) не подвергался влиянию мутаций slim1 (рис. 5А).Предполагается, что этот фермент важен для контроля потока восстановления сульфата, и его транскрипты в изобилии накапливаются в условиях -S (Gutierrez-Marcos et al., 1996; Setya et al., 1996; Vauclare et al., 2002). Механизм его регуляции, вероятно, отличается от пути, опосредованного SLIM1, идентифицированного в этом исследовании.
6).Эти профили метаболитов типичны для растений, культивируемых с -S, и предполагается, что они вызваны недостаточным поступлением серы на путь восстановления сульфатов и синтеза Cys в побегах. -S-индуцируемая изоформа Ser acetyltransferase, Serat3;1 (Kawashima et al., 2005), которая может иметь специфическую функцию в синтезе Cys в среде -S, проявляла SLIM1-зависимую экспрессию (рис. 5А). В отличие от этих метаболических генов, -S ответ аденилилсульфатредуктазы (APR2 и APR3) не подвергался влиянию мутаций slim1 (рис. 5А).Предполагается, что этот фермент важен для контроля потока восстановления сульфата, и его транскрипты в изобилии накапливаются в условиях -S (Gutierrez-Marcos et al., 1996; Setya et al., 1996; Vauclare et al., 2002). Механизм его регуляции, вероятно, отличается от пути, опосредованного SLIM1, идентифицированного в этом исследовании.
Эксперименты с кормлением показывают, что избыточная нагрузка GSH или OAS на растения может регулировать гены метаболизма серы, имитируя уровни транскрипции, наблюдаемые в условиях, когда растения могут получать адекватное или ограниченное количество сульфата, соответственно (Hirai et al. , 2004; Маруяма-Накашита и др., 2004b). Вопреки тому, что можно было бы ожидать от их постулируемого действия в регуляции, ни увеличение GSH, ни снижение OAS не наблюдалось при мутации slim1 на -S (рис. 6), хотя мутанты slim1 приводили к типичному невосприимчивости -S. профили экспрессии транскриптов (рис. 5). Хотя возможности локального накопления метаболитов остаются непроверенными, не предполагается, что SLIM1 расположен выше по течению от ранее предполагаемых регуляторных функций OAS и GSH в передаче сигналов серы в растениях.Кроме того, сравнение данных макрочипа об ответе OAS (Hirai et al., 2003) и наш анализ GeneChip не выявили значительного перекрытия между активацией, отвечающей за OAS, и активацией -S, зависящей от SLIM1; однако белок семейства аконитаз (At4g13430) и супероксиддисмутаза железа (At4g25100) были обнаружены как в ответной на OAS подавлении, так и в зависимом от SLIM1 подавлении -S. В настоящее время наши данные не подтверждают четкую связь между OAS и SLIM1 в передаче сигналов –S.
, 2004; Маруяма-Накашита и др., 2004b). Вопреки тому, что можно было бы ожидать от их постулируемого действия в регуляции, ни увеличение GSH, ни снижение OAS не наблюдалось при мутации slim1 на -S (рис. 6), хотя мутанты slim1 приводили к типичному невосприимчивости -S. профили экспрессии транскриптов (рис. 5). Хотя возможности локального накопления метаболитов остаются непроверенными, не предполагается, что SLIM1 расположен выше по течению от ранее предполагаемых регуляторных функций OAS и GSH в передаче сигналов серы в растениях.Кроме того, сравнение данных макрочипа об ответе OAS (Hirai et al., 2003) и наш анализ GeneChip не выявили значительного перекрытия между активацией, отвечающей за OAS, и активацией -S, зависящей от SLIM1; однако белок семейства аконитаз (At4g13430) и супероксиддисмутаза железа (At4g25100) были обнаружены как в ответной на OAS подавлении, так и в зависимом от SLIM1 подавлении -S. В настоящее время наши данные не подтверждают четкую связь между OAS и SLIM1 в передаче сигналов –S.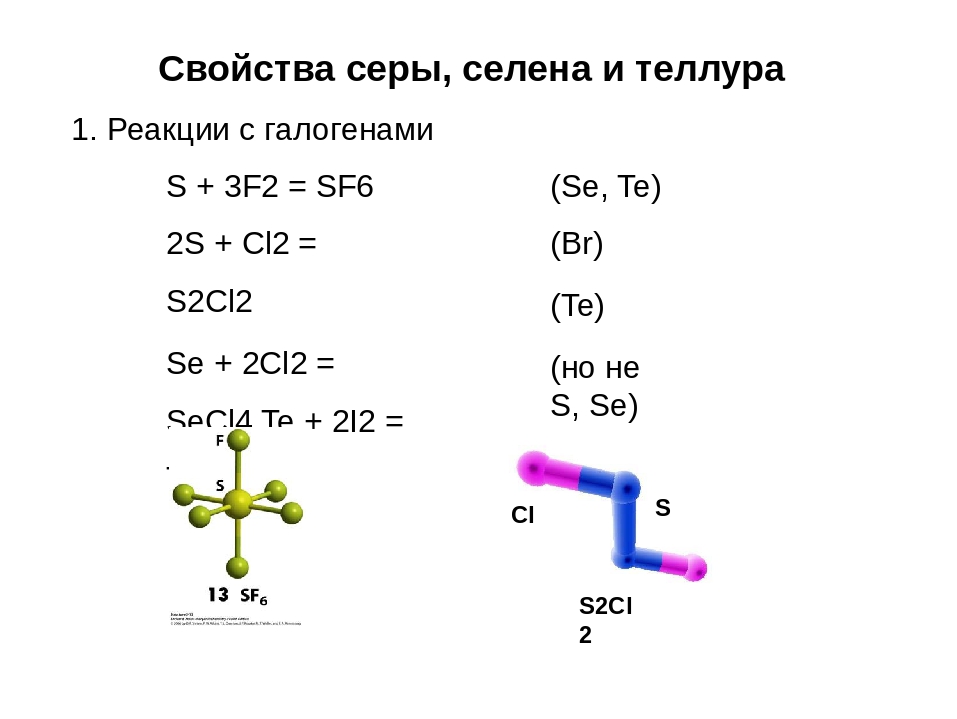
Деградация глюкозинолата является еще одним важным аспектом реакции ограничения серы.Процесс деградации катализируется тиоглюкозидазой (или мирозиназой), которая высвобождает агликон глюкозинолата. Впоследствии агликон расщепляется до изотиоцианата, оксазолидин-2-тиона, нитрила, эпитионитрила или тиоцианата (Grubb and Abel, 2006; Halkier and Gershenzon, 2006). Сульфат может высвобождаться при этой химической перегруппировке агликона и, возможно, повторно используется в первичном метаболизме. Предполагается, что индукция предполагаемой тиоглюкозидазы на -S представляет собой значительный метаболический ответ, который может служить для повторного использования пула серы в глюкозинолатах (рис. 9), хотя его физиологические эффекты на общий поток метаболизма серы ожидают дальнейшего изучения.У мутантов slim1 экспрессия гена тиоглюкозидазы была устранена (рис. 5В), а глюкозинолаты в изобилии накапливались даже в условиях –S (рис. 7). Наши результаты убедительно свидетельствуют о том, что SLIM1 совместно регулирует этот процесс рециркуляции серы параллельно с системами транспорта сульфата в среде –S (рис. 5 и 9).
5 и 9).
Мутации slim1 дополнительно влияли на экспрессию метаболических и регуляторных генов путей биосинтеза глюкозинолатов, таких как ферменты удлинения цепи Met (Field et al., 2004; Textor et al., 2004), CYP79F1/F2 (Hansen et al., 2001b; Reintanz et al., 2001; Chen et al., 2003), CYP79B2/B3 (Hull et al., 2000; Mikkelsen et al., 2000), CYP83B1 (Bak et al., 2001; Hansen et al., 2001a) и фактор транскрипции Myb34 (ATR1) (Celenza et al., 2005) (рис. 5). Кроме того, в эту группу были классифицированы формы адениллилсульфаткиназы (AKN2) и АТФ-сульфурилазы (APS4) со сниженной экспрессией –S, что предполагает возможный вклад этих конкретных изоферментов в образование донора сульфата, 3′-фосфоаденозин-5′-фосфосульфата. реакции сульфатирования, часть которой может быть использована для биосинтеза глюкозинолатов (Piotrowski et al., 2004; Хираи и др., 2005). Мутации slim1 обычно подавляли гены биосинтеза APS4 и глюкозинолата, аминотрансферазу аминокислот с разветвленной цепью, CYP79B2 и CYP79F2 в условиях с достаточным содержанием серы (рис. 5B, S1500). С другой стороны, их транскрипты были немного усилены мутациями slim1 в условиях -S (рис. 5B, S15). В результате эти контрастные профили дали относительно более низкие отношения S15:S1500 для родительской линии (рис. 5А).Эффекты SLIM1 на эти метаболические гены были довольно умеренными по сравнению с его основным вкладом в -S-зависимую активацию поглощения сульфата и катаболическую рециркуляцию серы из глюкозинолатов (рис. 5B). Частое появление предполагаемых сайтов связывания SLIM1 в зависимых от -S генах SLIM1 (см. Дополнительную таблицу 2 онлайн) подтверждает преобладающую роль SLIM1-опосредованной регуляции в этих метаболических процессах в среде -S.
5B, S1500). С другой стороны, их транскрипты были немного усилены мутациями slim1 в условиях -S (рис. 5B, S15). В результате эти контрастные профили дали относительно более низкие отношения S15:S1500 для родительской линии (рис. 5А).Эффекты SLIM1 на эти метаболические гены были довольно умеренными по сравнению с его основным вкладом в -S-зависимую активацию поглощения сульфата и катаболическую рециркуляцию серы из глюкозинолатов (рис. 5B). Частое появление предполагаемых сайтов связывания SLIM1 в зависимых от -S генах SLIM1 (см. Дополнительную таблицу 2 онлайн) подтверждает преобладающую роль SLIM1-опосредованной регуляции в этих метаболических процессах в среде -S.
Наши результаты демонстрируют, что транскрипционный фактор SLIM1 участвует в основном пути -S-чувствительной регуляции приобретения и метаболизма сульфатов у Arabidopsis .Эта работа открывает перспективы в изучении регуляторных сетей реакции растений на серу и метаболизма. Идентификация SLIM1 приведет к углубленному анализу нижестоящих регуляторных элементов регуляции –S-чувствительных генов. Выводы о функциях SLIM1 могут дополнительно способствовать общему повышению эффективности использования серы и разработке производства глюкозинолатов в растениях семейства крестоцветных.
Выводы о функциях SLIM1 могут дополнительно способствовать общему повышению эффективности использования серы и разработке производства глюкозинолатов в растениях семейства крестоцветных.
МЕТОДЫ
Рост растений
Растения Arabidopsis thaliana выращивали при 22°C с циклами 16-часовой свет/8-часовой темноты.Растения выращивали на минеральных питательных средах (Hirai et al., 1995), содержащих 1% сахарозы. Для приготовления агаровой среды агар дважды промывали 1 л деионизированной воды и фильтровали под вакуумом. Агаровую среду S0 готовили путем полной замены MgSO 4 на MgCl 2 . Агаризованные среды S1500, S300, S100, S30 и S15 готовили путем добавления MgSO 4 к среде S0. Концентрацию Mg доводили до 1500 мкМ путем добавления MgCl 2 .
Изоляция
slim1 Гомозиготное потомство трансгенных растений P SULTR1;2 -GFP (фон Колумбия-0) (Maruyama-Nakashita et al.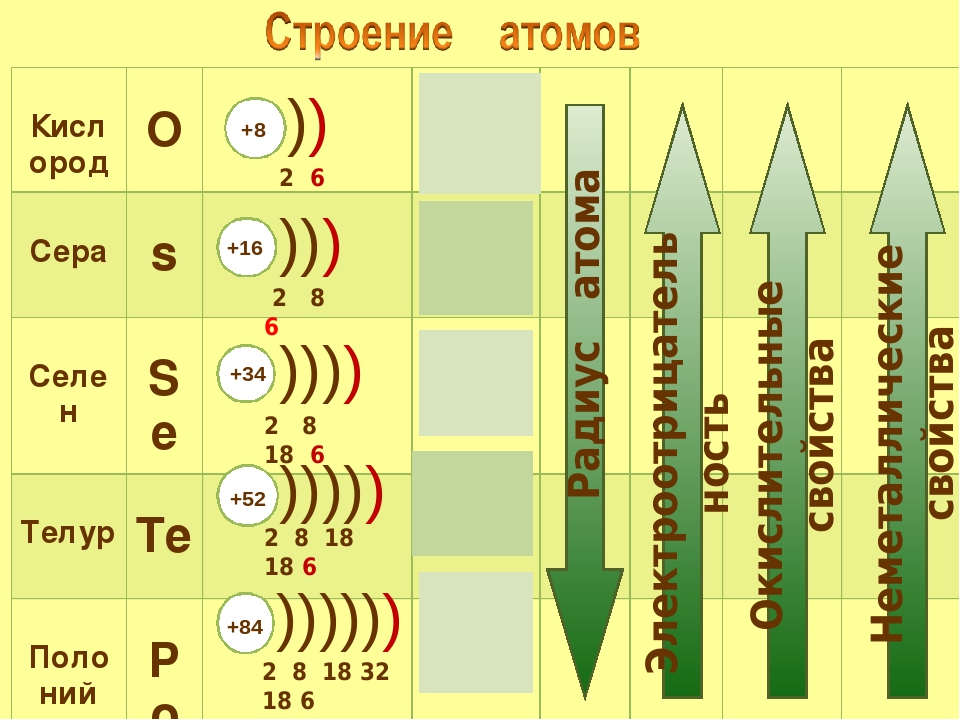 , 2004b) использовали в качестве родительской линии. Приблизительно 15 000 семян мутагенизировали 0,3% этилметансульфонатом в течение 16 часов и сразу же высевали в почву. Семена М2 собирали отдельно в виде 36 пулов. Приблизительно 2000 проростков М2 из каждого пула (всего 72000) подвергали скринингу на изменение флуоресценции GFP на агаровой среде S0. GFP был обнаружен в 11-дневных проростках с использованием анализатора изображений FluorImager 595 (Molecular Dynamics). Проростки М2, демонстрирующие сниженную флуоресценцию GFP, были выбраны в качестве мутантных кандидатов.Семена М3 были собраны от 209 независимых мутантов-кандидатов. Восемьдесят линий со сниженной флуоресценцией GFP были повторно отобраны путем сравнения флуоресценции на агаризованных средах S0 и S1500 и подвергнуты обратному скрещиванию с родительским растением P SULTR1;2 -GFP . Потомство F2 линий обратного скрещивания анализировали в тех же условиях. Наконец, 60 линий были отобраны как мутанты, не реагирующие на ограничения по сере.
, 2004b) использовали в качестве родительской линии. Приблизительно 15 000 семян мутагенизировали 0,3% этилметансульфонатом в течение 16 часов и сразу же высевали в почву. Семена М2 собирали отдельно в виде 36 пулов. Приблизительно 2000 проростков М2 из каждого пула (всего 72000) подвергали скринингу на изменение флуоресценции GFP на агаровой среде S0. GFP был обнаружен в 11-дневных проростках с использованием анализатора изображений FluorImager 595 (Molecular Dynamics). Проростки М2, демонстрирующие сниженную флуоресценцию GFP, были выбраны в качестве мутантных кандидатов.Семена М3 были собраны от 209 независимых мутантов-кандидатов. Восемьдесят линий со сниженной флуоресценцией GFP были повторно отобраны путем сравнения флуоресценции на агаризованных средах S0 и S1500 и подвергнуты обратному скрещиванию с родительским растением P SULTR1;2 -GFP . Потомство F2 линий обратного скрещивания анализировали в тех же условиях. Наконец, 60 линий были отобраны как мутанты, не реагирующие на ограничения по сере. Семейство аллельных мутантных линий было названо slim1 и проанализировано в данном исследовании.Растения slim1-1 и slim1-2 трижды скрещивали с родительской линией и использовали для фенотипического анализа.
Семейство аллельных мутантных линий было названо slim1 и проанализировано в данном исследовании.Растения slim1-1 и slim1-2 трижды скрещивали с родительской линией и использовали для фенотипического анализа.
Позиционное обозначение
slim1 Для клонирования на основе карты использовали растения F2, полученные в результате скрещивания мутантов slim1 и Landsberg erecta . Проростки F2, демонстрирующие устойчивость к канамицину и значительное снижение флуоресценции GFP, отбирали на агаровой среде S0, содержащей 10 мкМ сульфата канамицина.Хромосомосодержащие slim1 определяли с использованием генетических маркеров nga68, nga111, nga361, nga162, nga6, nga8 и nga139. slim1 был картирован между маркерами nga111 и ATPASE и сужен до области между клонами BAC T9L24 и F1M20 с использованием маркеров однонуклеотидного полиморфизма, созданных Inplanta Innovations (http://www. inplanta.jp/eng/service/mapping.html). ). Мы создали дополнительные молекулярные маркеры, обобщенные в дополнительной таблице 4 онлайн. Используя эти маркеры, slim1 был сопоставлен с положением между At1g73660 и At1g73850.Мутации в slim1-1 и slim1-2 были идентифицированы на At1g73730 путем секвенирования 21 гена между At1g73660 и At1g73850.
inplanta.jp/eng/service/mapping.html). ). Мы создали дополнительные молекулярные маркеры, обобщенные в дополнительной таблице 4 онлайн. Используя эти маркеры, slim1 был сопоставлен с положением между At1g73660 и At1g73850.Мутации в slim1-1 и slim1-2 были идентифицированы на At1g73730 путем секвенирования 21 гена между At1g73660 и At1g73850.
Трансгенные растения
Конструкция сверхэкспрессии SLIM1 ( 35S-SLIM1 ) была создана путем клонирования кодирующей области SLIM1 под промотором 35S CaMV в векторе pSMAH621 (Kubo et al., 2005). Конструкции для сверхэкспрессии других генов семейства EIL и генов Oryza sativa SLIM1 были приготовлены в ph45GS (Kubo et al., 2005), бинарный вектор, содержащий кассету Gateway (Invitrogen) в смысловой ориентации под промотором CaMV 35S в pSMAH621. Слитую конструкцию GFP-SLIM1 ( 35S-GFP-SLIM1 ) получали путем клонирования трансляционного гена слияния sGFP (Chiu et al. , 1996) и SLIM1 под промотором CaMV 35S в pBItech121 (Clontech121). Конструкцию SLIM1 промотор- GFP ( P SLIM1 -GFP ) получали путем клонирования 5′-промоторной области 2087 п.н. SLIM1 в векторе pBI101-GFP (Yaloshimoto et., 2003), который имеет замену гена β-глюкуронидазы в pBI101 (Clontech) на sGFP . Все фрагменты ДНК, клонированные в векторах трансформации, амплифицировали с помощью ПЦР с использованием высокоточной ДНК-полимеразы KOD-Plus (Toyobo). Последовательности праймеров, использованные для ПЦР, приведены в дополнительной таблице 5 онлайн. Бинарные плазмиды переносили в растений Agrobacterium tumefaciens GV3101 (pMP90) (Koncz and Schell, 1986) и трансформировали в растений Arabidopsis в соответствии с методом цветочного погружения (Clough and Bent, 1998).Трансгенные растения отбирали с использованием 25 мг L -1 гигромицина B (для конструкций pSMAH621 и ph45GS) или 50 мг L -1 сульфата канамицина (для конструкций pBI), и для анализа использовали потомство T2 или T3.
, 1996) и SLIM1 под промотором CaMV 35S в pBItech121 (Clontech121). Конструкцию SLIM1 промотор- GFP ( P SLIM1 -GFP ) получали путем клонирования 5′-промоторной области 2087 п.н. SLIM1 в векторе pBI101-GFP (Yaloshimoto et., 2003), который имеет замену гена β-глюкуронидазы в pBI101 (Clontech) на sGFP . Все фрагменты ДНК, клонированные в векторах трансформации, амплифицировали с помощью ПЦР с использованием высокоточной ДНК-полимеразы KOD-Plus (Toyobo). Последовательности праймеров, использованные для ПЦР, приведены в дополнительной таблице 5 онлайн. Бинарные плазмиды переносили в растений Agrobacterium tumefaciens GV3101 (pMP90) (Koncz and Schell, 1986) и трансформировали в растений Arabidopsis в соответствии с методом цветочного погружения (Clough and Bent, 1998).Трансгенные растения отбирали с использованием 25 мг L -1 гигромицина B (для конструкций pSMAH621 и ph45GS) или 50 мг L -1 сульфата канамицина (для конструкций pBI), и для анализа использовали потомство T2 или T3.
Филогенетический анализ
Программы BLASTP в информационных ресурсах Arabidopsi s (http://www.arabidopsis.org/Blast/), RAP (http://rapdb.lab.nig.ac.jp/blast/index.html), TIGR (http://tigrblast.tigr.org/euk-blast/index.cgi?project=osa1) и Национальный центр биотехнологической информации (http://www.ncbi.nlm.nih.gov/BLAST/) использовались для поиска в базе данных гомологов SLIM1. Последовательности белков выравнивали с помощью ClustalW (Thompson et al., 1994), а филогенетическое дерево строили методом объединения соседей (Saitou, Nei, 1987) с использованием программ DDBJ (http://www.ddbj.nig). .ac.jp/search/clustalw-j.html). Bootstrap-анализ был проведен в 1000 повторах. Выравнивание последовательности (см. Дополнительный рисунок 4 онлайн) было отредактировано с использованием Jalview (http://www.jalview.org/) (Clamp et al., 2004). Филогенетическое дерево без корней (рис. 8А) было построено с использованием TreeView (http://taxonomy. zoology.gla.ac.uk/rod/treeview.html) (Page, 1996).
zoology.gla.ac.uk/rod/treeview.html) (Page, 1996).
Визуализация экспрессии GFP
Экспрессию GFP в интактных растениях визуализировали с помощью анализатора изображений FluorImager 595 при возбуждении на длине волны 488 нм (Molecular Dynamics). Относительную интенсивность сигналов GFP определяли количественно с использованием ImageQuant (Molecular Dynamics). Система лазерной сканирующей конфокальной микроскопии FluoView 500 (Olympus) использовалась для микроскопического анализа растений SLIM1 промотора — GFP и ядерной локализации слитого белка GFP-SLIM1.
Поглощение сульфатов
Растения выращивали в вертикальном положении в течение 10 дней на среде S15 (15 мкМ сульфат). Корни погружали в питательный раствор, содержащий 15 мкМ [ 35 S] сульфата натрия (Amersham Biosciences), и инкубировали в течение 30 мин. Промывку и измерение проводили, как описано ранее (Kataoka et al. , 2004b; Maruyama-Nakashita et al., 2004b).
, 2004b; Maruyama-Nakashita et al., 2004b).
Гибридизация GeneChip и анализ данных
Родительскую линию, мутанты slim1-1 и slim1-2 выращивали в течение 10 дней в условиях S15 (15 мкМ сульфат) или S1500 (1500 мкМ сульфат).Из корней готовили дубликаты образцов РНК и проводили гибридизацию массива ATH-1 (Affymetrix) в соответствии с протоколом производителя. Для анализа данных использовали программы Microarray Suite 5.0 (Affymetrix) и GeneSpring 7.2 (Silicon Genetics). Все данные экспериментов GeneChip были депонированы в базе данных Gene Expression Omnibus под регистрационным номером GSE4455 (www.ncbi.nlm.nih.gov/geo).
Каждый чип был нормализован до 50-го процентиля измерений, снятых с этого чипа (нормализация на чип).Нормализация по генам выполнялась с использованием измерений образцов S1500 каждой линии растений в качестве контроля (например, сигналы каждого гена на массивах родительской линии [Parental-S1500-a, Parental-S1500-b, Parental-S15-a , и Parental-S15-b] были разделены на медиану измерений этого гена в образцах S1500 [Parental-S1500-a и Parental-S1500-b]). Данные массива мутантов slim1 были нормализованы аналогичным образом.
Данные массива мутантов slim1 были нормализованы аналогичным образом.
Элементы массива, демонстрирующие присутствующие или маргинальные крики по крайней мере в одном из четырех экспериментов с чипами родительской линии (16 731 ген), были отобраны для дальнейшей генной классификации.Гены, реагирующие на –S, были сначала отобраны из данных чипов родительской линии. Тест Стьюдента t (пороговое значение P: 0,01) был проведен между образцами S1500 и S15 родительской линии, и было получено 469 генов как -S-чувствительных генов. SLIM1-зависимые гены были дополнительно выделены путем множественного сравнения родительской линии, мутантов slim1-1 и slim1-2 . Нормализованные значения выборок S15 (соотношения S15/S1500) -S-чувствительных генов были подвергнуты одностороннему дисперсионному тесту с применением поправки множественного тестирования Бенджамини и Хохберга (Benjamini and Hochberg, 1995) с коэффициентом ложного обнаружения 0 .05 и апостериорный тест Тьюки. В результате 79 генов были перечислены как -S-чувствительные SLIM1-зависимые гены, которые демонстрируют статистически значимые различия между родительской линией и двумя мутантными аллелями (рис. 5; см. дополнительную таблицу 1 онлайн). Значения в дополнительной таблице 1 онлайн представляют собой нормализованные данные и скорректированные значения P, рассчитанные в соответствии с этой процедурой.
В результате 79 генов были перечислены как -S-чувствительные SLIM1-зависимые гены, которые демонстрируют статистически значимые различия между родительской линией и двумя мутантными аллелями (рис. 5; см. дополнительную таблицу 1 онлайн). Значения в дополнительной таблице 1 онлайн представляют собой нормализованные данные и скорректированные значения P, рассчитанные в соответствии с этой процедурой.
Количественная ОТ-ПЦР в реальном времени
ПолучениеРНК и обратную транскрипцию выполняли, как сообщалось ранее (Maruyama-Nakashita et al., 2004б). ПЦР в реальном времени проводили с использованием набора SYBR Green Perfect Real Time (Takara) и системы определения последовательности GeneAmp 5700 (Applied Biosystems). Содержание мРНК рассчитывали с использованием убиквитина в качестве внутреннего стандарта. Ген-специфические праймеры описаны в дополнительной таблице 6 онлайн.
Анализ метаболитов
Растительные ткани были собраны и заморожены в жидком азоте перед экстракцией. Замороженные ткани (100 мг FW) гомогенизировали при 4°C в 5-кратном объеме (500 мкл) растворителя для экстракции (80% метанол: 20% вода MilliQ [Millipore]) с использованием мешалки-мельницы MM300 (Retsch).После 3 мин гомогенизации клеточный дебрис удаляли центрифугированием, чтобы получить чистый экстракт. 300 мкл экстракта выпаривали в вакууме досуха и растворяли в 100 мкл воды milliQ с последующей ультрафильтрацией через NANOSEP MF GHP 0,45 мкм (PALL Life Sciences). Этот фильтрат сразу использовали для анализа.
Замороженные ткани (100 мг FW) гомогенизировали при 4°C в 5-кратном объеме (500 мкл) растворителя для экстракции (80% метанол: 20% вода MilliQ [Millipore]) с использованием мешалки-мельницы MM300 (Retsch).После 3 мин гомогенизации клеточный дебрис удаляли центрифугированием, чтобы получить чистый экстракт. 300 мкл экстракта выпаривали в вакууме досуха и растворяли в 100 мкл воды milliQ с последующей ультрафильтрацией через NANOSEP MF GHP 0,45 мкм (PALL Life Sciences). Этот фильтрат сразу использовали для анализа.
Глюкозинолаты анализировали жидкостной хроматографией-масс-спектрометрией, модифицируя методы, описанные Mellon et al. (2002). Десять микролитров образца наносили на систему Acquity UPLC (Waters) и разделяли на колонке SunFire C18 (150×2.диаметр 1 мм; воды) по программе элюирования с линейным градиентом растворителем A (0,1% трифторуксусной кислоты в воде) и растворителем B (0,1% трифторуксусной кислоты в метаноле): от 0 до 2% растворителя B (8 мин), от 2 до 30% растворителя B (12 мин), от 30 до 100 % растворителя B (18 мин), 100 % растворителя B (7 мин) и 100 % растворителя A (5 мин).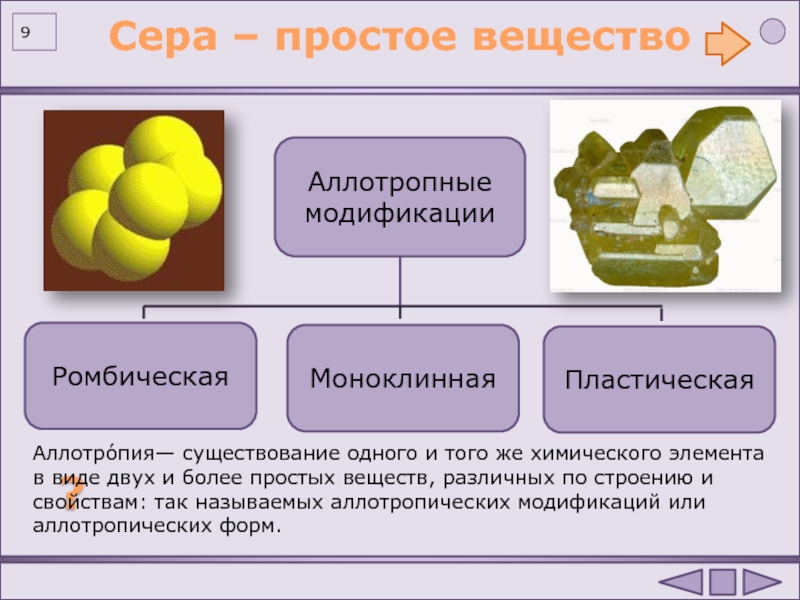 Элюцию проводили со скоростью 0,2 мл/мин и при 30°С. Метаболиты были обнаружены с помощью фотодиодного матричного сканирования поглощения в УФ-диапазоне (от 210 до 400 нм), а ионы [M-H] — для конкретных глюкозинолатов были обнаружены в времяпролетном масс-анализаторе Q-Tof Premier (Micromass).Зонд электрораспыления работал при напряжении 2,8 кВ. Исходная температура и температура десольватации составляли 100 и 120°С соответственно. Идентичность 4-метилсульфинилбутил- и 4-метилтиобутилглюкозинолатов со стандартными соединениями была подтверждена временем элюирования, УФ-поглощением, значением m/z и паттернами массовой фрагментации. Другие метилсульфинилалкил- и метилтиоалкилглюкозинолаты, а также индолглюкозинолаты были идентифицированы по их поглощению в УФ-излучении, значениям m/z и характеру массовой фрагментации.Содержание глюкозинолатов рассчитывали путем сравнения уровней ионов [M-H] — каждого соединения с уровнями синигрина в качестве стандарта.
Элюцию проводили со скоростью 0,2 мл/мин и при 30°С. Метаболиты были обнаружены с помощью фотодиодного матричного сканирования поглощения в УФ-диапазоне (от 210 до 400 нм), а ионы [M-H] — для конкретных глюкозинолатов были обнаружены в времяпролетном масс-анализаторе Q-Tof Premier (Micromass).Зонд электрораспыления работал при напряжении 2,8 кВ. Исходная температура и температура десольватации составляли 100 и 120°С соответственно. Идентичность 4-метилсульфинилбутил- и 4-метилтиобутилглюкозинолатов со стандартными соединениями была подтверждена временем элюирования, УФ-поглощением, значением m/z и паттернами массовой фрагментации. Другие метилсульфинилалкил- и метилтиоалкилглюкозинолаты, а также индолглюкозинолаты были идентифицированы по их поглощению в УФ-излучении, значениям m/z и характеру массовой фрагментации.Содержание глюкозинолатов рассчитывали путем сравнения уровней ионов [M-H] — каждого соединения с уровнями синигрина в качестве стандарта.
Содержание Cys и GSH определяли путем мечения тиолов монобромбиманом (Molecular Probes) после восстановления экстрактов методом DTT. Меченые продукты разделяли с помощью ВЭЖХ с использованием колонки Symmetry C18 (диаметр 150 × 4,6 мм; Waters) и детектировали с помощью сканирующего флуоресцентного детектора Waters 474, контролируя флуоресценцию тиол-бимановых аддуктов при 482 нм при возбуждении при 390 нм.Met и OAS анализировали методом капиллярного электрофореза-масс-спектрометрии (Agilent Technologies) (Sato et al., 2004). Содержание сульфата определяли с помощью капиллярно-электрофорезно-фотодиодной матричной системы детектирования в соответствии с протоколом производителя (Agilent Technologies).
Регистрационные номера
Данные микрочипаиз этой статьи можно найти в базе данных Gene Expression Omnibus (www.ncbi.nlm.nih.gov/geo) под инвентарным номером GSE4455.
Дополнительные данные
В онлайн-версии этой статьи доступны следующие материалы.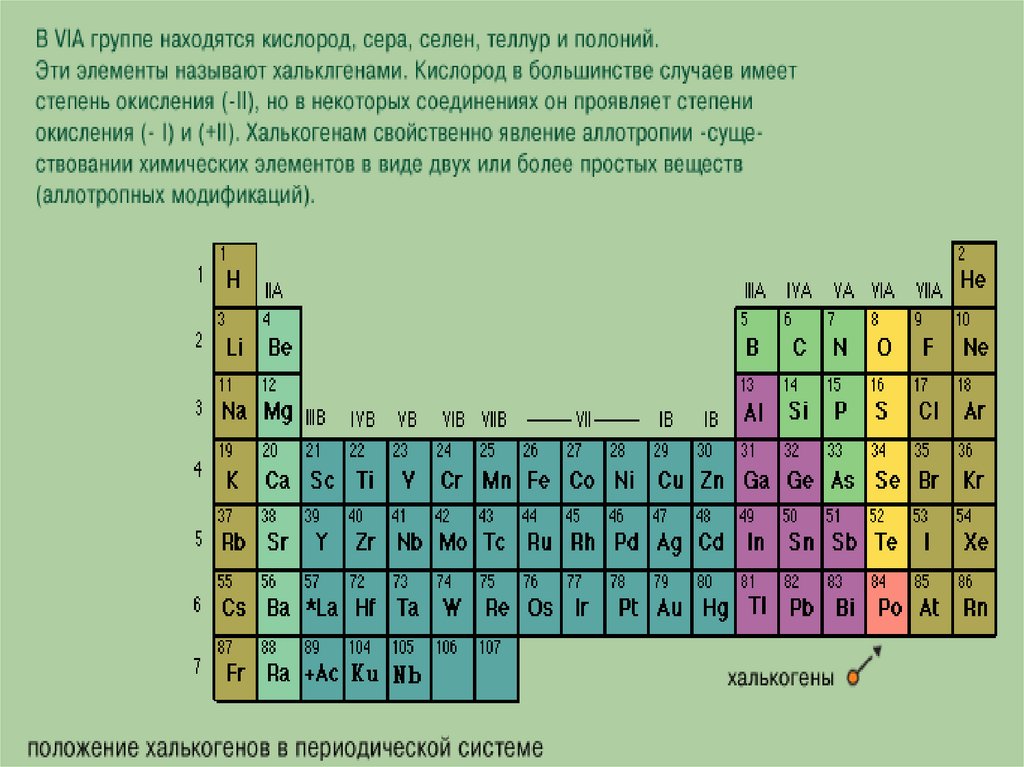
БЛАГОДАРНОСТИ
Мы благодарим Акико Ватанабэ-Такахаши, Эри Иноуэ и Рие Нииду за отличную техническую поддержку; Takeshi Nakano, Tetsuya Ishida и Eiji Nambara за советы по картографической стратегии; и Taku Demura и Minoru Kubo за предоставление векторов ph45GS и pSMAH621. Мы благодарим Джонатана Гершензона за предоставление стандартов глюкозинолатов и Ясуо Ниву за предоставление вектора sGFP(S65T). Эта работа была поддержана дискреционным фондом президента RIKEN и грантами на научные исследования в приоритетных областях от Министерства образования, культуры, спорта, науки и технологий Японии.
ССЫЛКИ
1.Алонсо Дж. М., Стапанова А. Н., Солано Р., Висман Э., Феррари С., Осубель Ф. М. и Экер Дж. Р. (
2003
). Пять компонентов пути ответа на этилен, идентифицированные при скрининге слабых нечувствительных к этилену мутантов у Arabidopsis .
Проц. Натл. акад. науч. США
100
,2992
–2997
.2.Бак, С., Налоговая, Ф.Е., Feldmann, K.A., Galbraith, D.W., and Feyereisen, R. (
2001
). CYP83B1, цитохром P450 в точке метаболического разветвления биосинтеза ауксина и индолглюкозинолата у арабидопсиса.Растительная клетка
13
,101
–111
.3.Бенджамини Ю. и Хохберг Ю. (
1995
). Контроль частоты ложных срабатываний: практичный и мощный подход к множественному тестированию.JR Stat. соц.B
57
,289
–300
.4.Buchner, P., Stuiver, C.E., Westerman, S., Wirtz, M., Hell, R., Hawkesford, M.J., and De Kok, L.J. (
2004
a). Регуляция поглощения сульфата и экспрессия генов переносчиков сульфата у Brassica oleracea под влиянием атмосферного H 2 S и педосферного сульфатного питания.Физиол растений.
136
,3396
–3408
. 5.
5.Бюхнер, П., Takahashi, H., and Hawkesford, MJ (
2004
b). Транспортеры сульфатов растений: координация поглощения, внутриклеточного и дальнего транспорта.Дж. Экспл. Бот.
55
,1765
–1773
.6.Селенца, Дж.Л., Кьель, Дж.А., Смолен, Г.А., Меррих, Х., Сильвестро, А.Р., Норманли, Дж. и Бендер, Дж. (
2005
). Фактор транскрипции ATR1 Myb Arabidopsis контролирует гомеостаз индольного глюкозинолата.Физиол растений.
137
,253
–262
.7.Чао, К., Ротенберг, М., Солано, Р., Роман, Г., Терзаги, В., и Экер, Дж. Р. (
1997
). Активация пути реакции на газообразный этилен у арабидопсиса ядерным белком ETHYLENE-INSENSITIVE3 и родственными белками.Ячейка
89
,1133
–1144
.8. Чен С., Главишниг Э., Йоргенсен К., Наур П., Йоргенсен Б., Олсен С.Е., Хансен С.Х., Расмуссен Х. , Пикетт Дж.А. и Халкиер Б.А. (
, Пикетт Дж.А. и Халкиер Б.А. (
2003
). CYP79F1 и CYP79F2 выполняют разные функции в биосинтезе алифатических глюкозинолатов у арабидопсиса.Завод J.
33
,923
–937
.9.Чиу В.Л., Нива Ю., Зенг В., Хирано Т., Кобаяши Х. и Шин Дж. (
1996
). Создал GFP в качестве жизненно важного репортера для растений.Курс.биол.
6
,325
–330
.10.Clamp, M., Cuff, J., Searle, S.M., and Barton, G.J. (
2004
). Редактор выравнивания Jalview Java.Биоинформатика
20
,426
–427
.11.Кларксон, Д. Т., Смит, Ф. В., и Ванден Берг, П. Дж. (
1983
). Регуляция транспорта сульфатов у тропических бобовых, Macroptilium atropurpureum cv.Сиратро.Дж. Экспл. Бот.
34
,1463
–1483
.12.Клаф, С.Дж., и Бент, А.Ф. (
1998
). Цветочное погружение: упрощенный метод опосредованной Agrobacterium трансформации Arabidopsis thaliana .
Цветочное погружение: упрощенный метод опосредованной Agrobacterium трансформации Arabidopsis thaliana .Завод J.
16
,735
–743
.13.Кроуфорд Н.М., Кан М.Л., Леустек Т. и Лонг С.Р. (
2000
).Азот и сера. В книге «Биохимия и молекулярная биология растений», Б. Б. Бьюкенен, В. Груиссем и Р. Л. Джонс, ред. (Роквилл, Мэриленд: Американское общество биологов растений), стр.824
–849
.14.Дин-Драммонд, CE (
1987
). Регулирование поглощения сульфатов после выращивания проростков Pisum sativum L. в условиях ограничения питательных веществ S. Взаимодействие транспорта нитратов и сульфатов.Науки о растениях.
50
,27
–35
.15.Филд Б., Кардон Г., Трака М., Боттерман Дж., Ванканнейт Г. и Митен Р. (
2004
). Биосинтез глюкозинолатов и аминокислот у арабидопсиса. Физиол растений.
135
,828
–839
.16.Грабб, К., и Абель, С. (
2006
). Метаболизм глюкозинолатов и его регулирование.Trends Plant Sci.
11
,89
–100
.17.Го, Х.и Экер, Дж. Р. (
2003
). Реакции растений на газообразный этилен опосредованы SCF EBF1/EBF2 -зависимым протеолизом фактора транскрипции EIN3.Ячейка
115
,667
–677
.18.Го Х. и Экер Дж. Р. (
2004
). Сигнальный путь этилена: новые идеи.Курс. мнение биол. растений
7
,40
–49
.19.Гутьеррес-Маркос, Х.Ф., Робертс, М.А., Кэмпбелл, Э.Дж., и Рэй, Дж.Л. (
1996
). Три члена нового небольшого семейства генов из Arabidopsis thaliana , способных функционально дополнять мутант Escherichia coli , дефектный по активности PAPS-редуктазы, кодируют белки с тиоредоксиноподобным доменом и активностью «APS-редуктазы».
Проц. Натл. акад. науч. США
93
,13377
–13382
.20.Халкиер, Б.А., и Гершензон, Дж. (
2006
). Биология и биохимия глюкозинолатов.год. Преподобный завод биол.
57
,303
–333
.21.Хансен, К.Х., Ду, Л., Наур, П., Олсен, К.Е., Аксельсен, К.Б., Хик, А.Дж., Пикетт, Дж.А., и Халкиер, Б.А. (
2001
а). CYP83B1 представляет собой фермент, метаболизирующий оксим в пути глюкозинолата у Arabidopsis .Дж. Биол. хим.
276
,24790
–24796
.22.Хансен, К.Х., Виттсток, У., Олсен, К.Е., Хик, А.Дж., Пикетт, Дж.А., и Халкиер, Б.А. (
2001
б). Цитохром Р450 CYP79F1 арабидопсиса катализирует превращение дигомометионина и тригометионина в соответствующие альдоксимы в биосинтезе алифатических глюкозинолатов.Дж. Биол. хим.
276
,11078
–11085
. 23.
23.Хираи М.Ю., Фудзивара Т., Авазухара М., Кимура Т., Нодзи М.и Сайто, К. (
2003
). Глобальное профилирование экспрессии арабидопсиса, страдающего от недостатка серы, с помощью макрочипа ДНК показывает роль O -ацетил-L-серина как общего регулятора экспрессии генов в ответ на питание серой.Завод J.
33
,651
–663
.24.Хираи М.Ю., Фудзивара Т., Чино М. и Найто С. (
1995
). Влияние концентрации сульфата на экспрессию гена запасного белка семян сои и его обратимость в трансгенном Arabidopsis thaliana .Физиол клеток растений.
36
,1331
–1339
.25.Hirai, MY, et al. (
2005
). Выяснение сетей между генами и метаболитами в генах у арабидопсиса путем интеграции метаболомики и транскриптомики.Дж. Биол. хим.
280
,25590
–25595
.26. Хираи М. Ю., Яно М., Гуденове Д.Б., Канайя С., Кимура Т., Авазухара М., Арита М., Фудзивара Т.и Сайто, К. (
Ю., Яно М., Гуденове Д.Б., Канайя С., Кимура Т., Авазухара М., Арита М., Фудзивара Т.и Сайто, К. (
2004
). Интеграция транскриптомики и метаболомики для понимания глобальных реакций на пищевые стрессы у Arabidopsis thaliana .Проц. Натл. акад. науч. США
101
,10205
–10210
.27.Hopkins, L., Parmar, S., Blaszczyk, A., Hesse, H., Hoefgen, R. и Hawkesford, M.J. (
2005
). O -ацетилсерин и регуляция экспрессии генов, кодирующих компоненты поглощения и ассимиляции сульфатов у картофеля.Физиол растений.
138
,433
–440
.28.Howarth, J.R., Fourcroy, P., Davidian, J.-C., Smith, F.W., and Hawkesford, M.J. (
2003
). Клонирование двух контрастных переносчиков сульфатов с высоким сродством из томатов, индуцированных низким содержанием сульфатов и инфекцией сосудистым патогеном Verticillium dahlia .Планта
218
,58
–64
. 29.
29.Халл, А.К., Видж Р. и Селенца Дж.Л. (
2000
). Arabidopsis цитохромы P450, которые катализируют первую стадию триптофан-зависимого биосинтеза индол-3-уксусной кислоты.Проц. Натл. акад. науч. США
97
,2379
–2384
.30.Катаока Т., Хаяши Н., Ямая Т. и Такахаши Х. (
2004
а). Транспорт сульфата от корня к побегу у арабидопсиса: доказательства роли SULTR3;5 как компонента низкоаффинной транспортной системы сульфата в сосудистой сети корней.Физиол растений.
136
,4198
–4204
.31.Катаока Т., Ватанабэ-Такахаши А., Хаяши Н., Ониши М., Мимура Т., Бюхнер П., Хоксфорд М.Дж., Ямая Т. и Такахаши Х. (
2004
б). Вакуолярные переносчики сульфата являются важными детерминантами, контролирующими внутреннее распределение сульфата у арабидопсиса.Растительная клетка
16
,2693
–2704
. 32.
32.Кавасима, К.Г., Берковиц О., Хелл Р., Нодзи М. и Сайто К. (
2005
). Характеристика и анализ экспрессии семейства генов серинацетилтрансферазы, участвующих в ключевом этапе пути ассимиляции серы у арабидопсиса.Физиол растений.
137
,220
–230
.33.Конц, К., и Шелл, Дж. (
1986
). Промотор гена 5 Т-ДНК контролирует тканеспецифическую экспрессию химерных генов, переносимых новыми типами бинарного вектора Agrobacterium .мол. Генерал Жене.
204
,383
–396
.34.Косуги С. и Охаси Ю. (
2000
). Клонирование и ДНК-связывающие свойства гомолога табака, нечувствительного к этилену3 (EIN3).Рез. нуклеиновых кислот.
28
,960
–967
.35.Кубо М., Удагава М., Нишикубо Н., Хоригучи Г., Ямагути М., Ито Дж., Мимура Т., Фукуда Х. и Демура Т. (
2005
). Переключатели транскрипции для образования протоксилемных и метаксилемных сосудов.
Переключатели транскрипции для образования протоксилемных и метаксилемных сосудов.Гены Дев.
19
,1855
–1860
.36.Куц А., Мюллер А., Хенниг П., Кайзер В. М., Пиотровски М. и Вейлер Э. В. (
2002
). Роль нитрилазы 3 в регуляции морфологии корней у Arabidopsis thaliana , испытывающего голодание по сере.Завод J.
30
,95
–106
.37.Леустек, Т., Мартин, М.Н., Бик, Дж.А., и Дэвис, J.P. (
2000
). Пути и регуляция метаболизма серы выявлены с помощью молекулярно-генетических исследований.год. Преподобный Завод Физиол. Завод Мол. биол.
51
,141
–165
.38.Леви, М., Ван, К., Каспи, Р., Паррелла, М.П., и Абель, С. (
2005
). Arabidopsis IQD1, новый ядерный белок, связывающий кальмодулин, стимулирует накопление глюкозинолатов и защиту растений.Завод J.
43
,79
–96
. 39.
39.Маруяма-Накашита, А., Иноуэ, Э., Ватанабэ-Такахаши, А., Ямая, Т. и Такахаши, Х. (
2003
). Профилирование транскриптома генов, чувствительных к сере, у арабидопсиса показывает глобальное влияние питания серой на несколько метаболических путей.Физиол растений.
132
,597
–605
.40.Маруяма-Накашита А., Накамура Ю., Ватанабе-Такахаши А., Иноуэ Э., Ямая Т. и Такахаши Х. (
2005
). Идентификация нового цис--действующего элемента, вызывающего реакцию дефицита серы в корнях Arabidopsis .Завод J.
42
,305
–314
.41.Маруяма-Накашита А., Накамура Ю., Ватанабэ-Такахаши А., Ямая Т. и Такахаши Х. (
2004
а). Индукция переносчика сульфата SULTR1;1 в корнях Arabidopsis включает цепь фосфорилирования/дефосфорилирования белка для регуляции транскрипции.Физиол клеток растений.
45
,340
–345
. 42.
42.Маруяма-Накашита А., Накамура Ю., Ямая Т. и Такахаши Х. (
2004
b). Новый регуляторный путь поглощения сульфата в корнях Arabidopsis : значение CRE1/WOL/AHK4-опосредованной цитокинин-зависимой регуляции.Завод J.
38
,779
–789
.43.Меллон, Ф.А., Беннетт, Р.Н., Холст, Б.и Уильямсон Г. (
2002
). Анализ интактного глюкозинолата в растительных экстрактах с помощью электрораспыления с запрограммированным коническим напряжением ЖХ/МС: производительность и сравнение с методами ЖХ/МС/МС.Анал. Биохим.
306
,83
–91
.44.Миккельсен, М.Д., Хансен, С.Х., Виттсток, У., и Халкиер, Б.А. (
2000
). Цитохром P450 CYP79B2 из Arabidopsis катализирует превращение триптофана в индол-3-ацетальдоксим, предшественник индолглюкозинолатов и индол-3-уксусной кислоты.Дж. Биол. хим.
275
,33712
–33717
. 45.
45.Никифорова В., Фрейтаг Дж., Кемпа С., Адамик М., Гессе Х. и Хофген Р. (
2003
). Транскриптомный анализ истощения серы у Arabidopsis thaliana : Переплетение путей биосинтеза обеспечивает специфичность реакции.Завод J.
33
,633
–650
.46.Страница, R.D.M. (
1996
).TREEVIEW: приложение для отображения филогенетических деревьев на персональных компьютерах.Вычисл. заявл. Бионауч.
12
,357
–358
.47.Пиотровски, М., Шеменевиц, А., Лопухина, А., Мюллер, А., Яновиц, Т., Вейлер, Э.В., и Окинг, К. (
2004
). Десульфоглюкозинолатсульфотрансферазы из Arabidopsis thaliana катализируют последнюю стадию биосинтеза структуры ядра глюкозинолата.Дж.биол. хим.
279
,50717
–50725
.48. Потушак Т., Лехнер Э., Парментье Ю., Янагисава С., Грава С. , Конч С. и Паскаль Г. (
, Конч С. и Паскаль Г. (
2003
). EIN3-зависимая регуляция передачи сигналов этиленового гормона растений двумя белками F-бокса Arabidopsis : EBF1 и EBF2.Ячейка
115
,679
–689
.50.Рейнтанц Б., Ленен М., Райхельт М., Гершензон Дж., Ковальчик М., Сандберг Г., Годде М., Уль Р. и Пальме К. (
2001
). шина , нокаутный мутант арабидопсиса CYP79F1 с нарушенным синтезом короткоцепочечных алифатических глюкозинолатов.Растительная клетка
13
,351
–367
.51.Сайто, К. (
2004
). Сероусвояющий метаболизм. Долгая и вонючая дорога.Физиол растений.
136
,2443
–2450
.52.Сайтоу, Н., и Ней, М. (
1987
). Метод объединения соседей: новый метод реконструкции филогенетических деревьев.мол. биол. Эвол.
4
,406
–425
. 53.
53.Сато С., Сога Т., Нисиока Т. и Томита М. (
2004
). Одновременное определение основных метаболитов в листьях риса с использованием капиллярного электрофореза, масс-спектрометрии и капиллярного электрофореза с диодной матрицей.Завод J.
40
,151
–163
.54.Сетя А., Мурильо М. и Леустек Т. (
1996
). Восстановление сульфатов у высших растений: молекулярные доказательства новой 5′-аденилсульфатредуктазы.Проц. Натл. акад. науч. США
93
,13383
–13388
.55.Шибагаки Н., Роуз А., Макдермотт Дж. П., Фудзивара Т., Хаяши Х., Йонеяма Т. и Дэвис Дж. П. (
2002
).Устойчивые к селенату мутанты Arabidopsis thaliana идентифицируют SULTR1;2, переносчик сульфата, необходимый для эффективного транспорта сульфата в корни.Завод J.
29
,475
–486
.56. Скирич А. , Райхельт М., Буров М., Биркемейер К., Ролцик Дж., Копка Дж., Занор М.И., Гершензон Дж., Стрнад М., Шопа Дж., Мюллер-Робер, Б., и Витт, И. (
, Райхельт М., Буров М., Биркемейер К., Ролцик Дж., Копка Дж., Занор М.И., Гершензон Дж., Стрнад М., Шопа Дж., Мюллер-Робер, Б., и Витт, И. (
2006
). Фактор транскрипции DOF AtDof1.1 (OBP2) является частью регуляторной сети, контролирующей биосинтез глюкозинолатов у арабидопсиса.Завод J.
47
,10
–24
.57.Смит, Ф. В., Илинг, П. М., Хоксфорд, М. Дж., и Кларксон, Д. Т. (
1995
). Растительные представители семейства переносчиков сульфатов выявляют функциональные подтипы.Проц. Натл. акад. науч. США
92
,9373
–9377
.58.Smith, F.W., Hawkesford, M.J., Ealing, P.M., Clarkson, D.T., Vanden Berg, P.J., Belcher, A.R., and Warrilow, A.GS (
1997
). Регуляция экспрессии кДНК из корней ячменя, кодирующей высокоаффинный переносчик сульфата.Завод J.
12
,875
–884
.59. Солано Р. , Степанова А., Чао К. и Экер Дж. Р. (
, Степанова А., Чао К. и Экер Дж. Р. (
1998
). Ядерные события в передаче сигналов этилена: транскрипционный каскад, опосредованный ETHYLENE-INSENSITIVE3 и ETHYLENE-RESPONSE-FACTOR1.Гены Дев.
12
,3703
–3714
.60.Такахаши Х., Ватанабэ-Такахаши А., Смит Ф.В., Блейк-Калф М., Хоксфорд М.Дж. и Сайто К. (
2000
). Роль трех функциональных переносчиков сульфата, участвующих в поглощении и перемещении сульфата в Arabidopsis thaliana .Завод J.
23
,171
–182
.61.Такахаши Х., Ямадзаки М., Сасакура Н., Ватанабэ А., Леустек Т., де Алмейда Энглер Дж., Энглер Г., Ван Монтегю М. и Сайто К. (
1997
). Регуляция ассимиляции серы высшими растениями: переносчик сульфатов, индуцированный в корнях, лишенных сульфатов, играет центральную роль в Arabidopsis thaliana .Проц. Натл. акад. науч. США
94
,11102
–11107
. 62.
62.Талалай, П., и Фэйи, Дж.В. (
2001
). Фитохимические вещества крестоцветных растений защищают от рака, модулируя метаболизм канцерогенов.Дж. Нутр.
131
,3027S
–3033
С.63.Textor, S., Bartram, S., Kroymann, J., Falk, K.L., Hick, A., Pickett, J.A., and Gershenzon, J. (
2004
). Биосинтез глюкозинолатов, полученных из метионина, в Arabidopsis thaliana : рекомбинантная экспрессия и характеристика метилтиоалкилмалатсинтазы, конденсирующего фермента цикла удлинения цепи.Планта
218
,1026
–1035
.64.Томпсон, Дж. Д., Хиггинс, Д. Г., и Гибсон, Т. Дж. (
1994
). CLUSTAL W: Повышение чувствительности последовательного множественного выравнивания за счет взвешивания последовательностей, штрафов за пробелы для конкретных позиций и выбора матрицы весов.Рез. нуклеиновых кислот.
22
,4673
–4680
. 65.
65.Воклар, П., Коприва, С., Фелл, Д., Сутер, М., Штичер, Л., фон Балльмоос, П., Крахенбюль, У., Ден Кэмп, Р.О., и Брунольд, К. (
2002
). Контроль потока ассимиляции сульфата в Arabidopsis thaliana : Аденозин-5′-фосфосульфатредуктаза более чувствительна, чем АТФ-сульфурилаза, к отрицательному контролю тиолами.Завод J.
31
,729
–740
.66.Видмар, Дж. Дж., Шьорринг, Дж. К., Турейн, Б., и Гласс, А. Д. М. (
1999
). Регуляция гена hvst1 , кодирующего высокоаффинный переносчик сульфата из Hordeum vulgare .Завод Мол. биол.
40
,883
–892
.67.Видмар, Дж. Дж., Тагмаунт, А., Катала, Н., Турен, Б., и Давидян, Дж.-К.Э. (
2000
). Клонирование и характеристика корневого специфичного переносчика сульфатов с высоким сродством из Arabidopsis thaliana .ФЭБС Письмо.
475
,65
–69
. 68.
68.Ямасаки К. и др. (
2005
).Структура раствора основного ДНК-связывающего домена Arabidopsis thaliana Нечувствительный к этилену3-подобный3.Дж. Мол. биол.
348
,253
–264
.69.Янагисава С., Ю С.-Д. и Шин Дж. (
2003
). Дифференциальная регуляция стабильности EIN3 посредством передачи сигналов глюкозы и этилена в растениях.Природа
425
,521
–525
.70.Йошимото, Н., Иноуэ Э., Сайто К., Ямая Т. и Такахаши Х. (
2003
). Транспортер сульфата, локализующий флоэму, Sultr1;3, опосредует перераспределение серы от источников к органам-приемникам у арабидопсиса.Физиол растений.
131
,1511
–1517
.71.Йошимото Н., Такахаши Х., Смит Ф.В., Ямая Т. и Сайто К. (
2002
). Два различных высокоаффинных переносчика сульфата с различной индуцибельностью опосредуют поглощение сульфата корнями Arabidopsis .
Завод J.
29
,465
–473
.Примечания автора
© Американское общество биологов растений, 2006 г. — коммерческое повторное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.Для коммерческого повторного использования, пожалуйста, свяжитесь с [email protected]
РЕШЕНО:Найти все подгруппы (№24,+). Укажите порядок каждую подгруппу, которую вы нашли.
Стенограмма видео
Здравствуйте. А вот и надо определить геометрию молекулы с формулой сера тоже влетела в хлор. Таким образом, мы должны определить его точечную группу геометрии и показать элементы симметрии, так что до сих пор имеет шесть валентных электронов, которые составляют три, три года, 23 P четыре, то есть всего шесть электронов.Э-э, и в течение четырех из этих выборов четыре из этих электронов будут формировать костяные виды или религии. Поэтому будет одна длинная пара. Таким образом, новая структура этой молекулы может быть показана как эта. Так что здесь нас просто не волнует немецкое дерево, и теперь мы будем определять геометрию. Итак, у Логана должно быть три э-э-э, у Лигона три пары э-э-э, одна пара, так как у Альфреда 11 пар. Итак, теперь нам нужно определить геометрию. Ах, значит, нам нужно определить местонахождение Флоренции таким образом, чтобы они испытали наименьшее отталкивание.Значит им повезло, у них угол между двумя флоренсами должен быть 1 80. И просвет будет располагаться в перпендикулярной плоскости. Так примерно это выглядит так, опять комок пар и пока одна пара. Так что это она увидела геометрию, которая имеет группу С. В точку. Итак, теперь покажем элементы симметрии С. Два, С. Два поворота. Доступ находится здесь, в о, извините. Типа в сере ну в хлорной сере хлорной плоскости. Итак, это наш С. Два. А также есть две фресковые плоскости.Один проходит через серный грипп и серный самолет, а другой — через серный поток Кларенса.
Поэтому будет одна длинная пара. Таким образом, новая структура этой молекулы может быть показана как эта. Так что здесь нас просто не волнует немецкое дерево, и теперь мы будем определять геометрию. Итак, у Логана должно быть три э-э-э, у Лигона три пары э-э-э, одна пара, так как у Альфреда 11 пар. Итак, теперь нам нужно определить геометрию. Ах, значит, нам нужно определить местонахождение Флоренции таким образом, чтобы они испытали наименьшее отталкивание.Значит им повезло, у них угол между двумя флоренсами должен быть 1 80. И просвет будет располагаться в перпендикулярной плоскости. Так примерно это выглядит так, опять комок пар и пока одна пара. Так что это она увидела геометрию, которая имеет группу С. В точку. Итак, теперь покажем элементы симметрии С. Два, С. Два поворота. Доступ находится здесь, в о, извините. Типа в сере ну в хлорной сере хлорной плоскости. Итак, это наш С. Два. А также есть две фресковые плоскости.Один проходит через серный грипп и серный самолет, а другой — через серный поток Кларенса. Итак, что здесь показано. Я предполагаю, что нам нужно перекатать эту молекулу еще раз, чтобы показать их плоскости росписи. Итак, это первая зеркальная плоскость. И это извините, и это второй самолет Бюро. Итак, теперь давайте подведем итоги наших выводов. Гм Итак, эта молекула имеет следующие элементы симметрии. См., чтобы получить доступ и искать мои плоскости зрения. Ага, стремиться к вертикальным зеркальным плоскостям, а также операцию тождества, о которой, наверное, не стоит упоминать.Да, это ответ на этот вопрос. Надеюсь, я помог вам. Большое Вам спасибо. Пока.
Итак, что здесь показано. Я предполагаю, что нам нужно перекатать эту молекулу еще раз, чтобы показать их плоскости росписи. Итак, это первая зеркальная плоскость. И это извините, и это второй самолет Бюро. Итак, теперь давайте подведем итоги наших выводов. Гм Итак, эта молекула имеет следующие элементы симметрии. См., чтобы получить доступ и искать мои плоскости зрения. Ага, стремиться к вертикальным зеркальным плоскостям, а также операцию тождества, о которой, наверное, не стоит упоминать.Да, это ответ на этот вопрос. Надеюсь, я помог вам. Большое Вам спасибо. Пока.
SFLD — Подгруппа — Образование тиоэфирной связи, требующее двух вспомогательных кластеров железо-сера
| Семья известна | |||||||
| Всего | 100% | Семья неизвестна | |||||
| Функциональные домены | 1448 | 112 | 1 | 1335 | |||
| ЮниПротКБ | 2376 | 0 | 144 | 2232 | |||
| ГИ | 4548 | 268 | 1 | 4279 | |||
| Конструкции | 0 | ||||||
| Реакции | 0 | ||||||
Функциональные домены этой подгруппы последний раз обновлялись 10 июня 2017 г. | |||||||
| Последний раз новые функциональные домены добавлялись в эту подгруппу 22 июня 2014 г. | |||||||
Все члены этой подгруппы ответственны за формирование тиоэфирных связей в продуктах субстрата и требуют двух вспомогательных кластеров железо-сера в дополнение к каноническому кластеру RSS.
Загрузка статических файлов
| Имя файла | Описание | Параметры | Статистика |
|---|---|---|---|
| сеть.sg1384.bs60.mek250K.xgmml | Один узел на сеть последовательностей | мин. битрейт = 60 максимальное количество ребер = 250K | размер = 129M num_edges = 250000 num_nodes = 1448 |
| репнет.sg1384.th50.pE20.mek250K.xgmml | Репрезентативная сеть: каждый узел представляет собой группу подобных последовательностей | порог сходства узлов = 50 максимальное количество ребер = 250K мин -log10 E = 20 | размер = 7,9M num_edges = 24588 num_nodes = 306 |
sfld_alignment_sg1384. msa msa | Выравнивание аннотированной последовательности, Стокгольмский формат | 594 последовательности Размер: 428K |
Общее количество функциональных доменов в этой группе.
Количество функциональных доменов, которые были вручную или автоматически назначены семейству.
Количество функциональных доменов, которые не были назначены семейству.
Количество структур, доступных из PDB для членов этой группы.
Количество функциональных доменов со 100% консервативными остатками
Количество функциональных доменов с менее чем 100% консервативными остатками
Подгруппа ┃ Семья ┃
Глубина многоуровневой иерархии подгрупп.
Ученые РУДН проанализировали
изображение: нековалентные взаимодействия. посмотреть больше
посмотреть больше
Фото: Кямран Махмудов
Международная группа ученых в составе приглашенного иностранного профессора РУДН Кямрана Махмудова проанализировала химические связи в белках на основе серы и других элементов 16-й группы таблицы Менделеева.Такие атомы называются халькогенами, а изученные связи известны как халькогенные связи. Результаты опубликованы в журнале Dalton Transactions и будут представлены на Международной Чугаевской конференции по координационной химии, которая пройдет со 2 по 6 октября в Нижнем Новгороде (Россия).
«За последние два года в научной базе данных Web of Science публиковалось более 100 научных работ по халькогеновому связыванию в год, — поясняет ведущий автор работы Кямран Махмудов.- «Интерес к этой теме рос в геометрической прогрессии в течение десятилетия, но, к удивлению, не было опубликовано обобщенной статьи об использовании халькогенных связей в синтезе, катализе и конструировании материалов, актуальной для современной химии. Мы считаем, что эта точка зрения, которая систематизирует существующую информацию о приложениях халькогеновой связи заполнит этот пробел и привлечет больше внимания к этой новой растущей области исследований».
Расположение атомов внутри молекулы определяется ковалентными связями.Они образуются, когда атомы имеют общие пары электронов, и ни один из них не «забирает» электрон полностью. Когда речь идет о белковых молекулах, ковалентные взаимодействия между атомами определяют первичную структуру молекулы («цепочку» аминокислот).
Наряду с ковалентными связями между атомами и многоатомными частицами существуют нековалентные взаимодействия. Нековалентные связи (аэрогенные, галогенные, халькогенные, пниктогенные, тетрел и икосагены) образуют элементы 13-18 групп периодической таблицы: водород, галогены (такие как хлор, бром, фтор, йод), халькогены (элементы подгруппы кислорода и серы), пниктогены (мышьяк, сурьма, висмут).Атомы этих химических элементов обладают положительным электростатическим потенциалом. Другими словами, эти атомы приобретают положительный заряд, который притягивает к себе отрицательно заряженные атомы химических элементов. Это рабочий принцип кислот Льюиса: их кислотный центр притягивает отрицательно заряженные молекулы (обогащенные электронами, которые придают им этот отрицательный заряд).
«Именно благодаря нековалентным взаимодействиям кластеры атомов или молекул могут существовать в конденсированном состоянии — в виде жидкости или твердого тела.Эти взаимодействия играют большую роль, когда мы имеем дело с полимерами, — сказал Кямран Махмудов. — В частности, различные белковые комплексы объединяются посредством нековалентных взаимодействий либо друг с другом, либо с нуклеиновыми кислотами с образованием рибосом, хроматина, вирусов или с липидами для составляют липопротеиновые мембраны. Таким образом, нековалентные взаимодействия составляют основу важных биологических структур, и их роль в биологии особенно важна».
Ученые открыли, как химические элементы из группы халькогенов образуют нековалентные химические связи.В эту группу входят кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po) и искусственно созданный радиоактивный ливерморий (Lv).
Халькогенная связь является одним из видов нековалентных взаимодействий. Атом халькогена связан с молекулой ковалентными связями, но имеет один или несколько положительно заряженных участков. За счет притяжения зарядов «+» к «-» атом халькогена присоединяется к другим частям молекулы, имеющим отрицательно заряженные участки. Так образуется халькогеновая связь.Это один из механизмов сворачивания белковой молекулы, сохраняющей ее форму.
Связывание халькогена обычно наблюдается в веществах в твердом состоянии. Но в некоторых исследованиях халькогены проявляли активность и в растворе. Это очень важное свойство, поскольку оно делает халькогены полезными для аналитической химии и медицины. Более того, уже известно, что халькогенная связь (главным образом взаимодействие серы с кислородом) играет важную роль в биологических системах.Ученые считают, что мы должны начать думать о включении халькогенов в разработку лекарств. С помощью множественных халькогеновых связей между центрами серы, селена и теллура мы можем создать нанотрубки, которые будут содержать другие молекулы.
«Мы надеемся, что эти примеры и связанное с ними обсуждение привлекут больше внимания к этой захватывающей области практического применения халькогена. Более того, мы можем ожидать, что связывание халькогена будет признано Международным союзом теоретической и прикладной химии (IUPAC) в ближайшем будущем. », — заключил ученый.
###
Журнал
Дальтон Транзакции
Отказ от ответственности: AAAS и EurekAlert! не несут ответственности за достоверность новостных сообщений, размещенных на EurekAlert! содействующими учреждениями или для использования любой информации через систему EurekAlert.
Гидрофобность подгрупп аминокислот в белках — Университет Джонса Хопкинса
TY — JOUR
T1 — Гидрофобность подгрупп аминокислот в белках
AU — Lesser, Glenn J.
AU — Rose, George D.
PY 1990
Y1 — 1990
N2 — Исследования фолдинга белков часто используют площади и объемы для оценки гидрофобного вклада в конформационную свободную энергию (Richards, FM Annu. Rev. Biophys. Bioeng. 6:151–176, 1977).Мы рассчитали среднюю площадь, скрытую при сворачивании, для каждой химической группы в каждом остатке в наборе белков, выявленных с помощью рентгеновских лучей. Эти измерения вместе со стандартным размером резонатора для каждой группы задокументированы в таблице. Замечено, что в среднем каждый тип группы занимает постоянную долю площади своего стандартного состояния. Среднюю площадь, захороненную большинством, хотя и не всеми группами, можно точно оценить, суммируя вклады трех характерных параметров, соответствующих трем типам атомов: (1) углерод или сера, которые в среднем оказываются захороненными на 86%; (2) нейтральный кислород или азот, которые в среднем заглублены на 40%; и (3) заряженный кислород или азот, которые в среднем заглублены на 32%.
AB — Исследования фолдинга белков часто используют площади и объемы для оценки гидрофобного вклада в конформационную свободную энергию (Richards, F.M. Annu. Rev. Biophys. Bioeng. 6:151–176, 1977). Мы рассчитали среднюю площадь, скрытую при сворачивании, для каждой химической группы в каждом остатке в наборе белков, выявленных с помощью рентгеновских лучей. Эти измерения вместе со стандартным размером резонатора для каждой группы задокументированы в таблице. Замечено, что в среднем каждый тип группы занимает постоянную долю площади своего стандартного состояния.Среднюю площадь, захороненную большинством, хотя и не всеми группами, можно точно оценить, суммируя вклады трех характерных параметров, соответствующих трем типам атомов: (1) углерод или сера, которые в среднем оказываются захороненными на 86%; (2) нейтральный кислород или азот, которые в среднем заглублены на 40%; и (3) заряженный кислород или азот, которые в среднем заглублены на 32%.
KW — гидрофобный эффект
KW — гидрофобность
KW — сворачивание белка
KW — доступность растворителя
UR — http://www.

