Подгруппа серы, сеная кислота
Просмотр содержимого презентации
«Сера и её соединения»

ПОДГРУППА СЕРЫ
План урока:
1. Характеристика подгруппы серы.
2. Физические свойства серы.
3. Аллотропные видоизменения серы.
4. Химические свойства серы.
5. Применение серы.

Цель урока: Дать понятие о положении серы в периодической системе химических элементов Д.И.Менделеева, продолжать учить составлять уравнения химических реакций, определять их тип, называть полученные соединения. Учить умению работать самостоятельно и в коллективе, выделять главное, сравнивать , делать выводы
Знать : Положение неметаллов в периодической системе. Особенности строения атомов неметаллов. Основные закономерности изменения состава и свойств: а) простых веществ неметаллов б) состава водородных соединений неметаллов в) состава высших оксидов и соответствующих кислородсодержащих кислот, образованных элементами, одного периода и одной группы главной подгруппы
УМЕТ Ь: Записывать формулы

Характеристика подгруппы серы.

Характеристика подгруппы серы.
Определите в каком приведенном ниже примере изображено заполнение электронов для атома серы

Характеристика подгруппы серы
Сера может иметь валентность: Ⅱ , Ⅳ , Ⅵ .
Объясните в каких случаях и за счет чего?

Аллотропные модификации серы

Физические свойства серы
На столах выдан кусочек серы опишите его физические свойства по плану:
- Цвет
- Агрегатное состояние вещества
- Запах
- Растворимость (флотация)
- Ядовито или не ядовито вещество.
- Металл или неметалл

Химические свойства серы

Химические свойства серы
Предположите в какие реакции может вступать сера.
Алгоритм к действию :
- Помните что сера может проявлять валентность Ⅱ , Ⅳ , Ⅵ
- Так как сера не металл, то в какие реакции будет вступать, с какими соединениями?
- С металлами будет проявлять валентность равную ?
- С неметаллами валентность равную?
Напишите соответствующие уравнения реакций, назовите вещества, укажите класс соединений
( где это возможно), тип химической связи.

Горение серы в селитре

Химические свойства серы
Проверьте свои предположения :
- S+O 2 → SO 2
- S+ 2 Na → Na 2 S сульфид натрия
- S + Mg → MgS сульфид магния
- 3 S+ 2 Al → Al
- S + H 2 → H 2 S сероводород
- 2 S + C→ CS 2 сероуглерод

Применение серы
Получение
пороха
В с/х для
борьбы с
вредителями
Краски
Сера
Производство
серной кислоты
Для
дезинфекции
Резина
Спички
Медицине:
Для лечения кожных
заболеваний

Итоги урока:
- 1. задание на дом: § 21 стр. 99 №3
- Творческое задание почему процесс обеззараживания помещений от пролитой ртути называется демеркуризацией?
- Какими свойствами обладают
Просмотр содержимого презентации
«Серная кислота»

Серная кислота и её соли
Цель урока : углубить понятие о кислотах на
примере серной кислоты, продолжать учить
составлять уравнения химических реакций,
определять их тип, называть полученные
соединения.
Учить умению работать самостоятельно и в коллективе, выделять главное, сравнивать , делать выводы.
Знать : состав и свойства серной кислоты :
а) физические б) химические в) состава высших оксидов и соответствующих кислородсодержащих кислот,
УМЕТ Ь: Составлять уравнения реакций:
1. характеризующих химические свойства кислородсодержащих кислот, называть полученные вещества, определять классы соединений, тип связи.

План урока
Физические свойства серной кислоты
Структурная формула серной кислоты
Химические свойства серной кислоты
Получение серной кислоты
Применение серной кислоты

Физические свойства серной кислоты Структурная формула серной кислоты
- Серная кислота – бесцветная , маслянистая,
тяжелая жидкость. Обладает сильным
водоотнимающим свойством (гигроскопичностью)
Давайте вспомним технику безопасности при
работе с кислотами
при попадании кислоты на кожу
промыть под большим потоком
воды, нейтрализовать раствором
соды

NaOH
Cu(OH) 2
CuO
BaCl 2
Na 2 CO 3
Na 2 SiO 3
cu
Химические свойства серной кислоты
- Перечислите с какими классами соединений реагируют все кислоты:
- Составьте уравнения реакций по предложенной схеме:
Zn
H 2 SO 4

Качественная реакция на сульфат ионы

Взаимодействие серной кислоты с медью

Получение серной кислоты
- Стадия 4 FeS 2 +11O 2 → 2Fe 2 O 3 + 8SO 2
- Стадия 2SO 2 + O 2 →2S O 3
- Стадия S O 3 + H 2 O → H 2 SO 4
( показ анимации производства серной кислоты)


Производство серной кислоты

- Получение серной кислоты. Часть 1.swf
- Получение серной кислоты. Часть 2.swf
- Получение серной кислоты. Часть 3.swf

Применение серной кислоты
multiurok.ru
Подгруппа серы — Справочник химика 21
Водородные соединения элементов подгруппы серы [c.345]Приведите формулы оксидов и оксокислот элементов подгруппы серы со степенью окисления — -4. Как изменяются кислотно-основные и окислительно-восстановительные свойства в подгруппе [c.115]
У других элементов данной подгруппы (серы, селена и теллура) спаренные электроны s- и р-орбиталей легко возбуждаются и могут переходить на соответствующие d-орбитали. При этом увеличивается число неспаренных электронов, а значит и валентность элементов до четырех [c.353]
В водородных соединениях элементов подгруппы серы полярность химической связи Э-Н невысока и проявления основных свойств элемента не наблюдается. Однако, в силу ослабления химической связи Э-Н и возможности ее [c.345]
И. Объясните многообразие оксокислот элементов подгруппы серы. [c.115]
Водородные соединения элементов подгруппы серы в водном растворе являются слабыми кислотами. [c.467]
Атомы элементов подгруппы хрома имеют следующее распределение электронов в двух крайних слоях Сг и Мо)8+5)1, (8+4)2. Все эти элементы являются металлами и в химических реакциях проявляют восстановительные свойства. Они не образуют отрицательных ионов. В отличие от элементов подгруппы серы элементы ряда хрома не образуют с водородом газообразных соединений. В зависимости от числа теряемых электронов элементы ряда хрома проявляют различную валентность. [c.293]
Сера. У следующего члена подгруппы— серы— способность к ассоциации атомов выражена значительно сильнее. Твердая сера имеет много модификаций, а жидкая обладает необычными свойствами, поэтому строение серы вызывает большой интерес и изучалось неоднократно. Ниже 95,6° С наиболее устойчива ромбическая сера. При 95,6° С она [c.209]
Разумеется, не одни лишь особенности строения атомных ядер изотопов определяют содержание элементов в земной коре. Важное значение имеет и геологическая история элемента (так, в земной коре наблюдается дефицит легколетучих элементов — ртути, элементов подгруппы серы и т. п.). Однако тип атомного ядра изотопа, несомненно, относится к числу решающих факторов. [c.20]
Перечислите важнейшие соединения элементов подгруппы серы, их способы получения и области применения. [c.115]
Теперь попробуем применить этот же принцип к описанию элемента полония (№ 84). Вряд ли Вам что-либо известно об этом элементе. Элемент полоний расположен в главной подгруппе VI группы. На внешнем уровне 6 электронов. Число орбиталей значительно больше — 36. Это позволяет предположить наличие у простого вещества металлических свойств (это предположение также возникает из-за четко проявляющегося усиления металлических свойств в подгруппе серы). [c.89]
Элементы подгруппы серы [c.196]
Для кислорода и подгруппы серы способность к комплексообразованию, так же как и для подгруппы фосфора, сильно ослаблена. Это типичные неметаллы, и только у теллура проявляются в какой-то степени металлические свойства, и он в растворах сильных кислот может давать катионы Те +, например ТеЬ. [c.395]
Сера, селен и теллур образуют разнообразные серо-, селен- и теллурсодержащие производные углеводородов. Особенно сильно развита химия серосодержащих соединений. Атомы подгруппы серы имеют близкие по структуре электронные конфигурации 8[Ке] 8е[Аг] и [c.514]
Элементы подгруппы хрома по химическим свойствам значительно больще отличаются от элементов подгруппы серы, чем это имеет место в главной и побочной подгруппах V группы периодической системы, и проявляют заметное сходство с соседями по V группе — ванадием, ниобием и танталом. [c.569]
Указать положение элементов подгруппы серы в периодической системе Менделеева, строение и размеры их атомов и проявляемые ими валентности. [c.101]
ЭЛЕМЕНТЫ ПОДГРУППЫ СЕРЫ, ИХ ВОДОРОДНЫЕ СОЕДИНЕНИЯ. [c.105]
Так, например, элементы шестой главной подгруппы сера, селен и теллур в своей высшей степени окисления — -6 в концентрированных кислотах Н2504, Н25е04, НеТеОб являются только окислителями, так как больше не могут отдавать электронов. Сера, селен и теллур в низшей степени окисления —2 в соединениях НаЗ, НгЗе и НгТе проявляют только восстановительные свойства, так как больше не могут присоединять электронов. Атомы этих элементов в промежуточной степени окисления +4 в соединениях типа Н2ЭО3 могут быть в зависимости от условий как восстановителями, так и окислителями, причем с более сильным окис сителем они будут играть роль восстановителя, а с более сильным восстановителем — роль окислителя. Таким образом, атомы этих элементов в степени окисления +6 проявляют аналогичные свойства и значительно отличаются от атомов, находящихся в степени окисления -(-4 или, тем более, в степени окисления —2. Это относится и к другим главным и побочным подгруппам периодической системы Д. И. Менделеева, элементы которых проявляют различные степени окисления. [c.59]
Элементы подгруппы серы, строение их атомов, восстановительно-окислительные свойства. Аллотропия серы. Соединения серы и ее аналогов с водородом. Сульфиды и полисульфиды и их свойства. [c.105]
Водородное соединение элемента подгруппы серы весит. 2,43 2, занимает при температуре 27° давлении 750 лш рт. ст. объем 750. ш. Какой это элемент [c.106]
Дайте общую характеристику элементов подгруппы серы [c.43]
Если только формально соблюдать принцип нарастания атомного веса, то в подгруппе серы надо было бы поместить иод, что явно противоречит закону размещения в подгруппе родственных элементов, ибо иод не имеет ничего общего с серой и селеном. ТочнО так же нельзя поместить теллур в подгруппу галогенов. Поэтому Д. И. Менделеев, учитывая химические свойства Л и Те, справедливо поместил их в родственные подгруппы, допустив нарушение принципа нарастания. атомных весов. [c.281]
Хром, молибден и вольфрам составляют побочную подгруппу шестой группы периодической системы. По многим своим свойствам эти элементы сильно отличаются от элементов главной подгруппы — серы, селена и теллура, однако в некоторых свойствах между ними проявляется сходство. [c.223]
Элемент полоний расположен в главной подгруппе VI группы. На внешнем уровне б электронов. Число орбиталей значительно больше — 36. Это позволяет предположить наличие у простого вещества металлических свойств. (Это предположение также возникает из-за четко проявляющегося усиления металлических свойств в подгруппе серы.) Электронная конфигурация внешнего уровня бв р — такая конфигурация позволяет предположить наличие с
www.chem21.info
Подгруппа кислорода | Дистанционные уроки
22-Окт-2012 | комментария 2 | Лолита Окольнова
Элементы 6-й группы главной подгруппы. Очень часто употребляемое название — ХАЛЬКОГЕНЫ — «руду рождающие». Думаю, этим названием они в большей степени обязаны сере, чем кислороду 🙂
В формате подготовки к ЕГЭ мы рассмотрим физические и химические свойства двух элементов — кислорода O и серы S.
Электронное строение
nS2 np4

Но тут не все так просто.
К кислороду претензий нет — у него электронное строение соответствует общей формуле, а вот у серы и остальных элементов есть и другие варианты… Если детально рассмотреть строение p-элементов по периодам, то нужно обратить внимание, что с 3-го периода у p- элементов появляется свободная d-орбиталь, на которую могут переходить электроны.

Именно поэтому степень окисления серы может быть не только -2.
Итак, выводы:
- Валентность элементов:
- валентность кислорода = 2,
- валентность серы — 2,4,6
- Степени окисления:
- степень окисления кислорода = -2 — типичный неметалл, сильный окислитель;
- степень окисления серы = -2(минимальная степень окисления), +2 (редко), +4, +6 (максимальная степень окисления) в минимальной с.о. S будет проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства
 Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Сера — S — твердое вещество, хотя мы пишем формулу этого вещества как S , но обычно образуются кристаллы состава S4 и S8. Обычно сера — пластичное вещество коричневого или желтого цвета.
На воздухе сера горит: S + O2 = SO2 (бесцветный газ с резким запахом)
Химические свойства
Свойства кислорода
| Окислительные свойства | Восстановительные свойства |
| Кислород может проявлять восстановительные свойства только к элементу, у которого больше электроотрицательность, т.е., он должен стоять в периодической системе элементов правее кислорода. Это КОРОЛЬ НЕМЕТАЛЛОВ — F:
|
Свойства серы:
| Окислительные свойства | Восстановительные свойства |
|
|
Cернистая кислота — h3SO3 (степень окисления серы= +4). Соли — сульфиты
Серная кислота — h3SO4 (cтепень окисления серы=+6). Соли — сульфаты
Их свойства мы рассмотрим отдельно.
Категории: |
Обсуждение: «Подгруппа кислорода»
(Правила комментирования)distant-lessons.ru
Конспект по химии «подгруппа кислорода. сера » (9класс)
«Подгруппа кислорода. Сера.»
Цель : изучить особенности строения атома серы в основном и возбужденном состоянии, аллотропные модификации серы, основные свойства серы и области её применения
Задачи :
1. Образовательная – изучить особенности строения атома серы в основном и возбужденном состоянии, аллотропные модификации серы, физические и химические свойства: взаимодействие с активными металлами, неметаллами, окислительно- восстановительные свойства.
2. Развивающая – развивать у учащихся умения работать с дополнительной литературой при подготовке к уроку, проводить эксперимент, наблюдать за результатами, делать выводы.
3. Воспитательная – формировать у учащихся
-взгляды и убеждения, соответствующие здоровому образу жизни, потребности в труде, познании, творчестве;
-чувство ответственности, умения работать в коллективе, отстаивать свое мнение и уважать мнение других.
Ход урока.
Проверка знаний
Учитель:На прощлом уроке мы начали изучение VI группы главной подгруппы ПСХЭ(подгруппы кислорода).
Какие элементы входят в состав VI-А подгруппы?
O, S, Se, Te, Po
Что общего и в чем различие в строении атомов элементов VI-А подгруппы?
Учащиеся на доске изображают особенности строения атомов элементов VI-А подгруппы и отмечают сходство и различие в строении атомов элементов
Общее: количество электронов на внешнем энергетическом уровне
Различие: число энергетических уровней
Каким образом изменяются свойства элементов в группе сверху вниз?
Объясните причины
Металлические свойства увеличиваются, неметаллические свойсва уменьшаются, т. к. радиус атома возрастает, энергия связи электронов внешнего энергетического уровня с ядром уменьшается, следовательно, они слабее удерживаются ядром и легче отщепляются.
Изучение нового материала
На прошлом уроке мы изучали особенности строения и свойства кислорода, темой нашего сегодняшнего урока будет Сера.
Сера была известна народам с глубокой древности. Свое название она получила от санкритского слова «сира»- светло- желтый.
Сера применялась в Древнем Египте- уже за 2 тыс. лет до н. э.- для приготовления красок, косметических средств, для беления тканей;
в Древнем Риме- для лечения кожных заболеваний; в Древней Греции серу сжигали для дезинфекции вещей и воздуха в помещениях.
средние века у алхимиков сера была выражением одного из «основных начал природы» и благодаря её горючести обязательной составной частью «философского камня».
В Ветхом завете также упоминается сера: на расплавленной сере сжигали грешников. Запах горящей серы олицетворяет запах ада.
Запишем строение атома серы
S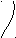
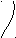
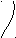
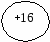 2 8 6 1s22s22p63s23p43d0
2 8 6 1s22s22p63s23p43d0
Составьте схему расположения электронов на энергетических уровнях?
Имея 2 свободных электрона на внешнем энергетическом уровне, сера в обычном состоянии 2-хвалентна и проявляет степень окисления-2.
В кислородных соединениях сера может проявлять валентность IV и VI и степени окисления +4 и +6
Объясните причину, основываясь на особенностях строения атома серы?
При переходе в возбужденное состояние электроны распариваются и сера оказывается способной проявлять степени окисления +4 и +6
В природе сера встречается в 3-х формах:
Самородная:
Вулканическая сера образуется при извержении вулканов, содержит примеси, требует тщательной очистки.
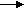 2H2S+ SO2 3S + 2H2O
2H2S+ SO2 3S + 2H2O
Комовую серу получают из сульфидов.
Серный цвет— порошок желтого цвета, применяют для экспериментов.
Черенковая сера- самая чистая
Сульфидная:
PbS- свинцовый блеск
Cu2S- медный блеск
ZnS- цинковая обманка
HgS- киноварь
H2S- сероводород( в природном газе- яд!; в минеральных источниках- лечебное средство от заболеваний кожи). Уникальное месторождение сероводорода- вода Черного моря.
Сульфатная:
Глауберова соль(Na2SO4 * 10H2O)- сильное слабительное средство
Гипс(CaSO4 * 2H2O)
Горькая соль(MgSO4 * 7H2O)
На прошлом уроке мы отмечали особенности аллотропных соединений кислорода.
Вспомним определение аллотропии?
Аллотропия- способность атомов одного элемента образовывать несколько простых веществ.
Какие аллотропные модификации кислорода вам известны?
Кислород О2 и озон О3
Для серы также характерны аллотропные модификации.
3 группа учащихся проводит эксперимент получения пластической серы.
По ходу эксперимента идет комментарий ученика:
Наиболее устойчива модификация, известная под названием ромбической серы( S8)
При нагревании происходит образование пластической серы- вязкого вещества темно- коричневого цвета.
В средние века пластическую серу использовали в качестве зубной пасты для дезинфекции полости рта.
По мере остывания пластическая сера будет опять переходить в ромбическую.
Рассмотрим основные свойства серы?
Физические свойства: твердое кристаллическое вещество желтого цвета, не проводит тепло и электрический ток, не растворяется в воде.
Учащийся проводит эксперимент, подтверждающий несмачиваемость серы водой( порошок серы насыпать в стакан с водой).
Сера- типичный химически активный неметалл, взаимодействующий с металлами, неметаллами, сложными веществами.
4 группа учащихся составляет уравнения соответствующих реакций, используя электронный баланс, уравнивают.
2Na0 +S0 = Na2S-2
Na0 -1e— = Na+1 2 в-ль
S
 0 + 2e— = S-2 2 1 о-ль
0 + 2e— = S-2 2 1 о-ль
H20 + S0 = H2S-2
H
 20 -1e— *2 = 2H+1 1 в-ль
20 -1e— *2 = 2H+1 1 в-ль
S0 + 2e— = S-2 2 1 о-ль
S
 0 + O20 = SO2
0 + O20 = SO2
S0 — 4e— = S+4 4 1 в-ль
O20 +2e— *2 =2O-2 1 о-ль
Какие свойства- окислительные или восстановительные- наиболее характерны для серы- простого вещества?
И окислительные, и восстановительные.
5 группа учащихся рассказывает об областях применения серы.
Применение серы описано еще в романе А. Дюма « Граф Монте-Кристо». Герой романа аббат Фариа притворился, что у него кожная болезнь, и ему дали для лечения серу, которую предприимчивый аббат использовал для изготовления пороха.
Основные составные компоненты пороха( «греческого огня»): сера, калийная селитра, уголь. С его помощью еще в 670г. защитники Константинополя сожгли арабский флот.
В настоящее время серу используют в производстве спичек, бумаги, резины, красок, взрывчатых веществ, лекарственных препаратов, пластмассы, серной кислоты, «сусального золота» SnS2 –для покрытия куполов церквей, золочения украшений дворцов и скульптур, в сельском хозяйстве- для борьбы с вредителями.
Домашнее задание.
§17. упр 3, 4, 6 творческое задание придумать сказку о сере
infourok.ru
Общая характеристика подгруппы кислорода. Сера, сероводород, оксиды серы.
 Урок химии 22 — Общая характеристика подгруппы кислорода. Сера, сероводород, оксиды серы. Производство и свойства серной кислоты.
Урок химии 22 — Общая характеристика подгруппы кислорода. Сера, сероводород, оксиды серы. Производство и свойства серной кислоты.
Подгруппу составляют элементы главной подгруппы VI группы периодической таблицы: кислород, сера, селен, теллур, полоний. На внешнем энергетическом уровне у них по шесть электронов – nS2nP4. В подгруппе сверху вниз возрастают металлические свойства и ослабляются неметаллические, полоний является радиоактивным металлом. Характерные степени окисления для этих элементов: -2, 0, +4, +6. В свободном виде в природе встречаются кислород и сера. В связанном виде – кислород в воде, сера в виде соединений: ZnS (цинковая обманка, сульфид цинка), PbS (cвинцовый блеск, сульфид свинца), FeS2 (железный колчедан, серный колчедан, пирит), СаSO4·2H2O (гипс), МgSO4·7H2O (горькая соль), Na2SO4·10H2O (глауберова соль).
Сера представляет собой, твердое хрупкое вещество желтого цвета, существующая в виде нескольких аллотропных модификаций – ромбической, моноклинной и пластической.
Получение. Самородную серу выплавляют из горных пород специальными аппаратами — автоклавами. Химическим путем получают по реакциям:
1.Разложение пирита: FeS2 → FeS + S
2.Неполное окисление сероводорода: 2Н2S + O2 → 2S +2H2O
3.Пропусканием через раствор сероводородной кислоты оксида серы (IV): 2H2S + SO2 → 3S + 2H2O.
Химические свойства.
1. Реакция с металлами:
Fe + S → FeS; 2Al + 3S → Al2S3.
2. Реакция с неметаллами:
S + 2Cl2 → SCl4 ; S + O2 → SO2.
3. Взаимодействие с концетрированными растворами сильных кислот:
S + 2H2SO4 (конц) → 3SO2 + 2H2O; S +6HNO3 (конц) → H2SO4 + 6NO2 + 2H2O.
Сероводород.
Сероводород Н2S – ядовитый бесцветный газ с запахом тухлых яиц. Получают по реакции:
FeS + 2HCl → FeCl2 + H2S↑.
Водный раствор представляет собой слабо диссоцирующую серовододную кислоту:
H2S « H+ + HS‾ ; HS‾ « H+ + S2- .
Сероводородная кислота является сильным восстановителем: H2S + 4Cl2 + 4H2O → 8HCl + H2SO4 ; H2S + 3H2SO4 (конц) → 4SO2 + 4H2O.
Оксид серы (IV) и серистая кислота.
Оксид серы (IV) SO2 в лаборатории получают действием на сульфиты сильных кислот, например:
CaSO3 +2 HCl → CaCl2 + H2O + SO2↑
В промышленности получают обжигом сульфидов, серы или железного колчедана:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
Оксид серы является бесцветным газом с резким запахом горячей серы, хорошо растворяющимся в воде. При этом образуется слабая сернистая кислота:
SO2 + H2O ↔ H2SO3
Оксид серы (IV) и сернистая кислота обладают всеми свойствами кислотных оксидов и кислот:
SO2 + Na2O → Na2SO3
SO2 + KOH → KHSO3 ; KHSO3 + KOH → K2SO3 + H2O
H2SO3 + 2NaOH → Na2SO3 + 2H2O
H2SO3 + CaO → CaSO3 + H2O
Соли сернистой кислоты называются сульфитами, например, CaSO3 – сульфит кальция, Сa(HSO3)2 – гидросульфит кальция.
Оксид серы (VI) и серная кислота.
Оксид серы (VI) SO3 – бесцветная жидкость с температурой плавления 16,8оС и температурой кипения 44,8оС.
Оксид серы (VI) получают окислением SO2 под высоким давлением в присутствии катализаторов (Pt, V2O5):
2SO2 + O2 → 2SO3
Оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4.
Раствор оксида серы (VI) в 100% — ной серной кислоте называется олеумом.
Серная кислота H2SO4 — тяжелая бесцветная маслянистая жидкость, хорошо смешивающаяся с водой. Ее раствор в воде является сильной кислотой, она образует два ряда солей: сульфаты и гидросульфаты.
Химические свойства.
Разбавленная серная кислота взаимодействует с металлами, стоящими в ряду напряжений до водорода, с выделением водорода:
Zn + H2SO4 → ZnSO4 + H2↑
При реакции концентрированной серной кислоты с металлами, она как правило восстанавливается до SO2 :
Zn + 2H2SO4(конц) → ZnSO4 + SO2↑ + 2H2O
С оксидами металлов:
CuO + H2SO4 → CuSO4 + H2O
С гидроксидами:
2KOH + H2SO4 → K2SO4 + 2H2O
С солями:
2NaCl + H2SO4 → Na2SO4 + 2HCl
C неметаллами:
С + 2H2SO4 → CO2↑ + 2SO2↑ + 2H2O
Производство контактным способом.
Серную кислоту в промышленности получают двумя способами: контактным и нитрозным. Контактный заключается в производстве SO2, окислении его в SO3 и превращении последнего в Н2SO4. SO2 получают в основном обжигом пирита. Полученный SO2 подвергают тщательной очистке. После очистки SO2 в смеси с воздухом поступает в контактный аппарат, где под действием катализатора V2O5 окисляется в SO3. SO3 затем растворяют в конц. Н2SO4, получая тем самым олеум:
S + O2 → SO2 или 4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
2SO2 + O2 ↔ 2SO3
SO3 + H2O → H2SO4
При нитрозном способе SO2 окисляют оксидом азота (IV). Конечный продукт содержит 78% Н2SO4. Концентрированная Н2SO4 является сильным окислителем.
Это был урок химии 22 — Общая характеристика подгруппы кислорода. Сера, сероводород, оксиды серы. Производство и свойства серной кислоты.
Friend me:
к нашему сайту.
sovety-tut.ru
Главная подгруппа VI группы
Главная подгруппа VI группы
К элементам главной подгруппы VI группы относятся кислород (О), сера (S), селен (Se), теллур (Te) и радиоактивный полоний (Po).
Общая характеристика подгруппы
Элементы главной подгруппы VI группы носят общее групповое название «халькогены». Их атомы являются электронными аналогами, поскольку имеют одинаковое строение внешнего электронного слоя (ns2np4).
р-элементы, неметаллы (кроме полония)
Валентность II, IV; VI
Степени окисления -2, +2, +4, +6 (кислород — исключение)
В невозбужденных атомах имеются 2 неспаренных электрона, которые участвуют в образовании ионных или ковалентных связей с другими атомами (В = II).
Вступая во взаимодействие с более ЭО атомами, сера, селен и теллур (а также Ро) могут переходить в возбужденные состояния, что сопровождается переходом электронов на вакантные d-орбитали.
При этом число неспаренных электронов увеличивается до 4 или 6, вследствие чего атомы могут проявлять В, равную IV и VI.
В атомах О валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s- и р-орбитали. Это исключает возможность перехода атомов О в возбужденные состояния, поэтому кислород во всех соединениях проявляет постоянную В = II.
Имея высокую ЭО (уступает только фтору), атомы кислорода всегда в соединениях заряжены отрицательно (с.о.= -2 или -1). Исключение — фториды OF2 и O2F2
Простые вещества, образуемые элементами данной подгруппы, существуют в виде различных аллотропных модификаций:
O2 — кислород, О3 — озон
S — пластическая, моноклинная, ромбическая
Se — красный, стекловидный, серый
Те — кристаллический, аморфный
Кроме газообразных кислорода и озона, все остальные простые вещества при обычной температуре — твердые.
H2S — сероводород, H2Se — селеноводород, Н2Те — теллуроводород
Бесцветные газы с неприятным запахом. Очень ядовиты. Сильные восстановители. Водные растворы проявляют свойства слабых кислот.
SO2 (г.) Se)2 (тв.), ТеO2 (тв.) — кислотные оксиды
H2SO3 — сернистая кислота, H2SeO3 — селенистая кислота, Н2ТеО3 — теллуристая — слабые кислоты, восстановители.
Кислотные свойства ослабевают. Восстановительная способность уменьшается.
SO3 (ж.) Se)3 (тв.), ТеO3 (тв.) — кислотные оксиды
H2SO4 — серная кислота, H2SeO4 — селеновая кислота — сильные кислоты, Н2ТеО4 — ортотеллуровая — слабая кислота.
Соли: сульфаты, селенаты, теллураты.
examchemistry.com
План-конспект урока по химии (9 класс) на тему: Урок в 9 классе «Подгруппа кислорода. Сера»
Урок в 9 классе «Подгруппа кислорода. Сера.»
Учитель высшей квалификационной категории
Серебрякова А. В.
Цель : изучить особенности строения атома серы в основном и возбужденном состоянии, аллотропные модификации серы, основные свойства серы и области её применения
Задачи :
1. Образовательная – изучить особенности строения атома серы в основном и возбужденном состоянии, аллотропные модификации серы, физические и химические свойства: взаимодействие с активными металлами, неметаллами, окислительно- восстановительные свойства.
2. Развивающая – развивать у учащихся умения работать с дополнительной литературой при подготовке к уроку, проводить эксперимент, наблюдать за результатами, делать выводы.
3. Воспитательная – формировать у учащихся
-взгляды и убеждения, соответствующие здоровому образу жизни, потребности в труде, познании, творчестве;
-чувство ответственности, умения работать в коллективе, отстаивать свое мнение и уважать мнение других.
Тип урока: урок овладения новым материалом.
Структура урока: 1. Организация начала урока
2. Проверка знаний
3. Введение нового материала
4. Закрепление
5. Домашнее задание
6.Окончание урока
Методы обучения, используемые на уроке:
1. Наглядные: а) Наблюдение( особенности строения атома серы)
б) Демонстрация( эксперимент, раскрывающий особенности физических свойств серы, перехода аллотропных модификаций)
2. Словесные: а) Рассказ(история применения серы в древности)
б)Объяснение(особенности физических и химических свойств серы)
3. Практические: а) практическая работа на уроке(исследование аллотропных модификаций серы
4. Упражнения: тестовая работа, помогающая учащимся закрепить полученные знания.
Формы организации познавательной деятельности, применяемые на уроке:
- Фронтальная работа.
- Индивидуальная работа.
- Парная работа.
- Групповая работа.
фронтальный, объяснительно – иллюстративный, наглядный, эксперимент, работа с дидактическим материалом, ИКТ
Характер деятельности учащихся:
- Репродуктивный.
- Частично- поисковый.
- Исследовательский.
План урока.
- Организационный этап: постановка цели и задач урока.
- Проверка знаний особенности строения атомов элементов VI-A подгруппы и причин закономерности их изменения
- Введение нового материала
- Особенности строения атомов серы в основном и возбужденном состоянии
- История появления и использования серы человечеством
- Сера в природе
- Аллотропия серы
- Практическое исследование взаимного перехода аллотропных модификаций серы
- Физические и химические свойства серы
- Промышленное использование серы
3. Закрепление: тестовая работа (5мин.)
4. Домашнее задание.
5. Окончание урока.
Ход урока.
Постановка целей и задач:
Мы продолжаем изучение отдельных элементов периодической системы Д.И.Менделеева и я не сомневаюсь в том, вас ждут сегодня открытия, потому что по словам Пиаже «Понять что-либо, значит открыть вновь». Урок посвящен одному из самых интересных элементов, соединения которого известны с глубокой древности. В средние века считалось, что это обязательная составная часть всех веществ.Сегодня на уроке мы должны изучить особенности строения атомов серы в основном и возбужденном состоянии, физические и химические свойства, составить соответствующие уравнения реакций; провести эксперимент, показывающий основные аллотропные модификации серы.
Учащиеся заранее распределяются по группам. Каждая группа получает задание самостоятельно подготовиться по каждому разделу(строение атомов, нахождение в природе, аллотропия, историческая справка, физические и химические свойства, области применения)
Проверка знаний
Учитель:На прощлом уроке мы начали изучение VI группы главной подгруппы ПСХЭ(подгруппы кислорода).
Какие элементы входят в состав VI-А подгруппы?
O, S, Se, Te, Po
Что общего и в чем различие в строении атомов элементов VI-А подгруппы?
Учащиеся на доске изображают особенности строения атомов элементов VI-А подгруппы и отмечают сходство и различие в строении атомов элементов
Общее: количество электронов на внешнем энергетическом уровне
Различие: число энергетических уровней
Каким образом изменяются свойства элементов в группе сверху вниз?
Объясните причины
Металлические свойства увеличиваются, неметаллические свойсва уменьшаются, т. к. радиус атома возрастает, энергия связи электронов внешнего энергетического уровня с ядром уменьшается, следовательно, они слабее удерживаются ядром и легче отщепляются.
Изучение нового материала
На прошлом уроке мы изучали особенности строения и свойства кислорода, темой нашего сегодняшнего урока будет Сера.
1 группа учащихся
Немало сера знаменита,
И в древности ее Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
Сера была известна народам с глубокой древности. Свое название она получила от санкритского слова «сира»- светло- желтый.
Сера применялась в Древнем Египте- уже за 2 тыс. лет до н. э.- для приготовления красок, косметических средств, для беления тканей;
в Древнем Риме- для лечения кожных заболеваний; в Древней Греции серу сжигали для дезинфекции вещей и воздуха в помещениях.
В средние века у алхимиков сера была выражением одного из «основных начал природы» и благодаря её горючести обязательной составной частью «философского камня».
В Ветхом завете также упоминается сера: на расплавленной сере сжигали грешников. Запах горящей серы олицетворяет запах ада.
Запишем строение атома серы
S 2 8 6 1s22s22p63s23p43d0
Составьте схему расположения электронов на энергетических уровнях?
3d
3p
3s
Имея 2 свободных электрона на внешнем энергетическом уровне, сера в обычном состоянии 2-хвалентна и проявляет степень окисления-2.
В кислородных соединениях сера может проявлять валентность IV и VI и степени окисления +4 и +6
Объясните причину, основываясь на особенностях строения атома серы?
При переходе в возбужденное состояние электроны распариваются и сера оказывается способной проявлять степени окисления +4 и +6
2 группа учащихся:
В природе сера встречается в 3-х формах:
Самородная:
Вулканическая сера образуется при извержении вулканов, содержит примеси, требует тщательной очистки.
2h3S+ SO2 3S + 2h3O
Комовую серу получают из сульфидов.
Серный цвет- порошок желтого цвета, применяют для экспериментов.
Черенковая сера- самая чистая
Сульфидная:
PbS- свинцовый блеск
Cu2S- медный блеск
ZnS- цинковая обманка
HgS- киноварь
h3S- сероводород( в природном газе- яд!; в минеральных источниках- лечебное средство от заболеваний кожи). Уникальное месторождение сероводорода- вода Черного моря.
Сульфатная:
Глауберова соль(Na2SO4 * 10h3O)- сильное слабительное средство
Гипс(CaSO4 * 2h3O)
Горькая соль(MgSO4 * 7h3O)
На прошлом уроке мы отмечали особенности аллотропных соединений кислорода.
Вспомним определение аллотропии?
Аллотропия- способность атомов одного элемента образовывать несколько простых веществ.
Какие аллотропные модификации кислорода вам известны?
Кислород О2 и озон О3
Для серы также характерны аллотропные модификации.
3 группа учащихся проводит эксперимент получения пластической серы.
По ходу эксперимента идет комментарий ученика:
Наиболее устойчива модификация, известная под названием ромбической серы( S8)
При нагревании происходит образование пластической серы- вязкого вещества темно- коричневого цвета.
В средние века пластическую серу использовали в качестве зубной пасты для дезинфекции полости рта.
По мере остывания пластическая сера будет опять переходить в ромбическую.
Рассмотрим основные свойства серы?
Физические свойства: твердое кристаллическое вещество желтого цвета, не проводит тепло и электрический ток, не растворяется в воде.
Учащийся проводит эксперимент, подтверждающий несмачиваемость серы водой( порошок серы насыпать в стакан с водой).
Сера- типичный химически активный неметалл, взаимодействующий с металлами, неметаллами, сложными веществами.
4 группа учащихся составляет уравнения соответствующих реакций, используя электронный баланс, уравнивают.
2Na0 +S0 = Na2S-2
Na0 -1e- = Na+1 2 в-ль
S0 + 2e- = S-2 2 1 о-ль
h30 + S0 = h3S-2
h30 -1e- *2 = 2H+1 1 в-ль
S0 + 2e- = S-2 2 1 о-ль
S0 + O20 = SO2
S0 — 4e- = S+4 4 1 в-ль
O20 +2e- *2 =2O-2 1 о-ль
Какие свойства- окислительные или восстановительные- наиболее характерны для серы- простого вещества?
И окислительные, и восстановительные.
5 группа учащихся рассказывает об областях применения серы.
Применение серы описано еще в романе А. Дюма « Граф Монте-Кристо». Герой романа аббат Фариа притворился, что у него кожная болезнь, и ему дали для лечения серу, которую предприимчивый аббат использовал для изготовления пороха.
Основные составные компоненты пороха( «греческого огня»): сера, калийная селитра, уголь. С его помощью еще в 670г. защитники Константинополя сожгли арабский флот.
В настоящее время серу используют в производстве спичек, бумаги, резины, красок, взрывчатых веществ, лекарственных препаратов, пластмассы, серной кислоты, «сусального золота» SnS2 –для покрытия куполов церквей, золочения украшений дворцов и скульптур, в сельском хозяйстве- для борьбы с вредителями.
Закрепление изученного материала( тест)
Вариант 1
Вставьте пропущенные слова
1. Сера- элемент… группы, … подгруппы.
2. В атоме серы …электронов.
3. На внешнем уровне в атоме …электронов.
4. Какие степени окисления проявляет сера:
а) +2, +3, +4.
б) –2, 0, +4, +6.
в) –1, –2, 0, +6.
5. Флотация – это свойство серы
а) растворяться в воде;
б) не смачиваться в воде;
в) частично растворяться в горячей воде.
6. При горении серы образуется:
а) сероводород;
б) сульфид;
в) сернистый газ.
7. В какой форме сера встречается в природе:
а) сульфатная;
б) гидросульфидная;
в) сульфитная.
8. С какой целью серу применяют в сельском хозяйстве:
а) как удобрение;
б) для борьбы с вредителями;
в) для подкормки скота
9. Составьте формулы сульфидов натрия, магния, алюминия.
Вариант 2
Вставьте пропущенные слова:
1. Заряд ядра атома серы равен…
2. Атом серы имеет … энергетических уровня.
3.Простое вещество сера является…
4. Сере принадлежит электронная формула:
а) 1s22s22p63s23p4
б) 1s22s22p6,
в) 1s22s22p63s23p6.
5. При нагревании серы на воздухе образуется:
а) монооксид серы;
б) диоксид серы;
в) триоксид серы;
г) сероводород.
6. Как называется метод удаления и обезвреживания ртути из разбитого термометра серой:
а) флотация;
б) демеркуризация;
в) нейтрализация
7. В какой форме сера не встречается в природе:
а) самородная;
б) сульфидная;
в) сульфитная.
8. При растворении сероводорода в воде образуется:
а) серная кислота;
б) сера;
в) сероводородная кислота.
9. Составьте формулы сульфатов калия, магния, железа(III).
Домашнее задание.
§17. упр 3, 4, 6 творческое задание придумать сказку о сере
nsportal.ru