Государственное бюджетное образовательное учреждение высшего

Министерство здравоохранения и социального развития Российской Федерации
профессионального образования
«Саратовский государственный медицинский университет
имени В.И. Разумовского» Министерства здравоохранения и социального
развития Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского
Минздравсоцразвития России)
Методические указания к лабораторно – практическому занятию
для студентов медицинских специальностей
Кинетика и катализ
Дисциплина: общая химия.
I курс.
Очная форма обучения.
Длительность занятия: 90 минут.
Разработка составлена асс. Куликовой Л.Н.
2011 г
Вопросы для подготовки к занятию
Предмет химической кинетики.
Скорость реакции, средняя скорость реакции в интервале, истинная скорость.
Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные).
Молекулярность элементарного акта реакции.
Порядок реакции.
Период полупревращения.
Зависимость скорости реакции от концентрации. Закон действующих масс.
- Константа скорости химической реакции.
Кинетические уравнения реакций нулевого, первого, второго порядков.
Экспериментальные методы определения скорости и константы скорости реакций.
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент скорости реакции и его особенности для биохимических процессов.
Уравнение Аррениуса. Энергетический профиль реакции; энергия активации.
Понятие о теории активных соударений.
Роль стерического фактора.
Понятие о теории переходного состояния.
Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции.
Особенности каталитической активности ферментов. Уравнение Михаэлиса — Ментен и его анализ.
Приложение 2: Краткий теоретический материал
Химическая кинетика изучает закономерности протекания химических процессов во времени.
Основные понятия кинетики:
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
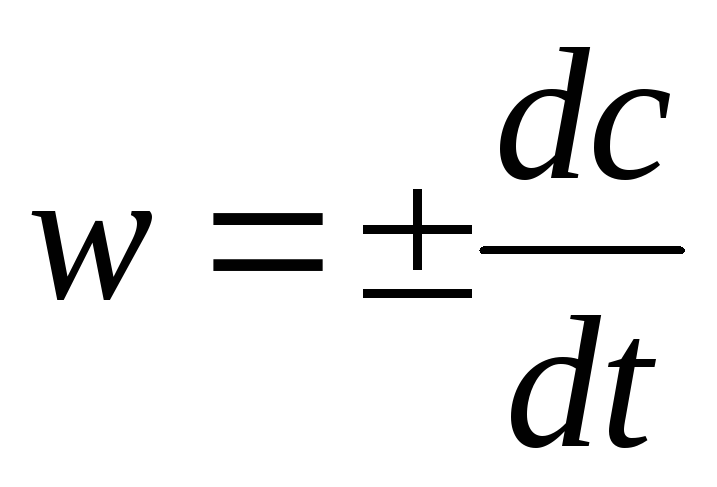 .
.
Поскольку скорость реакции — величина положительная, то “+” ставится, если используется концентрация продуктов реакции, и “-” — для исходных веществ.
Например, для реакции 3H2+N2 = 2NH3.
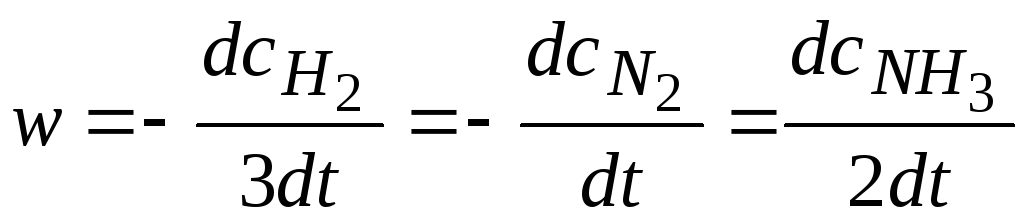 .
.
Общая скорость реакции равна скорости реакции по отдельному веществу, деленная на стехиометрический коэффициент, стоящий перед этим веществом в уравнении химической реакции.
Существует понятие средней и истинной скорости реакции.
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
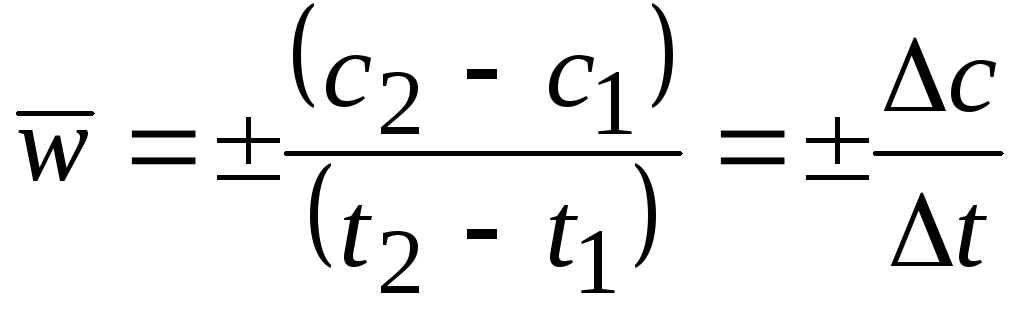 ,
,
Средняя
скорость относится к средней концентрации 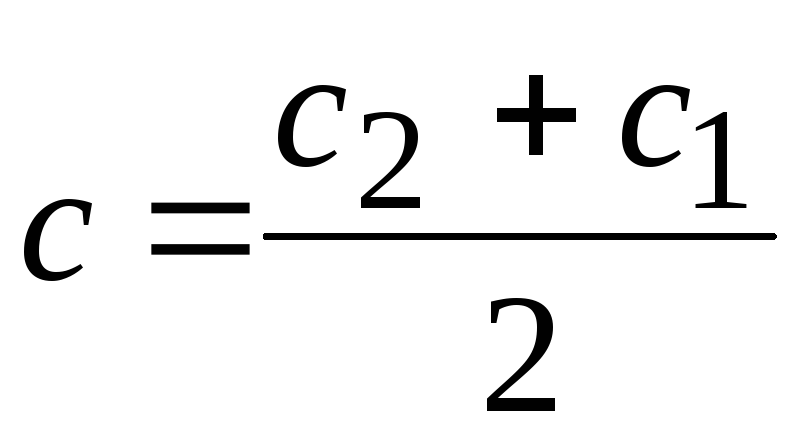
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при Dt®0
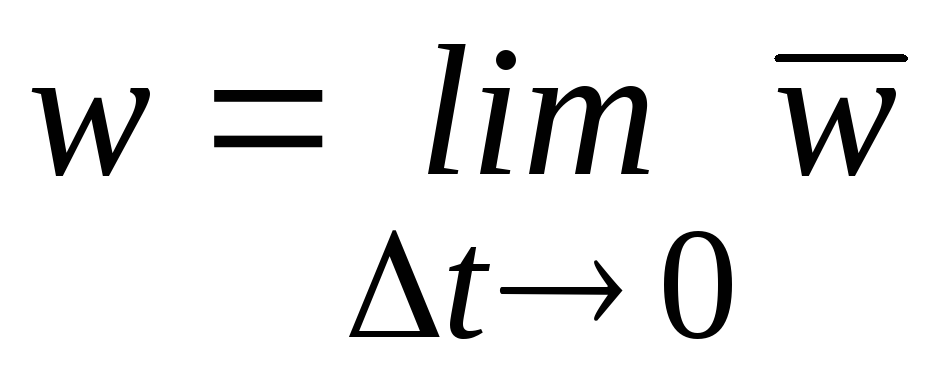 ,
,
Различают простые и сложные реакции.
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
параллельные;
последовательные,
сопряженные;
цепные.
Основной постулат химической кинетики – закон действующих масс
w=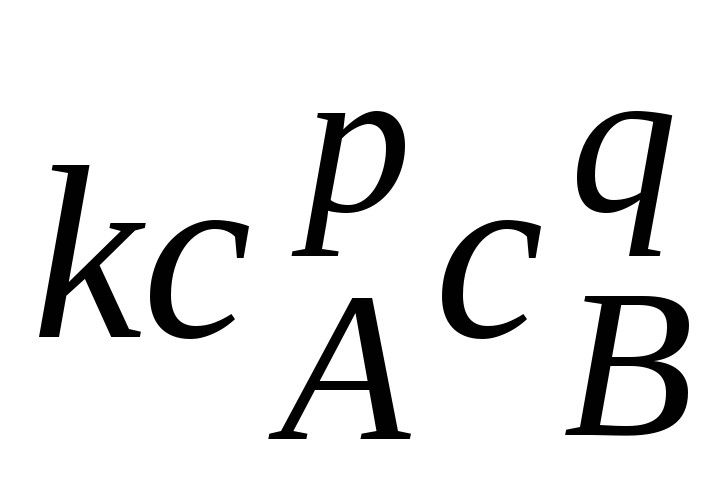
Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в некоторых степенях. Эти степени называются частными порядками реакции:
p — частный порядок реакции по веществу А,
q — частный порядок реакции по веществу В.
Сумма частных порядков дает полный порядок реакции n: n=p+q.
k — константа скорости реакции, это скорость реакции при концентрации реагирующих веществ, равных единице (удельная скорость).
Молекулярность реакции — число молекул, реагирующих в одном элементарном акте реакции.
Для реакций различных порядков зависимость скорости от концентрации реагирующих веществ выражается индивидуальным кинетическим уравнением.
1) Реакции нулевого порядка (n=0).
Вид реакции: A®продукт; в этом случае скорость реакции не зависит от концентрации исходного вещества, т.е. концентрация вещества А поддерживается на одном уровне.
Кинетическое уравнение:
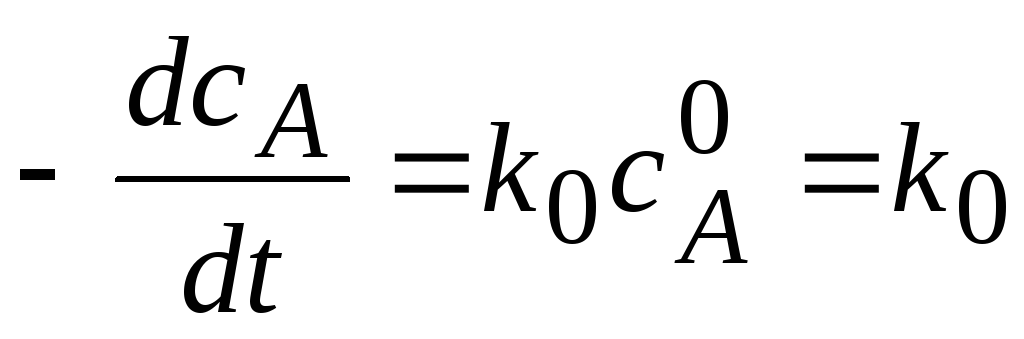 .
или
.
или 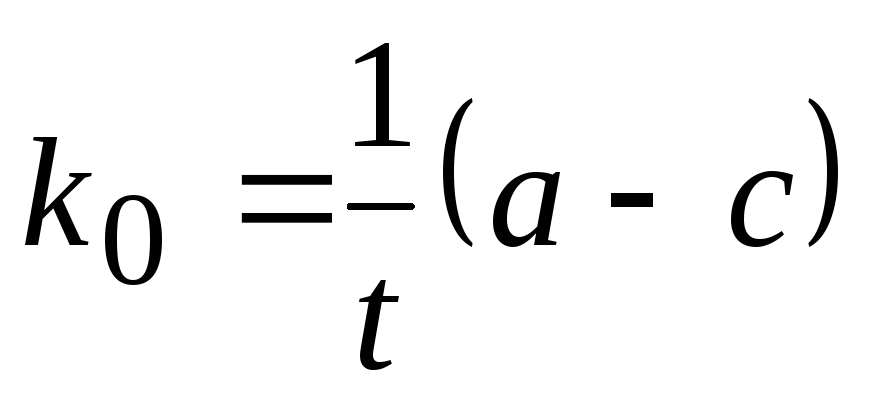 ,
,
где k0 – константа скорости реакции нулевого порядка;
t – время от начала реакции до достижения концентрации с;
а — концентрация вещества А при t=0,
с — концентрация вещества А в момент времени t .
Размерность k0 определяется выражением k0=w,
поэтому 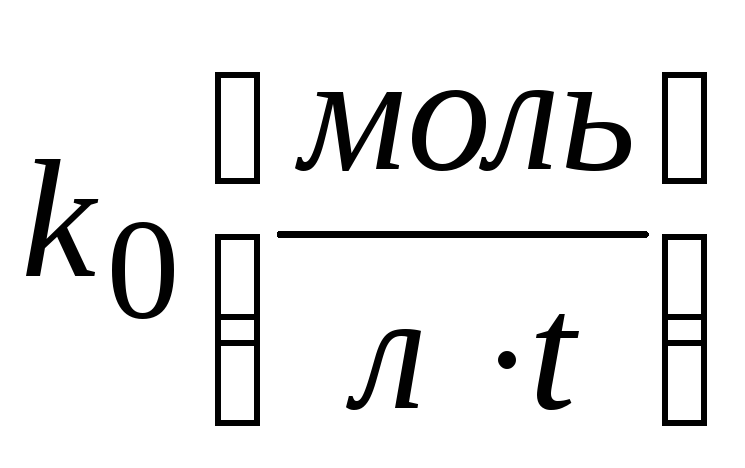 .
.
Время полупревращения t1/2 — время, за которое концентрация исходного вещества уменьшается в 2 раза.
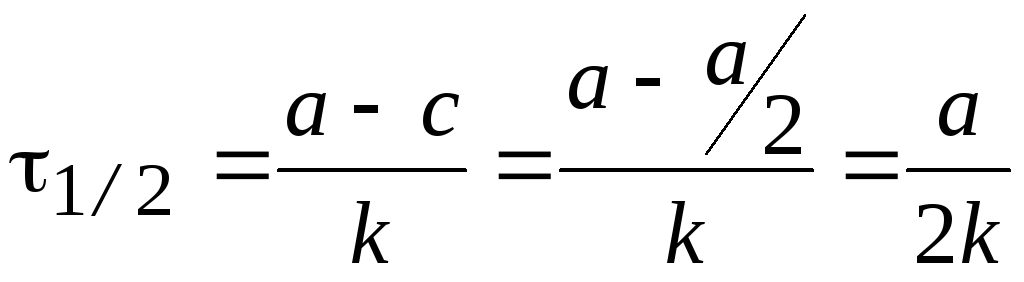 .
.
2) Реакции первого порядка ( n=1).
Вид реакции: A®продукт;
Кинетическое
уравнение: 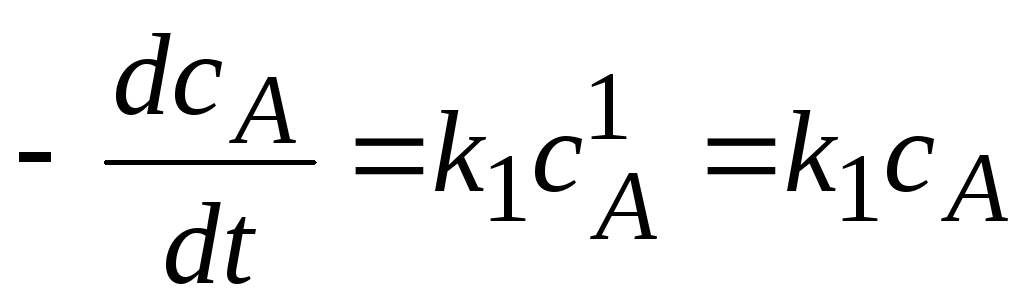 или
или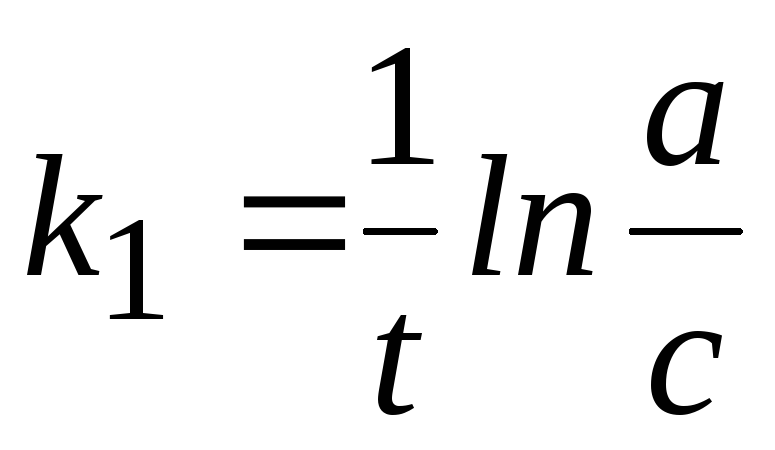 ,
,
Размерность константы скорости: k1, [t-1].
Время
полупревращения t1/2: 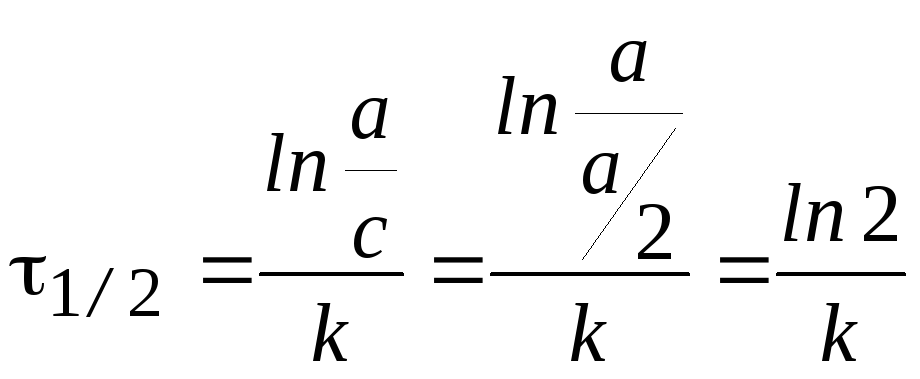 .
.
3) Реакции второго порядка ( n=2).
Вид реакции: A+В®продукт или 2A ®продукт.
Пусть
к началу реакциии концентрации исходных
веществ равны 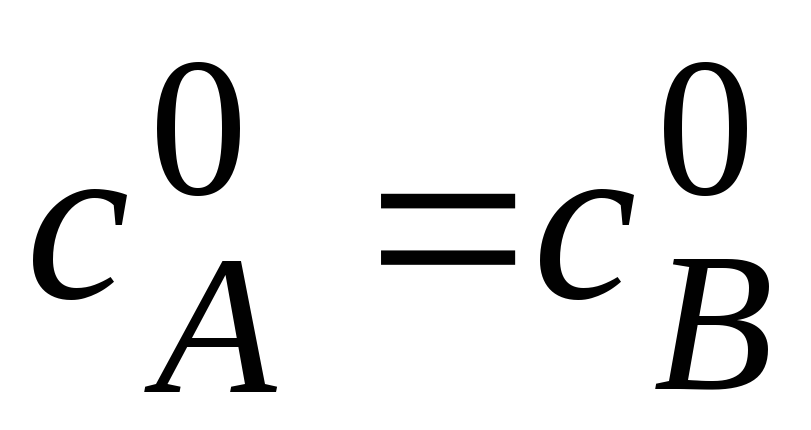
Кинетическое
уравнение: 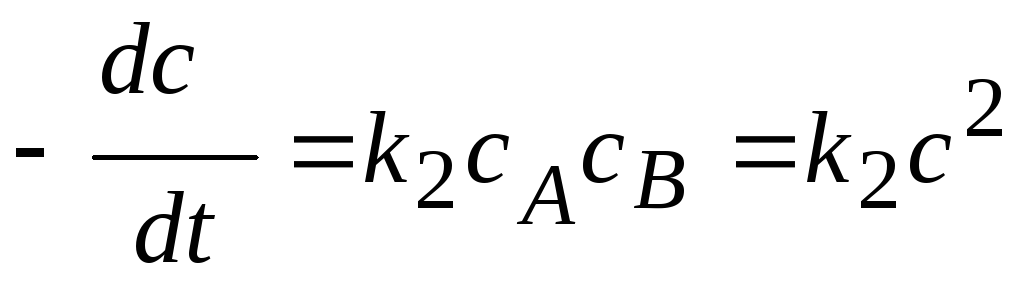 или
или 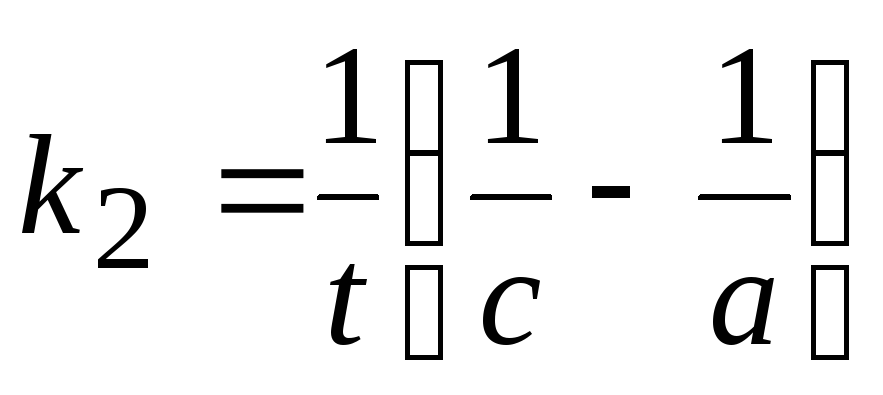 .
.
Размерность константы скорости: k2, [конц.-1× t-1].
Время
полупревращения t1/2: 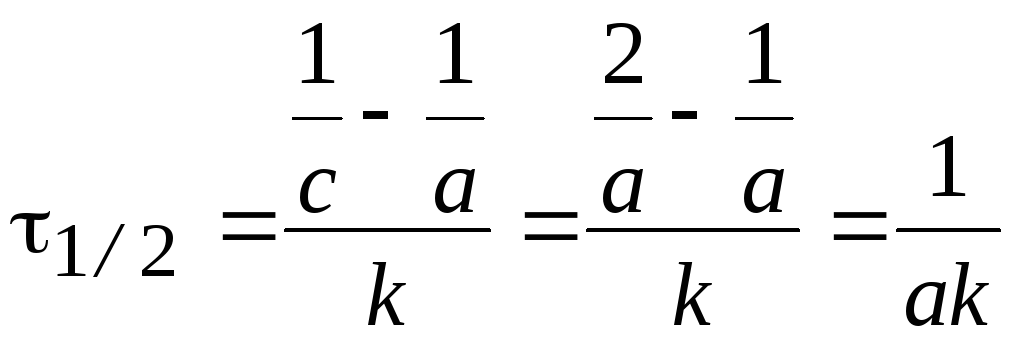 .
.
Размерность константы скорости: k3, [конц.-2× t-1].
В
общем случае 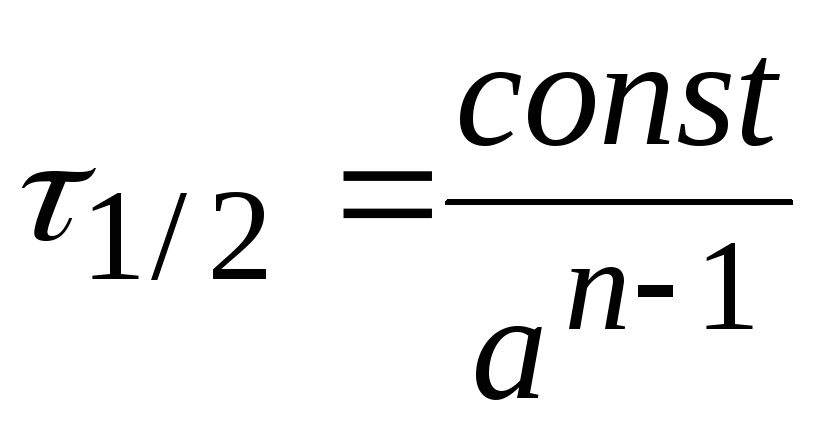 .
.
Экспериментально скорость реакции определяют измерением концентрации реагирующих веществ за определенный промежуток времени с последующим расчетом по формулам средней или истинной скорости реакции.
Константу скорости реакции можно определить представив экспериментальные данные в линейных координатах кинетического уравнения соответствующего порядка.
Скорость химических реакций истинная — Справочник химика 21
Что называется скоростью химической реакции Что такое средняя и истинная скорость реакции [c.58]Истинная скорость химической реакции определяется пре- [c.114]
Понятие о скорости химической реакции. Истинная (мгновенная) скорость реакции. [c.17]
Как выражается средняя и истинная скорость химических реакций [c.53]
Одним из факторов, влияющих на скорость большинства гомогенных реакций, может быть концентрация реагирующих веществ. Стечением времени скорость химической реакции изменяется, так как изменяется концентрация реагирующих веществ. Обычно различают среднюю и истинную скорости реакции. Приближенно скорость химической реакции измеряется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени. При этом концентрацию принято выражать в молях на литр, а время — в минутах. Средней скоростью реакции называют отношение уменьшения концентрации исходного веи ества или увеличения концентрации продуктов реакции ко времени, в течение которого это увеличение или уменьшение произошло. Так, если концентрацию исходного вещества ко времени обозначить буквой Сг, а концентрацию ко времени 4 обозначить Са, то средняя скорость реакции будет выражаться уравнением
Константа /г, входящая в уравнепия кинетики, называется кажущейся константой скорости процесса. Как видно из выражения (ХП, 86), она является произведением истинной константы скорости химической реакции к на адсорбционный коэффициент К. [c.319]
Поэтому для оценки истинной, скорости химической реакции в данный момент времени должна быть взята первая производная от концентрации по времени [c.115]
Скорость химических реакций. Знание скоростей химических реакций имеет научное и практическое значение, позволяет выяснить истинный механизм их протекания, а также экономическую эффективность получения различных продуктов. Химические реакции протекают с различными скоростями. Одни из них происходят очень быстро, почти мгновенно, например разложение взрывчатых веществ [c.18]
Активность катализаторов определяется их способностью увеличивать скорость химических реакций, в которых они участвуют. Но, так как сами каталитические реакции являются сложными процессами, состоящими из многих физико-химических стадий, то определение истинной активности катализаторов достаточно сложно. Обычно ее оценивают по выходу целевых продуктов в стандартных условиях испытания. [c.140]
Выражение для истинной скорости химической реакции, протекающей при постоянном объеме системы, записывается следующим образом [c.80]
Таким образом, интересно исследовать зависимость между, истинной скоростью химической реакции и явлением физического транспорта, чтобы определить выражение для полной скорости превращения (на единицу реакционного объема или на единицу массы катализатора), которое затем можно применять для расчетов реактора по способу, описанному во II и IV главах. [c.172]
Рассмотрим точку, принадлежащую первому потоку и находящуюся вблизи границ слоя смешения. Отклонение истинной скорости химической реакции от скорости, рассчитываемой по средним значениям [c.184]
Пусть для осуществления химической реакции веществу необходимо продиффундировать в некоторую частицу, которой может быть гранула с иммобилизованным ферментом, клетка растительного или животного происхождения, клеточная органелла, зерно гетерогенного катализатора и т. д. В этом случае э( фективная скорость химической реакции равна произведению истинной скорости на диффузионный фактор т). В свою очередь т] есть функция модуля Тиле (Ф), который определяется соотношением [c.270]
Различают среднюю и истинную скорости химической реакции. Допустим, что в момент времени ti концентрация вещества была i, а для момента Т2 — она стала q-Тогда средняя скорость реакции для интервала времени [c.111]
Истинная скорость химической реакции есть первая производная концентрации по времени. [c.111]
Фактически метод Клейна был разработан лишь для функций скорости химической реакции, которые быстро стремятся к нулю при т 0. При этом трудность холодной границы отпадает, и могут быть использованы истинные начальные условия. Таким образом, вместо уравнения (59) Клейн пользовался уравнением [c.164]
На настоящем этапе исследований в микроволновой химии важно определить оптимальные условия проведения микроволновых синтезов для пол) ения максимального выхода целевых продуктов и провести корректные кинетические расчеты параметров уравнения Аррениуса при проведении реакций с применением микроволнового и термического нагрева в сопоставимых условиях с тем, чтобы определить истинное влияние МВИ на скорость химических реакций. [c.191]
Чем этот отрезок меньше, т. е. чем меньше величина Ат, и чем бллже на кривой KL точки тип одна к другой, тем средняя скорость будет ближе к истинной. Если брать изменение концентрации йС за бесконечно малый промежуток времени т, то получим следующее выражение для истинной скорости химической реакции в данный момент времени [c.131]
По оси ординат— отношение эффективной константы скорости к к истинной константе скорости химической реакции к по оси абсцисс — отношение коэффициента массоотдачи 0 к константе скорости химической реакции к. [c.77]
Те же идеи и методы, которые были применены в теории теплового воспламенения для гомогенных реакций, мы применим теперь к вопросу о тепловом режиме гетерогенных экзотермических реакций. Отличие от гомогенных реакций заключается в том, что в этом случае скорость реакции не может уже возрастать неограниченно, вплоть до самых высоких температур. Скорость гетерогенного химического процесса определяется как истинной скоростью химической реакции на поверхности, так и скоростью подвода реагирующих веществ к этой поверхности молекулярной или конвективной диффузией. При низких температурах, пока скорость реакции мала по сравнению со скоростью диффузии (кинетическая область), суммарная скорость процесса определяется истинной кинетикой на поверхности и экспоненциально возрастает с температурой, согласно закону Аррениуса. Но это возрастание может продолжаться лишь до тех пор, пока скорость реакции не сделается сравнимой со скоростью диффузии. В дальнейшем процесс перейдет в диффузионную область, где скорость его всецело определяется скоростью диффузии и лишь весьма слабо возрастае
Скорость реакции, средняя скорость реакции в интервале, истинная скорость.
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
V=±
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
СКОРОСТЬ ВСЕГДА ПОЛОЖИТЕЛЬНА
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при dt→0
59. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные).
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
1) параллельные: протекание нескольких процессов с участием одних и тех же веществ;
2) последовательные: конечные продукты образуются через ряд промежуточных продуктов,
3) сопряженные: протекание одной реакции инициирует осуществление второй;
4) цепные: протекающие через ряд регулярно повторяющихся элементарных стадий.
В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе
В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах.
Микрогетерогенныереакции – это реакции происходящие в коллоидных системах.
Истинная скорость — химическая реакция
Истинная скорость — химическая реакция
Cтраница 1
Истинная скорость химической реакции представляет собой производную концентрации по времени. [1]
Как выражается средняя и истинная скорость химических реакций. [2]
Чтобы определить истинную скорость химической реакции ( V l), достаточно найти производную концентрации какого-нибудь одного вещества, участвующего в реакции, по времени. [3]
Поэтому для оценки истинной скорости химической реакции в данный момент времени должна быть взята первая производная of концентрации по времени. [4]
Таким образом, интересно исследовать зависимость между истинной скоростью химической реакции и явлением физического транспорта, чтобы определить выражение для полной скорости превращения ( на единицу реакционного объема или на единицу массы катализатора), которое затем можно применять для расчетов реактора по способу, описанному во II и IV главах. [5]
Задаваясь пределом точности, с которой необходимо определять истинную скорость химической реакции, и отвечающим. ДРд / Рл в диффузионном слое, находят соответствующую скорость потоков при данном значении комплекса X. Так, например, если экспериментальная точность определения скорости реакции должна быть более 110 %, то диффузионным сопротивлением можно пренебречь. [6]
Будем считать, что скорость процесса зависит как от истинной скорости химической реакции, так и от скорости переноса массы. [7]
Это дает предпосылки рассматривать зону реакции как проточный реактор с входящими потоками растворяющихся в жидкости компонентов и при построении модели ввести истинную скорость химической реакции, которая определена конкретным атомным механизмом взаимодействия, характерным для гомогенных систем. [8]
Из этой формулы следует, что глубина проникновения вещества в пористый химически активный для него материал определяется отношением скорости его молекулярной диффузии D к истинной скорости химических реакций К. [9]
Если брать изменение концентрации за бесконечно малый промежуток времени, то получим выражение для истинной скорости химической реакции в данный момент времени. [10]
Те же идеи и методы, которые были применены в теории теплового воспламенения для гомогенных реакций, мы применим теперь к вопросу о тепловом режиме гетерогенных экзотермических реакций. Отличие от гомогенных реакций заключается в том, что в этом случае скорость реакции не может уже возрастать неограниченно, вплоть до самых высоких температур. Скорость гетерогенного химического процесса определяется как истинной скоростью химической реакции на поверхности, так и скоростью подвода реагирующих веществ к этой поверхности молекулярной или конвективной диффузией. При низких температурах, пока скорость реакции мала по сравнению со скоростью диффузии ( кинетическая область), суммарная скорость процесса определяется истинной кинетикой на поверхности и экспоненциально возрастает с температурой, согласно закону Аррениуса. Но это возрастание может продолжаться лишь до тех пор, пока скорость реакции не сделается сравнимой со скоростью диффузии. В дальнейшем процесс перейдет в диффузионную область, где скорость его всецело определяется скоростью диффузии и лишь весьма слабо возрастает с температурой. При такой зависимости скорости выделения тепла от температуры и при определенных условиях тепло-отвода возможны три стационарных тепловых режима, из которых средний оказывается неустойчивым, верхний отвечает протеканию реакции в диффузионной, а нижний — в кинетической области. Воспламенение поверхности представляет собой скачкообразный переход от нижнего к верхнему стационарному тепловому режиму. Обратный переход от верхнего теплового режима к нижнему происходит также скачком при критическом условии потухания, не совпадающем с условием воспламенения. [11]
Первая стадия процесса определяется физико-химическими свойствами топливной смеси, а вторая стадия — диффузией и теплообменом. В зависимости от соотношения скоростей двух его стадий различают две предельные области. В первой из них — кинетической — скорость реакции гораздо меньше скорости диффузия реагирующих компонентов, и наблюдаемая скорость процесса совпадает с истинной скоростью химических реакций. Во второй области — диффузионной — скорость процесса всецело определяется переносом вещества в зоне горения, и он лимитируется фактором гидродинамической природы и в первую очередь смещением. [12]
Скорость реакции средняя — Справочник химика 21
Скорость реакции зависит от изменения концентрации реагирующих веществ в единицу времени. Поскольку скорость реакции изменяется во времени, то различают среднюю и истинную скорость реакции. Средней скоростью ре- [c.65]Расчет реактора вытеснения непрерывного действия (трубчатого или колонного типа) также основан на интегрировании по времени (или по длине реактора, что то же самое) ур-ний скорости реакции, средней степени полимеризации совместно с ур-ниями теплового баланса (ур-ниями скорости выделения и отвода тепла). Модель идеального вытеснения предполагает в первом приближении допущение, что среда в трубе движется подобно поршню. Перемешивание различных элементов среды в направлении движения потока отсутствует. Реальные аппараты описываются с помощью более сложных моделей, учитывающих радиальную и осевую диффузию и т. д. (см. Полимеризация в массе). [c.451]
В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость V равна отношению АС/А/ (АС = Сг — С1 А/ = 4 — 1)- Чтобы величина скорости была всегда положительной, перед дробью ставят знаки , V [c.114]
Скорость реакции, среднюю продолжительность жизни и длину кинетической цепи рассчитывают тем же методом, что и в случае моновиниловых мономеров, но значения кр и k в общем случае являются усредненными значениями констант скоростей для нескольких различных реакций роста или обрыва. Молекулярные веса также подчиняются обычным соотношениям, за исключением тех случаев, когда имеет место сшивание макромолекул. [c.42]
Реакторы с иммобилизованными клетками значительно различаются по принципу действия, а также по размеру и форме частиц. Поэтому возможность использования для определения объемной скорости реакции среднего содержания биомассы зависит от описываемой системы, но в общем Яов определяется уравнением (5.3) в случае, когда биомасса иммобилизуется в виде пленки, — уравнением (5.4) [c.182]
Задание 78. Предположим, что имеется некоторое количество пар данных (например, температура/скорость реакции, среднее значение pH воды в водоеме/год или номер телефона/фамилия) и необходимо упорядочить эти пары по первой величине (например, по номеру телефона) или по второй величине (например, по фамилии). Напишите для этого программу так, чтобы можно было выбрать один из вариантов, соответствующий характеру данных. [c.147]
Скорость реакции Средняя молекулярная масса Прочность на разрыв Эластичность [c.98]
Устойчивость латекса То же Размер частиц Поверхностное натяжение Скорость реакции Средняя молекулярная масса Разветвленность молекулярной цепи [c.98]
Полимеризацию нужно проводить при таких условиях, чтобы можно было легко регулировать концентрацию мономера, температуру и другие факторы, влияющие на скорость реакции, среднюю молекулярную массу продукта, его полидисперсность и др. [c.291]
Эмульсионный метод. Основным методом получения поливинилхлорида является водоэмульсионный метод, который на практике осуществляют в виде периодичного или непрерывного латексного способа. Для проведения полимеризации в эмульсии готовят реакционную смесь, состоящую из дистиллированной воды, содержащей эмульгатор, водорастворимый инициатор и стабилизатор в некоторых случаях применяют регуляторы pH среды и поверхностного натяжения. В готовую смесь вводят нужное количество мономера. На ход процесса полимеризации винилхлорида большое влияние оказывают примеси, содержащиеся в компонентах смеси в связи с этим все применяемые вещества подвергают тщательной очистке, а воду — обработке на ионообменной установке для обессоливания. В качестве эмульгаторов используют различные мыла (ализариновое, триэтаноламиновое), некаль, натриевые соли алифатических или ароматических сульфокислот. Количество введенного эмульгатора (обычно 0,1—0,5% от массы мономера) существенно влияет на скорость реакции, среднюю молекулярную массу полимера и на дисперсность латекса. [c.73]
Для большинства экзотермических процессов скорость увеличивается вначале (с возрастанием степени превращения) вследствие повышения температуры в системе, но снижается в конце (с уменьшением х) за счет расходования реагентов. При сравнительно малых степенях превращения средняя скорость реакции в аппарате идеального смешения всегда выше, чем в аппарате идеального вытеснения. Однако по достижении некоторого уровня х несколько большего, чем уровень, соответствующий максимуму скорости реакции, средние скорости для двух моделей реакторов становятся идентичными после превышения указанного уровня реактор идеального вытеснения становится предпочтительнее. [c.345]
В положении 1 появляется возможность перехода реакции в область высоких значений температуры. Дальнейшее увеличение Toa (положение 2) соответствует трем возможным температурным уровням и, соответственно, трем скоростям реакции. Средний температурный режим оказывается неустойчивым, поскольку любое [c.159]
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества вещества к единице объема называется концентрацией с, то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна [c.167]
Скорость реакции. Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени. Так как скорость реакции изменяется с течением времени, то различают среднюю и истинную скорость реакции. Средней скоростью реакции V за данный промежуток времени называется отношение уменьшения [c.322]
Скорость реакции Средняя молекулярная масса Разветвленность макромолекул Скорость реакции Разветвленность макромолекул Скорость реакции [c.344]
В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость [c.108]
Формула (5-3) определяет изменение во времени мгновенного значения константы скорости реакции. Среднее ее значение для установившегося (в среднем) процесса может быть выражено в виде [c.106]
Ван Зоонен показал, что температура мало влияет на скорость реакции. Средняя скорость реакции незначительно увеличивается также с уменьшением раз
Истинная и средняя скорость реакции. Связь между б/р концентрацией и степенью превращения. Факторы, влияющие на скорость химической реакции.Энергия активации, порядок реакции по реагентам и методы их определения
11ix10 ??? по Л1
1. Как измерить истинную и среднюю скорость реакции
2. Как вероятность реакции зависит от энергии частиц
3. Изменяется ли скорость реакции в замкнутой системе
4. Связь между б/р концентрацией и степенью превращения
5. Когда выход продукта численно равен: а) селективности; б) конверсии
К понятию скорости: изменение состава реакционной смеси, т.е. Сi(t), регистрируют методами физико-химического анализа, например, по изменению давления, объема, плотности, показателя преломления, электро- и теплопроводности реакционной смеси.
К понятию селективности: Как правило, процессы, представляющие практический интерес, являются весьма сложными. Например, н-бутан при высокой температуре может изомеризоваться в изобутан, дегидрироваться в бутен и далее в бутадиен, крекироваться с образованием этилена, газов С1-С3, кокса и т.п. (рис. 3).
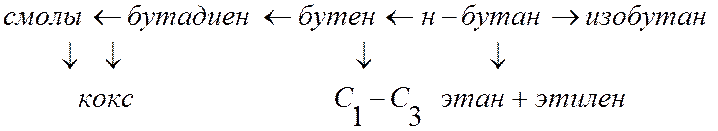
Рис. 3. Возможные варианты термического превращения н-бутана
Каждый из возможных вариантов превращения реагента называется маршрутом. В случае нескольких маршрутов вводится понятие селективности по продукту. В рассмотренном примере можно говорить о селективности по изобутану, бутену и др. продуктам.
Лекция 2
1.3 Факторы, влияющие на скорость химической реакции.Энергия активации, порядок реакции по реагентам и методы их определения
Основными факторами, влияющими на скорость химической реакции, являются температура и концентрация (давление) реагентов, а также наличие растворителя и катализатора (этому посвящены отдельные разделы). При изучении кинетики в реальных, макроскопических системах часто наблюдается зависимость скорости химической реакции от таких физических факторов, как скорость потока, вязкость и теплофизические свойства реакционной смеси, размер частиц реагента и катализатора. Однако эти явления изучает специальная дисциплина – макрокинетика.
Качественной характеристикой зависимости скорости реакции от температуры является температурный коэффициент реакции (предложен Вант-Гоффом), показывающий, во сколько раз возрастает скорость реакции при увеличении температуры на 10 градусов
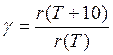 (10)
(10)
Величина γ составляет приблизительно 2 — 4 для различных типов реакций. Однако следует помнить, что правило Вант-Гоффа является эмпирическим, и единственной физически обоснованной характеристикой температурной зависимости скорости реакции является энергия активации.
Для вывода этой зависимости используем уравнение изобары химической реакции:
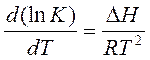 (11)
(11)
где К= k1/k2 – константа равновесия, 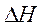 — теплота реакции, которую
представим, как разность двух величин А, имеющих размерность энергии. Тогда (11)
можно записать в виде:
— теплота реакции, которую
представим, как разность двух величин А, имеющих размерность энергии. Тогда (11)
можно записать в виде:
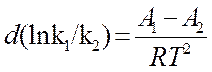 dT (12)
dT (12)
После интегрирования (12) получим
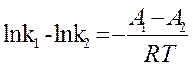 (13) или без индексов:
(13) или без индексов: 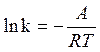 + lnB, откуда
+ lnB, откуда
k= B•exp(-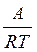 ) (14)
) (14)
величина А, характеризующая зависимость константы скорости реакции от температуры, названа энергией активации Е и B– предэкспоненциальным множителем или k0.
Сопоставляя (11) и (13) найдем, что
E1 – Е2 = ΔН (15)
разность значений энергии активации реакции в прямом и обратном направлении равна тепловому эффекту реакции. Уравнение (15) отражает связь кинетики реакции с термодинамикой, что проиллюстрировано на рис. 3.
Отметим, что кинетика рассматривает движение реакционной системы через