Сложные вещества — урок. Химия, 8–9 класс.
Химические элементы входят в состав сложных веществ (химических соединений).
Сложными называют вещества, состоящие из атомов разных химических элементов.
Большинство химических веществ являются сложными.
Многие сложные вещества имеют молекулярное строение. К молекулярным относятся метан Ch5, вода h3O, углекислый газ CO2, серная кислота h3SO4, глюкоза C6h22O6. Пластмассы, белки, жиры, крахмал тоже представляют собой сложные вещества, состоящие из молекул.
Рис. \(1\). Модель молекулы воды
Рис. \(2\). Модель молекулы этанола
Немолекулярное строение имеет песок SiO2, а также все сложные вещества, в состав которых входят металлы: поваренная соль NaCl, мел CaCO3, питьевая сода NaHCO3 и многие другие. Из сложных веществ немолекулярного строения состоят минералы и горные породы.
Рис. \(3\). Модель кристалла поваренной соли
При определённых условиях сложные вещества можно разложить на несколько новых веществ. Так под действием электрического тока вода разлагается на водород и кислород, а сахар при нагревании превращается в уголь и воду.
Водород и кислород совсем не похожи на воду. При обычных условиях водород и кислород представляют собой газы, а вода — жидкость. Уголь и вода ничем не напоминают сахар.
Обрати внимание!
Свойства сложного вещества не являются суммой свойств веществ, образующихся при его разложении.
Источники:
Рис. 1. Модель молекулы воды https://cdn.pixabay.com/photo/2013/07/13/13/41/molecule-161361_960_720.png
Рис. 2. Модель молекулы этанола https://upload.wikimedia.org/wikipedia/commons/0/00/Ethanol-3D-vdW.png
Рис. 3. Модель кристалла поваренной соли https://upload.wikimedia.org/wikipedia/commons/thumb/7/70/Lithium-chloride-3D-ionic.png/1024px-Lithium-chloride-3D-ionic.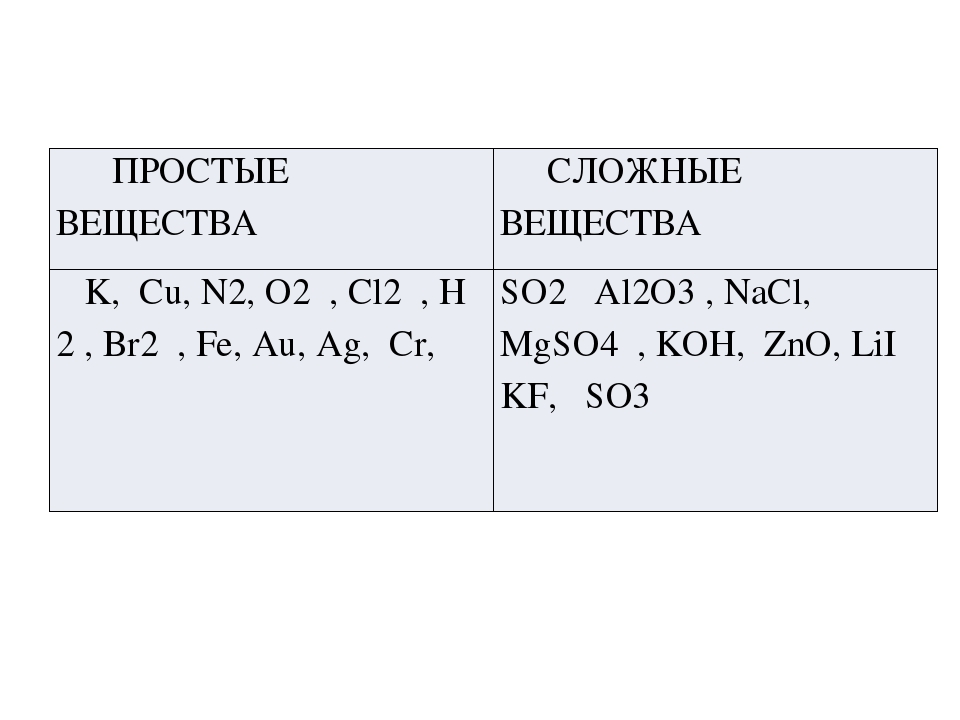 png
png
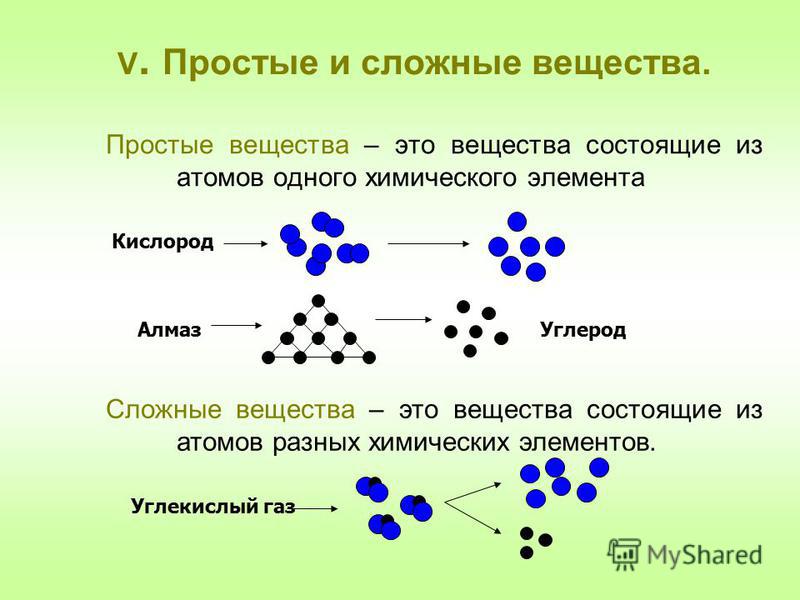
5. Простые и сложные вещества.
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений.
Дополнительные видеоуроки, рекомендуемые к изучению
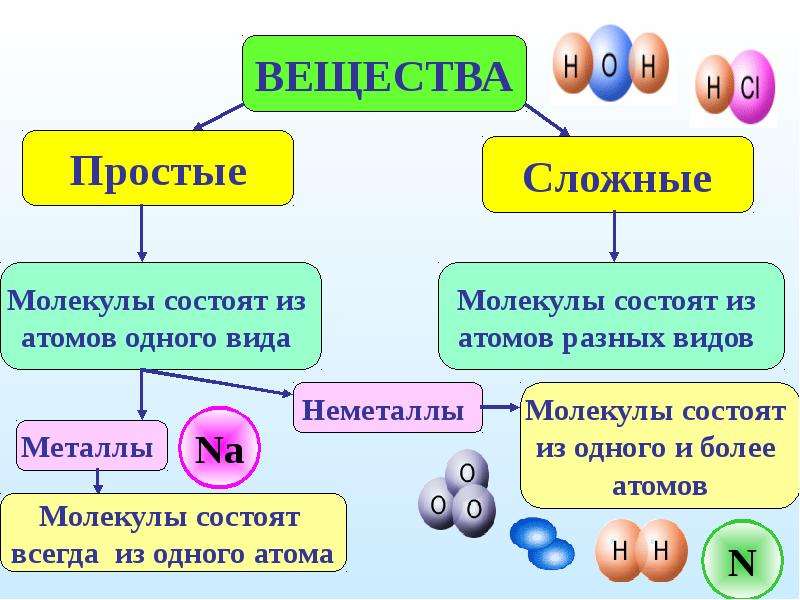
Простые вещества — молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения) — молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
С — алмаз, графит, карбин, фуллерен.
O — кислород, озон.
S — ромбическая, моноклинная, пластическая.
P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
1. Различным числом атомов в молекуле, например кислород O2 и озон O3.
2. Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример:
Na2+1O-2, Mg+2O-2, Fe+2O-2, Mn+2O-2.
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример:
Al2+3O3-2, Fe2+3O3-2, Mn+4O2-2, Zn+2O-2, Be+2O-2.
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример:
S+6O3-2, N2+5O5-2, Cr+6O3-2, Mn2+7O7-2
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания – сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН—).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Простые и сложные вещества. Аллотропия. Химические соединения и смеси
Все вещества делятся на простые и сложные.
Простые вещества — это вещества, которые состоят из атомов одного элемента.
В некоторых простых веществах атомы одного элемента соединяются друг с другом и образуют молекулы. Такие простые вещества имеют молекулярное строение. К ним относятся: водород H2, кислород O2, азот N2, фтор F2, хлор Cl2, бром Br2, йод I2. Все эти вещества состоят из двухатомных молекул. (Обратите внимание, что названия простых веществ совпадают с названиями элементов!)
Другие простые вещества имеют атомное строение, т.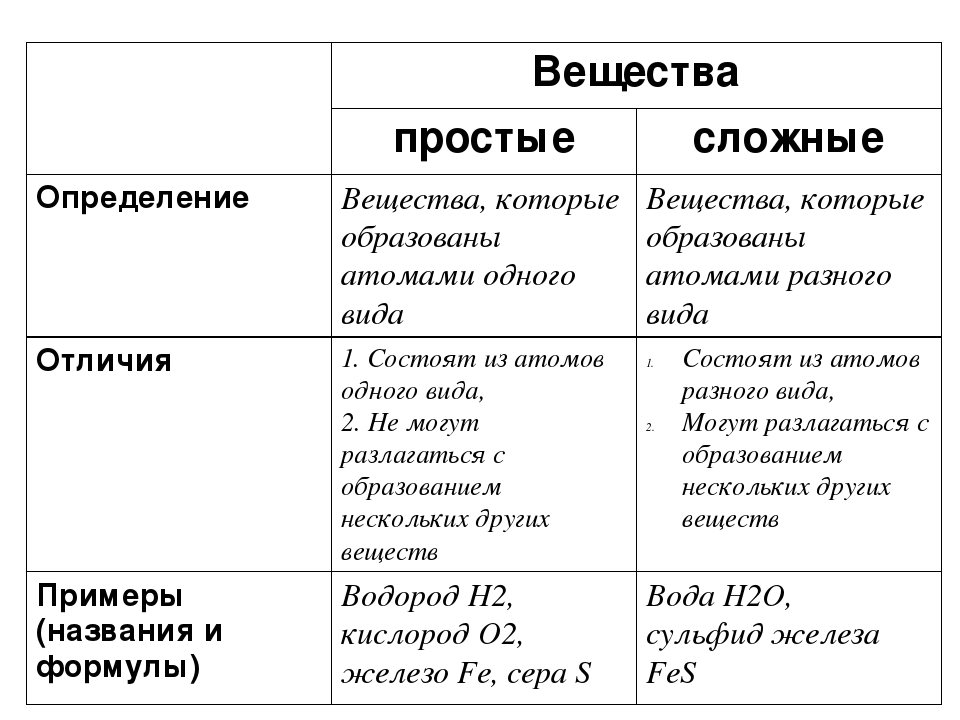 е. состоят из атомов, между которыми существуют определенные связи. Примерами таких простых веществ являются все металлы (железо Fe, медь Сu, натрий Na и т. д.) и некоторые неметаллы (углерод С, кремний Si и др.). Не только названия, но и формулы этих простых веществ совпадают с символами элементов.
е. состоят из атомов, между которыми существуют определенные связи. Примерами таких простых веществ являются все металлы (железо Fe, медь Сu, натрий Na и т. д.) и некоторые неметаллы (углерод С, кремний Si и др.). Не только названия, но и формулы этих простых веществ совпадают с символами элементов.
Существует также группа простых веществ, которые называются благородными газами. К ним относятся: гелий Не, неон Ne, аргон Аr, криптон Kr, ксенон Хе, радон Rn. Эти простые вещества состоят из не связанных друг с другом атомов.
Каждый элемент образует как минимум одно простое вещество. Некоторые элементы могут образовывать не одно, а два или несколько простых веществ. Это явление называется аллотропией.
Аллотропия — это явление образования нескольких простых веществ одним элементом.
Разные простые вещества, которые образуются одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Аллотропные модификации могут отличаться друг от друга составом молекул. Например, элемент кислород образует два простых вещества. Одно из них состоит из двухатомных молекул О
Например, элемент кислород образует два простых вещества. Одно из них состоит из двухатомных молекул О
Кислород О2 и озон О3 имеют различные физические и химические свойства.
Аллотропные модификации могут представлять собой твердые вещества, которые имеют различное строение кристаллов. Примером являются аллотропные модификации углерода С — алмаз и графит.
Число известных простых веществ (примерно 400) значительно больше, чем число химических элементов, так как многие элементы могут образовывать две или несколько аллотропных модификаций.
Сложные вещества — это вещества, которые состоят из атомов разных элементов.
Примеры сложных веществ: НCl, Н2O, NaCl, СО2, H2SO4 и т. д.
Сложные вещества часто называют химическими соединениями.
Например, хлорид натрия NaCl может образоваться из простых веществ — металлического натрия Na и газообразного хлора Сl Физические и химические свойства NaCl отличаются от свойств Na и Cl2.
В природе, как правило, встречаются не чистые вещества, а смеси веществ. В практической деятельности мы также обычно используем смеси веществ. Любая смесь состоит из двух или большего числа веществ, которые называются компонентами смеси.
Например, воздух представляет собой смесь нескольких газообразных веществ: кислорода О2 (21 % по объему), азота N2 (78%), углекислого газа СО2 и др. Смесями являются растворы многих веществ, сплавы некоторых металлов и т. д.
Смеси веществ бывают гомогенными (однородными) и гетерогенными (неоднородными).
Гомогенные смеси — это смеси, в которых между компонентами нет поверхности раздела.
Гомогенными являются смеси газов (в частности, воздух), жидкие растворы (например, раствор сахара в воде).
Гетерогенные смеси — это смеси, в которых компоненты разделяются поверхностью раздела.
К гетерогенным относятся смеси твердых веществ (песок + порошок мела), смеси нерастворимых друг в друге жидкостей (вода + масло), смеси жидкостей и нерастворимых в нем твердых веществ (вода + мел).
Важнейшие отличия смесей от химических соединений:
- В смесях свойства отдельных веществ (компонентов) сохраняются.
- Состав смесей не является постоянным.
Похожее
Вещества сложные — Справочник химика 21
Молекулярная адсорбционная хроматография. Этот вид хроматографии имеет большое значение для аналитического и технологического разделения смесей органических веществ сложного состава, например растительных пигментов, витаминов, антибиотиков, аминокислот.
Экстракция неорганических веществ — сложный физико-химический процесс, связанный с различными реакциями в растворах и переносом вещества через поверхность раздела фаз. Растворенное вещество распределяется между фазами в определенном закономерном соотношении. Закон распределения, открытый М. Бертло и Юнгфлейшем и обобщенный В. Нерстом, можно формулировать так растворенное вещество распределяется между двумя несмешивающнмнся фазами так, что отношение равновесных концентраций вещества в обеих фазах не зависит от общей концентрации, если в каждой фазе вещество имеет один и тот же молекулярный вес. Закон В. Нернста не является строго термодинамическим и выполняется в частных случаях для разбавленных растворов (1 Ю З—1 10 моль/л) [c.
 332]
332]Процессы ассоциации зависят не только от свойств растворенных молекул, анионов и катионов, но и от свойств той среды, в которой эти молекулы, анионы и катионы находятся, т. е. от взаимодействия между растворителем, молекулами растворенного вещества, сложными ионами, простыми ионами и агрегатами молекул. Каждый из трех процессов (диссоциация, ассоциация и комплексная диссоциация) зависит от физических и химических свойств растворителя, от его диэлектрической проницаемости, химической природы и т. д. При этом чем ниже диэлектрическая проницаемость, тем больше эти процессы сдвинуты в сторону агрегации всех частиц, находящихся в растворе.
Химический элемент, простое вещество, сложное вещество. Знаки химических элементов и хгшические формулы. Уравнения химических реакций. [c.122]
Другие уравнения состояния получены в большей или меньшей степени на эмпирической основе, поэтому их параметры связаны очень мало или совсем не связаны со свойствами молекул. Таким образом, экстраполяция по этим уравнениям весьма рискованна, ибо они надежно описывают только ту область параметров состояния, для которой имеются экспериментальные данные. Если экстраполяция необходима, то ее лучше осуществлять с помощью уравнения, имеющего теоретическую основу. (Это утверждение не следует рассматривать как разрешение на произвольную экстраполяцию для вириального уравнения. При любой экстраполяции необходимо соблюдать большую осторожность.) Однако основное достоинство вириального уравнения состояния заключается не в возможности более обоснованной экстраполяции, а в его теоретически аргументированной связи с межмолекулярными взаимодействиями, в частности с силами, действующими между молекулами. Как известно, многие макроскопические свойства вещества в большой степени зависят от межмолекулярных сил. Для некоторых из них, например транспортных свойств разреженных газов, вириальных коэффициентов и свойств простых кристаллов, функциональная связь между межмолекулярными силами и указанными свойствами вполне понятна.
Таким образом, экстраполяция по этим уравнениям весьма рискованна, ибо они надежно описывают только ту область параметров состояния, для которой имеются экспериментальные данные. Если экстраполяция необходима, то ее лучше осуществлять с помощью уравнения, имеющего теоретическую основу. (Это утверждение не следует рассматривать как разрешение на произвольную экстраполяцию для вириального уравнения. При любой экстраполяции необходимо соблюдать большую осторожность.) Однако основное достоинство вириального уравнения состояния заключается не в возможности более обоснованной экстраполяции, а в его теоретически аргументированной связи с межмолекулярными взаимодействиями, в частности с силами, действующими между молекулами. Как известно, многие макроскопические свойства вещества в большой степени зависят от межмолекулярных сил. Для некоторых из них, например транспортных свойств разреженных газов, вириальных коэффициентов и свойств простых кристаллов, функциональная связь между межмолекулярными силами и указанными свойствами вполне понятна.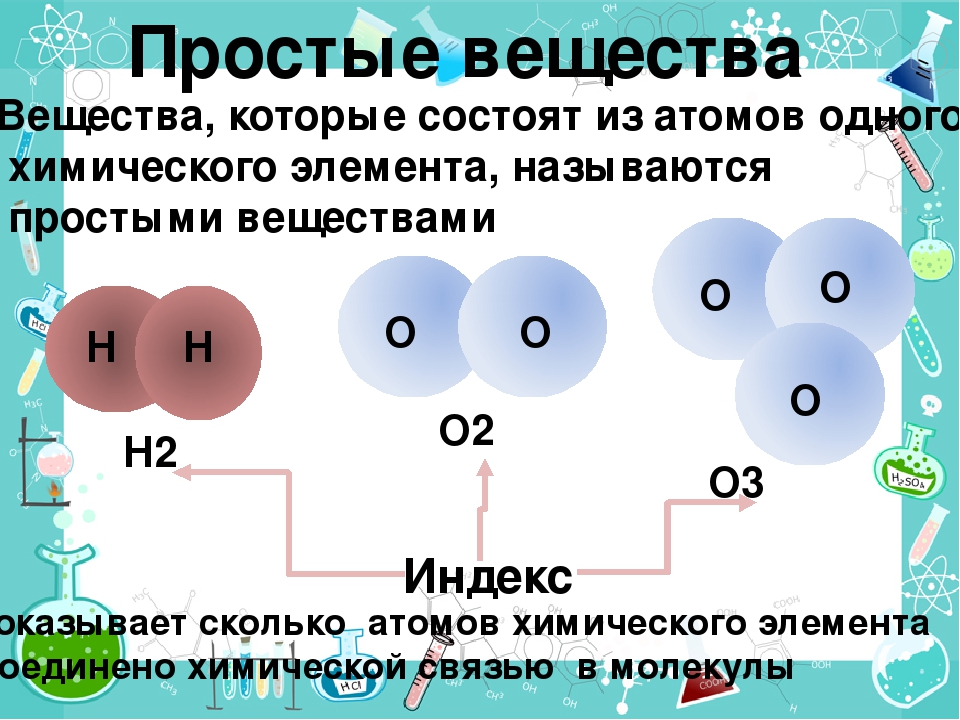
Важную информацию приносит и рентгенофазовый анализ исходных кристаллических форм и продуктов, получившихся в результате прогрева. Пользуясь этим методом, можно регистрировать различия кристаллических структур как одного и того же вещества (полиморфизм), так и различных веществ сложной системы. [c.74]
Что называется эквивалентом вещества (элемента, простого вещества, сложного вещества) [c. 7]
7]
Вещества (сложные эфиры), образующиеся при взаимодействии глицерина с жирными кислотами [c.544]
Простые вещества. Зависимость строения и свойств просты.х веществ от иоложения алементов в периодической системе. Получение простых веществ. Сложные вещества. Бинарные соединения. Двухэлементные соединения. Зависимость устойчивости и свойств двухэлементных соединений от атомного номера элемента с положительной степенью окисления. Неорганические полимеры с тетраэдрическими связями. Трехэлементные соединения. Их строение, свойства. Смешанные соединепия. Твердые расгвор1л. Эвтектические смеси. Оксосоединения /i-элементов. Силикат(.1, Алюмосиликаты. [c.181]
Исследования И. Н. Назарова позволили синтезировать ряд душистых природных веществ, исходя из спиртов, получаемых при переработке ацетилена. Таким путем были получены фарнезол, линалоол, гараниол. Из органических кислот и спиртов получают душистые вещества — сложные эфиры. Бензиловый эфпр уксусной кислоты применяют в духах типа Жасмин . Гераниоловые эфиры пропионовой и масляной кислот имеют запах розы и также используются в парфюмерных изделиях.
Бензиловый эфпр уксусной кислоты применяют в духах типа Жасмин . Гераниоловые эфиры пропионовой и масляной кислот имеют запах розы и также используются в парфюмерных изделиях.
Со значением свободной энергии, отнесенной к отдельному компоненту (веществу) сложной материальной системы, связывают понятие химического потенциала (в большинстве случаев он определяется для одного моля вещества). Химический потенциал зависит от свойств вещества и концентрации данного компонента в системе. Каждый процесс, ведущий к изменению состава (например, диффузия, химическая реакция), протекает в направлении уменьшения химического потенциала всех компонентов системы. Следовательно, если химический потенциал некоторых компонентов системы в различных ее точках имеет различную величину, то этот компонент при отсутствии каких-либо препятствий перейдет от точки с большим химическим потенциалом к точкам с меньшим химическим потенциалом. В результате система стремится к равновесию и достигает его, когда химические потенциалы всех компонентов по всему объему станут одинаковыми. [c.18]
[c.18]
ПРИРОДНЫЕ красящие вещества — сложные органические соединения, вырабатываемые живыми организмами и окрашивающие различные животные и растительные ткани. Длительное время природные красители применялись для окраски текстильных изделий, кожи, бумаги, пищевых продуктов и др. С развитием промышленности органического синтеза они утратили свое значение. Однако эти красители играют важную роль в жизни организмов, которыми они вырабатываются многие из них обладают значительной физиологической активностью и применяются как лечебные препараты. [c.203]
Понятно, что дисперсные системы по сравнению с агрегатными состояниями индивидуальных веществ сложнее по структуре и имеют свои особенности. [c.158]
Препараты для декорирования стекла, металла, дерева. Сульфиды (в виде терпенсульфидов золота или платины) используют для декорирования стекла, фарфора, металла, дерева, пластмассы, ткани, бумаги и др. [29]. Терпен-сульфиды металлов — вещества сложного, непостоянного состава они представляют собой продукты взаимодействия солей золота или платины со скипидаром (живичный скипидар, лиственничный терпентин), обработанным при нагревании элементарной серой. Нанесенный в виде орнамента на поверхность стекла или фарфора терпенсульфид золота восстанавливают при 420° С до свободного золота. [c.55]
Нанесенный в виде орнамента на поверхность стекла или фарфора терпенсульфид золота восстанавливают при 420° С до свободного золота. [c.55]
Таким образом, окислителями могут являться атомы веществ с высокой электроотрицательностью (ЭО) — элементарные окислители (Р, С1, О, 5 и т. д.) — или молекулы сложных веществ — сложные [c.254]
Моющее действие веществ — сложный коллоидно-химический процесс, включающий понижение поверхностной энергии, диспергирование, коллоидную защиту и солюбилизацию . [c.136]
Монопальмитат и моностеарат сахарозы относятся к классу неионогенных поверхностно-активных веществ. Сложные эфиры сахарозы обычно получают переэтерификацией по схеме [c.167]
Химическое превращение, т. е. образование новых веществ, обладающих по сравнению с исходными веществами иными свойствами, связано с изменением самих молекул вещества. Молекулы одних веществ сложнее, чем других, т. е. вещества отличаются друг от друга сложностью. Из различных сравнительно простых веществ посредством их соединения могут быть получены более сложные вещества. Наоборот, из сложных веществ посредством их разложения могут быть получены сравнительно более простые вещества. [c.5]
вещества отличаются друг от друга сложностью. Из различных сравнительно простых веществ посредством их соединения могут быть получены более сложные вещества. Наоборот, из сложных веществ посредством их разложения могут быть получены сравнительно более простые вещества. [c.5]
Поскольку свойства химических элементов находятся в периодической зависимости от заряда ядра их атомов (1-14), величина которого совпадает с порядковым номером элемента, в такой же зависимости от порядкового номера должны находиться и свойства элементарных веществ — как физические, так и химические. Так оно и есть на самом деле, только эта зависимость для элементарных веществ сложнее, чем для химических элементов. [c.48]
В отличие от ООС тонкий органический синтез (ТОС) объединяет производства органических веществ сложного строения, вырабатываемые в относительно небольших количествах и используемые преимущественно в качестве целевых конечных продуктов.
 К ним относятся красители, фото- и кинореактивы, фармацевтические препараты, взрывчатые вещества, парфюмерные средства и т.п. [c.236]
К ним относятся красители, фото- и кинореактивы, фармацевтические препараты, взрывчатые вещества, парфюмерные средства и т.п. [c.236]В начале 30-х годов Б. Уоррен применил этот метод для исследования структуры аморфных веществ сложного состава, ввел радиальные функции распределения электронной плотности, связанные с интенсивностью рассеяния уравнением [c.5]
Природа растворов. Растворы играют важную роль в природе и технике. В свое время алхимики считали, что вещества взаимодействуют лишь в растворенном состоянии. Многие технологические процессы, например получение соды или азотной кислоты, выделение и очистка редких металлов, отбеливание и окрашивание тканей, протекают в растворах. Вода, встречающаяся в природе, содержит растворенные вещества и поэтому всегда является раствором. Природные водные рас творы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные физико-химические процессы, происходящие в организме животных и человека, также протекают в растворах. Существует мнение, что образование белковоподобных соединений из неорганических веществ, т. е. возникновение жизни на Земле, также протекало в водных растворах. [c.180]
Существует мнение, что образование белковоподобных соединений из неорганических веществ, т. е. возникновение жизни на Земле, также протекало в водных растворах. [c.180]
Как известно, изоморфные вещества образуют друг с другом твердые растворы — гомогенные твердые вещества сложного состава, в структуре которых атомы распределены статистически. В твердых растворах ионных соединений, металлов, полимеров атомы соединены межатомными связями. Поэтому подобные вещества являются твердыми атомными соединениями. Каждому непрерывному твердому раствору соответствует ряд однотипных твердых химических соединений, в том числе соединений, обладающих равноценными статистическими структурами, и в ряде случаев интерметаллических соединений. Например, медь и золото образуют непрерывный ряд твердых растворов, но при концентрациях золота от 20 до 70 ат. % в сплавах, полученных отжигом (т. е. выдерживанием сплава при высокой температуре), проявляются интерметаллические соединения СизАи и СиАи, имеющие строго закономерную структуру.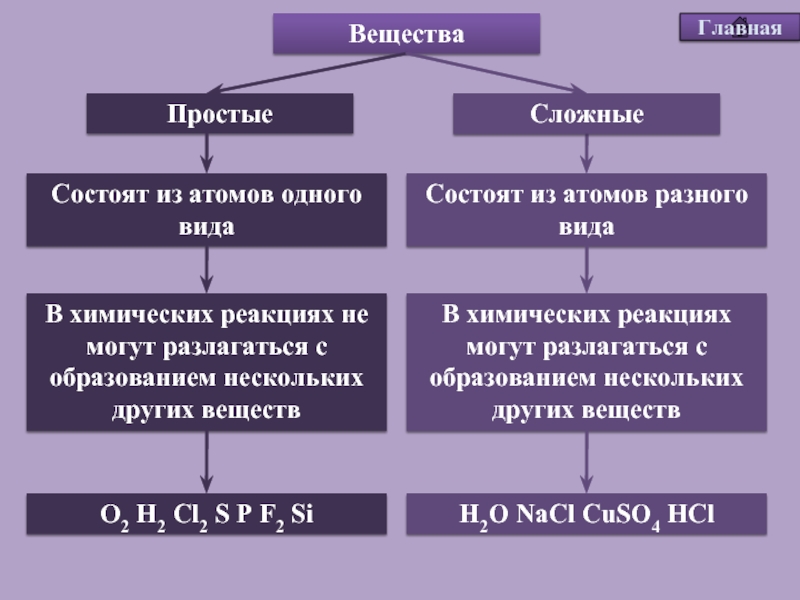 Следовательно, твердые растворы не всегда имеют неупорядоченное строение. Эта неупорядоченность — во многих случаях результат закрепления атомов при [c.44]
Следовательно, твердые растворы не всегда имеют неупорядоченное строение. Эта неупорядоченность — во многих случаях результат закрепления атомов при [c.44]
Веществ очень много. В настоящее время ученые знают около 3 миллионов органических и около 100 тысяч неорганических (минеральных) веществ. Для облегчения изучения веществ их классифицируют по различным признакам. Так, все известные вещества можно разделить на четыре большие группы элементарные частицы, простые вещества, сложные вещества и смеси. [c.5]
Белки. Белки — это природные вещества сложного строения, важнейшая составная часть живых организмов, основа процессов их жизнедеятельности. [c.309]
Автомобильные бензины до использования прихр- дится транспортировать и хранить иногда в течение длительного времени. В этот период наиболее нестабильные соединения, входящие в их состав, под действием кислорода воздуха претерпевают химические изменения с образованием смолистых веществ сложного состава (аутоокисление). Способ ность бензинов противостоять химическим изме- нениям при хранении, транспортировке и применении назы1 к)т химической стабильностью. [c.219]
Способ ность бензинов противостоять химическим изме- нениям при хранении, транспортировке и применении назы1 к)т химической стабильностью. [c.219]
Какое-нибудь вещество (сложное или простое) может находиться или рассматриваться в разных стандартных состояниях при одной и той же температуре. Так, воду при обычных температурах, наряду со стандартным жидким состоянием, часто рассматривают в стандартном состоянии идеального газа. Хотя такое состояние воды при обычных температурах практически недостия имо, термодинамические параметры, отвечающие ему, могут быть рассчитаны и широко используются в качестве вспомогательных величин при различных термодинамических расчетах. [c.22]
Со времени Лавуазье все вещества разделяют на простые вещества, сложные вещества (соединения) и смеси. Простое вещество состоит из атомов какого-нибудь одного элемента, соединения— из химически связанных атомов двух или более элементов. Простые вещества и соединения представляют собой химические иудивиды или индивидуальные вещества. Каждое из них обладает определенным составом, строением и только ему одному присущим набором свойств, обусловленных этим составом и строением. Химические индивиды отличаются от механических смесей однородностью, т. е. в их массе нет включений иного состава н строения. [c.12]
Каждое из них обладает определенным составом, строением и только ему одному присущим набором свойств, обусловленных этим составом и строением. Химические индивиды отличаются от механических смесей однородностью, т. е. в их массе нет включений иного состава н строения. [c.12]
Г 1,дрировать ароматические альдегиды, кетоны и спирты только пароматическим связям с сохранением кислородных функциональных групп не удается приходится защищать спиртовую или карбонильную группу, применяя производные этих веществ (сложные )фиры, ацетали). [c.509]
Исходное неизвестное органическое вещество — сложный эфир, так как прн кипячении его со щелочью в качестве одного из продуктов реакции образуется спирт. Грамм-моль С2Н5ОН = 46 г. Определим грамм-молекулярную массу сложного эфира, обозначив ее через х. [c.169]
Анализ сернистых соединений нефтяных дистиллятов сопряжен со значительными трудностями. Строение этих веществ сложнее строения углеводородов, в растворе которых они находятся, а содержание их в нефтепродуктах весьма мало (в среднедистиллятных фракциях высокосернистых нефтей не более 5—7 вес..jpg) %). Поэтому ни один из современных аналитических методов не позволяет с исчерпывающей полнотой определить состав нефтяных сернистых соединений. Лишь комбинируя методы определенным образом, удается решить эту задачу. Достоверность результатов во многом зависит от того, как подготовлено сырье для исследования. Насколько важна подготовка материала и насколько она может быть индивидуальна и неповторима для другого сырья, показывает следующий пример. Фракцию 111—150° С нефти месторождения Уассон (США) вначале в изотермических условиях разгоняли на узкие фракции. Из этих фракций специальными комбинированными методами были удалены меркаптаны (опи могли помешать определению соединений других классов). Однако даже такой подготовки оказалось недостаточно. Поэтому узкие фракхщ-подвергли гидрогеполизу. В результате сернистые соединения восстановились до соответствующих углеводородов, которые и были обнаружены методом газо-жидкост-ной хроматографии. Для проверки были проведены параллельные исследования методами ИК- и масс-спектрометрии, которые подтвердили правильность результата основного анализа.
%). Поэтому ни один из современных аналитических методов не позволяет с исчерпывающей полнотой определить состав нефтяных сернистых соединений. Лишь комбинируя методы определенным образом, удается решить эту задачу. Достоверность результатов во многом зависит от того, как подготовлено сырье для исследования. Насколько важна подготовка материала и насколько она может быть индивидуальна и неповторима для другого сырья, показывает следующий пример. Фракцию 111—150° С нефти месторождения Уассон (США) вначале в изотермических условиях разгоняли на узкие фракции. Из этих фракций специальными комбинированными методами были удалены меркаптаны (опи могли помешать определению соединений других классов). Однако даже такой подготовки оказалось недостаточно. Поэтому узкие фракхщ-подвергли гидрогеполизу. В результате сернистые соединения восстановились до соответствующих углеводородов, которые и были обнаружены методом газо-жидкост-ной хроматографии. Для проверки были проведены параллельные исследования методами ИК- и масс-спектрометрии, которые подтвердили правильность результата основного анализа. [c.75]
[c.75]
Поскольку ингибиторы представляют собой, как правило, многокомпонентные смеси веществ сложного строения, с помощью спектрометра 5РЕКОКО-М82 были получены ИК-спек-тры исследованных реагентов. При этом учитывали, что не следует надеяться на получение спектров, свободных от шумов, которые точно передавали бы контуры, частоты и интенсивности поглощения молекул и не были бы искажены самим спектрометром. В то же время с помощью ИК-спектрометрии невозможно установить различия в составе или структуре веществ, когда изменения сигналов соизмеримы с величинами случайных ошибок прибора, и констатировать, действительно ли данная проба удовлетворяет техническим условиям. Не имея атласа ИК-спектров, невозможно расшифровать состав ингибитора. Однако, рассмотрев внешнее сходство пиков ИК-спектров, ингибиторы можно подразделить на группы, в которых наблюдаются примерно одинаковые пики в определенных диапазонах [c.257]
Органический сапропелевый материал осаждается гораздо медленнее песка, но глинистый материал, как уже было показано, способен длительное время находиться во взвешенном состоянии, и поэтому понятно, почему органический материал и глинистые частицы могут осаждаться совместно, если вообще имело место поступление глинистого вещества. Так как глины, даже в неактивированном состоянии, способны превращать одни молекулы в другие, даже в пределах углеводородных классов, вообще менее способных к превращениям, чем соединения гетерогенного характера, образование углеводородов и близких к ним веществ сложной полициклической структуры кажется с химической точки зрения вероятным. С другой стороны, песок и карбонатные породы лишены ярко выраженных каталитических свойств, а потому совместное осаждение органического вещества теоретически не обеспечивает благоприятной обстановки для нефтепроизводящих процессов. Карбонатные породы, содержащие органическое вещество, являются продуктом превращений скелетных частей организмов, и, следовательно, невозможно как-то разъединять процессы отложения органического вещества и карбонатов. Вероятно, наличие карбонатов доля по препятствовать образованию нефти. Таким образом, приходится опираться главным образом на глинистые породы, ( держащие органическое вещество, как на благоприятную среду для нефтеобразовательных процессов.
Так как глины, даже в неактивированном состоянии, способны превращать одни молекулы в другие, даже в пределах углеводородных классов, вообще менее способных к превращениям, чем соединения гетерогенного характера, образование углеводородов и близких к ним веществ сложной полициклической структуры кажется с химической точки зрения вероятным. С другой стороны, песок и карбонатные породы лишены ярко выраженных каталитических свойств, а потому совместное осаждение органического вещества теоретически не обеспечивает благоприятной обстановки для нефтепроизводящих процессов. Карбонатные породы, содержащие органическое вещество, являются продуктом превращений скелетных частей организмов, и, следовательно, невозможно как-то разъединять процессы отложения органического вещества и карбонатов. Вероятно, наличие карбонатов доля по препятствовать образованию нефти. Таким образом, приходится опираться главным образом на глинистые породы, ( держащие органическое вещество, как на благоприятную среду для нефтеобразовательных процессов. [c.202]
[c.202]
Одной из важнейших задач в комплексе проблем, связанных с развитием нефтеперерабатывающей и нефтехимической отраслей России, является обеспечение высокой эксплуатационной надежности технологического оборудования. Важность этой задачи обусловлена как специфическими особенностями указанных отраслей, так и современными тенденциями их развития. К числу факторов, выделяющих нефтепереработку и нефтехимию из сферы промышленного производства, следует отнести широкое применение в технологических процессах повышенных и криогенных температур высоких давлений и вакуума коррозионных, огне- и взрывоопасных сред сильнодействующих ядовитых веществ сложные режимы нагружения технологического оборудования, включающие различные виды и сочетания силовых, тепловых и коррозионных нагрузок [1, 2], Для большинства видов оборудования эти факторы действуют одновременно, приводя к проявлению системного эффекта эмерджентности. Стохастическая природа внешних воздействий и внутренних процессов, протекающих в конструкционных материалах, делает результаты такого проявления трудно прогнозируемыми. При неблагоприятном стечении обстоятельств это может привести к большому экономическому ущербу, нарушению нормальной экологической обстановки на значительных территориях, а в особо тяжелых случаях- к человеческим жертвам. [c.3]
При неблагоприятном стечении обстоятельств это может привести к большому экономическому ущербу, нарушению нормальной экологической обстановки на значительных территориях, а в особо тяжелых случаях- к человеческим жертвам. [c.3]
Опыт 2. Влияние температуры. При взамодейст-вии иода с крахмалом образуется синее вещество сложного состава (соединение включения) [c.70]
Эпипроекцию применяют при изложении нового материала показывая рисунки или чертежи, учитель включает их описание в свой рассказ или предлагает учащимся проанализировать изображение. Умелое использование эпипроекции открывает возможность организовать творческую работу в классе. Так, по последовательному ряду веществ или химических реакций, можно предложить учащимся перечислить простые вещества, сложные, типичные восстановители, окислители, назвать предложенный тип химической реакции и пр. Творческая работа может быть организована и по фотографиям, снятым самими учащимися во время экскурсий на производство, в лаборатории и музеи. Комментируют такой эпифильм учащиеся-авторы. [c.137]
Комментируют такой эпифильм учащиеся-авторы. [c.137]
Атомы, из которых сложен остов твердого вещества, являются его структурными единицами. В общем случае структурные единицы имеют более сложный состав и строение, могут состоять из нескольких атомов, например SiOi >B кремнеземе. В твердых веществах сложного состава химические связи между атомами остова самые разнообразные, однако положение упрощается, если использовать понятие о структурных единицах. Тогда можно выявить общий принцип для твердых тел характер связей [c.9]
В избытке НС1 пентахлорид сурьмы образует комплексное соединение H(Sb l(.). Ион Sb l » образует с органическим полициклическим веществом сложной структуры — родамином Б — соединение с еще не изученной структурой. [c.225]
Помимо чисто химического, гомогенный катализ имеет громадное биологическое значение. В организмах и животных, и растений содержатся ферменты —органические вещества сложного строения, играющие роль катализаторов при разнообразных жизйенных процессах. Они обнаруживают резкую специфичность действия, так как каждый из них ускоряет только определенный процесс, не влияя на другие. В этом отношении ферменты превосходят неорганические катализаторы, которые большей частью могут ускорять ряд сходных по химизму реакций. 3 [c.346]
Они обнаруживают резкую специфичность действия, так как каждый из них ускоряет только определенный процесс, не влияя на другие. В этом отношении ферменты превосходят неорганические катализаторы, которые большей частью могут ускорять ряд сходных по химизму реакций. 3 [c.346]
Такая запись отражает три основных фактора, определяющих поведение ионов в системе их молекулярное взаимодействие с окружающей средой ( lio), участие в тепловом движении (RT ln i) и взаимодействие с электрическим полем (гг-есрЫд). Вообще говоря, соотношение (VII—6) должно выполняться для всех ионов, присутствующих в системе. Однако иногда (при больших значениях lio) какие-либо ионы практически отсутствуют в одной из фаз или в обеих контактирующих фазах в последнем случае они присутствуют только на поверхности раздела фаз (поверхностная диссоциация, характерная для неорганических веществ сложного строения, например, силикатных и алюмосиликатных минералов). Кроме того, возможна такая поляризация поверхности, когда для одного из ионов из-за кинетических затруднений электрохимическое равновесие не устанавливается тогда разность потенциалов между фазами может быть изменена без изменения их состава приложением внешней разности потенциалов.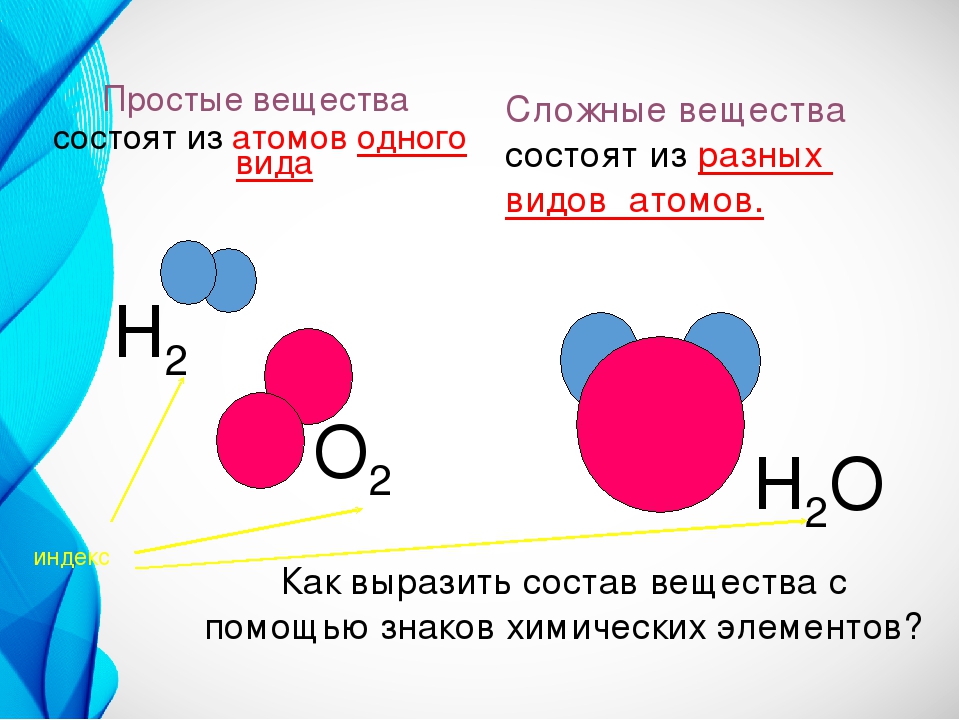 [c.177]
[c.177]
Химия для поступающих в вузы 1985 (1985) — [ c.12 ]
Химия для поступающих в вузы 1993 (1993) — [ c.11 ]
История химии (1975) — [ c.109 ]
Учебник физической химии (0) — [ c.71 ]
История химии (1966) — [ c.110 ]
Сочинения Научно-популярные, исторические, критико-библиографические и другие работы по химии Том 3 (1958) — [
c.5
,
c.15
,
c.22
,
c.31
,
c.47
,
c.49
,
c.52
,
c.57
,
c. 62
,
c.174
,
c.175
,
c.177
,
c.178
,
c.182
,
c.184
,
c.202
,
c.205
,
c.206
,
c.210
,
c.212
,
c.215
,
c.218
,
c.220
,
c.228
,
c.230
,
c.240
,
c.256
,
c.262
,
c.265
]
62
,
c.174
,
c.175
,
c.177
,
c.178
,
c.182
,
c.184
,
c.202
,
c.205
,
c.206
,
c.210
,
c.212
,
c.215
,
c.218
,
c.220
,
c.228
,
c.230
,
c.240
,
c.256
,
c.262
,
c.265
]
Урок на тему «Простые и сложные вещества».
 8-й класс, химия
8-й класс, химияЦель урока:
- Знать определение атома, молекулы, простого и сложного вещества.
- Уметь различать простые и сложные вещества; смеси и сложные вещества.
- Знать отличие смеси и сложного вещества.
Оборудование: Шаровые модели молекул воды, Штатив с пробирками, реактивы (железо, вода, сера, карбонат кальция).
демонстрация соединение железа с серой.
Лабораторные опыты: Ознакомление с образцами простых и сложных веществ.
Ход урока
1. Повторение и обобщение знаний.
1) Проверка домашнего задания:
Упражнение упр. 8, 9, 10, на стр. 22. (Взаимопроверка).
2) Выполните тестовое задание. Подберите соответствие: термин – определение понятия.
(Приложение №1). Самопроверка.
3) Приведите примеры смесей (не менее двух), которые можно разделить:
1 вариант:
А) фильтрованием————————————————————————————-
Б) отстаиванием—————————————————————————————-
2 вариант:
А) выпариванием—————————————————————————————
Б) дистилляцией——————————————————————————————
2. Изучение нового материала
Изучение нового материала
1. Фронтальный опрос:
Какие виды смесей вам известны?
Какие смеси называются однородными, неоднородными?
Какое вещество называется чистым? Что такое «вещество»? Из курса физики вам известно, что многие вещества состоят из молекул.
Дайте определения понятиям «молекула» и «атом». (Приложение №2).
Рассмотрите шаровые модели некоторых веществ, укажите состав данного вещества. Чем молекула озона отличается от молекулы оксида кальция? Чем водород отличается от соляной кислоты? Учащиеся могут ответить, что молекулы водорода, фосфора, азота образованы атомами одного вида. – Простые вещества.
Вещества соляная кислота, оксид кальция, метан, оксид натрия образованы атомами разного вида. Сложные вещества.
Выпишите в словарь новые понятия, со страниц 15,16.
Заполните схему:
2. Лабораторный опыт.
Инструкция к лабораторному опыту.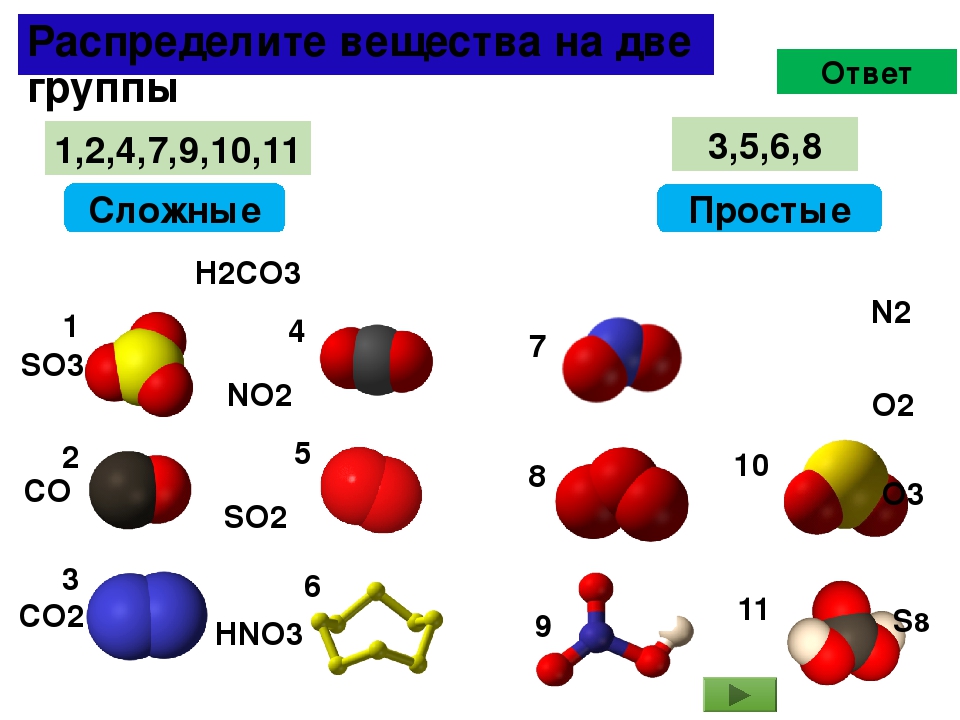
- Прослушайте инструктаж по охране труда.
- Выполните опыт: рассмотрите выданные вам образцы веществ: железо, вода, сера, карбонат кальция.
- Опишите их физические свойства.
- Оформите результаты в таблицу. (Приложение №3).
| Физические свойства | железо |
вода |
сера |
Карбонат кальция |
Агрегатное состояние (твердое, жидкое, газообразное) |
|
|
|
|
Цвет |
|
|
|
|
Блеск |
|
|
|
|
Растворимость в воде |
|
|
|
|
Хрупкость (пластичность) |
|
|
|
|
Теплоэлектропроводность |
|
|
|
|
Температура кипения, температура плавления. |
|
|
|
|
Простое (сложное) вещество |
|
|
|
|
Вывод к работе: о физических свойствах веществ, о составе простых и сложных веществах.
3. Чем смесь отличается от сложного вещества.
Напомнив, как готовиться смесь железа и серы, учитель отмечает, что сера — простое вещество, молекулы ее состоят из одинаковых атомов одного вида, железо тоже простое вещество, состоящее из одинаковых атомов другого вида. Можно ли назвать то, что получилось при перемешивании порошков, сложным веществом? Разделим смесь при помощи магнита. После обсуждения делаем вывод, что смесь можно разделить физическими способами и получить чистые вещества, из которых она состояла. Нагреваем железо с опилками. Образовалось новое вещество, которое невозможно разделить, не действует на него магнит. Сульфид железа – это чистое сложное вещество.
Нагреваем железо с опилками. Образовалось новое вещество, которое невозможно разделить, не действует на него магнит. Сульфид железа – это чистое сложное вещество.
Таблица №1. Сравнение смесей и сложных веществ.
Смесь |
Сложное вещество |
1. Вещества сохраняют свои свойства. |
1. Свойства исходных веществ не сохраняются. |
2. Вещества можно разделить физическими методами. |
2. Сложное вещество нельзя разделить физическими методами. |
3. Количественный состав может быть произвольным. |
3. Количественный состав химического соединения всегда одинаков независимо от места нахождения и способа получения. |
3. Закрепление.
1. Выпишите простые вещества: сталь, чугун, железо, морская вода, дистиллированная вода, алюминий, лимонад, спиртовая настойка йода, нефть, глюкоза, поваренная соль, воздух, кислород, бронза.
2. Простые вещества состоят из атомов … химического элемента.
Сложные вещества состоят из атомов … Химических элементов. Сложные вещества иначе называют … .
Простое вещество, в отличие от сложного, нельзя … .
3. Чем морская вода отличается от дистиллированной воды?
4. Сравнить смесь со сложным веществом.
Вопросы и задания |
Вещества |
|
вода |
Водород и кислород (смесь) |
|
Можно ли разделить эти вещества на более простые компоненты. |
|
|
Сохраняется ли способность молекул кислорода поддерживать горение? Почему? |
|
|
Рефлексия и подведение итогов.
Что нового узнали на уроке?
Какие вопросы вызвали затруднение?
Какие знания вы сегодня приобрели?
Домашнее задание: Читать стр. 15-17.
Выполнить упражнения 11-13 на стр.22.
Литература: Г.Е. Рудзитис, Ф.Г. Фельдман. «Химия 8 класс».
Сложные вещества — Химия. 7 класс. Попель
Химия. 7 класс. Попель
Материал параграфа поможет вам:
- выделять среди всех веществ сложные вещества;
- различать органические и неорганические вещества.

Сложные вещества. Соединение атомов разных химических элементов обуславливает существование веществ, которых в десятки тысяч раз больше, чем простых веществ.
Вещество, образованное двумя или большим количеством элементов, называют сложным веществом, или химическим соединением1.
Большинство сложных веществ имеют молекулярное строение. Температуры их плавления и кипения невысокие. Многие такие вещества имеют запах.
Молекулярным соединением является вода. Молекула воды состоит из двух атомов Гидрогена и одного атома Оксигена (с. 40, рис. 30, б). Молекулярное строение имеют угарный и углекислый газы (они образованы Карбоном и Оксигеном), сахар, этиловый спирт, уксусная кислота (образованы Карбоном, Гидрогеном и Оксигеном). Количество атомов в молекулах сложных веществ может быть разным — от двух атомов до сотен и даже тысяч.
1 Часто слово «химическое» опускают.
Некоторые соединения имеют атомное строение. Одним из них является минерал кварц — главная составная часть песка. В нем содержатся атомы Силиция и Оксигена, соединенные между собой (рис. 45).
Одним из них является минерал кварц — главная составная часть песка. В нем содержатся атомы Силиция и Оксигена, соединенные между собой (рис. 45).
Это интересно
В бактериях обнаружено вещество, молекула которого состоит из 19 913 атомов.
Рис. 45. Модель строения кварца
Существуют сложные вещества, образованные ионами. Это — поваренная соль, мел, питьевая и кальцинированная сода, известь, гипс и многие другие.
Кристаллы поваренной соли состоят из положительно заряженных ионов Натрия и отрицательно заряженных ионов Хлора (рис. 46).
Рис. 46. Модель строения поваренной соли
Названия сложных веществ. В этом и предыдущих параграфах учебника мы приводили традиционные, технические или бытовые названия сложных веществ — мел, кварц, питьевая сода и т. п. Кроме них, используют и химические названия. Например, химическое название поваренной соли — натрий хлорид.
Например, химическое название поваренной соли — натрий хлорид.
В нем первое слово является названием одного из двух элементов, которыми образовано вещество (его пишут с маленькой буквы), а второе происходит от названия другого элемента.
Органические и неорганические вещества. На уроках природоведения вы узнали, что вещества делят на органические и неорганические. Ранее органическими веществами называли те, которые содержатся в живых организмах. Это белки, жиры, сахар, крахмал, витамины, соединения, придающие цвет, запах, вкус овощам и фруктам. Со временем ученые обнаружили, что существуют и другие, подобные по составу вещества, которые можно получить лишь в химической лаборатории. Среди них — фармацевтические препараты, искусственные красители, полимеры и т. п. Ныне к органическим веществам относят почти все соединения Карбона (за исключением угарного и углекислого газов, мела, питьевой и кальцинированной соды, некоторых других).
Остальные сложные вещества, а также все простые называют неорганическими веществами. Они, как и органические вещества, распространены в природе. Неорганические вещества содержатся в почве, горных породах, воздухе, природной воде. Некоторые из них есть и в живых организмах.
Они, как и органические вещества, распространены в природе. Неорганические вещества содержатся в почве, горных породах, воздухе, природной воде. Некоторые из них есть и в живых организмах.
Материал параграфов 11 и 12 обобщен в схеме 4, иллюстрирующей многообразие веществ.
Схема 4
Типы веществ
ЛАБОРАТОРНЫЙ ОПЫТ № 2
Ознакомление с образцами простых и сложных веществ
Вам выданы такие вещества:
вариант I — сахар, мел (кальций карбонат), графит, медь;
вариант II — крахмал, алюминий, сера, поваренная соль (натрий хлорид).
Вещества содержатся в банках с этикетками.
Внимательно рассмотрите вещества, обратите внимание на их названия. Определите среди веществ простые (металлы, неметаллы) и сложные, а также органические и неорганические.
Запишите в таблицу название каждого вещества и укажите его тип, поставив в соответствующем столбце знак « + »:
Название вещества | Простое вещество | Сложное вещество | Органическое вещество | Неорганическое вещество | |
металл | неметалл | ||||
Выводы
Сложные вещества (химические соединения) образованы двумя или большим количеством химических элементов. Многие сложные вещества имеют молекулярное строение, некоторые состоят из соединенных между собой атомов.
Многие сложные вещества имеют молекулярное строение, некоторые состоят из соединенных между собой атомов.
Различают органические и неорганические вещества. К органическим веществам относятся почти все соединения Карбона, а к неорганическим — остальные соединения и простые вещества.
- 83. Какое вещество называют сложным? Приведите примеры нескольких таких веществ.
- 84. Простыми или сложными веществами являются металлические руды (их переработкой получают металлы)? Ответ обоснуйте.
- 85. Простым или сложным является вещество, при нагревании которого выделяются углекислый газ и водяной пар? Ответ объясните.
- 86. Какими элементами образованы сложные вещества с такими химическими названиями: алюминий оксид, силиций нитрид, натрий гидрогенсульфид?
- 87. Укажите в приведенном перечне органические и неорганические вещества: алмаз, глюкоза, вода, мел, растительное масло, витамин C (аскорбиновая кислота).
Сложное вещество
Сложное вещество – это вещество, состоящее из атомов двух и более разных химических элементов. Согласно принципам систематической номенклатуры, химическая формула сложного вещества разделяется на условно электроположительную (катион) и условно электроотрицательную (анион) составляющие. Первая составляющая ставится в формуле слева, а вторая – справа. Название сложного вещества читается справа налево, то есть вначале называется его электроотрицательная составляющая в именительном падеже, а затем электроположительная – в родительном. При этом в случае одноэлементной электроотрицательной составляющей используется суффикс –ид, а в случае многоэлементарной – суффикс –ат.
Классификация сложных веществ:Бинарные соединенияВ формулах бинарных соединений, состоящих из металла и неметалла, на первом месте всегда стоит металл (как более электроположительный элемент): K2S, CaCl2, CrO3, AlP, Cr2O3, ScF3.
В формулах соединений, не содержащих атомы металлов, на первом месте помещается элемент с меньшей электроотрицательностью. Порядок увеличения электроотрицательности определяется практическим рядом:
Rn, Xe, Kr, B, Si, C, As, P, H, Te, Se, S, At, I, Br, Cl, N, O, F
Например, H2O, CS2, Cl3N, C2H6, AsI3, NO2, OF2. Исключение составляют некоторые соединения азота с водородом, для которых оставлено традиционное написание формул: HN3, N2H4 (но для кислоты HN3).
Бинарные соединения:
- Галогениды;
- Оксиды;
- Халькогениды;
- Нитриды;
- Водородные соединения азота;
- Фосфиды;
- Карбиды;
- Гидриды;
- Интерметаллиды.
- Гидроксиды;
- Кислоты;
- Соли;
Автор: Тикавый В. Ф.
Ф.
Источник: Общая химия в формулах, определениях, схемах., под редакцией Тикавого В.Ф.,1987 год
Дата в источнике: 1987 год
Комплекс (химия) — Энциклопедия Нового Света
- Чтобы узнать о других значениях термина, см. Комплекс.
Синтез металлического комплекса медь (II) -тетрафенилпорфина из тетрафенилпорфина и моногидрата ацетата меди (II).
Комплекс в химии обычно используется для описания молекул или ансамблей, образованных комбинацией лигандов и ионов металлов. Первоначально химический комплекс подразумевал обратимую ассоциацию молекул, атомов или ионов через слабые химические связи.Применительно к координационной химии это значение было изменено.
Некоторые комплексы металлов образуются практически необратимо, и многие из них связаны довольно прочными связями.
История
Координационные комплексы были известны, хотя и не изучены в каком-либо смысле, с начала химии. Примеры включают берлинскую лазурь и медный купорос.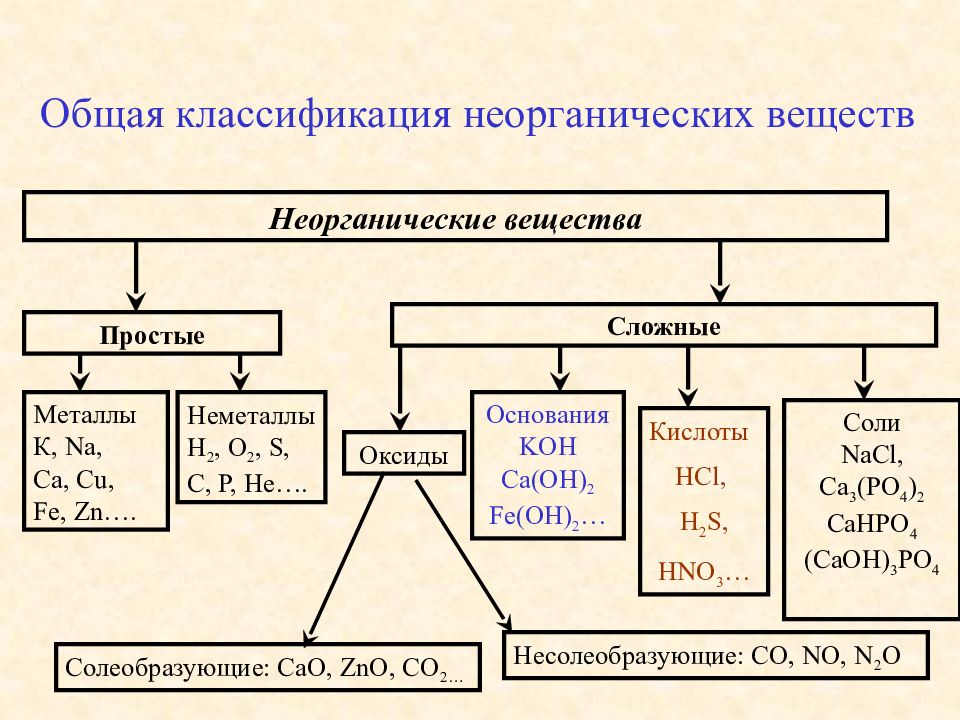 Ключевой прорыв произошел, когда Альфред Вернер предположил, среди прочего , что Co (III) несет шесть лигандов в октаэдрической геометрии.Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аминов кобальта и объяснить многие из ранее необъяснимых изомеров. Он разделил первый координационный комплекс на оптические изомеры, опровергнув теорию о том, что хиральность обязательно связана с углеродными соединениями.
Ключевой прорыв произошел, когда Альфред Вернер предположил, среди прочего , что Co (III) несет шесть лигандов в октаэдрической геометрии.Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аминов кобальта и объяснить многие из ранее необъяснимых изомеров. Он разделил первый координационный комплекс на оптические изомеры, опровергнув теорию о том, что хиральность обязательно связана с углеродными соединениями.
Металлокомплексы
Комплексы металлов, также известные как координационные соединения, включают все соединения металлов, за исключением паров металлов, плазмы и сплавов.Изучение «координационной химии» — это изучение «неорганической химии» всех щелочных и щелочноземельных металлов, переходных металлов, лантаноидов, актинидов и металлоидов. Таким образом, координационная химия — это химия большинства элементов таблицы Менделеева. Металлы и ионы металлов существуют только, по крайней мере, в конденсированных фазах, в окружении лигандов.
Ионы или молекулы, окружающие металл, называются лигандами. Лиганды обычно связаны с ионом металла координатной ковалентной связью (отдавая электроны из неподеленной электронной пары на пустую металлическую орбиталь), и, таким образом, говорят, что они координированы с ионом .Области координационной химии можно классифицировать в соответствии с природой лигандов, в общих чертах:
- Классический (или «комплексы Вернера»): лиганды в классической координационной химии связываются с металлами почти исключительно через свои «неподеленные пары» электронов, находящихся на атомах основной группы лиганда. Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en —
- Примеры: [Co (EDTA)] — ], [Co (NH 3 ) 6 ] Cl 3 , [Fe (C 2 O 4 ) 3 ] K 3
- Металлоорганический химический состав: лиганды являются органическими (алкены, алкины, алкилы) в виде а также «органические» лиганды, такие как фосфины, гидрид и CO.

- Пример: (C 5 H 5 ) Fe (CO) 2 CH 3
- Биоинорганическая химия: лиганды образуются природой, особенно в том числе боковые цепи аминокислот, и многие кофакторы, такие как порфирины.
- Пример: гемоглобин
- Многие природные лиганды являются «классическими», особенно вода.
- Кластерная химия: лиганды представляют собой все вышеперечисленное, но также включают другие металлы в качестве лигандов.
- Пример Ru 3 (CO) 12
- В некоторых случаях возможны комбинации различных полей:
- Пример: [Fe 4 S 4 (Scysteinyl) 4 ] 2−, в котором кластер внедрен в биологически активный вид.
Минералогия, материаловедение и химия твердого тела — применительно к ионам металлов — являются подмножествами координационной химии в том смысле, что металлы окружены лигандами. Во многих случаях эти лиганды являются оксидами или сульфидами, но, тем не менее, металлы скоординированы, и применяются принципы и рекомендации, обсуждаемые ниже. Верно, что направление минералогии, материаловедения и химии твердого тела отличается от обычного направления координационной или неорганической химии. Первые в первую очередь связаны с полимерными структурами, свойствами, возникающими в результате коллективного воздействия многих сильно взаимосвязанных металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Во многих случаях эти лиганды являются оксидами или сульфидами, но, тем не менее, металлы скоординированы, и применяются принципы и рекомендации, обсуждаемые ниже. Верно, что направление минералогии, материаловедения и химии твердого тела отличается от обычного направления координационной или неорганической химии. Первые в первую очередь связаны с полимерными структурами, свойствами, возникающими в результате коллективного воздействия многих сильно взаимосвязанных металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Строение координационных соединений
Геометрия
Структура в сложной химии начинается с акцента на «координационное число», количество лигандов, прикрепленных к металлу (более конкретно, количество связей σ-типа между лигандом (ами) и центральным атомом). Обычно можно подсчитать присоединенные лиганды, но иногда даже подсчет может быть неоднозначным. Координационные числа обычно составляют от двух до девяти, но большое количество лигандов не является редкостью. Количество связей зависит от размера, заряда и электронной конфигурации иона металла.Большинство ионов металлов могут иметь более одного координационного числа.
Координационные числа обычно составляют от двух до девяти, но большое количество лигандов не является редкостью. Количество связей зависит от размера, заряда и электронной конфигурации иона металла.Большинство ионов металлов могут иметь более одного координационного числа.
Обычно в химии комплексов доминируют взаимодействия между s- и p-молекулярными орбиталями лигандов и d (или f) -орбиталями ионов металлов. Орбитали s, p и d металла дают возможность разместить 18 электронов (см. Правило 18 электронов; для элементов f-блока это распространяется до 32 электронов). Таким образом, максимальное координационное число для определенного металла связано с электронной конфигурацией иона металла (точнее, с числом пустых орбиталей) и с соотношением размеров лигандов и иона металла.Большие металлы и маленькие лиганды приводят к высоким координационным числам, например [Mo (CN) 8 ] 4-. Мелкие металлы с большими лигандами приводят к низким координационным числам, например Pt [P (CMe 3 ] 2 .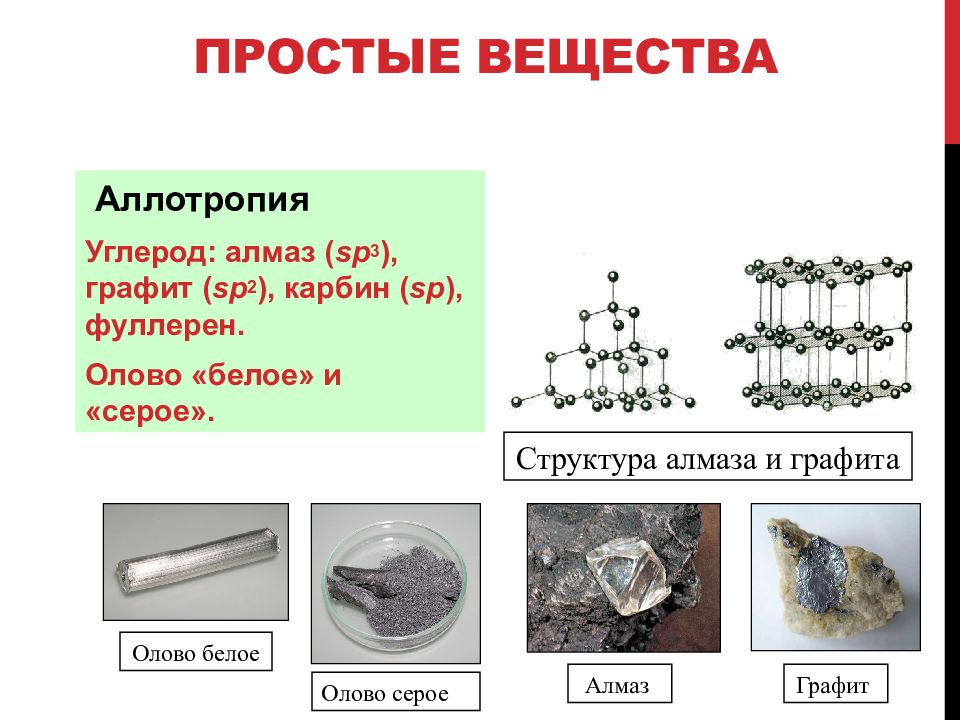 Из-за своего большого размера лантаноиды, актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Из-за своего большого размера лантаноиды, актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Различное структурное расположение лигандов обусловлено координационным числом. Большинство структур следуют шаблону точек на сфере (или, как если бы центральный атом находился в середине многогранника, где углы этой формы являются местоположениями лигандов), где орбитали перекрываются (между орбиталями лиганда и металла). ) и отталкивание лиганд-лиганд имеет тенденцию приводить к определенной регулярной геометрии.Наиболее наблюдаемые геометрии перечислены ниже, но есть много случаев, когда они отклоняются от обычной геометрии, например из-за использования лигандов разных типов (что приводит к неправильной длине связи; координационные атомы не следуют схеме точки на сфере), из-за размера лигандов или из-за электронных эффектов (см., например, Jahn -Кассирское искажение):
- Линейная двухкоординатная,
- Тригональный планарный трехкоординатный,
- Тетраэдрический или квадратно-плоский для четырехкоординатного
- Тригонально-бипирамидальный или квадратно-пирамидальный для пятикоординатного типа,
- Октаэдрический (ортогональный) или тригонально-призматический для шестикоординированной,
- Пятиугольная бипирамидальная семикоординация,
- Квадратный антипризматический для восьмикоординатного типа и
- Трехглавая треугольная призма (трехгранная треугольная призма) для девяти координат.

Следует отметить некоторые исключения и положения:
- Идеализированные описания 5-, 7-, 8- и 9-координации часто геометрически неотличимы от альтернативных структур с немного разными углами L-M-L (лиганд-металл-лиганд). Классический пример этого — разница между квадратно-пирамидальными и тригонально-бипирамидальными структурами.
- Из-за специальных электронных эффектов, таких как (второго порядка) стабилизация Яна-Теллера, некоторые геометрические формы стабилизируются относительно других возможностей, например.г. для некоторых соединений тригонально-призматическая геометрия стабилизируется по сравнению с октаэдрическими структурами для шестикоординации.
Изомерия
Расположение лигандов фиксировано для данного комплекса, но в некоторых случаях оно может изменяться в результате реакции, в результате которой образуется другой стабильный изомер.
Существует много типов изомерии в координационных комплексах, как и во многих других соединениях.
Стереоизомерия
Стереоизомерия возникает с одними и теми же связями в разной ориентации относительно друг друга.Стереоизомерию можно разделить на:
Геометрическая изомерия
Геометрическая изомерия встречается в октаэдрических и квадратных плоских комплексах (но не в тетраэдрических). Когда два лиганда находятся напротив друг друга, они называются транс , когда они взаимно соседними, цис . Когда три идентичных лиганда занимают одну грань октаэдра, изомер называется лицевым, или fac . Если эти три лиганда копланарны, изомер называют меридиональным, или мер .Например, в октаэдрическом соединении с тремя из одного лиганда и тремя из другого существует два геометрических изомера: mer , в котором каждый набор из трех одинаковых лигандов находится в меридиане, и fac , в котором каждый набор из трех находится на грани октаэдра.
цис — [CoCl 2 (NH 3 ) 4 ] +
транс — [CoCl 2 (NH 3 ) 4 ] +
fac — [CoCl 3 (NH 3 ) 3 ]
мер — [CoCl 3 (NH 3 ) 3 ]
Оптическая изомерия
Оптическая изомерия возникает, когда зеркальное отображение соединения не совмещается с исходным соединением. Это так называется, потому что такие изомеры оптически активны, то есть они вращают плоскость поляризованного света. Символ Λ (дельта) используется в качестве префикса для описания поворота левого винта, образованного тремя бидентатными лигандами, как показано. Аналогично, символ Δ (лямбда) используется в качестве префикса для правостороннего поворота воздушного винта.
Это так называется, потому что такие изомеры оптически активны, то есть они вращают плоскость поляризованного света. Символ Λ (дельта) используется в качестве префикса для описания поворота левого винта, образованного тремя бидентатными лигандами, как показано. Аналогично, символ Δ (лямбда) используется в качестве префикса для правостороннего поворота воздушного винта.
Λ- [Fe (ox) 3 ] 3−
Δ- [Fe (ox) 3 ] 3−
Λ- цис — [CoCl 2 (en) 2 ] +
Δ- цис — [CoCl 2 (en) 2 ] +
Структурная изомерия
Структурная изомерия возникает, когда связи сами по себе различны.Изомерия сцепления — это только один из нескольких типов структурной изомерии в координационных комплексах (как и в других классах химических соединений). Изомерия связывания возникает с амбидентатными лигандами, которые могут связываться более чем в одном месте. Например, NO 2 является амбидентатным лигандом: он может связываться с металлом либо по атому N, либо по атому O.
Изомерия связывания возникает с амбидентатными лигандами, которые могут связываться более чем в одном месте. Например, NO 2 является амбидентатным лигандом: он может связываться с металлом либо по атому N, либо по атому O.
Старые классификации изомерии
Традиционные классификации видов изомеров стали архаичными с появлением современной структурной химии.В более древней литературе можно встретить:
- Ионизационная изомерия описывает возможные изомеры, возникающие в результате обмена между внешней и внутренней сферами. Эта классификация основана на архаичной классификации внутренней и внешней сферы. В этой классификации «лиганды внешней сферы», когда ионы в растворе, могут быть заменены «лигандами внутренней сферы» с образованием изомера.
- Изомерия сольвата возникает, когда лиганд внутренней сферы заменяется молекулой растворителя.Эта классификация устарела, поскольку она рассматривает растворители как отличные от других лигандов.
 Некоторые проблемы обсуждаются под кристаллизационной водой.
Некоторые проблемы обсуждаются под кристаллизационной водой.
Электронное строение координационных соединений
Многие свойства комплексов металлов продиктованы их электронным строением. Электронную структуру можно описать с помощью относительно ионной модели, которая приписывает формальные заряды металлам и лигандам и не фокусируется на ковалентности. Этот подход составляет суть теории кристаллического поля (CFT).Теория кристаллического поля, представленная Гансом Бете в 1929 году, представляет собой квантово-механическую попытку понимания комплексов. Но теория кристаллического поля рассматривает все взаимодействия в комплексе как ионные и предполагает, что лиганды могут быть аппроксимированы отрицательными точечными зарядами.
Более сложные модели охватывают ковалентность, и этот подход описывается теорией поля Лиганда (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, представленная в 1935 году и основанная на теории молекулярных орбиталей, может работать с более широким кругом комплексов и может объяснять комплексы, в которых взаимодействия ковалентны. Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя простые, основанные на симметрии решения формальных уравнений.
Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя простые, основанные на симметрии решения формальных уравнений.
Химики склонны использовать простейшую модель, необходимую для предсказания интересующих свойств; по этой причине CFT был фаворитом для обсуждений, когда это было возможно. Теории МО и НЧ сложнее, но дают более реалистичную перспективу.
Электронная конфигурация комплексов придает им некоторые важные свойства:
Цвет
Металлические комплексы часто имеют эффектную окраску.Эти цвета возникают из-за поглощения света, который возбуждает электроны на орбиталях металла или, в случае переноса заряда, возбуждает электроны с орбиталей на основе металла на орбитали на основе лиганда (или наоборот). Помощь для объяснения и интерпретации электронных возбуждений в наборе металлических орбиталей — это диаграммы Танабе-Сугано (для простых соединений с хорошо определенной геометрией) или использование вычислительной химии.
Магнетизм
Комплексы металлов, содержащие неспаренные электроны, обладают магнитными свойствами.Рассматривая только монометаллические комплексы, неспаренные электроны возникают из-за нечетного числа электронов в комплексе или из-за дестабилизации спаривания электронов. Таким образом, мономерные частицы Ti (III) имеют один «d-электрон» и должны быть (пара) магнитными, независимо от геометрии или природы лигандов. Ti (II) с двумя d-электронами образует некоторые комплексы, которые имеют два неспаренных электрона, а другие — ни одного. Этот эффект иллюстрируется соединениями TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P (CH 3 ) 2 ] 2 : когда X = Cl, комплекс является парамагнитным (высокоспиновая конфигурация), тогда как при X = CH 3 он диамагнитен (низкоспиновая конфигурация).Важно понимать, что лиганды предоставляют важные средства регулировки свойств основного состояния.
В би- и полиметаллических комплексах, в которых отдельные центры имеют нечетное число электронов или имеют высокий спин, ситуация более сложная. Если существует взаимодействие (прямое или через лиганд) между двумя (или более) металлическими центрами, электроны могут взаимодействовать (антиферромагнитное взаимодействие, приводящее к диамагнитному соединению), или они могут усиливать друг друга (ферромагнитное взаимодействие).Когда нет взаимодействия, два (или более) отдельных металлических центра ведут себя как две отдельные молекулы.
Реакционная способность
Комплексы обладают множеством возможных реактивностей:
- Обычной реакцией между координационными комплексами с участием лигандов является перенос электронов внутри и снаружи сферы. Это два разных механизма окислительно-восстановительных реакций электронного переноса, в значительной степени определенных покойным Генри Таубе. В реакции внутренней сферы лиганд с двумя неподеленными электронными парами действует как мостиковый лиганд , лиганд, с которым могут связываться оба координационных центра.
 Благодаря этому электроны переносятся из одного центра в другой.
Благодаря этому электроны переносятся из одного центра в другой.
- (Вырожденный) обмен лигандов
- Одним из важных показателей реактивности является скорость вырожденного обмена лигандов. Например, скорость обмена координатной воды в комплексах [M (H 2 O) 6 ] n + варьируется более чем на 20 порядков. Комплексы, в которых лиганды высвобождаются и быстро восстанавливаются, классифицируются как лабильные. Такие лабильные комплексы могут быть термодинамически достаточно стабильными.Типичные лабильные комплексы металлов имеют либо низкий заряд (Na + ), электроны на d-орбиталях, которые разрываются по отношению к лигандам (Zn 2+ ), либо отсутствие ковалентности (Ln 3+ , где Ln — любое лантаноид). Лабильность металлического комплекса также зависит от конфигураций с высоким и низким спином, когда это возможно. Таким образом, высокоспиновые Fe (II) и Co (III) образуют лабильные комплексы, тогда как низкоспиновые аналоги инертны.
 Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
- Комплексы с незаполненными или наполовину заполненными орбиталями часто проявляют способность реагировать с субстратами. Большинство подложек имеют синглетное основное состояние, то есть у них есть неподеленные электронные пары (например, вода, амины, простые эфиры), поэтому этим подложкам нужна пустая орбиталь, чтобы иметь возможность реагировать с металлическим центром. Некоторые субстраты (например, молекулярный кислород!) Имеют триплетное основное состояние, что приводит к тому, что металлы с наполовину заполненными орбиталями имеют тенденцию реагировать с такими субстратами (следует сказать, что молекула дикислорода также имеет неподеленные пары, так что это также способен реагировать как «нормальная» база Льюиса).

Если лиганды вокруг металла тщательно выбраны, металл может способствовать (стехиометрическим или каталитическим) превращениям молекул или использоваться в качестве сенсора.
Именные комплексы
Базовый порядок наименования комплекса:
- При названии комплексного иона лиганды называют перед ионом металла.
- Напишите названия лигандов в алфавитном порядке. (Числовые префиксы не влияют на порядок.)
- Множественно встречающиеся монодентатные лиганды получают префикс в соответствии с числом вхождений: ди-, три-, тетра-, пента- или гекса .Полидентатные лиганды (например, этилендиамин, оксалат) получают бис-, трис-, тетракис- и т. Д.
- Анионы оканчиваются на или . Это заменяет последний ‘e’, когда анион заканчивается на ‘-ate’, например. сульфат становится сульфатом . Он заменяет ide: цианид становится циано .

- Нейтральным лигандам даны их обычные названия, за некоторыми исключениями: NH 3 становится аммином ; H 2 O становится aqua или aquo ; СО становится карбонил ; NO превращается в нитрозил .
- Напишите имя центрального атома / иона. Если комплекс представляет собой анион, имя центрального атома будет оканчиваться на -ate , и будет использоваться его латинское имя, если оно доступно (кроме ртути).
- Если необходимо указать степень окисления центрального атома (когда она является одной из нескольких возможных или нулем), запишите ее римской цифрой (или 0) в скобках.
- Назовите катион, затем анион отдельными словами (если применимо, как в последнем примере)
Примеры:
- [NiCl 4 ] 2− → ион тетрахлороникелата (II)
- [CuNH 3 Cl 5 ] 3− → ион амминпентахлоркупрат (II)
- [Cd (en) 2 (CN) 2 ] → дицианобис (этилендиамин) кадмий (II)
- [Co (NH 3 ) 5 Cl] SO 4 → сульфат пентаамминхлорокобальта (III)
Координационное число лигандов, присоединенных к более чем одному металлу (мостиковые лиганды), указывается нижним индексом к греческому перед названием лиганда ставится символ μ. Таким образом, димер трихлорида алюминия описывается формулой Al 2 Cl 4 (μ 2 -Cl) 2 .
Таким образом, димер трихлорида алюминия описывается формулой Al 2 Cl 4 (μ 2 -Cl) 2 .
См. Также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- De Vito, D., J. Weber, A.E. Merbach. 2005. Расчетный объем и энергетические профили для водообмена на т. 2 г 6 Гексаакваионы родия (III) и иридия (III): убедительные доказательства механизма I a , « Неорганическая химия .43: 858-863.
- Именование координационных соединений. Вашингтонский университет в Сент-Луисе. Проверено 8 ноября 2007 г. .
- Zumdahl, Steven S. 2005. Химические принципы . Нью-Йорк, Нью-Йорк: Хоутон Миффлин. ISBN 0618372067.
Внешние ссылки
Все ссылки получены 15 марта 2017 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Комплекс (химия) — Энциклопедия Нового Света
- Чтобы узнать о других значениях термина, см. Комплекс.
Синтез металлического комплекса медь (II) -тетрафенилпорфина из тетрафенилпорфина и моногидрата ацетата меди (II).
Комплекс в химии обычно используется для описания молекул или ансамблей, образованных комбинацией лигандов и ионов металлов. Первоначально химический комплекс подразумевал обратимую ассоциацию молекул, атомов или ионов через слабые химические связи.Применительно к координационной химии это значение было изменено.
Некоторые комплексы металлов образуются практически необратимо, и многие из них связаны довольно прочными связями.
История
Координационные комплексы были известны, хотя и не изучены в каком-либо смысле, с начала химии. Примеры включают берлинскую лазурь и медный купорос. Ключевой прорыв произошел, когда Альфред Вернер предположил, среди прочего , что Co (III) несет шесть лигандов в октаэдрической геометрии.Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аминов кобальта и объяснить многие из ранее необъяснимых изомеров. Он разделил первый координационный комплекс на оптические изомеры, опровергнув теорию о том, что хиральность обязательно связана с углеродными соединениями.
Металлокомплексы
Комплексы металлов, также известные как координационные соединения, включают все соединения металлов, за исключением паров металлов, плазмы и сплавов.Изучение «координационной химии» — это изучение «неорганической химии» всех щелочных и щелочноземельных металлов, переходных металлов, лантаноидов, актинидов и металлоидов. Таким образом, координационная химия — это химия большинства элементов таблицы Менделеева. Металлы и ионы металлов существуют только, по крайней мере, в конденсированных фазах, в окружении лигандов.
Ионы или молекулы, окружающие металл, называются лигандами. Лиганды обычно связаны с ионом металла координатной ковалентной связью (отдавая электроны из неподеленной электронной пары на пустую металлическую орбиталь), и, таким образом, говорят, что они координированы с ионом .Области координационной химии можно классифицировать в соответствии с природой лигандов, в общих чертах:
- Классический (или «комплексы Вернера»): лиганды в классической координационной химии связываются с металлами почти исключительно через свои «неподеленные пары» электронов, находящихся на атомах основной группы лиганда.
 Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en —
Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en —
- Примеры: [Co (EDTA)] — ], [Co (NH 3 ) 6 ] Cl 3 , [Fe (C 2 O 4 ) 3 ] K 3
- Металлоорганический химический состав: лиганды являются органическими (алкены, алкины, алкилы) в виде а также «органические» лиганды, такие как фосфины, гидрид и CO.
- Пример: (C 5 H 5 ) Fe (CO) 2 CH 3
- Биоинорганическая химия: лиганды образуются природой, особенно в том числе боковые цепи аминокислот, и многие кофакторы, такие как порфирины.
- Пример: гемоглобин
- Многие природные лиганды являются «классическими», особенно вода.
- Кластерная химия: лиганды представляют собой все вышеперечисленное, но также включают другие металлы в качестве лигандов.

- Пример Ru 3 (CO) 12
- В некоторых случаях возможны комбинации различных полей:
- Пример: [Fe 4 S 4 (Scysteinyl) 4 ] 2−, в котором кластер внедрен в биологически активный вид.
Минералогия, материаловедение и химия твердого тела — применительно к ионам металлов — являются подмножествами координационной химии в том смысле, что металлы окружены лигандами.Во многих случаях эти лиганды являются оксидами или сульфидами, но, тем не менее, металлы скоординированы, и применяются принципы и рекомендации, обсуждаемые ниже. Верно, что направление минералогии, материаловедения и химии твердого тела отличается от обычного направления координационной или неорганической химии. Первые в первую очередь связаны с полимерными структурами, свойствами, возникающими в результате коллективного воздействия многих сильно взаимосвязанных металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Строение координационных соединений
Геометрия
Структура в сложной химии начинается с акцента на «координационное число», количество лигандов, прикрепленных к металлу (более конкретно, количество связей σ-типа между лигандом (ами) и центральным атомом). Обычно можно подсчитать присоединенные лиганды, но иногда даже подсчет может быть неоднозначным. Координационные числа обычно составляют от двух до девяти, но большое количество лигандов не является редкостью. Количество связей зависит от размера, заряда и электронной конфигурации иона металла.Большинство ионов металлов могут иметь более одного координационного числа.
Обычно в химии комплексов доминируют взаимодействия между s- и p-молекулярными орбиталями лигандов и d (или f) -орбиталями ионов металлов. Орбитали s, p и d металла дают возможность разместить 18 электронов (см. Правило 18 электронов; для элементов f-блока это распространяется до 32 электронов). Таким образом, максимальное координационное число для определенного металла связано с электронной конфигурацией иона металла (точнее, с числом пустых орбиталей) и с соотношением размеров лигандов и иона металла.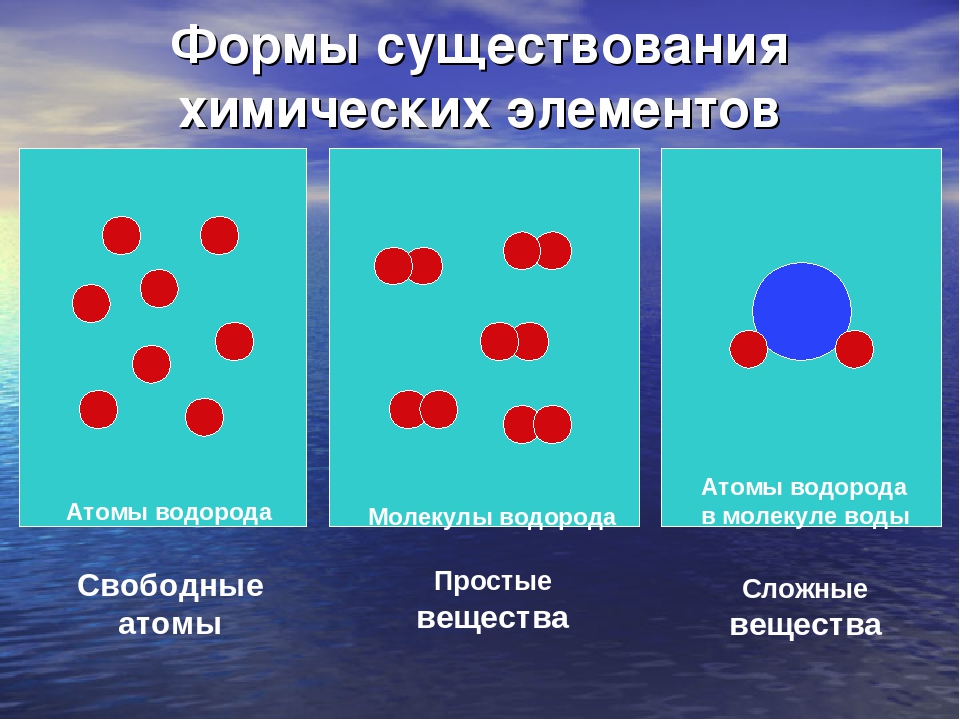 Большие металлы и маленькие лиганды приводят к высоким координационным числам, например [Mo (CN) 8 ] 4-. Мелкие металлы с большими лигандами приводят к низким координационным числам, например Pt [P (CMe 3 ] 2 . Из-за своего большого размера лантаноиды, актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Большие металлы и маленькие лиганды приводят к высоким координационным числам, например [Mo (CN) 8 ] 4-. Мелкие металлы с большими лигандами приводят к низким координационным числам, например Pt [P (CMe 3 ] 2 . Из-за своего большого размера лантаноиды, актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Различное структурное расположение лигандов обусловлено координационным числом. Большинство структур следуют шаблону точек на сфере (или, как если бы центральный атом находился в середине многогранника, где углы этой формы являются местоположениями лигандов), где орбитали перекрываются (между орбиталями лиганда и металла). ) и отталкивание лиганд-лиганд имеет тенденцию приводить к определенной регулярной геометрии.Наиболее наблюдаемые геометрии перечислены ниже, но есть много случаев, когда они отклоняются от обычной геометрии, например из-за использования лигандов разных типов (что приводит к неправильной длине связи; координационные атомы не следуют схеме точки на сфере), из-за размера лигандов или из-за электронных эффектов (см. , например, Jahn -Кассирское искажение):
, например, Jahn -Кассирское искажение):
- Линейная двухкоординатная,
- Тригональный планарный трехкоординатный,
- Тетраэдрический или квадратно-плоский для четырехкоординатного
- Тригонально-бипирамидальный или квадратно-пирамидальный для пятикоординатного типа,
- Октаэдрический (ортогональный) или тригонально-призматический для шестикоординированной,
- Пятиугольная бипирамидальная семикоординация,
- Квадратный антипризматический для восьмикоординатного типа и
- Трехглавая треугольная призма (трехгранная треугольная призма) для девяти координат.
Следует отметить некоторые исключения и положения:
- Идеализированные описания 5-, 7-, 8- и 9-координации часто геометрически неотличимы от альтернативных структур с немного разными углами L-M-L (лиганд-металл-лиганд). Классический пример этого — разница между квадратно-пирамидальными и тригонально-бипирамидальными структурами.
- Из-за специальных электронных эффектов, таких как (второго порядка) стабилизация Яна-Теллера, некоторые геометрические формы стабилизируются относительно других возможностей, например.г. для некоторых соединений тригонально-призматическая геометрия стабилизируется по сравнению с октаэдрическими структурами для шестикоординации.
Изомерия
Расположение лигандов фиксировано для данного комплекса, но в некоторых случаях оно может изменяться в результате реакции, в результате которой образуется другой стабильный изомер.
Существует много типов изомерии в координационных комплексах, как и во многих других соединениях.
Стереоизомерия
Стереоизомерия возникает с одними и теми же связями в разной ориентации относительно друг друга.Стереоизомерию можно разделить на:
Геометрическая изомерия
Геометрическая изомерия встречается в октаэдрических и квадратных плоских комплексах (но не в тетраэдрических). Когда два лиганда находятся напротив друг друга, они называются транс , когда они взаимно соседними, цис . Когда три идентичных лиганда занимают одну грань октаэдра, изомер называется лицевым, или fac . Если эти три лиганда копланарны, изомер называют меридиональным, или мер .Например, в октаэдрическом соединении с тремя из одного лиганда и тремя из другого существует два геометрических изомера: mer , в котором каждый набор из трех одинаковых лигандов находится в меридиане, и fac , в котором каждый набор из трех находится на грани октаэдра.
цис — [CoCl 2 (NH 3 ) 4 ] +
транс — [CoCl 2 (NH 3 ) 4 ] +
fac — [CoCl 3 (NH 3 ) 3 ]
мер — [CoCl 3 (NH 3 ) 3 ]
Оптическая изомерия
Оптическая изомерия возникает, когда зеркальное отображение соединения не совмещается с исходным соединением.Это так называется, потому что такие изомеры оптически активны, то есть они вращают плоскость поляризованного света. Символ Λ (дельта) используется в качестве префикса для описания поворота левого винта, образованного тремя бидентатными лигандами, как показано. Аналогично, символ Δ (лямбда) используется в качестве префикса для правостороннего поворота воздушного винта.
Λ- [Fe (ox) 3 ] 3−
Δ- [Fe (ox) 3 ] 3−
Λ- цис — [CoCl 2 (en) 2 ] +
Δ- цис — [CoCl 2 (en) 2 ] +
Структурная изомерия
Структурная изомерия возникает, когда связи сами по себе различны.Изомерия сцепления — это только один из нескольких типов структурной изомерии в координационных комплексах (как и в других классах химических соединений). Изомерия связывания возникает с амбидентатными лигандами, которые могут связываться более чем в одном месте. Например, NO 2 является амбидентатным лигандом: он может связываться с металлом либо по атому N, либо по атому O.
Старые классификации изомерии
Традиционные классификации видов изомеров стали архаичными с появлением современной структурной химии.В более древней литературе можно встретить:
- Ионизационная изомерия описывает возможные изомеры, возникающие в результате обмена между внешней и внутренней сферами. Эта классификация основана на архаичной классификации внутренней и внешней сферы. В этой классификации «лиганды внешней сферы», когда ионы в растворе, могут быть заменены «лигандами внутренней сферы» с образованием изомера.
- Изомерия сольвата возникает, когда лиганд внутренней сферы заменяется молекулой растворителя.Эта классификация устарела, поскольку она рассматривает растворители как отличные от других лигандов. Некоторые проблемы обсуждаются под кристаллизационной водой.
Электронное строение координационных соединений
Многие свойства комплексов металлов продиктованы их электронным строением. Электронную структуру можно описать с помощью относительно ионной модели, которая приписывает формальные заряды металлам и лигандам и не фокусируется на ковалентности. Этот подход составляет суть теории кристаллического поля (CFT).Теория кристаллического поля, представленная Гансом Бете в 1929 году, представляет собой квантово-механическую попытку понимания комплексов. Но теория кристаллического поля рассматривает все взаимодействия в комплексе как ионные и предполагает, что лиганды могут быть аппроксимированы отрицательными точечными зарядами.
Более сложные модели охватывают ковалентность, и этот подход описывается теорией поля Лиганда (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, представленная в 1935 году и основанная на теории молекулярных орбиталей, может работать с более широким кругом комплексов и может объяснять комплексы, в которых взаимодействия ковалентны.Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя простые, основанные на симметрии решения формальных уравнений.
Химики склонны использовать простейшую модель, необходимую для предсказания интересующих свойств; по этой причине CFT был фаворитом для обсуждений, когда это было возможно. Теории МО и НЧ сложнее, но дают более реалистичную перспективу.
Электронная конфигурация комплексов придает им некоторые важные свойства:
Цвет
Металлические комплексы часто имеют эффектную окраску.Эти цвета возникают из-за поглощения света, который возбуждает электроны на орбиталях металла или, в случае переноса заряда, возбуждает электроны с орбиталей на основе металла на орбитали на основе лиганда (или наоборот). Помощь для объяснения и интерпретации электронных возбуждений в наборе металлических орбиталей — это диаграммы Танабе-Сугано (для простых соединений с хорошо определенной геометрией) или использование вычислительной химии.
Магнетизм
Комплексы металлов, содержащие неспаренные электроны, обладают магнитными свойствами.Рассматривая только монометаллические комплексы, неспаренные электроны возникают из-за нечетного числа электронов в комплексе или из-за дестабилизации спаривания электронов. Таким образом, мономерные частицы Ti (III) имеют один «d-электрон» и должны быть (пара) магнитными, независимо от геометрии или природы лигандов. Ti (II) с двумя d-электронами образует некоторые комплексы, которые имеют два неспаренных электрона, а другие — ни одного. Этот эффект иллюстрируется соединениями TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P (CH 3 ) 2 ] 2 : когда X = Cl, комплекс является парамагнитным (высокоспиновая конфигурация), тогда как при X = CH 3 он диамагнитен (низкоспиновая конфигурация).Важно понимать, что лиганды предоставляют важные средства регулировки свойств основного состояния.
В би- и полиметаллических комплексах, в которых отдельные центры имеют нечетное число электронов или имеют высокий спин, ситуация более сложная. Если существует взаимодействие (прямое или через лиганд) между двумя (или более) металлическими центрами, электроны могут взаимодействовать (антиферромагнитное взаимодействие, приводящее к диамагнитному соединению), или они могут усиливать друг друга (ферромагнитное взаимодействие).Когда нет взаимодействия, два (или более) отдельных металлических центра ведут себя как две отдельные молекулы.
Реакционная способность
Комплексы обладают множеством возможных реактивностей:
- Обычной реакцией между координационными комплексами с участием лигандов является перенос электронов внутри и снаружи сферы. Это два разных механизма окислительно-восстановительных реакций электронного переноса, в значительной степени определенных покойным Генри Таубе. В реакции внутренней сферы лиганд с двумя неподеленными электронными парами действует как мостиковый лиганд , лиганд, с которым могут связываться оба координационных центра.Благодаря этому электроны переносятся из одного центра в другой.
- (Вырожденный) обмен лигандов
- Одним из важных показателей реактивности является скорость вырожденного обмена лигандов. Например, скорость обмена координатной воды в комплексах [M (H 2 O) 6 ] n + варьируется более чем на 20 порядков. Комплексы, в которых лиганды высвобождаются и быстро восстанавливаются, классифицируются как лабильные. Такие лабильные комплексы могут быть термодинамически достаточно стабильными.Типичные лабильные комплексы металлов имеют либо низкий заряд (Na + ), электроны на d-орбиталях, которые разрываются по отношению к лигандам (Zn 2+ ), либо отсутствие ковалентности (Ln 3+ , где Ln — любое лантаноид). Лабильность металлического комплекса также зависит от конфигураций с высоким и низким спином, когда это возможно. Таким образом, высокоспиновые Fe (II) и Co (III) образуют лабильные комплексы, тогда как низкоспиновые аналоги инертны. Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
- Комплексы с незаполненными или наполовину заполненными орбиталями часто проявляют способность реагировать с субстратами. Большинство подложек имеют синглетное основное состояние, то есть у них есть неподеленные электронные пары (например, вода, амины, простые эфиры), поэтому этим подложкам нужна пустая орбиталь, чтобы иметь возможность реагировать с металлическим центром. Некоторые субстраты (например, молекулярный кислород!) Имеют триплетное основное состояние, что приводит к тому, что металлы с наполовину заполненными орбиталями имеют тенденцию реагировать с такими субстратами (следует сказать, что молекула дикислорода также имеет неподеленные пары, так что это также способен реагировать как «нормальная» база Льюиса).
Если лиганды вокруг металла тщательно выбраны, металл может способствовать (стехиометрическим или каталитическим) превращениям молекул или использоваться в качестве сенсора.
Именные комплексы
Базовый порядок наименования комплекса:
- При названии комплексного иона лиганды называют перед ионом металла.
- Напишите названия лигандов в алфавитном порядке. (Числовые префиксы не влияют на порядок.)
- Множественно встречающиеся монодентатные лиганды получают префикс в соответствии с числом вхождений: ди-, три-, тетра-, пента- или гекса .Полидентатные лиганды (например, этилендиамин, оксалат) получают бис-, трис-, тетракис- и т. Д.
- Анионы оканчиваются на или . Это заменяет последний ‘e’, когда анион заканчивается на ‘-ate’, например. сульфат становится сульфатом . Он заменяет ide: цианид становится циано .
- Нейтральным лигандам даны их обычные названия, за некоторыми исключениями: NH 3 становится аммином ; H 2 O становится aqua или aquo ; СО становится карбонил ; NO превращается в нитрозил .
- Напишите имя центрального атома / иона. Если комплекс представляет собой анион, имя центрального атома будет оканчиваться на -ate , и будет использоваться его латинское имя, если оно доступно (кроме ртути).
- Если необходимо указать степень окисления центрального атома (когда она является одной из нескольких возможных или нулем), запишите ее римской цифрой (или 0) в скобках.
- Назовите катион, затем анион отдельными словами (если применимо, как в последнем примере)
Примеры:
- [NiCl 4 ] 2− → ион тетрахлороникелата (II)
- [CuNH 3 Cl 5 ] 3− → ион амминпентахлоркупрат (II)
- [Cd (en) 2 (CN) 2 ] → дицианобис (этилендиамин) кадмий (II)
- [Co (NH 3 ) 5 Cl] SO 4 → сульфат пентаамминхлорокобальта (III)
Координационное число лигандов, присоединенных к более чем одному металлу (мостиковые лиганды), указывается нижним индексом к греческому перед названием лиганда ставится символ μ.Таким образом, димер трихлорида алюминия описывается формулой Al 2 Cl 4 (μ 2 -Cl) 2 .
См. Также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- De Vito, D., J. Weber, A.E. Merbach. 2005. Расчетный объем и энергетические профили для водообмена на т. 2 г 6 Гексаакваионы родия (III) и иридия (III): убедительные доказательства механизма I a , « Неорганическая химия .43: 858-863.
- Именование координационных соединений. Вашингтонский университет в Сент-Луисе. Проверено 8 ноября 2007 г. .
- Zumdahl, Steven S. 2005. Химические принципы . Нью-Йорк, Нью-Йорк: Хоутон Миффлин. ISBN 0618372067.
Внешние ссылки
Все ссылки получены 15 марта 2017 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Комплекс (химия) — Энциклопедия Нового Света
- Чтобы узнать о других значениях термина, см. Комплекс.
Синтез металлического комплекса медь (II) -тетрафенилпорфина из тетрафенилпорфина и моногидрата ацетата меди (II).
Комплекс в химии обычно используется для описания молекул или ансамблей, образованных комбинацией лигандов и ионов металлов. Первоначально химический комплекс подразумевал обратимую ассоциацию молекул, атомов или ионов через слабые химические связи.Применительно к координационной химии это значение было изменено.
Некоторые комплексы металлов образуются практически необратимо, и многие из них связаны довольно прочными связями.
История
Координационные комплексы были известны, хотя и не изучены в каком-либо смысле, с начала химии. Примеры включают берлинскую лазурь и медный купорос. Ключевой прорыв произошел, когда Альфред Вернер предположил, среди прочего , что Co (III) несет шесть лигандов в октаэдрической геометрии.Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аминов кобальта и объяснить многие из ранее необъяснимых изомеров. Он разделил первый координационный комплекс на оптические изомеры, опровергнув теорию о том, что хиральность обязательно связана с углеродными соединениями.
Металлокомплексы
Комплексы металлов, также известные как координационные соединения, включают все соединения металлов, за исключением паров металлов, плазмы и сплавов.Изучение «координационной химии» — это изучение «неорганической химии» всех щелочных и щелочноземельных металлов, переходных металлов, лантаноидов, актинидов и металлоидов. Таким образом, координационная химия — это химия большинства элементов таблицы Менделеева. Металлы и ионы металлов существуют только, по крайней мере, в конденсированных фазах, в окружении лигандов.
Ионы или молекулы, окружающие металл, называются лигандами. Лиганды обычно связаны с ионом металла координатной ковалентной связью (отдавая электроны из неподеленной электронной пары на пустую металлическую орбиталь), и, таким образом, говорят, что они координированы с ионом .Области координационной химии можно классифицировать в соответствии с природой лигандов, в общих чертах:
- Классический (или «комплексы Вернера»): лиганды в классической координационной химии связываются с металлами почти исключительно через свои «неподеленные пары» электронов, находящихся на атомах основной группы лиганда. Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en —
- Примеры: [Co (EDTA)] — ], [Co (NH 3 ) 6 ] Cl 3 , [Fe (C 2 O 4 ) 3 ] K 3
- Металлоорганический химический состав: лиганды являются органическими (алкены, алкины, алкилы) в виде а также «органические» лиганды, такие как фосфины, гидрид и CO.
- Пример: (C 5 H 5 ) Fe (CO) 2 CH 3
- Биоинорганическая химия: лиганды образуются природой, особенно в том числе боковые цепи аминокислот, и многие кофакторы, такие как порфирины.
- Пример: гемоглобин
- Многие природные лиганды являются «классическими», особенно вода.
- Кластерная химия: лиганды представляют собой все вышеперечисленное, но также включают другие металлы в качестве лигандов.
- Пример Ru 3 (CO) 12
- В некоторых случаях возможны комбинации различных полей:
- Пример: [Fe 4 S 4 (Scysteinyl) 4 ] 2−, в котором кластер внедрен в биологически активный вид.
Минералогия, материаловедение и химия твердого тела — применительно к ионам металлов — являются подмножествами координационной химии в том смысле, что металлы окружены лигандами.Во многих случаях эти лиганды являются оксидами или сульфидами, но, тем не менее, металлы скоординированы, и применяются принципы и рекомендации, обсуждаемые ниже. Верно, что направление минералогии, материаловедения и химии твердого тела отличается от обычного направления координационной или неорганической химии. Первые в первую очередь связаны с полимерными структурами, свойствами, возникающими в результате коллективного воздействия многих сильно взаимосвязанных металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Строение координационных соединений
Геометрия
Структура в сложной химии начинается с акцента на «координационное число», количество лигандов, прикрепленных к металлу (более конкретно, количество связей σ-типа между лигандом (ами) и центральным атомом). Обычно можно подсчитать присоединенные лиганды, но иногда даже подсчет может быть неоднозначным. Координационные числа обычно составляют от двух до девяти, но большое количество лигандов не является редкостью. Количество связей зависит от размера, заряда и электронной конфигурации иона металла.Большинство ионов металлов могут иметь более одного координационного числа.
Обычно в химии комплексов доминируют взаимодействия между s- и p-молекулярными орбиталями лигандов и d (или f) -орбиталями ионов металлов. Орбитали s, p и d металла дают возможность разместить 18 электронов (см. Правило 18 электронов; для элементов f-блока это распространяется до 32 электронов). Таким образом, максимальное координационное число для определенного металла связано с электронной конфигурацией иона металла (точнее, с числом пустых орбиталей) и с соотношением размеров лигандов и иона металла.Большие металлы и маленькие лиганды приводят к высоким координационным числам, например [Mo (CN) 8 ] 4-. Мелкие металлы с большими лигандами приводят к низким координационным числам, например Pt [P (CMe 3 ] 2 . Из-за своего большого размера лантаноиды, актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Различное структурное расположение лигандов обусловлено координационным числом. Большинство структур следуют шаблону точек на сфере (или, как если бы центральный атом находился в середине многогранника, где углы этой формы являются местоположениями лигандов), где орбитали перекрываются (между орбиталями лиганда и металла). ) и отталкивание лиганд-лиганд имеет тенденцию приводить к определенной регулярной геометрии.Наиболее наблюдаемые геометрии перечислены ниже, но есть много случаев, когда они отклоняются от обычной геометрии, например из-за использования лигандов разных типов (что приводит к неправильной длине связи; координационные атомы не следуют схеме точки на сфере), из-за размера лигандов или из-за электронных эффектов (см., например, Jahn -Кассирское искажение):
- Линейная двухкоординатная,
- Тригональный планарный трехкоординатный,
- Тетраэдрический или квадратно-плоский для четырехкоординатного
- Тригонально-бипирамидальный или квадратно-пирамидальный для пятикоординатного типа,
- Октаэдрический (ортогональный) или тригонально-призматический для шестикоординированной,
- Пятиугольная бипирамидальная семикоординация,
- Квадратный антипризматический для восьмикоординатного типа и
- Трехглавая треугольная призма (трехгранная треугольная призма) для девяти координат.
Следует отметить некоторые исключения и положения:
- Идеализированные описания 5-, 7-, 8- и 9-координации часто геометрически неотличимы от альтернативных структур с немного разными углами L-M-L (лиганд-металл-лиганд). Классический пример этого — разница между квадратно-пирамидальными и тригонально-бипирамидальными структурами.
- Из-за специальных электронных эффектов, таких как (второго порядка) стабилизация Яна-Теллера, некоторые геометрические формы стабилизируются относительно других возможностей, например.г. для некоторых соединений тригонально-призматическая геометрия стабилизируется по сравнению с октаэдрическими структурами для шестикоординации.
Изомерия
Расположение лигандов фиксировано для данного комплекса, но в некоторых случаях оно может изменяться в результате реакции, в результате которой образуется другой стабильный изомер.
Существует много типов изомерии в координационных комплексах, как и во многих других соединениях.
Стереоизомерия
Стереоизомерия возникает с одними и теми же связями в разной ориентации относительно друг друга.Стереоизомерию можно разделить на:
Геометрическая изомерия
Геометрическая изомерия встречается в октаэдрических и квадратных плоских комплексах (но не в тетраэдрических). Когда два лиганда находятся напротив друг друга, они называются транс , когда они взаимно соседними, цис . Когда три идентичных лиганда занимают одну грань октаэдра, изомер называется лицевым, или fac . Если эти три лиганда копланарны, изомер называют меридиональным, или мер .Например, в октаэдрическом соединении с тремя из одного лиганда и тремя из другого существует два геометрических изомера: mer , в котором каждый набор из трех одинаковых лигандов находится в меридиане, и fac , в котором каждый набор из трех находится на грани октаэдра.
цис — [CoCl 2 (NH 3 ) 4 ] +
транс — [CoCl 2 (NH 3 ) 4 ] +
fac — [CoCl 3 (NH 3 ) 3 ]
мер — [CoCl 3 (NH 3 ) 3 ]
Оптическая изомерия
Оптическая изомерия возникает, когда зеркальное отображение соединения не совмещается с исходным соединением.Это так называется, потому что такие изомеры оптически активны, то есть они вращают плоскость поляризованного света. Символ Λ (дельта) используется в качестве префикса для описания поворота левого винта, образованного тремя бидентатными лигандами, как показано. Аналогично, символ Δ (лямбда) используется в качестве префикса для правостороннего поворота воздушного винта.
Λ- [Fe (ox) 3 ] 3−
Δ- [Fe (ox) 3 ] 3−
Λ- цис — [CoCl 2 (en) 2 ] +
Δ- цис — [CoCl 2 (en) 2 ] +
Структурная изомерия
Структурная изомерия возникает, когда связи сами по себе различны.Изомерия сцепления — это только один из нескольких типов структурной изомерии в координационных комплексах (как и в других классах химических соединений). Изомерия связывания возникает с амбидентатными лигандами, которые могут связываться более чем в одном месте. Например, NO 2 является амбидентатным лигандом: он может связываться с металлом либо по атому N, либо по атому O.
Старые классификации изомерии
Традиционные классификации видов изомеров стали архаичными с появлением современной структурной химии.В более древней литературе можно встретить:
- Ионизационная изомерия описывает возможные изомеры, возникающие в результате обмена между внешней и внутренней сферами. Эта классификация основана на архаичной классификации внутренней и внешней сферы. В этой классификации «лиганды внешней сферы», когда ионы в растворе, могут быть заменены «лигандами внутренней сферы» с образованием изомера.
- Изомерия сольвата возникает, когда лиганд внутренней сферы заменяется молекулой растворителя.Эта классификация устарела, поскольку она рассматривает растворители как отличные от других лигандов. Некоторые проблемы обсуждаются под кристаллизационной водой.
Электронное строение координационных соединений
Многие свойства комплексов металлов продиктованы их электронным строением. Электронную структуру можно описать с помощью относительно ионной модели, которая приписывает формальные заряды металлам и лигандам и не фокусируется на ковалентности. Этот подход составляет суть теории кристаллического поля (CFT).Теория кристаллического поля, представленная Гансом Бете в 1929 году, представляет собой квантово-механическую попытку понимания комплексов. Но теория кристаллического поля рассматривает все взаимодействия в комплексе как ионные и предполагает, что лиганды могут быть аппроксимированы отрицательными точечными зарядами.
Более сложные модели охватывают ковалентность, и этот подход описывается теорией поля Лиганда (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, представленная в 1935 году и основанная на теории молекулярных орбиталей, может работать с более широким кругом комплексов и может объяснять комплексы, в которых взаимодействия ковалентны.Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя простые, основанные на симметрии решения формальных уравнений.
Химики склонны использовать простейшую модель, необходимую для предсказания интересующих свойств; по этой причине CFT был фаворитом для обсуждений, когда это было возможно. Теории МО и НЧ сложнее, но дают более реалистичную перспективу.
Электронная конфигурация комплексов придает им некоторые важные свойства:
Цвет
Металлические комплексы часто имеют эффектную окраску.Эти цвета возникают из-за поглощения света, который возбуждает электроны на орбиталях металла или, в случае переноса заряда, возбуждает электроны с орбиталей на основе металла на орбитали на основе лиганда (или наоборот). Помощь для объяснения и интерпретации электронных возбуждений в наборе металлических орбиталей — это диаграммы Танабе-Сугано (для простых соединений с хорошо определенной геометрией) или использование вычислительной химии.
Магнетизм
Комплексы металлов, содержащие неспаренные электроны, обладают магнитными свойствами.Рассматривая только монометаллические комплексы, неспаренные электроны возникают из-за нечетного числа электронов в комплексе или из-за дестабилизации спаривания электронов. Таким образом, мономерные частицы Ti (III) имеют один «d-электрон» и должны быть (пара) магнитными, независимо от геометрии или природы лигандов. Ti (II) с двумя d-электронами образует некоторые комплексы, которые имеют два неспаренных электрона, а другие — ни одного. Этот эффект иллюстрируется соединениями TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P (CH 3 ) 2 ] 2 : когда X = Cl, комплекс является парамагнитным (высокоспиновая конфигурация), тогда как при X = CH 3 он диамагнитен (низкоспиновая конфигурация).Важно понимать, что лиганды предоставляют важные средства регулировки свойств основного состояния.
В би- и полиметаллических комплексах, в которых отдельные центры имеют нечетное число электронов или имеют высокий спин, ситуация более сложная. Если существует взаимодействие (прямое или через лиганд) между двумя (или более) металлическими центрами, электроны могут взаимодействовать (антиферромагнитное взаимодействие, приводящее к диамагнитному соединению), или они могут усиливать друг друга (ферромагнитное взаимодействие).Когда нет взаимодействия, два (или более) отдельных металлических центра ведут себя как две отдельные молекулы.
Реакционная способность
Комплексы обладают множеством возможных реактивностей:
- Обычной реакцией между координационными комплексами с участием лигандов является перенос электронов внутри и снаружи сферы. Это два разных механизма окислительно-восстановительных реакций электронного переноса, в значительной степени определенных покойным Генри Таубе. В реакции внутренней сферы лиганд с двумя неподеленными электронными парами действует как мостиковый лиганд , лиганд, с которым могут связываться оба координационных центра.Благодаря этому электроны переносятся из одного центра в другой.
- (Вырожденный) обмен лигандов
- Одним из важных показателей реактивности является скорость вырожденного обмена лигандов. Например, скорость обмена координатной воды в комплексах [M (H 2 O) 6 ] n + варьируется более чем на 20 порядков. Комплексы, в которых лиганды высвобождаются и быстро восстанавливаются, классифицируются как лабильные. Такие лабильные комплексы могут быть термодинамически достаточно стабильными.Типичные лабильные комплексы металлов имеют либо низкий заряд (Na + ), электроны на d-орбиталях, которые разрываются по отношению к лигандам (Zn 2+ ), либо отсутствие ковалентности (Ln 3+ , где Ln — любое лантаноид). Лабильность металлического комплекса также зависит от конфигураций с высоким и низким спином, когда это возможно. Таким образом, высокоспиновые Fe (II) и Co (III) образуют лабильные комплексы, тогда как низкоспиновые аналоги инертны. Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
- Комплексы с незаполненными или наполовину заполненными орбиталями часто проявляют способность реагировать с субстратами. Большинство подложек имеют синглетное основное состояние, то есть у них есть неподеленные электронные пары (например, вода, амины, простые эфиры), поэтому этим подложкам нужна пустая орбиталь, чтобы иметь возможность реагировать с металлическим центром. Некоторые субстраты (например, молекулярный кислород!) Имеют триплетное основное состояние, что приводит к тому, что металлы с наполовину заполненными орбиталями имеют тенденцию реагировать с такими субстратами (следует сказать, что молекула дикислорода также имеет неподеленные пары, так что это также способен реагировать как «нормальная» база Льюиса).
Если лиганды вокруг металла тщательно выбраны, металл может способствовать (стехиометрическим или каталитическим) превращениям молекул или использоваться в качестве сенсора.
Именные комплексы
Базовый порядок наименования комплекса:
- При названии комплексного иона лиганды называют перед ионом металла.
- Напишите названия лигандов в алфавитном порядке. (Числовые префиксы не влияют на порядок.)
- Множественно встречающиеся монодентатные лиганды получают префикс в соответствии с числом вхождений: ди-, три-, тетра-, пента- или гекса .Полидентатные лиганды (например, этилендиамин, оксалат) получают бис-, трис-, тетракис- и т. Д.
- Анионы оканчиваются на или . Это заменяет последний ‘e’, когда анион заканчивается на ‘-ate’, например. сульфат становится сульфатом . Он заменяет ide: цианид становится циано .
- Нейтральным лигандам даны их обычные названия, за некоторыми исключениями: NH 3 становится аммином ; H 2 O становится aqua или aquo ; СО становится карбонил ; NO превращается в нитрозил .
- Напишите имя центрального атома / иона. Если комплекс представляет собой анион, имя центрального атома будет оканчиваться на -ate , и будет использоваться его латинское имя, если оно доступно (кроме ртути).
- Если необходимо указать степень окисления центрального атома (когда она является одной из нескольких возможных или нулем), запишите ее римской цифрой (или 0) в скобках.
- Назовите катион, затем анион отдельными словами (если применимо, как в последнем примере)
Примеры:
- [NiCl 4 ] 2− → ион тетрахлороникелата (II)
- [CuNH 3 Cl 5 ] 3− → ион амминпентахлоркупрат (II)
- [Cd (en) 2 (CN) 2 ] → дицианобис (этилендиамин) кадмий (II)
- [Co (NH 3 ) 5 Cl] SO 4 → сульфат пентаамминхлорокобальта (III)
Координационное число лигандов, присоединенных к более чем одному металлу (мостиковые лиганды), указывается нижним индексом к греческому перед названием лиганда ставится символ μ.Таким образом, димер трихлорида алюминия описывается формулой Al 2 Cl 4 (μ 2 -Cl) 2 .
См. Также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- De Vito, D., J. Weber, A.E. Merbach. 2005. Расчетный объем и энергетические профили для водообмена на т. 2 г 6 Гексаакваионы родия (III) и иридия (III): убедительные доказательства механизма I a , « Неорганическая химия .43: 858-863.
- Именование координационных соединений. Вашингтонский университет в Сент-Луисе. Проверено 8 ноября 2007 г. .
- Zumdahl, Steven S. 2005. Химические принципы . Нью-Йорк, Нью-Йорк: Хоутон Миффлин. ISBN 0618372067.
Внешние ссылки
Все ссылки получены 15 марта 2017 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Комплекс (химия) — Энциклопедия Нового Света
- Чтобы узнать о других значениях термина, см. Комплекс.
Синтез металлического комплекса медь (II) -тетрафенилпорфина из тетрафенилпорфина и моногидрата ацетата меди (II).
Комплекс в химии обычно используется для описания молекул или ансамблей, образованных комбинацией лигандов и ионов металлов. Первоначально химический комплекс подразумевал обратимую ассоциацию молекул, атомов или ионов через слабые химические связи.Применительно к координационной химии это значение было изменено.
Некоторые комплексы металлов образуются практически необратимо, и многие из них связаны довольно прочными связями.
История
Координационные комплексы были известны, хотя и не изучены в каком-либо смысле, с начала химии. Примеры включают берлинскую лазурь и медный купорос. Ключевой прорыв произошел, когда Альфред Вернер предположил, среди прочего , что Co (III) несет шесть лигандов в октаэдрической геометрии.Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аминов кобальта и объяснить многие из ранее необъяснимых изомеров. Он разделил первый координационный комплекс на оптические изомеры, опровергнув теорию о том, что хиральность обязательно связана с углеродными соединениями.
Металлокомплексы
Комплексы металлов, также известные как координационные соединения, включают все соединения металлов, за исключением паров металлов, плазмы и сплавов.Изучение «координационной химии» — это изучение «неорганической химии» всех щелочных и щелочноземельных металлов, переходных металлов, лантаноидов, актинидов и металлоидов. Таким образом, координационная химия — это химия большинства элементов таблицы Менделеева. Металлы и ионы металлов существуют только, по крайней мере, в конденсированных фазах, в окружении лигандов.
Ионы или молекулы, окружающие металл, называются лигандами. Лиганды обычно связаны с ионом металла координатной ковалентной связью (отдавая электроны из неподеленной электронной пары на пустую металлическую орбиталь), и, таким образом, говорят, что они координированы с ионом .Области координационной химии можно классифицировать в соответствии с природой лигандов, в общих чертах:
- Классический (или «комплексы Вернера»): лиганды в классической координационной химии связываются с металлами почти исключительно через свои «неподеленные пары» электронов, находящихся на атомах основной группы лиганда. Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en —
- Примеры: [Co (EDTA)] — ], [Co (NH 3 ) 6 ] Cl 3 , [Fe (C 2 O 4 ) 3 ] K 3
- Металлоорганический химический состав: лиганды являются органическими (алкены, алкины, алкилы) в виде а также «органические» лиганды, такие как фосфины, гидрид и CO.
- Пример: (C 5 H 5 ) Fe (CO) 2 CH 3
- Биоинорганическая химия: лиганды образуются природой, особенно в том числе боковые цепи аминокислот, и многие кофакторы, такие как порфирины.
- Пример: гемоглобин
- Многие природные лиганды являются «классическими», особенно вода.
- Кластерная химия: лиганды представляют собой все вышеперечисленное, но также включают другие металлы в качестве лигандов.
- Пример Ru 3 (CO) 12
- В некоторых случаях возможны комбинации различных полей:
- Пример: [Fe 4 S 4 (Scysteinyl) 4 ] 2−, в котором кластер внедрен в биологически активный вид.
Минералогия, материаловедение и химия твердого тела — применительно к ионам металлов — являются подмножествами координационной химии в том смысле, что металлы окружены лигандами.Во многих случаях эти лиганды являются оксидами или сульфидами, но, тем не менее, металлы скоординированы, и применяются принципы и рекомендации, обсуждаемые ниже. Верно, что направление минералогии, материаловедения и химии твердого тела отличается от обычного направления координационной или неорганической химии. Первые в первую очередь связаны с полимерными структурами, свойствами, возникающими в результате коллективного воздействия многих сильно взаимосвязанных металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Строение координационных соединений
Геометрия
Структура в сложной химии начинается с акцента на «координационное число», количество лигандов, прикрепленных к металлу (более конкретно, количество связей σ-типа между лигандом (ами) и центральным атомом). Обычно можно подсчитать присоединенные лиганды, но иногда даже подсчет может быть неоднозначным. Координационные числа обычно составляют от двух до девяти, но большое количество лигандов не является редкостью. Количество связей зависит от размера, заряда и электронной конфигурации иона металла.Большинство ионов металлов могут иметь более одного координационного числа.
Обычно в химии комплексов доминируют взаимодействия между s- и p-молекулярными орбиталями лигандов и d (или f) -орбиталями ионов металлов. Орбитали s, p и d металла дают возможность разместить 18 электронов (см. Правило 18 электронов; для элементов f-блока это распространяется до 32 электронов). Таким образом, максимальное координационное число для определенного металла связано с электронной конфигурацией иона металла (точнее, с числом пустых орбиталей) и с соотношением размеров лигандов и иона металла.Большие металлы и маленькие лиганды приводят к высоким координационным числам, например [Mo (CN) 8 ] 4-. Мелкие металлы с большими лигандами приводят к низким координационным числам, например Pt [P (CMe 3 ] 2 . Из-за своего большого размера лантаноиды, актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Различное структурное расположение лигандов обусловлено координационным числом. Большинство структур следуют шаблону точек на сфере (или, как если бы центральный атом находился в середине многогранника, где углы этой формы являются местоположениями лигандов), где орбитали перекрываются (между орбиталями лиганда и металла). ) и отталкивание лиганд-лиганд имеет тенденцию приводить к определенной регулярной геометрии.Наиболее наблюдаемые геометрии перечислены ниже, но есть много случаев, когда они отклоняются от обычной геометрии, например из-за использования лигандов разных типов (что приводит к неправильной длине связи; координационные атомы не следуют схеме точки на сфере), из-за размера лигандов или из-за электронных эффектов (см., например, Jahn -Кассирское искажение):
- Линейная двухкоординатная,
- Тригональный планарный трехкоординатный,
- Тетраэдрический или квадратно-плоский для четырехкоординатного
- Тригонально-бипирамидальный или квадратно-пирамидальный для пятикоординатного типа,
- Октаэдрический (ортогональный) или тригонально-призматический для шестикоординированной,
- Пятиугольная бипирамидальная семикоординация,
- Квадратный антипризматический для восьмикоординатного типа и
- Трехглавая треугольная призма (трехгранная треугольная призма) для девяти координат.
Следует отметить некоторые исключения и положения:
- Идеализированные описания 5-, 7-, 8- и 9-координации часто геометрически неотличимы от альтернативных структур с немного разными углами L-M-L (лиганд-металл-лиганд). Классический пример этого — разница между квадратно-пирамидальными и тригонально-бипирамидальными структурами.
- Из-за специальных электронных эффектов, таких как (второго порядка) стабилизация Яна-Теллера, некоторые геометрические формы стабилизируются относительно других возможностей, например.г. для некоторых соединений тригонально-призматическая геометрия стабилизируется по сравнению с октаэдрическими структурами для шестикоординации.
Изомерия
Расположение лигандов фиксировано для данного комплекса, но в некоторых случаях оно может изменяться в результате реакции, в результате которой образуется другой стабильный изомер.
Существует много типов изомерии в координационных комплексах, как и во многих других соединениях.
Стереоизомерия
Стереоизомерия возникает с одними и теми же связями в разной ориентации относительно друг друга.Стереоизомерию можно разделить на:
Геометрическая изомерия
Геометрическая изомерия встречается в октаэдрических и квадратных плоских комплексах (но не в тетраэдрических). Когда два лиганда находятся напротив друг друга, они называются транс , когда они взаимно соседними, цис . Когда три идентичных лиганда занимают одну грань октаэдра, изомер называется лицевым, или fac . Если эти три лиганда копланарны, изомер называют меридиональным, или мер .Например, в октаэдрическом соединении с тремя из одного лиганда и тремя из другого существует два геометрических изомера: mer , в котором каждый набор из трех одинаковых лигандов находится в меридиане, и fac , в котором каждый набор из трех находится на грани октаэдра.
цис — [CoCl 2 (NH 3 ) 4 ] +
транс — [CoCl 2 (NH 3 ) 4 ] +
fac — [CoCl 3 (NH 3 ) 3 ]
мер — [CoCl 3 (NH 3 ) 3 ]
Оптическая изомерия
Оптическая изомерия возникает, когда зеркальное отображение соединения не совмещается с исходным соединением.Это так называется, потому что такие изомеры оптически активны, то есть они вращают плоскость поляризованного света. Символ Λ (дельта) используется в качестве префикса для описания поворота левого винта, образованного тремя бидентатными лигандами, как показано. Аналогично, символ Δ (лямбда) используется в качестве префикса для правостороннего поворота воздушного винта.
Λ- [Fe (ox) 3 ] 3−
Δ- [Fe (ox) 3 ] 3−
Λ- цис — [CoCl 2 (en) 2 ] +
Δ- цис — [CoCl 2 (en) 2 ] +
Структурная изомерия
Структурная изомерия возникает, когда связи сами по себе различны.Изомерия сцепления — это только один из нескольких типов структурной изомерии в координационных комплексах (как и в других классах химических соединений). Изомерия связывания возникает с амбидентатными лигандами, которые могут связываться более чем в одном месте. Например, NO 2 является амбидентатным лигандом: он может связываться с металлом либо по атому N, либо по атому O.
Старые классификации изомерии
Традиционные классификации видов изомеров стали архаичными с появлением современной структурной химии.В более древней литературе можно встретить:
- Ионизационная изомерия описывает возможные изомеры, возникающие в результате обмена между внешней и внутренней сферами. Эта классификация основана на архаичной классификации внутренней и внешней сферы. В этой классификации «лиганды внешней сферы», когда ионы в растворе, могут быть заменены «лигандами внутренней сферы» с образованием изомера.
- Изомерия сольвата возникает, когда лиганд внутренней сферы заменяется молекулой растворителя.Эта классификация устарела, поскольку она рассматривает растворители как отличные от других лигандов. Некоторые проблемы обсуждаются под кристаллизационной водой.
Электронное строение координационных соединений
Многие свойства комплексов металлов продиктованы их электронным строением. Электронную структуру можно описать с помощью относительно ионной модели, которая приписывает формальные заряды металлам и лигандам и не фокусируется на ковалентности. Этот подход составляет суть теории кристаллического поля (CFT).Теория кристаллического поля, представленная Гансом Бете в 1929 году, представляет собой квантово-механическую попытку понимания комплексов. Но теория кристаллического поля рассматривает все взаимодействия в комплексе как ионные и предполагает, что лиганды могут быть аппроксимированы отрицательными точечными зарядами.
Более сложные модели охватывают ковалентность, и этот подход описывается теорией поля Лиганда (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, представленная в 1935 году и основанная на теории молекулярных орбиталей, может работать с более широким кругом комплексов и может объяснять комплексы, в которых взаимодействия ковалентны.Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя простые, основанные на симметрии решения формальных уравнений.
Химики склонны использовать простейшую модель, необходимую для предсказания интересующих свойств; по этой причине CFT был фаворитом для обсуждений, когда это было возможно. Теории МО и НЧ сложнее, но дают более реалистичную перспективу.
Электронная конфигурация комплексов придает им некоторые важные свойства:
Цвет
Металлические комплексы часто имеют эффектную окраску.Эти цвета возникают из-за поглощения света, который возбуждает электроны на орбиталях металла или, в случае переноса заряда, возбуждает электроны с орбиталей на основе металла на орбитали на основе лиганда (или наоборот). Помощь для объяснения и интерпретации электронных возбуждений в наборе металлических орбиталей — это диаграммы Танабе-Сугано (для простых соединений с хорошо определенной геометрией) или использование вычислительной химии.
Магнетизм
Комплексы металлов, содержащие неспаренные электроны, обладают магнитными свойствами.Рассматривая только монометаллические комплексы, неспаренные электроны возникают из-за нечетного числа электронов в комплексе или из-за дестабилизации спаривания электронов. Таким образом, мономерные частицы Ti (III) имеют один «d-электрон» и должны быть (пара) магнитными, независимо от геометрии или природы лигандов. Ti (II) с двумя d-электронами образует некоторые комплексы, которые имеют два неспаренных электрона, а другие — ни одного. Этот эффект иллюстрируется соединениями TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P (CH 3 ) 2 ] 2 : когда X = Cl, комплекс является парамагнитным (высокоспиновая конфигурация), тогда как при X = CH 3 он диамагнитен (низкоспиновая конфигурация).Важно понимать, что лиганды предоставляют важные средства регулировки свойств основного состояния.
В би- и полиметаллических комплексах, в которых отдельные центры имеют нечетное число электронов или имеют высокий спин, ситуация более сложная. Если существует взаимодействие (прямое или через лиганд) между двумя (или более) металлическими центрами, электроны могут взаимодействовать (антиферромагнитное взаимодействие, приводящее к диамагнитному соединению), или они могут усиливать друг друга (ферромагнитное взаимодействие).Когда нет взаимодействия, два (или более) отдельных металлических центра ведут себя как две отдельные молекулы.
Реакционная способность
Комплексы обладают множеством возможных реактивностей:
- Обычной реакцией между координационными комплексами с участием лигандов является перенос электронов внутри и снаружи сферы. Это два разных механизма окислительно-восстановительных реакций электронного переноса, в значительной степени определенных покойным Генри Таубе. В реакции внутренней сферы лиганд с двумя неподеленными электронными парами действует как мостиковый лиганд , лиганд, с которым могут связываться оба координационных центра.Благодаря этому электроны переносятся из одного центра в другой.
- (Вырожденный) обмен лигандов
- Одним из важных показателей реактивности является скорость вырожденного обмена лигандов. Например, скорость обмена координатной воды в комплексах [M (H 2 O) 6 ] n + варьируется более чем на 20 порядков. Комплексы, в которых лиганды высвобождаются и быстро восстанавливаются, классифицируются как лабильные. Такие лабильные комплексы могут быть термодинамически достаточно стабильными.Типичные лабильные комплексы металлов имеют либо низкий заряд (Na + ), электроны на d-орбиталях, которые разрываются по отношению к лигандам (Zn 2+ ), либо отсутствие ковалентности (Ln 3+ , где Ln — любое лантаноид). Лабильность металлического комплекса также зависит от конфигураций с высоким и низким спином, когда это возможно. Таким образом, высокоспиновые Fe (II) и Co (III) образуют лабильные комплексы, тогда как низкоспиновые аналоги инертны. Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
- Комплексы с незаполненными или наполовину заполненными орбиталями часто проявляют способность реагировать с субстратами. Большинство подложек имеют синглетное основное состояние, то есть у них есть неподеленные электронные пары (например, вода, амины, простые эфиры), поэтому этим подложкам нужна пустая орбиталь, чтобы иметь возможность реагировать с металлическим центром. Некоторые субстраты (например, молекулярный кислород!) Имеют триплетное основное состояние, что приводит к тому, что металлы с наполовину заполненными орбиталями имеют тенденцию реагировать с такими субстратами (следует сказать, что молекула дикислорода также имеет неподеленные пары, так что это также способен реагировать как «нормальная» база Льюиса).
Если лиганды вокруг металла тщательно выбраны, металл может способствовать (стехиометрическим или каталитическим) превращениям молекул или использоваться в качестве сенсора.
Именные комплексы
Базовый порядок наименования комплекса:
- При названии комплексного иона лиганды называют перед ионом металла.
- Напишите названия лигандов в алфавитном порядке. (Числовые префиксы не влияют на порядок.)
- Множественно встречающиеся монодентатные лиганды получают префикс в соответствии с числом вхождений: ди-, три-, тетра-, пента- или гекса .Полидентатные лиганды (например, этилендиамин, оксалат) получают бис-, трис-, тетракис- и т. Д.
- Анионы оканчиваются на или . Это заменяет последний ‘e’, когда анион заканчивается на ‘-ate’, например. сульфат становится сульфатом . Он заменяет ide: цианид становится циано .
- Нейтральным лигандам даны их обычные названия, за некоторыми исключениями: NH 3 становится аммином ; H 2 O становится aqua или aquo ; СО становится карбонил ; NO превращается в нитрозил .
- Напишите имя центрального атома / иона. Если комплекс представляет собой анион, имя центрального атома будет оканчиваться на -ate , и будет использоваться его латинское имя, если оно доступно (кроме ртути).
- Если необходимо указать степень окисления центрального атома (когда она является одной из нескольких возможных или нулем), запишите ее римской цифрой (или 0) в скобках.
- Назовите катион, затем анион отдельными словами (если применимо, как в последнем примере)
Примеры:
- [NiCl 4 ] 2− → ион тетрахлороникелата (II)
- [CuNH 3 Cl 5 ] 3− → ион амминпентахлоркупрат (II)
- [Cd (en) 2 (CN) 2 ] → дицианобис (этилендиамин) кадмий (II)
- [Co (NH 3 ) 5 Cl] SO 4 → сульфат пентаамминхлорокобальта (III)
Координационное число лигандов, присоединенных к более чем одному металлу (мостиковые лиганды), указывается нижним индексом к греческому перед названием лиганда ставится символ μ.Таким образом, димер трихлорида алюминия описывается формулой Al 2 Cl 4 (μ 2 -Cl) 2 .
См. Также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- De Vito, D., J. Weber, A.E. Merbach. 2005. Расчетный объем и энергетические профили для водообмена на т. 2 г 6 Гексаакваионы родия (III) и иридия (III): убедительные доказательства механизма I a , « Неорганическая химия .43: 858-863.
- Именование координационных соединений. Вашингтонский университет в Сент-Луисе. Проверено 8 ноября 2007 г. .
- Zumdahl, Steven S. 2005. Химические принципы . Нью-Йорк, Нью-Йорк: Хоутон Миффлин. ISBN 0618372067.
Внешние ссылки
Все ссылки получены 15 марта 2017 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Комплекс (химия) — Энциклопедия Нового Света
- Чтобы узнать о других значениях термина, см. Комплекс.
Синтез металлического комплекса медь (II) -тетрафенилпорфина из тетрафенилпорфина и моногидрата ацетата меди (II).
Комплекс в химии обычно используется для описания молекул или ансамблей, образованных комбинацией лигандов и ионов металлов. Первоначально химический комплекс подразумевал обратимую ассоциацию молекул, атомов или ионов через слабые химические связи.Применительно к координационной химии это значение было изменено.
Некоторые комплексы металлов образуются практически необратимо, и многие из них связаны довольно прочными связями.
История
Координационные комплексы были известны, хотя и не изучены в каком-либо смысле, с начала химии. Примеры включают берлинскую лазурь и медный купорос. Ключевой прорыв произошел, когда Альфред Вернер предположил, среди прочего , что Co (III) несет шесть лигандов в октаэдрической геометрии.Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аминов кобальта и объяснить многие из ранее необъяснимых изомеров. Он разделил первый координационный комплекс на оптические изомеры, опровергнув теорию о том, что хиральность обязательно связана с углеродными соединениями.
Металлокомплексы
Комплексы металлов, также известные как координационные соединения, включают все соединения металлов, за исключением паров металлов, плазмы и сплавов.Изучение «координационной химии» — это изучение «неорганической химии» всех щелочных и щелочноземельных металлов, переходных металлов, лантаноидов, актинидов и металлоидов. Таким образом, координационная химия — это химия большинства элементов таблицы Менделеева. Металлы и ионы металлов существуют только, по крайней мере, в конденсированных фазах, в окружении лигандов.
Ионы или молекулы, окружающие металл, называются лигандами. Лиганды обычно связаны с ионом металла координатной ковалентной связью (отдавая электроны из неподеленной электронной пары на пустую металлическую орбиталь), и, таким образом, говорят, что они координированы с ионом .Области координационной химии можно классифицировать в соответствии с природой лигандов, в общих чертах:
- Классический (или «комплексы Вернера»): лиганды в классической координационной химии связываются с металлами почти исключительно через свои «неподеленные пары» электронов, находящихся на атомах основной группы лиганда. Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en —
- Примеры: [Co (EDTA)] — ], [Co (NH 3 ) 6 ] Cl 3 , [Fe (C 2 O 4 ) 3 ] K 3
- Металлоорганический химический состав: лиганды являются органическими (алкены, алкины, алкилы) в виде а также «органические» лиганды, такие как фосфины, гидрид и CO.
- Пример: (C 5 H 5 ) Fe (CO) 2 CH 3
- Биоинорганическая химия: лиганды образуются природой, особенно в том числе боковые цепи аминокислот, и многие кофакторы, такие как порфирины.
- Пример: гемоглобин
- Многие природные лиганды являются «классическими», особенно вода.
- Кластерная химия: лиганды представляют собой все вышеперечисленное, но также включают другие металлы в качестве лигандов.
- Пример Ru 3 (CO) 12
- В некоторых случаях возможны комбинации различных полей:
- Пример: [Fe 4 S 4 (Scysteinyl) 4 ] 2−, в котором кластер внедрен в биологически активный вид.
Минералогия, материаловедение и химия твердого тела — применительно к ионам металлов — являются подмножествами координационной химии в том смысле, что металлы окружены лигандами.Во многих случаях эти лиганды являются оксидами или сульфидами, но, тем не менее, металлы скоординированы, и применяются принципы и рекомендации, обсуждаемые ниже. Верно, что направление минералогии, материаловедения и химии твердого тела отличается от обычного направления координационной или неорганической химии. Первые в первую очередь связаны с полимерными структурами, свойствами, возникающими в результате коллективного воздействия многих сильно взаимосвязанных металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Строение координационных соединений
Геометрия
Структура в сложной химии начинается с акцента на «координационное число», количество лигандов, прикрепленных к металлу (более конкретно, количество связей σ-типа между лигандом (ами) и центральным атомом). Обычно можно подсчитать присоединенные лиганды, но иногда даже подсчет может быть неоднозначным. Координационные числа обычно составляют от двух до девяти, но большое количество лигандов не является редкостью. Количество связей зависит от размера, заряда и электронной конфигурации иона металла.Большинство ионов металлов могут иметь более одного координационного числа.
Обычно в химии комплексов доминируют взаимодействия между s- и p-молекулярными орбиталями лигандов и d (или f) -орбиталями ионов металлов. Орбитали s, p и d металла дают возможность разместить 18 электронов (см. Правило 18 электронов; для элементов f-блока это распространяется до 32 электронов). Таким образом, максимальное координационное число для определенного металла связано с электронной конфигурацией иона металла (точнее, с числом пустых орбиталей) и с соотношением размеров лигандов и иона металла.Большие металлы и маленькие лиганды приводят к высоким координационным числам, например [Mo (CN) 8 ] 4-. Мелкие металлы с большими лигандами приводят к низким координационным числам, например Pt [P (CMe 3 ] 2 . Из-за своего большого размера лантаноиды, актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Различное структурное расположение лигандов обусловлено координационным числом. Большинство структур следуют шаблону точек на сфере (или, как если бы центральный атом находился в середине многогранника, где углы этой формы являются местоположениями лигандов), где орбитали перекрываются (между орбиталями лиганда и металла). ) и отталкивание лиганд-лиганд имеет тенденцию приводить к определенной регулярной геометрии.Наиболее наблюдаемые геометрии перечислены ниже, но есть много случаев, когда они отклоняются от обычной геометрии, например из-за использования лигандов разных типов (что приводит к неправильной длине связи; координационные атомы не следуют схеме точки на сфере), из-за размера лигандов или из-за электронных эффектов (см., например, Jahn -Кассирское искажение):
- Линейная двухкоординатная,
- Тригональный планарный трехкоординатный,
- Тетраэдрический или квадратно-плоский для четырехкоординатного
- Тригонально-бипирамидальный или квадратно-пирамидальный для пятикоординатного типа,
- Октаэдрический (ортогональный) или тригонально-призматический для шестикоординированной,
- Пятиугольная бипирамидальная семикоординация,
- Квадратный антипризматический для восьмикоординатного типа и
- Трехглавая треугольная призма (трехгранная треугольная призма) для девяти координат.
Следует отметить некоторые исключения и положения:
- Идеализированные описания 5-, 7-, 8- и 9-координации часто геометрически неотличимы от альтернативных структур с немного разными углами L-M-L (лиганд-металл-лиганд). Классический пример этого — разница между квадратно-пирамидальными и тригонально-бипирамидальными структурами.
- Из-за специальных электронных эффектов, таких как (второго порядка) стабилизация Яна-Теллера, некоторые геометрические формы стабилизируются относительно других возможностей, например.г. для некоторых соединений тригонально-призматическая геометрия стабилизируется по сравнению с октаэдрическими структурами для шестикоординации.
Изомерия
Расположение лигандов фиксировано для данного комплекса, но в некоторых случаях оно может изменяться в результате реакции, в результате которой образуется другой стабильный изомер.
Существует много типов изомерии в координационных комплексах, как и во многих других соединениях.
Стереоизомерия
Стереоизомерия возникает с одними и теми же связями в разной ориентации относительно друг друга.Стереоизомерию можно разделить на:
Геометрическая изомерия
Геометрическая изомерия встречается в октаэдрических и квадратных плоских комплексах (но не в тетраэдрических). Когда два лиганда находятся напротив друг друга, они называются транс , когда они взаимно соседними, цис . Когда три идентичных лиганда занимают одну грань октаэдра, изомер называется лицевым, или fac . Если эти три лиганда копланарны, изомер называют меридиональным, или мер .Например, в октаэдрическом соединении с тремя из одного лиганда и тремя из другого существует два геометрических изомера: mer , в котором каждый набор из трех одинаковых лигандов находится в меридиане, и fac , в котором каждый набор из трех находится на грани октаэдра.
цис — [CoCl 2 (NH 3 ) 4 ] +
транс — [CoCl 2 (NH 3 ) 4 ] +
fac — [CoCl 3 (NH 3 ) 3 ]
мер — [CoCl 3 (NH 3 ) 3 ]
Оптическая изомерия
Оптическая изомерия возникает, когда зеркальное отображение соединения не совмещается с исходным соединением.Это так называется, потому что такие изомеры оптически активны, то есть они вращают плоскость поляризованного света. Символ Λ (дельта) используется в качестве префикса для описания поворота левого винта, образованного тремя бидентатными лигандами, как показано. Аналогично, символ Δ (лямбда) используется в качестве префикса для правостороннего поворота воздушного винта.
Λ- [Fe (ox) 3 ] 3−
Δ- [Fe (ox) 3 ] 3−
Λ- цис — [CoCl 2 (en) 2 ] +
Δ- цис — [CoCl 2 (en) 2 ] +
Структурная изомерия
Структурная изомерия возникает, когда связи сами по себе различны.Изомерия сцепления — это только один из нескольких типов структурной изомерии в координационных комплексах (как и в других классах химических соединений). Изомерия связывания возникает с амбидентатными лигандами, которые могут связываться более чем в одном месте. Например, NO 2 является амбидентатным лигандом: он может связываться с металлом либо по атому N, либо по атому O.
Старые классификации изомерии
Традиционные классификации видов изомеров стали архаичными с появлением современной структурной химии.В более древней литературе можно встретить:
- Ионизационная изомерия описывает возможные изомеры, возникающие в результате обмена между внешней и внутренней сферами. Эта классификация основана на архаичной классификации внутренней и внешней сферы. В этой классификации «лиганды внешней сферы», когда ионы в растворе, могут быть заменены «лигандами внутренней сферы» с образованием изомера.
- Изомерия сольвата возникает, когда лиганд внутренней сферы заменяется молекулой растворителя.Эта классификация устарела, поскольку она рассматривает растворители как отличные от других лигандов. Некоторые проблемы обсуждаются под кристаллизационной водой.
Электронное строение координационных соединений
Многие свойства комплексов металлов продиктованы их электронным строением. Электронную структуру можно описать с помощью относительно ионной модели, которая приписывает формальные заряды металлам и лигандам и не фокусируется на ковалентности. Этот подход составляет суть теории кристаллического поля (CFT).Теория кристаллического поля, представленная Гансом Бете в 1929 году, представляет собой квантово-механическую попытку понимания комплексов. Но теория кристаллического поля рассматривает все взаимодействия в комплексе как ионные и предполагает, что лиганды могут быть аппроксимированы отрицательными точечными зарядами.
Более сложные модели охватывают ковалентность, и этот подход описывается теорией поля Лиганда (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, представленная в 1935 году и основанная на теории молекулярных орбиталей, может работать с более широким кругом комплексов и может объяснять комплексы, в которых взаимодействия ковалентны.Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя простые, основанные на симметрии решения формальных уравнений.
Химики склонны использовать простейшую модель, необходимую для предсказания интересующих свойств; по этой причине CFT был фаворитом для обсуждений, когда это было возможно. Теории МО и НЧ сложнее, но дают более реалистичную перспективу.
Электронная конфигурация комплексов придает им некоторые важные свойства:
Цвет
Металлические комплексы часто имеют эффектную окраску.Эти цвета возникают из-за поглощения света, который возбуждает электроны на орбиталях металла или, в случае переноса заряда, возбуждает электроны с орбиталей на основе металла на орбитали на основе лиганда (или наоборот). Помощь для объяснения и интерпретации электронных возбуждений в наборе металлических орбиталей — это диаграммы Танабе-Сугано (для простых соединений с хорошо определенной геометрией) или использование вычислительной химии.
Магнетизм
Комплексы металлов, содержащие неспаренные электроны, обладают магнитными свойствами.Рассматривая только монометаллические комплексы, неспаренные электроны возникают из-за нечетного числа электронов в комплексе или из-за дестабилизации спаривания электронов. Таким образом, мономерные частицы Ti (III) имеют один «d-электрон» и должны быть (пара) магнитными, независимо от геометрии или природы лигандов. Ti (II) с двумя d-электронами образует некоторые комплексы, которые имеют два неспаренных электрона, а другие — ни одного. Этот эффект иллюстрируется соединениями TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P (CH 3 ) 2 ] 2 : когда X = Cl, комплекс является парамагнитным (высокоспиновая конфигурация), тогда как при X = CH 3 он диамагнитен (низкоспиновая конфигурация).Важно понимать, что лиганды предоставляют важные средства регулировки свойств основного состояния.
В би- и полиметаллических комплексах, в которых отдельные центры имеют нечетное число электронов или имеют высокий спин, ситуация более сложная. Если существует взаимодействие (прямое или через лиганд) между двумя (или более) металлическими центрами, электроны могут взаимодействовать (антиферромагнитное взаимодействие, приводящее к диамагнитному соединению), или они могут усиливать друг друга (ферромагнитное взаимодействие).Когда нет взаимодействия, два (или более) отдельных металлических центра ведут себя как две отдельные молекулы.
Реакционная способность
Комплексы обладают множеством возможных реактивностей:
- Обычной реакцией между координационными комплексами с участием лигандов является перенос электронов внутри и снаружи сферы. Это два разных механизма окислительно-восстановительных реакций электронного переноса, в значительной степени определенных покойным Генри Таубе. В реакции внутренней сферы лиганд с двумя неподеленными электронными парами действует как мостиковый лиганд , лиганд, с которым могут связываться оба координационных центра.Благодаря этому электроны переносятся из одного центра в другой.
- (Вырожденный) обмен лигандов
- Одним из важных показателей реактивности является скорость вырожденного обмена лигандов. Например, скорость обмена координатной воды в комплексах [M (H 2 O) 6 ] n + варьируется более чем на 20 порядков. Комплексы, в которых лиганды высвобождаются и быстро восстанавливаются, классифицируются как лабильные. Такие лабильные комплексы могут быть термодинамически достаточно стабильными.Типичные лабильные комплексы металлов имеют либо низкий заряд (Na + ), электроны на d-орбиталях, которые разрываются по отношению к лигандам (Zn 2+ ), либо отсутствие ковалентности (Ln 3+ , где Ln — любое лантаноид). Лабильность металлического комплекса также зависит от конфигураций с высоким и низким спином, когда это возможно. Таким образом, высокоспиновые Fe (II) и Co (III) образуют лабильные комплексы, тогда как низкоспиновые аналоги инертны. Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
- Комплексы с незаполненными или наполовину заполненными орбиталями часто проявляют способность реагировать с субстратами. Большинство подложек имеют синглетное основное состояние, то есть у них есть неподеленные электронные пары (например, вода, амины, простые эфиры), поэтому этим подложкам нужна пустая орбиталь, чтобы иметь возможность реагировать с металлическим центром. Некоторые субстраты (например, молекулярный кислород!) Имеют триплетное основное состояние, что приводит к тому, что металлы с наполовину заполненными орбиталями имеют тенденцию реагировать с такими субстратами (следует сказать, что молекула дикислорода также имеет неподеленные пары, так что это также способен реагировать как «нормальная» база Льюиса).
Если лиганды вокруг металла тщательно выбраны, металл может способствовать (стехиометрическим или каталитическим) превращениям молекул или использоваться в качестве сенсора.
Именные комплексы
Базовый порядок наименования комплекса:
- При названии комплексного иона лиганды называют перед ионом металла.
- Напишите названия лигандов в алфавитном порядке. (Числовые префиксы не влияют на порядок.)
- Множественно встречающиеся монодентатные лиганды получают префикс в соответствии с числом вхождений: ди-, три-, тетра-, пента- или гекса .Полидентатные лиганды (например, этилендиамин, оксалат) получают бис-, трис-, тетракис- и т. Д.
- Анионы оканчиваются на или . Это заменяет последний ‘e’, когда анион заканчивается на ‘-ate’, например. сульфат становится сульфатом . Он заменяет ide: цианид становится циано .
- Нейтральным лигандам даны их обычные названия, за некоторыми исключениями: NH 3 становится аммином ; H 2 O становится aqua или aquo ; СО становится карбонил ; NO превращается в нитрозил .
- Напишите имя центрального атома / иона. Если комплекс представляет собой анион, имя центрального атома будет оканчиваться на -ate , и будет использоваться его латинское имя, если оно доступно (кроме ртути).
- Если необходимо указать степень окисления центрального атома (когда она является одной из нескольких возможных или нулем), запишите ее римской цифрой (или 0) в скобках.
- Назовите катион, затем анион отдельными словами (если применимо, как в последнем примере)
Примеры:
- [NiCl 4 ] 2− → ион тетрахлороникелата (II)
- [CuNH 3 Cl 5 ] 3− → ион амминпентахлоркупрат (II)
- [Cd (en) 2 (CN) 2 ] → дицианобис (этилендиамин) кадмий (II)
- [Co (NH 3 ) 5 Cl] SO 4 → сульфат пентаамминхлорокобальта (III)
Координационное число лигандов, присоединенных к более чем одному металлу (мостиковые лиганды), указывается нижним индексом к греческому перед названием лиганда ставится символ μ.Таким образом, димер трихлорида алюминия описывается формулой Al 2 Cl 4 (μ 2 -Cl) 2 .
См. Также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- De Vito, D., J. Weber, A.E. Merbach. 2005. Расчетный объем и энергетические профили для водообмена на т. 2 г 6 Гексаакваионы родия (III) и иридия (III): убедительные доказательства механизма I a , « Неорганическая химия .43: 858-863.
- Именование координационных соединений. Вашингтонский университет в Сент-Луисе. Проверено 8 ноября 2007 г. .
- Zumdahl, Steven S. 2005. Химические принципы . Нью-Йорк, Нью-Йорк: Хоутон Миффлин. ISBN 0618372067.
Внешние ссылки
Все ссылки получены 15 марта 2017 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Сложные органические соединения в химии: типы, группы и примеры
Сложные органические соединения
Основная причина высокой ценности углерода заключается в том, что он может образовывать четыре связи одновременно, что позволяет ему образовывать сложные гибкие молекулы. Это идеальный вариант для жизни. Четыре основные группы молекул углерода жизни — это белков , углеводов , липидов и нуклеиновых кислот . Это самые сложные виды органических соединений.
Хорошо, иди взгляни в зеркало. Вы видите сложные органические соединения? Вы это сделаете, если увидите свою кожу. Кожа состоит из белков. Вы это сделаете, если увидите жир. Под кожей и жиром происходит множество процессов, для которых требуется энергия в виде углеводов. Мы не можем забыть очень важные нуклеиновые кислоты, которые сообщают клеткам вашего тела, как работать и воспроизводиться.
В простых органических соединениях углерод связан только с водородом. Сложные органические соединения, особенно те, которые участвуют в живых системах, имеют углеродные связи, по крайней мере, с водородом и кислородом.Давайте начнем с простого и снова перейдем к сложному.
Углеводы — это молекулы, состоящие из углерода, водорода и кислорода . Примером углеводов является столовый сахар , известный как сахароза . Сахароза имеет молекулярную формулу C12h32O11 . Все сложные органические молекулы, такие как сахароза, известны как полимеры , . Полимеры представляют собой комплексов повторяющихся структурных единиц .Структурные единицы , из которых состоят полимеры , называются мономерами . Итак, по сути, полимеры — это комплексы мономеров. Сахароза — это полимер мономера глюкозы.
Липиды , обычно называемые жирами, также являются полимерами. Липиды — это полимеров жирных кислот . Холестерин, который вы так усердно пытаетесь удержать в определенных пределах, является примером липидов. Холестерин является одним из основных компонентов мембран клеток животных и позволяет клетке быть гибкой и изменять форму.Холестерин имеет комплексную структуру из четырех связанных углеводородных колец и углеводородного хвоста . Молекулярная формула холестерина C27h56O .
Если вы уже пробовали соблюдать диету, то знаете о двух основных типах липидов: насыщенных, и ненасыщенных, . Возможно, вы сидели на диете с высоким содержанием ненасыщенных жиров или цепочек жирных кислот с двойными связями, потому что они более здоровы. Насыщенные липиды — это цепи жирных кислот, не имеющие двойных связей.Большинство животных жиров представляют собой насыщенные липиды, тогда как большинство жиров растений и семян являются ненасыщенными липидами. За исключением некоторых жиров тропических растений, таких как кокосовое или пальмовое масло, которые являются насыщенными липидами.
Наше следующее органическое соединение, белок , даже сложнее углеводов или липидов. Белки представляют собой полимеры из аминокислот. Аминокислоты содержат азот, углерод, кислород и водород . Вы замечаете, что чем больше мы добавляем элементов, тем сложнее органическое соединение? Есть 20 аминокислот с широким спектром химических свойств, благодаря содержащемуся в них азоту.Аминокислоты охватывают всю шкалу pH, некоторые из них являются кислыми, основными или нейтральными. Некоторые аминокислоты обладают зарядом, что делает их полярными. Это важно, когда речь идет о том, как белки складываются вместе, а также как они связываются с другими соединениями.
Форма белков после сворачивания определяет их функцию. Например, фермент представляет собой белок с активным центром, который объединяет другие молекулы, чтобы катализировать реакцию . Некоторые белки имеют огромные размеры из-за их окончательной формы после сворачивания.Эти белки настолько велики, что химики не обращают внимания на их молекулярную формулу; вместо этого они сосредотачиваются на своей молекулярной массе.
Белки, которые мы только что обсудили, созданы благодаря инструкциям, закодированным в нуклеиновых кислотах . Нуклеиновые кислоты представляют собой полимеры из нуклеотидов. Нуклеотиды представляют собой сахарофосфатные соединения , присоединенные к азотистому основанию . ДНК , сокращенно от дезоксирибонуклеиновой кислоты , представляет собой нуклеиновую кислоту, которая кодирует инструкции для клеток . Рибонуклеиновая кислота , или РНК , представляет собой нуклеиновую кислоту , которая помогает преобразовывать ДНК в белки . Каждый аспект каждого живого организма, от бактерий до растений, вашей собаки и нас, определяется нуклеиновыми кислотами.
Краткое содержание урока
Органические соединения — это любые молекулы, состоящие из элемента углерода .Четыре основные группы молекул углерода жизни — это самые сложные органические соединения: белков , углеводов , липидов и нуклеиновых кислот . Все сложные органические молекулы — это полимеры . Полимеры представляют собой комплексы повторяющихся структурных единиц , известных как мономеры . По сути, полимеры — это комплексы мономеров.
Углеводы — это молекулы, состоящие из углерода, водорода и кислорода .Примером углеводов является столовый сахар , известный как сахароза .
Липиды , также называемые жирами , представляют собой полимеры жирных кислот . Два типа липидов — это ненасыщенных жиров или цепей жирных кислот с двойными связями и насыщенных жиров или цепей жирных кислот, не имеющих двойных связей . Примером липида является холестерин , который представляет собой комплексную структуру из четырех связанных углеводородных колец и углеводородного хвоста .
Белки представляют собой полимеры из аминокислот . Аминокислоты — это мономеров, содержащих азот, углерод, кислород и водород . Одним из специализированных типов белка является фермент , который представляет собой белок с активным центром, который объединяет другие молекулы, чтобы катализировать реакцию .
Нуклеиновые кислоты представляют собой полимеры с нуклеотидами . Нуклеотиды представляют собой сахарофосфатные соединения , присоединенные к азотистому основанию .Двумя типами нуклеиновых кислот являются дезоксирибонуклеиновая кислота , сокращенно ДНК , которая представляет собой нуклеиновая кислота, кодирующая инструкции для клеток , и рибонуклеиновая кислота , сокращенно РНК , которая представляет собой нуклеиновую кислоту . что помогает преобразовывать ДНК в белки .
Автоматическое отображение атомов в простых и сложных химических реакциях
Во время разработки алгоритма и выбора эвристики (см.выше), мы внимательно изучили его результаты по 548 реакциям, которые можно назвать «обучающей выборкой». Этот набор включал 241 типичную реакцию с полной стехиометрией и взят из коллекции Organic Syntheses 37 ; набор из 191 случайно выбранных и обычно в основном стехиометрически несбалансированных реакций из коллекции Reaxys 38 ; и 116 механически сложных реакций (73 стехиометрически сбалансированных и 43 несбалансированных), взятых из различных литературных источников (например,g., Курти «Стратегическое применение названных реакций в органическом синтезе» 39 или Гроссмана «Искусство написания разумных механизмов органических реакций» 1 ), отображение которых должно стать проблемой даже для экспертов-людей. Эти реакции были нанесены на карту нашим алгоритмом с помощью ReactionMap 32 , Marvin JS version 16.4.18 33 и в качестве критерия правильности авторами (SS, BMK, TK, все опытные химики-органики с опытом работы в качестве соавторов). -разработчики ретросинтетического программного обеспечения Chematica ( 13,40 ).Все нанесенные на карту реакции представлены в дополнительном примечании 2. Для 241 типичной реакции с полной стехиометрией наш алгоритм обеспечивает 93,8% правильных назначений по сравнению с 92,1% для ReactionMap и 86,7% для методов MarvinJS, то есть он работает немного лучше, чем конкурирующие методы. решения. Для 191 реакции Reaxys во второй коллекции точность нашего алгоритма составляет 94,2% против 90,5% для MarvinJS и только 12% для ReactionMap. Плохой производительности ReactionMap можно было ожидать, поскольку, как признают ее авторы 25 , программа обычно не может справиться с реакциями без полной стехиометрии.Наш алгоритм наиболее решительно превосходит конкурентов в отображении 116 сложных реакций — здесь он правильно отобразил 85,3% реакций по сравнению с 44,8% для ReactionMap и 59,4% для MarvinJS.
Затем мы выполнили аналогичные сравнения на наборе из 401 реакции, которые не учитывались во время обучения (миниатюры реакций с сопоставлениями см. В дополнительном примечании 3). Этот «тестовый» набор включал: 100 относительно простых реакций с полной стехиометрией, взятой из общих синтезов, опубликованных в Org.Lett., J. Am. Chem. Soc. И J. Org. Chem .; 100 типичных реакций без полной стехиометрии, взятых из патентов; и 201 механически сложная реакция (92 стехиометрически сбалансированных и 109 несбалансированных), которые включают перегруппировки и многокомпонентные реакции, взятые из недавней литературы (в большинстве случаев после 2010 г. и из Org. Lett., J. Am. Chem. Soc. и J. Org. Chem.). Для всех 401 реакции мы сравнили производительность нашего алгоритма не только с MarvinJS и ReactionMap, но и с ChemDraw Prime (версия 16.0.0.82) и Indigo (версия 1.3.0 beta). Результаты, представленные на рис. 5, свидетельствуют о том, что для простых реакций с полной стехиометрией (зеленые столбцы) все алгоритмы, за исключением Indigo (правильность 65%), работают хорошо — наш имеет правильность 98%, MarvinJS 85%, ReactionMap 95% и ChemDraw 96%. Для 100 реакций без полной стехиометрии (синие столбцы) наш алгоритм немного более точен, чем ChemDraw, MarvinJS и Indigo (правильность 100% против 97%, 96% и 90% соответственно) и значительно лучше, чем ReactionMap (правильность 11%) , который не учитывает недостающую стехиометрию.Как и в обучающей выборке, основные различия наблюдаются для сложных реакций (красные столбцы), для которых наш алгоритм верен в 84% случаев по сравнению с 66% для ChemDraw, 62% для MarvinJS, 38% для Indigo и 33% для ReactionMap. Сделаем два комментария относительно этих результатов. Во-первых, показатели качества для ChemDraw и Indigo завышены, потому что значительная часть результатов, получаемых этими модулями сопоставления, приходит без полных сопоставлений (см. Дополнительный рис. 5), хотя фрагменты, не имеющие присвоения атомов, являются химически уникальными и могут быть однозначно присвоены с помощью человек-химик (с другой стороны, такие результаты могут не считаться правильными во время, скажем, автоматического извлечения правил реакции).Если применяется более строгий критерий, согласно которому все атомы в молекуле должны иметь уникальные номера, статистика для двух картографов будет намного хуже (сплошные части столбцов на рисунке): для ChemDraw 27% правильность простых реакций с полной стехиометрией , 16% для типичных реакций без полной стехиометрии и 27% для сложных реакций; для индиго 37% для простых реакций с полной стехиометрией, 12% для типичных реакций без полной стехиометрии и 16% для сложных реакций. Во-вторых, поучительно сравнить эффективность всех картографов по сложным реакциям с полной стехиометрией (73 таких реакции в обучающей выборке и 92 в тестовой выборке).Для таких реакций корректность ChemDraw, MarvinJS и Indigo не сильно меняется (соответственно 67%, 59%, 34%), но производительность ReactionMap значительно улучшается (~ 71%) — хотя она все еще заметно ниже нашего картографа. (86% правильности для стехиометрически сбалансированных реакций в тренировочной выборке и 87% для сбалансированных реакций в тестовой выборке).
Рис. 5Производительность различных картографов оценивается количественно на 401 реакции из основного тестового набора. Для ChemDraw и Indigo сплошные части полосок соответствуют более строгому критерию, согласно которому всем атомам в молекуле должны быть присвоены номера.Заштрихованные части столбцов дают процент правильных ответов, предполагающий более мягкий критерий, учитывающий неотмеченные, но химически уникальные атомы (см. Примеры на дополнительном рис. 6). ReactionMap значительно лучше (~ 71%) в сложных реакциях с полной стехиометрией (см. Основной текст)
Некоторые из этих сложных реакций, которые мы тестировали, включая несколько механистических стадий и / или перегруппировок, показаны на рис. 6. Например, реакция на фиг. 6a начинается с перегруппировки [3,3] -сигматропного аллильного азида с последующей внутримолекулярной реакцией Шмидта-Обе с образованием бициклического амида 41 .На рис. 6b циклопропениллитиевый реагент, полученный in situ, реагирует с альдегидом с последующей внутримолекулярной реакцией Дильса-Альдера с фурановым кольцом с образованием мостикового бициклического каркаса 42 . На фиг. 6c катализируемая кислотой Льюиса перегруппировка семипинакола создает бицикло [3.2.1] октан-8-он каркас 43 . На фиг. 6d катализируемая кислотой Льюиса окса-пианкателли перегруппировка спирта создает оксаспироциклический каркас 44 . Многоступенчатая последовательность на фиг. 6e включает перекрестное связывание 2-бромфурана с амидом, внутримолекулярную реакцию Дильса-Альдера, термическую перегруппировку амидофурана в дигидро- 2H -карбазолон и, наконец, циклизацию с аллиламином с образованием основного каркаса Минфиенсин алкалоид 45 .С другой стороны, 16% неправильно отображенных реакций обычно представляют собой реакции, в которых отсутствуют ключевые, механически важные субстраты или побочные продукты, те, которые включают последовательности механически сложных перегруппировок и необычных миграций функциональных групп (изменение атомного окружения в нетривиальные способы, см. дополнительный рис. 8), или те, которые представляют собой каскады не обязательно сложных, но слишком большого числа (> 4, 5) реакций 46 , которые могут / должны быть записаны как отдельные преобразования (рис.6е). Как уже говорилось ранее в тексте, такие угловые случаи невозможно преодолеть простым добавлением более специализированных эвристик, поскольку их применение создает дополнительные ложные решения — особенно когда атомные ядра эвристики перекрываются — с сопоставимыми оценками, но в конечном итоге приводящими к неправильному назначению атомов.
Рис. 6Примеры нанесенных на карту сложных реакций. a — e Реакции правильно отображаются нашим алгоритмом. f Пример реакции, при которой найдено неверное отображение.Правильное сопоставление показано в нижнем ряду. Разъединенные облигации окрашены в красный цвет, а созданные облигации отмечены зеленым. Для обсуждения см. Основной текст и ссылки. 41,42,43,44,45,46 для химических деталей
В качестве второго набора тестов мы рассмотрели производительность нашего алгоритма при картировании патентных реакций, на основе которых оценивается реактивность для пар атомов 11 или шаблонов / ядер реакций 47 были получены ранее и затем использовались, соответственно, для прогнозирования реакции или ретросинтетического планирования.Правильное распределение атомов в этом и подобных наборах реакций важно, поскольку машинное извлечение отображенных ядер реакций является обычным для большинства программ ретросинтетического проектирования (Wiley / CAS ChemPlanner 17 , InfoChem ICSynth 16 , BenevolentAI / Waller 12 и MIT / Coley 47 программ), но не на нашей платформе Chematica 13,40 . Здесь мы рассмотрели подмножество из 50000 реакций, выбранных Ландрамом и его сотрудниками 5,48 из базы данных Управления США по патентам и товарным знакам (USPTO), чтобы представить реакции, наиболее важные для медицинской химии (эта коллекция позже была использована Массачусетским технологическим институтом). команда в вышеупомянутых исследованиях 11 и 47 ).После дальнейшей очистки от химически бессмысленных записей (см. Дополнительный рисунок 9) мы классифицировали реакции в соответствии с количеством измененных связей (от одной до шести) и произвольно выбрали образцы из каждого класса, чтобы в конечном итоге собрать 281 образец (см. Рис. 7 и дополнительное примечание 4) — мы отмечаем, что этот метод категоризации и отбора делает упор на более сложные реакции, которые в противном случае были бы нечастыми (~ 72% набора USPTO изменяют одну или две связи), но важны в контексте изучения нетривиальных правил химических реакций.Когда реакции были нанесены на карту экспертами-людьми, мы сравнили правильность сопоставлений, представленных в наборе USPTO (красные столбцы на рис. 7a), с сопоставлениями, созданными нашим алгоритмом (зеленые столбцы). Как видно, для реакций разъединения / создания одной или двух связей нет существенных различий в производительности; с другой стороны, для более сложных реакций, изменяющих более двух связей, процент правильно отображенных реакций в коллекции USPTO быстро падает до 16–52%, в то время как для нашего картографа он остается между 82 и 92%.Проявление этой тенденции проиллюстрировано на фиг. 7b, на которой показаны две полезные реакции, циклоприсоединение Дильса-Альдера и N -алкилирование амидов, неправильно отображенных в наборе USPTO. Мы наблюдаем это, когда авторы исх. 11 использовали такие сопоставления для получения оценок реактивности для пар атомов, а затем, используя глубокую нейронную сеть на основе архитектуры Вайсфейлера-Лемана, предсказали результаты новых реакций, они утверждали, что «общая производительность модели не сильно зависит от качества отображения атомов. ».Хотя это может иметь место для некоторых очень простых химических процессов, мы проверили, что если для обучения нейронной сети используются неправильные сопоставления, предсказания продуктов тестовых реакций в подавляющем большинстве химически бессмысленны (см. Дополнительные примечания 5.2 и 5.3 и более подробное обсуждение в Разделе 8 Дополнительной информации к номеру 49 ). В более широком контексте такие примеры помогают нам понять, почему программное обеспечение для планирования синтеза, основанное на правилах машинного извлечения или индексах реактивности, которые идут с ошибочными сопоставлениями атомов, обычно не применимы к сложным мишеням, для синтеза которых требуется использование более продвинутой химии.Тем не менее, мы отмечаем, что также разрабатываются другие подходы, которые не требуют сопоставления атомов, а вместо этого основываются на прогнозировании реакций на основе отпечатков реакции 14 или так называемой последовательности моделей последовательностей 50,51 .
Рис. 7Сравнение нашего алгоритма с сопоставлениями USPTO. a Процентное соотношение правильных сопоставлений USPTO (красные столбцы) и сопоставлений, выполненных нашим алгоритмом (зеленые столбцы), сгруппированных в соответствии с количеством разорванных / созданных связей, от одного до шести.Статистика основана на 50 реакциях, каждая для которых изменяется от одной до пяти связей, и 31 реакции для шести связей. Мы отмечаем, что в дополнение к химически значимым реакциям, для которых мы сравнивали сопоставления, набор USPTO также содержал большую часть бессмысленных реакций, которые, вероятно, были вызваны ошибками ввода человека в используемые ими базы данных (например, отсутствие ключевых партнеров реакции, создание атомов «Ex nihilo» и т. Д., См. Дополнительный рис. 9). Такие реакции, а также простое снятие защиты не были включены в приведенную статистику. b , c Примеры двух реакций — циклоприсоединения Дильса-Альдера ( b ) и N -алкилирование амида ( c ) — неправильно отображены в наборе USPTO и правильно с помощью нашего программного обеспечения. Дополнительные примеры см. В дополнительном примечании 4
Мы запросили дополнительную проверку у химиков-синтетиков, не входящих в нашу группу (три студента со степенью магистра наук, два кандидата наук, два постдокторанта, все они перечислены в разделе «Благодарности»). Во-первых, чтобы сравнить наши экспертные сопоставления, четыре из этих химиков повторно сопоставили случайно выбранную выборку из наших 100 реакций — их сопоставления совпали с сопоставлениями наших внутренних экспертов.Затем, чтобы гарантировать, что реакции, которые мы выбрали для наших тестов, не были предвзятыми, всех семи внешних химиков попросили предоставить дополнительные образцы (25 реакций на человека), которые они считали репрезентативными для современной синтетической химии. Все эти реакции — различающиеся уровнем механистической сложности, представленные нам в типичных синтетических обозначениях (в 38,9% случаев без полной стехиометрии), и все перечисленные в дополнительном разделе 5 — были нанесены на карту нашим алгоритмом, и результаты были нанесены на карту. по сравнению с внешними сопоставлениями (кроме того, наши внутренние эксперты еще раз проверили внешние сопоставления).В конце концов, алгоритм обеспечил 90% правильных отображений для 100 реакций, предоставленных доктором философии. кандидаты и постдоки, и 95% правильных ответов на реакцию, предоставленную M.Sc. ученики.
Наконец, мы рассмотрели скорость работы алгоритма. Поскольку наш метод использует несколько эвристик для проблемы изоморфизма жесткого подграфа NP, его скорость, в принципе, экспоненциальна по отношению к размеру графа, однако тесты, приведенные на дополнительном рис.7, показывают, что типичное время отображения остается практичным (91.5% реакций были нанесены на карту в течение 1 с, 96,5% — менее чем за 10 с).
Таким образом, отображение органических реакций является примером NP-сложной задачи, предыдущие попытки которой были в значительной степени ограничены простыми типами реакций, которые химики обычно могут составить карту без особых усилий. В нашем подходе соединение теории графов и комбинаторики с химическими знаниями в предметной области (воплощенными в минимальном наборе эвристик реакций) позволяет отображать как простые, так и очень сложные органические реакции, в том числе те, которые могут бросить вызов специалистам-людям.


 Не разрушая молекул? Почему?
Не разрушая молекул? Почему?


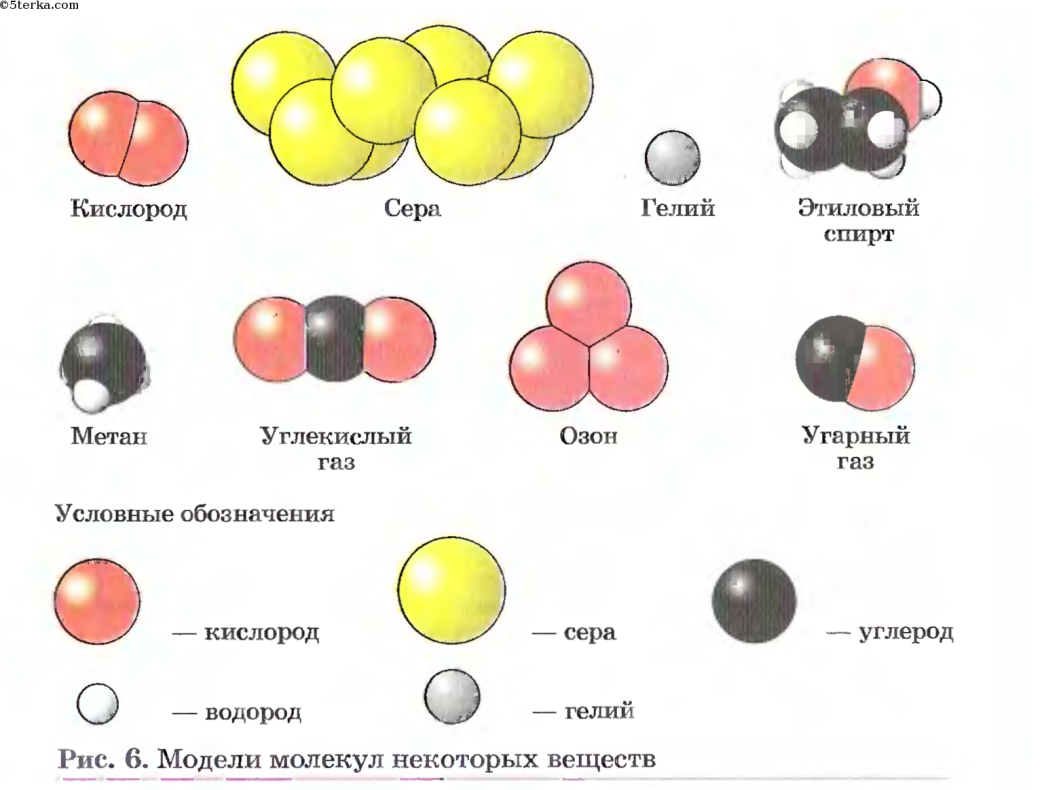 Некоторые проблемы обсуждаются под кристаллизационной водой.
Некоторые проблемы обсуждаются под кристаллизационной водой. Благодаря этому электроны переносятся из одного центра в другой.
Благодаря этому электроны переносятся из одного центра в другой.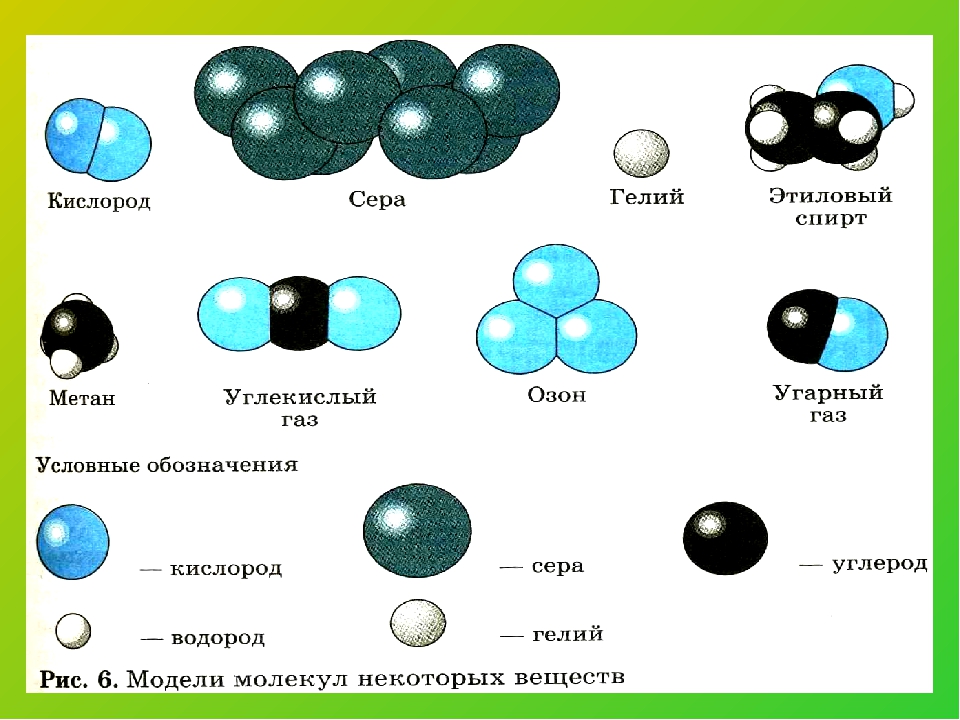 Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
Cr (III) может существовать только в низкоспиновом состоянии (квартет), которое инертно из-за его высокой формальной степени окисления, отсутствия электронов на орбиталях, которые разрывают связи ML, плюс некоторая «стабилизация поля лиганда», связанная с конфигурацией d3 .
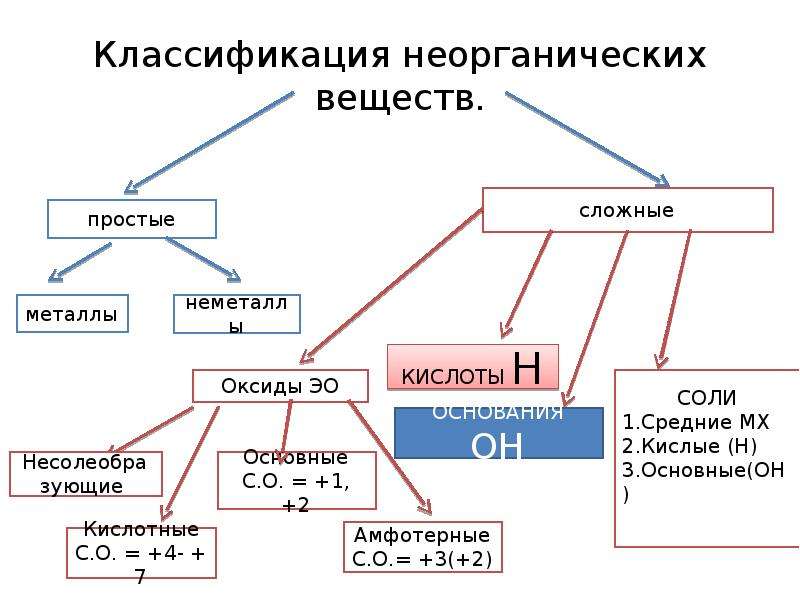
 Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en —
Типичными лигандами являются H 2 O, NH 3 , Cl — , CN — , en — 