Оксиды серы. Серная кислота | АЛХИМИК
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Кислотно-основные свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
б) с основными оксидами:
SO2 + CaO = CaSO3
SO2 + K2O = K2SO3
в) с водой:
SO2 + H2O = H2SO3
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
SO2 + 2H2S = 3S↓ + 2H2O
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
2SO2 + O2 = 2SO3
SO2 + Cl2 + 2H2O = H2SO3 + 2HCl
Получение
1) Сернистый газ образуется при горении серы:
S + O2 = SO2
2) В промышленности его получают при обжиге пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
Na2SO3 + H2SO4 = Na2SO4 + H2SO3→SO2↑ + H2O
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17оС превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Кислотно-основные свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
SO3 + NaOH = NaHSO4
SO3 + 2NaOH = Na2SO4 + H2O
б) с основными оксидами:
SO3 + CaO = CaSO4
в) с водой:
SO3 + H2O = H2SO4
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Образование олеума: H2SO4 + nSO3 = H2SO4 ∙ nSO3
Окислительно-восстановительные свойства
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
3SO3 + H2S = 4SO2 + H2O
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
2SO2 + O2 = 2SO3
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO 2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.
 Серная кислота
Серная кислотаСерная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Кислотно-основные свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
а) с основными оксидами:
MgO + H2SO4 = MgSO4 + H2O
б) с основаниями:
H2SO4 + NaOH = Na2SO4 + 2H2O
в) с солями:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Процесс взаимодействия ионов Ва2+ с сульфат-ионами SO42+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной H2SO4 окислителями являются ионы водорода Н+, а в концентрированной – сульфат-ионы SO42+. Ионы SO42+ являются более сильными окислителями, чем ионы Н+ (см.схему).

В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Zn + H2SO4 = ZnSO4 + H2↑
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Cu + H2SO4 ≠
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S↓ + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Fe + H2SO4 ≠
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO 2:
S + 2H2SO4 = 3SO2↑ + 2H2O
C + 2H2SO4 = 2SO2↑ + CO2↑ + 2H2O
Получение и применение
Реакция серной кислоты с сахаромВ промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
- Получение SO2 путем обжига пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
- Окисление SO2 в SO3 в присутствии катализатора – оксида ванадия (V):
2SO2 + O2 = 2SO3
- Растворение SO3 в серной кислоте:
H2SO4 + nSO3 = H2SO4 ∙ nSO3
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
H2SO4 ∙ nSO3 + H2O = H2SO4
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты
 Железный купорос
Железный купоросБольшинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000оС, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Na2SO4 ≠
CuSO4 = CuO + SO3
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (36 Загрузок)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Похожее
al-himik.ru
Соединения серы (IV)
SO2 — оксид серы (IV). Физические свойства.
SO2 — диоксид серы, сернистый газ, сернистый ангидрид. При обычной температуре — бесцветный газ с резким запахом, хорошо растворим в воде (в 1 л воды при 20°С растворяется — 40 л SO2).
Способы получения
1. Окисление кислородом серы, сероводорода, сульфидов
2. Термическое разложение сульфитов
CaSO3 = СаО + SO2↑
3.Действие сильных кислот на сульфиты
Na2SO3 + 2HCl = SO2 + Н2O + 2NaCI
4.Взаимодействие конц. H2SO4 с восстановителями, например:
2H2SO4 + Си = SO2↑ + CuSO4 + 2Н2O
Химические свойства
При растворении SO2 в воде происходит его частичное соединение с молекулами воды — об разуется слабая сернистая кислота.
SO2 + СаО = CaSO3 сульфит кальция
SO2 + NaOH = NaHSO3 гидросульфит натрия
SO2 + 2NaOH = Н2O + Na2SO3 сульфит натрия
Диоксид серы окисляется в газовой фазе до SO3:
2SO2 + O2 = SO3
SO2 + O3 = SO3+ O2
SO2+ NO2 = SO3 + NO
На свету легко окисляется хлором:
SO2 + Cl2 — SO2Cl2 хлористый сульфурил
В водных растворах при окислении SO2 образуется серная кислота H2SO4:
SO2 + 2HNO3 = H2SO4 + 2NO2
SO2 + Н2O2 = H2SO4
Обесцвечивание окрашенных окислителей (КМпO4 и Вr2) — качественная реакция для распознавания SO2 (например, отличие его от СO2, СО, СН4 и многих других газов):
SO2 + Вr2 + 2Н2О = H2SO4 + 2НВr
3SO2 + 2КМпO4 + 4Н2О = 3H2SO4 + 2MnO2↓ + 2КОН
Продуктом восстановления SO2 чаще всего является свободная сера.
SO2 + 2Н2S = 3S↓ + 2Н2О
SO2 + 2СО = S + 2CO2
H2SO3 — сернистая кислота
В свободном состоянии не выделена. Очень непрочное соединение. Образуется при растворении SO2 в воде. Обладает свойствами слабой кислоты.
Сульфиты и гидросульфиты
2-х основная сернистая кислота образует при взаимодействии со щелочами 2 ряда солей: нормальные (средние) — сульфиты Mex(SO3)y и кислые — гидросульфиты Me(HSO3)x.
Сульфиты щелочных Me и аммония растворимы в воде. Сульфиты остальных Me нерастворимы в воде (или не существуют).
Гидросульфиты Me хорошо растворимы в Н2O, некоторые из них существуют только в растворе, например, Ca(HSO3)2.
Водные растворы сульфитов вследствие гидролиза имеют щелочную среду (окрашивают лакмус в синий цвет).
SO3— + Н2O = HSO3— + ОН—
Na2SO3 + Н2O = NaHSO3 + NaOH
Химические свойства сульфитов
1. Взаимодействие с сильными кислотами:
Na2SO3 + 2HCl = 2NaCl + SO2↑ + Н2O
NaHSO3 + HCl = NaCl + SO2↑ + Н2O
Оба типа солей разлагаются сильными кислотами, при этом слабая сернистая кислота вытесняется в виде SO2 и Н2O.
2. Термическое разложение сульфитов:
CaSO3 = СаО + SO2↑
3. Нормальные сульфиты в водных растворах, содержащих избыток SO2, превращаются в гидросульфиты
CaSO3 + SO2 + Н2O = Ca(HSO3)sub>2
Благодаря этой реакции нерастворимые в воде сульфиты превращаются в растворимые гидросульфиты
4. Ионно-обменные реакции с другими солями, приводящие к образованию нерастворимых сульфитов:
Na2SO3 + ZnCl2 = ZnSO3↓ + 2NaCl
I. Сульфиты как восстановители.
Сульфиты, подобно SO2, могут быть и восстановителями, и окислителями, поскольку атомы серы в анионах SO3 находятся в промежуточной С.О. +4
В водных растворах и сульфиты, и гидросульфиты легко окисляются до сульфатов. Примеры реакций:
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
5K2SO3 + 2КМпO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
Даже твердые сульфиты при хранении на воздухе медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
II. Сульфиты как окислители.
Эти реакции не столь многочисленны. При нагревании сухих сульфитов с такими активными восстановителями, как С, Mg, Al, Zn, они переходят в сульфиды:
Na2SO3 + ЗС = Na2S + ЗСО
III. Диспропорционирование сухих сульфитов.
При нагревании до высоких температур сульфиты медленно превращаются в смесь сульфатов и сульфидов:
4K2SO3 = 3K2SO4 + K2S
examchemistry.com
Сернистый газ — физические свойства, получение и применение :: SYL.ru
Сернистый газ имеет молекулярное строение, аналогичное озону. Атом серы, находящийся в центре молекулы, связан с двумя атомами кислорода. Этот газообразный продукт окисления серы не имеет цвета, издает резкий запах, при изменении условий легко конденсируется в прозрачную жидкость. Вещество хорошо растворимо в воде, обладает антисептическими свойствами. В больших количествах получают SO2 в химической промышленности, а именно в цикле сернокислотного производства. Газ широко используется для обработки сельскохозяйственных и пищевых продуктов, отбеливания тканей в текстильной промышленности.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO2, — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).

Состав и особенности молекулярного строения SO2
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при –72…–75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при –10,1 °C вновь образуется газ. Молекулы SO2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).

Растворимость и взаимодействие с водой
Диоксид серы при растворении в воде частично взаимодействует с ней с образованием очень слабой сернистой кислоты. В момент получения она тут же разлагается на ангидрид и воду: SO2 + Н2О ↔ Н2SO3. На самом деле в растворе присутствует не сернистая кислота, а гидратированные молекулы SO2. Газообразный диоксид лучше взаимодействует с прохладной водой, его растворимость понижается с повышением температуры. При обычных условиях может раствориться в 1 объеме воды до 40 объемов газа.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.

Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Сернистый газ — получение в лаборатории и в промышленности
Лабораторные способы:
- При сжигании серы в колбе с кислородом или воздухом получается диоксид по формуле: S + O2 = SO2.
- Можно подействовать на соли сернистой кислоты более сильными неорганическими кислотами, лучше взять соляную, но можно разбавленную серную:
- Na2SO3 + 2HCl = 2NaCl + H2SO3;
- Na2SO3 + H2SO4 (разб.) = Na2SO4 + H2SO3;
- H2SO3 = Н2О + SO2↑.
3. При взаимодействии меди с концентрированной серной кислотой выделяется не водород, а диоксид серы:
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑.
Современные способы промышленного производства сернистого ангидрида:
- Окисления природной серы при ее сжигании в специальных топках: S + О2 = SO2.
- Обжиг железного колчедана (пирита).
Основные химические свойства диоксида серы
Сернистый газ является активным соединением в химическом плане. В окислительно-восстановительных процессах это вещество чаще выступает в качестве восстановителя. Например, при взаимодействии молекулярного брома с диоксидом серы продуктами реакции являются серная кислота и бромоводород. Окислительные свойства SO2 проявляются, если пропускать этот газ через сероводородную воду. В результате выделяется сера, происходит самоокисление-самовосстановление: SO2 + 2H2S = 3S + 2H2O.
Диоксид серы проявляет кислотные свойства. Ему соответствует одна из самых слабых и неустойчивых кислот — сернистая. Это соединение в чистом виде не существует, обнаружить кислотные свойства раствора диоксида серы можно с помощью индикаторов (лакмус розовеет). Сернистая кислота дает средние соли — сульфиты и кислые — гидросульфиты. Среди них встречаются стабильные соединения.
Процесс окисления серы в диоксиде до шестивалентного состояния в ангидриде серной кислоты — каталитический. Получившееся вещество энергично растворяется в воде, реагирует с молекулами Н2О. Реакция является экзотермической, образуется серная кислота, вернее, ее гидратированная форма.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.

Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация
сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
www.syl.ru
Диоксид серы — это… Что такое Диоксид серы?
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Na2SO3 + H2SO4 → Na2SO4 + H2SO3.
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑.
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
Химические свойства
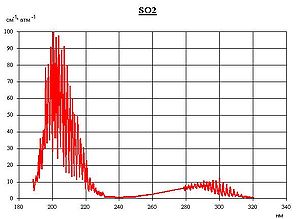
Спектр поглощения SO2 в ультрафиолетовом диапазоне
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
Последняя реакция является качественной реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие

SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation. 2010.
dic.academic.ru
Оксид серы(IV), сернистая кислота, сульфиты — урок. Химия, 8–9 класс.
Оксид серы(\(IV\))
Сернистый газ, или оксид серы(IV), образуется при сгорании серы, сероводорода или обжиге сульфидов:
4FeS2+11O2=2Fe2O3+8SO2↑.
При обычных условиях это бесцветный газ с характерным запахом. Ядовит.
Сернистый газ хорошо растворяется в воде — в \(1\) объёме воды при \(0\) °С может раствориться до \(80\) объёмов сернистого газа, а при комнатной температуре — до \(40\) объёмов. При этом происходит реакция с водой, и образуется сернистая кислота:
SO2+h3O⇄h3SO3.
Оксид серы(\(IV\)) проявляет и другие свойства кислотных оксидов: реагирует со щелочами, основными оксидами c образованием солей:
SO2+2NaOH=Na2SO3+h3O.
Степень окисления серы в оксиде — \(+4\). Это промежуточное значение, поэтому в окислительно-восстановительных реакциях он может быть и окислителем, и восстановителем. Так, свойства восстановителя проявляются в реакции с кислородом:
2S+4O2+O2⇄t,k2S+6O3.
Свойства окислителя сернистый газ проявляет в реакции с сероводородом:
S+4O2+2h3S−2=3S0+2h3O.
Оксид серы(\(IV\)) выделяется в атмосферу при сжигании разных видов топлива и загрязняет её.
Сернистая кислота и её соли
Сернистая кислота h3SO3 представляет собой водный раствор оксида серы(\(IV\)) и в свободном состоянии не выделена. Это слабая двухосновная кислота, которая образует два ряда солей. Средние её соли называются сульфитами (Na2SO3,CaSO3), а кислые — гидросульфитами (NaHSO3,Ca(HSO3)2).
Сернистая кислота и её соли, так же как и оксид серы(\(IV\)), в окислительно-восстановительных реакциях проявляют двойственные свойства — могут быть и окислителями, и восстановителями.
Сернистый газ уничтожает микроорганизмы, поэтому применяется для дезинфекции помещений, оборудования. Используется он как отбеливающее средство в производстве бумаги, тканей. Для отбеливания используются и соли: сульфит и гидросульфит натрия.
www.yaklass.ru
а) сернистый газ; б) оксид серы (VI) по плану
а) сернистый газ
Получение
В промышленности – сжигание серы или обжиг пирита:
S + O2 ⟶ SO2
2FeS2 + 5O2 ⟶ 2FeO + 4SO2
В лаборатории – воздействием сильных кислот на сульфиты:
Na2SO3 + H2SO4 t ⟶ Na2SO4 + H2O + SO2↑
Свойства
Относится к кислотным оксидам.
Взаимодействует с водой с образованием сернистой кислоты:
H2O + SO2 ⟶ H2SO3
Взаимодействует с щелочами с образованием сульфитов:
2NaOH + SO2 ⟶ Na2SO3 + H2O
Проявляет как окислительные, так и восстановительные свойства, т. к. сера находится в промежуточной степени окисления +4.
| 2SO2 + 2NO ⟶ N2 + 2SO3 | ||
| 2N+2 + 4ē ⟶ N2+6 | 1 | окислитель (восстановление) |
| S+4 — 2ē ⟶ S+6 | 2 | восстановитель (окисление) |
| SO2 + C t ⟶ S + CO2 | ||
| S+4 + 4ē ⟶ S0 | 1 | окислитель (восстановление) |
| C0 — 4ē ⟶ C+4 | 1 | восстановитель (окисление) |
Применение
Большая часть оксида серы (IV) используется для производства сернистой кислоты и оксида серы (VI). Также используется в качестве консерванта (пищевая добавка E220), и для отбеливания соломы, шёлка и шерсти.
б) оксид серы (VI)
Получение
В промышленности – окисление оксида серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5):
2SO2 + O2 t,V₂O₅ ⟶ 2SO3
Свойства
Относится к кислотным оксидам.
Взаимодействует с водой с образованием серной кислоты:
H2O + SO3 ⟶ H2SO4
Взаимодействует с основными оксидами с образованием сульфатов:
CaO + SO3 ⟶ CaSO4
Взаимодействует с щелочами с образованием сульфатов:
2NaOH + SO3 ⟶ Na2SO4 + H2O
Проявляет только окислительные свойства, т. к. сера находится в максимальной степени окисления +6.
| 2SO3 ⇄ 2SO2 + O2 | ||
| S+6 + 2ē ⟶ S+4 | 1 | окислитель (восстановление) |
| 2O-2 — 4ē ⟶ O20 | 1 | восстановитель (окисление) |
Применение
Оксид серы (IV) используют в основном для производства серной кислоты.
gomolog.ru
Оксид серы(IV) — это… Что такое Оксид серы(IV)?
У этого термина существуют и другие значения, см. Оксид серы.Окси́д се́ры (IV) (диокси́д се́ры, се́рнистый газ, се́рнистый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой се́рнистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, се́рной кислоте. SO2 — один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:
Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Спектр поглощения SO2 в ультрафиолетовом диапазонеОтносится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
Последняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также в слабоалкогольных напитках (вина средней ценовой категории) в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и как следствие присутствия воды H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре[1]. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты.
Физиологическое действие

SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
- ПДК(предельно допустимая концентрация):
- в атмосферном воздухе максимально-разовая — 0,5 мг/м³, среднесуточная — 0,05 мг/м³;
- в помещении (рабочая зона) — 10 мг/м³
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Воздействие на атмосферу
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное[источник не указан 62 дня]. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие ее в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
Примечания
- ↑ Гордон А., Форд Р. Спутник химика / Пер. на русск. Е. Л. Розенберга, С. И. Коппель. — М.: «Мир», 1976. — 544 с.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
biograf.academic.ru
